Robert Maniura
Sprawozdanie z ćwiczenia nr 23: Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalniku organicznym.
1. Wstęp teoretyczny:
Asocjacja jest to łączenie się cząsteczek tego samego związku w kilkucząsteczkowe ugrupowania. Asocjacja dotyczy takich cieczy, w których występują wiązania wodorowe, np. woda, alkohole, kwasy, aminy. Wiązanie wodorowe polega na tym, że atom wodoru związany chemicznie z atomem pierwiastka silnie elektroujemnego (np. tlen, azot, fluor) przyciąga siłami elektrostatycznymi elektrony należące do atomu również silnie elektroujemnego, ale wchodzącego w skład innej cząsteczki. Wiązanie wodorowe jest główną przyczyną asocjacji w roztworach i czystych cieczach. Powstają wówczas łańcuchy, pierścienie i inne struktury trójwymiarowe. Wiązanie wodorowe jest znacznie słabsze niż wiązania chemiczne. Asocjacja ma wpływ na właściwości fizyczne substancji. Powoduje np. podwyższenie temperatury wrzenia i topnienia. Woda ma znacznie wyższą temperaturę topnienia i wrzenia niż siarkowodór, podobnie amoniak i fosforowodór. Do rozerwania wiązań wodorowych konieczna jest znaczna energia. W cieczach zasocjowanych anomalnie zachowuje się gęstość, lepkość, napięcie powierzchniowe, przenikalność elektryczna. Asocjacja prowadzi do wzrostu średniej efektywnej masy cząsteczkowej, przewodnictwa cieplnego, zmniejszenia samodyfuzji i rozszerzalności cieplnej.
Stopień asocjacji kwasu octowego w rozpuszczalniku organicznym wyznaczam metodą kriometryczną. Po dodaniu do czystego rozpuszczalnika kwasu octowego nastąpi obniżenie temperatury krzepnięcia takiego roztworu w stosunku do czystego rozpuszczalnika. Obniżenie temperatury krzepnięcia jest proporcjonalne do stężenia substancji w roztworze. W przypadku cieczy zasocjowanych obserwuje się mniejsze obniżenie temperatury krzepnięcia niż wynikałoby to z obliczeń. Asocjacja powoduje wzrost średniej efektywnej masy cząsteczkowej. Efektywne stężenie substancji w roztworze jest mniejsze w porównaniu z wprowadzoną ilością substancji.
Pomiar kriometryczny przeprowadziłem w kalorymetrze wypełnionym lodem. Najpierw zmierzyłem temperaturę krzepnięcia czystego rozpuszczalnika do momentu ustalenia się wskazań miernika. Następnie w podobny sposób zmierzyłem temperaturę krzepnięcia kilku roztworów kwasu octowego w benzenie.
2. Opracowanie wyników:
Pomiar temperatury dokonuję za pomocą termistora. Na mierniku odczytuję opór w kW, następnie korzystam z równania termistora. Równanie termistora jest następujące:
![]()
z równania termistora można obliczyć temperaturę krzepnięcia rozpuszczalnika i roztworów (![]()
= -9,9301 Ⴑ 0,1125; b = -3970,340 Ⴑ 32,257):
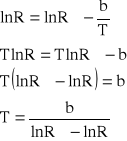
Ze zmierzonego oporu wyznaczam wykresy zależności temperatury oziębiania roztworów od czasu. Z wykreślonych roztworów wyznaczam temperaturę krzepnięcia poszczególnych roztworów:
temperatura krzepnięcia czystego rozpuszczalnika (50ml benzenu) wynosi: Tkrz. = 280,3 K.
temperatura krzepnięcia roztworu I (50ml benzenu + 1 ml kwasu octowego) wynosi: Tkrz.(I) = 279,2 K.
temperatura krzepnięcia roztworu II (50ml benzenu + 1,5ml kwasu octowego) wynosi: Tkrz.(II) = 278,7 K.
temperatura krzepnięcia roztworu III (50ml benzenu + 2ml kwasu octowego) wynosi: Tkrz.(III) = 278,4 K.
Obliczam obniżenie temperatury krzepnięcia dla badanych roztworów:
![]()
gdzie: T - obniżenie temperatury krzepnięcia; Tb - temperatura krzepnięcia rozpuszczalnika; Tr - temperatura krzepnięcia odpowiedniego roztworu.
Molarność roztworu obliczam z następującej zależności:
![]()
gdzie: m - molarność roztworu; T - obniżenie temperatury krzepnięcia; KK - stała krioskopowa wynosząca dla benzenu 5,4 [K*kg/mol].
Znając molarność można obliczyć masę molową kwasu w roztworze. Liczba moli:
![]()
gdzie: m - molarność roztworu; n - liczba moli; mrozp - masa rozpuszczalnika w [kg].
Pamiętając o zależnościach:
![]()
gdzie: ms - masa substancji; M - masa molowa substacji; oraz ![]()
Średnią masę molową kwasu octowego w odpowiednim roztworze obliczam na podstawie zależności:
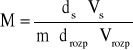
gdzie: s i rozp oznaczają substancję i rozpuszczalnik.
Stopień asocjacji:
![]()
gdzie: b - stopień asocjacji; ![]()
- średnia masa molowa; M - masa molowa kwasu (tablicowa), 60 [g/mol].
Znając odpowiednie dane: ds = 1,0498 [g/cm3]; drozp = 0,878*10-3 [kg/cm3];
L.p. |
Badany roztwór |
Obliczone T [K] |
Molarność roztworu |
Średnia masa molowa |
Stopień asocjacji b |
1 |
Roztwór 1,0 ml kwasu octowego w 50 ml benzenu |
1,1 |
0,2037 |
117,39 |
1,96 |
2 |
Roztwór 1,5 ml kwasu octowego w 50 ml benzenu |
1,6 |
0,2963 |
121,06 |
2,02 |
3 |
Roztwór 2,0 ml kwasu octowego w 50 ml benzenu |
1,9 |
0,3518 |
135,95 |
2,27 |
3. Wnioski:
Otrzymane wartości stopnia asocjacji kwasu octowego świadczą o tym, że cząsteczki kwasu octowego są zasocjowane, nie można określić jednak w jak dużym stopniu. Stopień asosjacji rośnie wraz ze wzrostem stężenia. Wiązania wodorowe powodują łączenie się cząsteczek kwasu octowego w większe ugrupowania.
2
Wyszukiwarka
Podobne podstrony:
Wyznaczanie stopnia asocjacji kwasu octowego
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
Wyznaczanie potencjału desorpcji związków powierzchniowo akt, Studia, Politechnika
Wyznaczanie izotermy?sorpcji ?osprcja kwasu octowego na węglu aktywnym
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
Wyznaczanie bezwzgl dnej aktywno ci promieniowania b v2, Politechnika Lubelska, Studia, Studia, mate
308. Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Pol
potencjal wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Wyznaczanie
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
309. Wyznaczanie sprawności świetlnej żarówki za pomocą fotometru, studia, studia Politechnika Pozna
Wyznaczenie stopnia zagęszczenia gruntu, Budownictwo studia, materiały budowalane
Stała dysocjacji słabego kwasu, Studia, Politechnika
Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Politech
Przemiana do kwasu acetylosalicylowego, Studia, Politechnika
Wyznaczanie masy cząsteczkowej metodą ebuliometryczną, Studia, Politechnika
Wyznaczanie objętości nadmiarowych, Studia, Politechnika
Wyznaczanie masy cząsteczkowej związków wielkocząsteczkowych, Studia, Politechnika
Wyznaczanie długości fal świetlnych przepuszczanych przez fil, Politechnika Lubelska, Studia, semest
więcej podobnych podstron