POLARYMETRIA metoda w której wyznacza się aktywność optyczną badanych substancji
dzięki pomiarom kąta skręcania płaszczyzny polaryzacji światła spolaryzowanego. Pomiary
polarymetryczne umożliwiają identyfikację substancji oraz określenie ich stężania w
roztworze. Kąt skręcenia płaszczyzny polaryzacji światłą monochromatycznego
charakteryzuje daną substancję jest jej indywidualną cechą. Pomiar kąta skręcania
płaszczyzny polaryzacji umożliwia różnicowanie ich własności optycznych (prawo i lewo
skrętne) wynikających z budowy chemicznej.
Skręcalność optyczna-właściwość substancji optycznie czynnej polegająca na skręcaniu
płaszczyzny polaryzacji światła podczas przechodzenia światła podczas przechodzenia światła
spolaryzowanego przez tę substancję. Skręcalność nie jest stała dla danego związku i zależy
ona od temperatury i długości fali światła.
Światło spolaryzowane to takie które da się sprowadzić do jednej płaszczyzny.
Związki optycznie czynne-takie związki które mają nieidentyczne wzory chemiczne
Polarymetria - technika analityczna polegająca na pomiarze stężenia substancji optycznie czynnej na podstawie wielkości kąta skręcenia płaszczyzny polaryzacji światła.
Urządzenie przy pomocy, którego dokonuje się pomiaru nazywane jest polarymetrem.
Jest to możliwe dzięki temu, że wielkość kąta skręcenia dla danej substancji jest proporcjonalna do jej stężenia w roztworze. Przez polarymetrię rozumie się też często oznaczanie kąta skręcenia płaszczyzny polaryzacji czystych związków chemicznych. Oprócz oznaczania stężeń związków czynnych optycznie, technika ta umożliwia także pomiar tzw. czystości optycznej enancjomerów.
Polarymetr jest to przyrząd optyczny służący do określania skręcalności substancji aktywnych optycznie, czyli takich substancji, których cząsteczki skręcają płaszczyznę polaryzacji światła. Po odpowiednim wyskalowaniu może służyć bezpośrednio do pomiaru stężenia roztworów tych substancji. Polarymetr służy też do określania składu mieszanin enancjomerów.
Budowa
Polarymetr jest zbudowany z dwóch polaryzatorów np. pryzmatów Nicola (nikoli). Pierwszy z nikoli nosi nazwę polaryzatora a drugi analizatora. Pomiędzy polaryzatorami znajduje się standaryzowana kuweta, w której umieszcza się badaną substancję.
Polaryzacja - własność fali poprzecznej (np. światła). Fala spolaryzowana oscyluje tylko w pewnym wybranym kierunku. Fala niespolaryzowana oscyluje we wszystkich kierunkach jednakowo. Fala niespolaryzowana może być traktowana jako złożenie wielu fal drgających w różnych kierunkach.
W naturze większość źródeł promieniowania elektromagnetycznego wytwarza fale niespolaryzowane. Polaryzacja występuje tylko dla fal rozchodzących się w ośrodkach, w których drgania ośrodka mogą odbywać się w dowolnych kierunkach prostopadłych do rozchodzenia się fali. Ośrodkami takimi są trójwymiarowa przestrzeń lub struna.
Gdy ośrodek fali nie może drgać w dowolnych kierunkach prostopadłych względem rozchodzenia się fali, zjawisko polaryzacji jest niemożliwe. Dotyczy to np. drgań na powierzchni membrany i na granicach faz. Przykładem tego są m.in. fale morskie. Fale dźwiękowe również nie podlegają zjawisku polaryzacji, gdyż są falami podłużnymi.
Wiele substancji organicznych (np. sacharoza rozpuszczona w wodzie) zmienia kierunek polaryzacji światła przechodzącego przez roztwór. Zjawisko to zwane aktywnością optyczną jest stosowane do rozpoznawania cukrów, a także do określania stężenia cukru w soku buraczanym.
Aktywność optyczną wykazują te związki organiczne których cząsteczki zawierają asymetryczny atom węgla, tzn. atom węgla związany z czterema różnymi podstawnikami. Cząsteczki takie mogą występować w dwóch formach, zwanych enancjomerami, będących wzajemnie swymi odbiciami lustrzanymi. Enancjomery skręcają płaszczyznę polaryzacji przechodzącego światła w przeciwnych kierunkach. Z tego powodu mieszanina zawierająca równe ilości obydwu enancjomerów (tzw. mieszanina racemiczna) nie skręca płaszczyzny polaryzacji.
Skręcalność właściwa - wartość charakteryzująca substancję aktywną optycznie, poprzez wartość kąta skręcania płaszczyzny światła spolaryzowanego przez roztwór tej substancji.
Otrzymuje się na podstawie wzoru:
gdzie:
α - wartość skręcenia płaszczyzny światła spolaryzowanego
c - stężenie roztworu (wyrażone w %) lub gęstość roztworu (mierzona w g/(cm³)
l - długość drogi pokonanej przez światło w roztworze (wyrażona w dm)
Skręcalność właściwa zależy istotnie od użytego rozpuszczalnika, temperatury i długości fali, w pewnym stopniu także od stężenia. Dla niektórych substancji rozpuszczalnik może wpływać nie tylko na wielkość, ale i na znak skręcalności.
Często spotykany symbol [α]D oznacza, że pomiar wykonano dla światła odpowiadającego długości fali linii D sodu.
Mutarotacja (łac. mutare - zmieniać + rotatio - obrót) - polega na zmianie wartości liczbowej kąta skręcania płaszczyzny światła spolaryzowanego przechodzącego przez roztwory sacharydów, spowodowana stopniowym przechodzeniem anomeru α w β. Jest wynikiem tautomerycznych równowag, ustalających się w roztworach cukrów (np. w stanie równowagi roztwór wodny D-glukozy zawiera 35,5% formy α i 64,5% formy β). (Przewaga formy β-D-glukozy wynika stąd, że odmiana ta jest korzystniejsza energetycznie, gdyż w konformacji krzesłowej wszystkie podstawniki są w pozycjach ekwatorialnych). Mutarotacja jest zjawiskiem, występującym u większości sacharydów (nie występuje np. w roztworze sacharozy, gdyż w tym disacharydzie oba anomeryczne atomy węgla są zablokowane wiązaniem O-glikozydowym). Jest charakterystyczna dla cukrów redukujących.
Mechanizm mutarotacji
Mechanizm polega na ataku pary elektronowej atomu tlenu grupy hydroksylowej przy przedostatnim atomie węgla w łańcuchu na karbonylowy atom węgla grupy aldehydowej lub ketonowej. Karbonylowy atom węgla posiada strukturę płaską, trójkątną o hybrydyzacji sp2 i jest połączony z atomem tlenu wiązaniem podwójnym. Z tego powodu atak pary elektronowej atomu tlenu grupy OH może nastąpić z jednej bądź z drugiej strony płaszczyzny grupy karbonylowej tworząc odpowiednio formę cykliczną z atomem tlenu przy atomie węgla C1 (w aldozach) lub C2 (w ketozach) skierowanym do góry lub na dół. Atom tlenu otrzymuje chwilowo ładunek ujemny, który szybko odrywa proton od atakującej grupy OH przy przedostatnim atomie węgla.
W roztworze wodnym obie formy anomeryczne ulegają ciągłemu przekształceniu jedna w drugą[1][2].
Asymetryczny atom węgla (centrum asymetrii), oznacza taki atom węgla, który ma cztery różne podstawniki.
Aldehyd glicerynowy, czyli aldotrioza jest wzorcem do ustalania konfiguracji cukrów. Ma jeden asymetryczny atom węgla.
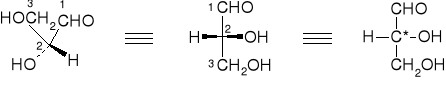
aldehyd D-(+)-glicerynowy
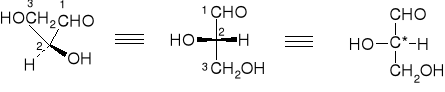
aldehyd L-(-)-glicerynowy
Jeśli grupa OH znajduje się po prawej stronie centrum asymetrii mówi się o odmianie D, a jeśli grupa OH znajduje się po lewej stronie centrum asymetrii mówi się o odmianie L. Cukry naturalne należą w większości do szeregu D. Otrzymane syntetycznie enancjomery tych cukrów, należące do szeregu L, nie są przyswajalne przez organizmy żywe.
W przypadku cukrów o większej ilości atomów węgla, o przynależności do odpowiedniego szeregu decyduje położenie podstawników przy ostatnim asymetrycznym atomie węgla.
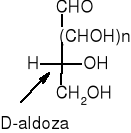
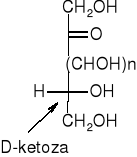
Anomery
Na skutek utworzenia pierścienia półacetalowego pierwszy atom węgla staje się węglem asymetrycznym, w związku z czym powstają dwie odmiany D-glukozy: α-D-glukoza, β-D-glukoza. Gdy grupa OH przy tym atomie węgla znajduje się pod płaszczyzną pierścienia wówczas jest to anomer α, a jeśli nad płaszczyzną pierścienia, to anomer β.
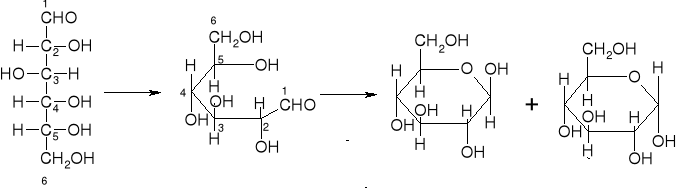
anomer β anomer α
Z występowaniem anomerów związane jest zjawisko mutarotacji.
Mutarotacja jest to zmiana kąta skręcalności optycznej roztworu substancji czynnej, aż do pewnej stałej wartości.
Przyczyną mutarotacji jest przejście w roztworze jednego z izomerów w drugi o innej skręcalności światła spolaryzowanego. Między izomerami ustala się równowaga dynamiczna.
α-D-glukoza po krystalizacji z metanolu, rozpuszczona w wodzie posiada początkową skręcalność roztworu [α]D = +112º lecz w miarę upływu czasu skręcalność ta stopniowo spada i osiąga stałą wartość [α]D = +52,5º.
W stanie równowagi jest różna ilość odmian α i β. α-D-glukozy jest 36%, formy łańcuchowej 0,02%, a β-D-glukozy 64%. Mutarotację katalizują zarówno kwasy jak i zasady. Reakcja przebiega poprzez odmianę łańcuchową (aldehydową).
Wyszukiwarka
Podobne podstrony:
polarymetria, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatologia
refrakcja, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatologia
Bromatologia - egzamin 2011, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatolog
definicje pestycydy, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatologia
onkologia, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatologia, prezentacja-die
kartk+kolo pytania z bromów, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatologi
egzamin bromyy 2011 (1), materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, bromatologia
Mechanizmy działania antybiotyków, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 2, farma
Zestaw 88 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
tpl zal, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, TPPL
TPL otwarte, materiały farmacja, Materiały 4 rok, tpl, na zaliczenie
immuno4, materiały farmacja, Materiały 3 rok, mat 3 rok, Immuno
higiena2, materiały farmacja, Materiały 4 rok, higiena, gmail, reegzamin
TPPL-testa, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 1, TPPL
pytania tple, materiały farmacja, materiały V rok, TPL, do zaliczenia, na kolokwium
leki p-padaczkowe tabela, materiały farmacja, Materiały 4 rok, farmakologia, reszta niezrzeszona, ko
Wariacje na temat ziół, materiały farmacja, Materiały 4 rok, LPN
Zestaw 54 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
więcej podobnych podstron