1.1.2. Hydroliza polifosforanów
Badania chemiczne i oznaczenia rentgenograficzne struktury wykazały, że polifosforany zawierają aniony, które zbudowane są z tetraedrów PO4 liniowo ze sobą związanych. Głównym powodem określenia szybkości hydrolizy jest kontrolowanie trwałości polifosforanów oraz wyjaśnienie ogólnego mechanizmu reakcji. W kwaśnych, wodnych roztworach wraz ze wzrostem temperatury hydroliza polifosforanów staje się coraz szybsza.
Polifosforany łańcuchowe są bardziej stabilne niż cykliczne, jednakże zarówno jedne jak i drugie mogą ulegać hydrolizie.
H-[PO3H]n-OH + H2O → H-[PO3H]m-OH + H-[PO3H]n-m-OH
gdzie: n i m - ilość monomerów -[PO3H]-, n≥2, m<n.
[P3O10]5- H2O [HP2O7]3- + [HPO4]2-
(P3O9)3- → H2P3O103- → H2P2O72- → H2PO4-
W procesie hydrolizy następuje pękniecie łańcucha polifosforanowego, w wyniku tego powstają dwa krótsze łańcuchy [18,12,21]. Reakcja hydrolizy polifosforanów zależy od następujących czynników:
ilości jednostek tetraedrycznych PO4 w strukturze,
temperatury,
pH,
stężenia.
obecności kationów metali, zwłaszcza ciężkich.
Proces hydrolizy badano w roztworach 0,1 molarnych względem PO3 w temperaturze przy zmiennym pH. W tej temperaturze roztwory kwaśne nie hydrolizują za szybko, a roztwory obojętne i zasadowe nie za wolno, by nie można było śledzić przebiegu procesu. Okazało się, że kinetyka hydrolizy polifosforanu nie zależy od pH roztworu i, pomijając końcowe stadium, przebiega zgodnie z równaniem kinetycznym pierwszego rzędu, co znaczy, że szybkość hydrolizy jest wprost proporcjonalna do chwilowego stężenia wielkocząsteczkowego polifosforanu. Natomiast dużą zależność od pH wykazuje przede wszystkim szybkość reakcji. Rośnie ona bardzo znacznie, gdy pH maleje [12, 21, 4].
Czasy połówkowe w 60ºC przy pH 8 wynoszą 45,1 dni, przy pH 5 - 4,4 dni, przy pH 3 - 7,7 godzin, przy pH 1 tylko 22 minuty, czyli hydroliza przebiega tym szybciej im wyższe jest stężenie jonów wodorowych w roztworze.
Również i rodzaj produktów hydrolizy zależy od pH roztworu. Przy pH 8 w miarę jak stężenie polifosforanu maleje powstają równoważne ilości mono- i trójmetafosforanu. Przy pH 1 poza mono- i trójmetafosforanem powstają dwu-, trójpolifosforan, a także czterometafosforan [4, 12, 13, 15, 21].
Hydroliza łańcucha polifosforanowego może rozpocząć się albo na końcu, albo w jego środku. Jeśli proces ten rozpoczyna się w środku łańcucha to obok powstania równych ilości mono- i trójmetafosforanu należy oczekiwać równoczesnego utworzenia czterech słabo kwaśnych grup OH [21,32].
Jeśli hydroliza zachodzi na końcu łańcucha to obok powstania równych ilości mono- i trójmetafosforanu należy oczekiwać równoczesnego utworzenia dwóch grup OH.
Należy więc oczekiwać, że przy tym samym stężeniu polifosforanów hydroliza przebiegać będzie tym szybciej im mniejsza jest średnia długość łańcucha, ponieważ przy tym samym stężeniu ilość grup końcowych łańcucha jest odwrotnie proporcjonalna do jego długości (im krótsze łańcuchy tym więcej grup końcowych).
Przy pH 8 polifosforany są w wysokim stopniu zjonizowane, dysocjują również grupy końcowe i to powoduje, że ta wartość pH najbardziej sprzyja trwałości jonów.
Jeżeli do takiego jonu polifosforowego zbliży się jon wodorowy, wówczas wędruje on ku miejscu o największej gęstości ładunku, mieszczącego się przy grupach końcowych łańcuchów anionowych, które posiadają ładunki ujemne.
Kinetyka hydrolizy polifosforanu nie zależy od pH roztworu, oraz pomijając końcowe stadium, przebiega zgodnie z równaniem kinetycznym pierwszego rzędu. Znaczy to, że szybkość hydrolizy jest wprost proporcjonalna do chwilowego stężenia wielkocząsteczkowego polifosforanu. Dużą zależność od pH wykazuje przede wszystkim szybkość reakcji. Gdy pH maleje, rośnie ona bardzo znacznie [12]. W tabeli 1 przedstawiono zależność hydrolizy od pH dla polifosforanów.
Tabela 1. Szybkość reakcji i czasy połówkowe hydrolizy polifosforanów
pH |
Temp. [oC] |
Stałe szybkości K103/min. |
Czasy połówkowe |
8 |
60 |
0,01 |
45,1 dni |
5 |
60 |
1,5 |
4,4 dni |
3 |
60 |
11 |
7,7 godz. |
1 |
60 |
30 |
22 min. |
Hydroliza polifosforanów przy tym samym całkowitym stężeniu przebiega tym szybciej, im mniejsza jest średnia długość łańcucha użytego fosforanu. Im krótsze są łańcuchy, tym więcej istnieje grup końcowych [12].
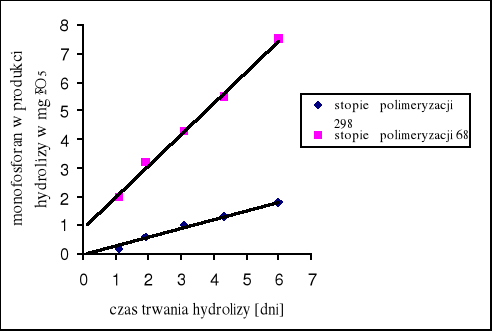
Rys. 4. Zależność szybkości hydrolizy od długości łańcucha
4. N. N. Greenwood, A. Earnshaw, Chemistry of the elements, Pergamon, 1984, chapter 12, 546-636
12. Thilo, Some problems of condensed phosphates and silicates chemistry, Wiad. Chem., 1958, 11, 651- 669]
J. D. Dzieżak, Food Technology, Phosphates improve many foods, 1990, 44 (4), 80 - 92
15. Ch. Everson, Phosphates in processed meat products, Meat Processing, 1982, 8, 42 - 44
18. H. J. Strack, Phosphates key ingredient in meat products, Intern. Food Ingradients, 1992, 4,. 45 - 51
F. Rashchi, J. A. Finch, Polyphosphates: a review their chemistry and application with particular reference to mineral processing, Minerals Engineering, 2000, vol. 13, 10-11, 1019 - 1035
W. Arneth, B. Herold, G. F. Hammer, Abbau von di- und triphosphat in brühwurstbrät, Fleischwirtschaft, 2002, 1, 78 - 80
Wyszukiwarka
Podobne podstrony:
WYSOKOSPRAWNA CHROMATOGRAFIA JONOWA, Chemia Przydatne dla studentów
konserwacja żywności, Chemia Przydatne dla studentów
SKŁADNIKI NIEODŻYWCZE, Chemia Przydatne dla studentów
OZNACZANIE DODATKÓW I SUBSTANCJI KONSERWUJĄCYCH W PRODUKTACH SPOŻYWCZYCH, Chemia Przydatne dla stude
Postęp w biotechnologii, Chemia Przydatne dla studentów
OZNACZANIE SOLI KUCHENNEJ W PIECZYWIE, Chemia Przydatne dla studentów
Promienie X, Chemia Przydatne dla studentów
Postęp w biotechnologii2, Chemia Przydatne dla studentów
Związki fosforu w organizmie człowieka, Chemia Przydatne dla studentów
CO TO SĄ WITAMINY, Chemia Przydatne dla studentów
Fizyczne metody konserwacji żywności, Chemia Przydatne dla studentów
ściąga z analizy instrumentalnej, Chemia Przydatne dla studentów
SPME mikroekstrakcja do fazy stałej, Chemia Przydatne dla studentów
technologia wody pytania, Chemia Przydatne dla studentów
Biotechnologia w polskiej opinii społecznej, Chemia Przydatne dla studentów
Jak zapewnić bezpieczeństwo zdrowotne żywności, Chemia Przydatne dla studentów
PŁYNY NADKRYTYCZNE, Chemia Przydatne dla studentów
CHEMIAwSZKOLE wersja dla studentów
więcej podobnych podstron