Powstawanie i podział alkoholi
Alkoholami nazywamy związki zawierające grupę lub grupy hydroksylowe --OH połączone z nasyconymi atomami węgla. Można je zatem uważać za pochodne węglowodorów, w których wodór podstawiony jest przez grupę wodorotlenową. Nazwy alkoholi szeregu nasyconego (Ar)R--CH2--OH wprowadza się od nazwy grupy węglowodorowej wchodzącej w skład alkoholu: alkohol metylowy, eytlowy, propylowy, benzylowy itd. Według słownictwa racjonalnego nazwę alkoholu wprowadza się z nazwy odpowiedniego węglowodoru przez dodanie końcówki -ol np. metanol, etanol, propanol. Reszta R--O-- powstała przez odłączenie wodoru z grupy hydroksylowej alkoholu nosi nazwę grupy alkoksylowej; grupę CH3O - nazywamy grupę metoksylową, C2H5O - etoksylową, ogólnie -OR alkoksylową.
Reakcję powstawania alkoholi można podzielić na dwie zasadnicze grupy. Do grupy pierwszej należą reakcje wspólne dla wszystkich alkoholi. Do najważniejszych z nich należy reakcja wymiany fluorowca w fluorowcoalkanach na grupę hydroksylową -OH za pomocą wodorotlenków, między innymi wodorotlenku srebra
Do grupy drugiej zaliczymy reakcje specyficzne dla poszczególnych alkoholi. I tak na przykład alkohol metylowy powstaje z gazu wodnego wzbogaconego w wodór
a alkohol etylowy podczas fermentacji alkoholowej cukrów lub metodą "acetylenową" (zwaną inaczej reakcją Kuczerowa)
Przy podziale alkoholi na odpowiednie podgrupy uwzględniamy:
1) rodzaj łańcucha węglowego,
2) rzędowość atomów węgla,
3) liczbę grup wodorotlenowych w cząsteczce
W związku z powyższym mamy:
1) alkohole nasycone lub nienasycone
2) alkohole pierwszo-, drugo- i trzeciorzędowe
3) alkohole jedno-, dwu i wielowodorotlenowe.
Do alkoholi nasyconych należą: metanol, etanol, propanol, itd. Przykładem alkoholu nienasyconego może być alkohol allilowy CH2=CH--HC2OH.
Wśród izomerycznych alkoholi wyróżniamy trzy ich rodzaje, zeleżnie od tego czy grupa --OH znajduje się przy węglu pierwszo-, drugo- czy trzeciorzędowym. Odpowiednie alkohole noszą nazwy: pierwszorzędowego, drugorzędowego i trzeciorzędowego. Jako przykład rzędowości alkoholi mogą posłużyć różne izomeryczne butanole. Z normalnego butanu wywodzą się dwa alkohole
Z izobutanu (2-metylopropanu) można również wyprowadzić dwa alkohole, a mianowicie
Rzędowaść alkoholi ilustrują zatem podane poniżej wzory ogólne
W celu odróżnienia od siebie alkoholi pierwszo-, drugo i trzeciorzędowych można wykorzystać reakcje utleniania. Alkohole pierwszorzędowe utlenianie przechodzą najpierw w aldehydy, później w kwasy o tej samej liczbie atomów węgla co utleniany alkohol
Podczas utleniania alkoholi drugorzędowych powstają ketony
Alkohole trzeciorzędowe utleniają się dość trudno, a podczas utleniania w drastycznych warunkach rozpadają się tworząc złożoną mieszaninę kwasów karboksylowych o mniejszej liczbie atomów węgla niż wyjściowy alkohol.
Oprócz alkoholi jednowodorotlenowych (zawierających jedną grup -OH w cząsteczce) mogą istnieć również alkohole dwu-, trój i wielowodorotlenowe, z tym jednak zastrzeżeniem, że przy tym samym atomie węgla nie może znajdować się więcej niż jedna grupa wodorotlenowa. Przykłaiem alkoholu dwuwodorotlenowego może być tzw. glikol zawierający w cząsteczce dwie grupy funkcyjne -OH, a alkoholu trójwodorotlenowego - gliceryna z trzema grupami -OH
Jak już zaznaczono powyżej obecność grupy alkoholowej -OH w związkach organicznych zaznaczamy przyrostkiem -ol. Stąd alkohole wywodzące się z alkanów nazywamy alkanolami, a pochodne alkenów alkenolami. Pochodne alkanów zawierające w cząsteczkach dwie grupy alkoholowe to alkanodiole, a zawierające trzy grupy -OH - alkanotriole; ogólnie alkanopoliole. Zgodnie z powyższym glikol wywodzący się z etanu ma nazwę racjonalną etanodiol, a gliceryna - propanotriol. W przypadku dłuższego łańcucha węglowodorowego, przed podaniem liczby grup -OH należy podać numery atomów węgla, przy których znajdują się te grupy. A oto przykład takiego alkoholu
Właściwości fizyczne i chemiczne alkanoli
Niższe człony szeregu homologicznego alkoholi są cieczami, dobrze rozpuszczalnymi w wodzie. Rozpuszczalność i lotnoć alkoholi maleje szybko wraz ze wzrostem masy cząsteczkowej tak, że alkohole mające więcej niż 10 atomów węgla w cząsteczce są już w temperaturze pokojowej nierozpuszczalnymi w wodzie ciałami stałść
Właściwości fizyczne i chemiczne alkanoli
Węglowodór |
Alkohol |
Masa cząsteczkowa |
Temperatura wrzenia w oC |
Temperatura topnienia w oC |
Etan |
|
30 |
-89 |
-172 |
|
Metanol |
32 |
65 |
-98 |
Propan |
|
44 |
-42,2 |
-189,9 |
|
Etanol |
46 |
78,5 |
-117,3 |
Butan |
|
58 |
-0,6 |
-135 |
|
Propanol |
60 |
97,2 |
-127 |
Heksan |
|
86 |
68 |
-95 |
|
Pentanol |
88 |
138 |
-79 |
Undekan C11H24 |
|
156 |
198 |
-26 |
|
Dekanol |
158 |
228 |
6 |
Porównanie właściwosci fizycznych alkoholi z własciwościami węglowodorów o podobncj masie cząsteczkowej wskazuje na pewne uderzające różnice. Alkohole w porównamu z odpowiadającymi im węglowodorami są znacznie mniej lotne, wykazują wyższe temperatury topnienia i większą rozpuszczalność w wodzie. W miarę wzrostu masy cząsteczkowej różnice te stopniowo maleją (tabela powyżej).
Zestawione w tabeli powyżej różnice między węglowodorami i alkoholami spowodowane są dużą polarnością grupy wodorotlenowej, której wprowadzenie do łańcucha węglowodorowego nadaje cząsteczce charakter polarny. W wyniku tego, cząsteczki alkoholu, podobnie jak cząsteczki wody, ulegają asocjacji wskutek tworzenia się wiązania między atomem wodoru jednej grupy wodorotlenowej, wykazującym charakter elektrododatni, a atomem tlenu drugiej grupy wodorotlenowej wykazującym charakter elektroujemny
W ,,asocjatach" alkoholi i wody cząsteczki powiązane są. tzw. wiązaniami wodorowymi, które są wynikiem wzajemnego oddziaływania pary elektronowej atomu tlenu jednej cząsteczki na atom wodoru drugiej. Istnieniem asocjatów tłumaczy się fakt, że alkohole mają wyższe temperatury wrzenia niż odpowiadające im halogenki alkilowe, węglowodoy i etery, ponieważ do odparowania cząstczek alkoholu konieczny jest pewien nakład dodatkowej energii na rozerwanie wiązań wodorowych (moc wiązań wodorowych wynosi ok. 20 kJ/mol). Inaczej mówiąc, można uznać, że asocjacja wywołana utworzeniem wiązań wodorowych odpowiada zwiększonej masie cząsteczkowej, w związku z tym następuje zmniejszenie lotności.
O powinowactwie alkoholi do środowiska wodnego, decyduje grupa hydroksylowa. Stąd dobrą rozpuszczalnosć w wodzie alkoholi o niższych masach cząsteczkowych łatwo wytłumaczyć tworzeniem się wiązań wodorowych z cząsteczkami wody. Grupa wodotlenowa w metanolu i etanolu stanowi ok. połowy masy cząsteczki, tłumaczy to mieszanie się metanolu i etanolu z wodą w każdym stosunku.
W miarę wzrostu masy cząsteczkowej grupy alkilowej w alkoholu udział grupy wodorotlenowej w jej masie cząsteczki jest coraz mniejszy, co powoduje zmniejszenie rozpuszczalności w wodzie. Alkohole stałe są już w wodzie praktycznie nierozpuszcalne. Właściwości fizyczne alkoholi o dużych masach cząsteczkowych stają się podobne do właściwości odpowiednich węglowodorów.
Podobieństwo alkoholu do wody uwidacznia się rńwnież w ich właściwościach chemicznych. Podobnie jak w cząsteczce wody, wodór grupy -OH można w alkoholu podstawić atomem metalu alkalicznego
Powstają wówczas tzw. alkoholany, ogólnie alkanolany. Alkanolany są związkami nietrwałymi i istnieją tylko w środowisku bezwodnym. Pod wpływem wody (nawet pary wodnej) ulegają rozkładowi z wytworzeniem wodorotlenku i wolnego alkoholu
Alkohole, podobnie jak woda, wykazują właściwości amofoteryczne, są jednak bardzo słabymi kwasami i zasadami. O kwasowym charakterze alkoholi świadczy reakcja z metalami alkalicznymi. Zasadowy charakter alkoholi uwidacznia się w fakcie, że można je za pomocą mocnych kwasów przeprowadzić w bardziej lub mniej trwałe sole. Na przykład reakcja bromowodoru z metanolem daje nietrwałą sól - bromek metylooksoniowy
Ważną grupę związków stanowią produkty reakcji alkoholi z kwasami zwane estrami. tworzą się one w odwracalnej reakcji estryfikacji alkoholi, zarówno z kwasami nieorganicznymi jak i organicznymi. Proces estryfikacji i słownicztwo estrów wyjaśniają następujące przykłady
Grupę alkoholową -OH można w odpowiednich warunkach podstawić grupą aminową lub fluorowcem. W pierwszym przypadku otrzymujemy aminę, drugim fluorowcoalkan.
Podczas przepuszczania par alkoholu i amoniaku nad tlenkiem gliu lub toru tworzą się odpowiednie aminy pierwszorzędowe
Odciągnięcie cząsteczki wody z dwóch cząsteczek alkoholu pierwszorzędowego (np. za pomocą stężonego kwasu sierkowego) prowadzi do eteru
Ważniejsze alkohole nasycone jednowodorotlenowe
Alkohol metylowy CH3OH, metanol, nazywany jest również spirytusem drzewnym, ponieważ dawniej otrzymywany był jako jeden z produktów suchej destylacjidrewna. Obecnie metanol otrzymuje się syntetycznie na skalę przymysłową przez ogrzewanie gazu wodnego wzbogaconego w wodór pod ciśnieniem 2 do 3.107
Alkohol metylowy jest łatwo lotną bezbarwną cieczą, wrzącą w temperaturze 64,7oC. Z wodą miesza się w każdym stosunku, przy czym rozpuszczaniu w wodzie towarzyszy zmniejszenie objętości mieszaniny i podwyższenie jej temperatury. Używany jest jako rozpuszczalnik żywic i lakierów, jak również do produkcji formaldehydu, barwników i substancji metylujących.
Alkohol metylowy jest bardzo trujący i wprowadzony doustnie do organizmu powoduje ślepote, a nawet śmierć. Trujące są równiez pary metanolu.
Najważniejszym i najbardziej rozpowszechnionym alkoholem jest alkohol etylowy(etanol) C2H5OH, jego 95% roztwór wodny nazywa się potocznie spirytusem.
Dawniej etanol otrzymywano wyłącznie w procesie fermentacji skrobi lub cukrów zawartych w materiale roślinnych. Umiano go już otrzymywać tym sposobem w czasach starożytnych drogą destylacji wina.
Fermentacja cukrów, przeprowadzana w gorzelniach, jest procesem złożonym. Nie wnikając w szczegóły zjawisk możemy je scharakteryzować krótko jako szereg reakcji, w których uczestniczą odpowiednie enzymy (biokatalizatory). Skrobię wydzieloną z ziemniaków, ryżu lub zboża poddaje się hydrolitycznemu rozkładowi enzymatycznemu z udziałem enzymu distazy na dwucukier maltozę
Po dodaniu drożdży obecny w nich enzym zwany maltazą przeprowaza maltozę w obecności wody w glukozę
W reakcji przemiany glukozy na etanol uczestniczy kompleks enzymów zway zymazą, a reakcja przebiega według ogólnego równania
Podczas fermentacji alkoholowej, która odbywa się w tzw. zacierze, stężenie alkoholu nie przekracza 16%, ponieważ przy stężęniu wyższym zachodzi inaktywacja wnzymów i fermentacja ustaje.
Aby otrzymać wysokoprocentowy etanol stosuje się destylacje frakcjonowaną. W ten sposób otrzymujemy nie tylko stężony alkohol, lecz uwalniamy go przy tym od domieszek i zanieczyszczeń głównie gliceryny i tzw. oleju fuzlowego, w skład którego wchodzą, obok innych, izomery alkoholu butylowego i amylowego (pentanolu) powstające na skutek rozkładu ciał białkowych zawartych w zbożu i ziemniakach. Po rektyfikacji otrzymuje się alkohol o zawartości 95,57% alkoholu i 4,43%wody. Dalsza rektyfikacja nie usuwa wody, powstała bowiem mieszanina jest mieszaniną azeotropową, wrzącą pod ciśnieniem 1013 hPa w temperaturze 78,14oC. Otrzymanie 100% etanolu, czyli tzw. alkoholu absolutnego wymaga spacjalnych zabiegów.
Większość etanolu otrzymywanego obecnie w procesie fermentacyjnym używana jest do celów spożywczych, a do celów technicznych stosowany jest głównie alkohol syntetyczny.
Etanol syntetyczny otrzymuje się tzw. metodą "acetylenową" zwaną również reakcją Kuczerowa. Acetylen w obecności siarczanu rtęci HgSO4 jako katalizatora, przyłącza cząsteczkę wody, tworząc aldehyd octowt. Aldehyd ten poddany redukcji daje alkohol etylowy
Zastosowanie etanolu jest wszechstronne. jest on bardzo dobrym rozpuszczalnikiem wielu substancji organicznych i nieorganicznych. Służy jako surowiec do syntey sztucznego kauczuku. odwodniony etanol w mieszaninie z benzyną używany jako paliwo silnikowe. Odwodniony etanol stosowany jest do wyrobu spirytusu skażonego tzw. denaturatu. W przemyśle farmaceutycznym jest surowcem do produkcji róznych lekarstw.
Duże zastosowanie ma etanol w różnych dziedzinach przemysłu spożywczego. Stosowany jest do wyrobu napojów alkoholowych. przemysł cukierniczy używa etanol do wyrobu różnych cukierków, tortów itp. Alkohol etylowy jest również surowcem do produkcji octu spirytusowego
Alkohol propylowy (propanol) C3H7OH istnieje w postaci dwóch izomerów, jako propanol pierwszo- i drugorzędowy
Znane są cztery izomery strukturalne alkoholi utylowych C4H9OH: dwa pierwszorzędowe, jeden drugorzędowy i jeden trzeciorzędowy. Alkohol pentylowy C6H11OH, zwany zwyczajowo alkoholem amylowym, występuje w postaci ośmiu izomerów. Alkohole propylowe, butylowe i amylowe są bardziej trujące i działają ardziej oszałamiajaco niż alkohol etylowy, wobec czego nie nadają się do celów konsumpcyjnych. Używane są, między innymi, jako doskonałe rozpuszczalniki lakierów nitrocelulozowych
Alkohole wielowodorotlenowe
Podobnie jak alkohole jednowodorotlenowe, tak i alkohole wielowodorotlenowe można wyprowadzić z węglowodorów zastępując atomy wodoru grupami -OH, z tym, że przy tym samym atomie węgla nie mogą znajdować się dwie grupy -OH (wyjątek stanowi wodzian chloranu i mezoksalu)
Zgodnie z podaną powyżej regułą najprostszy alkohol dwuwodorotlenowy musi posiadać co najmniej dwa atomy węgla, można go więc wyprowadzić z etanu
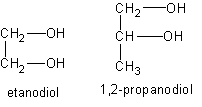
Alkohole dwuwodorotlenowe (diole) są bezbarwnymi cieczami o słodkim smaku, stąd zwyczajowo nazywa się je glikolami (od greckiego słowa glykys - słodki). Etanodiol, glikol etylenowy, jest bezbarwną trującą cieczą, dobrze rozpuszczalną w wodzie. Związek tan znalazł zastosowanie jako domieszka do wody w chłodnicach samochodowych, co zapobiega zamarzaniu wody zimą. Ponadto glikol etylenowy używany jest w kosmetyce, do produkcji materiałów wybuchowych oraz do wyrobu włókna sztucznego - terylenu.
Najprostszym, a równocześnie najważniejszym przedstawicielem alkoholi trójwodorotlenowych jest gliceryna (propanotriol)
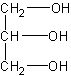
G l i c e r y n a jest oleistą bezbarwną cieczą o słodkawym smaku. Z wodą miesza się w każdym stosunku. Wśród pochodnych gliceryny na szczególną uwagę zasługują tłuszcze - właśnie przez hydrolizę otrzymuje sie glicerynę na skalę techniczną.
Gliceryna znalazła zastosowanie w kosmetyce, w przemyśle farmaceutycznym oraz w przemysle włókienniczym do apretury. Znaczne ilości gliceryny zużywa przemysł materiałów wybuchowych do otrzymywania triazotanu gliceryny zwanego tradycyjnie, lecz niesłusznie, nitrogliceryną. Powstaje ona w wyniku estryfikacji gliceryny stężonym kwasem azotowym w obecności stężonego kwasu siarkowego
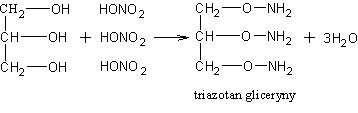
Triazotan gliceryny jest oleistą cieczą, łatwo wybuchającą np. wskutek wstrząsu. Zmieszany w odpowiedniej proporcji z ziemią okrzemkową stanowi materiał wybuchowy, zwany dynamitem. Dynamit został wynaleziony w roku 1899 przez szwedzkiego chemika Alberta Nobla. Część dochodów uzyskanych z zastosowania tego wynalazku przeznaczył Nobel na nagrody przyznawane corocznie za wybitną twórczość naukową, literacką, artystyczną - jako tzw. nagrody Nobla. Z wzoru cząsteczki gliceryny wynika, że związek ten jest równocześnie alkoholem pierwszo- i drugorzędowym (dwa skrajne atomy węgla są pierwszorzędowe, środkowy atom wegla jest drugorzędowy). dlatego podczas utleniania gliceryny otrzymuje się aldehyd glicerynowy i keton zwany dihydroksyacetonem
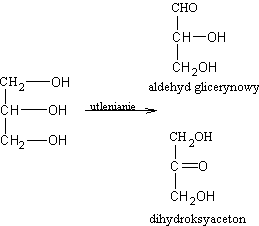
związki te stanowią podstawę klasyfikacji cukrów prostych (podział na aldozy i ketozy).
Alkohole z czterema grupami -OH w cząsteczce (tetraole) nazywamy zwyczajowo erytrytami, z pięcioma (pentaole) - pentytami, a z sześcioma - heksytami. Otrzymuje się je przez redukcję cukrów prostych. Z arabinozy powstaje arabit, z glukozy - sorbit, z mannozy - mannit, a z galaktozy - dulcyt.
Ważniejszym alkoholem czterowodorotlenowym jest pentaerytryt o wzorze
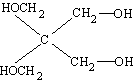
Związek ten w postaci tetraazotanu jest szeroko stosowany pod różnymi nazwami jako materiał wybuchowy.
Wszystkie alkohole wielowodorotlenowe (od czterech grup -OH) zawierają w cząsteczkach asymetryczne atomy węgla i dlatego występują w różnych odmianach optycznie czynnych. Nazwy pentytów o wzorze ogólym
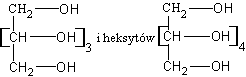
związków rózniących się przestrzennym rozmieszczeniem grup alkoholowych wokół asymetrycznych atomów węgla, związane są najcześciej z nazwami roslin, z których je po raz pierwszy wyodrebniono. Na przykład nazwa sorbit pochodzi stąd, że związek ten wyodrębniono z owoców jarzębiny (sorbus aucuparia).
Alkohole nienasycone i aromatyczne
Najprostszym nienasyconym alkoholem otwierającym szreg homologiczny alkenoli jest 2-propen-1-ol zwany zwyczajowo allilowym. Alkohol allilowy tworzy się podczas ogrzewania gliceryny z kwasem szczawiowym.
Jako produkt pośredni reakcji powstaje obojętny ester kwasu szczawiowego i gliceryny, który podczas dalszego ogrzewania rozpada się na alkohol allilowy i dwutlenek węgla. Estry alkoholu allilowego stosuje sie jako monomery do syntezy związków wielkocząsteczkowych (polimerów).
Wyższe alkohole o jednym lub dwóch wiązaniach podwójnych w łańcuchu znaleziono w olejkach eterycznych różnych roślin. Wyróżniają się one przyjemnym zapachem i należą do głównych substancji zapachowych tych olejków. Należą do nich, między innymi występujące w olejku różanym geraniole i cytronelole oraz posiadający zapach konwali linalool.
Związki te w budowie chemicznej wykazują pewne podobieństwo do terpenów, w które mogą się przekształcić; odróżniają się jednak od terpenów tym, że nie mają budowy cyklicznej. Podobieństwo tych związków (zwanych także alkoholami terpenowymi) do terpenów uwidaczniamy pisząc wzory ich budowy w postaci przypominającej szkielet mentanu.
Olejki eteryczne sązwykle mieszaniną izomerów, np. geraniol, którego wzór podano poniżej występuje jako geranio I i geraniol II
Jak wynika z wzorów związki te są izomerami, a różnią się jedynie położeniem wiązania podwójnego.
W przyrodzie występuje również (w postaci związanej w chlorofilu) alkohol nienasycony tzw. fitol C20H39OH: jest to gesy olej dający się destylować tylko pod znacznie obniżonym ciśnieniem (4 Pa). grupa fitylowa C20H39 - występuje również w witaminie K i E.
Najprostszym alkoholem z potrójnym wiazaniem jest a l k o h o l p r o p a r g i l o w y (2-propyn-1-ol).
Związek ten powstaje podczas polimeryzacji acetylenu z formaldehydem. Alkohol propargilowy ulega charakterystycznym reakcjom zarówno grupy alkoholowej jak i potrójnnego wiązania. Acetylenowy atom wodoru może być podstawiony metalem; tworzą się wówczas trudno rozpuszczalne, wybuchowe sole. Najprostszym alkoholem aromatycznym jest fenylometanol zwany zwyczajowo alkoholem benzylowym (C6H5CH2OH). Alkohol benzylowy jest cieczą o temp. wrzenia 206oC, wystepuje w stanie wolnym w olejku jaśminowym. Syntetycznie można go otrzymać przez hydrolizę chlorku benzylu
Alkohol benzylowy wykazuje słaby aromatyczny zapach i reaguje podobnie do alkoholi pierwszozedowych.
Następnym w szeregu homologicznym alkoholi aromatycznych, alkohol fenyloetylowy (2-fenylo-1-etanol) C6H5CH2CH2OH jest składnikiem oleju różanego i posiada zapach tych kwiatów. Ma on zastosowanie w perfumerii.
Fenole
Fenole - Hydroksylowe pochodne węglowodorów aromatycznych, w których grupa hydroksylowa związana jest z atomem węgla pierścienia aromatycznego
wzór ogólny:
przykłady:
fenol - benzenol
właściwości fizyczne fenolu:
-substancja krystaliczna o silnym charakterystycznym zapachu
-czysty bezbarwny, w obecności związków żelaza przyjmuje barwę różową albo brunatną
-powoduje trudno gojące się oparzenia, jego opary są trujące
-słabo rozpuszczalny w wodzie
właściwości chemiczne fenolu:
fenol jest słabym kwasem - ulega dysocjacji:
Zwiększona kwasowość fenoli w porównaniu z alkoholami wynika z oddziaływania wolnych par elektronowych atomu tlenu z sekstetem elektronowym pierścienia aromatycznego. Następuje zmniejszenie polaryzacji wiązania C-O i zwiększenie polaryzacji wiązania O-H, co ułatwia oderwanie protonu.
reakcje charakterystyczne:
1) reagują z roztworami wodorotlenków litowców dając sole - fenolany.
Fenolany jako sole słabych kwasów i mocnych zasad ulegają w wodzie hydrolizie zasadowej:
Fenol może być wyparty ze swej soli przez mocniejszy od niego kwas na przykład kwas węglowy.
2) rekcje tworzenia barwnych związków kompleksowych z solami żelaza (III) - kolor fioletowy, granatowy lub czerwonobrunatny
3) reakcje podstawienia wodoru w pozycjach orto i para względem grupy hydroksylowej w pierścieniu aromatycznym.
a) reakcje nitrowania fenolu (zachodzi bardzo łatwo - powstaje mieszanina orto i para nitrofenoli).
b) chlorowanie lub bromowanie fenolu Reakcja zachodzi bardzo łatwo, jest używana do oznaczania zawartości fenolu, na przykład w ściekach przemysłowych.
3) reakcja ze stężonym kwasem bromowodorowym w obecności stężonego kwasu siarkowego nie zachodzi w przeciwieństwie do alkoholi (odróżnianie fenoli i alkoholi).
4) Reakcja uwodornienia
5) reakcje estryfikacji z kwasami karboksylowymi.
Otrzymywanie:
a) hydroliza halogenków arylowych zachodząca w bardzo ostrych warunkach (ogrzewanie ze stężonym roztworem NaOH w temperaturze ponad 370 C i pod ciśnieniem), rozkład utworzonego fenolanu kwasem węglowym.
b) destylacja smoły węglowej
Zastosowanie:
-krezole są stosowane jako środki do dezynfekcji pomieszczeń sanitarnych.
Lizol - roztwór krezoli w mydle potasowym
-benzodiole służą do produkcji barwników
-hydrochinon stosowany jako składnik wywoływacza fotograficznego
-naftole są stosowane do wyrobu barwników, leków, środków zapachowych
-fenol stosowany do produkcji tworzyw sztucznych, barwników, farb, materiałów wybuchowych wodny roztwór fenolu - karbol używany jest do dezynfekcji pomieszczeń
Etery o wzorze ogólnym R-O-R' można uważać za alkilowe lub arylowe pochodne wody, lub pochodne alkoholi, z których się je zazwyczaj otrzymuje
Jeżeli obydwie grupy R są identyczne eter nazywamy prostym lub symetrycznym, a jeżeli sa rózne - mieszanym lub niesymetrycznym
Etery są izometryczne alkoholami, a ponadto wykazują izomerię łańcuchową. Na przykład izomeryczny z alkoholem butylowym eter o wzorze sumarycznym C4H10O może występować jako symetryczny eter dietylowy lub niesymetryczny eter metylowopropylowy CH3-O-CH2-CH2-CH3. Ten rodzaj izomerii, polegającej na różnorodności grup wystepujących w cząsteczkach (np. eterów) o takim samym składzie pierwiastkowym nosi nazwę metamerii. Etery, dietylowy i metylowopropylowy są więc metamerami.
Nazwy zwyczajowe eterów wywodzą się ze słowa eter i nazwy alkilów, np. eter dimetylowy CH3-O-CH3, eter metylowoetylowy CH3-O-CH2-CH3 itd. Racjonalnie nazwy eterów wywodzą się z nazwy węglowodorów z przedrostkiem alkoksy. Nazwy tych grup uzyskujemy zastępując -yl w nazwie grupy węglowodorowej końcówką -oksy
Przykłady słownictwa niektórych eterów
Etery, z powodu braku wewnątrz- i międzycząsteczkowych wiązań wodorowych, mają znacznie niższe temperatury wrzenia niż izomeryczne z nimi alkohole. Ogólnie biorąc temperatury wrzenia eterów są zbliżone do temperatury wrzenia alkanów o tej samej masie cząsteczkowej i podobnej budowie łańcucha.
Etery proste powstają przez odwodnienie alkoholi
Jako środka odwadiającego używa się zwykle stężonego kwasu siarkowego.
Metodą miejsca ogólne zastosowanie do otrzymywania eterów, zarówno prostych jak i mieszanych, jest tzw. synteza Williamsona. Polega ona na reakcji pomiedzy odpowiednimi alkoholami i halogenkami alkilowymi
Dany alkohol można zamienić w odpowieni eter symetryczny przez zamianę jednej części alkoholu w pochodną sodową, a drugiej w odpowiedni bromek lub jodek i przeprowadzenie reakcji między tymi dwoma składnikami
W syntezie Williamsona halogenek alkilowy można zastąpić siarczanej dialkilowym, co jest szeroko stosowane do otrzymywania metylowych lub etylowych eterów fenoli
Najważniejszy z eterów pierścieniowych 1,4-dioksna jest dobrze rozpuszczalną w wodzie ciecząo temperaturze wrzenia podobnej do temp. wrzenia wody (101oC). Jest to cenny organiczny rozpuszczalnik, zastępujący wodę. Powstaje przez dimeryzację najprostszego eteru cyklicznego, a mianowicie tlenku etylenu
Etery mają właściwości zasadowe, jest to spowodowane faktem, że wolne pary elektronowe atomu tlenu mogą przyłączać protony i tworzyć odpowiednie sole, zwane solami oksoniowymi
Atomy tlenu w eterach mogą być również donorami par elektronowych; tworzą się wówczas odpowiednie związki kompleksowe.
Z eterów najważniejsze zastosowanie ma eter dietylowy. Wdychanie par eteru dietylowego powoduje utratę świadomości wskutek obniżenia czynności osrodkowego układu nerwowego, z tego względu związek ten bywa stosowany do narkozy.
Eter jako doskonały rozpuszczalnik tłuszczów i innych substancji organicznych stosowany bywa również jako rozpuszczalnik do ekstrakcji. Pary eteru są łatwopalne, dlatego należy go stosować ostrożnie.
Analogami siarkowymi alkoholi są Tioalkohole nazywane również zwyczajowo merkaptanami. Związki te powstają, między innymi, podczas przepuszczania par alkoholu z siarkowodorem nad tlenkiem toru.
Grupa funkcyjna tioalkoholi -SH nazywana jest grupą sulfhydrylową lub tiolową. Tioalkohole mają charakter bardziej kwaśny niż alkohole, zgodnie z tym, że siarkowodór jest mocniejszym kwasem od wody. Związki te rozpuszczają się w wodnym roztworze NaOH tworząc sole R-SNa, zwane merkaptydami. Nazwa merkaptan pochodzi z nazwy łacińskiej "corpus mercurio aptum" co oznacza dosłownie ciało podatne rtęci. Wyrażą to zdolność merkaptanów do tworzenia z jonami rtęci trwałych krystalicznych soli (merkaptydów). Nazwy racjonalne tioalkoholi wyprowadzamy od nazwy alkanu z przyrostkiem -tiol, np. CH3-SH metaniotiol, CH3CH2-SH etanotiol, ogólnie alkanotiol; używane są też nazwy zwyczajowe - tioalkohol lub merkaptan. Analogami eterów są siarkoetery, zwane również tioeterami. Związki te powstają podobnie do eterów z merkaptydu sodowego lub potasowego i czynników alkilujących
Tioetery są obojętnymi nierozpuszczalnymi w wodzie cieczami. Wśrodowisku kwaśnym pzyłączają proton tworząc analogicznie do soli oksoniowych - sole sulfoniowe
Estry kwaów karboksylowych
wzór ogólny:
Estry są pochodnymi kwasów karboksylowych w których zamiast atomu wodoru grupy karboksylowej znajduje się grupa alkilowa lub arylowa
przykłady:
otrzymywanie:
Reakcja estryfikacji - reakcja kwasu karboksylowego z alkoholem lub fenolem w obecności środowisku kwasowym
przykłady:
Reakcja estryfikacji jest przykładem reakcji kondensacji.
Reakcja kondensacji - proces w którym z dwóch cząsteczek reagentów organizacja powstaje cząsteczka produktu złożona z fragmentów cząsteczek obu reagentów oraz cząsteczka prostego produktu ubocznego, najczęściej wody.
Aby ustalić z którego z substratów pochodzi atom tlenu w cząsteczce wody wykorzystano metodę atomów znaczonych.
Zastąpiono atom tlenu w cząsteczce alkoholu jego izotopem radioaktywnym.
Stwierdzono że znalazł się on w cząsteczce estru a nie wody. Atom tlenu w cząsteczce wody pochodzi więc z kwasu.
właściwości fizyczne estrów:
-ciecze
-trudno rozpuszczalne w wodzie
-o gęstości mniejszej od gęstości wody
-przyjemny zapach
-estry niższych i średnich kwasów karboksylowych oraz niższych i średnich alkoholi są nazywane olejkami eterycznymi (występują w owocach lub kwiatach i nadają im charakterystyczny zapach).
Olfaktologia - nauka zajmująca się zapachami.
reakcje charakterystyczne:
1. Reakcja kwasowej hydrolizy estrów - reakcja odwrotna do reakcji estryfikacji
2. Reakcja hydrolizy zasadowej pod wpływem jonów OH- - reakcja zmydlania
przykłady:
Zastosowanie:
-rozpowszechnione w przyrodzie (nadają zapach olejkom roślinnym i owocom)
-estry kwasów karboksylowych o długich łańcuchach to woski (wchodzą w skład wosku pszczelego i stanowią powłokę liści)
-są stosowane do wyrobu esencji zapachowych, rozpuszczalników i farb (np rozpuszczalnik nitro to mieszanina octanów propylu, butylu i pentylu)
Kwas acetylosalicylowy (Polopiryna, Aspirin)- jest od 1899 r. Lekiem przeciwbólowym, przeciwgorączkowym, przeciwzapalnym, przeciwzakrzepowym.
Estry kwasów nieorganicznych
Otrzymywanie:
Reakcja estryfikacji:
kwas nieorganiczny + alkohol = ester kwasu nieorganicznego + woda
[kwas azotowy (V)]
[kwas siarkowy (VI)]
[kwas borowy]
[kwas fosforowy (V)]
przykłady:
Kwas borowy reaguje z alkoholem w obecności stężonego kwasu siarkowego - reakcja stosowana do wykrywania związków boru (pary estrów kwasu borowego palą się zielonym płomieniem)
Reakcja estryfikacji nitrogliceryny
Reakcje charakterystyczne:
1. Hydroliza katalizowana jonami H+ - reakcja odwrotna do estryfikacji
ester kwasu nieorganicznego + woda = kwas nieorganiczny + alkohol
2. Hydroliza zasadowa
ester kwasu nieorganicznego + zasada = sól kwasu nieorganicznego + alkohol
Zastosowanie:
-występują w organizmach żywych (np. estry kwasu fosforowego (V) uczestniczą w procesach biochemicznych ATP - adenozynotrójfosforan)
-są półproduktami w syntezie organicznej (np siarczan (VI) dietylu)
-sole sodowe wodorosiarczanów alkoholi o długich łańcuchach węglowych są używane do wyrobu detergentów
-azotany alkoholi wielowodorotlenowych są stosowane do wyrobu materiałów wybuchowych
(nitrogliceryna - triazotan (V) gliceryny)
Amidy kwasowe
Amidy kwasowe - pochodne kwasów karboksylowych w których grupa OH- grupy karboksylowej została zastąpiona grupą aminową -NH2
przykłady:
Właściwości fizyczne acetamidu:
-biała krystaliczna substancja
-dobrze rozpuszczalny w wodzie
-odczyn roztworu wodnego obojętny
Reakcje charakterystyczne:
Amidy kwasowe reagują zarówno z kwasami jak i z zasadami, są więc amfolitami. Ich charakter amfolityczny jest spowodowany występowaniem tautomerii amidowo-imidowej, polegającej na wędrówce protonu między grupą aminową i karbonylową. Forma amidowa tworzy połączenia z kwasami dzięki obecności wolnej pary elektronowej na atomie azotu grupy NH2 forma imidowa może reagować z zasadami odszczepiając proton z grupy hydroksylowej.
1. Hydroliza w środowisku kwaśnym (pod wpływem mocnych kwasów nieorganicznych)
2. Hydroliza w środowisku zasadowym (pod wpływem wodorotlenków litowców)
Otrzymywanie:
1. Ogrzewanie kwasów karboksylowych z ... a) z amoniakiem (otrzymywanie amidów I-rzędowych)
b) z aminami I-rzędowymi (otrzymywanie amidów II-rzędowych)
c) z aminami II-rzędowymi (otrzymywanie amidów III-rzędowych)
Aminy
ORGANICZNE POCHODNE AMONIAKU
przykłady
Właściwości chemiczne
Aminy mają podobnie jak amoniak właściwości zasadowe - ich roztwory wodne zawierają jony OH-
Aminy alifatyczne są słabymi zasadami o mocy porównywalnej z mocą amoniaku, a aminy aromatyczne są od nich słabszymi zasadami. Słaby charakter zasadowy amin aromatycznych jest spowodowany oddziaływaniem wolnej pary elektronowej grupy aminowej z sekstetem elektronowym pierścienia aromatycznego.
1. Tworzenie soli w reakcji z kwasami.
2. Tworzenie amidów z kwasami karboksylowymi w wyniku ogrzewania (dotyczy amin I i II rzędowych)
Otrzymywanie:
a) amin aromatycznych - przez redukcję związków nitrowych
b) amin alifatycznych - przez podstawienie atomu fluorowca amoniakiem i wydzielenie aminy zasadą.
Hydroksykwasy
- związki zawierające w cząsteczkach grupy karboksylowe i hydroksylowe.
przykłady:
kwas mlekowy
Kwas mlekowy ma dwa enancjomery:
-prawoskrętny (kwas(+)mlekowy) tworzy się w mięśniach podczas pracy fizycznej powodując uczucie bólu mięśni.
-lewoskrętny (kwas(-)mlekowy) jest produktem fermentacji niektórych cukrów pod wpływem enzymów wytwarzanych przez bakterie. (znajduje się w zsiadłym mleku, ogórkach kiszonych, kapuście)
kwas salicylowy
Kwas salicylowy wykazuje właściwości kwasu karboksylowego:
-odczyn kwasowy
-wypiera słabsze kwasy z ich soli (np. kwas węglowy)
Fioletowe zabarwienie roztworu po dodaniu chlorku żelaza świadczy o obecności grupy fenylowej.
Kwas salicylowy ma działanie bakteriobójcze. (Jego 70% roztwór w alkoholu etylowym - to spirytus salicylowy)
reakcje charakterystyczne:
1. Tworzenie poliestrów w reakcji estryfikacji
Obecność grup: hydroksylowej i karboksylowej w cząsteczce powoduje że związki te mogą reagować same ze sobą.
Grupa karboksylowa jednej cząsteczki reaguje z grupą hydroksylową innej cząsteczki tworząc wiązanie estrowe.
Reakcja ta przebiega dalej aż do utworzenia poliestru - związku o długim łańcuchu z rozmieszczonymi w nim regularnie grupami estrowymi.
2. Wewnątrzcząsteczkowa reakcja estryfikacji
Reakcja zachodzi w obrębie tej samej cząsteczki dając ester cykliczny zwany laktonem.
3. Podczas ogrzewania a-hydroksykwasu zachodzi reakcja kondensacji dwóch cząsteczek hydroksykwasu z utworzeniem estru o budowie pierścieniowej - laktydu.
Otrzymywanie:
Kwas mlekowy otrzymuje się syntetycznie przez chlorowanie kwasu propanowego a następnie podstawienie atomu chloru grupą hydroksylową. Produktem jest racemat kwasu mlekowego.
Zastosowanie:
kwas salicylowy - stosowany do odkażania (ma działanie bakteriobójcze).
salicylan metylu - składnik maści przeciwreumatycznych.
kwas acetylosalicylowy - główny składnik aspiryny.
kwas winowy i kwas cytrynowy - występują w owocach i są stosowane w przemyśle spożywczym
Wiele hydroksykwasów występuje w przyrodzie będąc produktami reakcji przebiegających w organizmach żywych głównie komórkowego utleniania węglowodanów.
Aminokwasy
Aminokwasy- związki dwufunkcyjne zawierające w swych cząsteczkach grupy karboksylowe i aminowe.
przykłady:
Właściwości fizyczne aminokwasów:
-są związkami krystalicznymi
-rozpuszczają się w rozpuszczalnikach polarnych (woda, alkohol etylowy), nie rozp. się w rozpuszczalnikach niepolarnych (benzen, eter, heksan)
-mają wysokie temp topnienia
Właściwości chemiczne glicyny:
Roztwór wodny glicyny jest obojętny ponieważ obecne w cząsteczce grupy: karboksylowa i aminowa ulegają wewnętrznemu zobojętnieniu. Tworzy się sól wewnętrzna w rezultacie przeniesienia jonu H+ od grupy karboksylowej do aminowej.
a) Sól taka może reagować zarówno z kwasami jak i z zasadami.
b) Reakcja kondensacji - zachodzi pomiędzy grupą aminową i karboksylową dwóch aminokwasów.
Powstały produkt nadal ma grupę aminową i karboksylową i może reagować dalej w reakcji kondensacji. Związki powstałe w wyniku kondensacji aminokwasów,
noszą nazwę peptydów.
przykłady innych reakcji kondensacji:
Reakcją odwrotną do redakcji kondensacji jest reakcja hydrolizy.
Za pomocą tej reakcji można ustalić, z jakich aminokwasów składał się peptyd.
c) Reakcja kondensacji - zachodząca pomiędzy grupą aminową I karboksylową tego samego aminokwasu. - wewnątrzcząsteczkowa reakcja kondensacji.
Pierścienie laktamowe są elementami składowymi penicyliny.
d) Reakcja dezaminacji
-proces transaminacji - zachodzi u kręgowców; prowadzi do powstania ketokwasów; akceptorem amoniaku z aminokwasu jest ketokwas, który jest jednocześnie donorem tlenu na rzecz dezaminowanego aminokwasu.
-dezaminacja oksydacyjna - zachodzi u kręgowców; następuje odwodorowanie aminokwasu przy udziale enzymu dehydrogenazy (koenzym FAD, rzadziej NAD+) do iminokwasu, następnie samorzutne dołączenie wody z odłączeniem amoniaku.
-dezaminacja hydrolityczna - zachodzi u bakterii; prowadzi do powstania hydroksykwasów.
-dezaminacja redukcyjna zachodzi u bakterii; prowadzi do powstania kwasów nasyconych.
-dezaminacja bezpośrednia zachodzi u bakterii; prowadzi do powstania kwasów nienasyconych.
Punkt izoelektryczny (pI) - takie pH środowiska, przy którym cząsteczka aminokwasu w danych warunkach jest obojętna. W punkcie izoelektrycznym cząsteczka nie ma wędrowania w polu elektrycznym.
Punkt izojonowy - taka wartość pH, przy której liczba protonów związanych z grupami -NH2 jest równa liczbie protonów odszczepionych przez grupy -COOH. W tym punkcie przeciętny ładunek jest równy zeru. Punkt ten ma wartość stałą i charakterystyczną dla danego aminokwasu lub białka.
Natomiast punkt izoelektryczny ulega zmianie, bo zależy od środowiska.
W roztworze o Ph większym od punktu izoelektrycznego cząsteczka występuje w postaci anionu, a poniżej pI - w formie kationu. W punkcie izoelektrycznym jest najsłabiej rozpuszczalna, czyli najłatwiej ją strącić.
Podział aminokwasów:
a) ze względu na ilość grup karboksylowych i aminowych:
obojętne (1 grupa -NH2 1 grupa -COOH)
kwaśne (1 grupa -NH2 2 grupy -COOH)
zasadowe (2 grupy -NH2 1 grupa -COOH)
obojętne z układem cyklicznym
b) ze względu na polarność grup R w sąsiedztwie węgla a.
Aminokwasy białkowe
Białka zbudowane są z reszt aminokwasowych połączonych wiązaniami peptydowymi. Ze wszystkich znanych białek wyodrębniono tylko 25 aminokwasów tzw. białkowych.
W aminokwasach białkowych jedna grupa aminowa jest związana z tym samym atomem węgla, z którym związana jest jest grupa karboksylowa oraz atom wodoru.
Ten atom węgla określa się jako atom węgla a.
Wszystkie aminokwasy białkowe są a-aminokwasami.
Z atomem węgla a związane są cztery różne podstawniki a więc są to cząsteczki chiralne i mogą występować w dwóch odmianach czynnych optycznie (enancjomerach).
Konfiguracja grup związanych z atomem węgla a jest dla wszystkich aminokwasów białkoweych taka sama i oznacza się ją jako L.
Wszystkie aminokwasy białkowe są więc L-a-aminokwasami.
przykłady:
Aminokwasy egzogenne - są to aminokwasy, które nie są syntezowane w organizmie ludzkim, a ich obecność i odpowiednie stężenie w białkach spożywczych decyduje o wartości odżywczej. (Walina, leucyna, lizyna, metionina, treonina, fenyloalanina, tryptofan, arginina, histydyna)
Aminokwasy endogenne są to aminokwasy, które są syntezowane w organizmie ludzkim. (Glicyna, alanina, tyrozyna, kwas asparaginowy, kwas glutaminowy, glutamina, prolina, cysteina, hydroksyprolina)
Aminokwasy glikogenne - aminokwasy, których metabolizmprowadzi do wytwarzania glukozy (sacharydów).
Aminokwasy ketogenne - aminokwasy których metabolizm prowadzi do wytwarzania związków ketonowych.
Mocznik
Kwas węglowy ze względu na obecność w swojej cząsteczce dwóch grup karboksylowych może tworzyć pochodne organiczne np. mocznik.
Właściwości fizyczne mocznika:
-biała krystaliczna substancja
-dobrze rozpuszczalny w wodzie
-odczyn roztworu wodnego obojętny
Reakcje charakterystyczne:
1. Hydroliza w środowisku kwaśnym (pod wpływem mocnych kwasów nieorganicznych)
2. Hydroliza w środowisku zasadowym (pod wpływem wodorotlenków litowców)
3. Reakcja kondensacji dwóch cząsteczek mocznika.
W wyniku reakcji tworzy się cząsteczka dimocznika zw. biuretem. Biuret zawiera wiązanie peptydowe, (wiązanie peptydowe wykrywa się za pomocą reakcji z jonami miedzi (II)- reakcja biuretowa).
Otrzymywanie:
A) Synteza amoniaku i dwutlenku węgla w reakcji odwrotnej do reakcji hydrolizy.
B) Z karbidu w reakcji z azotem otrzymuje się mieszaninę cyjanamidku wapnia i grafitu (zwaną azotniakiem), a następnie w reakcji z kwasami mineralnymi uzyskuje się cyjanamid, który z wodą tworzy mocznik.
C) w reakcji fosgenu z amoniakiem.
Występowanie:
-w pocie i moczu zwierząt i ludzi jako produkt przemiany białek
Zastosowanie:
-jako półprodukt w syntezie środków leczniczych i mas plastycznych
-jako nawóz azotowy
37
Wyszukiwarka
Podobne podstrony:
Alkohole wielowodorotlenowe
Chemia alkoholu, Chemia Fizyka Matma
chemia alkohole i aldehydy
CHEMIA ALKOHOLEi Fenole
Chemia - alkohole, chemia
Chemia - alkohole i fenole, Liceum Matura, Chemia, Chemia(1)
ALKOHOLE WIELOWODOROTLENOWE id Nieznany (2)
Chemia - alkohole - ketony, Ściągi (liceum)
CHEMIA- ALKOHOLE, CHEMIA
chemia, ALKOHO~1, Alkohole-Związki o wzorze ROH gdzie r - dowolna grupa alkilowa
chemia, CHEMIA ALKOHOLE, Alkohole - są to pochodne węglowodorów, których cząsteczki zbudowane są z g
chemia alkohole
Chemia alkohole, fenole, aldehydy, ketony
ściąga chemia alkohole
chemia alkohole, etanol, metanol, fenol, aldehydy, kwasy karboksylowe
Chemia 2 ściąga (klasówka aldehydy alkohole estry kw karb ?nole)
więcej podobnych podstron