Pęcherzyki opłaszczone klatryną - powstawanie i losy.
Generalnie, pęcherzyki opłaszczone klatryną kierowane są do endosomów z błony komórkowej (te właściwie to są wczesnymi endosomami) lub do lizosomów przez późne endosomy z trans-Golgiego.
Pęcherzyki te mają dwie warstwy płaszcza: wewnętrzną zbudowaną z białek AP lub GGA (różne warianty dla różnych pęcherzyków) i zewnętrzną zbudowaną z klatryny. Klatryna tworzy charakterystyczne jednostki zwane triskelionami, z których każdy ma trzy łańcuchy ciężkie (180kDa) i trzy lekkie (35-40kDa). Asoscjują one po 36 tworząc wielościan o ściśle określonym zakrzywieniu powierzchni i średnicy. W środku znajduje się pęcherzyk, a między nim a klatryną - kompleksy AP (340kDa), z których każdy skalda się z czterech rożnych podjednostek zwanych adaptynami. To właśnie one określają jakie białka (receptor i związane z nimi ligandy) wejdą do pęcherzyka, stąd ich nazwa - AP=adapter proteins (o specyficzności w następnym zagadnieniu). Pęcherzyki opłaszczone AP1 lub GGA powstają w trans-Golgim i kierują się do lizosomów przez późne endosomy. Te opłaszczone AP3 również powstają w trans-Golgim i kierują się bezpośrednio do lizosomów lub podobnych do lizosomów organelli spichrzowych. Oplaszczenie AP2 natomiast, powstają w błonie komórkowej i tworzą wczesne endosomy, które na skutek fuzji zmieniają się w późne endosomy i łączą z lizosomami.
Wszystkie pęcherzyki klatryna/AP tworzą się dzięki GTP-azie ARF, a do ich odpoączkowania konieczna jest jeszcze dynamina, o której szerzej w następnym zagadnieniu. Powtarzając to co już było i za chwile będzie, aktywna - związana GTP forma ARF wiąże się z błoną i rekrutuje kompleksy AP i klatrynę. AP rekrutują odpowiednie receptory/białka transportowe, a klatryna powoduje wybrzuszanie się błony i tworzenie pęcherzyka. W końcu, dynamina wykorzystuje energię z GTP aby odciąć pęcherzyk od błony donorowej. Etap z dynaminą odbywa się tylko dla pęcherzyków klatrynowych. Nie wiadomo, dlaczego inne mogą odpączkować bez dynaminy.
Zaraz po utworzeniu pęcherzyka jego płaszcz oddysocjowuje. Prawdopodobnie dzieje się to z wykorzystaniem energii z ATP przez cytozolowe białko Hsc70. Pozwala to nie tylko na recykling płaszcza, ale też odsłania miejsca wiązania Rab i białka SNARE.
Pęcherzyki klatryna/AP1 jeden mają jedną charakterystyczną cechą, mianowicie transportują rozpuszczalne enzymy lizosomalne do późnych endosomów. Enzymy te mają sekwencje sygnalne, które w odróżnieniu od większości sekwencji sygnalnych białek są resztami cukrowymi a nie krótkimi fragmentami polipeptydowymi. Ten fragment sygnalny to mannozo-6-fosforan, dodawany w cis-Golgim. Enzymy te przechodzą taką samą N-glikozylację w ER jak białka mające iść na zewnątrz komórki, ale w Golgim na końce ich łańcuchów cukrowy dodawana jest ufosforylowana mannoza. W trans-Golgim M6P rozpoznawany jest przez transbłonowe receptory, które z kolei rozpoznawane są przez AP1. W kwaśnym pH endosomu M6P dysocjuje,a fosfatazy odcinają resztę fosforanową. Receptory M6P podobnie jak inne receptory/białka transportowe odpączkowują w specjalnych pęcherzykach i wracają do trans-Golgiego, choć czasami mogą trafić do błony komórkowej, gdzie biorą udział w odzyskiwaniu na drodze endocytozy wydzielanych do środowiska enzymów lizosomalnych. Późne endosomy w końcu łączą się z lizosomami i enzymy trafiają na swoje miejsce.
Adaptyny, dynamina, ARF
Adaptyny to białka tworzące kompleksy AP oplaszczające pęcherzyki. Od ich specyficzności zależy to jakie receptory/białka transportowe znajdą się w pęcherzyku. Rozpoznają one krótkie cytozolowe fragmenty sortujące transmembranowych receptorów/białek transportowych.
Pęcherzyki idące z trans-Golgiego do lizosomów przez późne endosomy są opłaszczone AP1 lub GGA (różnice między tymi dwoma są na razie nieznane). Rozpoznają one sygnał sortujący YXXΦ (Y=Tyr, X=dowolny aa, Φ=duży hydrofobowy aa) w domenie cytozolowej receptorów i białek transportowych. Pęcherzyki opłaszczone AP3 idą do lizosomów z pominięciem późnych endosomów, jest to szczególnie ważne w komórkach w których występują podobne do lizosomów organella magazynowe np. w komórkach barwnikowych skóry albo w komórkach tworzących płytki krwi. Pęcherzyki oplaszczone AP2, również rozpoznające YXXΦ to pęcherzyki z błony komórkowej do późnych endosomów przez wczesny endosom.
ARF to GTP-aza biorąca udział przy tworzeniu pęcherzyków klatryna/AP. Jej dokładna rola i mechanizm działania zostały przedstawione w zagadnieniu 52.
Dynamina to GTP-aza konieczna do odcięcia nowo utworzonego pęcherzyka od błony donora. Występuje tylko przy pęcherzykach opłaszczonych klatryną/AP2. W końcowej fazie pączkowania, dynamina polimeryzuje tworząc pierścień dookoła „szyjki” pęcherzyka. Wydaje się obecnie, że używa ona energii z hydrolizy GTP do zaciśnięcia się i oderwania pęcherzyka. W przypadku jeśli zablokujemy dynaminę, w komórce zakumulują się wykształcone, ale nie oderwane pęcherzyki.
Losy receptorów w endocytozie.
Przed związywaniem substratu receptory poruszają się swobodnie w błonie komórkowej, albo też związane są z dołkami klatrynowo/AP2. Związanie substratu powoduje zmianę konformacyjną kierująca te swobodne do dołków. Tam sekwencje sortujące w C-końcowych domenach cytozolowych, najczęściej jest to YXXΦ, rozpoznawane i wiązane są specyficznie przez adaptyny kompleksów AP2. Formuje się pęcherzyk, który po oddysocjowaniu płaszcza tworzy wczesny endosom, a następnie po fuzji z innymi pęcherzykami z błony i z Golgiego - późny endosom. Jak już było mówione, w późnym endosomi panuje niższe pH niż w cytozolu/Golgi/na zewnątrz, poniżej 6. Jest to skutek działania błonowych V ATP-az. W takim pH większość receptorów uwalnia swoje ligandy. Pod mikroskopem elektronowym późne endosomy wyglądają na sferyczne, ale z tubularnymi wypustkami. Okazało się, że w tych wypustkach gromadzą się wolne receptory, które następnie odpączkowują i ulegają recyklingowi, wracając do membrany. Dla przykładu receptor LDL, którego czas życia w komórce wynosi średnio 20h, odbywa jeden cykl błona->endosom->błona w 10-20 minut, czyli 60-120 razy w ciągu swego życia. Recykling receptorów pokazany był na obrazkach przy pęcherzykach klatrynowych i prze endocytozie. Poniżej zdjęcie recyklingu receptorów LDL.
Transport LDL.
Transport LDL to przykład endocytozy z udziałem receptorów. LDL to lipoproteina zawierająca na zewnątrz warstwę fosfolipidów i jedno duże białko apoB-100. W środku znajdują się estry cholesterolu, a całość ma 20-25nm średnicy. Receptor LDL, ekspersjonowany w większości ssaczych komórek to transmembranowa glikoproteina z krótkim cytozolowym C-końcem zawierającym sygnał sortujący NPXY - rozpoznawany przez AP2. N-koniec białka eksponowany na zewnątrz komórki zawiera domenę β-śruby (chyba tak to się nazywało, było na enzymologii na pewno, jak ktoś chce może sprawdzić^^) oraz bogatą w cysteinę domenę (7 powtórzeń motywów bogatych w cysteinę) wiążącą apoB-100. Po związaniu LDL receptor kierowany jest do formującego się pęcherzyka i razem z nim trafia do późnego lizosomu. Tam, pH niższe od 6 powoduje, że histydyny z domeny β-śruby zyskują ładunek dodatni i wiążą się z ujemnie naładowanymi resztami domeny wiążące ligand, wyrzucając ligand z kompleksu (uwielbiam takie motywy, gdzie białka działają jak takie mechaniczne urządzonka/silniczki^^). Receptor LDL wraca do błony, a składniki LDL są hydrolizowane przez enzymy lizosomalne.
Transport żelaza do komórki.
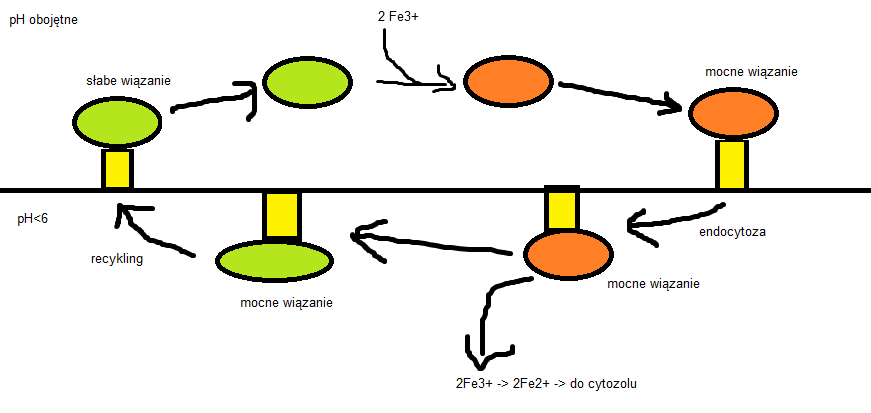
Żelazo transportowane jest do komórki w kompleksie z transferryną na drodze endocytozy z udziałem receptorów. Jednak jest ona trochę inna niż większość procesów endocytozy, ale najpierw o transferrynie. Transferryna to jeden z głównych składników osocza. Jest glikoproteiną transportującą żelazo z jelita i wątroby do reszty ciała. Ma dwie formy: niezwiązaną z żelazem apotransferrynę, która bardzo mocno wiąże dwa jony Fe3+ dając ferrotransferrynę. Wszystkie ssacze komórki mają receptory ferrotransferyny wiążące ją w obojętnym pH i jest ona endocytowana przez pęcherzyki klatrynowo/AP2 jak inne substancje. Jednak kiedy pęcherzyki docierają do późnych lizosomów pojawiają się pewne różnice. W normalnym przypadku, jak np. LDL, cały ligand oddziela się od receptora i jest trawiony. W przypadku transferryny zmiana pH powoduje dysocjację tylko jonów Fe3+, które na nieznanej drodze są redukowane do jonów Fe2+ a następnie wydzielane z endosomu przez transporter jonów dwudodatnich. Po uwolnieniu jonów żelaza ferrotransferryna przechodziapotransferrynę, która w niskim pH świetnie wiąże receptor i wraz z nim do błony komórkowej. Tam, w neutralnym pH wiązanie między apotransferryną i receptorem słabnie i apotransferryna jest uwalniana do środowiska (czyli płynu okołokomórkowego a nast. Krwioobiegu).
Rysunek jest mój własny, proszę nie narzekać. Zielone to apotransferryna, pomarańczowe to ferrotransferyna, żółte to receptor. GÓRNA I DOLNA POŁOWA OBRAZKA OZNACZAJĄ RÓŻNE WARUNKI pH. NIE SĄ W ŻADNYM WYPADKU GRAFICZNĄ REPREZENTACJĄ PRZEDZIAŁÓW KOMÓRKOWYCH.
Przykłady zjawisk transportu odbywającego się za pośrednictwem endocytozy z udziałem receptora.
Nie jestem pewien, czy w tym pytaniu należy też je opisać, czy tylko wymienić. Jeśli myślicie, że opisać, to opisy są powyżej a tu tylko wymienię:
wchłanianie LDL przez komórki
transport żelaza do komórki
transport hormonów peptydowych do komórki np. insuliny
wchłanianie niektórych glikoprotein
odzyskiwanie wydzielonych enzymów lizosomalny przez receptory M6P błony komórkowej
Wyszukiwarka
Podobne podstrony:
JW 44n 48n pecherzyki1
54 59
JW 60 64 pecherzyki4
JW 49n 53n pecherzyki2
2015 08 20 07 54 59 01
2015 08 20 07 54 59 01
54 59
53 54 57 58 59 60 61 doc
rak pecherza
Urazy pecherza
Określenie roli NMP22 w rozpoznaniu raka pęcherza
pecherzykidrogizol
Guzy nablonkowe pecherza moczowego
rak pecherza moczowego
59 04
2011 03 05 21;10;59
54
53 54
więcej podobnych podstron