Ćwiczenie 5. Spektroskopia w podczerwieni w badaniu struktury
biomakromolekuł
Metody spektroskopowe polegają na obserwacji oddziaływania promieniowania
elektromagnetycznego z materią. Można je podzielić na metody: emisyjne, w których
uzyskujemy informacje na temat promieniowania emitowanego przez próbkę; absorpcyjne,
gdzie informacje uzyskiwane są na podstawie tej części promieniowania, która została
zaabsorbowana oraz metody polegające na analizie promieniowania rozproszonego przez
próbkę (spektroskopia Ramana). Spektroskopia w podczerwieni bada absorpcję
promieniowania związaną ze wzbudzeniem poziomów oscylacyjnych cząsteczek.
5.1. Spektroskopia w podczerwieni – podstawy teoretyczne
W widmie promieniowania elektromagnetycznego zakres podczerwieni znajduje się
pomiędzy promieniowaniem widzialnym i mikrofalowym. Najbardziej istotny z punktu
widzenia spektroskopii biocząsteczek jest zakres podstawowy podczerwieni 4000 – 400 cm
-1
,
otoczony przez bliską (powyżej 4000 cm
-1
) i daleką podczerwień (poniżej 400 cm
-1
).
Energia wewnętrzna cząsteczek występuje w różnych formach, m. in.: (a) energii
translacji, związanej z nieuporządkowanym ruchem molekuł; (b) energii rotacyjnej,
wynikającej z wirowania cząsteczek wokół własnych osi; (c) energii oscylacyjnej, związanej
z oscylacjami wokół położeń równowagi atomów cząsteczek oraz (d) energii elektronowej, w
której skład wchodzi energia kinetyczna ruchu elektronów w cząsteczce oraz energia
potencjalna oddziaływania elektronów z jądrami oraz sąsiednimi elektronami. Absorpcja
promieniowania podczerwonego powoduje zmiany energii oscylacyjnej i rotacyjnej
cząsteczki. Kształt widm w tym zakresie promieniowania w przypadku ciał stałych i cieczy
zależy głównie od wzbudzeń oscylacyjnych, ponieważ rotacje cząsteczek są w tym przypadku
częściowo lub całkowicie hamowane przez oddziaływania międzycząsteczkowe. Widma ciał
stałych i cieczy są w związku z tym nazywane widmami oscylacyjnymi, natomiast widma
cząsteczek w fazie gazowej noszą nazwę widm oscylacyjno-rotacyjnych ze względu na dużą
swobodę zarówno rotacji jak i oscylacji cząsteczek. Drgania molekuł wieloatomowych mają
złożony charakter, można je jednakże przedstawić jako superpozycję pewnej liczby drgań
prostych, zgodnych w fazie i o jednakowej częstości. Drgania te nazywane są drganiami
normalnymi. Wyróżniamy wśród nich drgania rozciągające związane ze zmianą długości
wiązań i drgania deformacyjne wynikające ze zmiany kątów płaskich pomiędzy wiązaniami
podczas ruchu w płaszczyźnie lub poza płaszczyznę wiązań. Każdy z rodzajów drgań może
być dodatkowo symetryczny lub niesymetryczny.
H
2
O
symetryczne
rozciągające (ν
s
OH)
3652 cm
-1
asymetryczne
rozciągające (ν
as
OH)
3756 cm
-1
deformacyjne
nożycowe (δ
s
OH)
1596 cm
-1
Rys. 1. Drgania normalne izolowanej cząsteczki H
2
O.

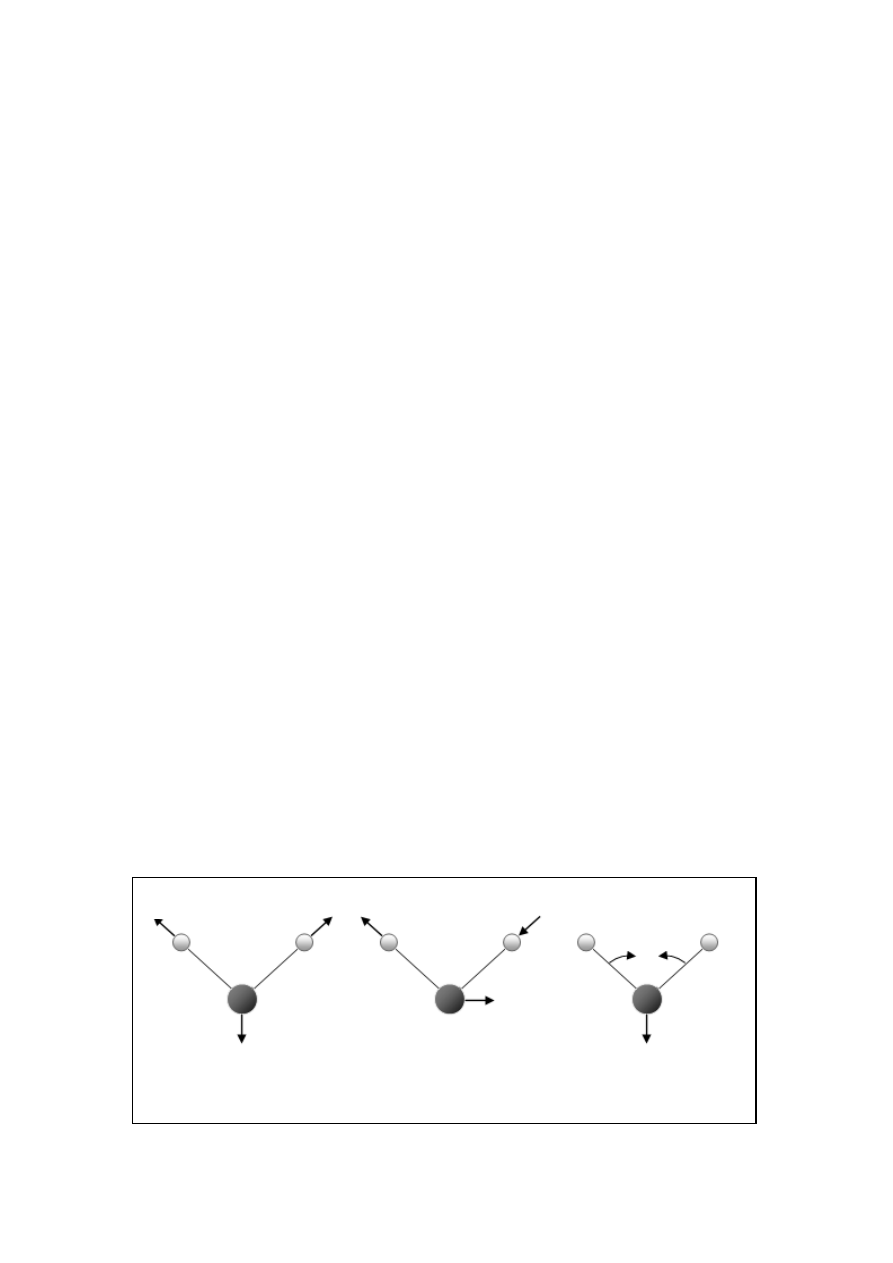
Liczba stopni swobody cząsteczki jest równa sumie stopni swobody tworzących ją
atomów. Każdy atom ma trzy stopnie swobody ruchu, odpowiadające współrzędnym
kartezjańskim. Zatem cząsteczka składająca się z n atomów ma 3n stopni swobody. W
przypadku cząsteczek nieliniowych trzy stopnie swobody dotyczą translacji, a trzy kolejne
ruchu obrotowego. Pozostałe 3n-6 stopnie swobody opisują ruchy oscylacyjne i
odpowiadające im drgania normalne. Cząsteczki liniowe mają tylko dwa rotacyjne stopnie
swobody, więc ich drganiom odpowiada 3n-5 drgań normalnych. Przykładem nieliniowej
drobiny jest cząsteczka wody, która składa się z trzech atomów, ma zatem 3·3 – 6 = 3 stopnie
swobody oscylacyjnej. Odpowiadające im trzy drgania normalne przedstawiono na Rys. 1.
Do przybliżonego opisu oddziaływania cząsteczki dwuatomowej z promieniowaniem
elektromagnetycznych wykorzystuje się model oscylatora harmonicznego. Oscylatorem
harmonicznym jest w tym przypadku układ dwóch mas (atomów lub rdzeni atomowych),
drgających doskonale sprężyście wokół środka masy układu. Częstość drgań własnych
takiego oscylatora (ν
osc
) wyraża się wzorem:
r
osc
m
f
π
ν
2
1
=
, (1)
gdzie f to stała siłowa, będąca miarą siły wiązania, natomiast m
r
oznacza masę zredukowaną,
równą iloczynowi mas obu atomów podzielonemu przez ich sumę.
Energia mikrooscylatora jest kwantowana i dla poszczególnych poziomów
energetycznych oscylacji wyraża się wzorem:
+
=
2
1
υ
ν
osc
osc
h
E
, (2)
gdzie υ – oscylacyjna liczba kwantowa, która może przyjąć wartości υ = 0, 1, 2, 3, …
Oddziaływanie promieniowania podczerwonego z oscylującymi cząsteczkami jest
możliwe tylko wtedy, gdy spełnione są pewne warunki nazywane regułami wyboru. Zgodnie
z pierwszą regułą, energia fotonu promieniowania elektromagnetycznego, która może zostać
pochłonięta przez cząsteczkę musi odpowiadać różnicy energii poziomów energetycznych
cząsteczki (dla spektroskopii oscylacyjnej ∆E
osc
= hν). W przypadku oscylatora
harmonicznego dozwolone są tylko przejścia absorpcyjne lub emisyjne, dla których
oscylacyjna liczba kwantowa zmienia się o ∆υ = ±1.
Przedstawiony model oscylatora harmonicznego wyjaśnia występowanie tak zwanych
pasm podstawowych, czyli intensywnych pasm absorpcyjnych w widmach cząsteczek
heteroatomowych, którym towarzyszy zmiana oscylacyjnej liczby kwantowej ∆υ = 1. W
widmach obserwowane są również pasma o niskiej intensywności i o częstościach zbliżonych
do wielokrotności częstości pasma podstawowego, są to tzw. nadtony. Ich występowanie
wyjaśnia model oscylatora anharmonicznego. Najważniejszą konsekwencją zastosowania
tego modelu jest rozszerzenie reguły wyboru dotyczącej zmiany liczby kwantowej oscylacji –
dozwolone stają się przejścia, dla których oscylacyjna liczba kwantowa zmienia się o kilka
jednostek (∆υ = ±1, ±2, ±3, …). Warunek ten stanowi drugą regułę wyboru obowiązującą w
spektroskopii w podczerwieni. Z trzeciej reguły wyboru wynika natomiast, że w podczerwieni
można obserwować tylko te przejścia oscylacyjne, którym towarzyszy zmiana momentu
dipolowego cząsteczki. Drgania te nazywa się drganiami aktywnymi w podczerwieni.
Rzadko obserwuje się teoretyczną liczbę drgań normalnych tonów podstawowych,
ponieważ nadtony i drgania złożone, czyli suma lub różnica kilku drgań, zwiększają liczbę
pasm, natomiast inne zjawiska zmniejszają ich liczbę. Gdy dwa oscylujące wiązania mają
wspólny atom, pomiędzy utworzonymi oscylatorami istnieje oddziaływanie mechaniczne i z
tego względu rzadko zachowują się jak odrębne oscylatory, chyba że częstości ich drgań są
bardzo różne. Sprzężenie dwóch drgań normalnych powoduje powstanie dwóch nowych
drgań o częstościach wyższej i niższej niż ta, gdy oddziaływania nie zachodzą (rezonans
Fermiego). Oddziaływania mogą pojawiać się również pomiędzy drganiami podstawowymi,
nadtonami i drganiami złożonymi.
W każdym drganiu normalnym biorą udział wszystkie atomy cząsteczek, ale amplitudy
ich wychyleń mogą być różne. W wielu drganiach biorą udział przede wszystkim najbliższe
atomy tworzące charakterystyczną grupę funkcyjną w cząsteczce, a pozostałe atomy mają tak
małą amplitudę wychyleń, że praktycznie nie wpływają na drgania. Z wymienionych powyżej
powodów wiele grup funkcyjnych wykonuje drgania o charakterystycznej częstości,
zmieniającej się niewiele w różnych cząsteczkach.
Kształt krzywej dzwonowej pasm absorpcyjnych jest charakterystyczną cechą
oddziaływania substancji z promieniowaniem. Poszerzenie pasma wynika z kilku przyczyn
naturalnych, takich jak zasada nieoznaczoności Heisenberga, efekt Dopplera. Pasma w
podczerwieni faz skondensowanych są poszerzone ze względu na zatartą strukturę rotacyjną
widma oscylacyjnego. Zdarza się również, że sąsiadujące ze sobą pasma w widmie nakrywają
się tworząc wspólny kontur.
Położenie maksimum pasm w widmie w podczerwieni jest najczęściej określane w skali
liczb falowych, czyli liczby drgań przypadających na 1 cm drogi promieniowania (
ν
=
1/λ,
cm
-1
), rzadziej przy pomocy długości fali (λ, nm) lub częstości promieniowania (ν, Hz).
Intensywność pasm jest natomiast wyrażona w skali transmitancji (T) lub absorbancji (A).
Transmitancja jest to stosunek natężenia światła przepuszczonego przez próbkę do natężenia
światła padającego na próbkę. Absorbancja jest logarytmem dziesiętnym odwrotności
transmitancji A = log
10
(1/T). Pod pojęciem natężenia pasm rozumiemy pole powierzchni
pomiędzy linią określającą kontur pasma a jego linią bazową. W niektórych przypadkach
miarą natężenia pasma może być jego wysokość mierzona w maksimum.
5.2. Aparatura pomiarowa
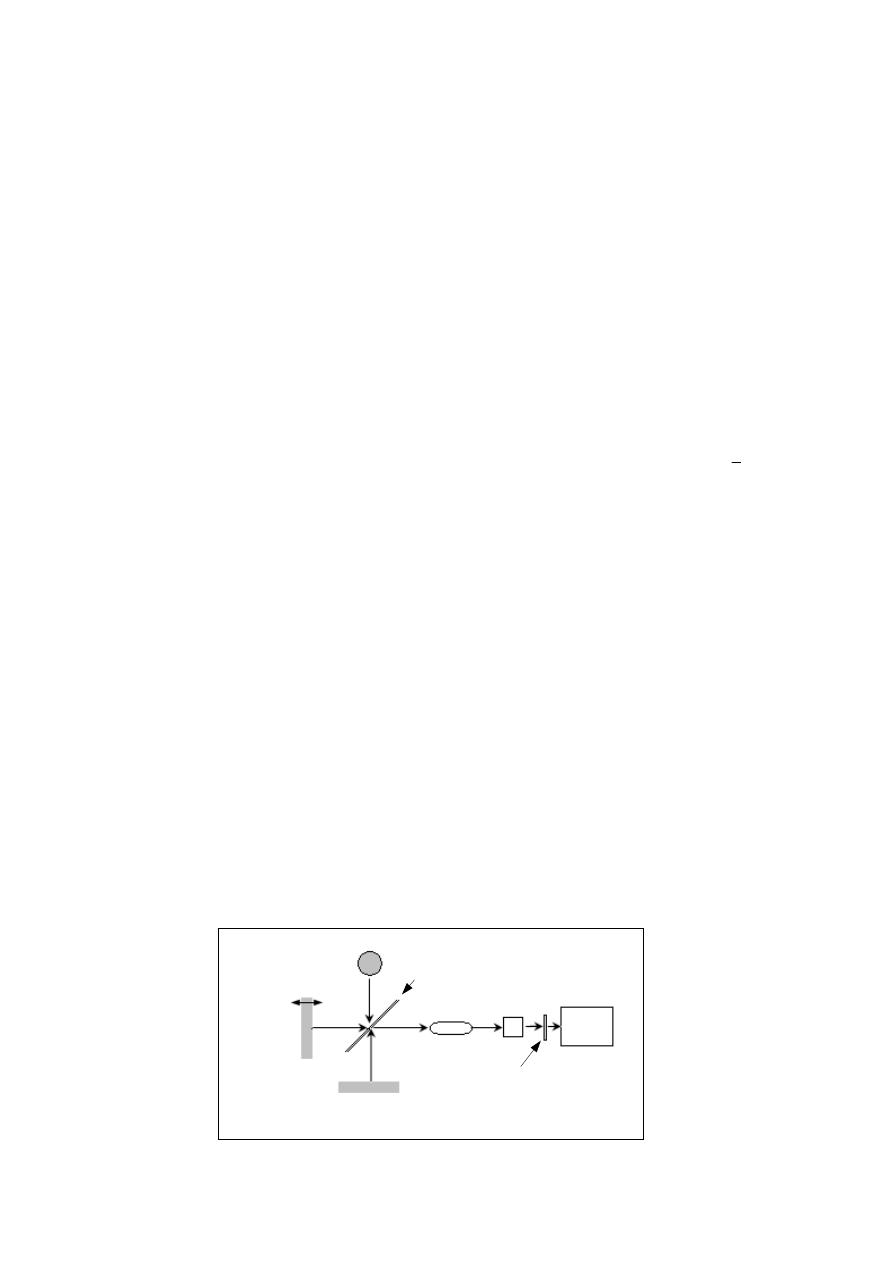
Współczesne spektrometry zamiast widm rejestrują bezpośrednio tzw. interferogramy.
Promieniowanie obejmujące określony zakres podczerwieni (np. 4000 – 400 cm
-1
)
rozdzielane jest na dwie wiązki (Rys. 2). Jedna z nich przebiega drogę o stałej długości, a
druga generowana jest przez interferometr z ruchomym zwierciadłem poruszającym się ze
stałą prędkością. Zmieniająca się różnica długości dróg obu wiązek powoduje wzajemne
interferencje i w wyniku tego powstaje interferogram. Zastosowanie transformacji Fouriera
pozwala na przekształcenie takiego interferogramu z domeny czasowej na bardziej użyteczną
domenę częstości, czyli widmo. Jedno przejście szerokopasmowego promieniowania przez
próbkę pozwala na rejestrację całkowitego widma w podczerwieni, co znacznie skraca czas
analizy. Zastąpienie tradycyjnych monochromatorów interferometrami znacznie polepszyło
także czułość i rozdzielczość przyrządów.
Przetwornik
Komputer
Detektor
Próbka
Dzielnik
wiązki
Zwierciadło
stałe
Zwierciadło
ruchome
Źródło
Rys. 2. Schemat spektrometru podczerwieni z transformacją Fouriera (FTIR).
5.3. Spektroskopia w podczerwieni w badaniach struktury i stabilności białek
Spektroskopia w podczerwieni jest jedną z najbardziej wszechstronnych technik
badawczych, pozwalających na obserwowanie struktury drugorzędowej białek oraz jej zmian
wywołanych różnymi czynnikami zewnętrznymi. Jej niewątpliwą zaletą jest możliwość
dostosowania warunków pomiarowych do konkretnego problemu. Dostępnych jest wiele
odmian tej techniki (np. tradycyjna spektroskopia transmisyjna, spektroskopia ATR lub
spektroskopia odbiciowa), umożliwiających pomiary roztworów białek o różnym stężeniu,
żeli, cienkich filmów lub stałych preparatów.
Popularnym problemem biochemicznym do którego wykorzystuje się spektroskopię
FTIR jest analiza struktury drugorzędowej białek. Rozwój tej techniki eksperymentalnej w
badaniach biochemicznych spowodowany jest wzrostem zainteresowania strukturą białek
oraz ograniczeniami bardziej bezpośrednich technik, takich jak NMR i krystalografia
rentgenowska. Wprawdzie za pomocą spektroskopii w podczerwieni nie można uzyskać
informacji o absolutnej strukturze białka, to jednak, w przeciwieństwie do wymienionych
wyżej technik, pozwala ona na analizę struktury białek trudno rozpuszczalnych, nie
tworzących kryształu lub białek o masach cząsteczkowych powyżej kilkudziesięciu kDa.
Spektroskopia w podczerwieni jest także wykorzystywana w badaniach nad stabilnością
białek, nad mechanizmem ich denaturacji oraz do badania molekularnych podstaw ich
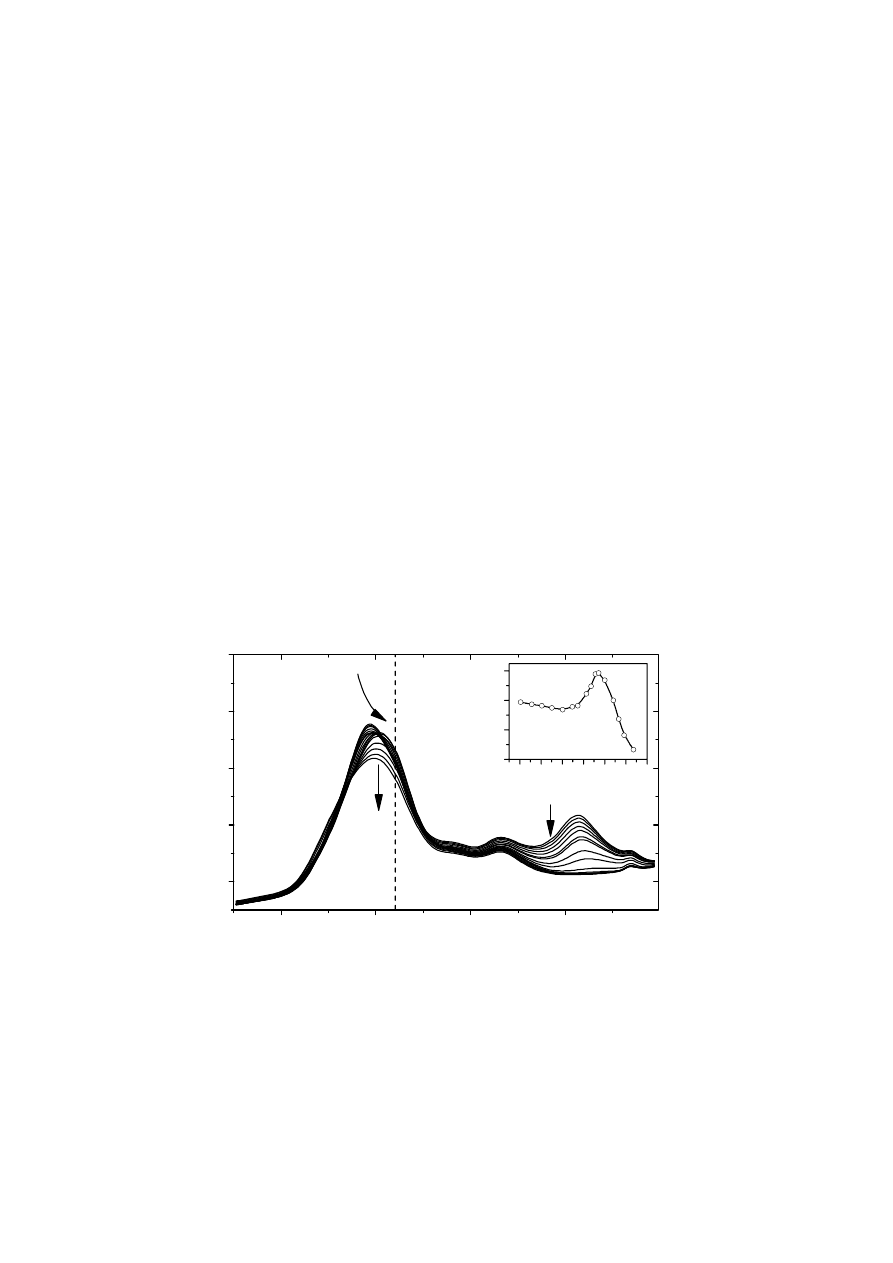
funkcjonowania. Na Rys. 3 przedstawiono przykładową serię widm FTIR lizozymu z białka
jaja kurzego zmierzonych w różnych temperaturach (rozpuszczalnikiem była woda ciężka).
Zmiany w kształcie pasm można powiązać ze zmianami w strukturze drugorzędowej białka,
pojawiającymi się wraz ze wzrostem temperatury. Na podstawie zależności wartości
absorbancji przy liczbie falowej 1640 cm
-1
od temperatury możliwe jest wykreślenie krzywej
denaturacji (we wstawce), która może posłużyć do określenie temperatury denaturacji lub
pomóc w określeniu mechanizmu denaturacji białka.
1700
1650
1600
1550
0.5
1.0
1.5
2.0
2.5
30 40 50 60 70 80 90
1.4
1.5
1.6
1.7
pasmo amidowe II
Ab
sor
bancj
a
Liczba falowa (cm
-1
)
1.
2.
pasmo amidowe I'
A
bs
. @
1640 c
m
-1
Temperatura (
o
C)
Rys. 3. Seria widm lizozymu z białka jaja kurzego zmierzonych w zakresie
temperatur 30,4
o
C – 83,5
o
C. Strzałkami oznaczono kierunek najważniejszych
zmian w natężeniu i położeniu pasm amidowych I’ oraz II, towarzyszących
wzrostowi temperatury. Widma zmierzono w kuwecie transmisyjnej wyposażonej
w okienka z CaF
2
rozdzielone przekładkami teflonowymi o grubości 56 µm.
Temperatura była regulowana za pomocą zewnętrznego kontrolera. We wstawce
przedstawiono krzywą denaturacji, wyznaczoną dla liczby falowej 1640 cm
-1
.
Wykorzystanie spektroskopii różnicowej lub czasowo rozdzielczej spektrofotometrii
(ang. time-resolved) z wykorzystaniem techniki zatrzymanego przepływu pozwala
przykładowo na obserwowanie zmian w centrum katalitycznym enzymu. Często
wykorzystuje się w tym zakresie technikę znakowania białek ciężkimi izotopami (
15
N) lub
mutagenezę ukierunkowaną. Pozwala to na precyzyjne przypisanie określonych pasm
widocznych w widmie białka konkretnym resztom aminokwasowym.
5.3.1. Określanie struktury drugorzędowej białek
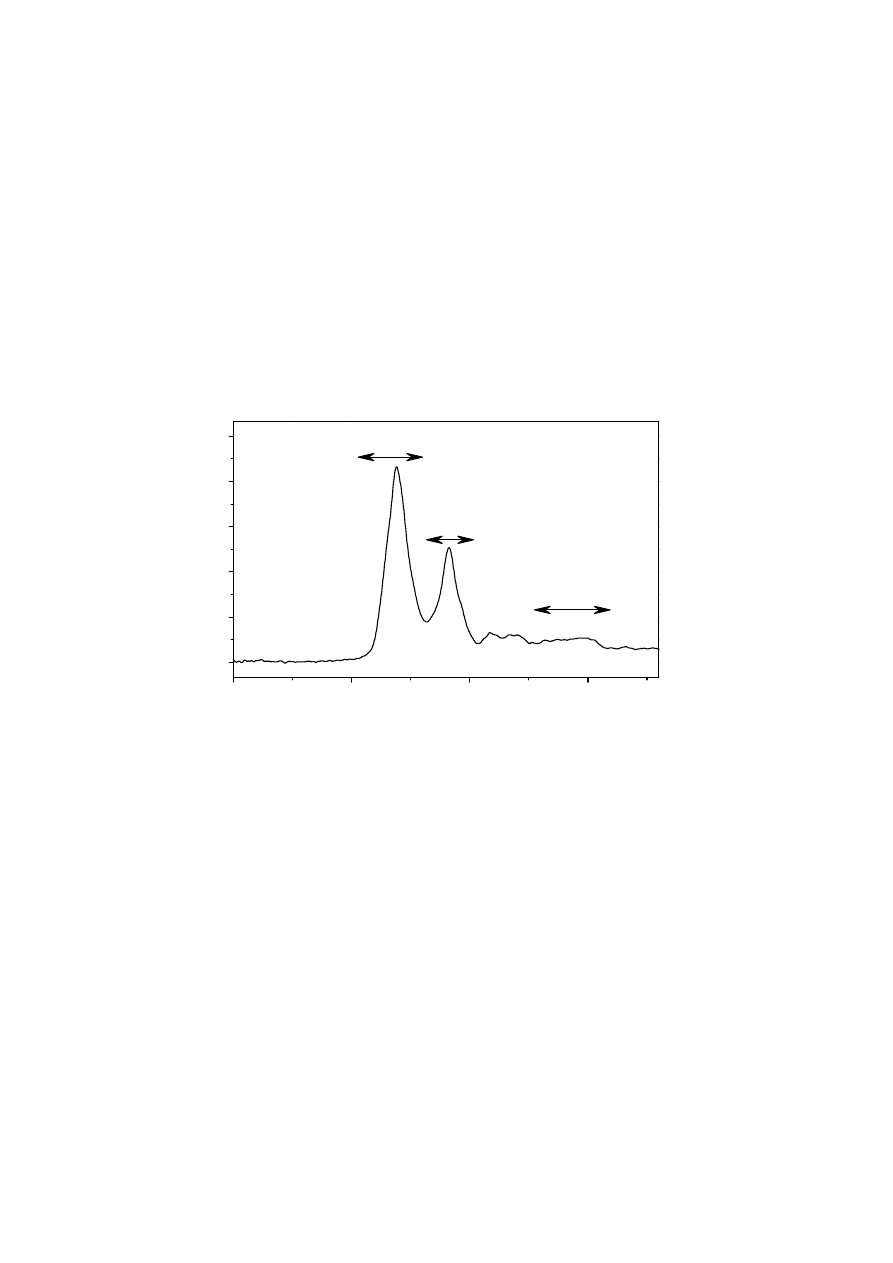
Białka posiadają dziewięć charakterystycznych pasm, z których największe znaczenie w
analizie struktury drugorzędowej mają przedstawione na Rys.4: pasmo amidowe I
(odpowiadające głównie drganiom rozciągającym wiązania C=O, ok. 1700-1600 cm
-1
), pasmo
amidowe II (odpowiadające sprzężonym drganiom zginającym wiązania N-H i rozciągającym
wiązania C-N, ok. 1600-1500 cm
-1
) oraz w mniejszym stopniu pasmo amidowe III
(odpowiadające głównie drganiom rozciągającym wiązania C-N i drganiom zginającym
wiązania N-H, ok. 1340 - 1200 cm
-1
).
2000
1750
1500
1250
0.00
0.03
0.06
0.09
0.12
0.15
Ab
so
rb
an
cj
a
Liczba falowa (cm
-1
)
pasmo amidowe III
pasmo amidowe II
pasmo amidowe I
Rys. 4. Charakterystyczne widmo czystego białka (lizozym z białka jaja kurzego)
rozpuszczonego w wodzie wraz z zaznaczonymi najważniejszymi pasmami
amidowymi, służącymi do analizy zmian w jego strukturze. Widmo jest wynikiem
odjęcia zmierzonego widma ATR czystej wody od widma ATR roztworu białka.
Wskaźnikiem prawidłowego odjęcia widm było uzyskanie płaskiego przebiegu
linii bazowej widma wynikowego powyżej 1800 cm
-1
.
Ograniczenia steryczne, hydrofobowy/hydrofilowy charakter reszt bocznych
aminokwasów jak i samego szkieletu polipeptydowego, a także otaczający białko
rozpuszczalnik powodują, że białka przyjmują w roztworach wodnych ściśle określone
konformacje geometryczne, zwane strukturami drugorzędowymi. Istotnym elementem każdej
z nich jest charakterystyczna sieć wiązań wodorowych między atomami tlenu karbonylowego
łańcucha polipeptydowego a atomem wodoru grupy aminowej, które spinają fragmenty
łańcucha polipeptydowego, często znacznie oddalone od siebie. Każda ze struktur
drugorzędowych białek posiada charakterystyczną geometrię sieci wiązań wodorowych, a co
za tym idzie, także charakterystyczne zakresy częstości drgań wiązań zaangażowanych w ich
tworzenie. Na Rys. 5 przedstawiono zakresy częstości drgań wiązań w zakresie pasma
amidowego I, najczęściej wykorzystywanego do określania zawartości poszczególnych
struktur drugorzędowych, przypisane poszczególnym strukturom drugorzędowym. Wartości
te opierają się głównie na danych eksperymentalnych oraz obliczeniach teoretycznych.
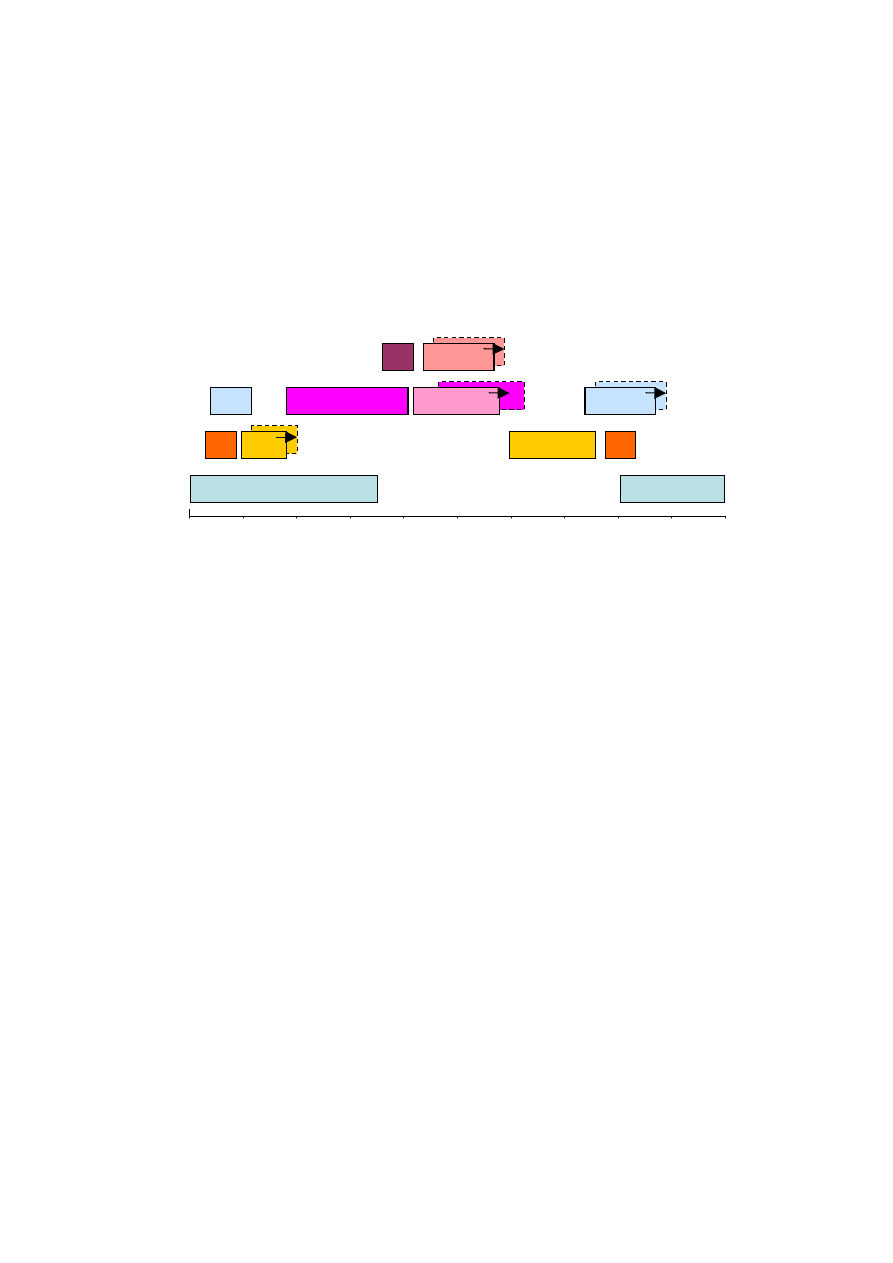
Granice różnych zakresów są często dosyć szerokie, dlatego należy ostrożnie analizować
uzyskane wyniki.
W strukturze przestrzennej białek można najczęściej wyróżnić wiele różnych struktur
drugorzędowych, dlatego też ich widma w podczerwieni mają złożony charakter. Pasma
amidowe składają się w wielu różnych, zachodzących na siebie pasm składowych,
charakterystycznych dla poszczególnych struktur. Znacząco komplikuje to analizę widm.
Jednak stosując techniki zwiększania rozdzielczości widm można jednak uzyskać informacje
o ich położeniu i natężeniu, a czasem także o ich procentowym udziale w stosunku do
wszystkich struktur drugorzędowych danego białka.
1600
1610
1620
1630
1640
1650
1660
1670
1680
1690
1700
1
2
3
4
5
6
7
8
9
10
11
10
α-helisa
Pętle
Agr
Agregat
βs
βs
β-kartki
β
Zakręty i pętle
Reszty AA
Reszty AA
Liczba falowa / cm
-1
Rys. 5. Zakresy absorpcji poszczególnych struktur drugorzędowych
występujących powszechnie w białkach. Skróty i objaśnienia: β – β-kartki, βs – β-
spinki (β-kartki zbudowane tylko z dwóch łańcuchów), reszty AA – grupy boczne
reszt aminokwasowych, Agr. – agregaty, 3
10
– helisa 3
10
, Pętle – rozumiane jako
długie pętle, lub struktura nieuporządkowanego polipeptydu (charakterystyczna
dla białek zdenaturowanych); struktury, których pasma absorpcji przesuwają się
pod wpływem wymiany protonowej oznaczone zostały strzałką, prostokątami
przerywanymi oznaczono zakresy absorpcji tych struktur w wodzie ciężkiej.
5.3.2. Izolacja i analiza widm biocząseczek w roztworach wodnych
Widma biocząsteczek najczęściej mierzone są w roztworach wodnych i rzadko możliwa
jest bezpośrednia analiza charakterystycznych pasm absorpcji. Ogólny schemat postępowania
w takich sytuacjach przedstawia się następująco:
a. Usunięcie udziału widmowego pary wodnej
Pierwszym problemem we wstępnej obróbce danych widmowych jest usunięcie pasm
absorpcji pary wodnej w zakresie pasma amidowego I i II. W dużym stopniu problem ten jest
zmniejszany przez intensywne płukanie aparatu suchym azotem lub osuszonym powietrzem.
Jednak nie zawsze jest to wystarczające rozwiązanie. Korekcja atmosfery opiera się
najczęściej na takim dobraniu współczynnika odejmowania zmierzonego widma pary wodnej,
aby uzyskać widmo w najwyższym stopniu pozbawione udziału tej pary. Procedura odbywa
się metodą "prób i błędów", a kryterium jest ocena wizualna widma.
b. Odejmowanie udziału widmowego wody
Największym problemem w przygotowaniu widm do dalszej obróbki jest prawidłowe
odjęcie widma wody (lub buforu), ponieważ nawet w bardzo stężonych próbkach natężenie
pasma wody w zakresie amidu I jest od 5 do 10 razy większe, niż samego pasma amidowego
I. Powszechnie stosowanym sposobem odejmowania widma wody od zmierzonego widma
roztworu białka (zarówno uzyskanego metodą transmisyjną jak i ATR) jest wizualne odjęcie
wcześniej zmierzonego widma wody aż do uzyskania na widmie wynikowym płaskiej linii w
okolicy 2000 – 1800 cm
-1
.
Alternatywnym rozpuszczalnikiem białek może być woda ciężka, D
2
O. Jej zaletą jest to,
iż nie posiada silnych pasm absorpcji w zakresie pasma amidowego I. Zastąpienie atomów
wodoru deuterem nie powoduje drastycznych zmian w kształcie pasma amidowego I’ (znak
prim oznacza, że widmo zostało zmierzone w wodzie ciężkiej), zmiany te jednak pozwalają
na rozróżnienie pasm absorpcji struktur α od struktur pętlowych, co w wodzie zwykłej (H
2
O)
nie byłoby łatwe. Niewielkiemu przesunięciu w stronę niższych liczb falowych ulegają też
wartości absorpcji pozostałych struktur drugorzędowych (Rys. 5). Drastycznej zmianie ulega
natomiast położenie pasma amidowego II. Wymiana protonowa powoduje przesunięcie
maksimum tego pasma od ok. 1550 cm
-1
do ok. 1450 cm
-1
(to nowe pasmo nazywane jest
pasmem amidowym II’). Tak duża zmiana jest podstawą dla eksperymentów mających na
celu np. określenie stabilności hydrofobowego rdzenia białek.
c. Zwiększanie rozdzielczości widm - uzyskiwanie informacji o pasmach składowych
Stosuje się powszechnie kilka technik pozwalających określić liczbę i położenie pasm
składowych, które można następnie przypisać konkretnym strukturom drugorzędowym.
Wszystkie te techniki mają jednak poważną wadę – uzyskane wyniki są w dużym stopniu
zależne od subiektywnych decyzji dokonywanych na kolejnych etapach obróbki widm i
powinny być stosowane z ostrożnością.
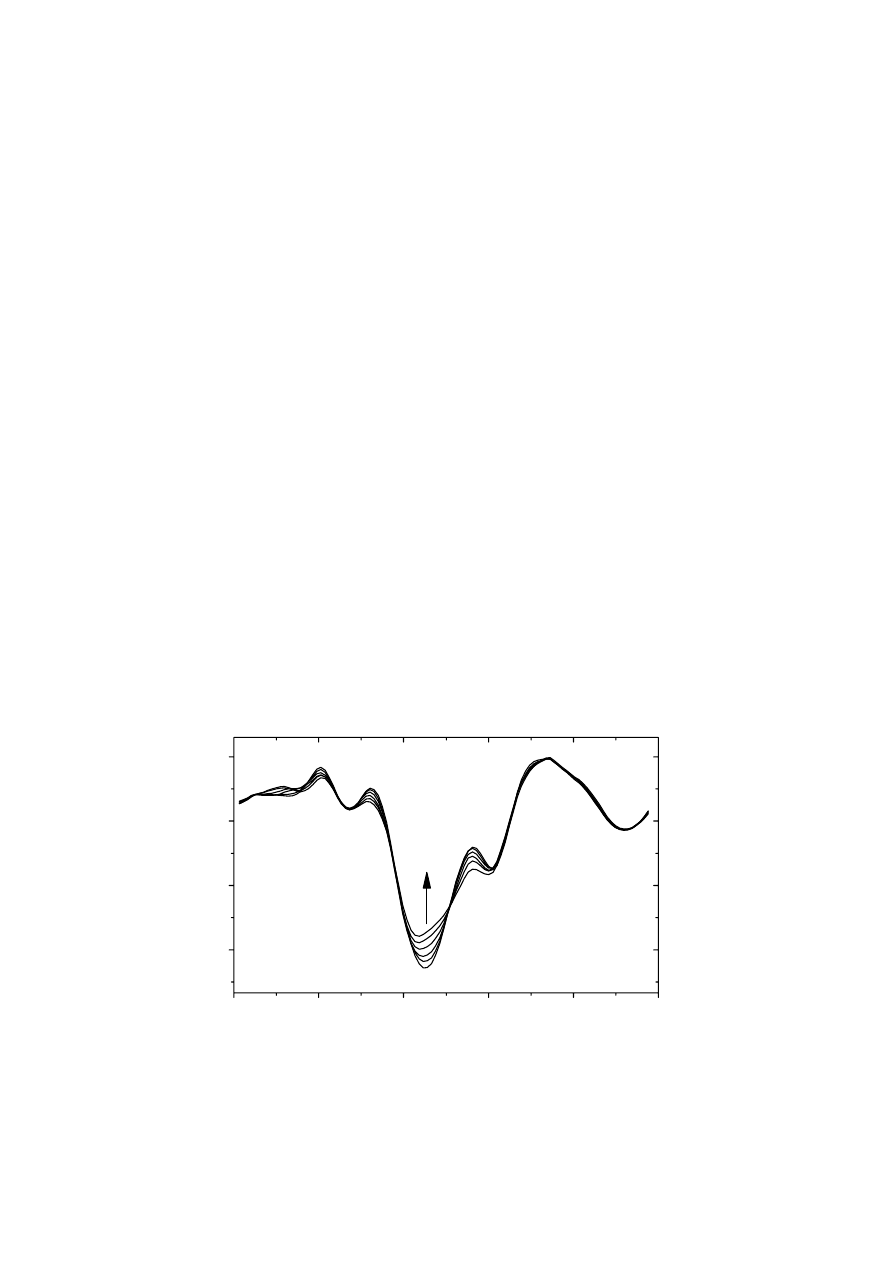
i) Druga pochodna widm. Minima na drugiej pochodnej widm biocząsteczek określają
w przybliżeniu liczbę i położenie pasm składowych. Kształt drugiej pochodnej, w
szczególności informacja o liczbie pasm składowych, zależy od jakości danych pierwotnych.
Druga pochodna widm jest bardzo wrażliwa na wszelkie zakłócenia (np. szumy aparaturowe,
nieskorygowane pasma absorpcji pary wodnej, itp), dlatego należy ostrożnie analizować jej
kształt. Na Rys. 6 przedstawiono serię drugich pochodnych widm lizozymu z białka jaja
kurzego zmierzonych w zakresie temperatury 35
o
C – 56
o
C. Minima drugich pochodnych
wskazują prawdopodobne położenie pasm składowych, które można przypisać
poszczególnym strukturom drugorzędowym.
1700
1680
1660
1640
1620
1600
-0.006
-0.003
0.000
0.003
D
ru
ga
pochodna
Liczba falowa (cm
-1
)
β
α
+pętle
zakręty
Rys. 6. Seria drugich pochodnych widm lizozymu z białka jaja kurzego,
zmierzonych w zakresie temperatury 35
o
C – 56
o
C. Strzałką oznaczono kierunek
zmian towarzyszących wzrostowi temperatury. Oznaczono także najważniejsze
struktury drugorzędowe: α – α - helisy, β – β - kartki.
ii) Rozkład pasma na składowe. Kształt złożonego pasma na widmie w podczerwieni
przybliża się sumą sztucznie wygenerowanych pasm składowych, będących najczęściej
funkcjami Gaussa i Lorentza, ich sumą lub iloczynem.
1700
1680
1660
1640
1620
1600
0.00
0.02
0.04
0.06
0.08
0.10
0.12
0.14
1686
3%
1657
25%
1673
11%
1644
13%
1633
46%
Ab
so
rb
an
cja
Liczba falowa (cm
-1
)
1612
2%
Rys. 7. Przykład rozkładu pasma amidowego I białka bogatego w β-kartki
(świadczy o tym silne pasmo przy 1633 cm
-1
). Każdemu pasmu składowemu
przypisano maksimum oraz procentowy udział zajmowanej powierzchni całego
pasma.
iii) Dekonwolucja z wykorzystaniem odwrotnej transformacji Fourier’a. Metoda ta
służy przede wszystkim do zwiększenia rozdzielczości widma, a nie do samego określania
liczby i położenia składowych, chociaż i w takim celu może być wykorzystana.
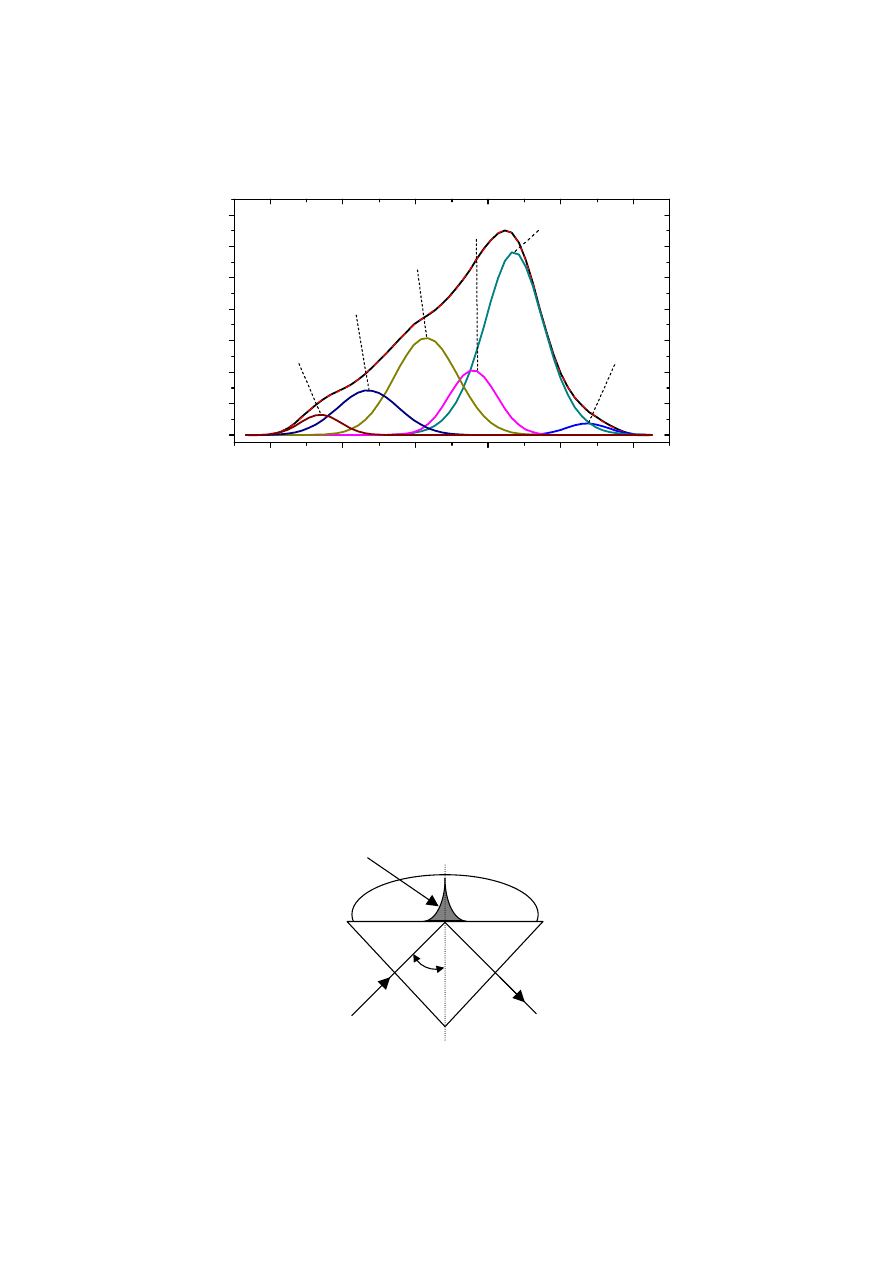
5.3.3. Technika tłumionego całkowitego odbicia
Technika tłumionego całkowitego odbicia (ang. Attenuated Total Reflectance – ATR)
jest obecnie coraz szerzej stosowaną odmianą spektroskopii odbiciowej, posiadającą wiele
wspomnianych wcześniej zalet w stosunku do tradycyjnej techniki transmisyjnej pomiaru
widm.
fala zanikająca
promień
odbity
promień
padający
próbka
kryształ
ATR
θ
Rys. 8. Przebieg promieni w krysztale ATR.
Promień padający pod kątem θ, większym od kąta granicznego, na powierzchnię
kryształu ATR ulega całkowitemu odbiciu (Rys. 8). Materiały z którego wykonane są
kryształy ATR charakteryzują się wysokim współczynnikiem załamania światła i są
wykonane najczęściej z germanu, selnku cynku lub diamentu. Jeśli do powierzchni kryształu

zostanie przyłożona próbka materiału absorbującego promieniowanie, to wiązka
promieniowania wnika w głąb próbki (fala zanikająca) na bardzo małą głębokość, zależną od
kąta padania wiązki i współczynników załamania światła kryształu ATR i samej próbki.
Część promieniowania może zostać zaabsorbowana przez próbkę, a mierząc intensywność
promieniowania wiązki odbitej od powierzchni kryształu można uzyskać widmo
charakterystyczne dla materiału próbki, tzw. widmo ATR.
Widma ATR są złożeniem widma refleksyjnego (odbiciowego) oraz absorpcyjnego.
Korekcja ATR umożliwia wyodrębnienie części absorpcyjnej widma ATR. Korygowane są
także efekty widmowe związane z niektórymi zjawiskami optycznymi, jak normalna lub
anomalna dyspersja optyczna. W ich wyniku fale o różnych częstotliwościach penetrują
warstwy próbki o różnej grubości, a co za tym idzie, są różnie przez nią absorbowane.
Zjawisko to jest silnie zależne od współczynnika załamania światła próbki, dlatego też nie
można dokonywać operacji odejmowania lub dodawania widm ATR próbek o różnych
współczynnikach załamania światła.
W spektroskopii biocząsteczek najważniejszą zaletą techniki tłumionego wewnętrznego
odbicia jest możliwość uzyskania widm roztworów, których składniki (przede wszystkim
woda) posiadają bardzo silne pasma własne, uniemożliwiające uzyskanie widma samego
białka metodą transmisyjną. Wadą tej techniki jest jednak konieczność stosowania dość
wysokich stężeń biocząsteczek oraz konieczność korekcji tych widm, jeżeli mają one zostać
poddane dalszej analizie.
5.4. Eksperymenty
Cel ćwiczenia
Celem ćwiczenia jest obserwacja zmian zachodzących w strukturze drugorzędowej
lizozymu z białka jaja kurzego, spowodowanych obecnością w roztworze substancji
denaturującej: soli metalu ciężkiego lub kwasu nieorganicznego.
Przebieg ćwiczenia
Przygotowanie roztworów
Roztwory substancji denaturującej
1. Za pomocą biurety przygotować 12 roztworów substancji denaturującej o
wzrastającym stężeniu. Rodzaj substancji oraz jej stężenia wskazuje osoba prowadząca
zajęcia. Wszystkie rzeczywiste objętości roztworów wyjściowych oraz końcowych
zapisać w tabeli wyników.
Roztwory lizozymu
1. Do ponumerowanych probówek 1,5 ml odważyć na wadze analitycznej po ok. 50 mg
wcześniej oczyszczonego i liofilizowanego białka. Masę białka w każdej z probówek
zapisać w tabeli.
2. Do kolejnych probówek dodać odpowiedni roztwór denaturanta tak, aby końcowe
stężenie białka wynosiło 100 – 150 mg/ml roztworu denaturanta (dokładne stężenie
końcowe białka podaje osoba prowadząca). Wszystkie objętości zapisać w tabeli
wyników.
3. Każdą próbkę zworteksować i odwirować przez ok. 30 sekund przy 6 tys.
obrotów/min.
4. Próbki pozostawić na 30 minut w temperaturze pokojowej.

5. Po tym czasie rozpocząć pomiary spektroskopowe oraz równolegle zmierzyć
współczynnik załamania światła wszystkich próbek i roztworów substancji
denaturującej, n
D
25
. Wszelkie zmiany w wyglądzie próbek zanotować w tabeli
wyników.
Wykonanie pomiarów
1. Na godzinę przed planowanym rozpoczęciem pomiarów spektroskopowych rozpocząć
płukanie aparatu suchym azotem.
2. Uruchomić program OMNIC i w zakładce „Parametry pomiaru” ustalić następujące
parametry: liczba skanów – 128, rozdzielczość widm – 4 cm
-1
, zakres liczb falowych –
4500 – 500 cm
-1
.
3. Rozpocząć pomiary od pomiaru widma tła klikając przycisk „Pomiar tła”. Widmo tła
należy mierzyć przed każdą próbką, chyba że prowadzący wskaże inaczej.
4. Pomiary próbek rozpocząć od próbki o najniższym stężeniu substancji denaturującej.
Próbki nanosić na kryształ przystawki ATR i rozpocząć pomiar poprzez kliknięcie
przycisku „Pomiar próbki”. Zacząć od serii roztworów substancji denaturującej, a
następnie zmierzyć serię roztworów lizozymu.
5. Po każdym pomiarze próbki kryształ przetrzeć 10% roztworem SDS i wodą.
6. Po zakończeniu wszystkich pomiarów zmierzyć widmo atmosfery i zapisać wszystkie
widma w formacie *.SPA.
Opracowanie wyników
1. Skorygować wszystkie widma próbek ze względu na obecność atmosfery.
2. Na każdym widmie dokonać korekcji ATR, uwzględniając zmierzony współczynnik
załamania światła, n
D
25
.
3. Odjąć od każdego widma widmo czystego rozpuszczalnika.
4. Uzyskane wyizolowane widma białka sprowadzić do wspólnej linii bazowej oraz
wyznaczyć ich drugie pochodne w zakresie pasma amidowego I. Wszystkie widma i
ich drugie pochodne zapisać w postaci plików *.CSV.
5. Uzupełnić wszystkie dane w tabeli wyników.
6. Wszystkie widma (w zakresie 1800 – 1500 cm
-1
) przedstawić na zbiorczym wykresie
oraz omówić zmiany w kształcie widm lizozymu, towarzyszące zwiększającemu się
stężeniu substancji denaturującej.
7. Na podstawie drugich pochodnych widm dla roztworów o skrajnych stężeniach
substancji denaturującej określić precyzyjnie które struktury drugorzędowe są
najbardziej wrażliwe na obecność substancji denaturującej.
8. Dla wskazanej przez osobę prowadzącą liczby falowej wykonać wykres natężenia
pasma od stężenia substancji denaturującej oraz omówić uzyskaną zależność.
Wielkości niezbędne do wyznaczenia danych w tabeli wyników
Stężenie roztworu wyjściowego denaturanta, C
r.wyj.
mol·dm
-3
Objętość końcowa przygotowywanych roztworów denaturanta, V
k.r.den.
ml
Cząstkowa objętość właściwa lizozymu, υ 0,703
cm
3
·g
-1
Masa molowa lizozymu z białka jaja kurzego
g·mol
-1
Końcowe stężenie białka w roztworze denaturanta
mg·(ml roztw. denaturanta)
-1
Końcowe stężenie białka w roztworze denaturanta
mol·dm
-3

Tabela wyników
Roztwory
substancji
denaturującej Roztwory
lizozymu
Nr V
r.wyj
V
wody
C
den.
n
D
25
r. den.
m
białka
V
r.den.
C
k.den.
n
D
25
r. białka
Uwagi
[ml] [ml] [mol·dm
-3
]
[mg] [
µl]
[mol·dm
-3
]
0
1
2
…
12
V
r.wyj
– objętość roztworu wyjściowego substancji denaturującej
V
wody
– objętość wody
C
den.
– stężenie substancji denaturującej w przygotowanych roztworach
n
D
25
r. den.
– współczynnik załamania światła roztworów substancji denaturującej
m
białka
– masa białka odważona do probówki 1,5 ml
V
r.den.
– objętość roztworu substancji denaturującej konieczna do uzyskania założonego stężenia
końcowego białka
C
k.den.
– stężenie końcowe substancji denaturującej w roztworze białka
n
D
25
r. białka
– współczynnik załamania światła roztworów białka
Document Outline
Wyszukiwarka
Podobne podstrony:
Cwicz 05
CWICZ 05
ch ćwicz 05
Ćwicz 05 Log. obsluga klienta, T: Ocena operatorów logistycznych - poziom logistycznej obsługi klien
CWICZ 05 01
CWICZ 05 08
CWICZ 05 09
CWICZ 05 06
CWICZ 05 10
CWICZ 05 07
Przechowalnictwo ćwicz 05 11 2005
RO GERBERY wykł, ćwicz 05 11 2005
CWICZ 05 04
CWICZ 05 02
CWICZ 05 03
MO C10 cwicz 05 (2)
05 metoda dobrego startu cwicz Nieznany
Laboratorium elektroniki - Ćwiczenie 05, Politechnika Lubelska, Studia, sem III, materiały, Teoria O
więcej podobnych podstron