
1
Chemia Organiczna
Wykład 12

2
Wiązania pomiędzy pierwiastkami w związkach
organicznych
W związkach organicznych atomy węgla mogą tworzyć
cztery wiązania
(mogą to być wiązania pojedyncze, podwójne lub potrójne)
Również łącząc się same ze sobą atomy węgla mogą tworzyć
wiązania:
pojedyncze
podwójne
potrójne
C C
C
C
C C
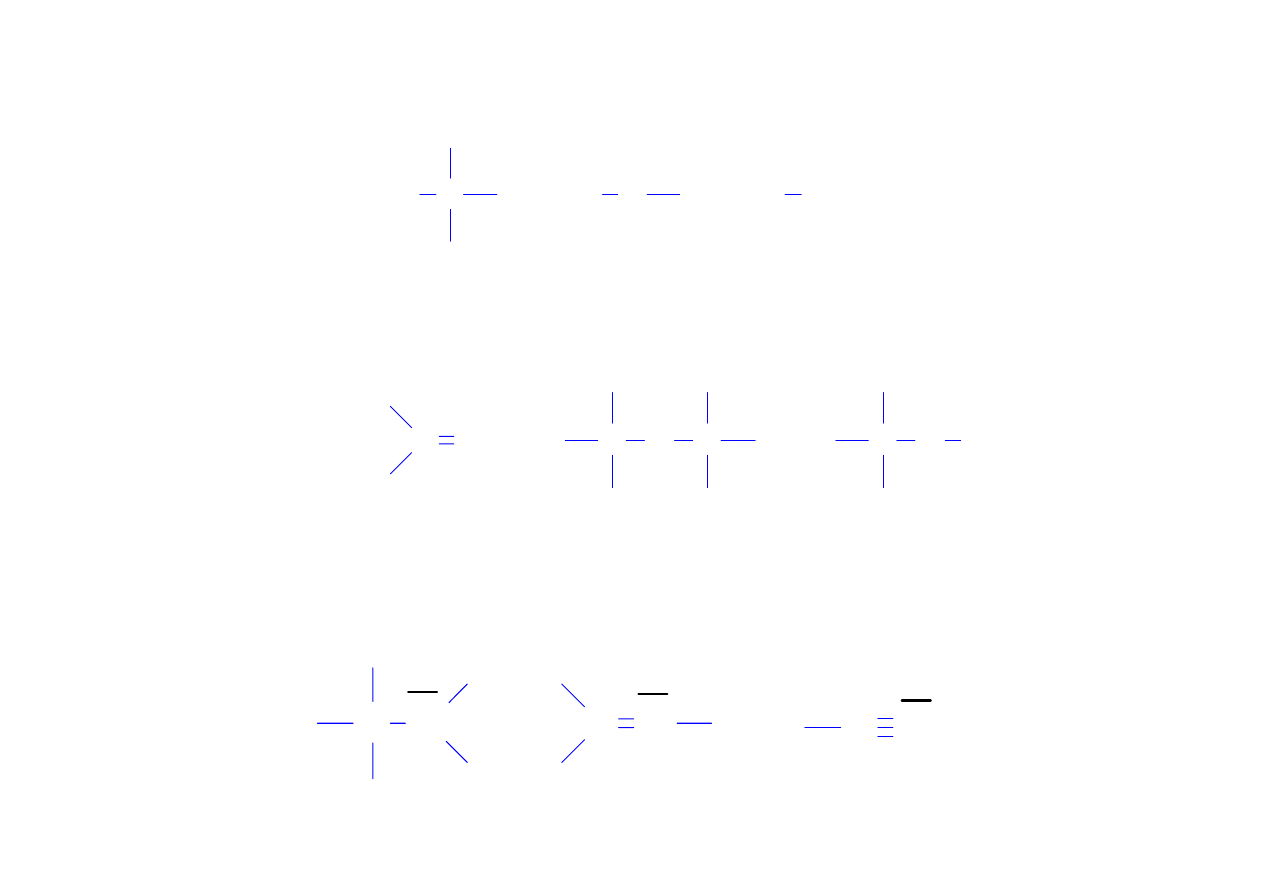
3
Atomy wodoru tworzą tylko jedno wiązanie
H O
H Cl
C
H
Atomy tlenu tworzą dwa wiązania
(mogą to być dwa wiązania pojedyncze, lub jedno wiązanie
podwójne).
C O
C O C
C O H
Atomy azotu w związkach organicznych tworzą najczęściej
trzy wiązania, z wolną parą elektronową na atomie azotu.
C N
C N
C N
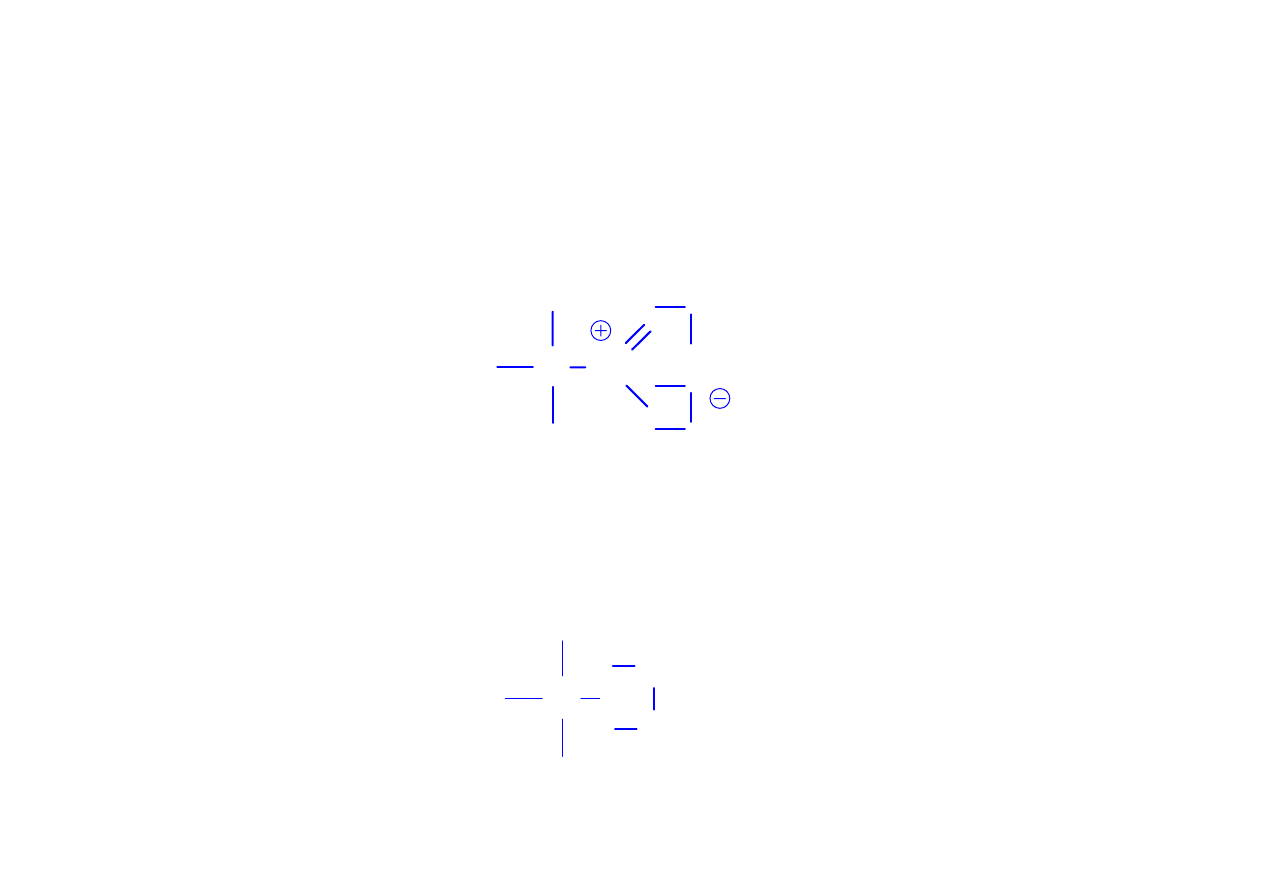
4
Możliwe są jednak również przypadki, kiedy atom azotu
tworzy więcej niż trzy wiązania, wykorzystując swoją wolną
parę elektronową
np. w niektórych związkach zawierających tlen.
C N
O
O
Atomy F, Cl, Br, I tak jak wodór tworzą w
związkach organicznych wiązania pojedyncze
C Cl
5
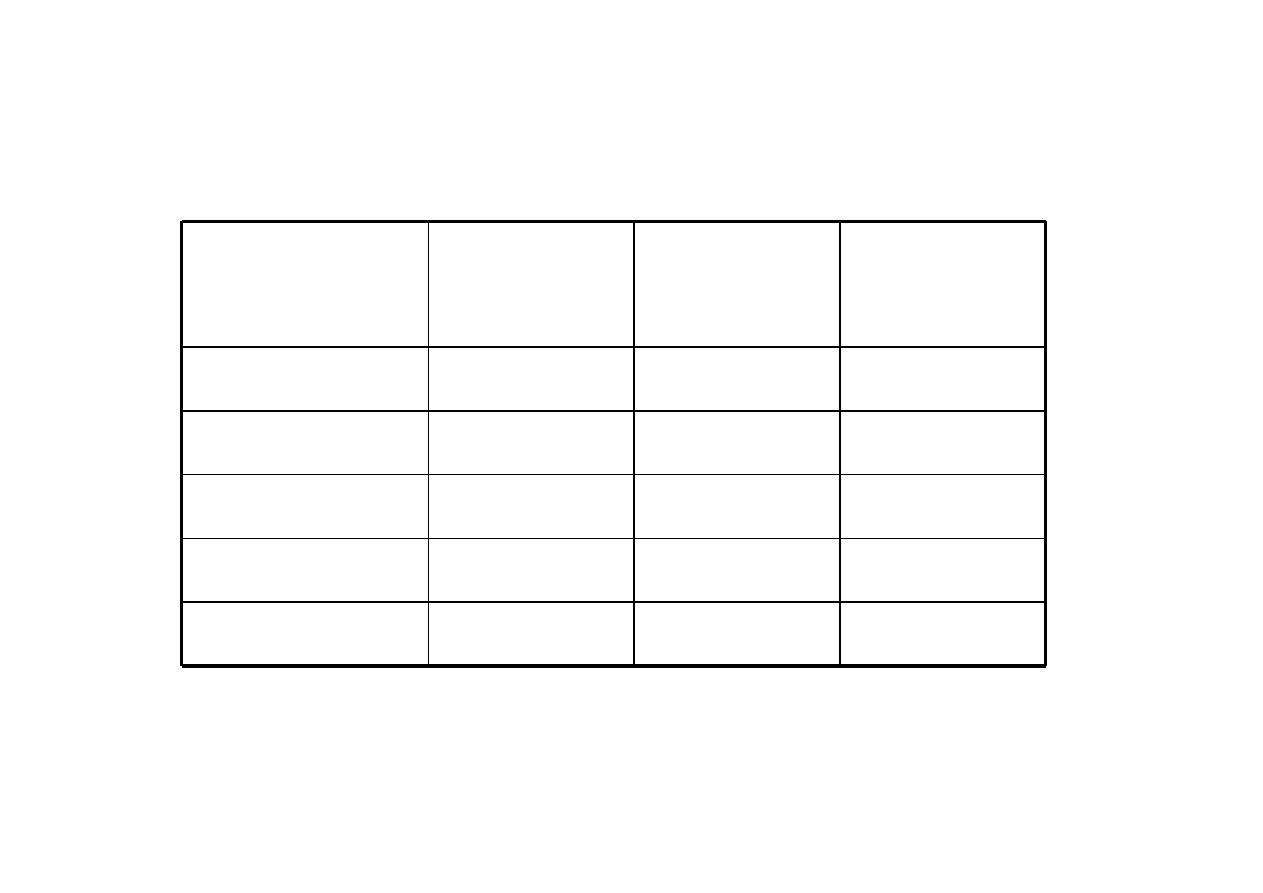
Elektrony walencyjne, wiązania i wolne pary elektronowe.
Wolna para elektronowa
– para elektronów nie tworzących wiązania
ATOM
elektrony
walencyjne
ilość wiązań
Ilość wolnych
par
elektronowych
H
1
1
0
C
4
4
0
N
5
3
1
O
6
2
2
F
7
1
3
C,N,O,F – 2 okres , atomy dążą do uzyskania oktetu
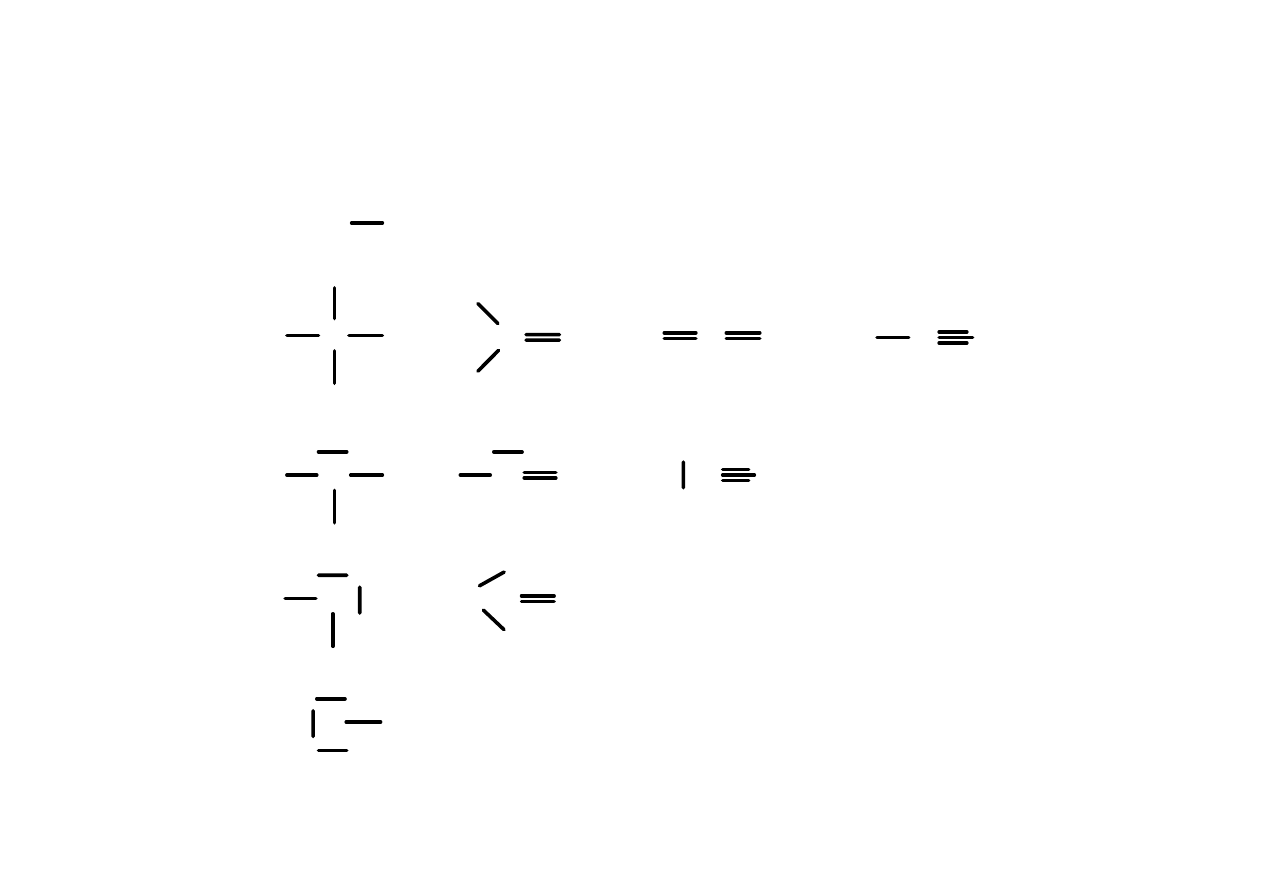
6
Wiązania kowalencyjne
H
C
C
C
C
N
N
N
O
O
F
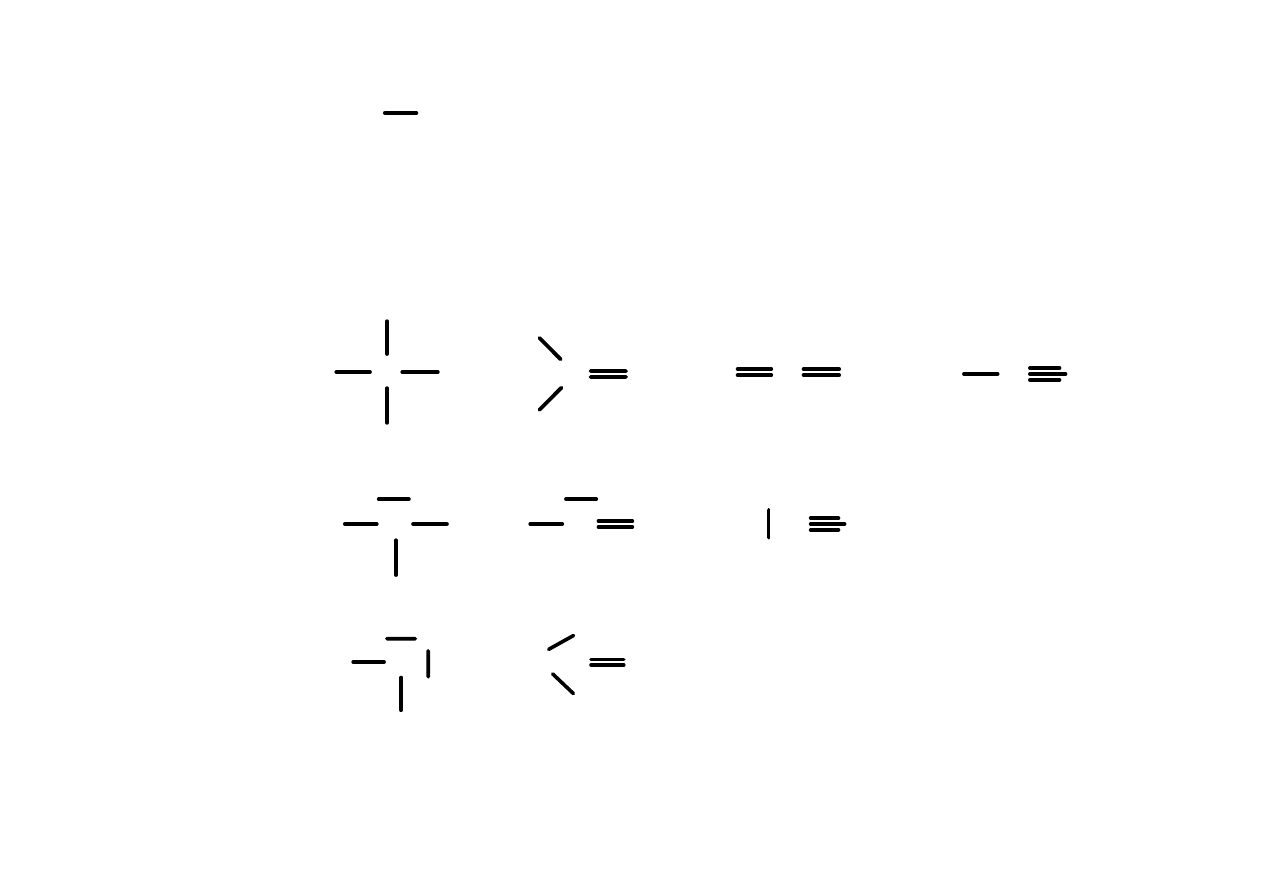
7
H
orbital atomowy s
C
C
C
C
hybrydyzacja:
sp
3
sp
2
sp
sp
N
N
N
O
O
8
C
N
CH
2
CH C CH CH
2
NH
2
C
O
O H
sp
sp
sp
3
sp
2
sp
sp
2
sp
3
sp
3
sp
2
sp
2
sp
3

9
Siła (energia, moc) i długości wiązań między atomami węgla
Długość wiązań między atomami węgla jest zależna od rodzaju
wiązania:
wiązanie pojedyncze C-C w etanie CH
3
CH
3
długość C-C ok.
1,54Å
i moc
376 kJ/mol
;
wiązanie podwójne C=C w etenie (etylenie) CH
2
=CH
2
jest
krótsze i mocniejsze niż w etanie
długość C=C ok.
1,33 Å
i moc
611 kJ/mol
;
wiązanie potrójne C≡C w etynie (acetylenie) HC≡CH ma
długość C≡C ok.
1,20 Å
i moc
835 kJ/mol
;
wiązanie σ C-C moc
376 kJ/mol
wiązanie π w C=C moc
235 kJ/mol
(611-376)
Wiązanie π w C=C jest słabsze i łatwiejsze do rozerwania.
Proces ten dominuje w chemii alkenów i alkinów (addycja).

10
Siła (energia, moc) i długość wiązania
230
0,214
C-I
280
0,194
C-Br
339
0,177
C-Cl
452
0,138
C-F
Moc
(kJ/mol)
Długość
(nm)
Wiązanie
Wiązania krótsze są zwykle wiązaniami mocniejszymi.
11
Pełen wzór strukturalny:
C
H
H
H
C
H
C
H
C
H
H
H
H
C H
H
H
Rysowanie wzorów strukturalnych
Wzory skrócone (grupowe):
CH
3
CH
2
CH
CH
3
CH
3
CH
3
CH
2
CHCH
3
CH
3
CH
3
CH
2
CH(CH
3
)
2
12
CH
3
CCH
3
CH
3
CH
3
1.
Atomy węgla się na ogół nie uwidacznia
. Zakłada się, że
atom węgla znajduje się na każdym przecięciu dwóch linii
(wiązań) i na końcu każdej linii.
Strukturalne wzory szkieletowe:
Atom węgla można zaznaczyć dla jasności obrazu albo
położenia nacisku.
COOH
OH
O
CH
3
CH
2
CH
2
CH
2
COOH
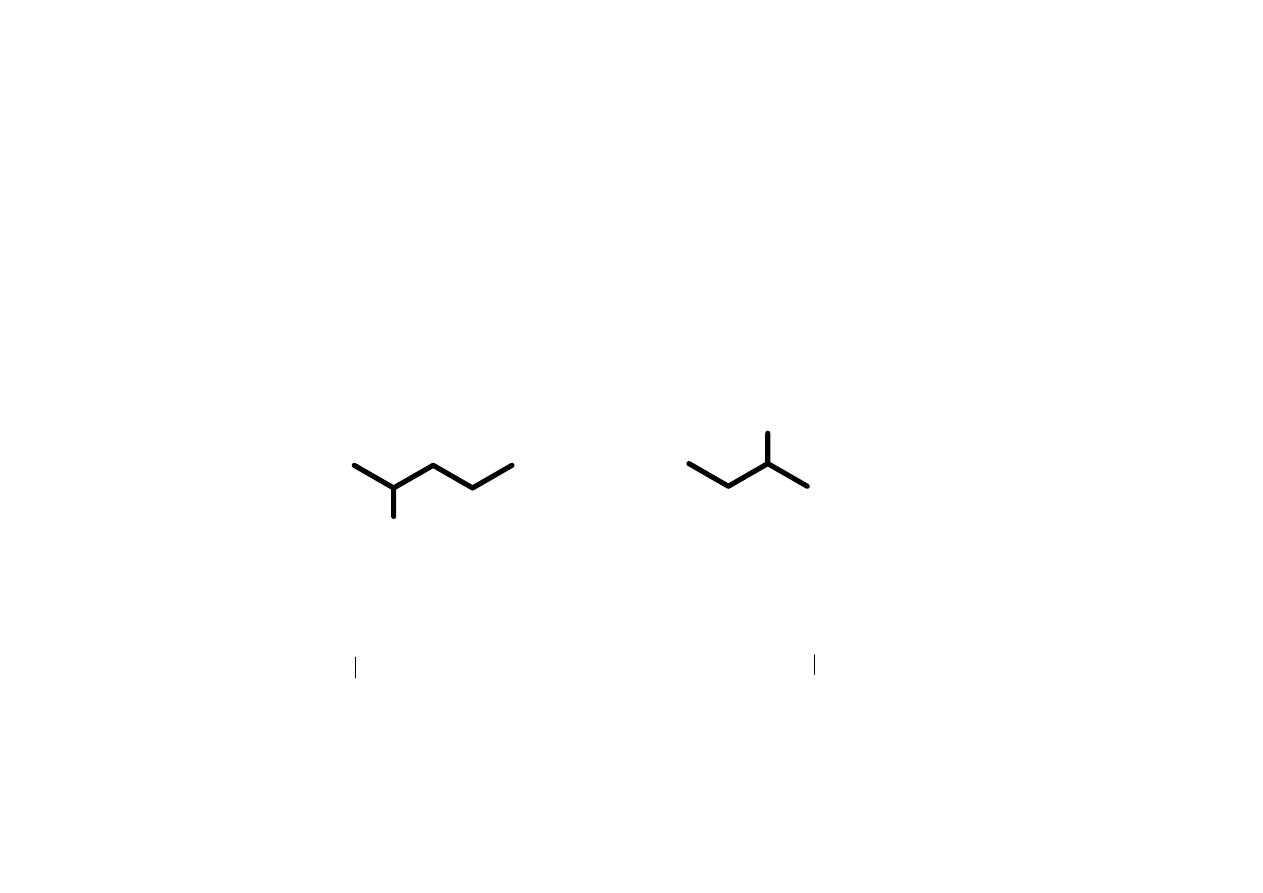
13
2.
Atomy wodoru przyłączone do atomu węgla nie są
uwidaczniane.
Ponieważ atom węgla ma zawsze wartościowość 4, przypisujemy
odpowiednią liczbę atomów wodoru każdemu atomowi węgla.
3.
Atomy inne niż węgiel i wodór są zawsze uwidaczniane.
Cl
OH
CH
3
CHCH
2
CH
2
CH
3
Cl
CH
3
CH
2
CHCH
3
OH
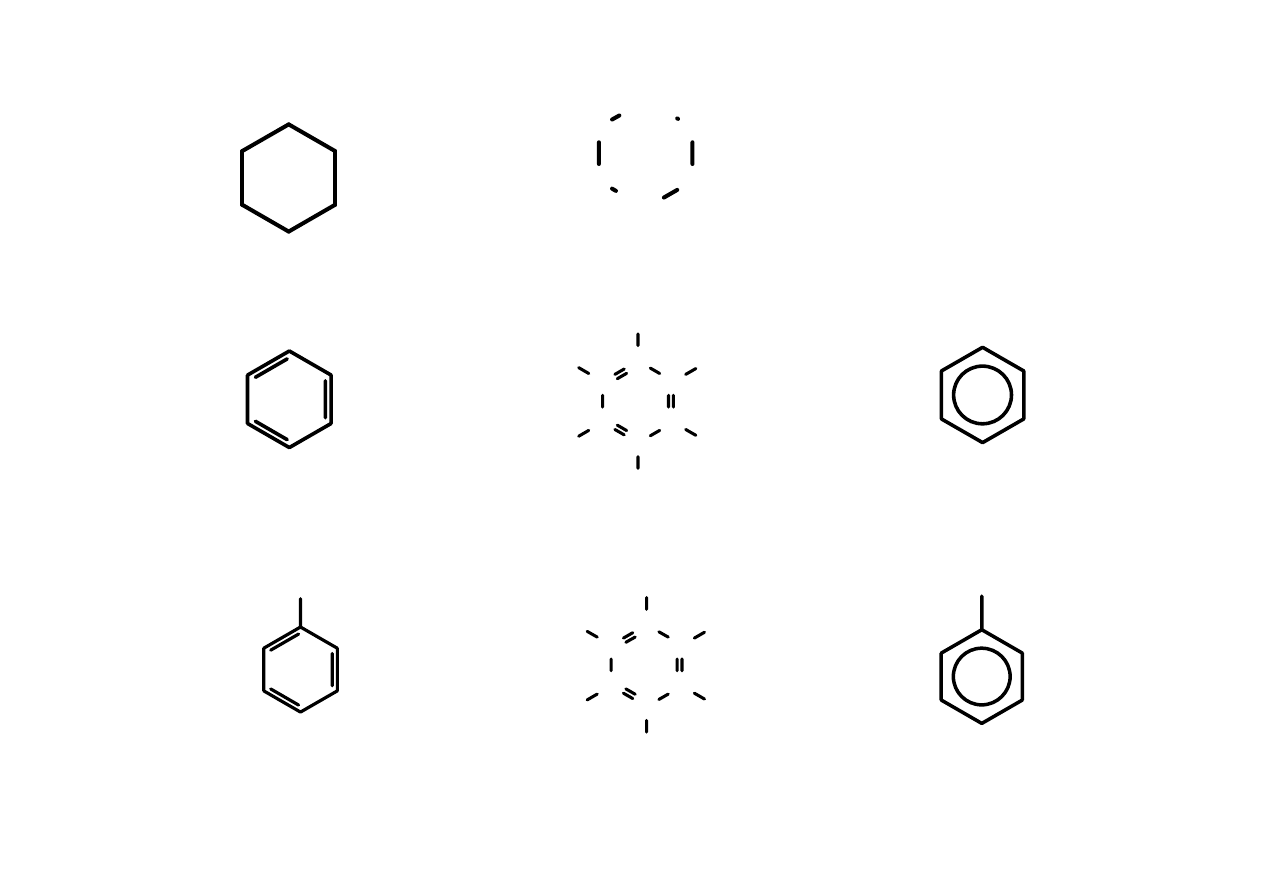
14
C
C
C
C
C
C
H
H
H
H
H
H
H
2
C
H
2
C
CH
2
CH
2
CH
2
CH
2
C
C
C
C
C
C
NH
2
H
H
H
H
H
NH
2
NH
2
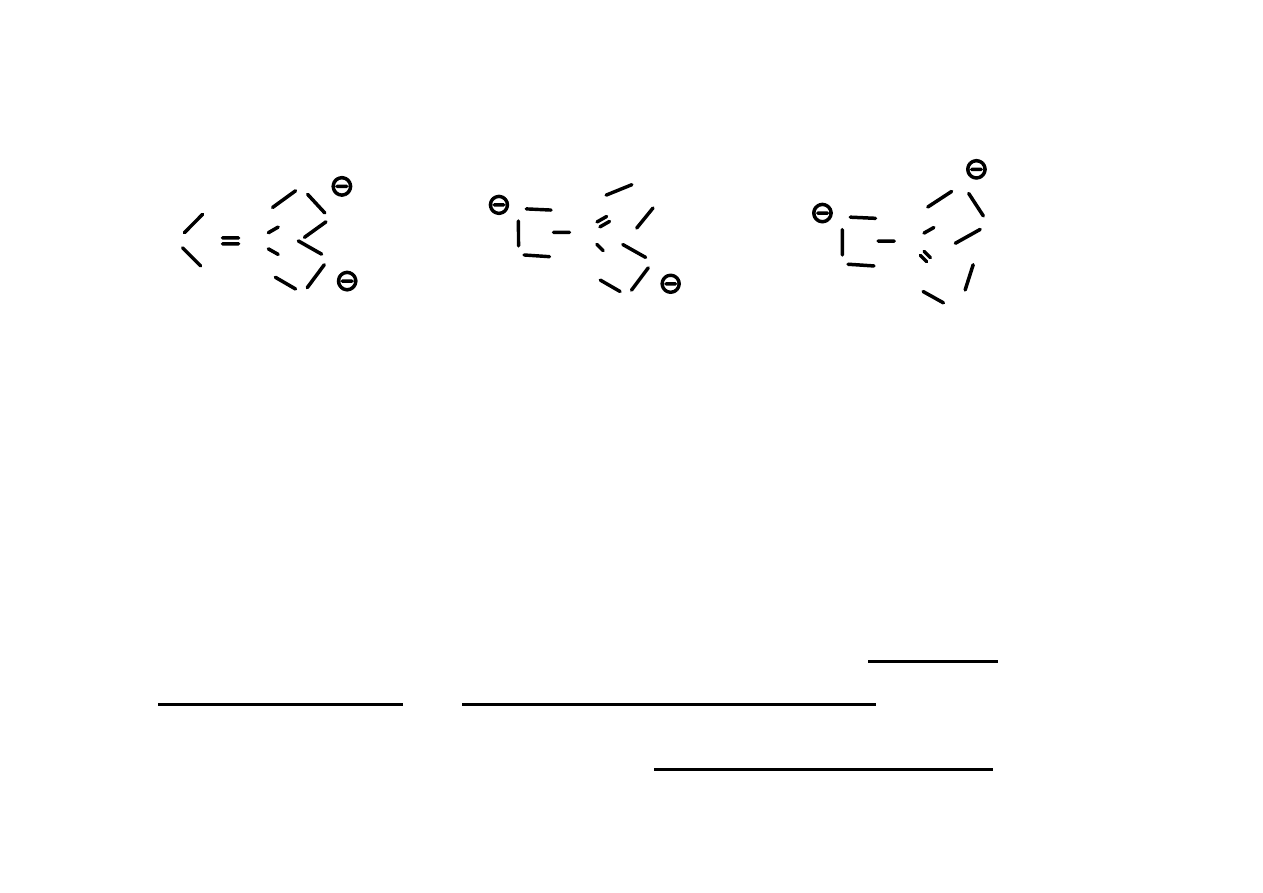
15
C
O
O
O
REZONANS
C
O
O
O
C
O
O
O
CO
3
2-
Wszystkie te struktury są w rzeczywistości równocenne.
Żaden ze wzorów strukturalnych Kekulégo jonu węglanowego
nie jest sam w sobie poprawny.
Prawdziwy wzór strukturalny jest wypadkową tych trzech
wzorów.
Te wzory strukturalne Kekulégo noszą nazwę struktur
rezonansowych lub struktur mezomerycznych.
Mówimy, że jon węglanowy jest hybrydą rezonansową trzech
struktur rezonansowych.
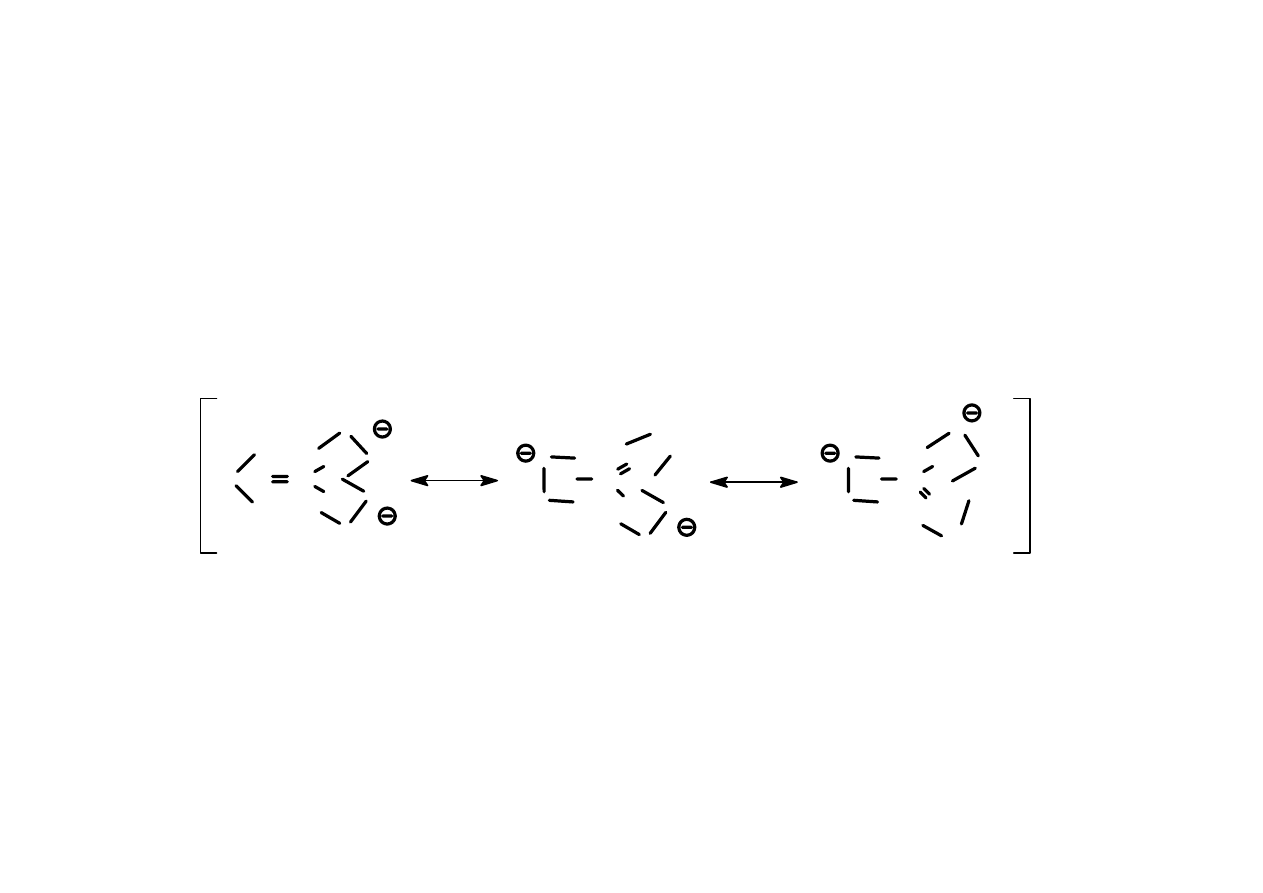
16
Wzajemną relację między wszystkimi strukturami
rezonansowymi zaznacza strzałka z dwoma grotami
wstawiona między nimi, a wszystkie wzory (struktury)
ujmuje się w nawias kwadratowy.
C
O
O
O
C
O
O
O
C
O
O
O
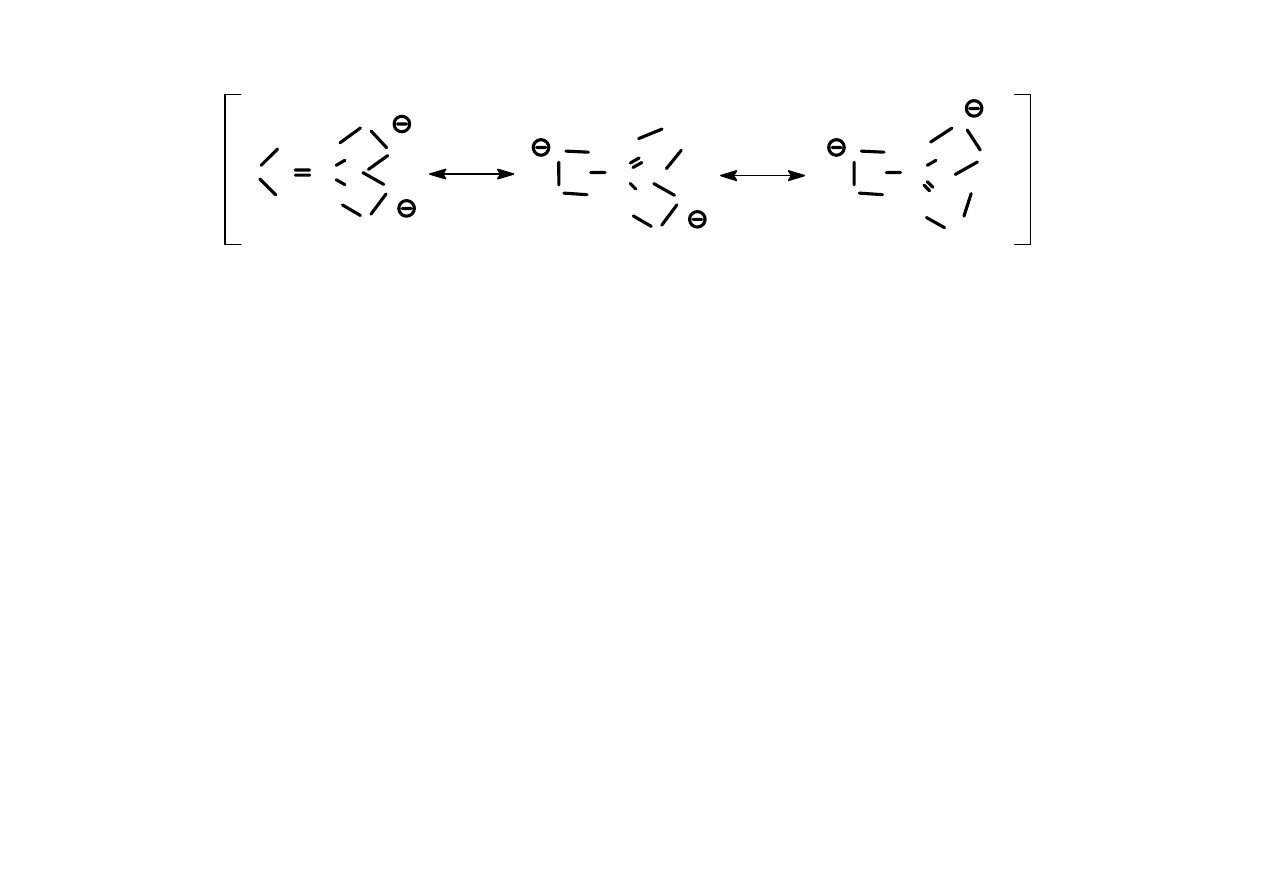
17
C
O
O
O
C
O
O
O
C
O
O
O
Jedyna różnica pomiędzy strukturami rezonasowymi
polega na różnym rozmieszczeniu elektronów wiązania
podwójnego π i elektronów niewiążących.
Same atomy znajdują się dokładnie w tych
samych miejscach we wszystkich strukturach.
Nie zmienia się układ wiązań pojedynczych.
Nie można rozdzielać par elektronowych, jeżeli w
strukturze Lewisa nie było niesparowanych elektronów,
czyli struktura ta nie była rodnikiem.
Nieprawdopodobna jest struktura, w której sąsiadują ze
sobą dwa jednoimienne ładunki (np. + obok +)
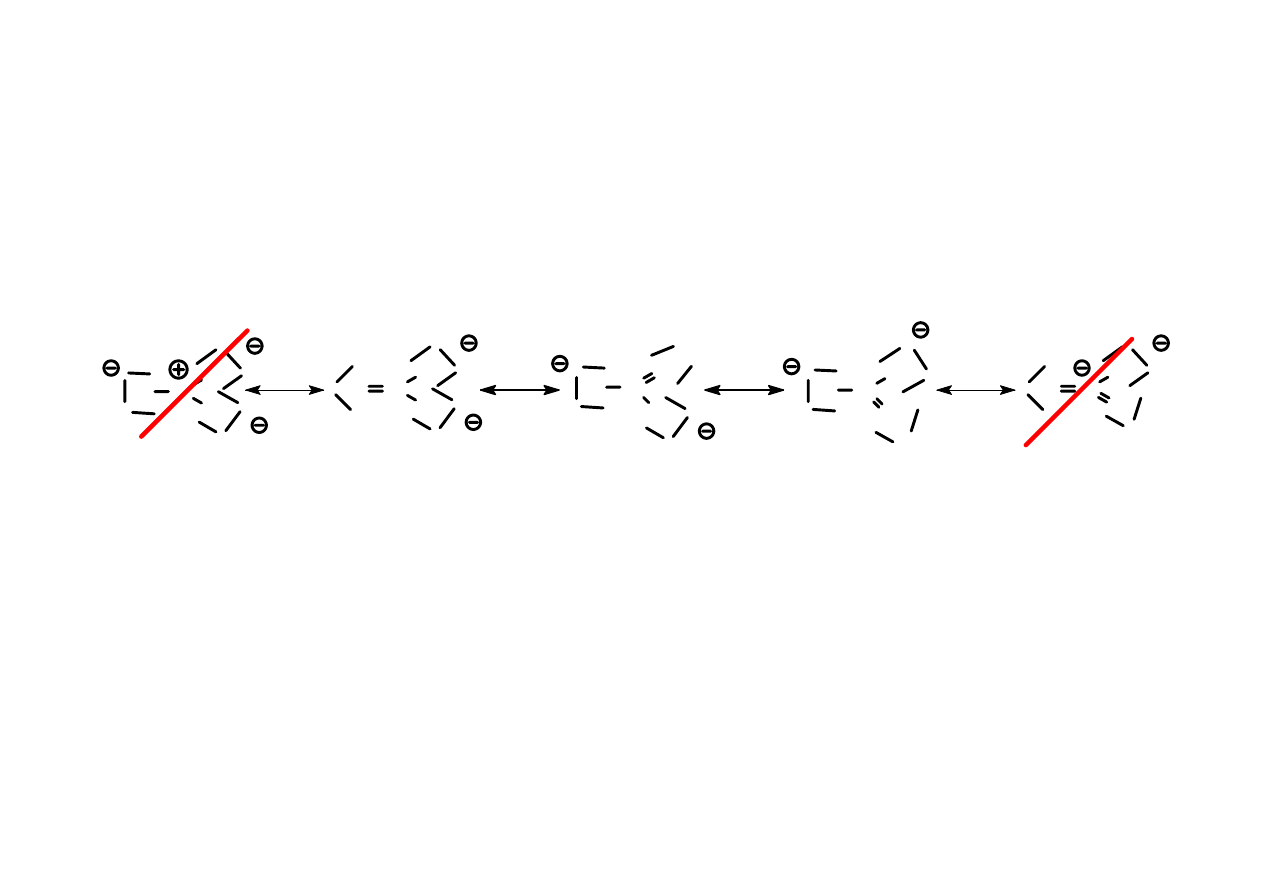
18
C
O
O
O
C
O
O
O
C
O
O
O
C
O
O
O
C
O
O
O
Każda struktura rezonansowa musi być zgodna ze wzorami
Lewisa (Kekulégo) (musi spełniać zasady walencyjności).
6 el. na C
10 el. na C

19
Klasy związków . Grupy funkcyjne
Grupa funkcyjna jest częścią dużej cząsteczki, składa się
z atomu lub grupy atomów, które wykazują
charakterystyczne zachowanie chemiczne.
Dana grupa funkcyjna, z chemicznego punktu widzenia,
zachowuje się w ten sam sposób w każdej cząsteczce,
której część stanowi.
Właściwości każdej cząsteczki organicznej, bez względu
na jej wielkość i złożoność, są określone przez grupy
funkcyjne, które zawiera.
20
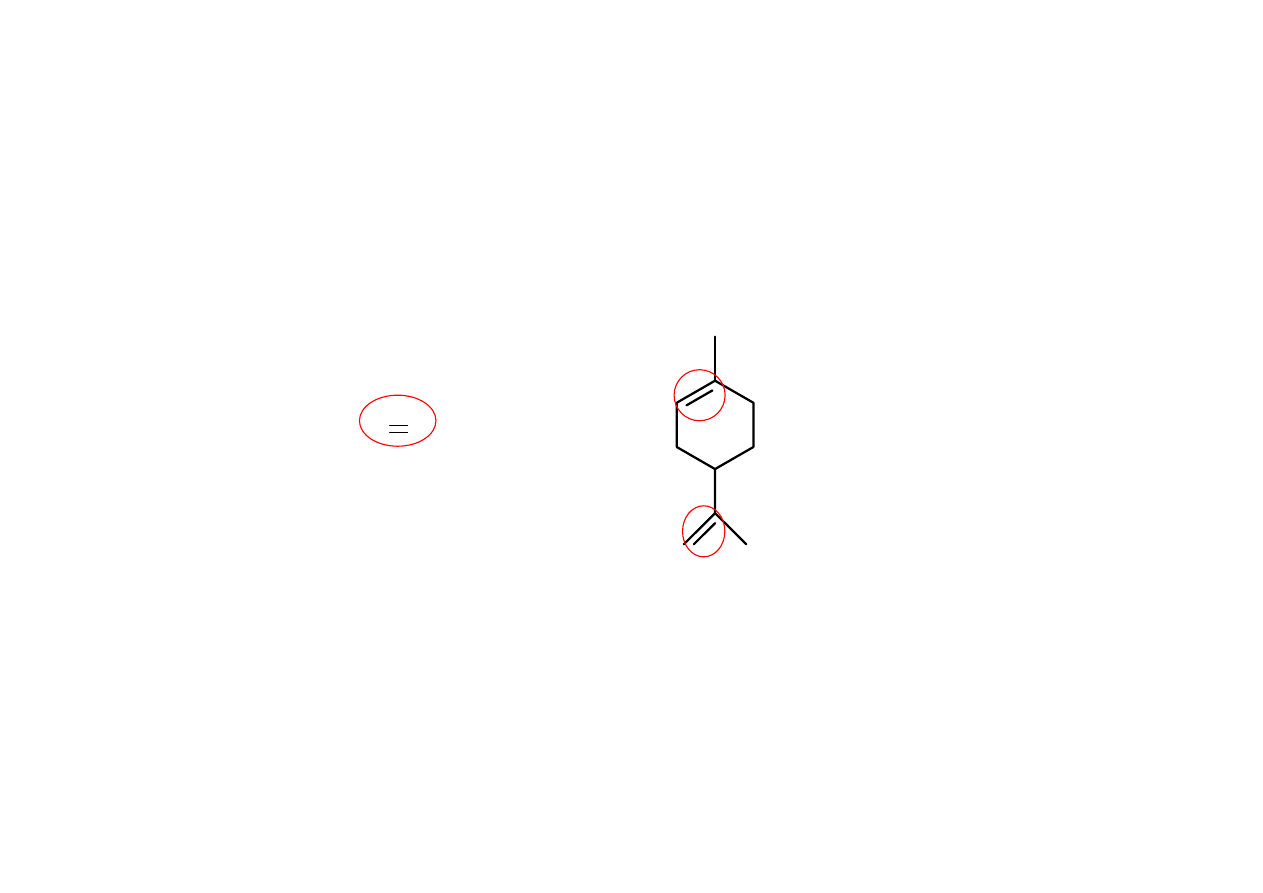
Grupa funkcyjna z punktu widzenia chemicznego, zachowuje
się w ten sam sposób, w każdej cząsteczce, w której się znajduje
(np. : podwójne wiązanie w etenie i limonenie).
limonen
eten
H
2
C CH
2
21
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Alkan
RH
Zawiera jedynie
pojedyncze wiązania
C-H i C-C
CH
3
CH
3
-an
etan
22
RH
CH
4
metan
CH
3
CH
3
etan
CH
3
CH
2
CH
3
propan
CH
3
CH
2
CH
2
CH
3
butan
C
5
H
12
pentan
C
6
H
14
heksan
C
7
H
16
heptan
C
8
H
18
oktan
C
9
H
20
nonan
C
10
H
22
dekan
CH
3
CHCH
3
izopropyl
CH
3
CHCH
2
CH
3
izobutyl
CH
3
C
CH
3
CH
3
tert-butyl
Alkan
Alkil
R
CH
3
-
metyl
C
2
H
5
-
etyl
CH
3
H
7
-
propyl
-an
→
-yl ; -il
CH
3
CH
CH
3
23
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
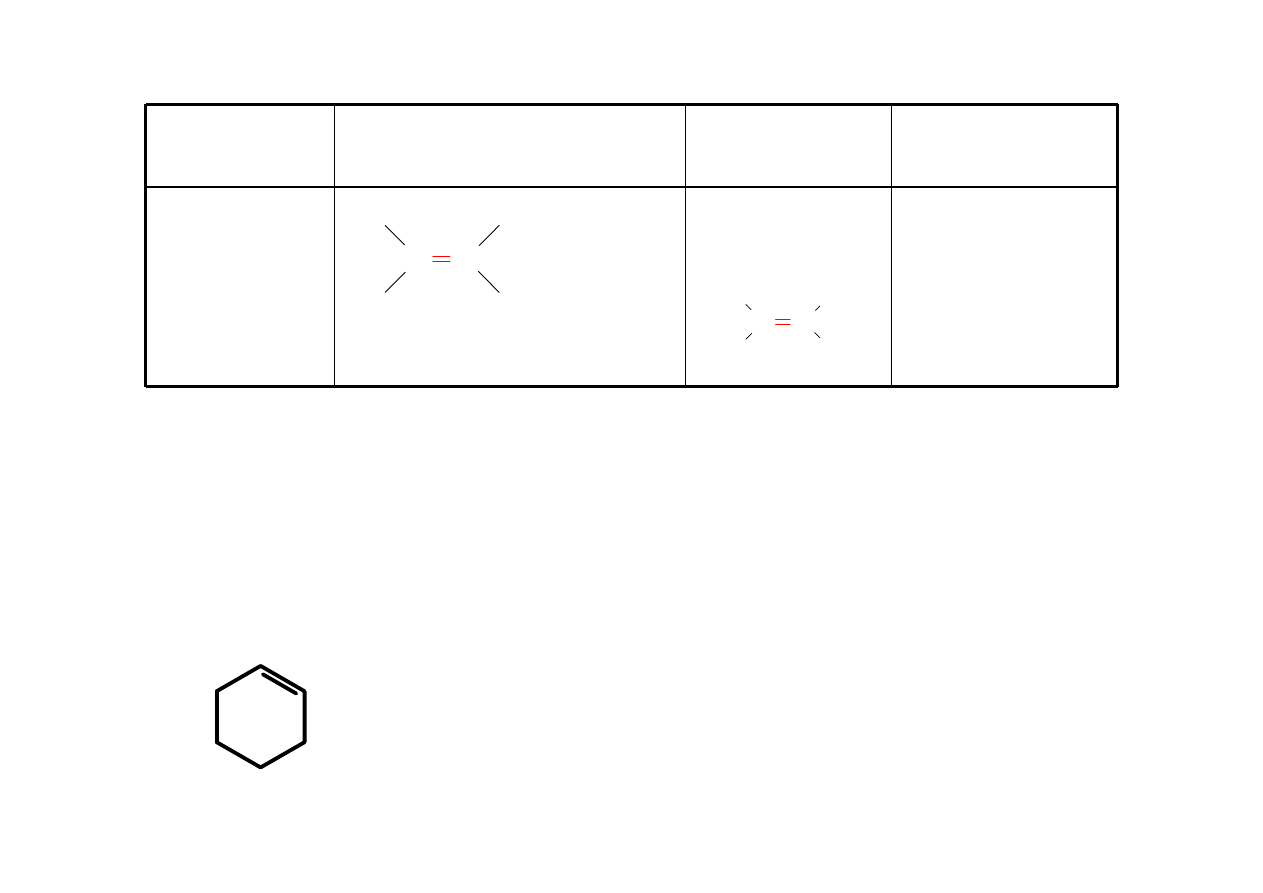
cykloalkan
Zawiera jedynie
pojedyncze
wiązania C-H i C-C
cykloalkan
cyklopropan
cyklobutan
cyklopentan
cykloheksan
24
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
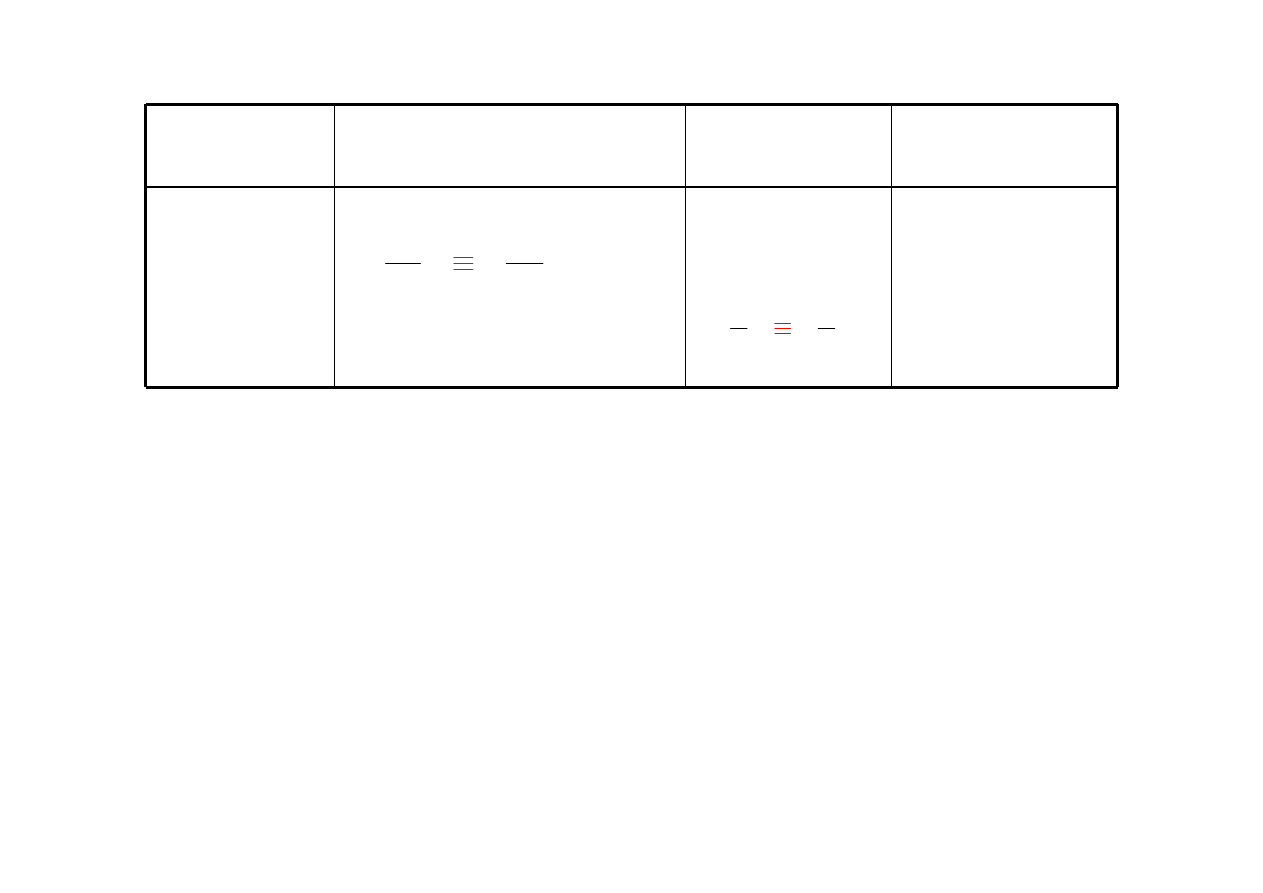
Alken
-en
eten (etylen
)
C C
C
H
H
C
H
H
CH
3
CH
3
etan
CH
2
=CH
2
eten (etylen)
CH
3
CH
2
CH
3
propan
CH
3
CH=CH
2
propen (propylen)
CH
3
CH
2
CH
2
CH
3
butan
CH
2
=CHCH
2
CH
3
1-buten
CH
3
CH=CHCH
3
2-buten
cykloheksen
25
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Alkin
-
in
lub –
yn
etyn
(acetylen)
C C
C C
H
H
CH
3
C≡CH
propyn
CH
3
C≡CCH
3
2-butyn
but-2-yn
CH
3
CH
2
C≡CH
1-nutyn
but-1-yn
26
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
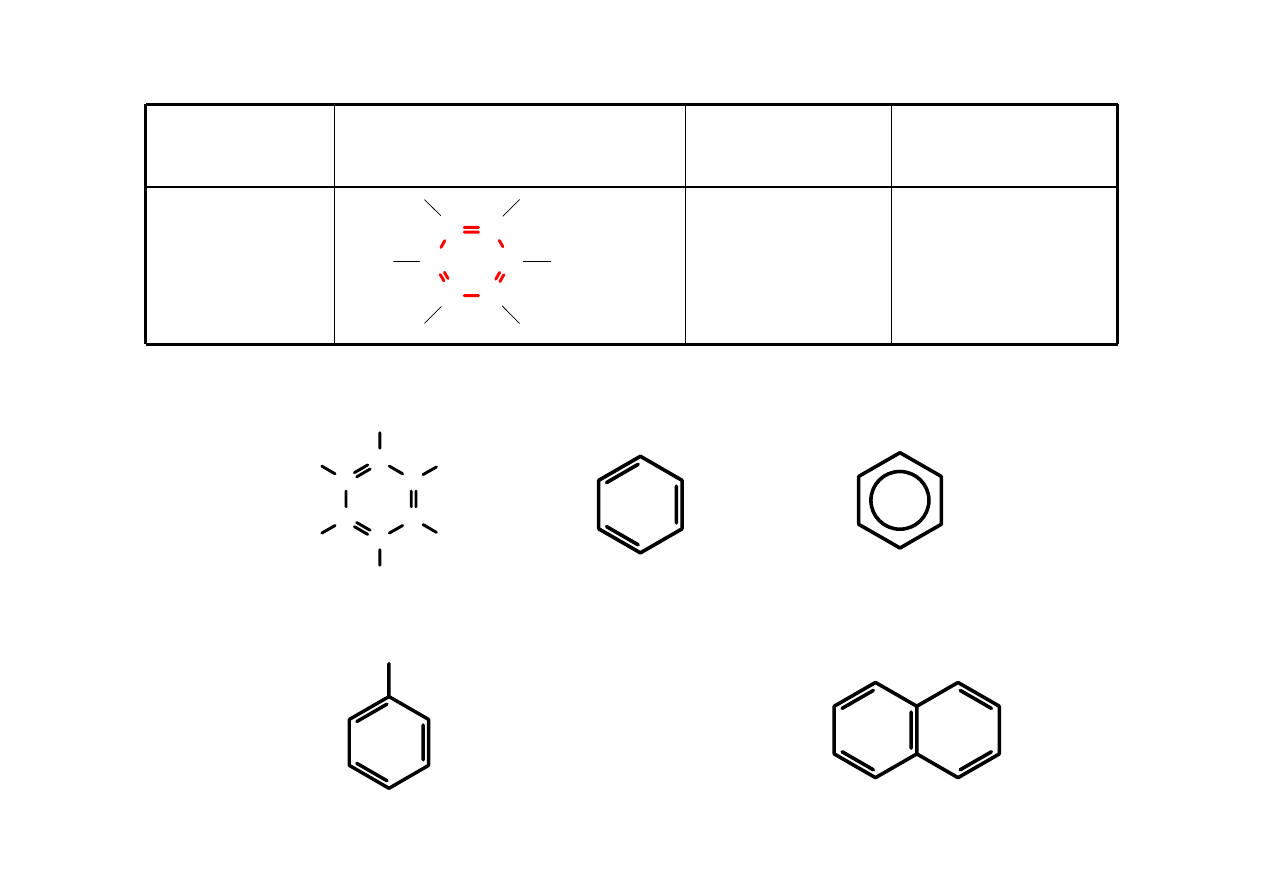
Aren
związki
aromatyczne
brak
C C
C
C
C
C
C
C
C
C
C
C
H
H
H
H
H
H
benzen
CH
3
toluen
naftalen
27
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Halogenek
RX
brak
chlorometan
C X
C Cl
H
H
H
CH
3
CH
2
l jodoetan
CH
3
Br bromometan
CH
3
CHCH
3
2-fluoropropan
F
CH
3
CH
2
CH
2
Br
1-bromopropan
CH
3
CH
2
CH
2
CH
2
CH
2
Br
1-bromopentan
28
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Alkohol
ROH
alkan-
ol
C O H
CH
3
OH
metan
ol
CH
3
CH
2
OH
etan
ol
CH
3
CH(OH)CH
3
2-propan
ol
propan-2-
ol
CH
3
CH
2
CH
2
OH
1-propan
ol
propan-1-
ol
OH
cykloheksanol
OH
CH
3
CH(OH)CH
2
CH
3
2-butanol
butan-2-ol
29
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
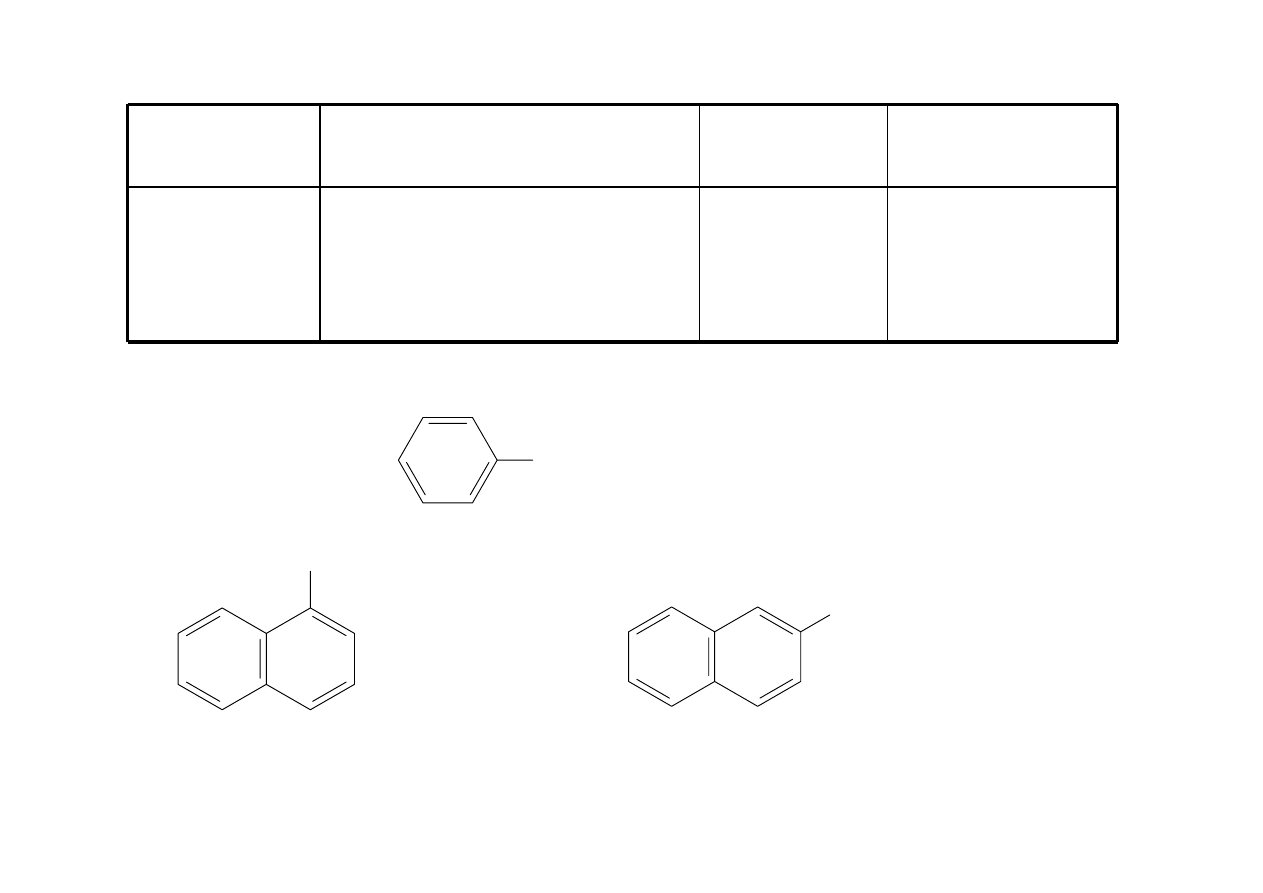
Fenol
ArOH
Grupa –OH przyłączona
bezpośrednio do pierścienia
aromatycznego
OH
fenol
OH
1-naftol
α-naftol
OH
2-naftol
β-naftol
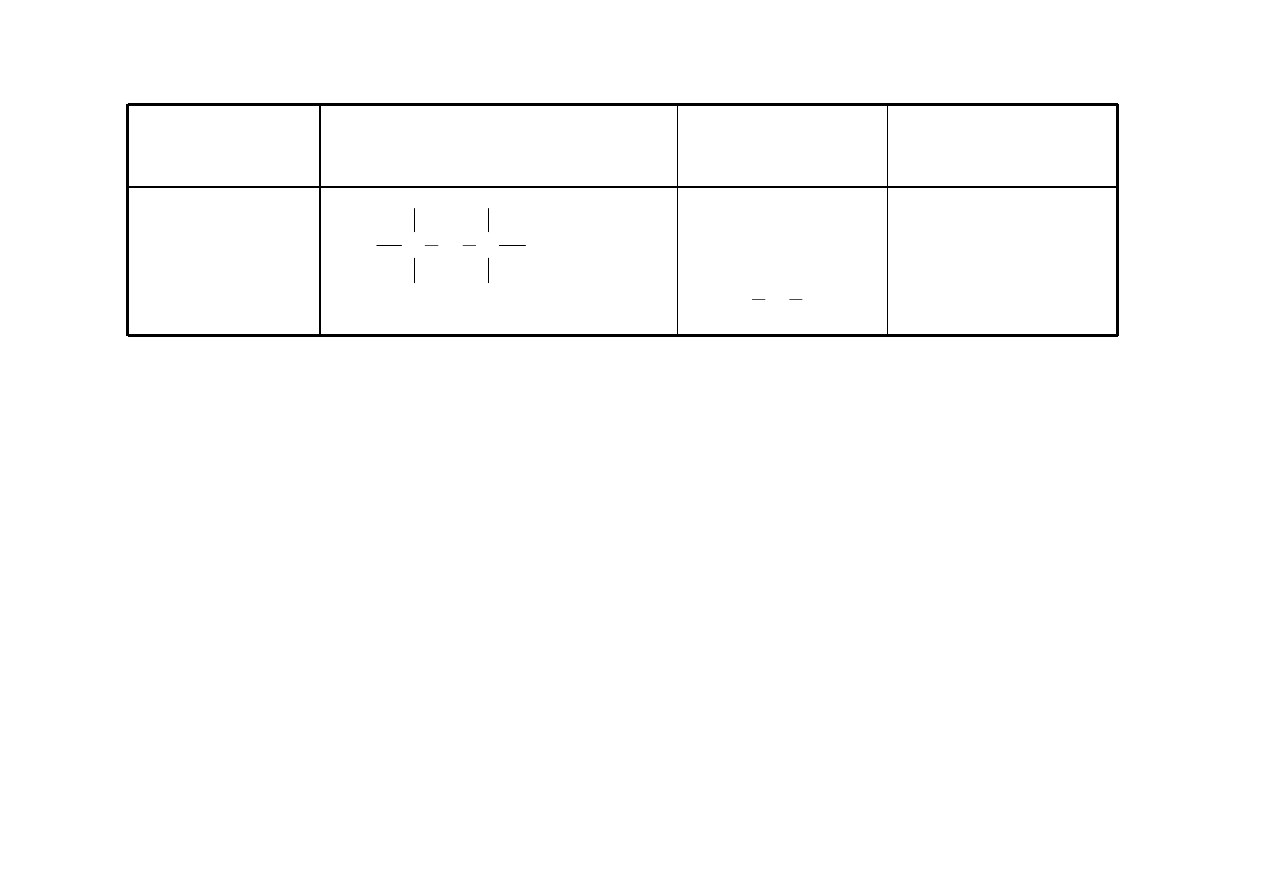
30
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Eter
ROR’
eter
eter
dimetylowy
C O C
H
3
C O C
H
3
CH
3
OCH
3
eter dimetylowy
CH
3
CH
2
OCH
2
CH
3
eter dietylowy
CH
3
CH
2
OCH
3
eter etylowo-metylowy
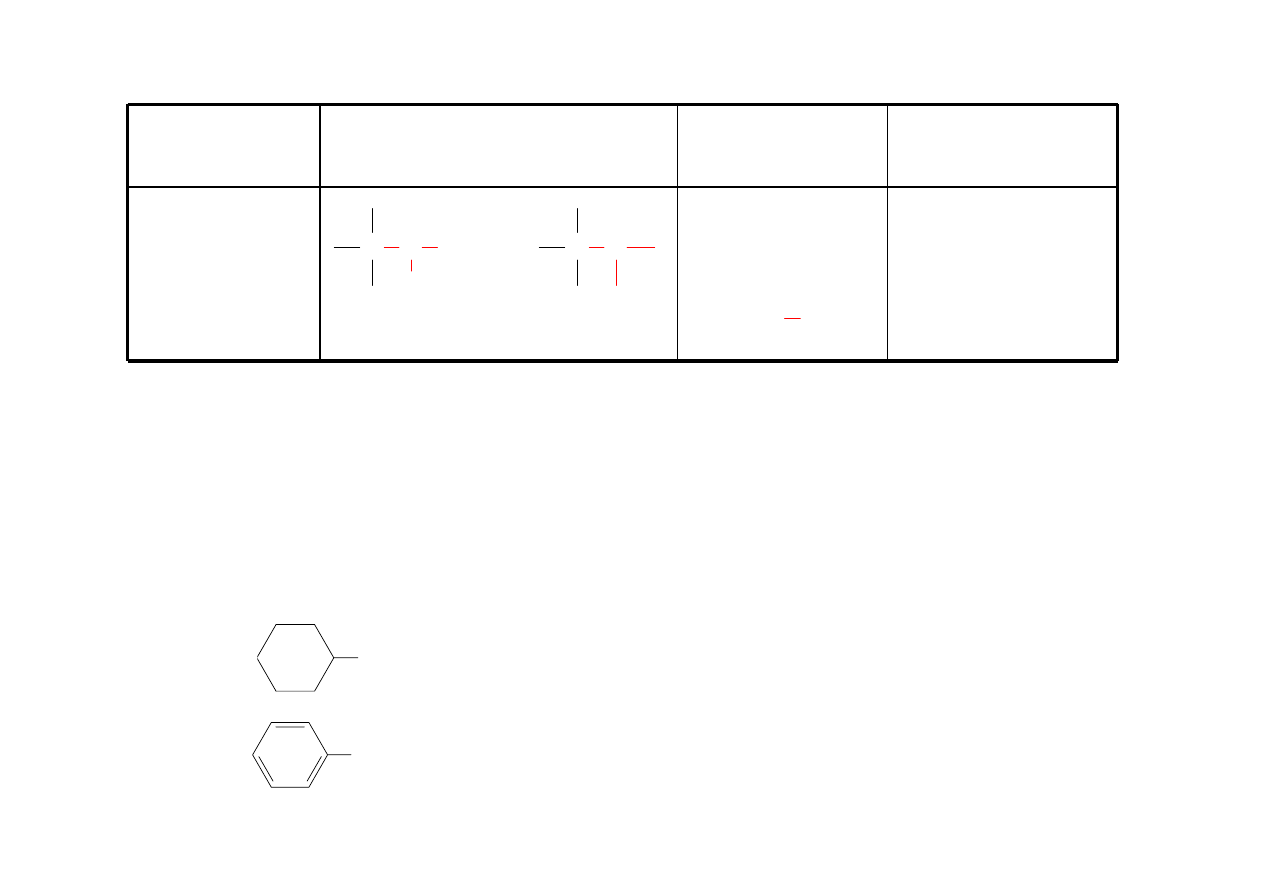
31
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Amina
RNH
2
alkiloamina
metyloamina
C N H
H
C N
H
3
C NH
2
CH
3
CH
2
NH
2
etyloamina
(CH
3
)
2
NH dimetyloamina
(CH
3
CH
2
)
3
N trietyloamina
NH
2
anilina aminobenzen
NH
2
cykloheksyloamina
CH
3
CH
2
CH
2
NH
2
1-propyloamina
CH
3
CH
2
CH
2
CH
2
NH
2
1-butyloamina
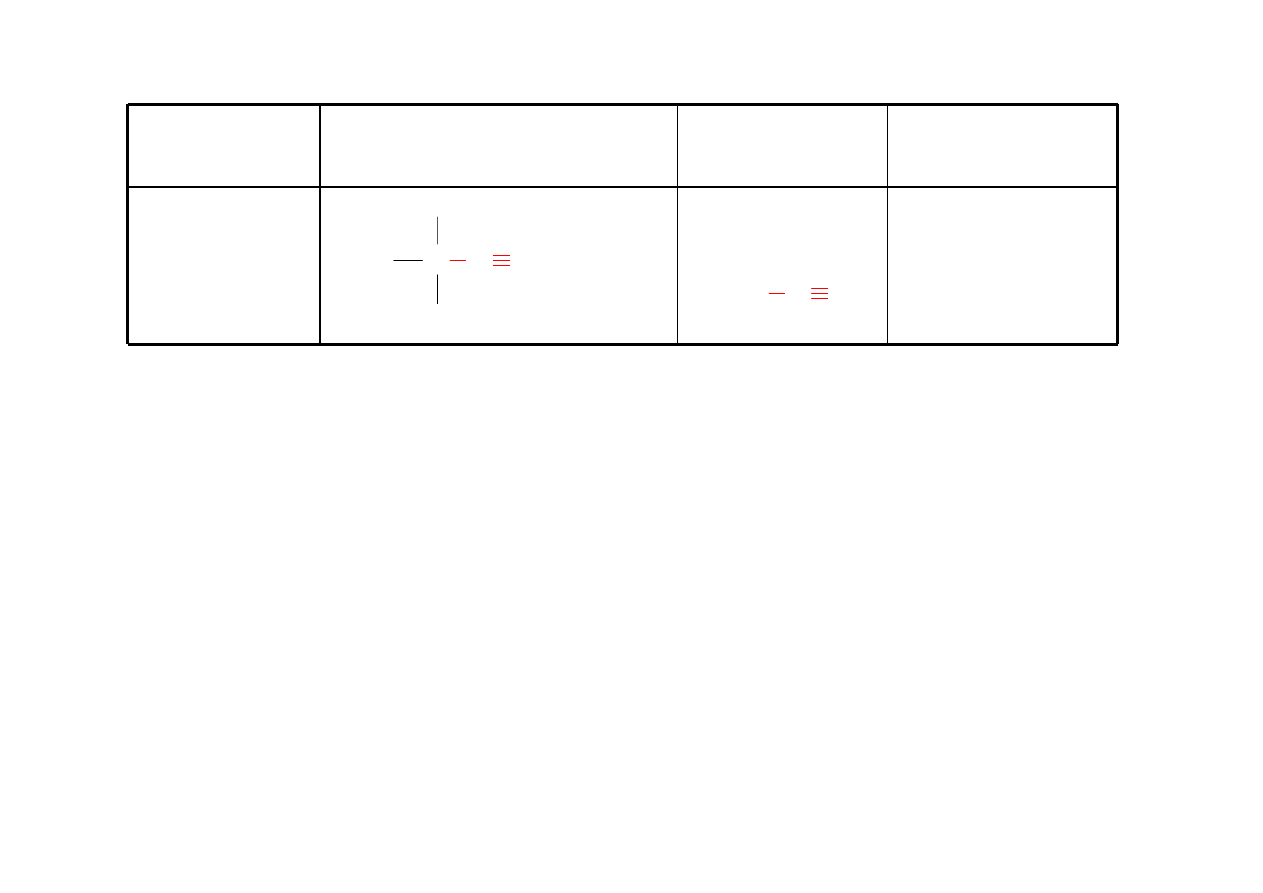
32
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Nitryl
RCN
alkano-
nitryl
etanonitryl
(acetonitryl)
C C N
H
3
C C N
CH
3
CH
2
CN propanonitryl
CH
3
CH
2
CH
2
CN butanonitryl
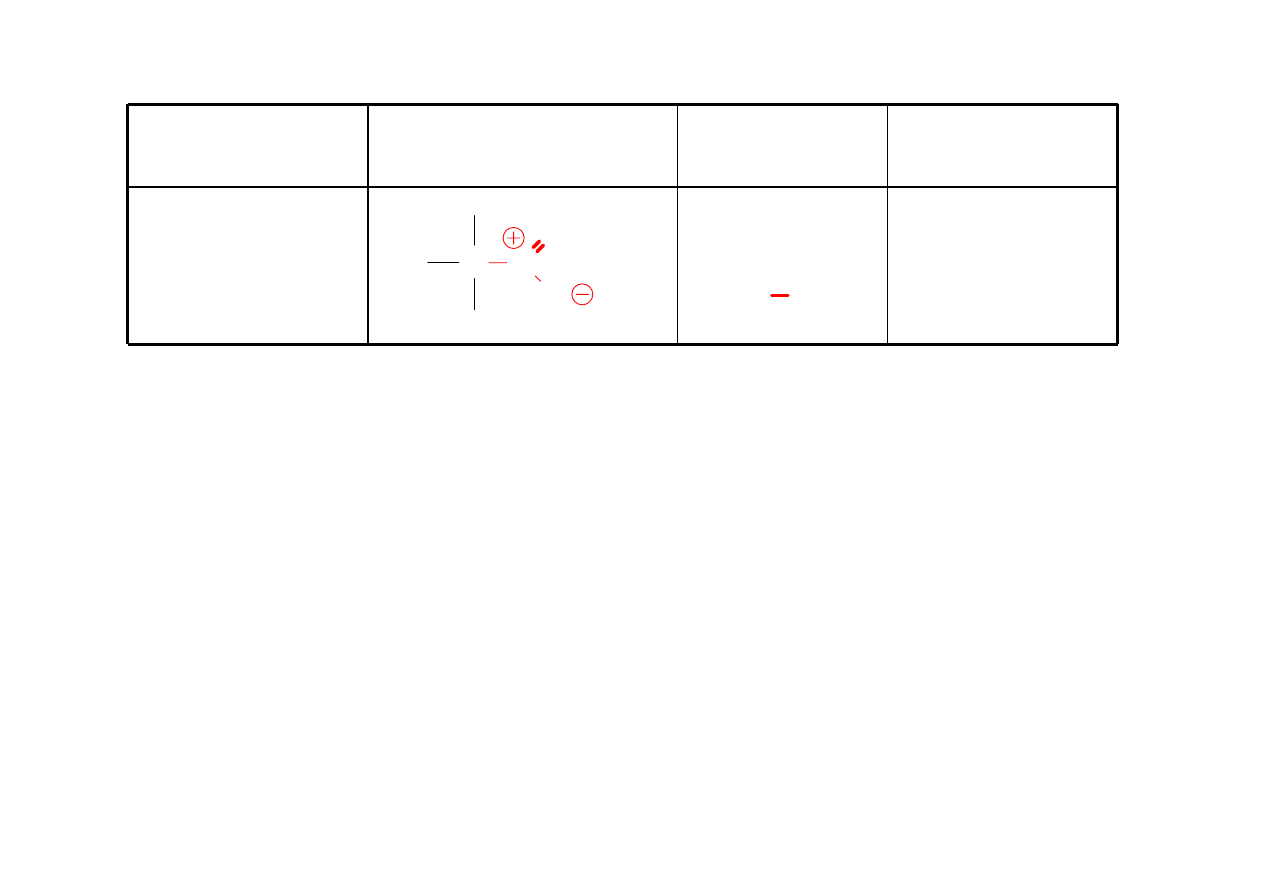
33
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
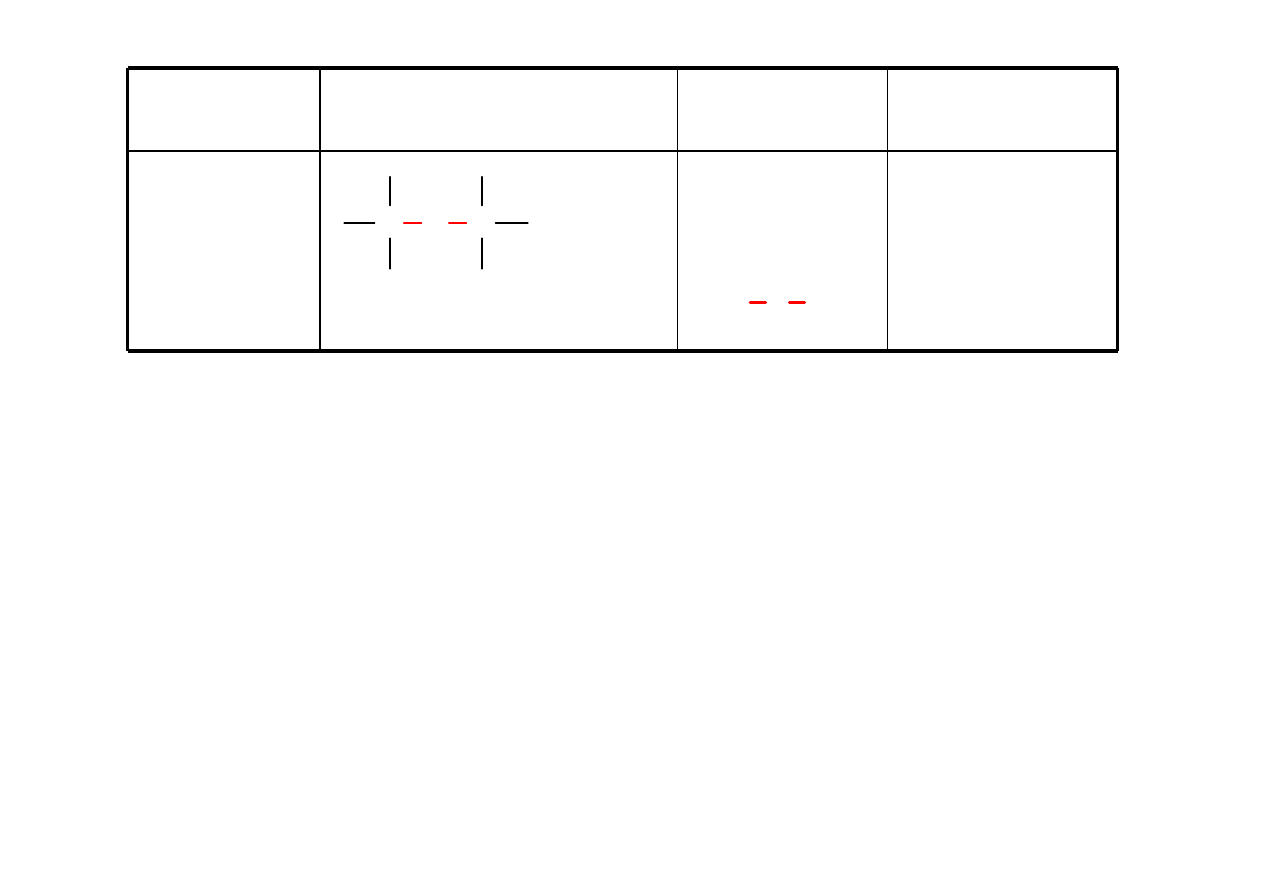
Nitrozwiązek
RNO
2
brak
nitroalkan
nitrometan
C N
O
O
H
3
C NO
2
34
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
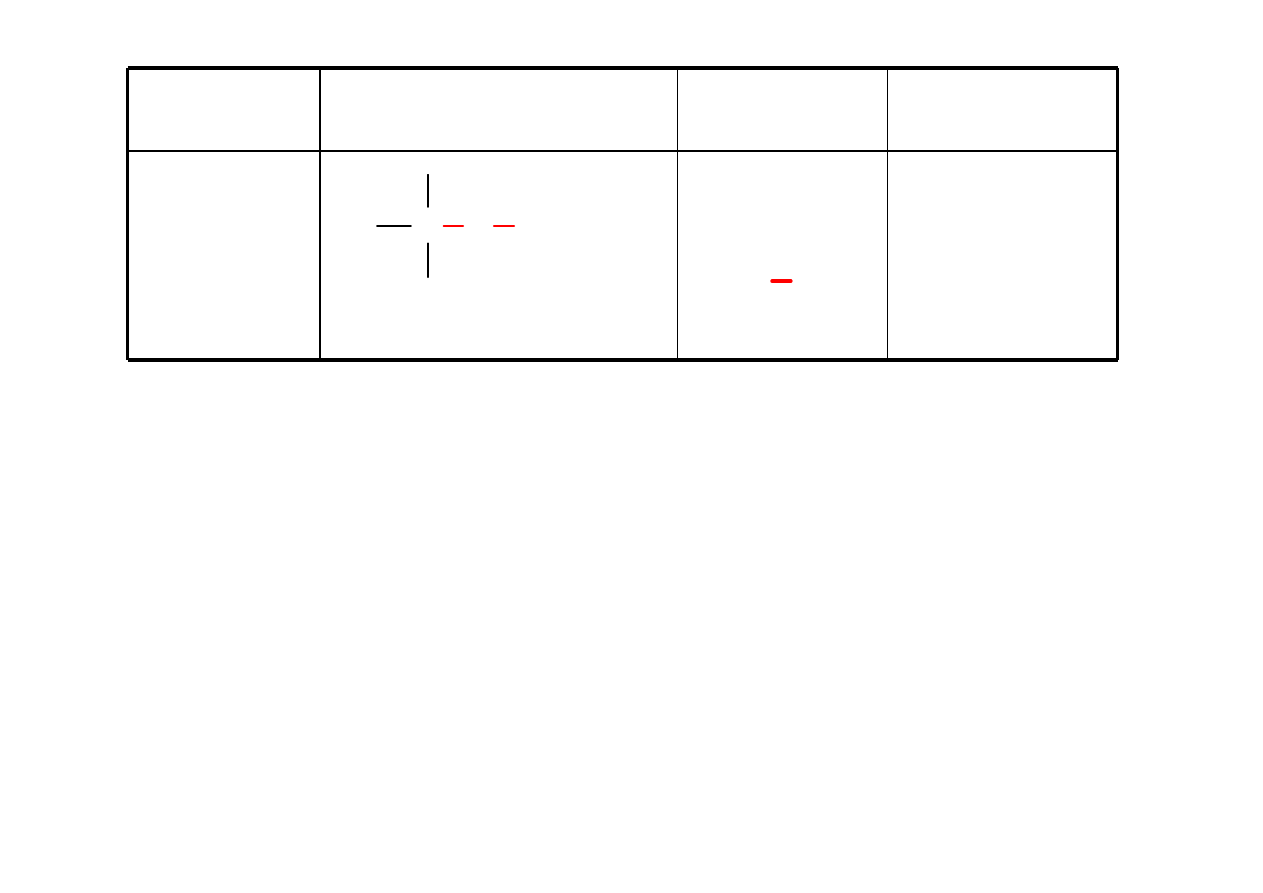
Sulfid
RSR’
sulfid
sulfid
dimetylowy
C S C
H
3
C S C
H
3
35
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
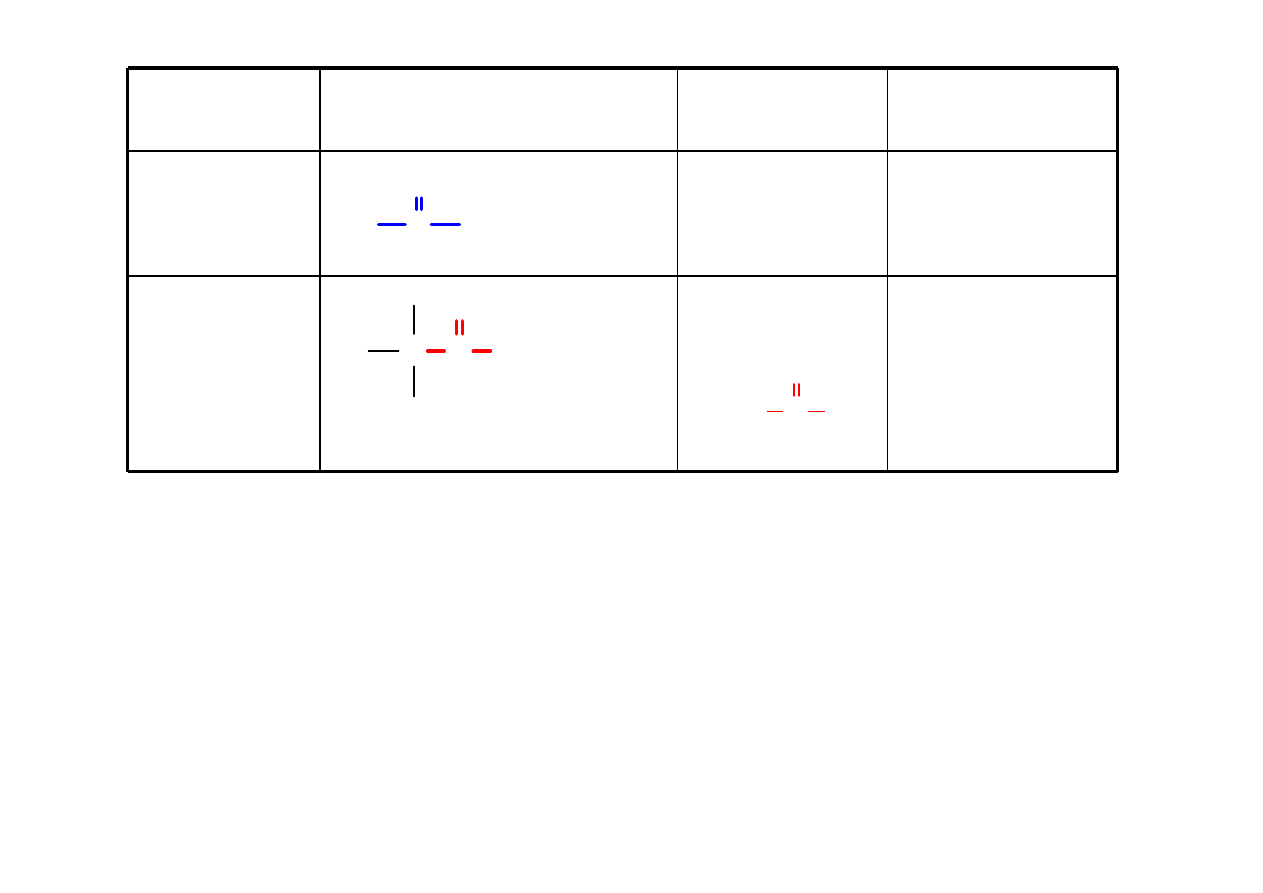
Tiol
RSH
alkano
tiol
metanotiol
C S H
H
3
C SH
36
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Karbonyl
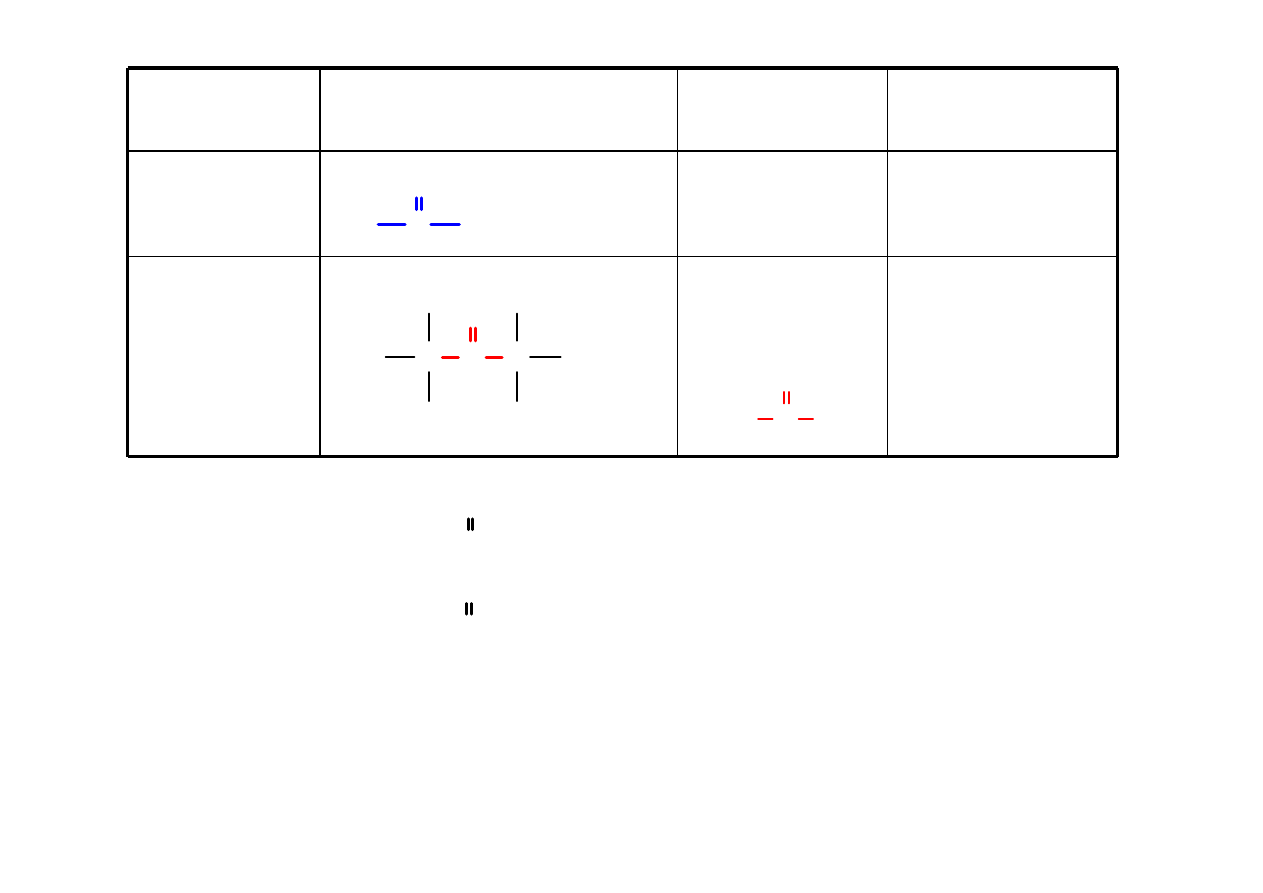
Aldehyd
RCHO
alkan
al
etanal
C
O
C C
O
H
H
3
C C
O
H
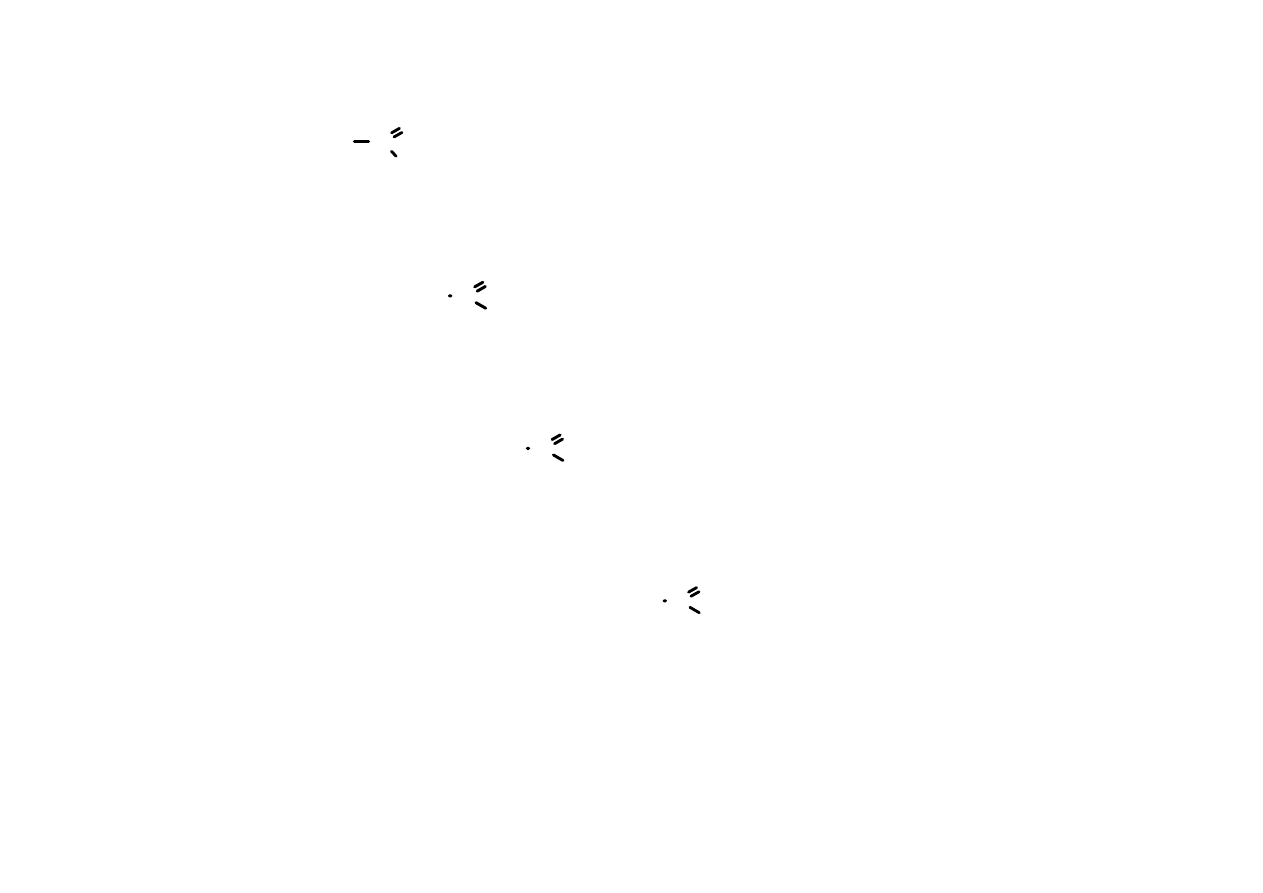
37
HCHO H C
O
H
metanal aldehyd mrówkowy
CH
3
CHO CH
3
C
O
H
etanal
aldehyd octowy
CH
3
CH
2
CHO CH
3
CH
2
C
O
H
propanal
CH
3
CH
2
CH
2
CHO CH
3
CH
2
CH
2
C
O
H
butanal
aldehyd masłowy
38
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
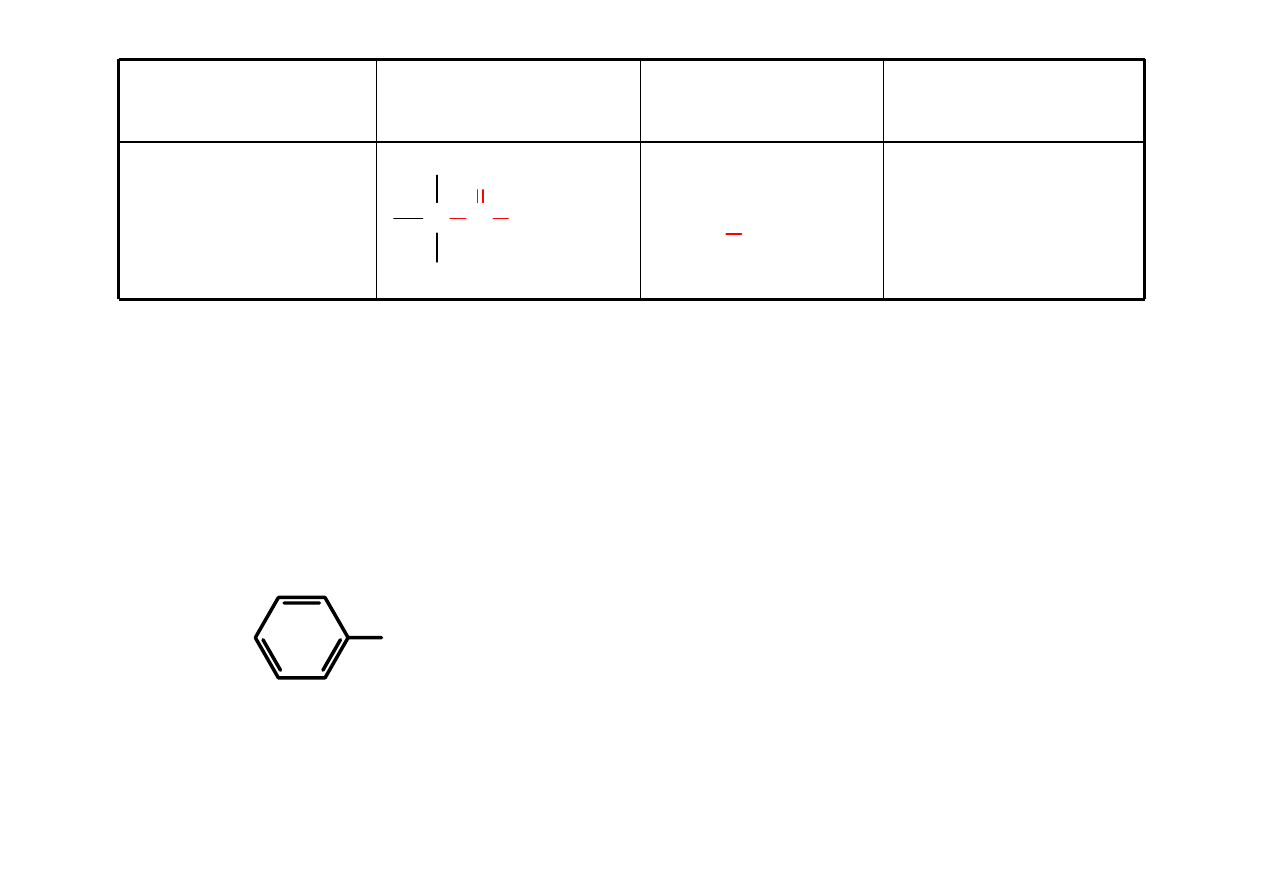
Karbonyl
Keton
RCOR’
alkan-
on
propanon
(aceton)
C
O
C C
O
C
H
3
C C C
H
3
O
CH
3
CH
2
CCH
2
CH
3
3-pentanon
O
CH
3
CH
2
CCH
3
butanon
O
CH
3
COCH
2
CH
2
CH
3
2-pentanon
pent-2-on
39
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Kwas
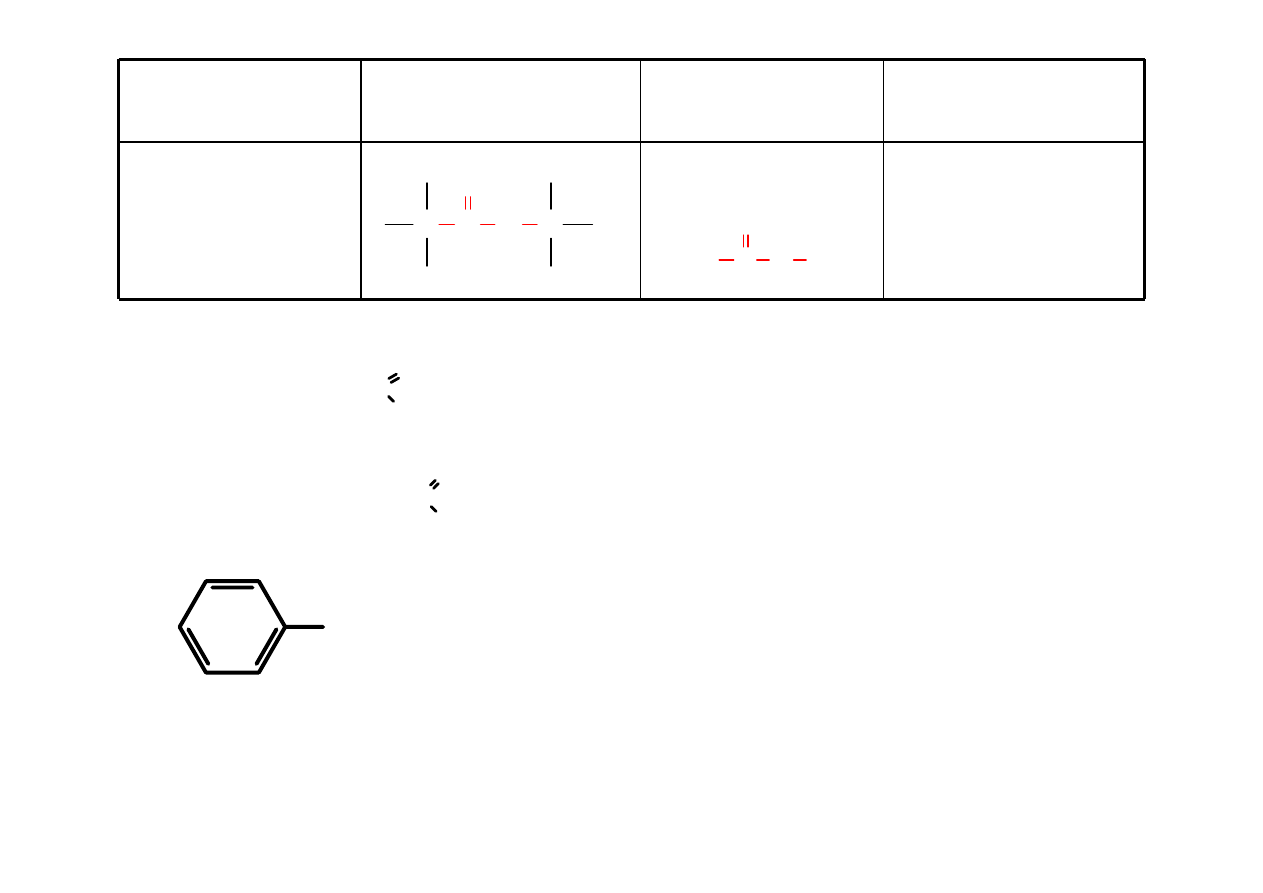
Karboksylowy
RCOOH
kwas
alkanowy
kwas etanowy
(kwas octowy)
C C
O
OH
H
3
C COOH
HCOOH
kwas metanowy ( mrówkowy)
CH
3
COOH
kwas etanowy
( octowy)
CH
3
CH
2
COOH
kwas propanowy
CH
3
CH
2
CH
2
COOH
kwas butanowy (masłowy)
COOH
C
6
H
5
COOH
kwas benzoesowy
40
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Ester
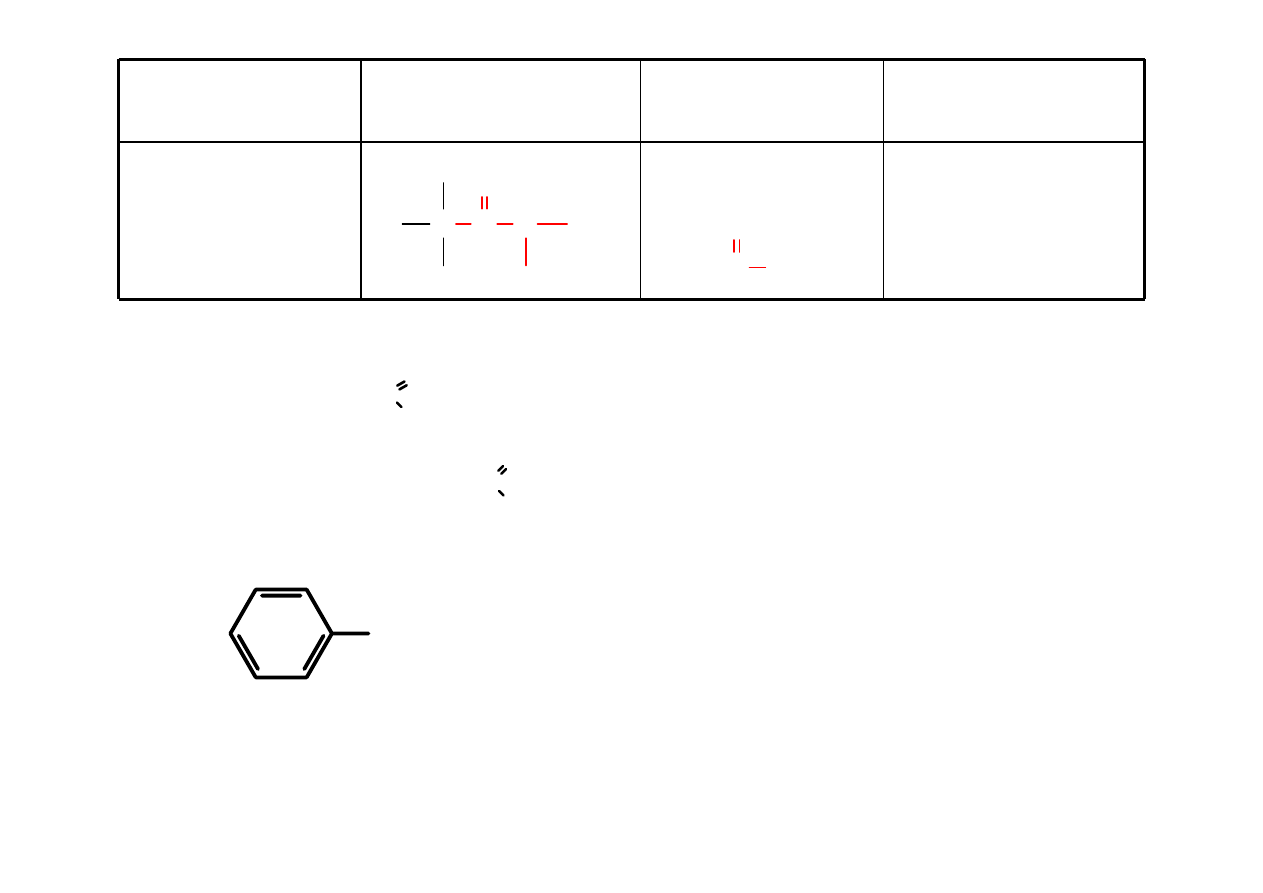
RCOOR’
alkanian alkilu
etanian metylu
(octan metylu)
C C
O
O C
CH
3
COOC
2
H
5
CH
3
C
O
OCH
2
CH
3
metanian metylu (mrówczan metylu)
etanian etylu (octan etylu)
HCOOCH
3
HC
O
OCH
3
H
3
C C
O
O C
H
3
COOCH
3
benzoesan metylu
CH
3
CH
2
COOCH
3
propanian metylu
41
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
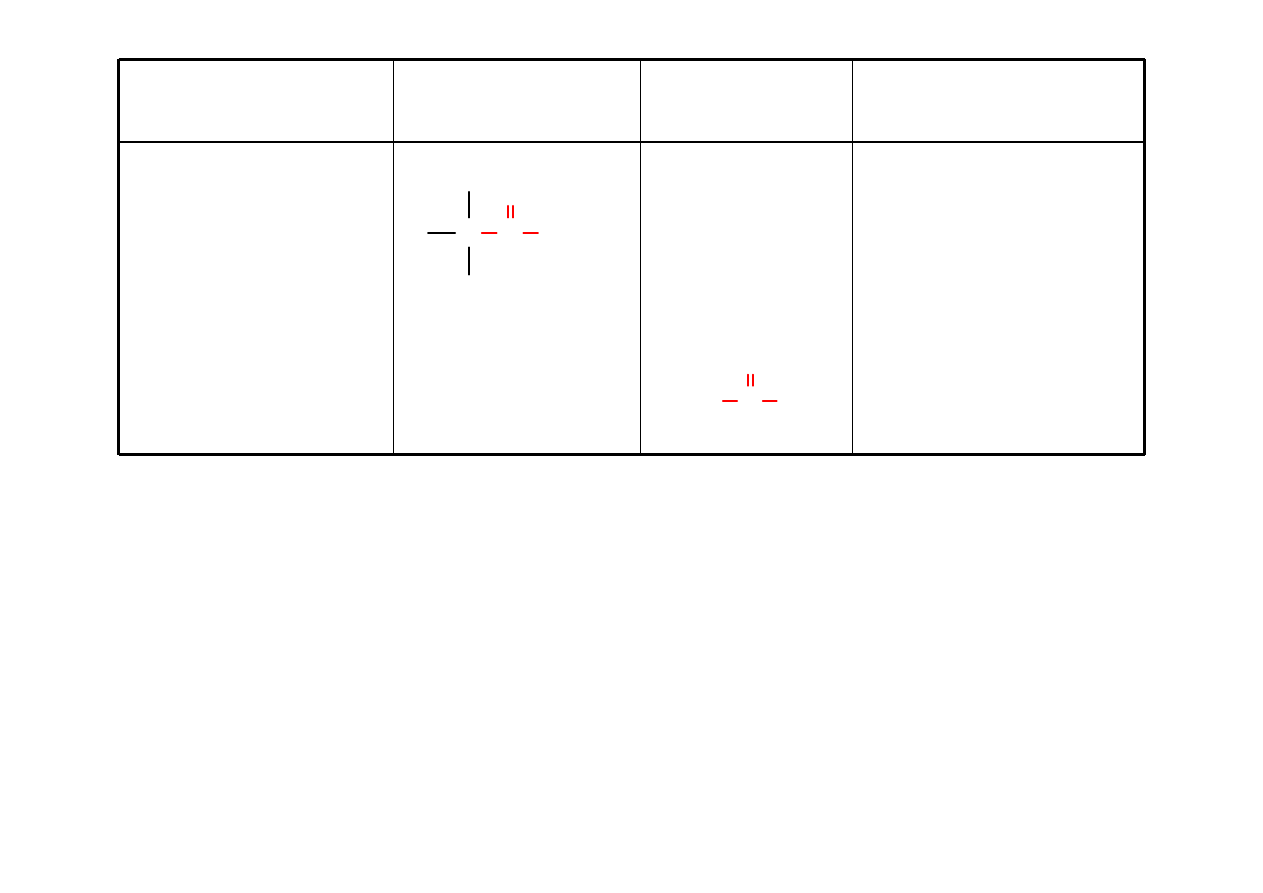
Amid
RCONH
2
alkanoamid
etanoamid
(acetamid)
C C
O
N
H
3
CC
O
NH
2
HCONH
2
HC
O
NH
2
CH
3
CH
2
CONH
2
CH
3
CH
2
C
O
NH
2
metanoamid (formamid)
propanoamid
CONH
2
benzamid
amid kwasu benzoesowego
42
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
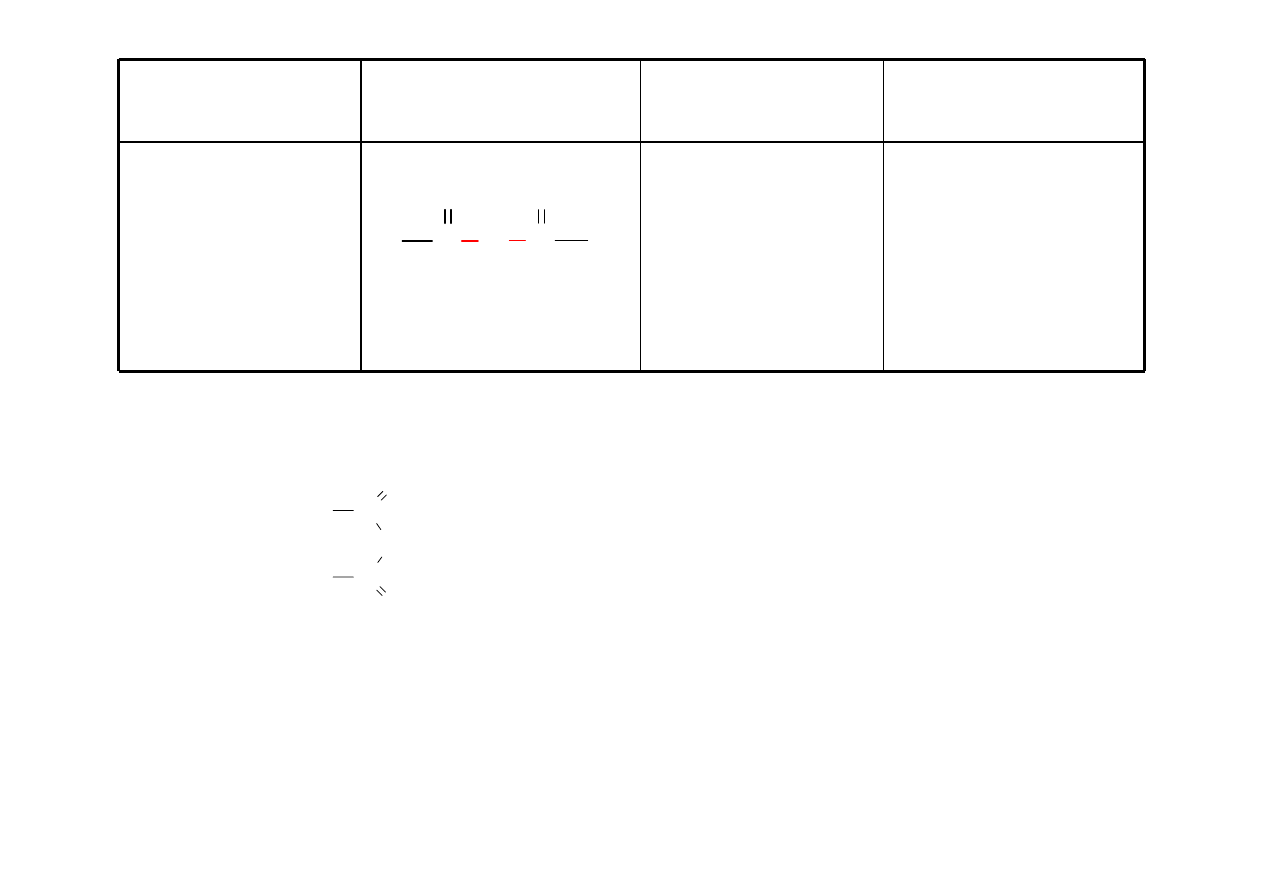
Chlorek kwasu
karboksylowego
RCOCl
chlorek
alkan
oilu,
chlorek ac
ylu
,
chlorek etanoilu
(chlorek acetylu)
C C
O
Cl
H
3
C C
O
Cl
43
Nazwa klasy
związków
Struktura grupy
funkcyjnej
Przykład
Przyrostek
Nazwa przykładu
Bezwodnik
kwasu
karboksylowego
(RCO)
2
O
Bezwodnik kwasu
……….
bezwodnik …-owy
O
C
O
C
O
C
O
C
CH
3
CH
3
O
O
bezwodnik kwasu etanowego
bezwodnik octowy
(CH
3
CO)
2
O
44
O
H
H
HO
H
H
N CH
3
HO
O
H
H
HO
H
H
N CH
3
HO
fenol
O
H
H
HO
H
H
N CH
3
HO
eter
O
H
H
HO
H
H
N CH
3
HO
alkohol
O
H
H
HO
H
H
N CH
3
HO
alken
O
H
H
HO
H
H
N CH
3
HO
amina
morfina
aromatyka
aren
Wyszukiwarka
Podobne podstrony:
Chemia labolatorium, Grupy funkcyjne, Grupa funkcyjna jest to charakterystyczne ugrupowanie atomów w
Chemia organiczna Tabela otrzymywania i reakcji związków od alkanów do amidów
Program wykladow, Studja, Chemia Organiczna
wykladChK-12, Chemia UŁ, teoretyczna wykład
Organiczne grupy funkcyjne
Wykład 12 - STRUKTURY ORGANIZACYJNE, Organizacja i Zarządzanie
Wykład 13 Chemia Organiczna, izomeria, oddziaływania międzycząsteczkowe, kwasy i zasady 5fantastic p
chemia organiczna testy na egzamin 2 www.przeklej.pl(1), AGH GiG WWNiG, Chemia organicza
chemia organiczna testy na egzamin 2 www.przeklej.pl, Wiertnik, 2 semestr
Chemia organiczna wyklad 12 [tryb zgodnosci]
Socjologia wyklad 12 Organizacja i zarzadzanie
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia organiczna wykłady całość(1)
analiza związku, chemia, organiczna
EgzaminMikrobPytania2008, chemia organiczna, biologia ewolucyjna-wykłady, genetyka, biologia komórki
Chemia fizyczna wykład 12
więcej podobnych podstron