
AKADEMIA ROLNICZA W SZCZECINIE
Wydział Nauk o śywności i Rybactwa
Zakład Opakowalnictwa i Biopolimerów
I N S T R U K C J A
Ć
W I C Z E N I E 11
ALKOHOLE
Wykrywanie alkoholi I, II, II – rzędowych i badanie ich właściwości
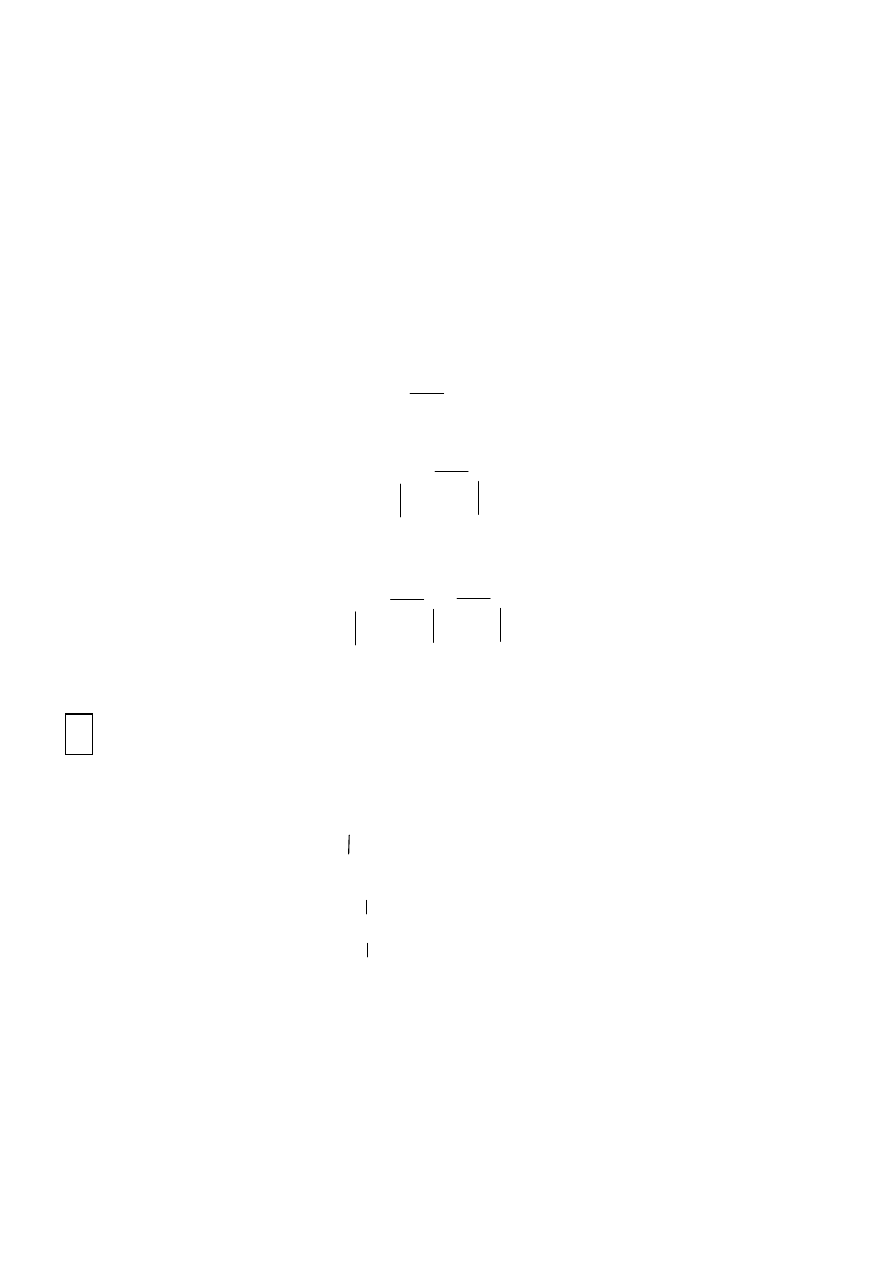
Alkohole
Alkohole są to związki zawierające jedną lub więcej grup hydroksylowych
(wodorotlenowych) połączonych z atomami węgla.
Wyróżniamy dwie grupy alkoholi (podział ze względu na szkielet węglowy):
1.
Alkohole alifatyczne:
•
alkohole nasycone
−
pochodne alkanów
•
alkohole nienasycone
−
pochodne alkinów bądź alkenów
2.
Alkohole aromatyczne
−
fenole
Jeżeli będziemy się kierować ilością grup wodorotlenowych, wówczas możemy mówić o
alkoholach:
monowodorotlenowych np.:
CH3
OH
metanol
diwodorotlenowe (diole) np.:
CH2
CH2
OH
OH
1,2 etanodiol
triwodorotlenowe np.:
CH2
CH
OH
OH
OH
CH2
1,2,3 propanotriol
poliwodorotlenowe, gdzie grup hydroksylowych jest wiecej.
Wzór ogólny: R
−
O
−
H
W zależności od liczby grup organicznych przyłączonych do atomu węgla z grupą OH wśród
alkoholi można wyodrębnić:
a.
alkohole I rzędowe: R – CH
2
– OH
b.
alkohole II rzędowe: R – CH – OH
R
R
c.
alkohole III rzędowe: R – C – OH
R
Nazewnictwo tego związku tworzymy dodając końcówkę
−
ol do nazwy węglowodoru ( o tej
samej liczbie węgli).
Metody otrzymywania alkoholi
1)
Hydroliza fluorowcoalkanów
R
−
X + OH
−
→
R
−
OH + X
−
(X
−
Cl,Br,I)
!
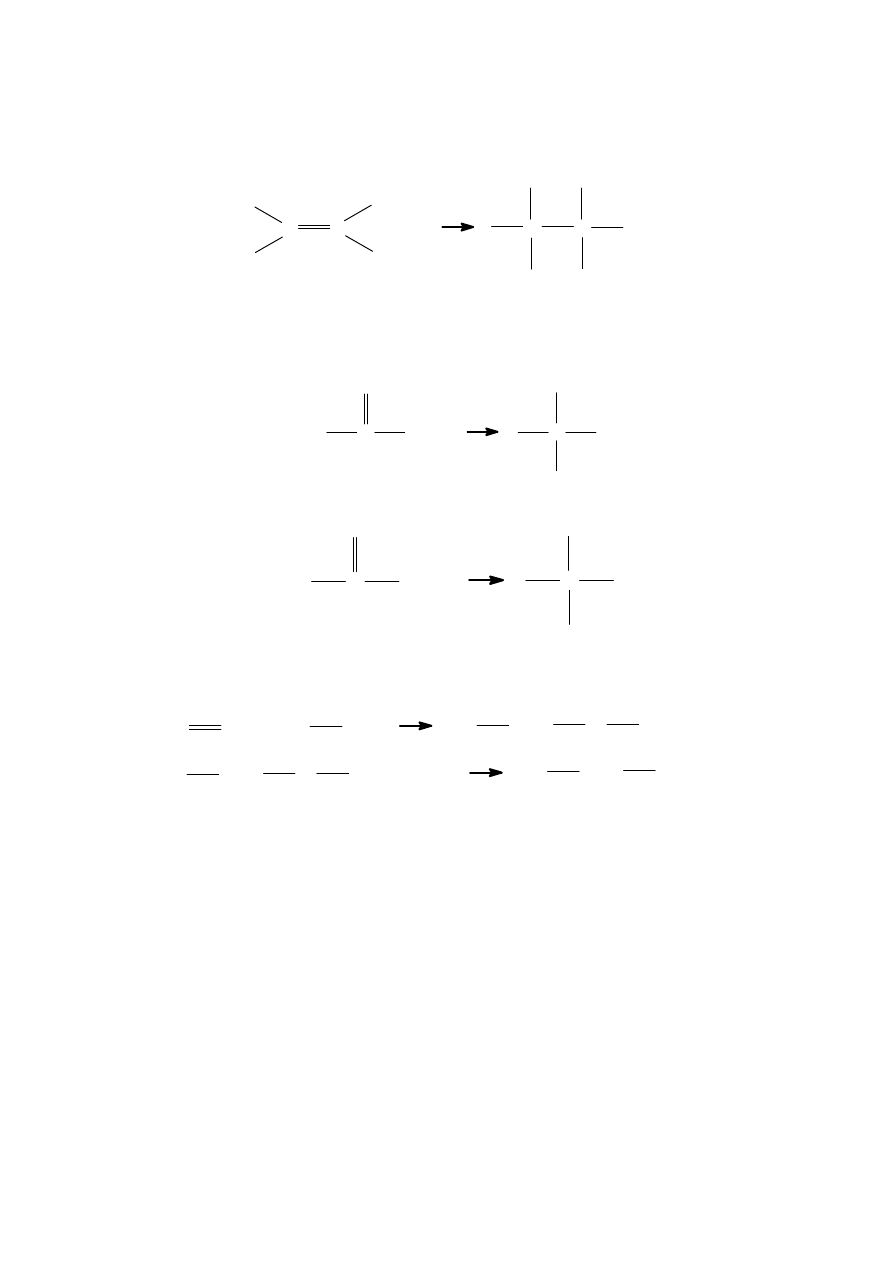
2)
Uwodnienie alkenów
C
C
H
H
H
H
+ H2O
C
C
OH
H
H
H
H
H
H
+
3)
Redukcja aldehydów i ketonów ( uwodornienie)
R
C
H
O
+ H2
R
OH
H
H
C
R
R
R
C
O
+ H2
R
OH
H
C
4)
Hydroliza estrów
CH2
CH2
O
SO3H
SO3H
+ HO
CH3
CH2
CH3
SO3H + HOH
O
CH2
CH3
H2SO4
OH +
CH2
5)
Działanie kwasu azotowego (III) na pierwszorzędowe aminy alifatyczne
6)
Przemysłowe metody otrzymywania alkoholi:
a)
redukcja katalityczna tlenku węgla gazowym wodorem – metanol
b)
katalizowana kwasem reakcja hydratacji etylenu – etanol; również inne reakcje
m.in. fermentacja zboża
Właściwości fizyczne
Alkohole, które zawierają do 10 atomów węgla są cieczami posiadającymi charakterystyczny
zapach, a pierwsze 4 mieszają się z wodą w każdym stosunku dzięki wytwarzającym się
wiązaniom wodorowym. Natomiast alkohole wyższe są substancjami stałymi, bezwonnymi.
Zarówno temperatury topnienia i wrzenia są wyższe od temperatur wrzenia i topnienia
węglowodorów i chlorowcopochodnych.
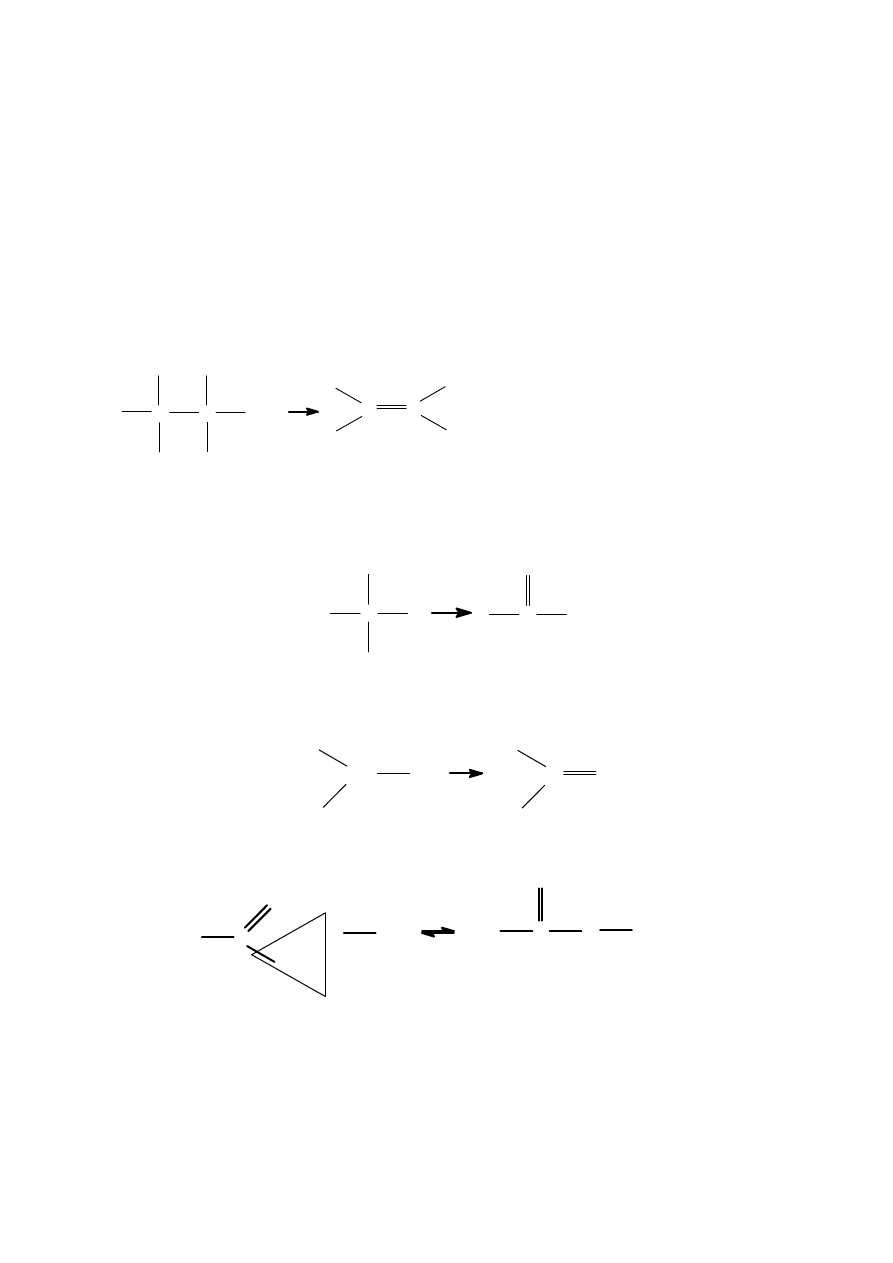
Właściwości chemiczne
1.
Podstawienie grupy hydroksylowej atomem fluorowca:
R
−
OH + HX
→
R
−
X + H
2
O (X
−
Cl,Br,I)
2.
Tworzenie alkoholanów
R
−
O
−
H + Na
→
R
−
O
−
Na + ½ H
2
3.
Reakcja eliminacji wody
C
C
H
H
H
H
+ H2O
C
C
OH
H
H
H
H
H
Al
2
O
3
4.
Reakcje utleniania:
-alkoholi I rzędowych do aldehydów
R
C
H
O
R
OH
H
H
C
+ O
-H2O
-alkoholi II rzędowych do ketonów
CH3
CH3
CH
OH
+O
-H
2
O
O
C
CH3
CH3
5.
Reakcja estryfikacji
CH3
C
O
OH
+ HO
CH3
+ H
+
CH3
CH3 + H2O
C
O
O
6.
Właściwości kwasowe
Alkohole reagują z Na, K, trudniej z Mg i Al. W wyniku reakcji wydziela się wodór i
powstaje związek jonowy zwany alkoholanem
R
−
O
−
H + Na
→
R
−
ONa + H
2
↑
Działając na alkoholany wodą otrzymamy wodorotlenek i wodny alkohol.

Charakterystyka niektórych alkoholi:
Metanol
−
produkuje się go na skalę przemysłową z produktów rozkładowej
destylacji drewna. Jest ważnym surowcem przemysłowym, stosowanym do produkcji
aldehydu mrówkowego, estrów metylowych i eterów metylowych. Stosowany jako
rozpuszczalnik. W organizmie utlenia się do kwasu mrówkowego; wywołuje duże
zakwaszenie krwi
−
kwasicę, działając głównie silnie na komórki siatkówki oka.
Etanol
−
otrzymuje się głównie w procesie fermentacji cukrów pod wpływem
drożdży. Jest ważnym surowcem przemysłowym, stosowanym do produkcji aldehydu
octowego, eteru etylowego, octanu etylu. Etanol jest także środkiem antyseptycznym.
Fenole
Fenole to związki w których grupa hydroksylowa jest połączona z pierścieniem
aromatycznym.
OH
Otrzymywanie fenoli
Fenol C
6
H
5
OH możemy otrzymać działając na chlorobenzen rozcieńczonym NaOH
w wysokiej temperaturze i pod zwiększonym ciśnieniem. Powstaje najpierw fenolan sodu,
który przekształca się w fenol na skutek działania CO
2
.
Właściwości fizyczne
Są to substancję stałe, posiadające charakterystyczny zapach, a ich rozpuszczalność
w wodzie wzrasta wraz ze wzrostem grup hydroksylowych w cząsteczce.
Właściwości chemiczne
1.
Właściwości kwasowe
Kwasowość fenolu jest mniejsza od kwasowości kwasów karboksylowych i H
2
CO
3
.
2.
Fenole reagują z zasadami, metalami lub tlenkami.
3.
Fenole reagują z solami żelaza (III) dając zwiazki kompleksowe
−
reakcje barwne służące
do wykrywania fenoli.
4.
Redukcja fenolu w obecności katalizatora i pod wysokim ciśnienie do cylkoheksanu
5.
Ulegają reakcjom fluorowcowania
−
pod wpływem Cl,Br, prowadzi do powstawania
(w przypadku Cl ) orto i para chlorofenoli a przedłużając chlorowania można otrzymać di
i trichloropochodną fenolu.
6.
Nitrowanie fenoli
−
powstaje mieszanina orto i para nitrofenoli
7.
Kondensacja pod wpływem kwasów i zasad z aldehydem mrówkowym.
Zagadnienia do przygotowania:
Budowa, podział, otrzymywanie, właściwości fizyczne i chemiczne oraz wykrywanie
alkoholi alifatycznych.
Odróżnianie alkoholi: monowodorotlenowych od poliwodorotlenowych oraz alkoholi I
−
,II
−
, III
−
rzędowych.
Napisać wzory strokturalne i określić ich rzędowość :
metanol,
2
−
propanol,
1
−
propanol,
2
−
metylo
−
2
−
propanol,
3
−
pentanol,
2
−
metylo
−
3,3
−
dietylo
−
1butanol,
fenol
(benzenol),
1,2,3
benzenotriol,
2
−
metylo
−
benzenol
Napisać przebieg reakcji:
CH
2
=CH
2
→
A
→
B
C
2
H
6
→
X
→
Y
→
Z
→
K
→
C
2
H
4
(OH)
2
1. SPRZĘT
1.1 Probówki
1.2 Łaźnia wodna
1.3 Palnik gazowy
1.4 Pipety
1.5 Papierki wskaźnikowe
2. ODCZYNNIKI
2.1
NaOH –wodorotlenek sodu
2.2
roztwór jodu w jodku potasowym – płyn Lugola
2.3
Na
2
CO
3
– węglan sodu
2.4
chlorek acetylu
2.5
1 M H
2
SO
4
– kwas siarkowy (VI)
2.6
metanol, etanol, butanolu, pentanolu
2.7
stężony roztwor K
2
Cr
2
O
7
– dwuchromian (VI) potasu
2.8
AgNO
3
– azotan srebra
2.9
NH
4
OH – wodorotlenek amonu
2.10
CuSO
4
– siarczan (VI) miedzi (II)
2.11
Odczynnik Lucasa
+ HBr
+ CH
3
ONa
Cl
2
NaOHaq
300
°
C
Al
2
O
3
Br
2
NaOHaq

Ć
wiczenie 1. Utlenianie alkoholu metylowego
Przebieg ćwiczenia:
1.
Do probówki wlać około 1cm
3
metanolu.
2.
Dodać 2cm
3
1 molowego roztworu H
2
SO
4
i około 2 cm
3
stężonego roztworu K
2
Cr
2
O
7
.
3.
Zawartość probówki ogrzewać. Po chwili można wyczuć ostry, charakterystyczny
zapach aldehydu mrówkowego.
Reakcje:
K
2
Cr
2
O
7
+ 4 H
2
SO
4
→
K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 4 H
2
O + 3 0
CH
3
OH +
→
HCHO + H
2
O
aldehyd mrówkowy
Zadania i pytania:
1. Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
1. Napisać reakcje przebiegu ćwiczenia.
Ć
wiczenie 2. Badanie rozpuszczalności alkoholi i ich odczynu w wodzie
Celem ćwiczenia jest zbadanie rozpuszczalności i odczynu alkoholi.
Wraz ze wzrostem długości łańcucha węglowego maleje rozpuszczalność alkoholi w wodzie.
Metanol i etanol mieszają się z wodą bez ograniczeń, natomiast 1
−
butanol i 1
−
pentanol
rozpuszczają się w wodzie tylko w nieznacznym stopniu. Alkohole nie przewodzą prądu
elektrycznego a ich wodny roztwór wodny wykazuje odczyn obojętny.
Przebieg ćwiczenia:
1.
Przygotować 4 probówki
2.
Do pierwszej probówki wlać 2 cm
3
metanolu
3.
Do drugiej probówki wlać 2 cm
3
etanolu
4.
Do trzeciej probówki wlać 2 cm
3
1
−
butanolu
5.
Do czwartej probówki wlać 2 cm
3
1
−
pentanolu
6.
Następnie dodać do wszystkich probówek po 2 cm
3
wody destylowanej i wstrząsać
celem wymieszania całości.
7.
Obserwować zawartość probówek i określić rozpuszczalność badanych alkoholi w
wodzie.
8.
Następnie za pomocą papierka uniwersalnego zbadać odczyn powstałych roztworów.
Zadania i pytania:
1. Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
2. Który z alkoholi rozpuszcza się w wodzie najlepiej a który najsłabiej.
3. Jakie było pH poszczególnych roztworów.
Ćwiczenie 3. Reakcja gliceryny z Cu(OH)
2
Cel ćwiczenia zbadanie zdolności gliceryny do tworzenia wiązań z miedzią. Grupa
hydroksylowa połączona z węglem dwurzędowym ma zdolność łączenia się z Cu(OH)
2
, dając
ciemnoniebieskie połączenie addycyjne z miedzią. Właściwość ta może być wykorzystana dla
wykrywania obecności alkoholu II
−
rzędowego.
Przebieg ćwiczenia:
1.
Do dwóch probówek wlać po1cm
3
rozcieńczonego roztworu CuSO
4
.
2.
Następnie dodać do obu probówek kilka kropli 2M roztworu NaOH, (wytrąca się
niebieski, galaretowaty osad Cu(OH)
2
).
3.
Do pierwszej probówki dodać kilka kropli roztworu A.
4.
Do drugiej probówki dodać kilka kropli roztworu B.
5.
W przypadku roztworu gliceryny następuje rozpuszczenie osadu i zmiana barwy na
intensywnie ciemnoniebieski.
Reakcje:
C
C
C
O
O
O
H
H
H
H
H
H
H
H
+ Cu(OH)2
H
H
H
H
H
H
Cu
H
O
O
O
C
C
C
H
H
H
H + 2H2O
H
H
H
O
O
O
C
C
C
Zadania i pytania:
1. W której próbie znajduje się gliceryna.
2. Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
3. Napisać reakcje przebiegu ćwiczenia.
Ćwiczenie 4. Rozróżnianie alkoholi I, II i III
−−−−
rzędowych.
Celem ćwiczenia jest rozróżnienie alkoholi I, II, III
−
rzędowych.
Próba Lucasa:
Z odczynnikiem Lucasa szybko reagują alkohole III
−
rzedowe, nieco wolniej II
−
rzędowe, a
I
−
rzędowe nie reagują wcale. Wyjątek stanowi alkohol allilowy, który szybko reaguje z
wydzieleniem ciepła.
Odczynnik Lucasa: 136g bezwodnego ZnCl
2
rozpuścić w 105g stężonego HCl z
jednoczesnym chłodzeniem. (Przygotowany przez prowadzących ćwiczenia.)
Przebieg ćwiczenia:
1.
Przygotować 3 probówki
2.
Do pierwszej wlać 0,5 cm
3
substancji I.
3.
Do drugiej wlać 0,5 cm
3
substancji II.
4.
Do trzeciej wlać 0,5 cm
3
substancji III.
5.
Do wszystkich probówek dodawać kolejno po 5 cm
3
odczynnika Lucasa .
6.
W probówce z alkoholem III
−
rzędowym powstaje zmętnienie, a po chwili tworzą się dwie
warstwy.
7.
W probówce z alkoholem II
−
rzędowym zmętnienie powstaje po około 5 min, a po 10
widoczne są 2 warstwy.
8.
W probówce z alkoholem I
−
rzędowym nie obserwuje się żadnych zmian.
Reakcje:
HCl + H2O
+ HCl
C
R
OH
R
ZnCl
2
R
R
C
R + H2O
+ HCl
R
Cl
R
C
C
R
OH
R
R
ZnCl
2
Zadania i pytania:
1.
Należy określić, w której próbce znajduje się alkohol I
−
rzędowy, II
−
rzędowy a także
III
−
rzędowy. Jak jest zasadnicza różnica w budowie tych alkoholi?
2.
Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
3.
Napisać reakcje przebiegu ćwiczenia.
Wyszukiwarka
Podobne podstrony:
W- 11- monograficzny, ALKOHOL A ZDROWIE
C6wiczenie 10=2E Estry=2Epdf =
C6wiczenie 7 =2D Aminokwasy=2C peptydy i bia=2Dka=2Epdf =
Z 11 Alkohole itd
psychozy alkoholowe 13.11.2005, Studia, Psychoprofilaktyka
Alkoholizm (11 stron) 4KRGM6N2DRS7GDIS4B77CD6RXIW2X5YTVMZYDOI
Zatrucia alkoholami niekonsumpcyjnymi - Nowa Klinika 2000 Vol 7 Nr 11-12, uczelnia awf, pierwsza pom
C6wiczenie 17 Polimery=2Epdf = Nieznany
Æwiczenie 11 Alkohole
Moczydłowska, J (1996) Doświadczanie poczucia winy u nieletnich prostytutek, Problemy alkoholizmu, 1
11 (Liche c5 84) Wsp c3 b3 c5 82uzale c5 bcnienie alkoholowe
Z 11 Alkohole etery
11.Alkohole, Notatki AWF, Biochemia
5 alkohole 07 11 2015 2014
alkohole 11
11.Alkohole i etery, MATERIAŁY NA STUDIA, Chemia
Æwiczenie 11 Alkohole
Z 11 Alkohole itd
więcej podobnych podstron