Copyright by Nowa Era Sp. z o.o.
Instrukcja dla zdającego
1. Sprawdź, czy arkusz egzaminacyjny zawiera 22 strony (zadania 1–47).
Ewentualny brak stron zgłoś nauczycielowi nadzorującemu egzamin.
2. Odpowiedzi do każdego zadania zapisz w miejscu na to przeznaczonym.
3. W rozwiązaniach zadań rachunkowych przedstaw tok rozumowania
prowadzący do ostatecznego wyniku oraz pamiętaj o podaniu jednostek.
4. Pisz czytelnie. Używaj długopisu/pióra tylko z czarnym tuszem/atramentem.
5. Nie używaj korektora, a błędne zapisy wyraźnie przekreślaj.
6. Pamiętaj, że zapisy w brudnopisie nie będą oceniane.
7. Podczas egzaminu możesz korzystać z Wybranych wzorów i stałych
fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki, linijki
oraz kalkulatora prostego.
8. Na tej stronie wpisz swój kod oraz imię i nazwisko.
9. Nie wpisuj żadnych znaków w części przeznaczonej dla osoby sprawdzającej.
Powodzenia!
PRÓBNY EGZAMIN MATURALNY
Z NOWĄ ERĄ
CHEMIA – POZIOM ROZSZERZONY
STYCZEŃ 2018
Czas pracy:
180 minut
Liczba punktów
do uzyskania: 60
KOD
* nieobowiązkowe
IMIĘ I NAZWISKO *
WPISUJE ZDAJĄCY
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
2 z 22
Informacja do zadań 1.–3.
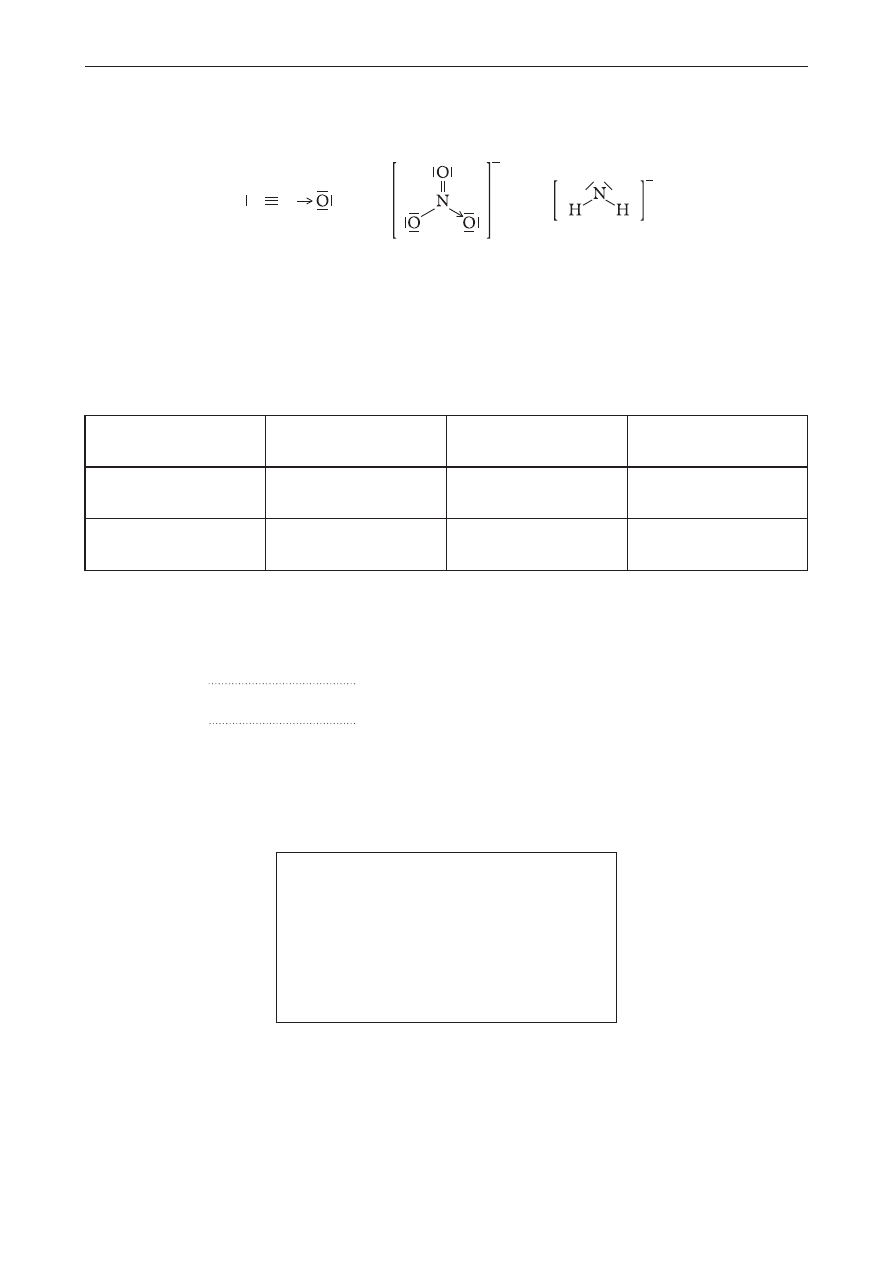
Poniżej przedstawiono wzory elektronowe trzech cząsteczek lub jonów (I–III), w których atomem
centralnym jest atom azotu.
N N
I
II
III
Zadanie 1. (0–2)
Uzupełnij tabelę, wpisując: nazwę typu hybrydyzacji orbitali walencyjnych atomu centralnego
(dygonalna, trygonalna lub tetraedryczna) oraz kształt cząsteczki / jonu (liniowy, kątowy, trójkąt
równoboczny, piramida trygonalna, tetraedryczny).
Numer wzoru
elektronowego
I
II
III
Typ hybrydyzacji
atomu centralnego
Kształt cząsteczki /
/ jonu
Zadanie 2. (0–1)
Napisz, ile wiązań σ i π występuje w cząsteczce związku chemicznego oznaczonego numerem I.
Liczba wiązań σ:
Liczba wiązań π:
Zadanie 3. (0–1)
Napisz wzór elektronowy (wzór kreskowy) cząsteczki, która według teorii Brønsteda–Lowry’ego
jest kwasem sprzężonym z jonem oznaczonym numerem III.
Więcej arkuszy znajdziesz na stronie: arkusze.pl
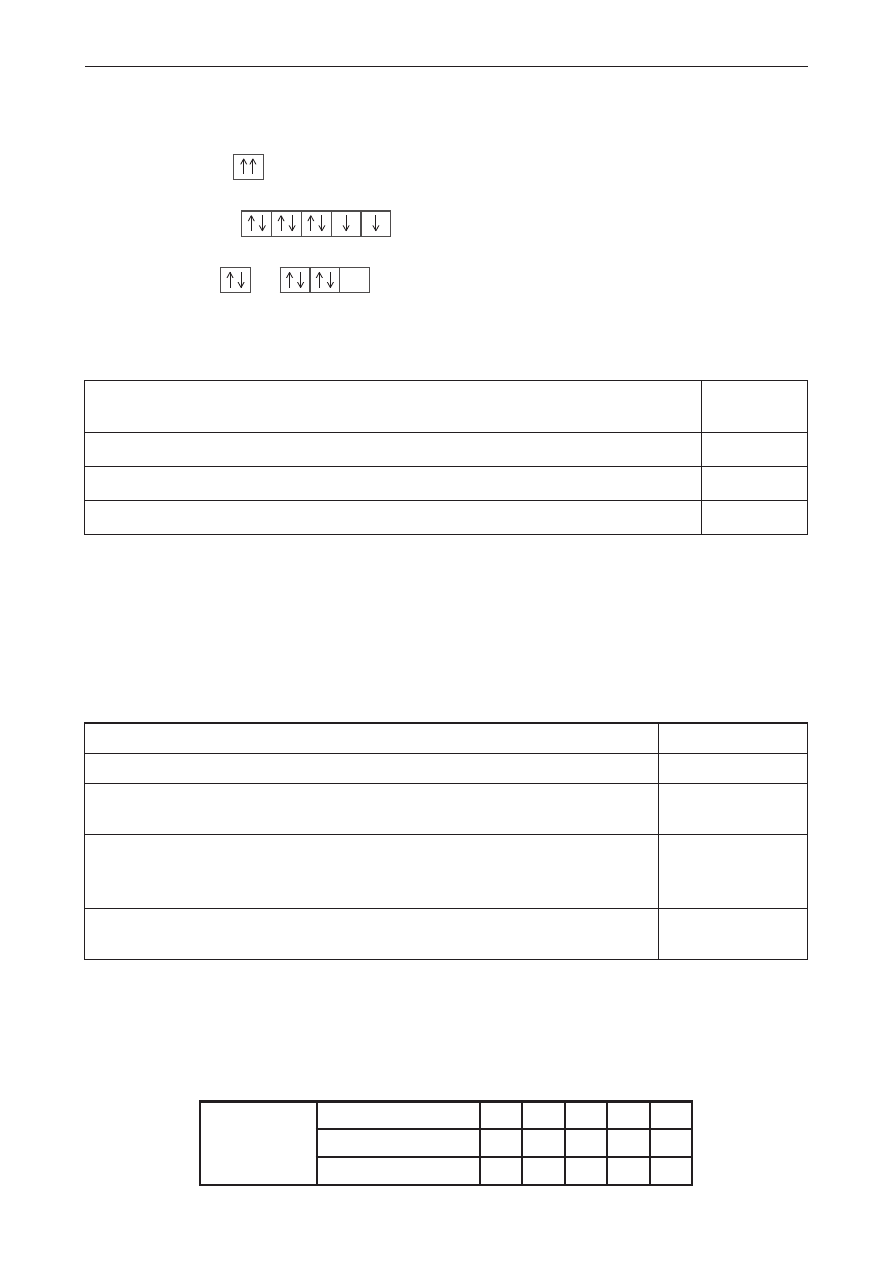
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
3 z 22
Zadanie 4. (0–1)
Poniżej przedstawiono skrócony zapis konfiguracji elektronowej atomów i jonu (I–III) za pomocą
schematu klatkowego. Niektóre z nich zostały zapisane niezgodnie z regułami.
I
38
Sr: [
36
Kr]
5s
II
28
Ni
2+
: [
18
Ar]
III
16
S: [
10
Ne]
3s
3p
Uzupełnij tabelę, wpisując oznaczenia cyfrowe (I–III) konfiguracji spełniających poszczególne
opisy. Jeśli opis nie jest spełniony przez żadną z konfiguracji, wpisz znak „–”.
Opis
Oznaczenie
cyfrowe
Zapis konfiguracji jest niezgodny z regułą Hunda.
Zapis konfiguracji jest niezgodny z zakazem Pauliego.
Zapis przedstawia konfigurację jonu mającego tyle samo elektronów, co atom żelaza.
Zadanie 5. (0–1)
W celu porównania właściwości fizycznych i chemicznych metali 1. i 2. grupy układu okresowego
o symbolach: Ca, K i Mg, uczniowie wykonali doświadczenia chemiczne.
Uzupełnij poniższą tabelę zawierającą obserwacje i wnioski uczniów, wpisując przy każdym
opisie symbol chemiczny tylko jednego metalu.
Obserwacje i wnioski uczniów
Symbol metalu
Kawałek metalu wyjęty z nafty jest miękki; można go kroić nożem.
Kawałek metalu wrzucony do zimnej wody nie roztwarza się; reakcja
zachodzi dopiero po podgrzaniu.
Kawałek metalu wrzucony do wody unosi się na jej powierzchni, formuje
w kulkę, roztwarza się z wydzieleniem dużej ilości energii.
Wydzielający się wodór zapala się.
Kawałek metalu wrzucony do zimnej wody roztwarza się; wydziela się gaz;
w czasie doświadczenia roztwór mętnieje.
Wypełnia
sprawdzający
Nr zadania
1.
2.
3.
4.
5.
Maks. liczba pkt
2
1
1
1
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
4 z 22
Informacja do zadań 6.–7.
Liczba koordynacyjna określa, ile atomów (lub jonów) jest połączonych bezpośrednio z danym
atomem (lub jonem). Można ją ustalić na podstawie stosunku promieni jonowych kationów (r
kationu
)
do promieni jonowych anionów(r
anionu
).
Liczba koordynacyjna
r
kationu
/ r
anionu
8
> 0,732
6
od 0,732 do 0,414
4
od 0,414 do 0,225
Poniższa tabela przedstawia wartości promieni jonowych wybranych jonów.
Symbol jonu
Wartość r [pm]
Cs
+
167
Cl
–
181
Na
+
97
Zn
2+
74
Na podstawie: Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, PWN, Warszawa 2007.
Zadanie 6. (0–1)
Uzupełnij tabelę, wpisując liczbę koordynacyjną dla kationu sodu w chlorku sodu i dla kationu
cezu w chlorku cezu.
Wzór związku chemicznego
Liczba koordynacyjna
NaCl
CsCl
Zadanie 7. (0–1)
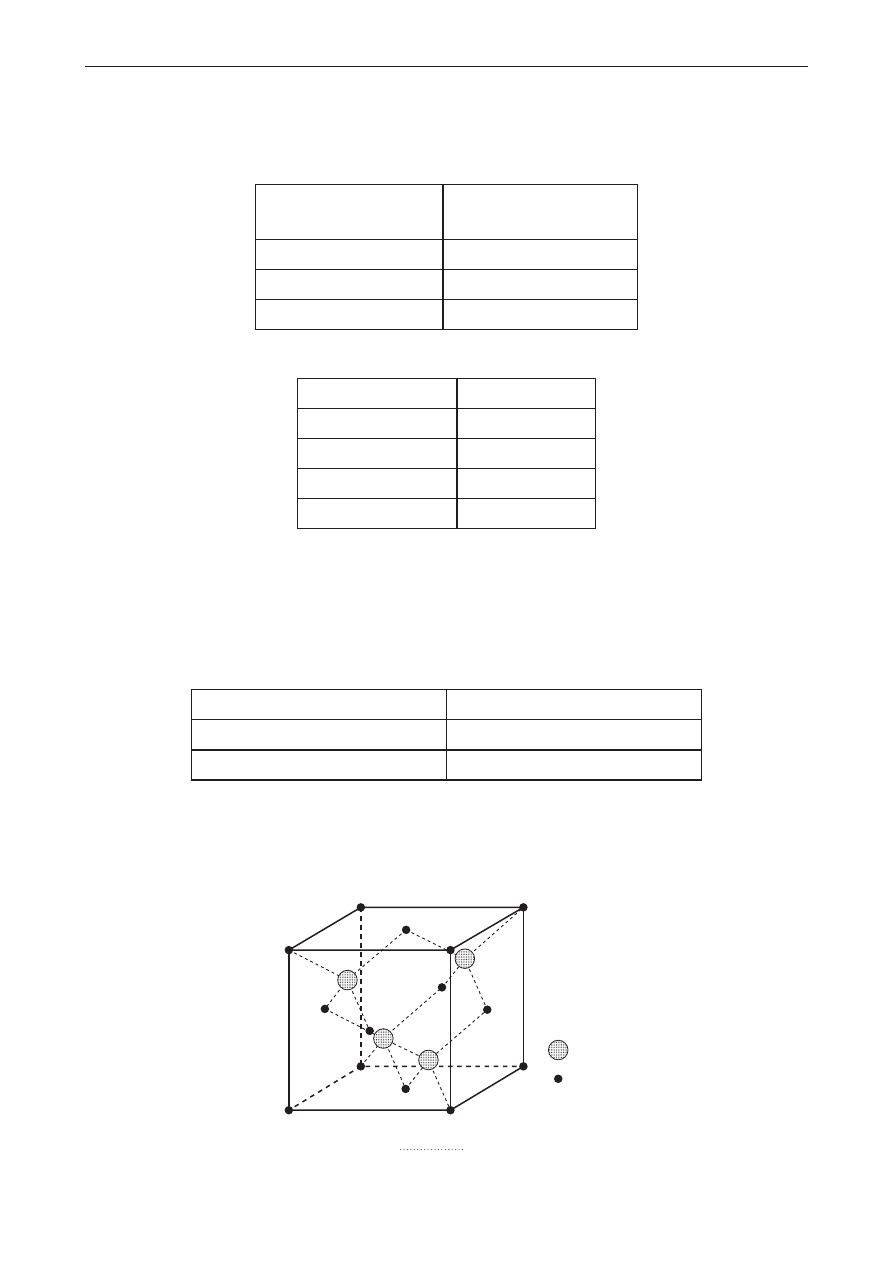
Na podstawie modelu sieci przestrzennej kryształu siarczku cynku określ liczbę koordynacyjną
jonów siarczkowych.
S
2–
Zn
2+
S
2–
Zn
2+
Liczba koordynacyjna jonów siarczkowych:
.
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
5 z 22
Informacja do zadań 8.–9.
Dane są wzory kilku tlenków azotu:
N
2
O, NO, N
2
O
3
, NO
2
, N
2
O
5.
Zadanie 8. (0–1)
Spośród podanych wzorów tlenków azotu wybierz te, których właściwość jest podana
w tabeli. Wpisz do tabeli ich wzory sumaryczne.
Właściwość
Wzór sumaryczny
Utlenia się łatwo tlenem z powietrza; powstaje brunatny gaz.
Ma kwasowy charakter chemiczny.
Nie reaguje z wodą.
Zadanie 9. (0–2)
NO
2
w niskich temperaturach dimeryzuje z wytworzeniem N
2
O
4
. N
2
O
4
w temperaturze pokojowej
to bezbarwna ciecz o gęstości 1,45 g ∙ cm
–3
, która reaguje z wodą z wytworzeniem dwóch tlenowych
kwasów azotu – kwasu azotowego(III) i kwasu azotowego(V), zgodnie z równaniem:
N
2
O
4
+ H
2
O
HNO
2
+ HNO
3
Do naczynia zawierającego nieznaną masę wody wprowadzono 14 cm
3
N
2
O
4
. Po zakończeniu
reakcji chemicznej naczynie otwarto i stwierdzono, że:
• N
2
O
4
przereagował całkowicie,
• masa mieszaniny poreakcyjnej wynosiła 25 g.
Oblicz masę wody, która nie uległa reakcji chemicznej zachodzącej w naczyniu. Przyjmij,
że proces prowadzony w naczyniu zachodzi z wydajnością 100%. Wynik podaj w gramach
z dokładnością do dwóch miejsc po przecinku.
Obliczenia:
Odpowiedź:
Wypełnia
sprawdzający
Nr zadania
6.
7.
8.
9.
Maks. liczba pkt
1
1
1
2
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
6 z 22
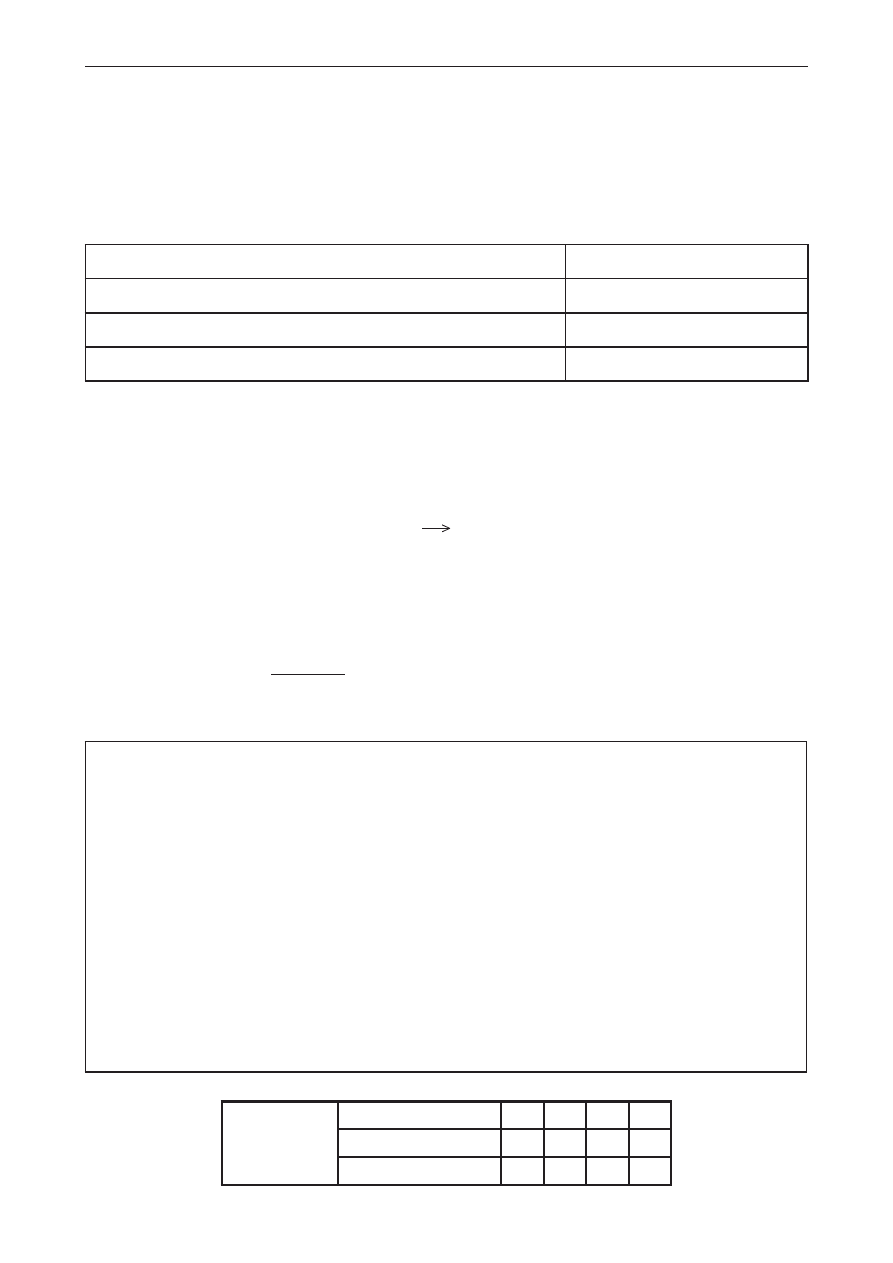
Informacja do zadań 10.–13.
W celu zbadania zachowania wodnego roztworu stearynianu potasu wobec wybranych odczynników
przeprowadzono doświadczenia I–III.
HCl
(aq)
stearynian
potasu
(aq)
NaOH
(aq)
stearynian
potasu
(aq)
CaCl
2(aq)
stearynian
potasu
(aq)
I
II
III
W dwóch probówkach zaobserwowano strącenie osadów, a w jednej probówce nie zaobserwowano
zmian świadczących o przebiegu reakcji chemicznej.
Zadanie 10. (0–1)
Napisz numer doświadczenia, podczas którego nie zaszła reakcja chemiczna.
Zadanie 11. (0–2)
Napisz w formie jonowej skróconej równania dwóch reakcji chemicznych, których skutkiem
było powstanie osadów w opisanych doświadczeniach.
Zadanie 12. (0–1)
Przed wykonaniem doświadczeń I–III zbadano pH roztworu stearynianu potasu. Odnotowano, że
odczyn nie był obojętny.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, która odpowiada za odczyn
roztworu stearynianu potasu przed wykonaniem doświadczeń chemicznych.
Zadanie 13. (0–1)
Poniżej przedstawiono wzór anionu stearynianowego.
Zaznacz na wzorze anionu stearynianowego część hydrofilową i część hydrofobową.
CH
2
CH
2
O
–
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C
O
H
3
C
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
7 z 22
Zadanie 14. (0–1)
W tabeli zebrano informacje o trzech typach układów dyspersyjnych oznaczonych literami: X, Y, Z.
X
Y
Z
Wielkość cząstek < 10
–9
m
Wielkość cząstek w zakresie:
10
–9
m – 5 ∙ 10
–7
m
Wielkość cząstek > 5 ∙ 10
–7
m
Cząstek nie można rozróżnić
optycznie.
Cząstki można rozróżnić pod
ultramikroskopem.
Cząstki można rozróżnić
gołym okiem lub pod
mikroskopem.
Cząstki przenikają przez bibułę filtracyjną.
Cząstki nie przenikają przez
bibułę filtracyjną.
Opisanym typom układów dyspersyjnych (X, Y, Z) przyporządkuj ich nazwy (roztwór
rzeczywisty, zawiesina, koloid).
Oznaczenie układu dyspersyjnego
Nazwa układu dyspersyjnego
X
Y
Z
Zadanie 15. (0–1)
Danych jest pięć mieszanin.
I. Mieszanina ciekłych węglowodorów – heptanu i oktanu.
II. Roztwór jodu w wodnym roztworze jodku potasu (tzw. płyn Lugola).
III. Mieszanina powstająca w wyniku działania tlenku węgla(IV) na wodę wapienną.
IV. Mieszanina wody i benzyny.
V. Mieszanina opiłków żelaza i piasku.
Uzupełnij tabelę, przyporządkowując tylko jeden numer mieszaniny (I–V) każdej z metod
rozdzielania.
Metoda rozdzielania
Numer mieszaniny
Sączenie przez sączek z bibuły
Rozdzielanie z wykorzystaniem rozdzielacza
Destylacja
Ekstrakcja jednego ze składników do rozpuszczalnika organicznego
Wypełnia
sprawdzający
Nr zadania
10.
11.
12.
13.
14.
15.
Maks. liczba pkt
1
2
1
1
1
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl

Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
8 z 22
Informacja do zadań 16.–18.
Dana jest mieszanina trzech substancji stałych: SiO
2
, Na
2
CO
3
i CaCO
3,
o masie 10,0 g i nieznanej
zawartości węglanów, co przedstawiono w poniższej tabeli.
Składnik
Liczba moli składnika
w mieszaninie o masie 10,0 g
SiO
2
0,111
Na
2
CO
3
y
CaCO
3
z
Zadanie 16. (0–3)
W celu określenia składu mieszaniny wykonano doświadczenie. W doświadczeniu stwierdzono,
że do całkowitego roztworzenia obydwu węglanów będących składnikami mieszaniny potrzeba
32,25 cm
3
kwasu solnego o stężeniu 2 mol ∙ dm
–3
. Zachodzą wówczas reakcje opisane równaniami:
Na
2
CO
3
+ 2 HCl
2 NaCl + H
2
O + CO
2
,
CaCO
3
+ 2 HCl
CaCl
2
+ H
2
O + CO
2
.
Uwzględniając podaną w tabeli liczbę moli SiO
2
w wyjściowej mieszaninie, oblicz, ile moli
Na
2
CO
3
i ile moli CaCO
3
zawierała wyjściowa mieszanina (oblicz y oraz z). Przyjmij następujące
wartości mas molowych: SiO
2
– 60 g ∙ mol
–1
, Na
2
CO
3
– 106 g ∙ mol
–1
, CaCO
3
– 100 g ∙ mol
–1
.
Wynik podaj z dokładnością do trzeciego miejsca po przecinku.
Obliczenia:
Odpowiedź:
Więcej arkuszy znajdziesz na stronie: arkusze.pl

Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
9 z 22
Zadanie 17. (0–2)
Zawarty w mieszaninie tlenek krzemu(IV) nie reaguje z kwasem solnym, a może reagować
z wodorotlenkiem sodu w procesie stapiania.
a) Napisz w formie cząsteczkowej równanie reakcji zachodzącej w czasie stapiania tlenku
krzemu(IV) z wodorotlenkiem sodu.
b) O jakim charakterze chemicznym tlenku krzemu(IV) świadczą jego zdolność do reakcji
z wodorotlenkiem sodu i brak reakcji z kwasem solnym?
Zadanie 18. (0–2)
Jaki odczyn miałby roztwór uzyskany po dodaniu do mieszaniny SiO
2
, Na
2
CO
3
i CaCO
3
wody
destylowanej? Uzasadnij odpowiedź, zapisując równanie reakcji w formie jonowej skróconej.
Odczyn:
Równanie reakcji chemicznej:
Zadanie 19. (0–1)
Uzupełnij poniższy tekst.
Siarczan(VI) wapnia jest trudno rozpuszczalny w wodzie. W temperaturze do 333 K w równowadze
z roztworem nasyconym pozostaje związek chemiczny o wzorze CaSO
4
∙ 2 H
2
O, którego nazwa
systematyczna to
. Ta sól uwodniona w przemyśle
jest znana pod nazwą . Hydrat ten – ogrzewany – traci częściowo
wodę dopiero w temperaturze wyższej od 373 K. Przechodzi wtedy w związek chemiczny o wzorze
, który po wymieszaniu z wodą wykazuje zdolność do jej
wiązania i twardnienia z utworzeniem porowatej, białej masy. Proces twardnienia można przedstawić
za pomocą następującego równania reakcji:
.
Wypełnia
sprawdzający
Nr zadania
16.
17.
18.
19.
Maks. liczba pkt
3
2
2
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
10 z 22
Informacja do zadań 20.–22.
Przeprowadzono doświadczenie przedstawione na schemacie.
Kl
(aq)
FeCl
3(aq)
W wyniku reakcji chemicznej powstaje ciekła, homogeniczna mieszanina, której naniesienie
na powierzchnię ziemniaka zabarwia ją na granatowo. Po dodaniu heksanu, wymieszaniu
i rozwarstwienu się roztworów faza wodna przyjęła barwę zielonkawą.
Zadanie 20. (0–1)
Napisz nazwę związku chemicznego, którego występowanie w ziemniaku wywołało zmiany
opisane w informacji do zadania.
Zadanie 21. (0–1)
Napisz w formie cząsteczkowej równanie reakcji zachodzącej w probówce.
Zadanie 22. (0–1)
Do mieszaniny poreakcyjnej opisanej w informacji do zadania dodano kilka kropli heksanu
i energicznie wymieszano zawartość probówki. Zaobserwowano wytworzenie się dwóch faz.
Oceń prawdziwość informacji. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest
fałszywa.
1. Heksan tworzy warstwę dolną, a woda – warstwę górną, ponieważ węglowodory
mają gęstość większą od gęstości wody.
P
F
2. Warstwa heksanu barwi się na fioletowo.
P
F
3. Po zanurzeniu elektrod w warstwie wodnej i przyłożeniu źródła napięcia
obserwuje się przewodzenie prądu elektrycznego przez mieszaninę poreakcyjną.
P
F
Więcej arkuszy znajdziesz na stronie: arkusze.pl
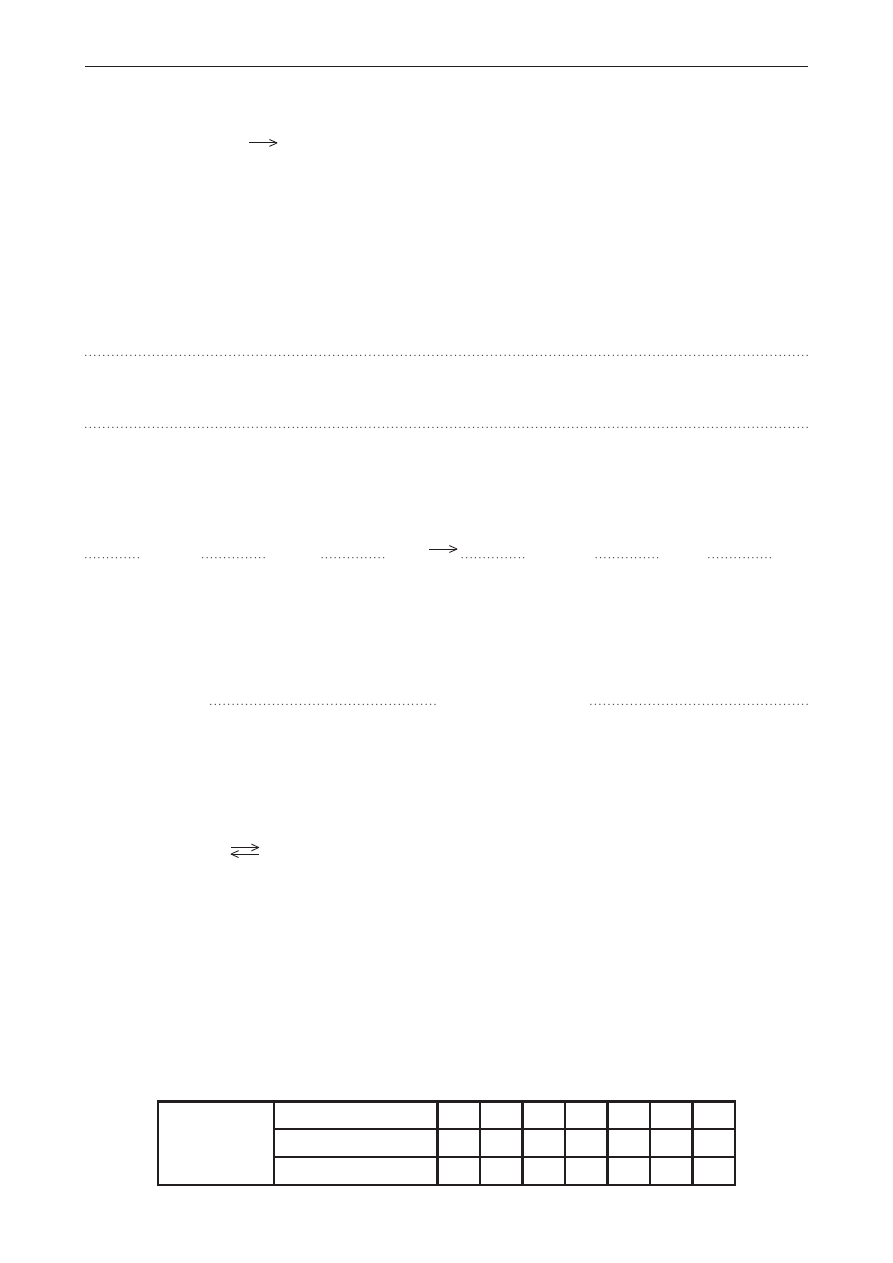
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
11 z 22
Informacja do zadań 23.–25.
W pewnych warunkach zachodzi reakcja opisana schematem:
Pb
3
O
4
+ Mn
2+
+ H
3
O
+
MnO
4
–
+ Pb
2+
+ H
2
O,
gdzie Pb
3
O
4
jest tlenkiem mieszanym o wzorze: 2 PbO · PbO
2
Zadanie 23. (0–2)
Napisz w formie jonowej, z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-
elektronowy), równania procesów redukcji i utleniania.
Równanie procesu redukcji:
Równanie procesu utleniania:
Zadanie 24. (0–1)
W poniższym schemacie uzupełnij współczynniki stechiometryczne.
Pb
3
O
4
+ Mn
2+
+ H
3
O
+
MnO
4
–
+ Pb
2+
+ H
2
O
Zadanie 25. (0–1)
Napisz wzór związku pełniącego funkcję utleniacza i podaj nazwę jonu pełniącego funkcję
reduktora.
Wzór utleniacza:
Nazwa reduktora:
Zadanie 26. (0–2)
Dwaj uczniowie sporządzili dwa roztwory dichromianu(VI) sodu o stężeniu 1 mol · dm
–3
. Jeden
z nich sporządził 250 cm
3
(roztwór 1.), a drugi – 500 cm
3
(roztwór 2.). W obydwu roztworach
ustaliła się równowaga między jonami Cr
2
O
7
2–
a jonami CrO
4
2–
, którą opisuje równanie:
Cr
2
O
7
2–
(aq)
+ H
2
O
(c)
2 CrO
4
2–
(aq)
+ 2 H
+
(aq)
.
Uzupełnij zdania tak, aby były prawdziwe. Wybierz i podkreśl jedno sformułowanie spośród
podanych w każdym nawiasie.
Po ustaleniu się stanu równowagi w roztworach 1. i 2. zależność stężeń molowych jonów CrO
4
2–
jest
następująca: (stężenia są sobie równe / stężenie w roztworze 1. jest większe / stężenie w roztworze
2. jest większe ). Po zmieszaniu roztworów (stężenia molowe jonów CrO
4
2–
i Cr
2
O
7
2–
nie uległy
zmianie / zwiększyło się stężenie jonów CrO
4
2–
/ zmniejszyło się stężenie jonów Cr
2
O
7
2–
). Zmieszanie
obydwu roztworów (spowoduje przesunięcie stanu równowagi w stronę tworzenia produktów /
spowoduje przesunięcie stanu równowagi w stronę tworzenia substratów / nie zmieni położenia
stanu równowagi).
Wypełnia
sprawdzający
Nr zadania
20.
21.
22.
23.
24.
25.
26.
Maks. liczba pkt
1
1
1
2
1
1
2
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
12 z 22
Informacja do zadań 27.–28.
Poniżej przedstawiono cztery wykresy (A–D) zmian energii wewnętrznej podczas przebiegu reakcji
chemicznej.
En
er
gi
a w
ew
nęt
rzn
a, kJ
Czas, s
A
En
er
gi
a w
ew
nęt
rzn
a, kJ
Czas, s
B
En
er
gi
a w
ew
nęt
rzn
a, kJ
Czas, s
C
En
er
gi
a w
ew
nęt
rzn
a, kJ
Czas, s
D
Zadanie 27. (0–1)
Które wykresy przedstawiają reakcje egzoenergetyczne, a które – reakcje endoenergetyczne.
Uzupełnij tabelę, wpisując odpowiednie oznaczenia wykresów (A–D).
Wykresy przedstawiające reakcje egzoenergetyczne
Wykresy przedstawiające reakcje endoenergetyczne
Zadanie 28. (0–1)
O pewnej reakcji chemicznej wiadomo, że jej energia aktywacji ma wartość trzykrotnie mniejszą
oraz przeciwny znak do entalpii tej reakcji.
Wskaż wykres, który poprawnie przedstawia zmiany energetyczne opisanej reakcji chemicznej.
Zmiany energetyczne poprawnie przedstawia wykres:
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
13 z 22
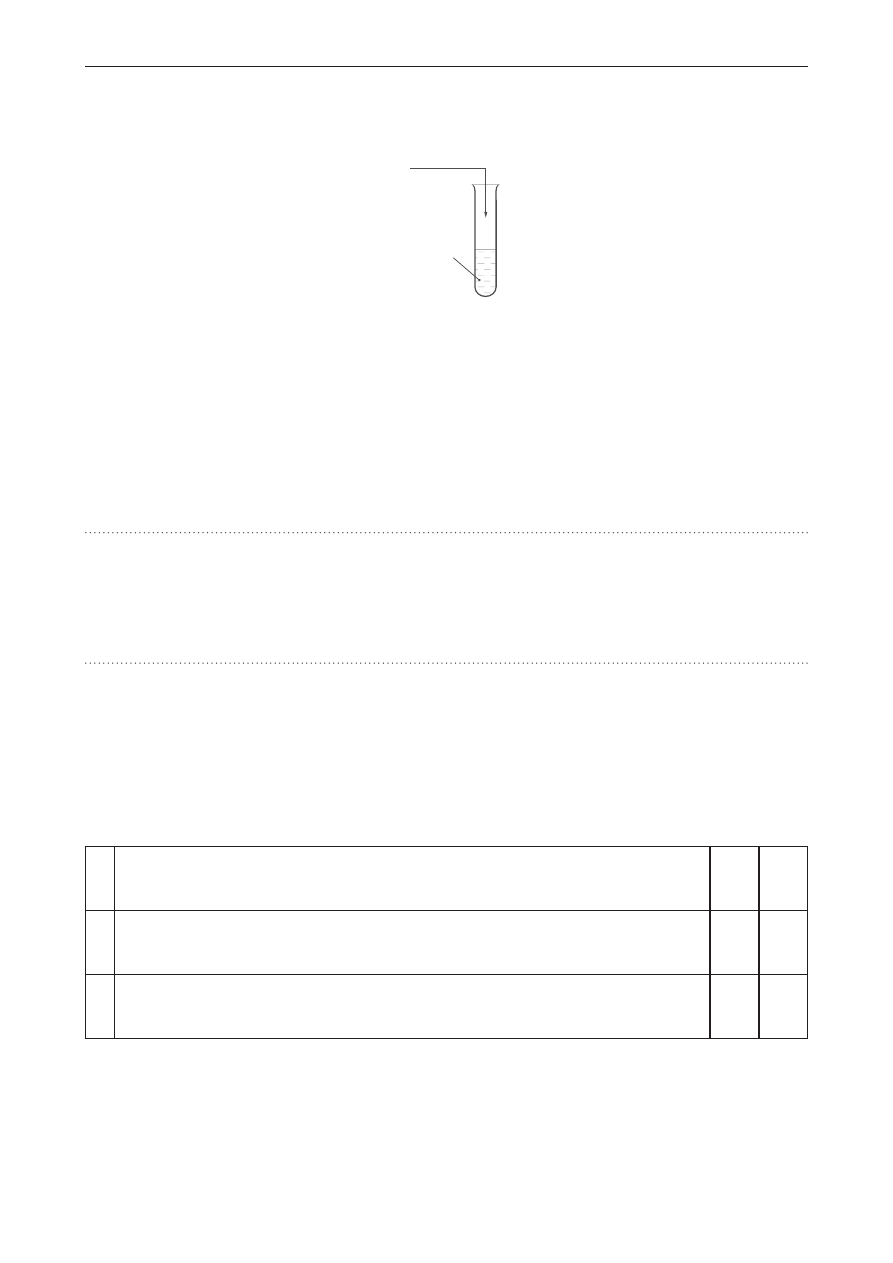
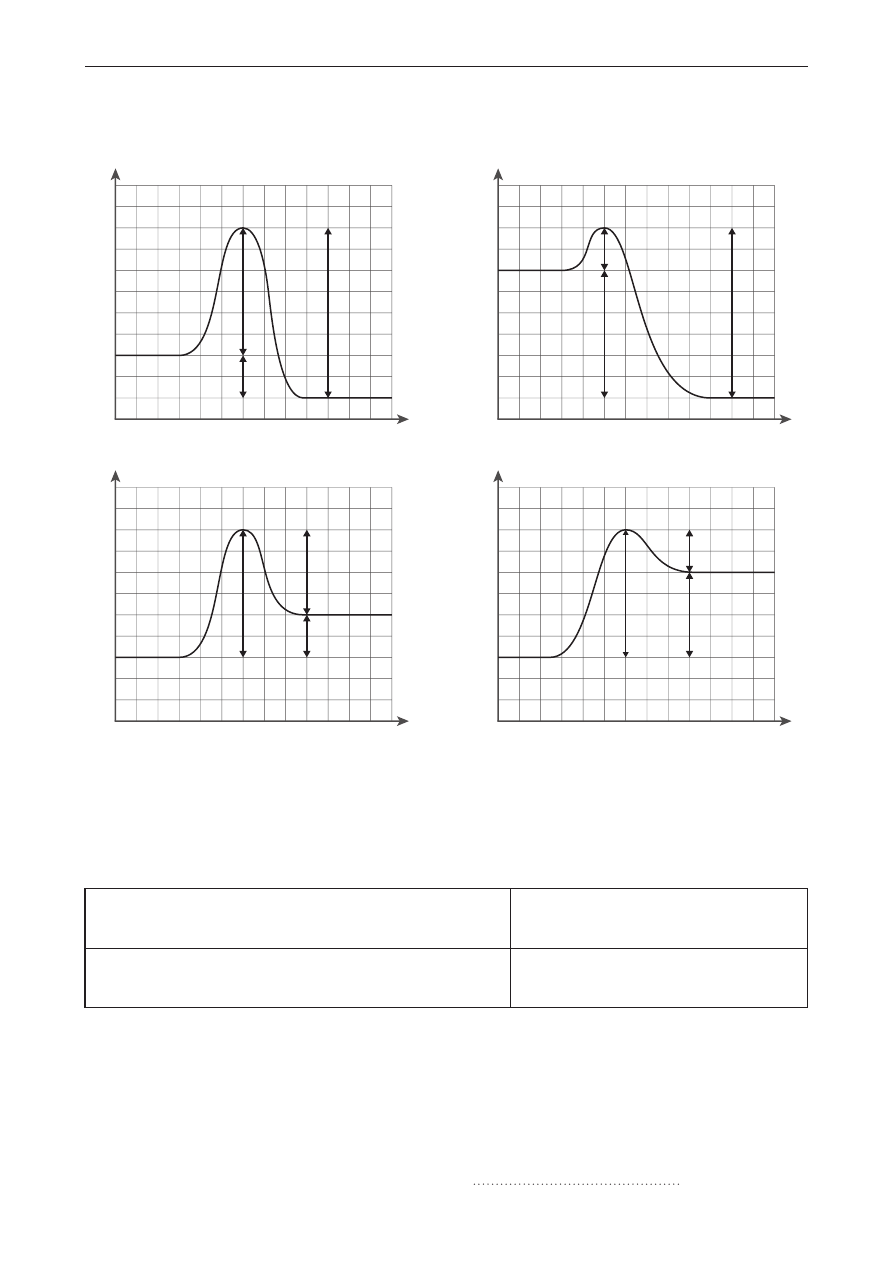
Informacja do zadań 29.–31.
Przeprowadzono dwa doświadczenia przedstawione na schematach.
blaszka aluminiowa
FeSO
4(aq)
blaszka miedziana
AgNO
3(aq)
I
II
Zadanie 29. (0–2)
Napisz w formie jonowej skróconej równania reakcji zachodzących w obydwu doświadczeniach.
Doświadczenie I:
Doświadczenie II:
Zadanie 30. (0–1)
Oceń, co stanie się z masą płytek zanurzonych w roztworach na skutek zachodzących reakcji
chemicznych. Podkreśl właściwe określenie w każdym nawiasie.
1. W doświadczeniu I masa płytki (zwiększy się / zmniejszy się / nie zmieni się).
2. W doświadczeniu II masa płytki (zwiększy się / zmniejszy się / nie zmieni się).
Zadanie 31. (0–1)
Podkreśl informacje prawdziwe dla doświadczenia II.
1. Na skutek zachodzącej reakcji chemicznej roztwór przyjmuje barwę niebieską.
2. Na skutek zachodzącej reakcji chemicznej z probówki wydziela się bezbarwny i bezwonny gaz.
3. Brak objawów reakcji.
4. Na skutek zachodzącej reakcji chemicznej metalowa płytka pokrywa się srebrzystym osadem.
Zadanie 32. (0–1)
Dane są dwa roztwory: kwasu azotowego(III) i kwasu azotowego(V), o których wiadomo, że stężenia
anionów reszt kwasowych są w nich równe.
Uzupełnij poniższe zdanie, podkreślając poprawne sformułowanie.
W opisanym przypadku pH roztworu kwasu azotowego(III) jest (wyższe od / niższe od / równe) pH
roztworu kwasu azotowego(V).
Wypełnia
sprawdzający
Nr zadania
27.
28.
29.
30.
31.
32.
Maks. liczba pkt
1
1
2
1
1
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
14 z 22
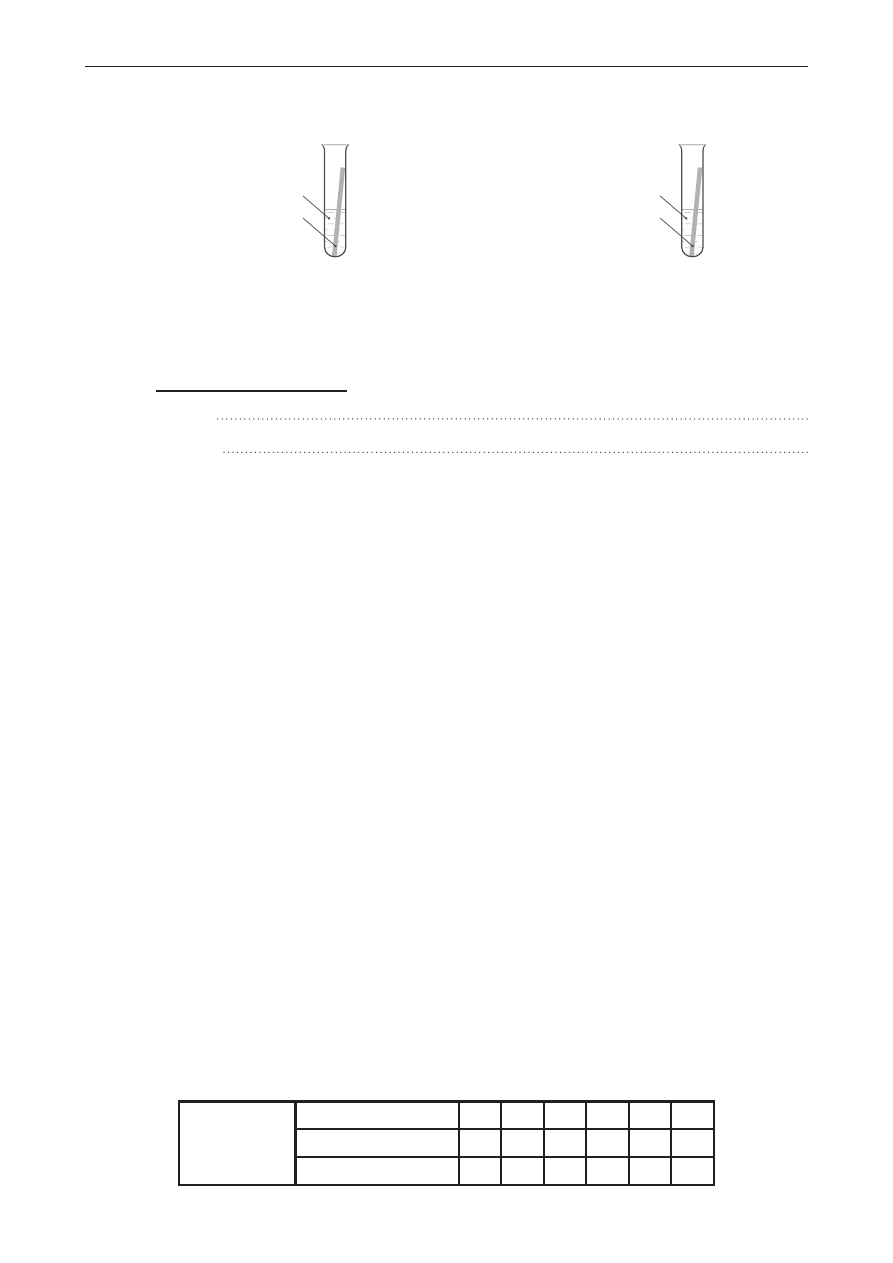
Zadanie 33. (0–1)
Reakcją następczą nazywamy proces, podczas którego z pewnego substratu X powstaje produkt
przejściowy Y, z którego podczas kolejnej przemiany powstaje produkt końcowy Z. Można
to w uproszczeniu zapisać: X
Y
Z.
W czasie takiego procesu początkowo duże stężenie substratu X zmniejsza się. Stężenie produktu
przejściowego Y początkowo się zwiększa, następnie przechodzi przez maksimum, po czym stale
się zmniejsza. Stężenie produktu końcowego Z początkowo zwiększa się powoli, po czym zaczyna
szybko rosnąć. Zmiany stężeń substratu i produktów w czasie przedstawiono na wykresie.
St
ężenie s
ubs
tra
tu l
ub p
ro
du
kt
u,
m
ol · dm
–3
Czas, s
I
II
III
Symbolom poszczególnych substratów i produktów X, Y i Z przypisz numery krzywych (I–III),
które poprawnie przedstawiają zmianę ich stężenia. W tym celu uzupełnij poniższą tabelę,
wpisując odpowiednie numery krzywych.
Symbol substratu lub
produktu
X
Y
Z
Numer krzywej
na wykresie
Informacja do zadań 34.–35.
Dane są trzy roztwory wodorotlenków metali 1. i 2. grupy układu okresowego. Stężenia kationów
metali w tych roztworach przedstawiono w tabeli.
Roztwór I
[Ba
2+
] = 0,5 mol · dm
–3
Roztwór II
[K
+
] = 0,5 mol · dm
–3
Roztwór III
[Na
+
] = 0,4 mol · dm
–3
Zadanie 34. (0–1)
Uszereguj roztwory I–III według wzrastającej wartości pH.
Więcej arkuszy znajdziesz na stronie: arkusze.pl

Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
15 z 22
Zadanie 35. (0–2)
Ustal, jakie powinno być stężenie molowe kwasu chlorowego(III), aby w jego roztworze
znajdowała się liczba kationów wodoru dziesięciokrotnie mniejsza niż liczba anionów
wodorotlenkowych w roztworze III. Wynik zapisz w zaokrągleniu do jednego miejsca
po przecinku.
Obliczenia:
Odpowiedź:
Informacja do zadań 36.–37.
Jedną z metod otrzymywania tlenu jest elektroliza wody. W tym procesie, w wyniku przepływu
prądu elektrycznego, dochodzi do rozkładu wody. Podczas elektrolizy na elektrodach zachodzą
następujące procesy:
katoda: 2 H
2
O + 2e
–
H
2
+ 2 OH
–
anoda: 2 H
2
O
4 H
+
+ O
2
+ 4e
–
Zadanie 36. (0–1)
Na podstawie równań reakcji połówkowych zachodzących na katodzie i anodzie, napisz
równanie sumarycznej reakcji zachodzącej podczas elektrolizy wody.
Zadanie 37. (0–1)
Jaki będzie odczyn roztworu po przeprowadzeniu procesu elektrolizy, jeśli w wyniku przepływu
prądu elektrycznego rozkładowi uległo 0,5% całkowitej liczby cząsteczek wody?
Wypełnia
sprawdzający
Nr zadania
33.
34.
35.
36.
37.
Maks. liczba pkt
1
1
2
1
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
16 z 22
Informacja do zadań 38.–39.
W poniższej tabeli zestawiono wartości K
a
wybranych o-, m-, p- podstawionych pochodnych fenolu.
Podstawnik
Położenie podstawnika
o-
m-
p-
–Cl
2,75 ∙ 10
–9
7,59 ∙ 10
–10
3,89 ∙ 10
–10
–Br
3,54 ∙ 10
–9
9,33 ∙ 10
–10
4,27 ∙ 10
–10
–I
3,09 ∙ 10
–9
9,33 ∙ 10
–10
4,68 ∙ 10
–10
Wartości K
a
podano na podstawie: CRC Handbook of Chemistry and Physics, 93rd Edition, CRC Press, 2012.
Zadanie 38. (0–1)
Na podstawie tabeli określ, czy wymienione monopodstawione pochodne fenolu są kwasami
silniejszymi, czy słabszymi od fenolu. Odpowiedź uzasadnij.
Zadanie 39. (0–1)
Przygotowano roztwory wodne soli sodowych wszystkich fenoli opisanych w tabeli. Stężenie
wszystkich roztworów było jednakowe.
Napisz nazwę tej soli sodowej, której roztwór wodny ma najniższe pH.
Informacja do zadań 40.–43.
Poniżej zapisano wzory półstrukturalne trzech związków organicznych oznaczonych cyframi I–III.
CH
3
- CH
2
- C C - CH
2
- CH
3
CH
3
- CH C - CH
2
- CH
2
- CH
3
Br
H - C C - H
I
II
III
Zadanie 40. (0–1)
Na podstawie analizy budowy cząsteczki związku III ustal, czy może on
występować
w postaci izomerów cis-trans. Odpowiedź uzasadnij.
Więcej arkuszy znajdziesz na stronie: arkusze.pl

Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
17 z 22
Zadanie 41. (0–1)
Związek I poddano działaniu nadmiaru bromowodoru, w wyniku czego powstał związek W.
Napisz (stosując wzory półstrukturalne związków organicznych) równanie reakcji związku I
z nadmiarem bromowodoru.
Zadanie 42. (0–1)
Narysuj wzór półstrukturalny izomeru związku III, o którym wiadomo, że nie odbarwia wody
bromowej, a wszystkie atomy węgla w jego cząsteczce mają jednakową rzędowość.
Zadanie 43. (0–1)
Związek I w reakcji z wodą w obecności katalizatora siarczanu(VI) rtęci(II) i kwasu siarkowego(VI)
ulega tzw. reakcji Kuczerowa (addycji wody do wiązania potrójnego). Produktem jest keton. Reakcji
Kuczerowa ulega także związek II.
Oceń, czy za pomocą próby Tollensa można rozróżnić organiczne produkty reakcji Kuczerowa
związków I i II. Uzasadnij odpowiedź.
Wypełnia
sprawdzający
Nr zadania
38.
39.
40.
41.
42.
43.
Maks. liczba pkt
1
1
1
1
1
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
18 z 22
Zadanie 44. (0–2)
Znakowanie izotopowe to metoda umożliwiająca zbadanie mechanizmu reakcji chemicznej. Fenol
znakowany izotopowo, czyli zawierający atomy izotopu
18
O zamiast atomów tlenu
16
O, reaguje
z zasadą sodową zawierającą atomy tlenu
16
O. Poniżej przedstawiono zapis tej reakcji chemicznej.
18
OH
+ Na
16
OH
18
ONa
+ H
2
16
O
Powstają fenolan sodu zawierający izotopy tlenu
18
O oraz cząsteczka wody zbudowana
z izotopów tlenu
16
O. Dzięki temu uzyskuje się informację, że w trakcie reakcji od cząsteczki fenolu
odłączany jest tylko kation wodoru H
+
, który następnie łączy się z anionem OH
–
pochodzącym
z zasady sodowej, tworząc cząsteczkę wody.
Wykorzysując metodę znakowania izotopowego, zbadano mechanizmy reakcji kwasów
karboksylowych z alkoholami i zasadami. Dokończ poniższe równiania reakcji w formie
cząsteczkowej, stosując wzory półstrukturalne związków organicznych. Przy wszystkich atomach
tlenu wpisz ich liczby masowe.
H
3
C - C
18
O
18
OH
+ Na
16
OH
H
3
C - C
18
O
18
OH
+ CH
3
CH
2
16
OH
H
+
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
19 z 22
Zadanie 45. (0–1)
Aminy, podobnie jak alkohole, można przekształcić w alkeny, np. w reakcji eliminacji Hofmanna.
W pierwszym etapie aminę poddaje się metylowaniu w reakcji z nadmiarem jodometanu.
Produktem jest czwartorzędowa sól amoniowa, która następnie, po ogrzewaniu z tlenkiem
srebra(I) jako zasadą, ulega eliminacji, w wyniku czego powstaje alken oraz odpowiednia amina
trzeciorzędowa (np. heksyloamina przekształcana jest w heks-1-en i trimetyloaminę).
CH
3
– CH
2
– CH
2
– CH
2
– CH
2
– CH
2
– NH
2
CH
3
– CH
2
– CH
2
– CH
2
– CH
2
– CH
2
– N
+
– CH
3
I
–
CH
3
CH
3
CH
3
I
jodek heksylotrimetyloamoniowy
Ag
2
O, H
2
O, ogrzewanie
CH
3
– CH
2
– CH
2
– CH
2
– CH = CH
2
+
N
CH
3
CH
3
H
3
C
Na podstawie: McMurry J., Chemia organiczna, PWN Warszawa 2007, s. 912–913.
Uzupełnij schemat przemian ilustrujących przebieg eliminacji Hofmanna dla podanej aminy,
zakładając, że głównym produktem tego procesu jest alken, który nie ma izomerów cis-trans.
Napisz wzory półstrukturalne odpowiednich związków chemicznych.
Ag
2
O, H
2
O, ogrzewanie
CH
3
– CH
2
– CH
2
– CH – NH
2
CH
3
CH
3
I
N
CH
3
CH
3
H
3
C
Wypełnia
sprawdzający
Nr zadania
44.
45.
Maks. liczba pkt
2
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
20 z 22
Zadanie 46. (0–2)
Poniżej przedstawiono wzory pięciu cukrów oznaczonych literami A–E.
H
H
H
OH
H
OH
CH
2
OH
CHO
A
CH
2
OH
O
H
OH
H
HO
H
OH
OH
H
H
B
O
CH
2
OH
OH
H
HO
OH
CH
2
OH
H
H
C
CH
2
OH
O
H
OH
H
HO
H
OH
H
H
CH
2
OH
O
H
OH
H
OH
H
OH
H
H
O
D
O
CH
2
OH
OH
H
HO
CH
2
OH
H
H
CH
2
OH
O
H
OH
H
HO
H
O
OH
H
H
E
Uzupełnij tabelę – wstaw znak „x”, jeśli dana cecha może być cechą cukru.
Cukier jest aldozą
Cukier jest ketozą
Cukier ma właściwości
redukujące
A
B
C
D
E
Więcej arkuszy znajdziesz na stronie: arkusze.pl

Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
21 z 22
Zadanie 47. (0–1)
Gąbczasta encefalopatia bydła, zwana potocznie chorobą szalonych krów, jest spowodowana
gromadzeniem się w ośrodkowym układzie nerwowym nieprawidłowej izoformy białka prionowego
PrP. Białko prionu występuje w dwóch formach: prawidłowej PrP
C
, kodowanej przez gen PRNP,
oraz nieprawidłowej PrP
Sc
, powstającej w wyniku konwersji formy prawidłowej. Mechanizm
przekształcania się formy prawidłowej w nieprawidłową nie został dotychczas wyjaśniony.
O obu izoformach wiadomo, że różnią się strukturą przestrzenną przy identycznej sekwencji
aminokwasowej. W strukturze PrP
C
obecne są dwie α-helisy i dwie β-harmonijki, a w formie PrP
Sc
przeważają struktury typu β.
Oceń prawdziwość informacji. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest
fałszywa.
1. Izoformy PrP
C
i PrP
Sc
różnią się strukturą pierwszorzędową.
P
F
2. α-helisa i β-harmonijka to przykłady struktur drugorzędowych białka.
P
F
3.
Konwersja prawidłowej formy prionu PrP
C
do formy PrP
Sc
odpowiedzialnej
za chorobę jest związana ze zmianą struktury drugorzędowej łańcucha
polipeptydowego.
P
F
Wypełnia
sprawdzający
Nr zadania
46.
47.
Maks. liczba pkt
2
1
Uzyskana liczba pkt
Więcej arkuszy znajdziesz na stronie: arkusze.pl

Próbny egzamin maturalny z Nową Erą
Chemia – poziom rozszerzony
22 z 22
BRUDNOPIS (nie podlega ocenie)
Więcej arkuszy znajdziesz na stronie: arkusze.pl
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron