
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Sylwia Wośko
Wykonywanie jałowych leków recepturowych
322[10].Z3.06
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr n. farm. Elwira Telejko
dr n. farm. Przemysław Drożyński
Opracowanie redakcyjne:
mgr Alina Krawczak
Konsultacja:
dr hab. inż. Henryk Budzeń
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 322[10].Z3.06
Wykonywanie jałowych leków recepturowych zawartego w modułowym programie nauczania
dla zawodu technik farmaceutyczny.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Materiał nauczania
7
4.1. Wyjaławianie i dezynfekcja pomieszczeń i sprzętu do pracy aseptycznej
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
10
4.1.3. Ćwiczenia
10
4.1.4. Sprawdzian postępów
12
4.2. Podział i charakterystyka postaci leków jałowych
13
4.2.1. Materiał nauczania
13
4.2.2. Pytania sprawdzające
17
4.2.3. Ćwiczenia
17
4.2.4. Sprawdzian postępów
21
4.3. Metody sporządzania kropli i maści do oczu
22
4.3.1. Materiał nauczania
22
4.3.2. Pytania sprawdzające
25
4.3.3. Ćwiczenia
26
4.3.4. Sprawdzian postępów
27
4.4. Receptura antybiotyków
28
4.4.1. Materiał nauczania
28
4.4.2. Pytania sprawdzające
28
4.4.3. Ćwiczenia
29
4.4.4. Sprawdzian postępów
30
5. Sprawdzian osiągnięć
31
6. Literatura
36

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik ten pomoże Ci w przyswojeniu wiedzy teoretycznej oraz opanowaniu
umiejętności wykonywania jałowych leków recepturowych, a także w organizacji procesu
samokształcenia.
W poradniku zamieszczono:
−
wykaz niezbędnej wiedzy i umiejętności, które powinieneś posiadać przystępując do nauki
wykonywania jałowych leków recepturowych,
−
wykaz wiedzy i umiejętności, jakie ukształtujesz w czasie pracy z poradnikiem,
−
materiał nauczania omawiający zagadnienia dotyczące wykonywania jałowych postaci leku
recepturowego, pozwalający samodzielnie przygotować się do ćwiczeń,
−
pytania sprawdzające opanowanie przez Ciebie podanych treści,
−
ćwiczenia umożliwiające nabycie praktycznych umiejętności z wykorzystaniem zalecanych
metod nauczania i środków dydaktycznych,
−
sprawdzian postępów, który po zrealizowaniu każdego podrozdziału pozwoli Ci ocenić
stan Twojej wiedzy oraz wskazać materiał nauczania, który nie został przez Ciebie w pełni
opanowany,
−
zestaw zadań testowych potwierdzający opanowanie wiedzy i umiejętności z zakresu całej
jednostki. Rozwiązanie przykładowego testu, zgodnie z instrukcją będzie dla ciebie formą
treningu przed testem zaplanowanym przez nauczyciela.
−
wykaz literatury związany z tematyką jednostki modułowej.
Na każdym etapie nauki możesz poprosić nauczyciela o pomoc i wyjaśnienie trudnych dla
Ciebie kwestii.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
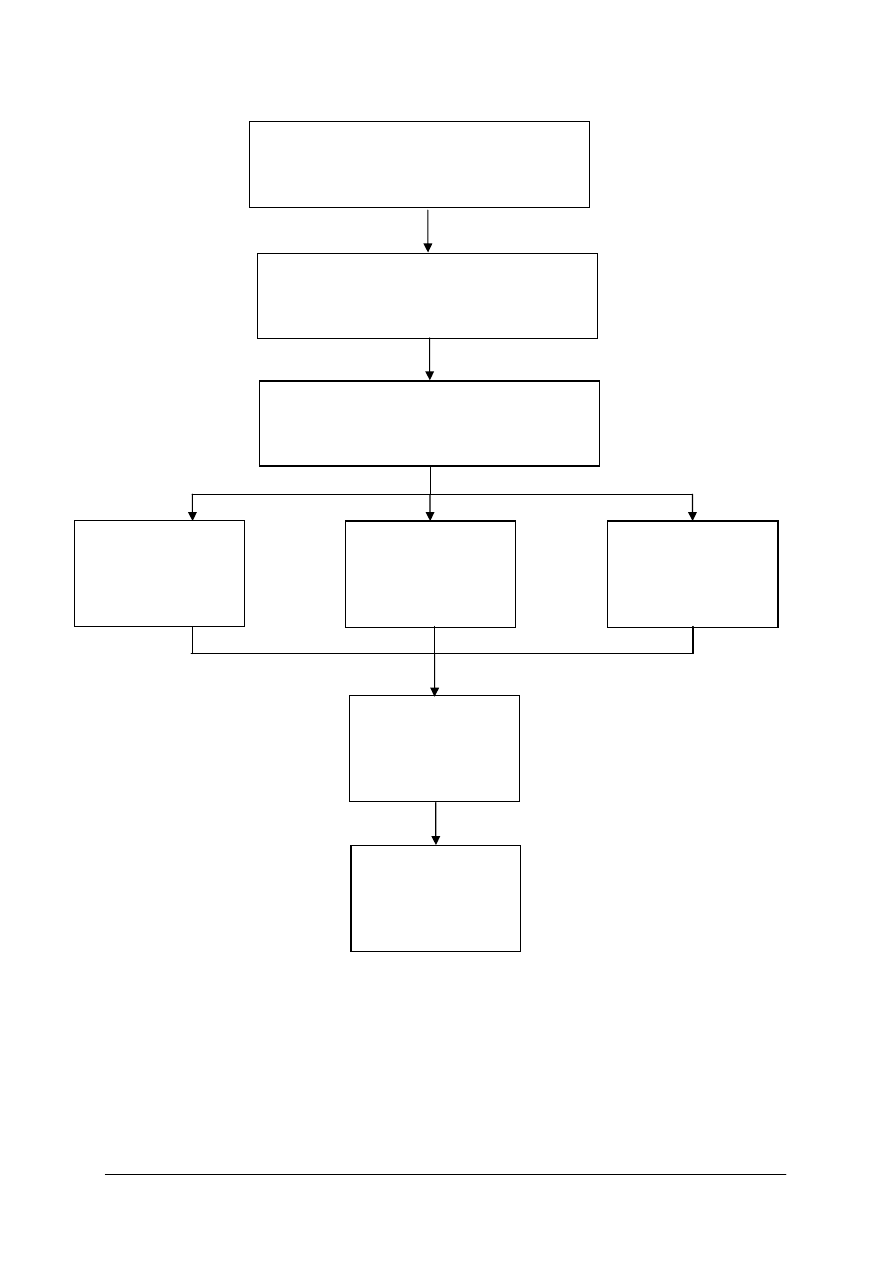
Schemat układu jednostek modułowych
322[10].Z3.01
Analizowanie i ocenianie zapisu leku
recepturowego i aptecznego
322[10].Z3.02
Wykonywanie leków recepturowych
i aptecznych z surowców roślinnych
322[10].Z3.04
Wykonywanie
płynnych leków
recepturowych
322[10].Z3.05
Wykonywanie
półstałych leków
recepturowych
322[10].Z3.07
Kontrolowanie
i wydawanie
gotowego leku
322[10].Z3.06
Wykonywanie
jałowych leków
recepturowych
322[10].Z3
Leki recepturowe i apteczne
322[10].Z3.03
Wykonywanie
stałych leków
recepturowych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
przestrzegać zasad bezpieczeństwa i higieny pracy , zasad ergonomii oraz regulaminu
porządkowego pracowni,
−
współpracować w grupie,
−
korzystać z FP i innych źródeł informacji,
−
organizować stanowisko pracy,
−
posługiwać się wagą i podstawowymi utensyliami używanymi w recepturze,
−
czytać receptę,
−
oceniać prawidłowość jej wystawienia,
−
oceniać prawidłowość zapisu recepty,
−
identyfikować łacińskie nazwy substancji leczniczych,
−
interpretować łacińskie skróty zawarte w recepcie,
−
interpretować nazwy synonimowe substancji leczniczych,
−
przeliczać dawki,
−
korygować dawki przekroczone,
−
klasyfikować substancje w zależności od siły działania, oraz rozpoznawać oznakowanie
naczyń w których są przechowywane,
−
sporządzać maści, czopki i globulki wg ogólnych zasad,
−
formułować ogólne zasady Dobrej Praktyki Wytwarzania,
−
prezentować efekt wykonanego zadania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
zdefiniować pojęcie aseptyki, antyseptyki i wyjaławiania,
−
scharakteryzować klasy czystości powietrza i pomieszczeń według zasad Dobrej Praktyki
Wytwarzania,
−
określić zasady i metody sterylizacji,
−
przygotować substancje lecznicze, rozpuszczalniki, naczynia i sprzęt do pracy,
−
przygotować pracownika oraz pomieszczenia do pracy w warunkach aseptycznych,
−
scharakteryzować postacie leków do oczu, z uwzględnieniem ocznych systemów
terapeutycznych,
−
określić metody sporządzania kropli i maści do oczu,
−
scharakteryzować rozpuszczalniki i podłoża stosowane do leków ocznych,
−
sporządzić krople oczne w warunkach aseptycznych,
−
określić wymagania dotyczące postaci leków z antybiotykami,
−
sporządzić czopki z antybiotykami,
−
sporządzić maści z antybiotykami,
−
oznakować, przechować i skontrolować leki jałowe,
−
określić wymagania farmakopealne i drogi podawania leków parenteralnych,
−
wyjaśnić sposoby sporządzania leków parenteralnych według zasad Dobrej Praktyki
Wytwarzania,
−
podać przykłady leków do żywienia pozajelitowego,
−
zastosować przepisy bezpieczeństwa i higieny pracy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Wyjaławianie i dezynfekcja pomieszczeń i sprzętu do pracy
aseptycznej
4.1.1. Materiał nauczania
Podstawowe pojęcia
Wyjaławianie (sterylizacja) jest procesem polegającym na zabiciu lub usunięciu ze
środowiska lub materiału wszystkich drobnoustrojów w ich formach wegetatywnych
i przetrwalnikowych. Można to osiągnąć za pomocą czynników fizycznych lub chemicznych.
Aseptyka jest to postępowanie mające na celu zapobieganie zakażeniu przez stosowanie
wyjałowionego sprzętu, rozpuszczalników, substancji itp. w wyjałowionym otoczeniu.
Antyseptyka jest postępowaniem mającym na celu zniszczenie drobnoustrojów na skórze,
narzędziach, pomieszczeniach, za pomocą chemicznych substancji bakteriobójczych.
Najczęściej stosowane metody wyjaławiania:
−
wyżarzanie i spalanie,
−
wyjaławianie suchym gorącym powietrzem,
−
wyjaławianie nasyconą para wodną pod ciśnieniem,
−
wyjaławianie za pomocą promieniowania:
–
nadfioletowego,
–
jonizującego,
−
wyjaławianie przez sączenie,
−
wyjaławianie za pomocą substancji chemicznych,
−
wyjaławianie za pomocą gazów.
Wyżarzanie i spalanie w płomieniach palnika powoduje spalenie drobnoustrojów i jest
stosowane tylko w odniesieniu do małych przedmiotów metalowych np. ezy do posiewów
mikrobiologicznych. Wyjaławianie przez spalanie jest skuteczną metodą niszczenia skażonego
materiału.
Wyjaławianie suchym gorącym powietrzem prowadzi do nieodwracalnej inaktywacji
i degradacji składników komórkowych bakterii, powodując w rezultacie ich zabicie.
Wyjaławianie w suchym gorącym powietrzu przeprowadza się obecnie w sterylizatorach
powietrznych z termoregulacją, zapewniających cyrkulację gorącego powietrza. FP VI zaleca
wyjaławianie w temp. 160°C w czasie nie krótszym niż 2h, w 170°C w czasie nie krótszym niż
1h lub w temp. 180°C w czasie nie krótszym niż 30 minut. Suchym gorącym powietrzem
można wyjaławiać materiały niewrażliwe na wysoką temp.: szkło, ceramikę, metal oraz
substancje nie zawierające wody np. oleje, podstawy maściowe, związki mineralne – tlenek
cynku, talk itp. Suche gorące powietrze wykorzystywane jest również do depirogenizacji np.
przedmiotów szklanych.
Wyjaławianie nasyconą parą wodną pod ciśnieniem powoduje, w wyniku hydrolizy,
denaturację i koagulację enzymów oraz innych struktur komórkowych, doprowadzając
w rezultacie do śmierci drobnoustrojów. Powszechnie uznawane jest za najskuteczniejszą
metodę wyjaławiania. Wyjaławianie nasyconą parą wodną pod ciśnieniem przeprowadza się w
sterylizatorze parowym (autoklawie), w parze nasyconej, nie zawierającej powietrza. Polecane
przez FP VI warunki wyjaławiania to temp. 121°C, nadciśnienie 101,4 kPa (0,1 MPa), w
czasie nie krótszym niż 15 minut. Przy nadciśnieniu powyżej 101,4 kpa i temp. 128°C lub
134°C stosuje się odpowiednio krótszy czas wyjaławiania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
W czasie pracy autoklawu możemy wyróżnić 4 okresy: czas nagrzewania, czas
wyrównywania temperatury, czas wyjaławiania oraz czas schładzania. Czas wyjaławiania
powinien być liczony od chwili całkowitego usunięcia powietrza z wnętrza sterylizatora
parowego i osiągnięcia przez wyjaławiane materiały wymaganej temperatury.
Wyjaławianie za pomocą promieniowania polega na wywoływaniu zmian w strukturze
kwasów nukleinowych. Źródłem promieniowania jonizującego są akceleratory elektronów
i źródła izotopowe. Wyjaławianie promieniowaniem jonizującym jest metodą z wyboru,
stosowaną do wyjaławiania materiałów wrażliwych na temperaturę. Źródłem promieniowania
nadfioletowego są lampy rtęciowe, które dzięki odpowiednim filtrom emitują około 95%
promieni o długości fali 254 nm. Taka długość fali gwarantuje największą aktywność
bakteriobójczą. Promieniowanie nadfioletowe znajduje głównie zastosowanie do wyjaławiania
powietrza.
Wyjaławianie przez sączenie polega na usuwaniu drobnoustrojów przez zatrzymanie ich
na sączkach o średnicy porów 0,2 μm. Warunek ten spełniają sączki membranowe. Metoda
znajduje zastosowanie do wyjaławiania roztworów wrażliwych na temperaturę oraz gazów.
Wyjaławianie za pomocą substancji chemicznych ma zastosowanie tylko
w wyjątkowych przypadkach tj. wtedy gdy materiał nie może być wyjaławiany innymi
metodami np. cystoskopy, endoskopy, bronchoskopy. Najczęściej używa się do tego celu
roztworu aldehydu glutarowego lub kwasu nadoctowego.
Wyjaławianie za pomocą gazów jest metodą z konieczności, gdy nie mogą być
zastosowane inne metody. Najczęściej stosuje się tlenek etylenu lub formaldehyd.
Potencjalne źródła zakażenia podczas pracy w warunkach aseptycznych:
−
pomieszczenia do pracy,
−
pracownicy,
−
substancje lecznicze, pomocnicze,
−
rozpuszczalniki,
−
sprzęt,
−
utensylia,
−
opakowania.
Sporządzanie jałowych leków powinno mieć miejsce w pomieszczeniach zwanych boksami
aseptycznymi lub w lożach aseptycznych o różnej konstrukcji, z laminarnym nawiewem
jałowego powietrza (pionowym lub poziomym). Pomieszczenia te powinny być wydzielone z
zespołu pomieszczeń apteki, oddzielone śluzą z wydzielonym przedsionkiem, w którym
powinno odbywać się przygotowanie pracownika do pracy aseptycznej. Umieszczona w boksie
lub loży aparatura musi być umyta i zdezynfekowana, a powietrze w pomieszczeniach, o
odpowiedniej czystości mikrobiologicznej. Odpowiednią czystość powietrza uzyskać można
stosując filtry HEPA (High Efficiency Particulate Air). Powietrze zasysane jest z otoczenia
przez filtr wstępny, wykonany z waty szklanej, zatrzymujący cząstki o średnicy 5μm, a
następnie tłoczone jest w sposób jednostajny, bez zawirowań przez filtry HEPA, wykonane z
włókien szklanych i zatrzymujące 99,99% cząstek o średnicy 0,3 μm.
Wprowadzono cztery klasy czystości powietrza pomieszczeń (A, B, C, D):
Klasa czystości A/B – w pomieszczeniach o tej klasie czystości, sporządza się aseptycznie leki
(roztwory, zawiesiny, emulsje, maści) bez wyjaławiania termicznego.
Klasa czystości B – w pomieszczeniach o tej klasie czystości, wykonuje się sączenie do
opakowań bezpośrednich.
Klasa czystości C – sporządza się leki wyjaławiane termicznie w opakowaniach końcowych.
Klasa czystości D – w pomieszczeniach tej klasy czystości, wykonuje się łączenie jałowych
roztworów z opakowań zamkniętych przy użyciu np. jałowej strzykawki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Oczyszczanie powietrza uzyskuje się również przy użyciu wentylatorów ultrafioletowych.
Bardzo ważnym elementem w pracy aseptycznej jest przygotowanie pracownika, który
powinien być szkolony, w zakresie zasad higieny i czystości mikrobiologicznej. Przed
przystąpieniem do pracy, w przedsionku, pracownik powinien zmienić odzież wierzchnią na
jałową odzież ochronną, która składa się z: fartucha, czepka na włosy, maseczki ochronnej na
nos i usta oraz gumowych kaloszy. Odzież ochronną należy wyjaławiać w autoklawie w temp.
132–134°C, co odpowiada nadciśnieniu 202,6 kPa, przez 15–30 minut (zależnie od rodzaju
wyjaławianego materiału oraz jego wielkości). Po przebraniu się powinien umyć ręce
i wydezynfekować je etanolem 70° lub 1% kremem chlorheksydynowym oraz wysuszyć
w strumieniu ciepłego powietrza.
Przygotowanie sprzętu do pracy aseptycznej polega na wstępnym umyciu roztworem
detergentu, spłukaniu ciepłą bieżącą wodą, płukaniu wodą jałową oraz wyjaławianiu
w sterylizatorze powietrznym w temp. 170°C przez godzinę. Opakowania szklane oraz tuby
aluminiowe powinno wyjaławiać się termicznie, natomiast elementy plastikowe tlenkiem
etylenu. Zakraplacze i nakrętki do butelek można ogrzewać w roztworze substancji
przeciwbakteryjnej w temp. 90°C przez 30 minut, (przed użyciem należy te przedmioty
opłukać kilkakrotnie jałową wodą). Aparat do napełniania tub należy dokładnie wymyć ciepłą
wodą z detergentem, przetrzeć 1% roztworem chlorku benzalkoniowego oraz wyjaławiać,
naświetlając promieniami UV przez 30 minut.
Substancje używane do sporządzania jałowych leków recepturowych powinny być jałowe,
np. NaCl, MgO, talk, skrobia, ZnO, kwas borowy można wyjaławiać w temp. 170°C / 90
minut; chloramfenikol – 100°C / 120minut; sulfacetamid, sulfanilamid – 140°C / 120minut.
Praktykuje się również naświetlanie promieniami UV substancji rozłożonej w cienkiej warstwie
w loży aseptycznej.
Rozpuszczalniki – do sporządzania kropli ocznych oraz wszystkich roztworów
pomocniczych powinna być użyta woda, która spełnia wymagania wody do wstrzykiwań
zgodnie z FP VI, za wyjątkiem badań na obecność ciał gorączkotwórczych. Jest to woda
świeżo destylowana i wyjaławiana w autoklawie lub szybkowarze temp. 122°C ± 2°C w czasie
20 minut.
UWAGA – zgodnie z monografią szczegółową dla wody do celów farmaceutycznych
wg FPVI Suplement 2005, 3. Aqua pro usu ophthalmico (woda do sporządzania leków do
oczu): „Do sporządzania leków do oczu w recepturze aptecznej używa się wody do
wstrzykiwań Aqua ad iniectabilia lub wody wysokooczyszczonej Aqua valde purificata. Do
sporządzania leków do oczu nie poddawanych wyjaławianiu używa się wody jałowej”.
Olej do kropli ocznych powinien odpowiadać wymaganiom oleju do sporządzania iniekcji
Oleum Arachidis pro iniectione, który po przesączeniu przez bibułę na ciepło, powinien być
wyjałowiony w suszarce w temp. 160°C przez godzinę, w naczyniach zamkniętych i możliwie
całkowicie wypełnionych.
Warunki, w jakich odbywa się produkcja leków pozajelitowych, muszą odpowiadać
wymaganiom GMP (Good Manufacturing Practice). Są to wytyczne określające zasady
prawidłowego postępowania podczas wytwarzania i kontroli leków.
Pomieszczenia przeznaczone do produkcji leków pozajelitowych powinny posiadać
przestrzenie o określonej i kontrolowanej ilości zanieczyszczeń cząstkami stałymi
i drobnoustrojami. Powinny mieć wejścia ze śluzami powietrznymi, służące do przemieszczania
pracowników lub materiałów z pomieszczeń o różnych klasach czystości, posiadających dwoje
lud więcej drzwi, które nie mogą być otwierane jednocześnie. Pomieszczenia do pracy
powinny być wyposażone w filtry z laminarnym nawiewem powietrza, które są w stanie
zapewnić nadciśnienie w stosunku do pomieszczeń sąsiadujących.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Urządzenia i sprzęt powinny być czyszczone i wyjałowione. W tym celu wprowadza się do
urządzeń parę wodną pod ciśnieniem, a po zakończeniu wyjaławiania przepuszcza się również
pod ciśnieniem, jałowe powietrze lub azot, w celu wysuszenia całego układu. Wymagane jest,
aby urządzenia przeznaczone do napełniania pojemników preparatami, które nie będą już
wyjaławiane termicznie w opakowaniach bezpośrednich, kontrolować okresowo metodami
mikrobiologicznymi. Postępowanie takie wchodzi zakres badań walidacyjnych niezbędnych
przy realizacji wymagań GMP.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jaka jest różnica pomiędzy aseptyką i antyseptyką?
2. Jak brzmi definicja wyjaławiania?
3. Jakie metody wyjaławiania stosuje się najczęściej i dlaczego?
4. Na czym polega wyjaławianie suchym gorącym powietrzem?
5. Na czym polega wyjaławianie nasyconą parą wodną pod ciśnieniem?
6. Na czym polega sączenie wyjaławiające?
7. Jakie są potencjalne źródła zakażenia podczas pracy aseptycznej?
8. Jakie znasz pomieszczenia do pracy aseptycznej i jakie jest ich wyposażenie?
9. Jaka jest budowa i przeznaczenie filtrów HEPA?
10. Jaka jest klasyfikacja czystości powietrza pomieszczeń do pracy aseptycznej?
11. Na czym polega przygotowanie pracownika do pracy w warunkach jałowych?
12. W jaki sposób przygotowuje się sprzęt i aparaturę do pracy?
13. Jakie są wymagania GMP, jeśli chodzi o przygotowanie pomieszczeń i sprzętu
niezbędnego do wykonania jałowych leków?
4.1.3. Ćwiczenia
Ćwiczenie 1
Przygotowanie sprzętu do pracy aseptycznej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący przygotowania sprzętu
i aparatury do pracy aseptycznej oraz poszerzyć wiadomości z literatury uzupełniającej,
2) dobrać i przygotować sprzęt i opakowanie leku,
3) ustalić metody sterylizacji,
4) umyć i wyjałowić termicznie pojemniki i utensylia wykonane ze szkła lub porcelany,
5) umyć i wyjałowić odpowiednią metodą pozostały sprzęt niezbędny do pracy aseptycznej,
6) zabezpieczyć wyjałowiony sprzęt i opakowanie do chwili użycia,
7) opisać wykonywane czynności w zeszycie ćwiczeniowym.
Wyposażenie stanowiska pracy:
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: moździerze, pistle różnych rozmiarów, łopatki i łyżeczki plastikowe lub metalowe,
naczynia do przechowywania substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki
i zestawy do sączenia próżniowego, jałowe zestawy filtracyjne, płytka szklana, unguator,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
destylator lub inne urządzenie do otrzymywania wody oczyszczonej (np. aparat do
odwróconej osmozy), łaźnia wodna, parownice, wagi apteczne, odważniki,
−
substancje lecznicze i substancje pomocnicze, leki gotowe,
−
opakowania do leków: butelki szklane – różnych rozmiarów, opakowania leków
parenteralnych, pudełka tekturowe, słoiki porcelanowe,
−
etykiety i sygnatury do leków ocznych,
−
filmy dydaktyczne na temat sposobów wyjaławiania,
−
foliogramy,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Przygotowanie boksu lub loży z nawiewem laminarnym do pracy aseptycznej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący wyposażenia
i przygotowania boksu i loży aseptycznej oraz poszerzyć wiadomości z literatury
uzupełniającej,
2) ustalić miejsce wykonywania leków aseptycznych,
3) zapoznać się z budową loży aseptycznej lub wyglądem i wyposażeniem boksu oraz
z rozmieszczeniem i działaniem filtrów HEPA,
4) umyć wszystkie powierzchnie przeznaczone do pracy aseptycznej, świeżo przygotowanym
roztworem detergentu i odkazić substancją dezynfekującą,
5) umyć i zdezynfekować aparaturę umieszczoną w boksie lub loży aseptycznej,
6) uruchomić przepływ jałowego powietrza przed przystąpieniem do pracy,
7) umieścić w loży lub boksie wszystkie niezbędne do wykonania leku wyjałowione
wcześniej materiały, utensylia, naczynia i opakowania,
8) włączyć lampy UV na 20-30 minut (jeżeli loża lub boks są w nią wyposażone),
9) zakończyć przygotowanie pomieszczeń do pracy aseptycznej, wyłączając lampę UV po
odpowiednim czasie (przy zachowaniu ciągłego przepływu jałowego powietrza podczas
wykonywania pracy),
10) opisać wykonywane czynności w zeszycie ćwiczeniowym.
Wyposażenie stanowiska pracy:
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: moździerze, pistle różnych rozmiarów, łopatki i łyżeczki plastikowe lub metalowe,
naczynia do przechowywania substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki
i zestawy do sączenia próżniowego, jałowe zestawy filtracyjne, płytka szklana, unguator,
destylator lub inne urządzenie do otrzymywania wody oczyszczonej (np. aparat do
odwróconej osmozy), łaźnia wodna, parownice, wagi apteczne, odważniki,
−
substancje lecznicze i substancje pomocnicze, leki gotowe,
−
opakowania do leków: butelki szklane – różnych rozmiarów, opakowania leków
parenteralnych, pudełka tekturowe, słoiki porcelanowe,
−
etykiety i sygnatury do leków ocznych,
−
filmy dydaktyczne na temat sposobów przygotowania pomieszczeń do pracy aseptycznej,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie aseptyki, antyseptyki i wyjaławiania?
2) wymienić klasy czystości pomieszczeń wg. zasad Dobrej Praktyki
Wytwarzania?
3) scharakteryzować klasy czystości powietrza wg zasad Dobrej Praktyki
Wytwarzania?
4) scharakteryzować pomieszczenia do pracy aseptycznej?
5) opisać budowę i działanie filtrów HEPA?
6) określić zasady i metody sterylizacji?
7) opisać przygotowanie boksu i loży z nawiewem laminarnym do pracy i
wykonać to praktycznie?
8) opisać przygotowanie sprzętu i aparatury do pracy aseptycznej
i wykonać to praktycznie?
9) opisać przygotowanie substancji leczniczych i rozpuszczalników?
10) opisać przygotowanie pracownika do pracy aseptycznej?
11) wymienić potencjalne źródła zakażenia w aseptyce?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
4.2. Podział i charakterystyka postaci leków jałowych
4.2.1. Materiał nauczania
Postacie leków do oczu
Leki do oczu (ophthalmica) są jałowymi płynnymi, półstałymi lub stałymi preparatami
przeznaczonymi do podawania: do worka spojówkowego, na powierzchnię oka lub do
głębszych części gałki ocznej w celach leczniczych, profilaktycznych lub diagnostycznych.
Do płynnych postaci zalicza się:
−
wodne krople do oczu (Gutta ophthalmicae, Oculoguttae)
−
płyny do oczu (Solutiones ophthalmicae)
−
olejowe krople do oczu (Gutta ophthalmicae oleosae),
−
zawiesiny do oczu (Suspensiones ophthalmicae),
−
wstrzyknięcia do oczu (Iniectiones ophthalmicae).
Postacie półstałe i stałe to:
−
maści do oczu (Unguenta ophthalmicae),
−
wkładki do oczu (Inserty),
−
systemy terapeutyczne do oczu,
−
proszki do sporządzania kropli lub płynów do oczu.
Krople do oczu są jałowymi wodnymi lub olejowymi roztworami, emulsjami lub
zawiesinami, jednej lub kilku substancji leczniczych przeznaczonymi do wprowadzania do oka.
Muszą spełniać następujące wymagania:
−
jałowość,
−
pH w granicach 3,5-8,5,
−
brak zanieczyszczeń nierozpuszczalnych,
−
izotoniczność z płynem łzowym (w szczególnych przypadkach mogą być hipertoniczne).
Krople do oczu mogą zawierać substancje pomocnicze, np. regulujące ciśnienie
osmotyczne lub lepkość preparatu, regulujące pH, zwiększające rozpuszczalność substancji
czynnej oraz trwałość preparatu. Substancje te w zastosowanych ilościach nie mogą wpływać
niekorzystnie na działanie preparatu, wywoływać działania drażniącego ani wpływać na
trwałość i dostępność biologiczną leku.
Roztwory izotonizujące:
−
roztwór chlorku sodu 9g/l,
−
roztwór azotanu potasu 16g/l,
−
roztwór kwasu borowego 19g/l,
−
roztwór glukozy 50g/l.
Roztwory buforujące:
−
roztwór cytrynianu sodu 30g/l (dla penicyliny),
−
bufor boranowy (dla chloramfenikolu),
−
bufor tetraboranowy (dla tetracyklin),
−
bufor fosforanowy (dla pilokarpiny)
−
roztwór glukozy 50g/l.
Roztwory izotonizujące i buforujące sporządza się rozpuszczając substancję leczniczą
w jałowej wodzie, sączy przez sączek klarujący do jałowych hermetycznie zamykanych butelek
i wyjaławia w autoklawie lub szybkowarze w temp. 122°±2°C przez 20 minut. (trwałość tych
roztworów wynosi około 3 miesiące).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Roztwory substancji konserwujących:
I. Chlorek benzalkoniowy
0,05g/l
Octan lub glukonian chlorheksydyny
0,10g/l
II. Chlorek benzalkoniowy
0,05g/l
Alkohol β-fenyloetylowy
4,00g/l
III. Boran fenylortęciowy
0,01g/l
Alkohol β-fenyloetylowy
4,00g/l
IV. Azotan fenylortęciowy
0,02g/l
Alkohol β-fenyloetylowy
4,00g/l
V. Tiomersal
0,2g/l
Alkohol β-fenyloetylowy
4,00g/l
VI. Boran fenylortęciowy
0,01g/l
VII. Hydroksybezoesan metylu
0,65g/l
Hydroksybenzoesan propylu
0,35g/l
Alkohol β-fenyloetylowy
4,00g/l
Roztwory substancji konserwujących sporządza się przez rozpuszczenie w jałowej wodzie
(boran i azotan fenylortęciowy, tiomersal oraz hydroksybenzoesan metylu i propylu należy
rozpuszczać w wodzie w podwyższonej temperaturze). Po rozpuszczeniu roztwory należy
przesączyć przez sączek klarujący i wyjaławiać w temp. 122°±2°C przez 20 minut w ciemnych
butelkach, używanych jako opakowanie do kropli ocznych i następnie w warunkach
aseptycznych zamknąć zakrętkami z zakraplaczem, co umożliwi odmierzanie substancji
konserwujących kroplami.
Roztwory zwiększające lepkość:
−
roztwory metylocelulozy (MC) w stężeniu 2,5g/l – 10,0g/l,
−
roztwory polialkoholu winylowego (PVA) w stężeniu od 14,0g/l – 40,0g/l,
−
hydroksyetylocelulozy (HEC) od 2,5g/l – 5,0g/l,
−
hydroksypropylometylocelulozy (HPMC) 5,0g/l.
Roztwory pomocnicze substancji zwiększających lepkość należy sporządzać w stężeniu
dwukrotnie większym, niż wymagane jest w kroplach do oczu. Wykonuje się je przez
rozpuszczanie odpowiedniej substancji w wodzie o temp. 80-90°C i wyjaławia w temp.
122°±2°C przez 20 minut. Wyjałowione i hermetycznie zamknięte roztwory substancji
zwiększających lepkość mogą być przechowywane w chłodnym miejscu do 3 miesięcy.
Lepkość kropli do oczu nie powinna przekraczać 20 mPa s.
Płyny do oczu są to jałowe, wodne roztwory substancji leczniczych przeznaczone do
przemywania i płukania oczu oraz do nasycania opatrunków. Pojemniki wielodawkowe nie
powinny zawierać więcej niż 200 ml płynu; muszą zawierać substancje konserwujące. Płyny do
oczu mogą zawierać dodatek substancji pomocniczych, mających na celu regulowanie ciśnienia
osmotycznego, pH i lepkości roztworu. Płyny przeznaczone do użycia w zabiegach
chirurgicznych lub zestawach pierwszej pomocy nie mogą zawierać substancji konserwujących
i po otwarciu nie mogą być przechowywane. Płyny do oczu powinny być przezroczyste i
wolne od zanieczyszczeń nierozpuszczalnych.
Olejowe krople do oczu sporządza się przez rozpuszczenie lipofilowej substancji
leczniczej w jałowym rozpuszczalniku, którym jest olej roślinny np. olej arachidowy,
rycynowy, oliwkowy, rzadziej syntetyczny (Miglyol). Rozpuszczalniki olejowe łagodzą
drażniące działanie leku, nie wymagają dodatku substancji konserwujących i przedłużają czas
kontaktu leku z powierzchnią oka.
Zawiesiny do oczu stanowią dyspersję nierozpuszczalnych lub trudno rozpuszczalnych
w wodzie substancji. FP VI wymaga się aby próbka preparatu odpowiadająca 10 μg substancji

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
leczniczej nie zawierała więcej niż 20 cząstek większych niż 25 μm, w tym nie więcej niż 2
cząstki większe niż 50 μm, żadna cząstka nie powinna być większa niż 90 μm.
Wstrzyknięcia do oczu stosuje się wtedy, gdy substancja lecznicza jest przeznaczona do
wywołania działania w głębszych częściach oka. Wstrzyknięcia do oczu występują najczęściej
w postaci roztworów i zmikronizowanych zawiesin i podawane są podspojówkowo
i dokomorowo w objętości nie przekraczającej 1ml.
Maści do oczu są jałowymi preparatami o konsystencji półstałej, przeznaczonymi do
umieszczania w worku spojówkowym lub nanoszone na brzegi powiek. Zawierają jedną lub
kilka substancji leczniczych rozpuszczonych lub rozproszonych w odpowiednim podłożu.
Podłoże maściowe nie powinno drażnić oka, powinno być trwałe i obojętne pod względem
chemicznym, powinno być wolne od zanieczyszczeń nierozpuszczalnych i posiadać odczyn
zbliżony do obojętnego. Uniwersalną podstawą do maści ocznych jest złożone podłoże
zalecane przez FP VI, o składzie:
Vaselinum album
80 cz.
Lanolinom anhydricum
10 cz.
Paraffinum liquidum
10 cz.
Do maści ocznych można stosować również wazelinę białą. Podłoża makrogolowe nie są
polecane , ponieważ drażnią oko.
Każde podłoże przed zastosowaniem należy stopić, przesączyć i wyjałowić w sterylizatorze
powietrznym, w temp. 160°C przez 1 godzinę.
Półstałe preparaty do oczu są pakowane w małych, jałowych tubach, z dołączoną oddzielnie
jałową końcówką, lub jałowych porcelanowych słoiczkach zawierających nie więcej niż 10 g
preparatu.
Wkładki do oczu (Inserty) są jałowymi, stałymi lub półstałymi preparatami o odpowiedniej
wielkości i kształcie, przeznaczonymi do umieszczania w worku spojówkowym, w celu
uzyskania odpowiedniego działania. Składają się ze zbiornika substancji leczniczej o budowie
matrycowej lub z błoną regulującą szybkość uwalniania leku. Jest to przykład postaci leku o
przedłużonym działaniu. Wkładki do oczu umieszczone są pojedynczo w jałowych
pojemnikach.
Systemy terapeutyczne do oczu
Oczny system terapeutyczny to insert, z którego substancja czynna uwalniana jest na
drodze dyfuzji, ze stałą, kontrolowaną szybkością. Przykładem takiego systemu
terapeutycznego jest Ocusert, który zawiera krążek z kwasu alginowego z pilokarpiną.
Substancja lecznicza uwalniana jest przez membranę otaczającą krążek a szybkość uwalniania
regulowana jest przez dobór odpowiedniej grubości i powierzchni membrany.
Ocusert P-20 zawiera 5 mg pilokarpiny i uwalnia 20 μg leku w ciągu 1 godziny.
Proszki do sporządzania kropli lub roztworów do oczu występują w formie suchych
i jałowych substancji do rozpuszczania lub zawieszania w odpowiednim rozpuszczalniku
bezpośrednio przed podaniem. Mogą zawierać substancje pomocnicze, ułatwiające
rozpuszczanie, regulujące ciśnienie osmotyczne i pH lub zapewniające trwałość preparatu. Po
rozpuszczeniu proszku w odpowiednim rozpuszczalniku powinny spełniać wymagania
odpowiednio dla kropli do oczu lub roztworów do oczu.
Dużą grupą leków wykonywanych w warunkach jałowych są preparaty pozajelitowe, do
których należą:
−
płyny do wstrzykiwań (Iniectiones, Iniectabilia),
−
płyny do infuzji (Infundibilia).
Płyny do wstrzykiwań są jałowymi roztworami, emulsjami lub zawiesinami jednej lub kilku
substancji leczniczych, przeznaczonymi do stosowania pozajelitowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Wymagania
Płyny do wstrzykiwań powinny być:
−
jałowe, wolne od drobnoustrojów,
−
pozbawione zanieczyszczeń nierozpuszczalnych,
−
wolne od pirogenów (endotoksyn bakteryjnych), nieobecne w roztworach podawanych
jednorazowo w objętości 15 ml i powyżej,
−
izohydryczne z osoczem krwi, tzn. ich pH powinno być zbliżone fizjologicznym
wartościom (7,35 – 7,45),
−
izoosmotyczne z surowicą krwi tzn. charakteryzować się ciśnieniem osmotycznym
w granicach 280 – 320 mOsm.
Drogi podawania: wstrzyknięcia śródskórne, doskórne, podskórne, domięśniowe, dożylne,
dotętnicze, dosercowe, dordzeniowe, śródstawowe, dostawowe i dootrzewnowe.
Płyny infuzyjne (do wlewów kroplowych) są to jałowe, wolne od substancji
gorączkotwórczych, wodne roztwory lub emulsje typu o/w jednej lub kilku substancji
leczniczych przeznaczone do stosowania pozajelitowego w postaci wlewu kroplowego,
najczęściej dożylnego. Zasadniczo są przeznaczone do podawania w dużej ilości, od 100 ml,
maksymalnie do 4000 ml / dobę.
Wymagania
Roztwory do wlewów muszą być:
−
jałowe, wolne od żywych drobnoustrojów,
−
apirogenne, wolne od substancji gorączkotwórczych,
−
wolne od zanieczyszczeń nierozpuszczalnych.
Poza tym, powinny być:
−
izohydryczne (pH 6,5 – 7,8),
−
izojoniczne, skład elektrolitowy płynów powinien być zgodny ze stężeniem
poszczególnych jonów występujących w płynie zewnątrzkomórkowym,
−
izoosmotyczne.
Płyny do infuzji nie zawierają żadnych substancji konserwujących.
Drogi podawania: podanie dożylne, dotętnicze, podskórne (rzadko).
Płyny stosowane w żywieniu pozajelitowym
Całkowite żywienie pozajelitowe jest metodą terapii prowadzoną drogą dożylną,
z całkowitym pominięciem przewodu pokarmowego, mającą na celu dostarczenie wszystkich
substancji niezbędnych do funkcji życiowych organizmu tj. aminokwasy potrzebne do budowy
białka, lipidy, węglowodany, elektrolity, witaminy i pierwiastki śladowe. Za prawidłowe
wykonanie mieszanin do żywienia pozajelitowego odpowiada farmaceuta. Mieszaniny te są
jałową postacią leku recepturowego, wykonywanego w systemie „unit dose” dla danego
chorego, indywidualnie dobranego pod względem składu. Przygotowanie mieszanin polega na
łączeniu poszczególnych składników w jednym pojemniku, określane jest jako All In One
(AIO) – system jednego pojemnika. Mieszaniny do żywienia pozajelitowego są układami
wieloskładnikowymi,
których
poszczególne substancje charakteryzują się różnymi
właściwościami fizykochemicznymi, dlatego też bardzo ważny jest sposób ich sporządzania
zapewniający bezpieczeństwo i skuteczność stosowania. Ważnym problemem jest trwałość
leków pozajelitowych w okresie przechowywania, w których niekiedy obserwuje się zmianę
barwy, powstanie zmętnienia, osadu itp. Oprócz zmian wizualnych należy uwzględnić przede
wszystkim stężenie substancji leczniczej i produktów jej rozkładu. Czynności związane ze
sporządzeniem leków pozajelitowych powinny odbywać się w odpowiednich, izolowanych od
otoczenia pomieszczeniach, umożliwiających postępowanie aseptyczne i muszą odpowiadać
wymaganiom GMP. Wszystkie preparaty ze względu na sposób podawania, podlegają

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
wszechstronnej i wnikliwej kontroli. Oprócz oznaczeń tożsamości, zawartości substancji
leczniczej i pomocniczej niezbędne są badania jałowości, obecności substancji
gorączkotwórczych, zanieczyszczeń nierozpuszczalnych, pH, ciśnienia osmotycznego,
zawartości leku w pojemniku, właściwości hemolitycznych.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie są postacie leków do oczu?
2. Jak brzmi definicja kropli do oczu?
3. Jakie są wymagania stawiane kroplom ocznym?
4. Jakie substancje pomocnicze są stosowane w kroplach do oczu?
5. Jaką rolę pełnią substancje konserwujące?
6. Od czego zależy wybór roztworów izotonicznych?
7. Jakie wymagania są stawiane maściom do oczu?
8. W jaki sposób należy sporządzać i wyjaławiać roztwory izotoniczne, buforujące,
konserwujące oraz substancje zwiększające lepkość?
9. Jakie wymagania są stawiane płynom do oczu?
10. Co to są inserty?
11. Na czym polega działanie ocznych systemów terapeutycznych?
12. Jak brzmi definicja płynów do wstrzykiwań i płynów do wlewów?
13. Jakie są różnice pomiędzy wymaganiami stawianymi płynom do wstrzykiwań i płynom do
wlewów?
14. Co oznaczają terminy: izotoniczność, izoosmotyczność i izojoniczność?
15. Co to są pirogeny?
16. Jakie są drogi podania iniekcji?
17. Jakie są drogi podania płynów infuzyjnych?
18. Na czym polega żywienie pozajelitowe?
4.2.3. Ćwiczenia
Ćwiczenie 1
Sporządź roztwór izotoniczny stosowany w kroplach do oczu, wykonanie opisz
w zeszycie wykonania w zeszycie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący przygotowania
roztworów izotonicznych oraz poszerzyć wiadomości z literatury uzupełniającej,
2) przygotować niezbędne składniki oraz jałowy sprzęt do sporządzenia roztworów
izotonicznych,
3) wykonać roztwory izotoniczne,
4) przesączyć je do jałowych hermetycznie zamykanych butelek,
5) wyjałowić w autoklawie lub szybkowarze w temp. 122°±2°C przez 20 minut,
6) gotowe roztwory, po ostygnięciu, odpowiednio opisać i odstawić w chłodne miejsce,
7) sprzątnąć miejsce pracy,
8) opisać w zeszycie wykonywane czynności.
Wyposażenie stanowiska pracy:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: łopatki i łyżeczki plastikowe lub metalowe, naczynia do przechowywania
substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki i zestawy do sączenia
próżniowego, jałowe zestawy filtracyjne, destylator lub inne urządzenie do otrzymywania
wody oczyszczonej (np. aparat do odwróconej osmozy), łaźnia wodna, palnik gazowy,
wagi apteczne, odważniki, autoklaw lub szybkowar,
−
surowce farmaceutyczne, substancje lecznicze i substancje pomocnicze,
−
opakowania do leków: butelki szklane – różnych rozmiarów, opakowania leków
parenteralnych,
−
etykiety i sygnatury,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Przygotowanie roztworów buforujących stosowanych do kropli do oczu, z opisem
wykonania w zeszycie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący przygotowania
roztworów buforujących oraz poszerzyć wiadomości z literatury uzupełniającej,
2) przygotować niezbędne składniki oraz jałowy sprzęt do sporządzenia roztworów
buforujących,
3) wykonać roztwory buforujące,
4) przesączyć je do jałowych hermetycznie zamykanych butelek,
5) wyjałowić w autoklawie lub szybkowarze w temp. 122°±2°C przez 20 minut,
6) gotowe roztwory, po ostygnięciu, odpowiednio opisać i odstawić w chłodne miejsce,
7) sprzątnąć miejsce pracy,
8) wykonywane czynności opisać w zeszycie.
Wyposażenie stanowiska pracy:
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: łopatki i łyżeczki plastikowe lub metalowe, naczynia do przechowywania
substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki i zestawy do sączenia
próżniowego, jałowe zestawy filtracyjne, destylator lub inne urządzenie do otrzymywania
wody oczyszczonej (np. aparat do odwróconej osmozy), łaźnia wodna, palnik gazowy,
wagi apteczne, odważniki, autoklaw lub szybkowar,
−
surowce farmaceutyczne, substancje lecznicze i substancje pomocnicze,
−
opakowania do leków: butelki szklane – różnych rozmiarów, opakowania leków
parenteralnych,
−
etykiety i sygnatury,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Ćwiczenie 3
Przygotowanie roztworów substancji konserwujących stosowanych do kropli do oczu,
z opisem wykonania w zeszycie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący przygotowania
roztworów konserwujących oraz poszerzyć wiadomości z literatury uzupełniającej,
2) przygotować niezbędne składniki oraz jałowy sprzęt do sporządzenia roztworów
substancji konserwujących,
3) wykonać roztwory pomocnicze substancji konserwujących,
4) przesączyć je przez sączek klarujący,
5) wyjałowić w autoklawie lub szybkowarze w temp. 121°±2°C przez 20 minut w ciemnych
butelkach, używanych jako opakowanie kropli do oczu,
6) gotowe roztwory, po ostygnięciu zamknąć w warunkach aseptycznych zakrętkami
z zakraplaczem,
7) opisać buteleczki i odstawić w chłodne miejsce,
8) sprzątnąć miejsce pracy,
9) opisać w zeszycie wykonane czynności.
Wyposażenie stanowiska pracy:
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: łopatki i łyżeczki plastikowe lub metalowe, naczynia do przechowywania
substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki i zestawy do sączenia
próżniowego, jałowe zestawy filtracyjne, destylator lub inne urządzenie do otrzymywania
wody oczyszczonej (np. aparat do odwróconej osmozy), łaźnia wodna, palnik gazowy,
wagi apteczne, odważniki, autoklaw lub szybkowar,
−
rozpuszczalniki, substancje pomocnicze,
−
opakowania do leków: butelki szklane – różnych rozmiarów, opakowania leków
parenteralnych,
−
etykiety i sygnatury,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.
Ćwiczenie 4
Przygotowanie roztworów zwiększających lepkość stosowanych do kropli do oczu,
z opisem wykonania w zeszycie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący przygotowania
roztworów zwiększających lepkość oraz poszerzyć wiadomości z literatury uzupełniającej,
2) przygotować niezbędne składniki oraz jałowy sprzęt do sporządzenia roztworów
zwiększających lepkość,
3) wykonać roztwory pomocnicze substancji zwiększających lepkość w stężeniu dwukrotnie
większym, niż wymagane w kroplach do oczu,
4) przelać je do jałowych hermetycznie zamykanych butelek,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
5) wyjałowić w autoklawie lub szybkowarze w temp. 121°±2°C przez 20 minut,
6) gotowe roztwory, po ostygnięciu, odpowiednio opisać i odstawić w chłodne miejsce,
7) sprzątnąć miejsce pracy,
8) opisać w zeszycie wykonane czynności.
Wyposażenie stanowiska pracy:
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: łopatki i łyżeczki plastikowe lub metalowe, naczynia do przechowywania
substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki i zestawy do sączenia
próżniowego, jałowe zestawy filtracyjne, destylator lub inne urządzenie do otrzymywania
wody oczyszczonej (np. aparat do odwróconej osmozy), łaźnia wodna, palnik gazowy,
wagi apteczne, odważniki, autoklaw lub szybkowar,
−
surowce farmaceutyczne, substancje pomocnicze,
−
opakowania do leków: butelki szklane – różnych rozmiarów, opakowania leków
parenteralnych,
−
etykiety i sygnatury,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.
Ćwiczenie 5
Przygotowanie podłoży przeznaczonych do maści ocznych, z opisem wykonania
w zeszycie
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący przygotowania podłoży
maściowych do maści ocznych oraz poszerzyć wiadomości z literatury uzupełniającej,
2) przygotować odpowiednie składniki podłoży maściowych i niezbędny jałowy sprzęt,
3) przygotować poszczególne podłoża maściowe z uwzględnieniem podłoża złożonego,
zalecanego przez FP VI,
4) przesączyć na ciepło gotowe podłoża,
5) wyjałowić w temp. 160°C / 1 godzinę,
6) jałowe podłoża zapakować do sterylnych naczyń lub tub w warunkach aseptycznych
i opisać,
7) sprzątnąć miejsce pracy,
8) wykonywane czynności opisać w zeszycie.
Wyposażenie stanowiska pracy:
−
boks, loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: moździerze i pistle różnych rozmiarów, parownice, łopatki i łyżeczki plastikowe
lub metalowe, naczynia do przechowywania substancji leczniczych, bagietki, zlewki, lejki,
butelki, sączki i zestawy do sączenia próżniowego, łaźnia wodna, palnik gazowy, wagi
apteczne, odważniki,
−
składniki podłoży maściowych,
−
opakowania do leków: słoiki porcelanowe, tuby aluminiowe,
−
etykiety i sygnatury,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wymienić postacie leków do oczu?
2) wymienić i scharakteryzować wymagania kropli do oczu?
3) scharakteryzować oczne systemy terapeutyczne?
4) wymienić roztwory izotoniczne, buforujące, zwiększające lepkość
i konserwujące?
5) opisać
wykonanie
i
wyjaławianie roztworów izotonicznych,
buforujących, zwiększających lepkość i konserwujących?
6) wykonać roztwory izotoniczne, buforujące, zwiększające lepkość
i konserwujące?
7) opisać wymagania maści do oczu?
8) wymienić podłoża maściowe do maści ocznych?
9) przygotować podłoża maściowe do maści ocznych?
10) oznakować, przechować i skontrolować leki jałowe?
11) wymienić i scharakteryzować preparaty pozajelitowe?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
4.3. Metody sporządzania kropli i maści do oczu
4.3.1. Materiał nauczania
Metody sporządzania kropli do oczu
Metoda 1
Substancję leczniczą należy rozpuścić w określonej ilości jałowej wody, dodać roztwór
konserwujący i uzupełnić przewidzianym rozpuszczalnikiem izotonicznym lub buforującym do
wymaganej masy. Uzyskany roztwór przesączyć przez sączek klarujący do buteleczki
stanowiącej opakowanie. Po zabezpieczeniu wlotu, folią aluminiową (z wyjątkiem roztworów
z tiomersalem), wyjałowić termicznie. Następnie, w warunkach aseptycznych zamknąć jałową
nakrętką z zakraplaczem.
Rp.
Dionini sol. 1% 10,0
M.f. guttae ophthalmicae
S. 1 x dziennie do oka prawego.
Wykonanie:
Krople należy wykonać w warunkach aseptycznych.
Należy odważyć 0,1g chlorowodorku etylomorfiny i rozpuścić ją w niewielkiej ilości
izotonicznego (19 g/l) kwasu borowego. Dodać substancje konserwujące (5 kropli chlorku
benzalkoniowego i 2 krople alkoholu β-fenyloetylowego) i uzupełnić do 10g roztworem
izotonicznym. Wyjaławiać w temp. 100°ć / 30 minut. Po ostudzeniu, w warunkach
aseptycznych, zamknąć butelkę zakrętką z zakraplaczem.
Metoda 2
Sporządzanie kropli do oczu wykonać podobnie jak w metodzie 2. Uzyskany roztwór
sączyć, w warunkach aseptycznych, przez jałowy sączek membranowy o wielości porów 0,22
μm, do jałowej buteleczki stanowiącej opakowanie i zamknąć jałową nakrętką z zakraplaczem.
Rp.
Gentamycini sol. 0,2%
10,0
M.f. guttae ophthalmicae
S. 2 x dziennie do oka prawego.
Wykonanie:
Krople należy wykonać w warunkach aseptycznych.
Wyliczoną ilość siarczanu gentamycyny rozpuścić w roztworze buforującym G, bez użycia
wody, dodać 5-6 kropli roztworu chlorku benzalkoniowego i 2–3 krople alkoholu β-
fenyloetylowego, po czym uzupełnić roztworem G do przepisanej masy. Otrzymany roztwór
przesączyć przez sączek wyjaławiający do butelki stanowiącej opakowanie. Butelkę zamknąć
nakrętką z zakraplaczem.
Metoda 3
W warunkach aseptycznych rozpuścić lub zawiesić substancję leczniczą w odpowiednim
jałowym roztworze izotonicznym lub buforującym. Roztwór przelać do jałowej butelki
i zamknąć jałową nakrętką z zakraplaczem.
Metoda 3 stosowana jest w przypadku sporządzania termolabilnych roztworów koloidalnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
Rp.
Argenti colloidalis
0,2
Aquae dest. ad
10,0
M.f. guttae ophthal.
S. wiadomo
Wykonanie:
Krople należy wykonać w warunkach aseptycznych.
Odważyć i wlać do parownicy 4g wody do wstrzykiwań oraz 6g izotonicznego roztworu
azotanu potasu (26 g/l), dodać 2 krople boranu fenylortęciowego. Na powierzchni uzyskanego
roztworu rozsypać srebro koloidalne i poczekać aż substancja rozpuści się całkowicie.
Otrzymany w ten sposób roztwór koloidalny przelać do jałowej butelki i zamknąć jałową
zakrętką z zakraplaczem. Wydać z etykietką „Chronić od światła”.
Uwaga! Jeżeli ilość wody potrzebnej do uzyskania roztworu izotonicznego substancji
leczniczej nie przekracza 20% przepisanej ilości preparatu, to substancję leczniczą należy
rozpuścić bezpośrednio w roztworze izotonicznym, pomijając wodę. Jeśli woda stanowi więcej
niż 90% przepisanego roztworu, substancję leczniczą należy rozpuścić tylko w jałowej wodzie.
Przygotowanie kropli o zwiększonej lepkości
Krople o zwiększonej lepkości sporządza się przez rozpuszczenie substancji leczniczej,
substancji doprowadzającej do izotonii i substancji konserwujących w połowie przepisanej
ilości wody. Roztwór ten należy wyjałowić zgodnie z zalecaną metodą, a następnie dopełnić do
przepisanej ilości, jałowym roztworem zwiększającym lepkość, o stężeniu dwukrotnie
większym od przepisanego w kroplach. Do sporządzania kropli ocznych można używać 2%
roztworu metylocelulozy, otrzymanej przez jej rozpuszczenie w roztworze izotonicznym
chlorku sodu, kwasu borowego lub azotanu potasu. Roztwory MC należy wyjaławiać
w autoklawie w temp. 122°±2°C przez 20 minut.
Rp.
Zinci sulfatis
0,01
2% Sol. Methylcellulosi 5,0
Aquae pro iniectione ad 10,0
M.f. oculoguttae
S. do oka prawego.
Wykonanie:
Krople należy wykonać w warunkach aseptycznych.
Substancję leczniczą należy rozpuścić w 5g izotonicznego (19g/l) roztworu kwasu borowego,
dodać 5 kropli roztworu konserwującego, chlorku benzalkoniowego i 2 krople alkoholu β-
fenyloetylowego. Przesączyć przez sączek wyjaławiający (metoda 2) do butelki, wytarować,
a następnie dodać 2% roztwór metylocelulozy w (19g/l) roztworze kwasu borowego. Butelkę
zamknąć zakrętką z zakraplaczem.
Rp.
1% Sol. Neomycini sulfatis + HEC 10,0
M.f.guttae ophtalmicae
Przygotowanie: 0,1 g siarczanu neomycyny + 4,9 g roztworu izotonicznego (1,9% H
3
BO
3
) +
5,0 g HEC (0,5% roztworu)

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Przygotowanie kropli w postaci zawiesin
Do sporządzania kropli w postaci zawiesin zaleca się metodę 3. Zmikronizowaną
substancję leczniczą należy zawiesić w jałowym rozpuszczalniku zawierającym oprócz
roztworów substancji izotonicznych i konserwujących także roztwory zwiększające lepkość.
Wielkość cząstek substancji leczniczej wg FP VI nie powinna przekraczać 20 μm.
Rp.
Hydrocortisoni
0,1
Aquae pro usu ophthalmico
10,0
M.f. guttae ophthalm.
D.S. wkraplać do OL.
Wykonanie:
Krople należy wykonać w warunkach aseptycznych.
Hydrokortyzon rozetrzeć stopniowo w jałowym moździerzu z 5g 2% jałowego roztworu
metylocelulozy w 0,9% chlorku sodu, następnie mieszaninę uzupełnić stale mieszając, 5g
izotonicznego, jałowego chlorku sodowego. Na końcu dodać substancji konserwującej (5–6
kropli mieszaniny I). Uzyskaną zawiesinę przelać do butelki, zamknąć zakrętką
z zakraplaczem, dołączyć etykietkę „Zmieszać przed użyciem”.
Przygotowanie kropli w postaci roztworów olejowych
Krople olejowe, ze względu na użycie oleju jako rozpuszczalnika należy wykonać
metodą 3.
Substancję leczniczą należy rozpuścić w jałowym oleju, przesączyć przez suchy, wyjałowiony
sączek klarujący np. ze szkła spiekanego Schotta G3 lub G4, do suchej, jałowej butelki
i zamknąć zakrętką z zakraplaczem.
Metody sporządzania maści do oczu
Metoda 1
Maści emulsje. Substancję czynną należy rozpuścić w jak najmniejszej ilości jałowej wody
(Aqua pro usu ophthalmico), dodać substancję konserwującą. W warunkach aseptycznych
roztwór ten połączyć z odpowiednią ilością jałowego podłoża maściowego i odpowiednio
zapakować.
Rp.
Atropini sulfatis
0,1
Scopolamini hydrobromidi 0,02
Cocaini hydrochloridi
0,05
M.f. unq. ophthalm.
10,0
Wykonanie:
W warunkach aseptycznych, w jałowym moździerzu należy rozpuścić siarczan atropiny,
bromowodorek skopolaminy i chlorowodorek kokainy w 10 kroplach roztworu pomocniczego
o stężeniu chlorku benzalkoniowego 0,05g/l i alkoholu β-fenyloetylowego 4g/l, a następnie
roztwór soli alkaloidów wemulgować w podłoże zalecane przez FP VI dla maści ocznych.
Maść zapakować do jałowego pojemnika.
Metoda 2
Maści zawiesiny. Substancję leczniczą należy zmikronizować przez ucieranie z niewielką
ilością jałowej parafiny płynnej, a następnie zmieszać z niewielką ilością jałowego podłoża . Po
dokładnym zmikronizowaniu substancji czynnej można dodać pozostałą część podstawy
maściowej i dokładnie wymieszać. Gotową maść zapakować do jałowego pojemnika lub tuby
aluminiowej i dołączyć odpowiednią etykietkę.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Rp.
Acidi borici
0,1
Vaselini ophthalm. ad 10,0
M.f. ung.
D.S. Maść do oczu.
Wykonanie:
W warunkach aseptycznych kwas borowy należy ucierać z kilkoma kroplami jałowej parafiny
płynnej przez ok. 20 minut, a następnie dodawać porcjami jałową wazelinę białą. Całość
dokładnie wymieszać i przenieść do jałowego pudełka lub tuby.
Opakowania kropli i maści do oczu
Odpowiednio dobrane opakowanie powinno zapewnić właściwy sposób aplikacji leku oraz
zabezpieczyć go, przed możliwością zanieczyszczenia mikrobiologicznego. Do recepturowych
leków do oczu stosuje się opakowania wielodawkowe:
−
do kropli ocznych stosuje się buteleczki z ciemnego szkła obojętnego, do których
dołączone są plastikowe nakrętki z zakraplaczem. To opakowanie nie daje jednak
całkowitego zabezpieczenia przed skażeniem leku. Całkowitą gwarancję jałowości, dają
natomiast opakowania jednodawkowe, małe zbiorniczki z tworzywa sztucznego,
zawierające niewielką ilość kropli, do jednokrotnego użycia.
−
maści umieszcza się w specjalnych lakierowanych wewnątrz tubkach z wydłużoną
końcówką, w celu ułatwienia aplikacji.
Trwałość kropli i maści do oczu
Okres ważności nienaruszonego opakowania kropli do oczu wynosi nie dłużej niż 1 miesiąc,
krople zawierające substancje konserwujące przechowuje się do 10 dni od chwili pierwszego
użycia, natomiast bez substancji konserwujących 24 godziny.
Maści do oczu należą do preparatów o dłuższym terminie ważności o którym, w dużej mierze
decyduje użyte podłoże.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie są metody sporządzania kropli do oczu?
2. Na czym polegają różnice przy sporządzaniu kropli trzema metodami?
3. Od czego zależy wybór metody wyjaławiania kropli ocznych?
4. Na czym polega przygotowanie kropli ocznych w postaci zawiesin?
5. W jaki sposób należy wykonać krople o zwiększonej lepkości?
6. W jaki sposób sporządza się krople olejowe?
7. Jakie są metody sporządzania maści do oczu?
8. W jaki sposób można uzyskać w aptece odpowiednie rozdrobnienie substancji leczniczej
w maściach ocznych?
9. Jakie są sposoby zabezpieczania jałowości kropli i maści do oczu?
10. Jaka jest trwałość kropli i maści ocznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.3.3. Ćwiczenia
Ćwiczenie 1
Wykonywanie kropli do oczu różnymi metodami.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący sporządzania kropli do
oczu różnymi metodami i poszerzyć wiadomości z literatury uzupełniającej,
2) wykorzystać podane recepty lub zestawy recept przygotowane przez nauczyciela,
3) przeczytać poprawnie receptę,
4) przeanalizować receptę pod względem:
−
poprawności zapisu,
−
sposobu zapisu,
5) odszukać w FP, monografię szczegółową poszczególnych składników recepty, (zwracając
uwagę na postać i właściwości substancji leczniczej, dawkę, działanie i zastosowanie,
sposób przechowywania oraz przynależność do wykazu leków),
6) zaplanować tok postępowania,
7) przygotować sprzęt, substancje lecznicze i pomocnicze, rozpuszczalniki i pomieszczenie
do pracy aseptycznej,
8) wykonać krople do oczu różnymi metodami,
9) zamknąć, w warunkach jałowych, butelki z lekiem nakrętką z zakraplaczem,
10) dołączyć odpis recepty oraz odpowiednią etykietkę z warunkami przechowywania leku,
11) sprzątnąć miejsce pracy,
12) opisać wykonanie recept w zeszycie ćwiczeniowym.
Wyposażenie stanowiska pracy:
−
boks lub loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: łopatki i łyżeczki plastikowe lub metalowe, naczynia do przechowywania
substancji leczniczych, bagietki, zlewki, lejki, butelki, sączki i zestawy do sączenia
próżniowego, jałowe zestawy filtracyjne, destylator lub inne urządzenia do otrzymywania
wody oczyszczonej (np. aparat do odwróconej osmozy), łaźnia wodna, palnik gazowy,
wagi apteczne, odważniki, szybkowar, autoklaw,
−
surowce farmaceutyczne, substancje lecznicze i substancje pomocnicze, rozpuszczalniki,
−
opakowania do leków: butelki szklane – różnych rozmiarów, nakrętki plastikowe
z zakraplaczami,
−
etykiety i sygnatury,
−
recepty na krople sporządzane różnymi metodami,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.
Ćwiczenie 2
Wykonywanie maści do oczu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący sporządzania maści do

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
oczu i poszerzyć wiadomości z literatury uzupełniającej,
2) wykorzystać podane recepty lub zestawy recept przygotowane przez nauczyciela,
3) przeczytać poprawnie receptę,
4) przeanalizować receptę pod względem:
–
poprawności zapisu,
–
sposobu zapisu,
5) odszukać w FP, monografię szczegółową poszczególnych składników recepty, (zwracając
uwagę na postać i właściwości substancji leczniczej, dawkę, działanie i zastosowanie,
sposób przechowywania oraz przynależność do wykazu leków),
6) zaplanować tok postępowania,
7) przygotować sprzęt, substancje lecznicze, podłoża maściowe i pomieszczenie do pracy
aseptycznej,
8) wykonać maści do oczu różnymi metodami,
9) przełożyć gotową maść do jałowych opakowań,
10) dołączyć odpis recepty oraz odpowiednią etykietkę z warunkami przechowywania leku,
11) sprzątnąć miejsce pracy,
12) opisać wykonanie recept w zeszycie ćwiczeniowym.
Wyposażenie stanowiska pracy:
−
boks lub loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: moździerze i pistle różnych rozmiarów, łopatki i łyżeczki plastikowe lub metalowe,
naczynia do przechowywania substancji leczniczych, bagietki, zlewki, sączki i zestawy do
sączenia próżniowego, łaźnia wodna, palnik gazowy, wagi apteczne, odważniki,
szybkowar, autoklaw,
−
surowce farmaceutyczne, substancje lecznicze i substancje pomocnicze, podłoża
maściowe,
−
opakowania do leków: słoiki porcelanowe, tuby aluminiowe,
−
etykiety i sygnatury,
−
recepty na maści sporządzane różnymi metodami,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) przygotować boks lub lożę z nawiewem laminarnym do wykonania
kropli i maści ocznych?
2) dobrać jałowy sprzęt, substancje lecznicze i pomocnicze do wykonania
kropli i maści ocznych?
3) zastosować substancje pomocnicze do wykonania kropli ocznych?
4) wykonać krople do oczu różnymi metodami?
5) opakować i oznakować prawidłowo gotowe krople?
6) określić i zastosować warunki przechowywania kropli i maści
ocznych?
7) sporządzić maści do oczu?
8) dobrać opakowanie i zapakować odpowiednio maści do oczu?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
4.4. Receptura antybiotyków
4.4.1. Materiał nauczania
Antybiotyki są to substancje, które powstały w wyniku procesów metabolicznych żywych
komórek i które hamują w bardzo małych stężeniach wzrost drobnoustrojów. Antybiotyki
należą do substancji bardzo wrażliwych na różne czynniki np. temperaturę, odczyn
środowiska, wilgoć, światło oraz na enzymy wytwarzane przez inne drobnoustroje,
niewrażliwe na dany antybiotyk.
Wymagania
Wszystkie postacie recepturowe leków z antybiotykami powinny by jałowe, zarówno ze
względu na możliwość inaktywacji antybiotyku przez enzymy bakteryjne jak i ze względu na
możliwość dodatkowego zakażenia pacjenta.
Ze względu na termolabilność antybiotyków, nie stosuje się termicznych metod
wyjaławiania gotowych postaci leku (wyjątek stanowi siarczan neomycyny), dlatego też
wskazana jest sterylizacja sprzętu, aparatury, opakowań jak również substancji czynnych,
rozpuszczalników i podłoży do sporządzania jałowych leków.
Wszystkie czynności związane z wykonaniem preparatów z antybiotykami powinny być
wykonane w pomieszczeniach jałowych tj. w boksie lub loży z nawiewem laminarnym.
Antybiotyki takie jak np. chloramfenikol, tetracyklina, erytromycyna, neomycyna czy
nystatyna, które należą do wrażliwych na światło powinny być przechowywane w naczyniach z
ciemnego, oranżowego szkła, a gotowy lek wydawany pacjentowi powinien zawierać etykietkę
„Chronić od światła”.
Aby zwiększyć trwałość antybiotyków na pH, do roztworów wodnych należy dodawać
substancje buforujące zalecane dla danego związku, dodaje się również substancje
konserwujące, które mają na celu zabezpieczenie leków recepturowych z antybiotykami przed
wtórnym zakażeniem.
Wszystkie bezwodne leki z antybiotykami należ chronić przed wilgocią ze względu na
hydrolityczny rozkład substancji czynnych, a gotowe leki przechowywać w hermetycznie
zamkniętych, jałowych opakowaniach.
Większość antybiotyków w postaci sproszkowanej nie jest wrażliwa na temperaturę,
natomiast w postaci recepturowej jako roztwory lub maści wymagają przechowywania
w temperaturze około 5ºC.
Antybiotyki zapisywane są w różnych postaciach np. stosuje się je w maściach, czopkach,
gałkach dopochwowych, zasypkach, pastach , roztworach, kroplach do oczu, nosa lub uszu.
Mogą być zapisywane jako leki proste i złożone.
Ze względu na to, że antybiotyki są substancjami o różnej strukturze chemicznej i różnych
wymaganiach, podczas pracy recepturowej powinno się je traktować w sposób indywidualny.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Dlaczego leki zawierające w swym składzie antybiotyki należy sporządzać jałowo?
2. Jakie czynniki mogą wpływać na rozkład antybiotyków?
3. Jakie wymagania powinny spełniać opakowania leków zawierających antybiotyki?
4. Dlaczego leki z antybiotykami należy przechowywać chroniąc od wilgoci i światła?
5. Jakie substancje należy stosować do leków zawierających antybiotyki, aby stworzyć
optymalny odczyn środowiska?
6. Dlaczego do preparatów z antybiotykami dodajemy substancje konserwujące?
7. Jakie są drogi podania leków z antybiotykami?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
4.4.3. Ćwiczenia
Ćwiczenie 1
Wykonywanie czopków i gałek z antybiotykami.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać materiał nauczania z poradnika dla ucznia dotyczący sporządzania leków
z antybiotykami i poszerzyć wiadomości z literatury uzupełniającej,
2) wykorzystać podane recepty lub zestawy recept przygotowane przez nauczyciela,
3) przeczytać poprawnie receptę,
4) zanalizować receptę pod względem:
−
poprawności zapisu,
−
sposobu zapisu,
−
ewentualnych niezgodności,
5) odszukać w FP, monografię szczegółową poszczególnych składników recepty, (zwracając
uwagę na postać i właściwości substancji leczniczej, dawkę, działanie i zastosowanie,
sposób przechowywania oraz przynależność do wykazu leków),
6) przeliczyć dawki dla substancji silnie działających z uwzględnieniem dawkowania,
7) zaplanować poprawny tok postępowania,
8) przygotować sprzęt, substancje lecznicze, podłoża czopkowe i pomieszczenie do pracy
aseptycznej,
9) wykonać czopki i gałki z antybiotykami,
10) opakować i oznakować prawidłowo gotowe gałki i czopki,
11) dołączyć odpis recepty oraz odpowiednią etykietkę o warunkach przechowywania leku,
12) sprzątnąć miejsce pracy,
13) opisać wykonanie recept w zeszycie ćwiczeniowym.
Wyposażenie stanowiska pracy:
−
boks lub loża z nawiewem laminarnym, szafki i półki na leki,
−
sprzęt: moździerze i pistle różnych rozmiarów, łopatki i łyżeczki plastikowe lub metalowe,
naczynia do przechowywania substancji leczniczych, płyta szklana, bagietki, zlewki, łaźnia
wodna, palnik gazowy, wagi apteczne, odważniki, szybkowar, autoklaw,
−
surowce farmaceutyczne, substancje lecznicze i substancje pomocnicze, podłoża
czopkowe,
−
opakowania do leków: słoiki porcelanowe, pudełka plastikowe,
−
etykiety i sygnatury,
−
recepty na gałki i czopki z antybiotykami,
−
poradnik dla ucznia,
−
zeszyt i przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) omówić jaki jest wpływ opakowania na trwałość postaci leków
z antybiotykami?
2) określić jakie czynniki mogą powodować rozkład antybiotyków?
3) wymienić
substancje
pomocnicze
stosowane
w
lekach
z antybiotykami?
4) dobrać jałowy sprzęt, substancje lecznicze i pomocnicze do wykonania
czopków i gałek z antybiotykami?
5) wykonać czopki i gałki z antybiotykami?
6) określić
i zastosować warunki przechowywania preparatów
z antybiotykami?
7) zapakować odpowiednio gałki i czopki z antybiotykami?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań dotyczących „ Wykonywania jałowych leków recepturowych” Do
każdego zadania dołączone są 4 możliwości odpowiedzi i tylko jedna odpowiedź jest
prawidłowa.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi, stawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową.
6. Kolejność rozwiązywania zadań jest dowolna.
7. Jeśli udzielenie odpowiedzi będzie sprawiało Ci trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
8. Po zakończeniu rozwiązywania zadań, sprawdź w KARCIE ODPOWIEDZI, czy dla
wszystkich zadań zaznaczyłeś odpowiedzi.
9. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
10. Na rozwiązanie testu masz 45 minut.
Powodzenia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
ZESTAW ZADAŃ TESTOWYCH
1. Antyseptyka jest to
a) postępowanie mające na celu zapobieganie zakażeniu przez stosowanie
wyjałowionych przedmiotów, roztworów itp. w wyjałowionym otoczeniu.
b) postępowanie mające na celu zniszczenie drobnoustrojów na skórze, rękach,
narzędziach, w pomieszczeniach za pomocą chemicznych substancji bakteriobójczych.
c) postępowanie mające na celu przedłużenie trwałości materiału przez dodawanie
substancji niszczących lub stworzenie warunków zapobiegających rozwojowi
drobnoustrojów.
d) postępowanie mające na celu zabicie lub usunięcie ze środowiska lub materiału
wszystkich
drobnoustrojów
zarówno
w
ich
formach
wegetatywnych
i przetrwalnikowych.
2. FP VI poleca następujące parametry wyjaławiania suchym gorącym powietrzem
a) temp. 160°C, nie krócej niż 2 godziny.
b) temp. 150°C, nie krócej niż 30 minut.
c) temp. 180°C, nie krócej niż 2 godziny.
d) temp. 100°C, nie dłużej niż 1 godzinę.
3. Woda do przyrządzania kropli ocznych powinna odpowiadać wymaganiom
a) wody podwójnie destylowanej.
b) wody do wstrzykiwań z wyjątkiem apirogenności.
c) apirogennej wody do wstrzykiwań.
d) wody utlenionej.
4. Wkładki do oczu to
a) inspekty.
b) infuza.
c) inserty.
d) inwerty.
5. Do półstałych i stałych postaci leków ocznych zaliczamy
a) systemy terapeutyczne do oczu.
b) emulsje do oczu.
c) wstrzyknięcia do oczu.
d) zawiesiny do oczu.
6. W celu doprowadzenia kropli ocznych do izotonii stosuje się
a) roztwór azotanu potasu (16g/l).
b) roztwór boranu fenylortęciowego (1,0g/).
c) roztwór tiomersalu (20g/l).
d) roztwór azotanu fenylortęciowego (16g/l).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
7. Pomieszczenie przeznaczone do przyrządzania leków, których nie wyjaławia się
w opakowaniach bezpośrednich, musi zapewniać prowadzenie procesu wytwarzania
a) w strefie powietrza klasy czystości A, przy powietrzu klasy czystości B,
wypełniającym całe pomieszczenie.
b) w strefie powietrza klasy czystości C, przy powietrzu klasy czystości A,
wypełniającym całe pomieszczenie.
c) w strefie powietrza klasy czystości A, przy powietrzu klasy czystości C,
wypełniającym całe pomieszczenie.
d) w strefie powietrza klasy czystości C, przy powietrzu klasy czystości D,
wypełniającym całe pomieszczenie.
8. Krople oczne zawierające związki srebra uzupełnia się
a) roztworem chlorku sodu (9,0g/l).
b) roztworem kwasu borowego (19,0g/l).
c) roztworem azotanu potasu (16,0g/l).
d) roztworem tiomersalu (0,2g/l).
9. Podłoża do maści ocznych należy wyjaławiać
a) sącząc przez sączek bibułowy.
b) w sterylizatorze powietrznym w temp. 100°C przez 30 minut.
c) w sterylizatorze powietrznym w temp. 160° przez 1 godzinę.
d) za pomocą substancji konserwujących.
10. Lepkość kropli do oczu nie powinna przekraczać
a) 20-25 mPa · s
b) 50-55 mPa · s
c) 40-45 mPa · s
d) 35-40 mPa · s
11. Zgodnie z wymaganiami FP, płyny infuzyjne
a) muszą zawierać substancje konserwujące.
b) powinny zawierać substancje konserwujące.
c) nie mogą zawierać substancji konserwujących.
d) powinny zawierać pirogeny.
12. Substancje konserwujące, które można by określić mianem „idealnych”, powinny
charakteryzować się
a) wąskim spektrum działania.
b) chemiczną i termiczną labilnością.
c) brakiem zgodności ze składnikami leku i opakowania.
d) brakiem działania toksycznego i drażniącego na tkanki gałki ocznej.
13. Aldesan to preparat dezynfekujący w skład którego wchodzi
a) diglukonian chlorheksydyny.
b) aldehyd glutarowy.
c) aldehyd orto-ftalowy.
d) laurylosiarczan sodu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
14. Podłożem stosowanym do maści ocznych z penicyliną jest
a) lanolina.
b) podłoże złożone, zalecane przez FP.
c) wazelina biała.
d) wazelina żółta.
15. Trzecia metoda wykonywania kropli ocznych zalecana jest dla
a) roztworów rzeczywistych i koloidalnych.
b) roztworów koloidalnych i zawiesin.
c) roztworów rzeczywistych i zawiesin.
d) roztworów rzeczywistych i barwnych.
16. Okres przydatności kropli po pierwszym użyciu, wynosi w przypadku kropli
zawierających substancje konserwujące
a) 1 miesiąc.
b) 7 dni.
c) 24 godziny.
d) 10 dni.
17. Wielkość cząstek substancji leczniczej w kroplach, w postaci zawiesin nie powinna
przekraczać
a) 10 μm.
b) 20 μm.
c) 20 mm.
d) 100 μm.
18. Leki do oczu umieszczone są w następującej grupie wymagań czystości
mikrobiologicznej:
a) IIa.
b) I
c) II
d) IIIa.
19. Wszystkie leki recepturowe z antybiotykami powinny być
a) wyjaławiane w autoklawie.
b) jałowe.
c) wyjaławiane w szybkowarze.
d) apirogenne.
20. Płyn Ringera składa się z:
a) NaCl, KCl, CaCl
2
· 6H
2
0
b) NaCl, KCl, K
2
HPO
4
, NaC
3
H
5
O
3.
c) KCl, glukoza.
d) NaCl, KCl, NH
4
Cl.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
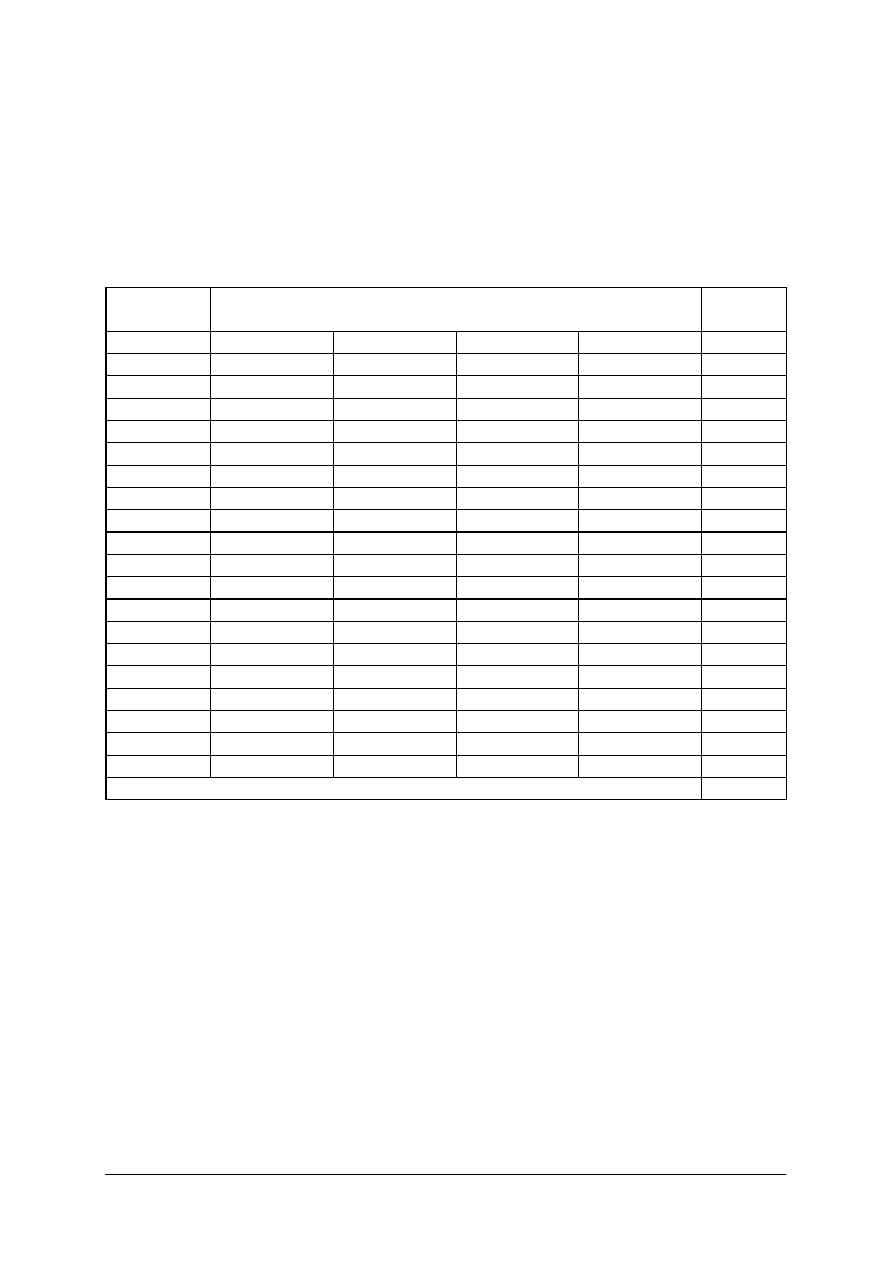
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie jałowych leków recepturowych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
6. LITERATURA
1. Farmakopea Polska IV PZWL, Warszawa 1970
2. Farmakopea Polska V. PTFarm., Warszawa 1995–1999
3. Farmakopea Polska VI. PTFarm., Warszawa 2002
4. Farmakopea Polska VII. PTFarm., Warszawa 2006
5. Jachowicz R.: Receptura apteczna. PZWL, Warszawa 2005
6. Janicki S., Szulc J., Woyczikowski B.: Zbiór recept. Gdańsk 2003
7. Janicki S., Fiebig A., Sznitowska M.: Farmacja stosowana. PZWL Warszawa 2006
8. Krówczyński L.: Ćwiczenia z receptury. PZWL, Warszawa1996
9. Krówczyński L.: Technologia postaci leku. PZWL, Warszawa 1969
10. Krówczyński L.: Zarys technologii postaci leku. PZWL, Warszawa 1994
11. Krówczyński L., Jachowicz R. (red.): „Ćwiczenia z receptury”. Wydawnictwo UJ,
Kraków 1998
12. Mueller R.H., Hildebrand G.E. (red.): Technologia nowoczesnych postaci leku. PZWL,
Warszawa 1998
13. Modrzejewski F.: Farmacja stosowana. PZWL, Warszawa 1997
14. Nerlo H.: Aseptyczne przyrządzanie leków. PZWL, Warszawa 1979
Wyszukiwarka
Podobne podstrony:
16 Wykonywanie jałowych leków recepturowych
16 Wykonywanie jałowych leków recepturowych
13 Wykonywanie stałych leków recepturowych
13 Wykonywanie stałych leków recepturowych
13 Wykonywanie stałych leków recepturowych
14 Wykonywanie płynnych leków recepturowych
15 Wykonywanie półstałych leków recepturowych
14 Wykonywanie płynnych leków recepturowych
15 Wykonywanie półstałych leków recepturowych
15 Wykonywanie półstałych leków recepturowych
14 Wykonywanie płynnych leków recepturowych
12 Wykonywanie leków recepturowych
12 Wykonywanie leków recepturowych
12 Wykonywanie leków recepturowych i aptecznych z surowców roślinnych
Zasady wyceny leków recepturowych i gotowych, Farmacja, farmakologia
TPL WYK 13 03 25 Sposoby zapisywania leków recepturowych w postaci roztworów
16 Wykonywanie napraw i renowacji wyrobów stolarskich
16 Wykonywanie połączeń elementów odzieży
16 Wykonywanie zabiegow agrotec Nieznany
więcej podobnych podstron