
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
18 / 39
XIb. ELEKTROLITY cd.
6. Wodorotlenki
Wodorotlenkami nazywa się związki nieorganiczne,
w których we wzorze wyróżnia się kation metalu lub
kation amonowy (NH
4
+
) oraz grupę wodorotlenową (OH
-
).
Np: NaOH, Ca(OH)
2
, Al(OH)
3
, Fe(OH)
3
.
Wodorotlenki, których wodne roztwory mają odczyn
wyraźnie
zasadowy,
nazywamy
zasadami.
Są
to
wodorotlenki mocne.
Np: NaOH, KOH, Ca(OH)
2
.
Ale zasadą jest również wodny roztwór amoniaku
(NH
3
⋅⋅⋅⋅
H
2
O). Reakcje dysocjacji elektrolitycznej:
NaOH
→
→
→
→
Na
+
+ OH
-
NH
3
· H
2
O
⇔
⇔
⇔
⇔
NH
4
+
+ OH
-
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
19 / 39
Wodorotlenki dzielimy na:
- wodorotlenki zasadowe - reagują tylko z kwasami;
np: NaOH, Ca(OH)
2
:
Ca(OH)
2
+ 2HCl = CaCl
2
+ 2H
2
O
- wodorotlenki amfoteryczne - reagują z kwasami
i zasadami;
np: Al(OH)
3
, Zn(OH)
2
.
Stechiometryczny
zapis
reakcji
roztwarzania
wodorotlenku cynku w kwasach i zasadach:
Zn(OH)
2
+ 2HCl = ZnCl
2
+ 2H
2
O
Zn(OH)
2
+ 2NaOH = Na
2
[Zn(OH)
4
]

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
20 / 39
7. Sole
W
wyniku
reakcji
kwasu
z
wodorotlenkiem
(tzw. reakcja zobojętnienia) powstają sole.
Przykłady:
HCl + NaOH = NaCl + H
2
O
chlorek sodu
2HNO
3
+ Ca(OH)
2
= Ca(NO
3
)
2
+ H
2
O
azotan wapnia
H
2
SO
4
+ 2NH
3
H
2
O = (NH
4
)
2
SO
4
+ 2H
2
O
siarczan amonu
2H
3
PO
4
+ 3Mg(OH)
2
= Mg
3
(PO
4
)
2
+ 6H
2
O
fosforan magnezu
Sole są związkami stałymi o budowie krystalicznej.
W węzłach ich sieci są kationy metali i aniony reszt
kwasowych.
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
21 / 39
Sole mogą też powstać w reakcjach:
- tlenek kwasowy + tlenek zasadowy
np: CO
2
+ CaO = CaCO
3
- tlenek zasadowy + kwas
np: CaO + 2HCl = CaCl
2
+ H
2
O
- tlenek kwasowy + zasada
np: SO
2
+ 2NaOH = Na
2
SO
3
+ H
2
O
Poznane tutaj sole są solami obojętnymi.

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
22 / 39
Są też wodorosole i hydroksosole.
Wodorosole (inaczej sole kwaśne) powstają przez
niecałkowite zobojętnienie kwasu wieloprotonowego
zasadą. Przykłady:
H
2
SO
4
+ NaOH = NaHSO
4
+ H
2
O
wodorosiaczan sodu
H
3
PO
4
+ Ca(OH)
2
= CaHPO
4
+ 2H
2
O
wodorofosforan wapnia
2H
3
PO
4
+ Ca(OH)
2
= Ca(H
2
PO
4
)
2
+ 2H
2
O
dwuwodorofosforan wapnia
Hydroksosole (inaczej sole zasadowe) powstają
przez niecałkowite zobojętnienie kwasem wodorotlenku
posiadającym więcej niż jedną grupę OH
-
. Przykłady:
Mg(OH)
2
+ HCl = Mg(OH)Cl + H
2
O
chlorek hydroksomagnezu
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
23 / 39
Niektóre sole są bardzo trudno rozpuszczalne
w wodzie. Przykłady:
- większość siarczków np. CuS, HgS,
- większość fosforanów np. Ca
3
(PO
4
)
2
,
- niektóre chlorki np. AgCl,
- niektóre siarczany np. CaSO
4
.

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
24 / 39
8. Hydroliza soli
a)
Odczyn roztworów wodnych
kwasów
→
→
→
→
kwaśny;
pH < 7,0
zasad
→
→
→
→
zasadowy;
pH > 7,0
Jaki jest odczyn roztworu wodnego soli - obojętny?
(1) NaCl
→
→
→
→
Na
+
+ Cl
-
pH = 7,0
(2) NH
4
Cl
→
→
→
→
NH
4
+
+ Cl
-
pH < 7,0
(3) CH
3
COONa
→
→
→
→
CH
3
COO
-
+ Na
+
pH > 7,0
Dlaczego odczyn soli (2) i (3) nie jest obojętny?
Przyczyną jest zjawisko hydrolizy
Hydrolizą nazywamy proces rozkładu jakiejś substancji
(soli) następujący pod wpływem wody.
Ściślej: hydrolizie ulegają jony wywodzące
się z danej soli.
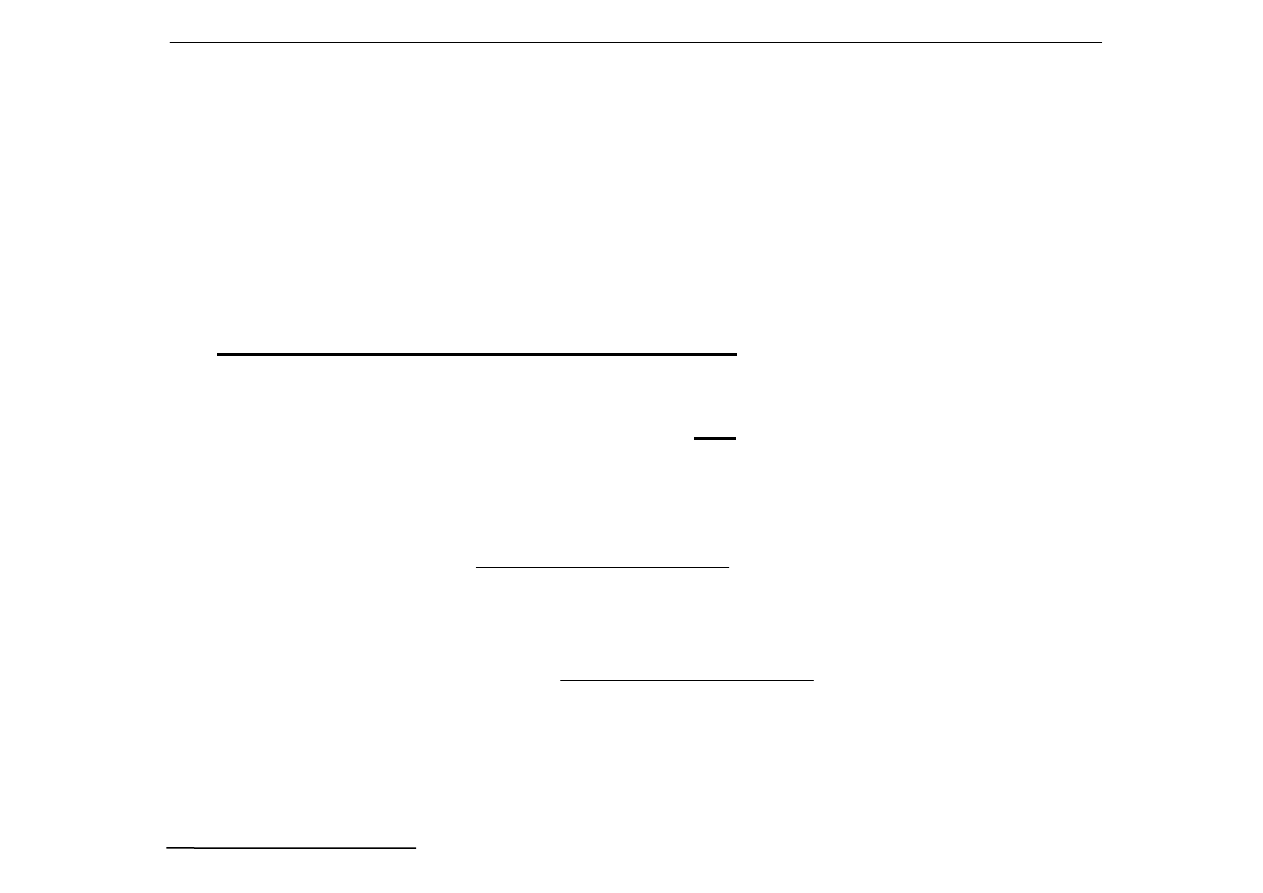
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
25 / 39
I tak hydrolizie ulegają jony:
reakcja (2)
NH
4
+
(3)
CH
3
COO
-
hydrolizie nie ulegają natomiast jony Na
+
czy Cl
-
b) Opis ilościowy reakcji hydrolizy
1
o
NH
4
+
+ H
2
O
⇔
⇔
⇔
⇔
NH
3
H
2
O + H
+
odczyn słabo kwaśny
]
NH
[
]
O][H
H
NH
[
=
O]
[H
K
=
K
O]
][H
[NH
]
O][H
H
NH
[
=
K
+
4
+
2
3
2
,
h
h
2
+
4
+
2
3
,
h
⋅⋅⋅⋅
⋅⋅⋅⋅
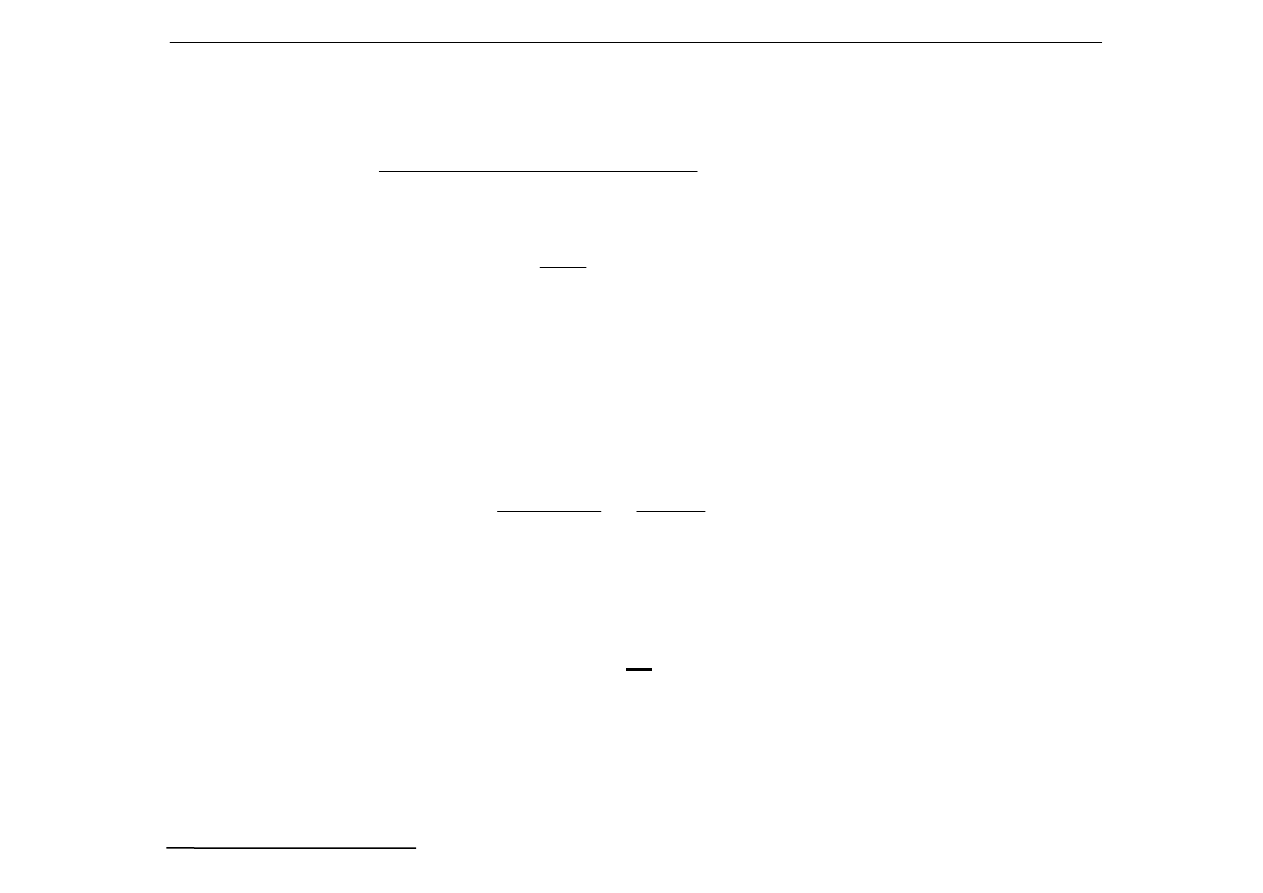
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
26 / 39
Pomnóżmy obie strony przez [OH
-
]
Jeżeli nie ma dodatkowych jonów "wspólnych":
ββββ
- stopień hydrolizy, 0 <
ββββ
< 1
dla
ββββ
<< 1 K
h
=
ββββ
2
c
s
p
K
K
=
K
]
OH
][
NH
[
]
OH
][
H
O][[
H
NH
[
=
K
b
w
h
-
+
4
-
+
2
3
h
⋅⋅⋅⋅
ββββ
ββββ
⋅⋅⋅⋅
-
1
c
=
c
-
c
c
=
K
]
[H
=
O]
H
[NH
p
s
2
H
p
s
2
+
H
h
+
2
3
+

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
27 / 39
2
o
CH
3
COO
-
+ H
2
O
⇔
⇔
⇔
⇔
CH
3
COOH + OH
-
odczyn słabo zasadowy
Jeżeli nie ma dodatkowych jonów "wspólnych":
K
K
=
]
COO
CH
[
]
COOH][OH
CH
[
=
K
O]
][H
COO
CH
[
]
COOH][OH
CH
[
=
K
a
w
-
3
-
3
h
2
-
3
-
3
,
h
ββββ
⋅⋅⋅⋅
ββββ
-
1
c
=
c
-
c
c
=
K
p
s
2
OH
p
s
2
OH
h
-
-

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
28 / 39
3
o
NH
4
+
+ CH
3
COO
-
+ H
2
O
⇔
⇔
⇔
⇔
NH
3
⋅⋅⋅⋅
H
2
O + CH
3
COOH
Odczyn tego typu soli zależy od tego co jest
„mocniejsze”, tj. kwas czy zasada:
W przypadku CH
3
COONH
4
: pK
a
= pK
b
, [H
+
] = [OH
-
] i dla
pK
w
= 14,00 mamy pH = 7,0
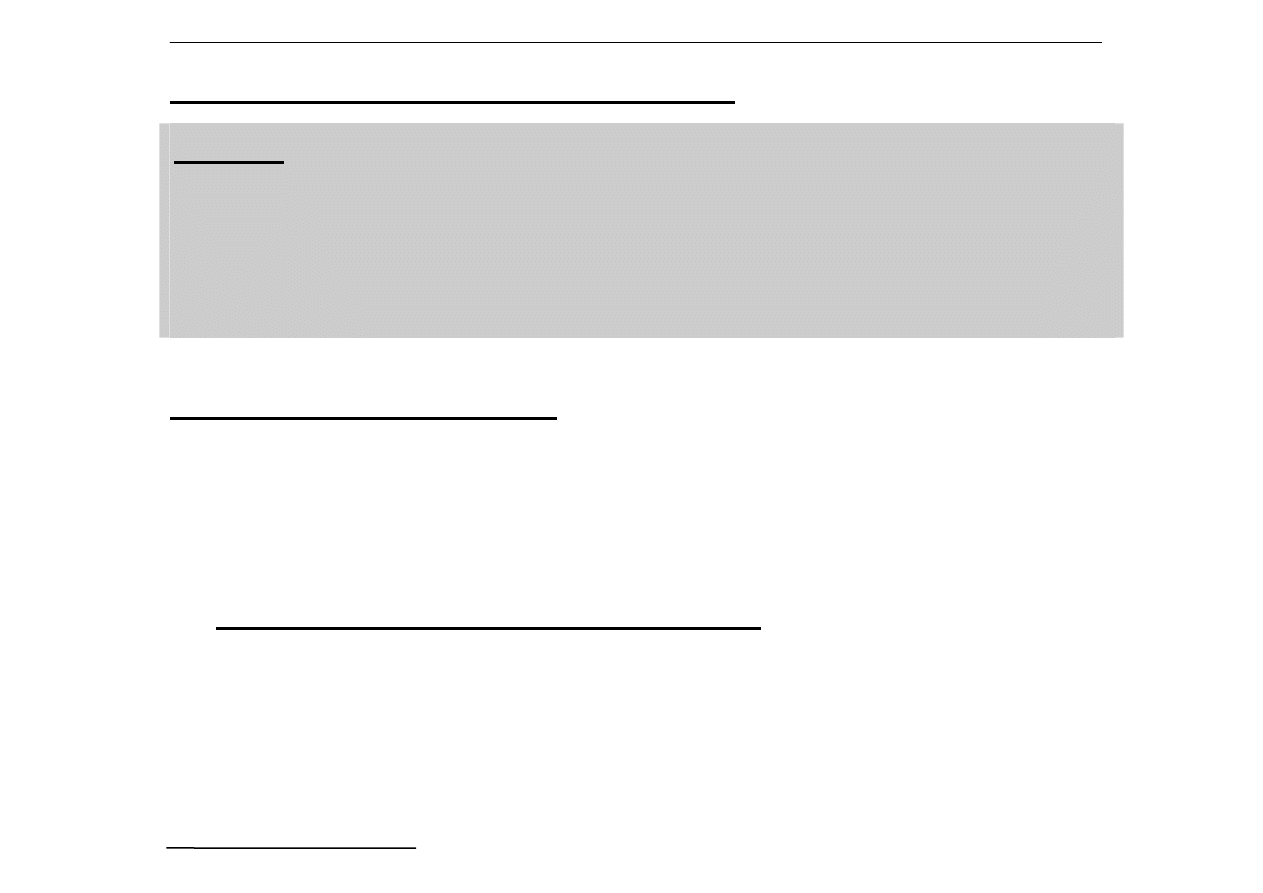
Inne jony ulegające hydrolizie:
Zn
2+
+ H
2
O = [ZnOH]
+
+ H
+
Al
3+
+ H
2
O = [AlOH]
2+
+ H
+
CO
3
2-
+ H
2
O = HCO
3
-
+ OH
-
K
K
=
c
c
=
]
OH
[
]
H
[
b
a
OH
H
-
+
-
+
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
29 / 39
9. Roztwory buforowe (bufory)
Bufory są to roztwory wodne, których pH nie zmienia się
przy dość znacznych rozcieńczeniach, oraz w których
dodatek niewielkich ilości mocnego kwasu lub mocnej
zasady powoduje małe zmiany kwasowości
(zasadowości) roztworu.
Roztworem buforowym może być roztwór wodny:
- słabej zasady i jej soli,
- roztwór słabego kwasu i jego soli,
- roztwór dwóch soli słabego kwasu wieloprotonowego.
a) Bufor: Słaby kwas + jego sól, np.
CH
3
COOH + CH
3
COONa
Równowagę w tej mieszaninie opisuje reakcja:
CH
3
COOH = CH
3
COO
-
+ H
+
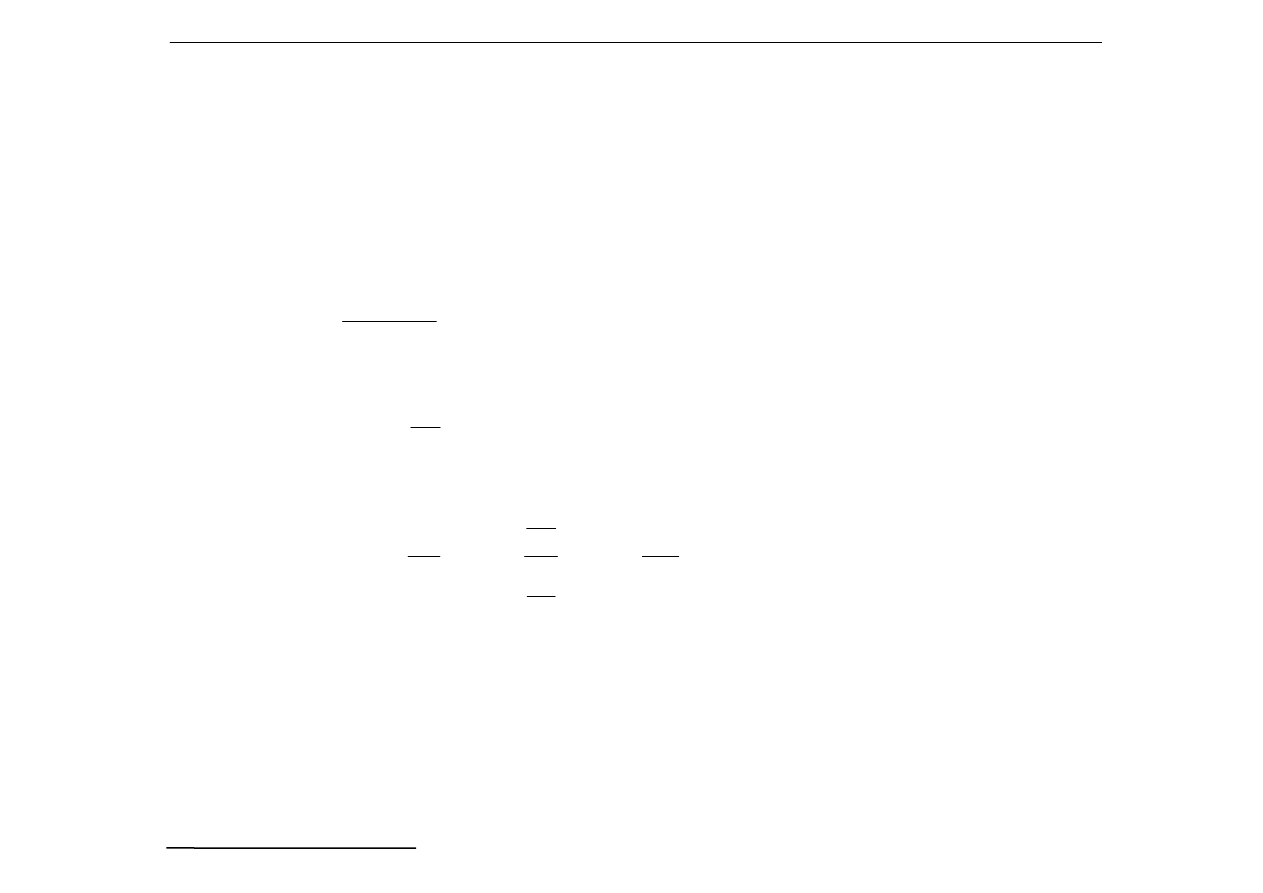
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
30 / 39
Wpływ jonów octanowych pochodzących od octanu sodu
- cofa się dysocjacja.
Stała równowagi kwasu octowego. K
a
, w obecności
octanu sodu przyjmuje postać:
1
o
Wpływ rozcieńczenia (w określonych granicach)
- [H
+
] nie zmienia się
c
s
p
, c
k
p
- stężenia
początkowe octanu sodu
i kwasu octowego
c
c
K
=
c
c
c
c
=
K
p
s
p
k
a
H
p
k
p
s
H
a
+
⋅⋅⋅⋅
⋅⋅⋅⋅
++++
n
n
K
=
K
=
c
c
K
=
c
p
s
p
k
a
V
n
V
n
a
p
s
p
k
a
H
p
s
p
k
⋅⋅⋅⋅
++++
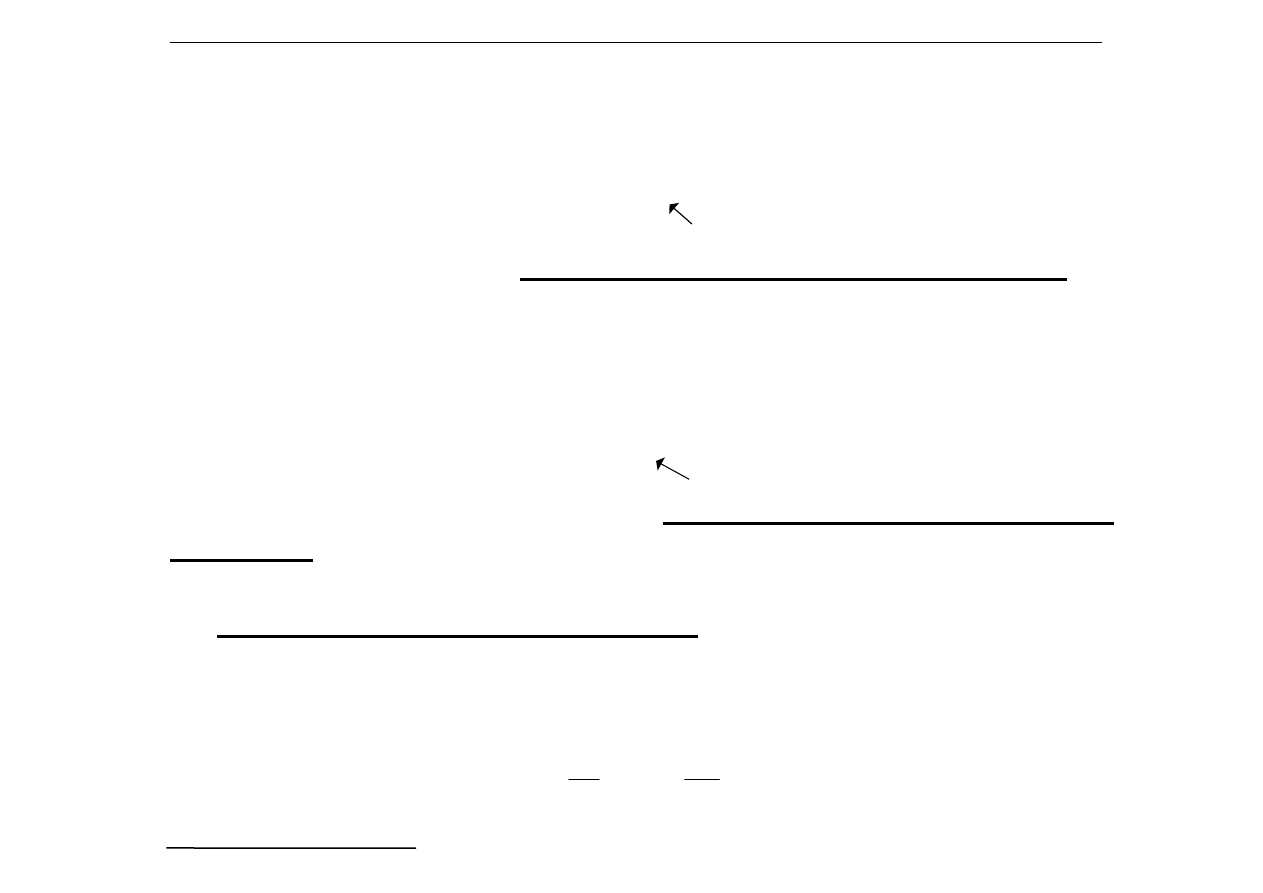
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
31 / 39
2
o
Wpływ dodatku niewielkiej ilości mocnego kwasu
- niewielka zmiana pH roztworu
CH
3
COOH = CH
3
COO
-
+ H
+
H
+
z mocnego kwasu
Dysocjacja cofa się - równowaga przesuwa się w lewo
3
o
Wpływ dodatku niewielkiej ilości mocnej zasady
CH
3
COOH = CH
3
COO
-
+ H
+
OH
-
z mocnej zasady
Dysocjacja zwiększa się - równowaga przesuwa się
w prawo
b) Bufor: słaba zasada + jej sól:
NH
3
⋅⋅⋅⋅
H
2
O + NH
4
Cl
n
n
K
=
c
c
K
=
]
OH
[
p
s
p
z
b
p
s
p
z
b
-
⋅⋅⋅⋅

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
32 / 39
c) Bufor: mieszanina dwóch soli tego samego kwasu:
NaH
2
PO
4
+ Na
2
HPO
4
(kwas)
(sól)
H
2
PO
4
-
⇔
⇔
⇔
⇔
HPO
4
2-
+ H
+
(K
a2
)
c
c
K
=
c
c
c
c
=
c
c
c
=
K
p
HPO
Na
p
PO
NaH
a2
H
p
PO
NaH
p
HPO
Na
H
p
k
p
s
H
a2
4
2
4
2
4
2
4
2
+
+
⋅⋅⋅⋅
⋅⋅⋅⋅
⋅⋅⋅⋅
++++
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
33 / 39
10. Iloczyn rozpuszczalności
Niektóre elektrolity cechuje niska lub bardzo niska
rozpuszczalność w wodzie.
Weźmy nasycony roztwór wodny AgCl:
AgCl
⇔
⇔
⇔
⇔
Ag
+
+ Cl
-
dla I = const.
I
r
- iloczyn rozpuszczalności dla I = const. i T = const.
Dla siarczku cyny(IV):
I
r
= [Sn
4+
][S
2-
]
2
Dla fosforanu wapnia:
I
r
= [Ca
2+
]
3
[PO
4
3-
]
2
Ag
+
, Cl
-
←
←
←
←
roztwór
nasycony
←
←
←
←
osad AgCl
W roztworze nasyconym
[AgCl] = const.
[Ag
+
][Cl
-
] = K
⋅⋅⋅⋅
[AgCl] = I
r
[AgCl]
]
Cl
][
Ag
[
=
K
-
+
−−−−
++++
++++
⇔
⇔
⇔
⇔
2
4
2
S
2
Sn
SnS
−−−−
++++
++++
⇔
⇔
⇔
⇔
3
4
2
2
4
3
PO
2
Ca
3
)
PO
(
Ca

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
34 / 39
W tabelach często zamiast I
r
podaje się pI
r
: pI
r
= -logI
r
Iloczyn rozpuszczalności jest iloczynem
ze stężeń najprostszych postaci jonów
związku słabo rozpuszczalnego
i jest wielkością stałą w danej
temperaturze i sile jonowej.
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
35 / 39
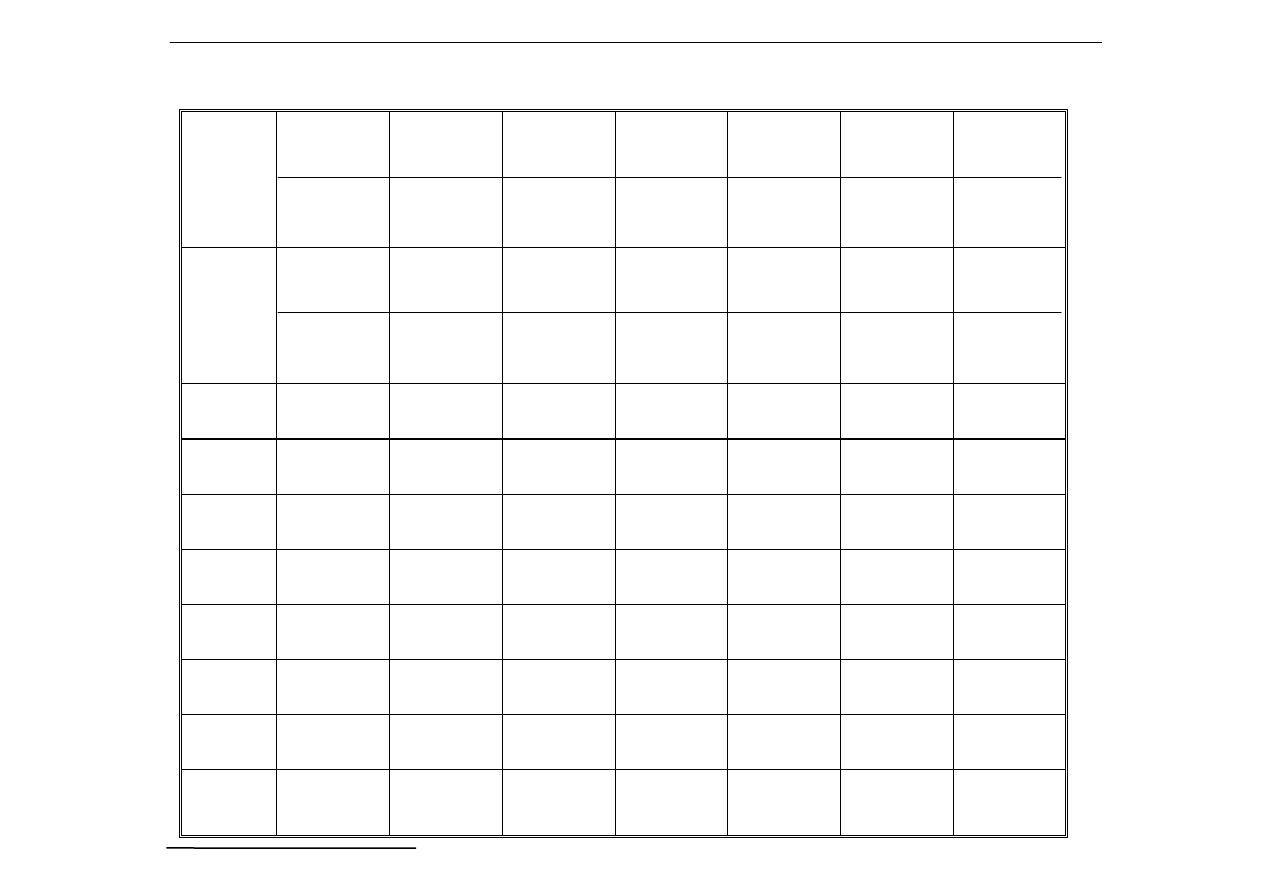
Tabela rozpuszczalności wybranych związków nieorganicznych:
OH
-
F
-
Cl
-
Br
-
I
-
S
2-
SO
4
2-
CO
3
2-
PO
4
3-
Na
+
K
+
Mg
2+
B
B
B
B
Ca
2+
B
B
B
B
Al
3+
B
B
B
B
B
Pb
2+
B
B
B
B
ś
Cza
B
B
B
Zn
2+
B
B
B
B
B
Ag
+
Br
B
ś
ś
Cza
ś
ś
Cu
2+
N
Br
Cza
N
N
Fe
2+
B
Cza
B
N
Fe
3+
Br
Br
Br
Br
ś
Ni
2+
Z
Cza
Z
Z
Co
2+
R
Cza
Cze
Fi
Cr
3+
Z
Z
Cza
Z
Kolory związków trudnorozpuszczalnych:
B - biały
Cza – czarny Cze - czerwony Br - brązowy
R - różowy Z - zielony N - niebieski Fi - fioletowy
ś - żółty
Puste pole oznacza iż dany związek chemiczny jest rozpuszczalny
w wodzie.
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
36 / 39
Przykładowe wartości pI
r
dla I = 0 w temp. 298 K
CO
3
2-
Ag
+
11,09
Mg
2+
4,05
Ba
2+
8,69
Ni
2+
8,18
Ca
2+
8,41
Pb
2+
13,13
Cd
2+
12,00
Zn
2+
10,84
Co
2+
9,98
Fe
2+
10,46
PO
4
3-
Ag
+
19,89
Pb
2+
42,10
Al
3+
18,24
Mg
2+
25,20
Zn
2+
32,04
Bi
3+
22,89
Cr
3+
26,0
CaH
3+
6,66
Fe
3+
21,89
AsO
4
3-
Ag
+
22,0
Al
3+
15,80
Ba
2+
50,11
Bi
3+
9,36
Ca
2+
18,17
Cd
2+
32,66
Co
2+
28,12
Cu
2+
35,12
Cr
3+
20,11
Fe
3+
20,24
Mg
2+
19,68
Mn
2+
28,72
Ni
2+
25,51
Pb
2+
35,39
Ag
+
49,2
Bi
3+
97,0
Cd
2+
26,1
Co
2+
20,4
Cu
+
47,6
Cu
2+
35,2
S
2-
Hg
2+
49,2
Fe
2+
17,2
Mn
2+
9,6
Ni
2+
18,5
Pb
2+
26,6
Sn
2+
25,9
Zn
2+
23,8
SO
4
2-
Ba
2+
9,77
Ca
2+
4,37
Pb
2+
7,78
Sr
2+
6,49
F
-
Ca
2+
10,40
Mg
2+
8,19
Pb
2+
7,57
Cl
-
Pb
2+
4,79
Ag
+
9,75
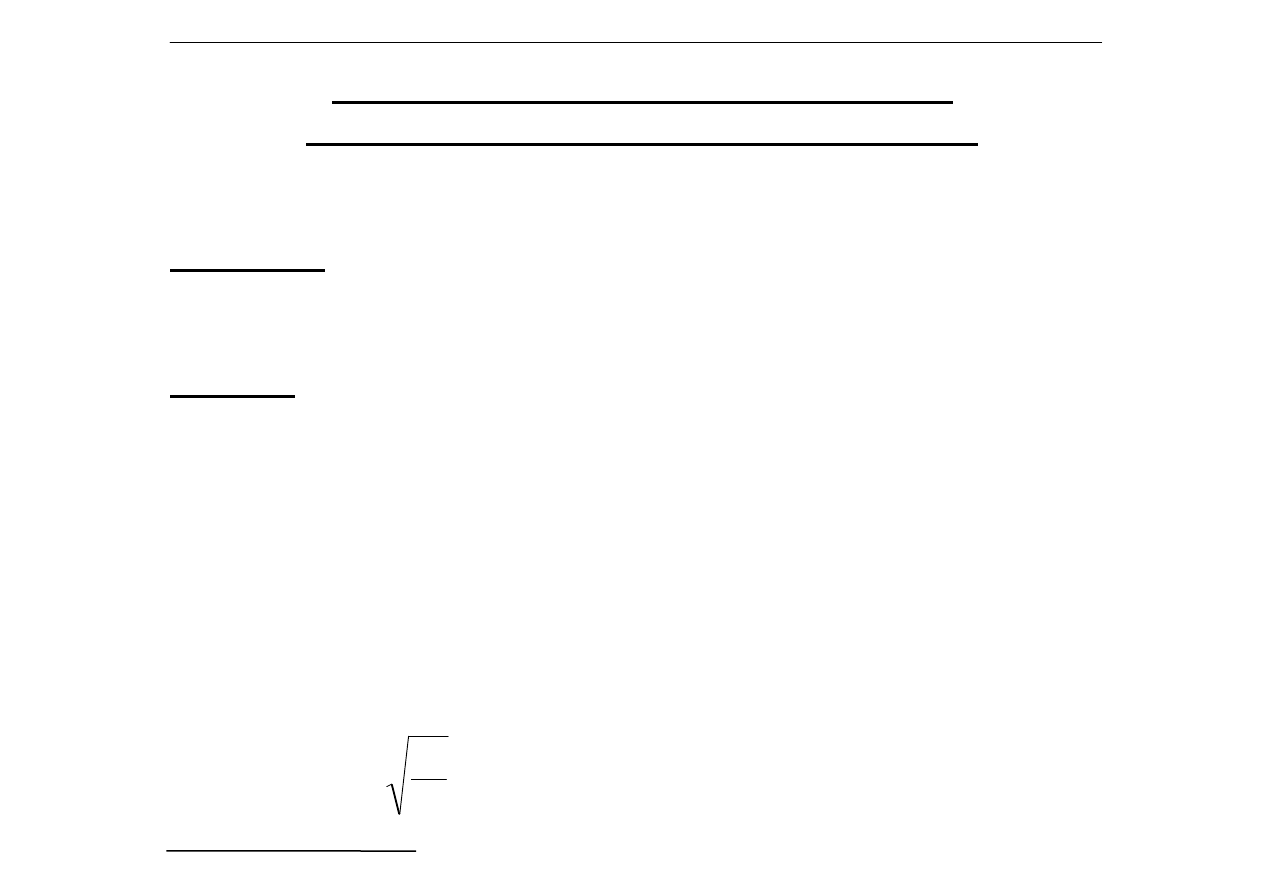
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
37 / 39
Jak obliczyć rozpuszczalność związku
słaborozpuszczalnego w czystej wodzie?
(brak dodatkowych jonów wspólnych)
Przykład:
wodny nasycony roztwór Ag
2
CrO
4
:
Ag
2
CrO
4
⇔
⇔
⇔
⇔
2Ag
+
+ CrO
4
2-
Uwaga:
Ag
2
CrO
4
należy traktować jako związek "złożony"
z Ag
+
i CrO
4
2-
- inaczej więc należałoby pisać Ag
2
[CrO
4
]
Stężenie molowe Ag
2
CrO
4
w roztworze wodnym nad
osadem to tzw. rozpuszczalność tej soli w wodzie - R =
I
r
= [Ag
+
]
2
[CrO
4
2-
] = (2R)
2
R = 4R
3
Stąd:
3
r
4
I
=
R

Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
38 / 39
Uwaga:
W
tych
rozważaniach
nie
uwzględniono
hydrolizy jonów Ag
+
i CrO
4
2-
Rozpuszczalność w obecności elektrolitu zawierającego
jony wspólne
Rozpuszczalność Ag
2
CrO
4
w obecności K
2
CrO
4
(jony
wspólne, tj. CrO
4
2-
) oznaczane są jako R
1
:
I
r
= [Ag
+
]
2
[CrO
4
2-
] = (2R)
2
⋅⋅⋅⋅
(R + c
K2CrO4
)
Rozpuszczalność zmaleje, więc:
R
1
<< c
K2CrO4
I
r
= (2R
1
)
2
⋅⋅⋅⋅
c
K2CrO4
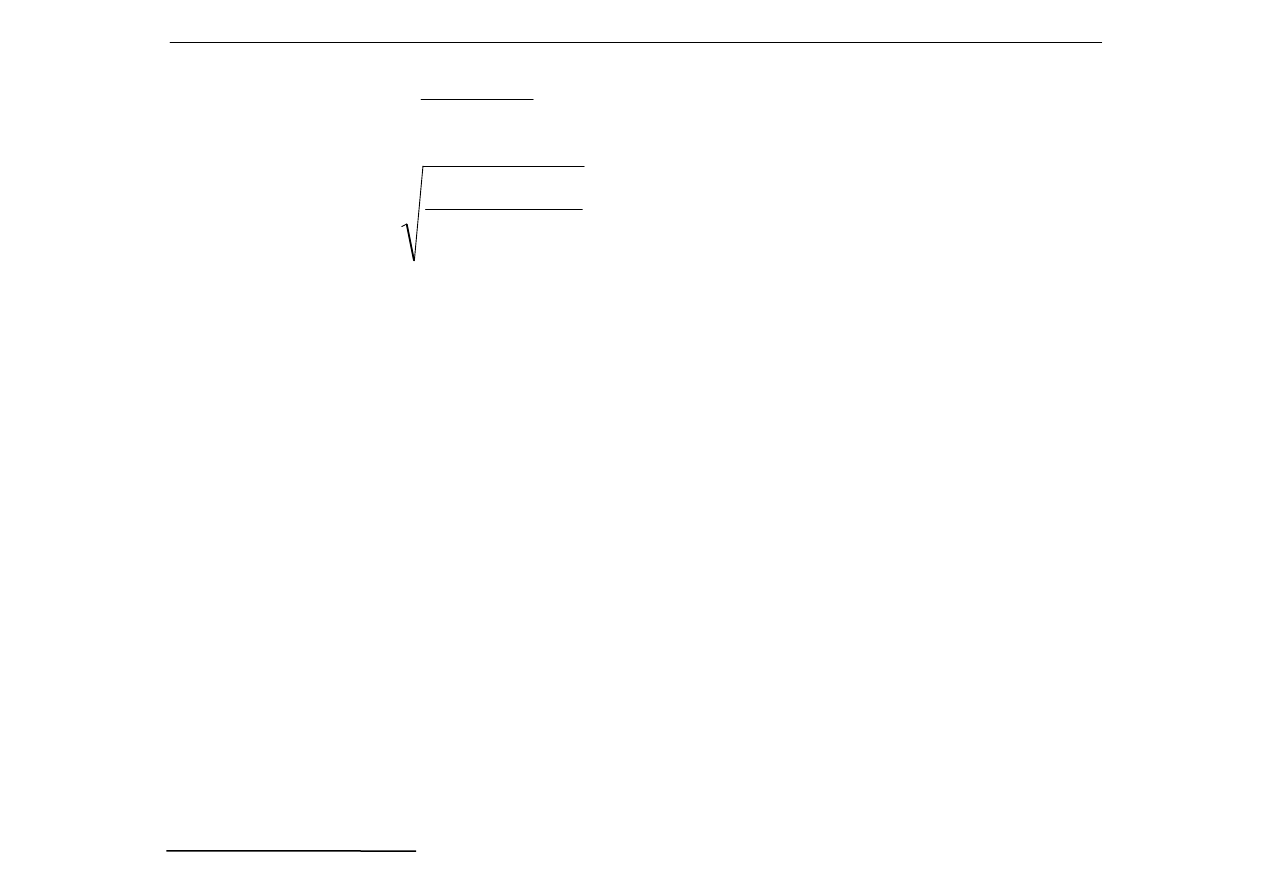
Władysław Walkowiak - Chemia Ogólna. WPC1002w
Rozdział 11b. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
39 / 39
R
1
<< R
4
2
4
2
CrO
K
r
1
CrO
K
r
2
1
c
4
I
=
R
c
I
=
4R
⋅⋅⋅⋅
Wyszukiwarka
Podobne podstrony:
Wyklad 11b. Elektrolity - cd., pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Hydroliza soli iloczyn rozpuszczalności
Z Rownowagi dys słabe hydroliza iloczyn rozpuszczalnosci
Iloczyn rozpuszczalności, CHEMIA, semestr 1, chemia ogólna, wykłady
Elektrodynamika cd kolo, elektra, elektrotechnika gajusz, elektrotechnika gajusz, Wykłady z elektry
Elektrodynamika cd, elektra, elektrotechnika gajusz, elektrotechnika gajusz, Wykłady z elektry
Wyklad 7 Wlasnosci elektryczne metali
Wykład 1 cd2, Elektrotechnika-materiały do szkoły, Gospodarka Sowiński
iloczyn rozpuszczalności
Patofizjologia ukł. krążenia cz. 1, Farmacja UMB, Patofizjologia, Wykłady w formie elektronicznej
Iloczyn rozpuszczalnosci roztwo Nieznany
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Wykład 3 'Praca Elektrowni W SEE'
Iloczyn rozpuszczalności
Wyklad 11a. Elektrolity, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
więcej podobnych podstron