PRACA ABSOLUTNA, UŻYTECZNA, TECHNICZNA
Praca absolutna (bezwzględna)
Praca użyteczna (gdy
0)
,
gdzie:
- ciśnienie otoczenia,
- praca kompresji otoczenia.
Praca techniczna
CIEPŁO WŁAŚCIWE, CIEPŁO PRZEMIANY
Ciepło właściwe (właściwa pojemność cieplna)
c – ilość ciepła potrzebna do ogrzania 1 kg ciała o 1 stopień;
·
Dla gazów doskonałych – wartość stała!
Kilomolowe ciepło właściwe (kilomolowa pojemność cieplna właściwa)
(Mc) – ilość ciepła potrzebna do ogrzania 1 kmol ciała o 1 stopień;
·
Dla gazów doskonałych – wartość stała!
Przy rozpatrywaniu gazów mamy do czynienia z dwoma rodzajami ciepła właściwego:
a)
z ciepłem właściwym w stałej objętości c
v
(izochoryczna pojemność cieplna
właściwa),
b)
z ciepłem właściwym pod stałym ciśnieniem c
p
(izobaryczna pojemność cieplna
właściwa).
Dla gazów doskonałych i półdoskonałych istnieje zależność:
c
p
– c
v
= R.
Analogicznie:
(Mc
p
) – (M c
v
)= MR, a więc:
(Mc
p
) – (M c
v
)= 8314,5
!
"#$%·&
Kilomolowe ciepło właściwe gazów doskonałych
Średnie ciepło właściwe dla zakresu temperatur od T
1
do T
2
'(|
*
*
- wartość zależna od rodzaju ciała oraz od zakresu temperatur!
Analogicznie można zapisać różne rodzaje ciepła właściwego dla danego zakresu temperatur:
'+(|
*
*
, '
(
,
|
*
*
, '
(
-
*
*
, '
+(
,
|
*
*
, '
+(
-
*
*
.
W tablicach podaje się najczęściej wartości średniego ciepła właściwego w zakresie od 0
o
C
(lub od 0 K) do różnych temperatur. W celu obliczenia średniego ciepła właściwego w
zakresie temperatur od T
1
do T
2
należy skorzystać z zależności:
'.|
/
0
/
1
'.|
2
/1
·/
1
'.|
2
/0
·/
0
/
1
/
0
.
W przypadku kilomolowych pojemności cieplnych właściwych gazów doskonałych i
półdoskonałych:
'3.
4
-
2
/
–
'3.
5
|
2
/
=
8314,5
6
789:
⋅⋅⋅⋅
;
Ciepło właściwe roztworu gazów
. < =
>
· .
>
8
>?0
,
J
kg · K
3. < D
>
· 3.
>
8
>?0
,
J
kmol · K
Ciepło przemiany
Dla gazów doskonałych ze stałym ciepłem właściwym:
H
01
8 · . · /
1
/
0
,
H
01
I · 3. · /
1
/
0
.
Dla pozostałych:
H
01
8 · '.|
/
0
/
1
· /
1
/
0
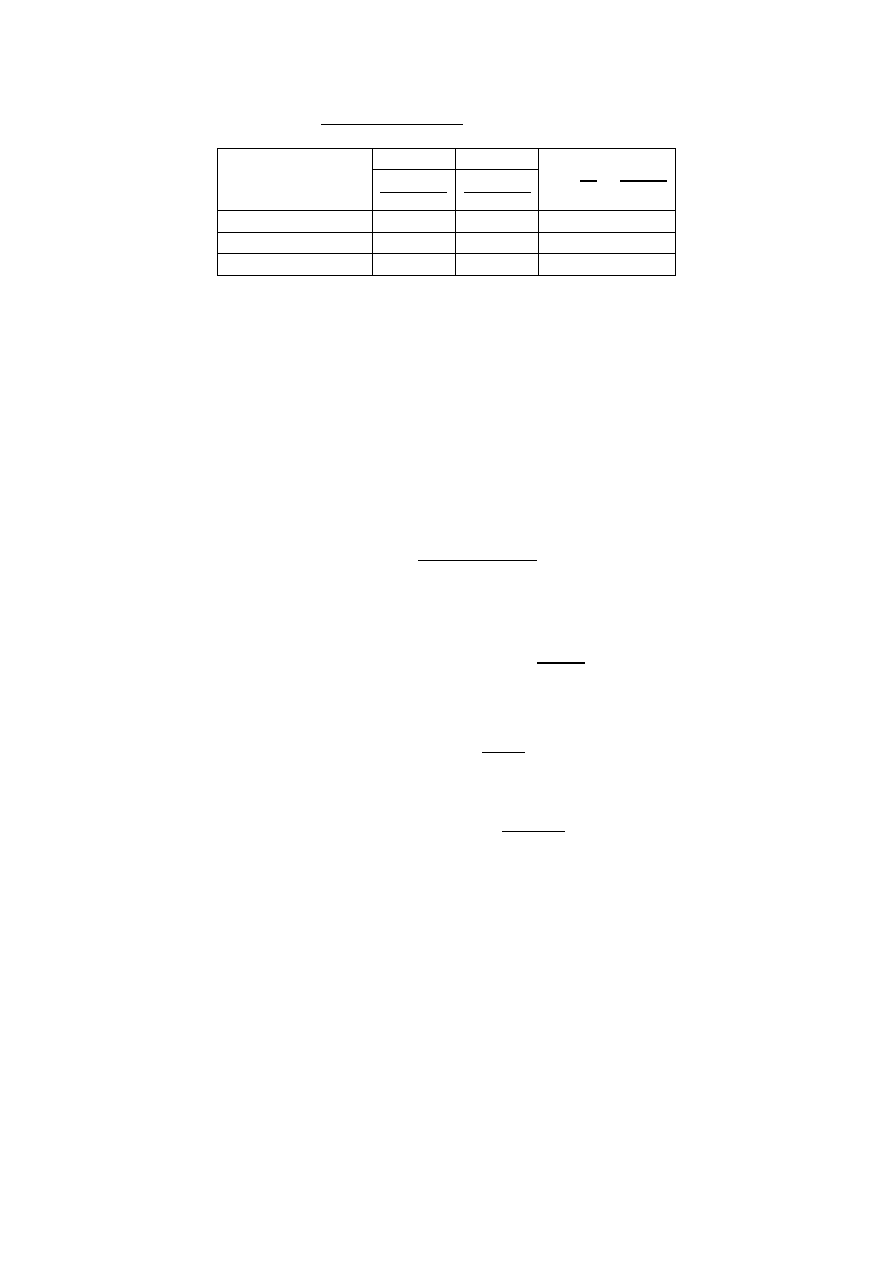
Gazy
(Mc
v
)
(Mc
p
)
κ
(
(
,
+(
+(
,
J
KLMN · O
J
KLMN · O
1-atomowe
12500
20800
1,67
2-atomowe
20800
29100
1,40
3- i więcej atomów
24900
33300
1,33

Ciepło Q
0-2
jest sumą ciepła Q
0-1
koniecznego do ogrzania ciała od 0 K (lub 0
o
C) do
temperatury T
1
(ew. t
1
) i ciepła Q
1-2
potrzebnego do ogrzania tego ciała od temperatury T
1
do
T
2
(lub od t
1
do t
2
). Stąd można zapisać:
H
01
P
P
L · '(|
*
· Q
0 L · '(|
*
· Q
0
L · '(|
*
· Q
L · '(|
*
· Q
8 · R'.|
2
/
1
· /
1
'.|
2
/
0
· /
0
S
Analogicznie można wyprowadzić wzór:
H
01
I · T'R3.
4
S-
2
/
1
· /
1
'R3.
4
S-
2
/
0
· /
0
U.
PIERWSZA ZASADA TERMODYNAMIKI
Energia wewnętrzna
U = m
⋅⋅⋅⋅
u, J,
gdzie:
m – masa, kg,
u – energia wewnętrzna właściwa, J/kg
Analogicznie:
U = n
⋅⋅⋅⋅
(Mu)
Dla gazów doskonałych można zapisać zależności:
u = c
v
⋅⋅⋅⋅
T,
(Mu) = (Mc
v
)
⋅⋅⋅⋅
T
Stąd:
U = m
⋅⋅⋅⋅
c
v
⋅⋅⋅⋅
T = n
⋅⋅⋅⋅
(Mc
v
)
⋅⋅⋅⋅
T
Dla gazów półdoskonałych – analogicznie:
u = '
.
5
|
2
/
⋅⋅⋅⋅
T,
(Mu) ='
3.
5
|
2
/
⋅⋅⋅⋅
T
U = m
⋅⋅⋅⋅
'
.
5
|
2
/
⋅⋅⋅⋅
T = n
⋅⋅⋅⋅
'
3.
5
|
2
/
⋅⋅⋅⋅
T
Pierwsza zasada termodynamiki dla systemów zamkniętych – pierwsza postać równania
pierwszej zasady termodynamiki:
Q
d
=
∆∆∆∆
U + L
Q
d
= U
2
– U
1
+ L
1-2

Entalpia – suma energii wewnętrznej i energii przetłaczania (pracy przetłaczania)
I = U + p
⋅⋅⋅⋅
V, J
Entalpia właściwa (entalpia 1 kg czynnika)
i = u + p
⋅⋅⋅⋅
v, J/kg
Entalpia gazów doskonałych i półdoskonałych
i = u + p
⋅⋅⋅⋅
v = c
v
⋅⋅⋅⋅
T + R
⋅⋅⋅⋅
T = (c
v
+ R)
⋅⋅⋅⋅
T
Ponieważ: c
v
+ R = c
p
, można zapisać wzór na entalpię gazów doskonałych:
i = c
p
⋅⋅⋅⋅
T,
a także:
(Mi) = (Mc
p
)
⋅⋅⋅⋅
T.
Stąd:
I = m
⋅⋅⋅⋅
c
p
⋅⋅⋅⋅
T = n
⋅⋅⋅⋅
(Mc
p
)
⋅⋅⋅⋅
T, J
Dla gazów półdoskonałych można zapisać:
i = '
.
4
-
2
/
⋅⋅⋅⋅
T,
a także:
(Mi) = '
R3.
4
S -
2
/
⋅⋅⋅⋅
T
oraz:
I = m
⋅⋅⋅⋅
'
.
4
-
2
/
⋅⋅⋅⋅
T = n
⋅⋅⋅⋅
'
R3.
4
S -
2
/
⋅⋅⋅⋅
T, J
Energia dopływająca do układu lub odpływająca z układu wraz ze strumieniem czynnika
(np. rurociągiem) jest sumą entalpii, energii potencjalnej, kinetycznej i chemicznej czynnika.
Jeśli prędkość gazu w<40 m/s oraz wysokość h<100 m to z błędem mniejszym od 1% można
zapisać:
E
d
= I = m
⋅⋅⋅⋅
i = n
⋅⋅⋅⋅
(Mi)
Pierwsza zasada termodynamiki dla systemów otwartych – druga postać równania
pierwszej zasady termodynamiki – bilans maszyny przepływowej:
Q
d
=
∆∆∆∆
I + L
t 1-2
Q
d
= I
2
– I
1
+ L
t 1-2
Wyszukiwarka
Podobne podstrony:
Praca absolutna, ciepło właściwe, I zasada termodynamiki
2.12 molowe ciepło właściwe, materiały, Fizyka
Praca licencjacka wersja właściwa
I zasada Termodynamiki
2 Bilans energii Pierwsza zasada termodynamiki
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
fizyka lab3 cieplo wlasciwe Wstęp laboratorium 3
CIEPLO WLASCIWE id 117049 Nieznany
18 entropia i II zasada termodynamiki
Ciepło właściwe (test, Ściągi, notatki, materiały szkolne
ciepło właściwe gazu
16 I zasada termodynamiki
bryja, fizyka ciała stałego II, Ciepło właściwe wg Debye’a
I Zasada Termodynamiki rozszerzenie id 208487
bryja, fizyka ciała stałego II, Ciepło właściwe wg Debye’a
zasada termodynamiki Nernsta (twierdzenie Nernsta)
ciepło właściwe metalu, studia, fizyka
więcej podobnych podstron