
TRAWIENIE BIAŁEK

PROTEOLIZA
•
Rozpad białek zachodzi pod działaniem enzymów
proteolitycznych, które huydrolizują wiązanaia peptydowe.
•
Proces ten nazywamy – proteolizą.
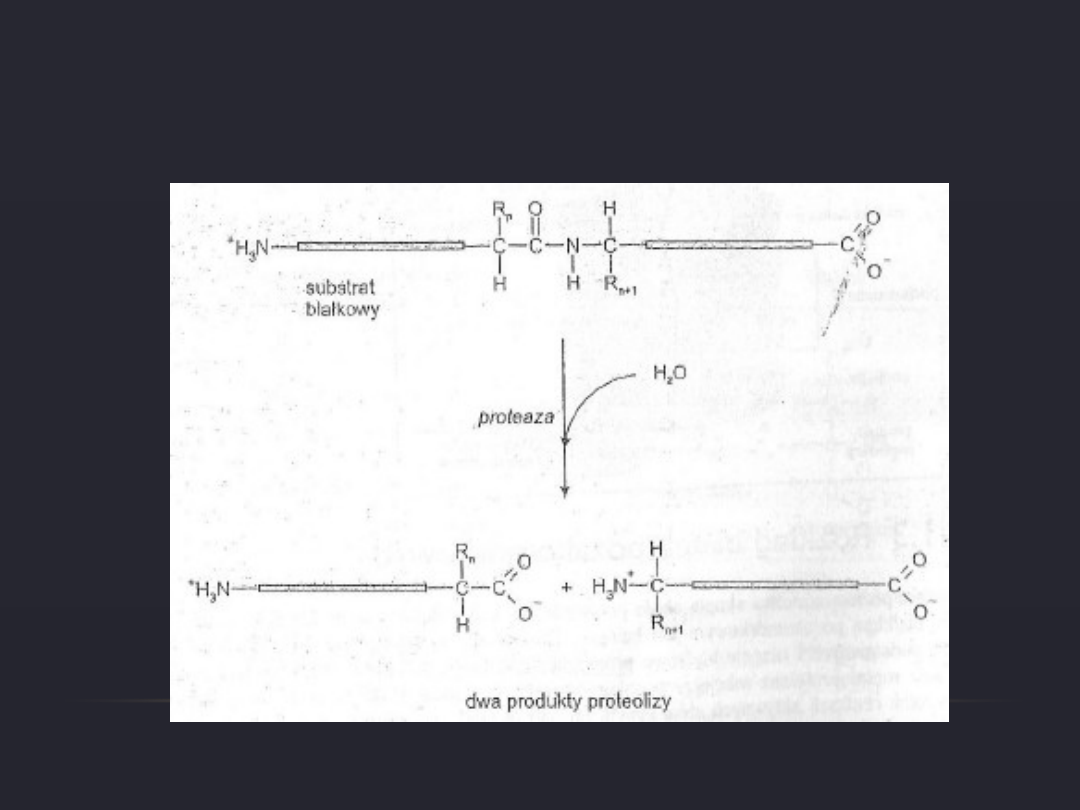
REAKCJA PROTEOLIZY

ENZYMY PROTEOLITYCZNE/PROTEAZY/PEPTYDAZY
DZIELIMY NA:
•
Egzopeptydazy
•
Aminopeptydazy – odłączają aminokwasy N-końcowe
•
Koarboksypeptydazy – odłączają aminokwasy C-końcowe
•
Endopeptydazy – hydrolizują wiązanie peptydowe położone w
środku łańcucha białkowego (prowadzą do fragmentacji peptydu)

•
Proteazy możemy podzielić ze
względu na budowę ich miejsca
aktywnego na:
•
Serynowe
•
Cysteinowe
•
Asparaginianowe
•
Treoninowe
•
Metaloproteinazy (najczęściej z
jonem Zn2+)

ROZPAD BIAŁEK POKARMOWYCH
W sokach trawiennych przewodu pokarmowego znajdują
się enzymy:
•
W soku żołądkowym – pepsyna
•
W soku trzustkowym – trypsyna, chymotrypsyna,
elastaza i karboksypeptydaza
•
W soku jelitowym - aminopeptydaza

PEPSYNA
•
Optymalne pH: 1-2 (białko ulega denaturacji)
•
Rozkłada wiązanie peptydowe powstałe z
udziałem gryup aminowych aminokwasów
aromatycznych i kwaśnych oraz pomiędzy
waliną i leucyną
•
Jest endopeptydazą

TRYPSYNA
•
Optymalne pH: 8
•
Rozkłada wiązania peptydowe z udziałem grup
karboksylowych aminokwasów lizyny i
argininy.

CHYMOTRYPSYNA
•
Optymalne pH: 8
•
Rozkłada wiązania peptydowe z udziałem grup
karboksylowych aminokwasów aromatycznych:
fenyloalaniny, tyrozyny i tryptofanu

ELASTAZA
•
Optymalne pH: 8
•
Rozkłada wiązania peptydowe pomiędzy
różnymi aminokwasami obojętnymi,
szczególną aktywnośc wykazuje wobec
elastyny.

KARBOKSYPEPTYTAZA A
•
Opymalne pH: 8
•
Odłącza różne aminokwasy C-końcowe, z
wyjątkiem lizyny i argininy

KARBOKSYPEPTYDAZA B
•
Optymalne pH: 8
•
Odłącza aminokwasy C-końcowe, argininę i
lizynę, przez co uzupełnia działania
karboksypeptydazy A

WCHŁANIANIE AMINOKWASÓW
•
Aminokwasy powstające w wyniku hydrolizy białek
transportowane są przez rąbek szczoteczkowy przy
udziale PLP przez liczne przenośniki podobne do
SGLT-1
•
Wyróżniamy następujące przenośniki:
•
Zależne od Na+: dla aa obojętnych
•
Niezależne od Na+: dla aa lipofilnych i
obojętnych

•
Flora bakteryjna jelita powoduje
przekształcenie niewchłoniętych
aminokwasów.
•
Aminowkwasy siarkowe przekształcane są w
tiole, z których powastaje siarkowodór.
•
Powastały z deaminacji amoniak dostaje się do
krążenia wrotnego, skąd eliminuje go wątroba.

ROZPAD BIAŁEK
WEWNĄTRZKOMÓRKOWYCH
•
Rozkład zachodzi pod działaniem proteaz
wewnątrzkomówrkowych.
•
Niektóre białka przeznaczone do rozkładu są
znakowane ubikwityną.
•
W komórce eukariotycznej są dwa szlaki
preteolizy: lizosomalny i pozalizosomalny

SZLAK LIZOSOMALNY
•
We wnętrzu lizosomu znajduje się około 40
enzymów hydrolitycznych, wśród nich wystepują
proteazy zwane katepsynami (od A do S)
•
Działają one głównie w kwaśnym zakresie pH, w
miejscach aktywnych zawiarają cysteinę,
asparaginian lub serynę.
•
Najliczniej występują katepsyny cysteinowe (B,H,L)
•
W pewnych przypadkach katepsyny mogą
wydostawać się do cytosolu, a nawet poza
komórkę – do krwioobiegu.

SZLAK LIZOSOMALNY CD.
•
Łączne działanie wielu katepsyn prowadzi do
doszczętnej degradacji białek
wewnątrzkomórkowych
•
Proteoliza lizosomalna nie wymaga
ubikwitynacji substratu białkowego

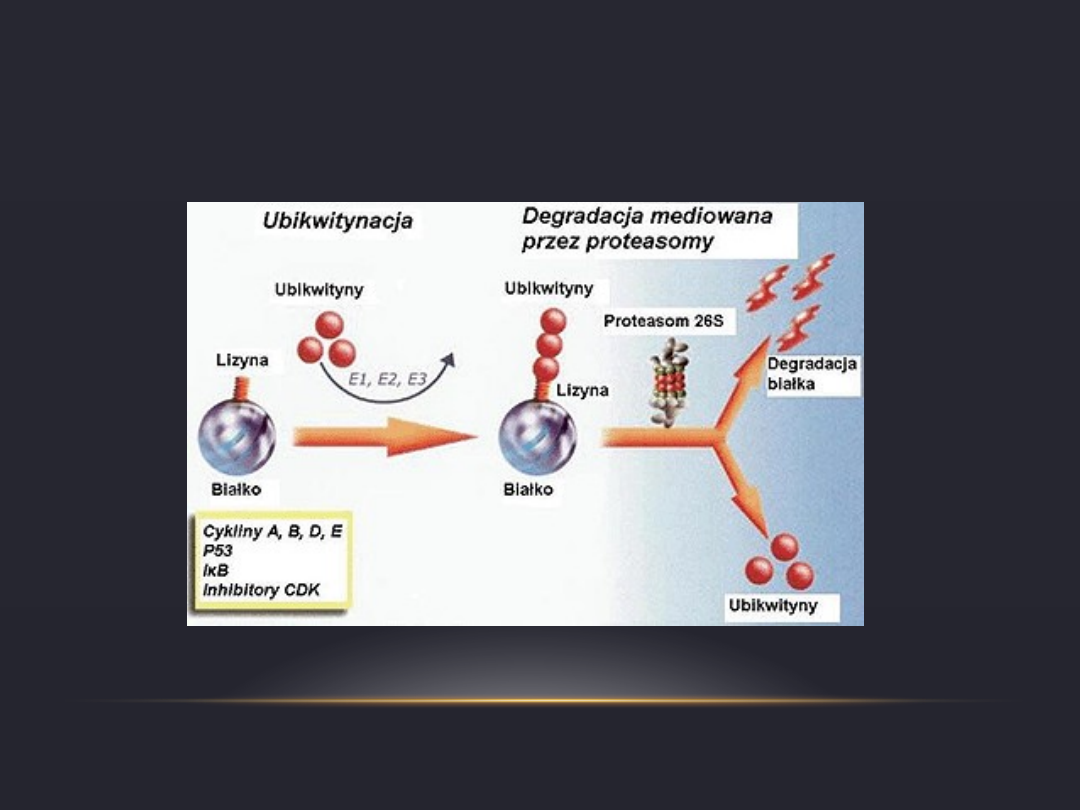
UBIKWITYNA
•
Jest oina obecna we wszystkich komórkach
eukariotycznych
•
jej aminokwasem C-końcowym jest glicyna
•
Grupa karboksylowa wytwarza wiązanie
izopeptydowe z grupą ε-aminową należącą do
lizyny (przy zużyciu ATP)
•
W procesie tym pośredniczą 3 enzymy: E1, E2 i E3
•
Zwykle białko przeznaczone do degradacji wiąże
się z szeregiem cząsteczek ubikwityny
(kompleksem poliubikwitynowym)

SZLAK POZALIZOSOMALNY
•
Funkcjonuje w:
•
Cytosolu
•
Mitochondriach
•
Siateczce endoplazmatycznej
•
Aparacie Golgiego
•
Jądrach komórkowych

SZLAK POZALIZOSOMALNY CD.
•
Największe znaczenie ma proteasom. Jest to
kompleks wieloenzymatyczny rozkładający
białka oznakowane ubikwityną. Występuje w
jądrach i cytozolu wszystkich komórek
eukariotycznych.
•
Typowa komórka ludzka zawiwera około 30
000 proteasomów.
•
Ze względu na stałą sedymentacji jest
nazywany proteasomem 20S
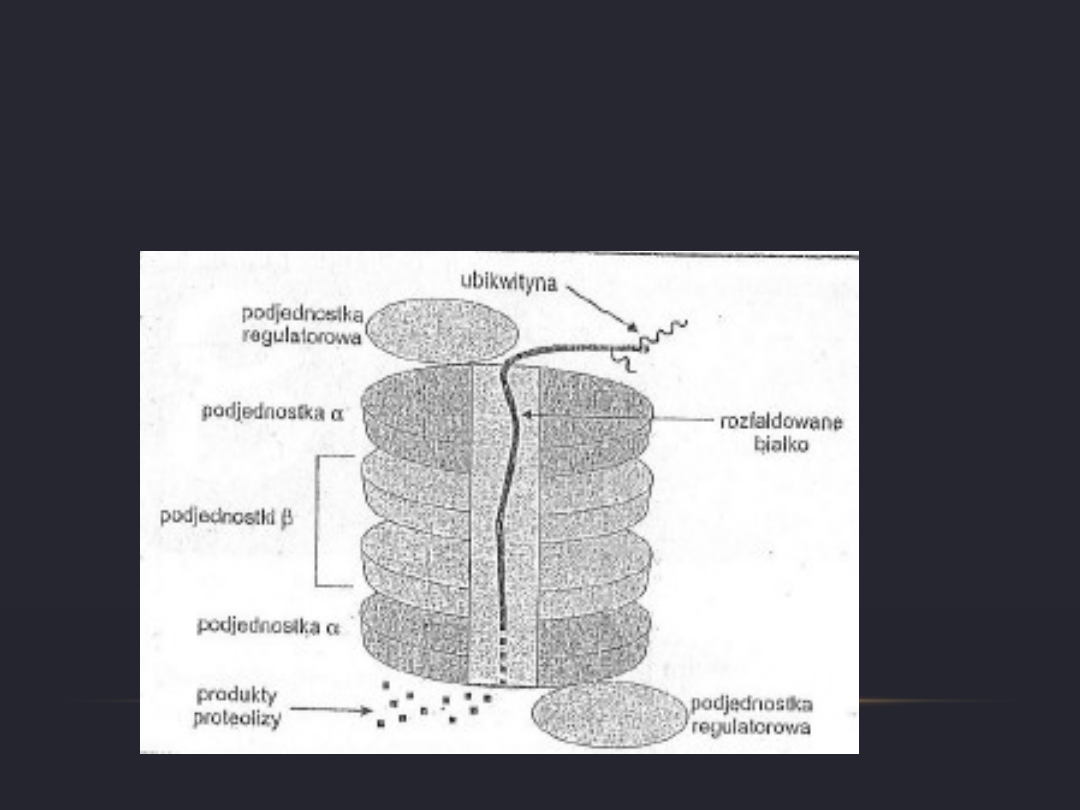
PROTEASOM 20S
•
Składa się z 28 podjednostek ułożonych w cztery
współosiowe pierścienie (jeden pierścień – 7
podjednostek)

PROTEASOM 20S CD.
•
Podjednostki β tworzą kanał w którym znajdują
się miejsca aktywne proteaz.
•
Podjednostki α zapewniają selektywność
proteolityczną proteasomu. Pełnią funkcję
filtra, który pozwala na wniknięcie tylko białek
oznakowanych ubikwityną.
•
Proteasom 20S wiąże na swoich
przeciwstawnych biegunach dwa kompleksy
regulatorowe o stałej sedymentacji 19S, tak
powstaje proteasom 26S

KOMPLEKS REGULATOROWY
•
Składa się z wielu podjednostek, conajmniej 6
z nich wykazuje aktywność ATP-azową.
•
Podjednostki te prawdopodobnie uczestniczą w
rozfałdowywaniu substratów białkowych
kosztem energii uwalnianej z ATP

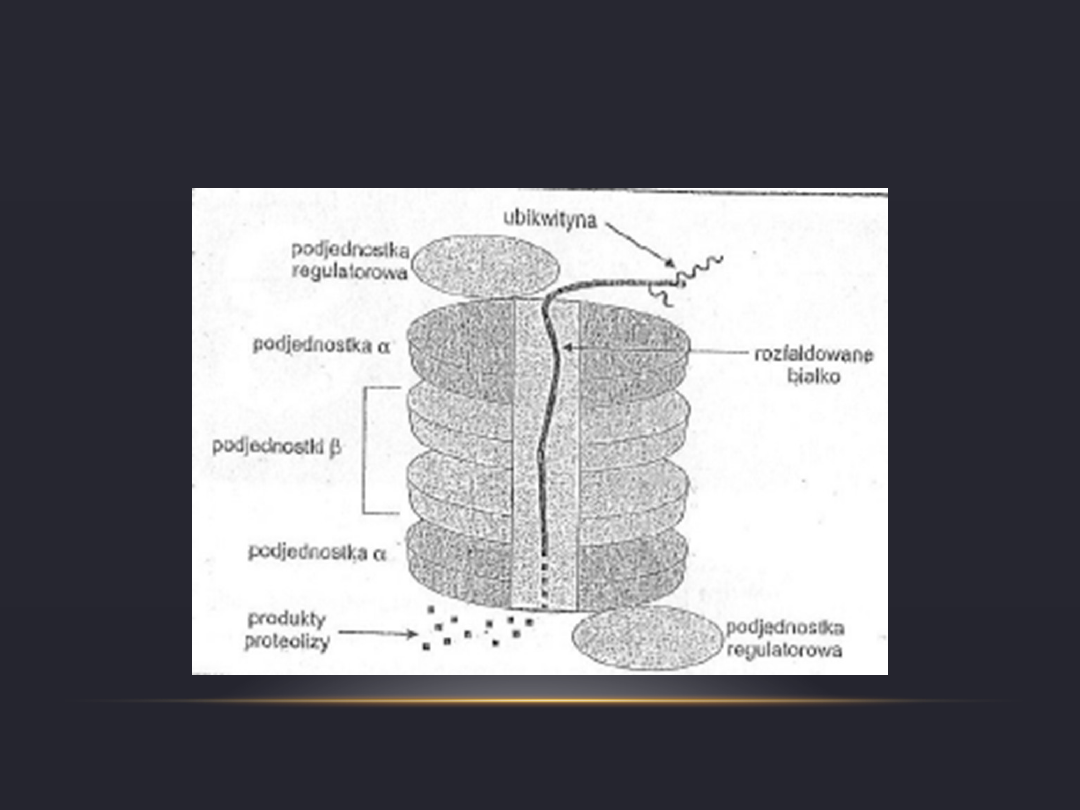
DZIAŁANIE PROTEASOMU 26S
•
Cząsteczka substratu białkowego, pozbawiona
struktury przestrzennej w wyniku rozfałdowania
wnika do wnętrza kanału wytworzonego przez
podjednostki proteasomu, gdzie ulega rozpadowi.
•
Różne białka sa degradowane z różną prędkością
(od kilku minut do kilku tygodni) szybkość
rozkładu białek zależy od stanu fizjologicznego
narządu.
•
Degradacja białek mięśni szkieletowych zwiększa
się podczas głodu.

ROZPAD BIAŁEK POZAKOMÓRKOWYCH
•
Głównym białkiem pozakomórkowym jest kolagen,
licznie występują również: elastyna, glikoproteiny
błon podstawnych i rdzenie białkowe.
•
Rozpad białek pozakomórkowych zachodzi z
udziałem metaloproteinaz (atom Zn2+ w miejscu
aktywnym)
•
Metaloproteinazy są wydzielane poza komórkę w
postaci nieaktywnych prekursorów – zymogenów.
(odłączają fragment polipeptydowy przechodząc
w formę aktywną)

METALOPROTEINAZY
•
Są wiązane przez składniki macierzy
pozakomórkowej.
•
Są endopeptydazami.
•
Produkty proteolizy zachodzącej poza
komórką, ulegają endocytozie i dalej są
rozkładane do produktów
drobnocząsteczkowych.
•
Najlepiej poznanymi metaloproteinazami są
kolagenazy i żelatynazy.

•
Trawienie kolagenu ze względu na jego
trihelikalną strukturę jest utrudnione. Enzymy
rozkładające kolagen nazywamy
kolagenazami.
•
Żelatyna (zdenaturowany kolagen) jest łatwo
rozkładana przez proteazy.

ROZKŁAD CZĄSTECZKI
TROPOKOLAGENU
•
Kolagenaza tkankowa rozkłada tropokolagen
na tropokolagen A i tropokolagen B (o niskiej
temperaturze topnienia, które w fizjologicznej
temperaturze organizmu ulegają denaturacji)
•
Wnikają do komórki drogą endocytozy i są
dalej trawione przez nieswoiste proteazy do
produktów drobnocząsteczkowych.
Document Outline
- Slide 1
- Proteoliza
- Reakcja proteolizy
- Enzymy proteolityczne/proteazy/peptydazy dzielimy na:
- Slide 5
- Rozpad białek pokarmowych
- Pepsyna
- Trypsyna
- Chymotrypsyna
- Elastaza
- Karboksypeptytaza A
- Karboksypeptydaza B
- Wchłanianie aminokwasów
- Slide 14
- Rozpad białek wewnątrzkomórkowych
- Szlak lizosomalny
- Szlak lizosomalny cd.
- Ubikwityna
- Slide 19
- Szlak pozalizosomalny
- Szlak pozalizosomalny cd.
- Proteasom 20S
- Proteasom 20S cd.
- Kompleks regulatorowy
- Działanie proteasomu 26S
- Slide 26
- Rozpad białek pozakomórkowych
- metaloproteinazy
- Slide 29
- Rozkład cząsteczki tropokolagenu
Wyszukiwarka
Podobne podstrony:
Konspekt trawienie białek, tłuszczów i węglowodanów
Trawienie białek, studia, Biomedyczne podstawy rozwoju i wychowania
Trawienie białek. 5fantastic.pl , Ćwiczenia(1)
trawienie białek
Konspekt trawienie białek, tłuszczów i węglowodanów
trawienie białek
trawienie i wchłanianie białek
Temat pracy Rola składników odżywczych trawienie i przyswajanie białek, tłuszczów i węglowodanówx
trawienie, strawnośc, źródła białek, alergie
18. Trawienie i wchłanianie białek i węglowodanów, licencjat(1)
TRAWIENIE TŁUSZCZÓW CUKRÓW I BIAŁEK
Przykłady roli biologicznej białek
Właściwości fizykochemiczne białek
1 Przyswajanie białek przez organizmid 8658 ppt
właściwości białek mięśniowych
Trawienie i wchlanianie weglowodanow AW
Budowa Chemiczna Białek
więcej podobnych podstron