
1
1
Materiały internetowe
• http://www.angelo.edu/faculty/kboudr
ea/index/Notes_Chapter_08.pdf
• http://cwx.prenhall.com/petrucci/medi
alib/power_point/Ch24.ppt
• http://web.mit.edu/2.813/www/Class
%20Slides/Lecture
%207%20Mat.Prod.pdf
2
2
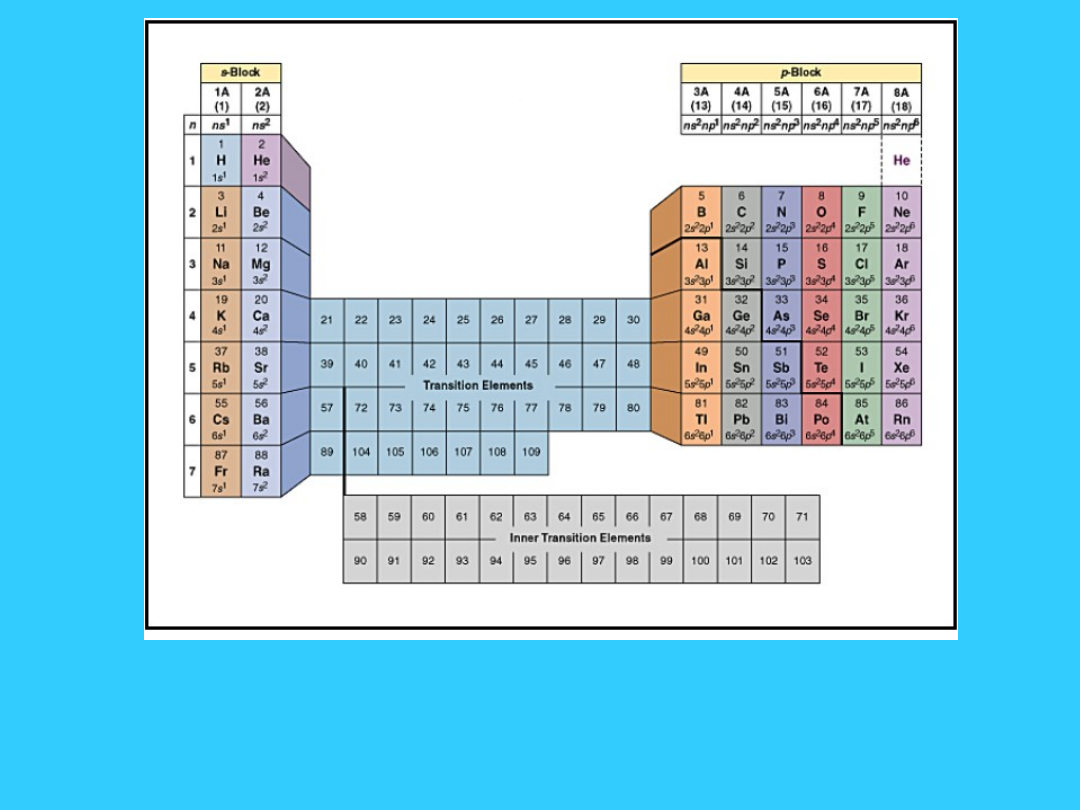
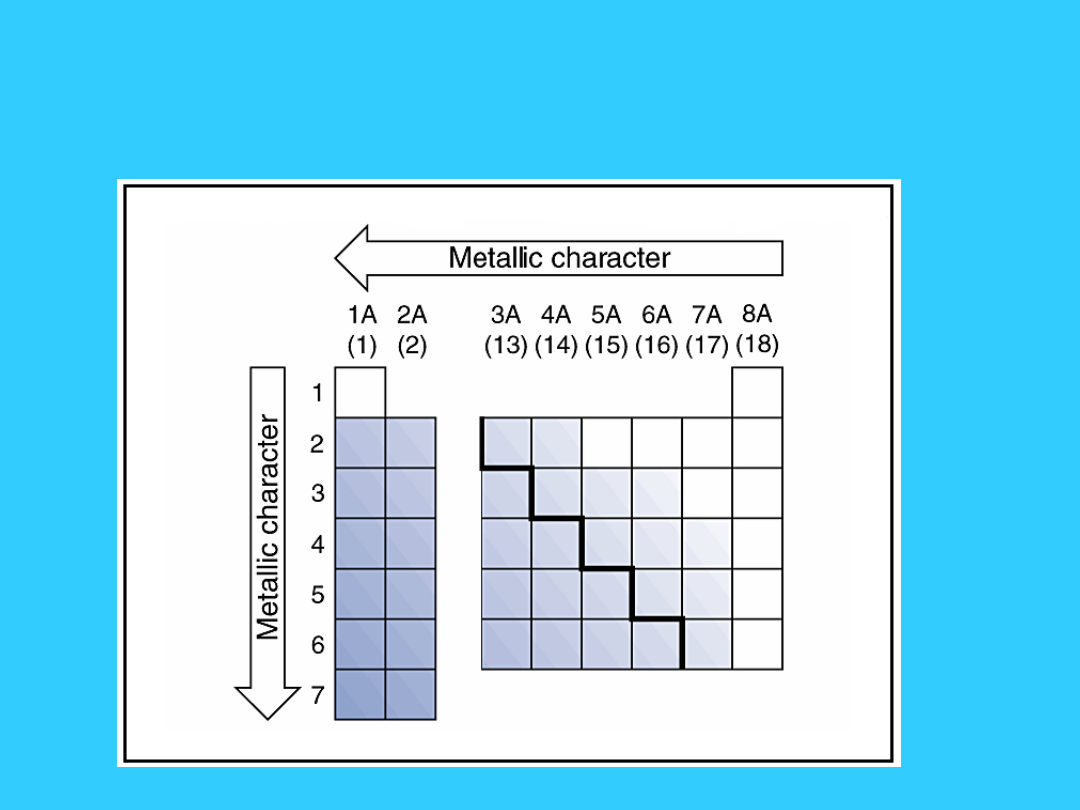
Przesuwając się z lewa na prawo, energia jonizacji wzrasta i
wzrasta powinowactwo elektronowe. Dlatego też charakter
metaliczny maleje gdy przesuwamy się z lewa na prawo w
danym okresie.
• Przesuwając się w dół grupy, energia jonizacji maleje, a
charakter metaliczny wzrasta
Przesuwając się z lewa na prawo, energia jonizacji wzrasta i
wzrasta powinowactwo elektronowe. Dlatego też charakter
metaliczny maleje gdy przesuwamy się z lewa na prawo w
danym okresie.
• Przesuwając się w dół grupy, energia jonizacji maleje, a
charakter metaliczny wzrasta
3
3
Zmiana charakteru
metalicznego grup
głównych
4
4
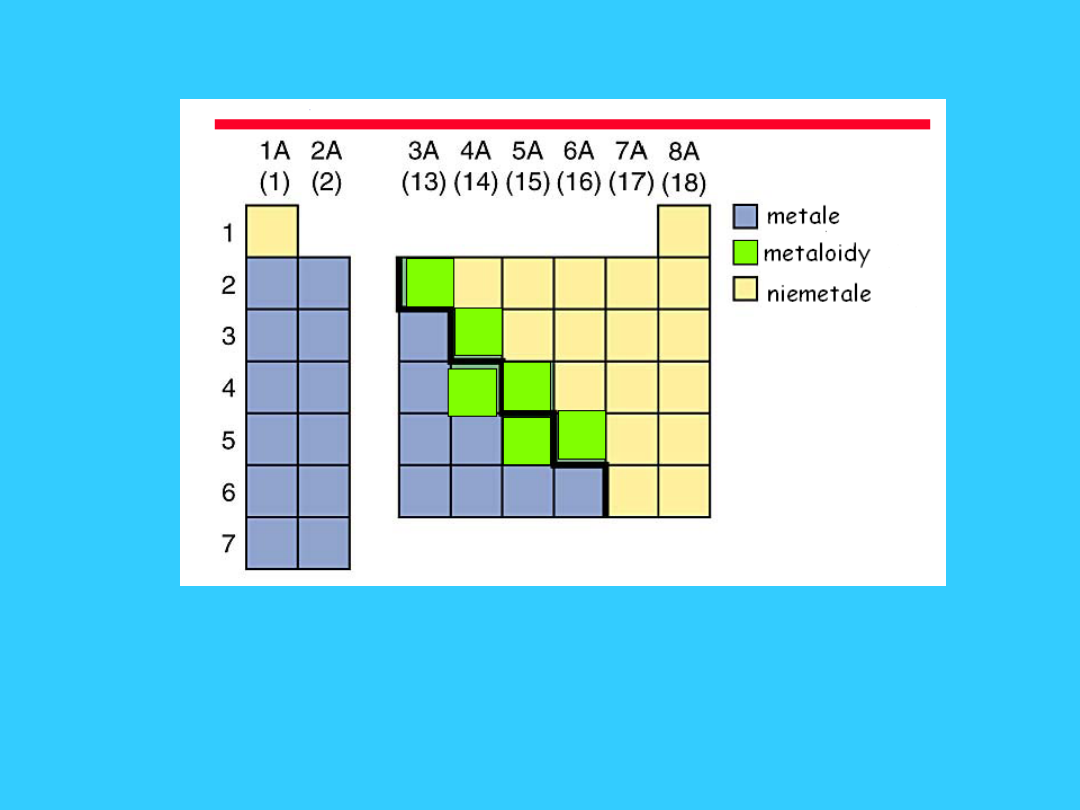
Metale, metaloidy,
niemetale
• metaloidy [gr.], chem. używana dawniej nazwa
pierwiastków, które w reakcjach chem. — w
zależności od warunków — mogą wykazywać
cechy metali (oddawać elektrony) lub niemetali
(pobierać je), jak german, antymon.
5
5
Właściwości metali i
niemetali
Metale
Niemetale
Własności atomowe
mało elektronów
walencyjnych
więcej elektronów
walencyjnych
większe promienie
atomowe
mniejsze promienie atomowe
niższe energie jonizacji
większe energie jonizacji
niższe elektroujemności
wyższe elektroujemności
Własności fizyczne
stałe w temperaturze
pokojowej
trzy stany skupienia
dobre przewodnictwo
elektryczne i cieplne
słabe przewodnictwo
elektryczne i cieplne
kowalne i ciągliwe
niekowalne, nieciągliwe
Własności
chemiczne
oddając elektrony stają
się kationami
przyjmując elektrony stają
się anionami
reagują z niemetalami
tworząc związki jonowe
reagują z metalami tworząc
związki jonowe
mieszane z innymi
metalami tworzą stopy
reagują z innymi
niemetalami tworząc związki
kowalencyjne

6
6
Reakcje metali z wodą
Wszystkie litowce (E
0
Me/Me+
=-3,05--2,92)
reagują z wodą z wydzieleniem wodoru.
Litowiec o największym promieniu atomowym
jest najbardziej reaktywny. Reaktywność
maleje wraz ze zmniejszaniem się promienia
atomowego. Rubid i Cez eksplodują przy
kontakcie z wodą.
2 M(s) + 2 H
2
O(l) = H
2
(g) + 2 OH
-
(aq) + 2 M
+
(aq)
Berylowce (E
0
=- 1,85- -2,91 V)
Roztwarzalność berylowców w wodzie:
Beryl - nie roztwarza się, a pozostałe - roztwarzają się
wg
reakcji:
Me + 2H
2
O = Me
2+
+ 2OH
-
+ H
2
Mg - na gorąco, a pozostałe - na zimno
Wszystkie litowce (E
0
Me/Me+
=-3,05--2,92)
reagują z wodą z wydzieleniem wodoru.
Litowiec o największym promieniu atomowym
jest najbardziej reaktywny. Reaktywność
maleje wraz ze zmniejszaniem się promienia
atomowego. Rubid i Cez eksplodują przy
kontakcie z wodą.
2 M(s) + 2 H
2
O(l) = H
2
(g) + 2 OH
-
(aq) + 2 M
+
(aq)
Berylowce (E
0
=- 1,85- -2,91 V)
Roztwarzalność berylowców w wodzie:
Beryl - nie roztwarza się, a pozostałe - roztwarzają się
wg
reakcji:
Me + 2H
2
O = Me
2+
+ 2OH
-
+ H
2
Mg - na gorąco, a pozostałe - na zimno

7
7
Reakcje metali z
wodorotlenkami
Cynk, cyna i glin roztwarzają się w
wodorotlenkach z wydzieleniem wodoru, gdyż
są to metale amfoteryczne.
Zn + 2OH
-
+ 2H
2
O = [Zn(OH)
4
]
2-
+ H
2
Sn + 2OH
-
+ 4H
2
O = Sn(OH)
6
2-
+ 2H
2
Al + OH
-
+ 3H
2
O = Al(OH)
4
-
+ 3/2H
2
Cynk, cyna i glin roztwarzają się w
wodorotlenkach z wydzieleniem wodoru, gdyż
są to metale amfoteryczne.
Zn + 2OH
-
+ 2H
2
O = [Zn(OH)
4
]
2-
+ H
2
Sn + 2OH
-
+ 4H
2
O = Sn(OH)
6
2-
+ 2H
2
Al + OH
-
+ 3H
2
O = Al(OH)
4
-
+ 3/2H
2

8
8
Reakcje metali z kwasami
1) Wodór może być wydzielany z roztworu przez
metale
o ujemnym potencjale a więc metale
nieszlachetne. Przykład:
Fe + 2H+ = Fe2+ + H2
Podobnie roztwarza się cynk lub chrom.
Natomiast nie zajdzie reakcja roztwarzania miedzi
w kwasie solnym:
Cu + 2H
+
= Cu
2+
+ H
2
Podobnie zachowuje się srebro (Cu i Ag są
metalami
szlachetnymi).
1) Wodór może być wydzielany z roztworu przez
metale
o ujemnym potencjale a więc metale
nieszlachetne. Przykład:
Fe + 2H+ = Fe2+ + H2
Podobnie roztwarza się cynk lub chrom.
Natomiast nie zajdzie reakcja roztwarzania miedzi
w kwasie solnym:
Cu + 2H
+
= Cu
2+
+ H
2
Podobnie zachowuje się srebro (Cu i Ag są
metalami
szlachetnymi).

9
9
Reakcje metali z kwasami
2) Metale szlachetne roztwarzają się natomiast w roztworach
wodnych silnych utleniaczy, np. kwasów utleniających (HNO
3
,
st. gorący H
2
SO
4
)
Cu + H
+
+ NO
3
-
= Cu
2+
+ NO + H
2
O
2) Metale szlachetne roztwarzają się natomiast w roztworach
wodnych silnych utleniaczy, np. kwasów utleniających (HNO
3
,
st. gorący H
2
SO
4
)
Cu + H
+
+ NO
3
-
= Cu
2+
+ NO + H
2
O

10
10
Reakcje metali z kwasami
3) Złoto, platyna i pallad nie roztwarzają się w
kwasie
azotowym oraz gorącym st. siarkowym.
Potrafi je natomiast roztworzyć woda
królewska.
Jest to mieszanina stężonych kwasów: solnego
(HCl)
i azotowego (HNO
3
) w stosunku objętościowym
3:1
HCl + HNO
3
= H
+
+ NO
3
-
+ Cl
-
Roztwarzanie platyny i złota:
3Pt + 16H
+
+ 4NO
3
-
+ 18Cl
-
= 3PtCl
6
2-
+ 4NO +
8H
2
O
Au + 4H
+
+ NO
3
-
+ 4Cl
-
= AuCl
4
-
+ NO + 2H
2
O
3) Złoto, platyna i pallad nie roztwarzają się w
kwasie
azotowym oraz gorącym st. siarkowym.
Potrafi je natomiast roztworzyć woda
królewska.
Jest to mieszanina stężonych kwasów: solnego
(HCl)
i azotowego (HNO
3
) w stosunku objętościowym
3:1
HCl + HNO
3
= H
+
+ NO
3
-
+ Cl
-
Roztwarzanie platyny i złota:
3Pt + 16H
+
+ 4NO
3
-
+ 18Cl
-
= 3PtCl
6
2-
+ 4NO +
8H
2
O
Au + 4H
+
+ NO
3
-
+ 4Cl
-
= AuCl
4
-
+ NO + 2H
2
O

11
11
Reakcje metali z kwasami
Zjawisko pasywacji
Be, Al, Cr - stężony kwas azotowy
Pb - kwas solny, kwas siarkowy
Zjawisko pasywacji
Be, Al, Cr - stężony kwas azotowy
Pb - kwas solny, kwas siarkowy

12
12
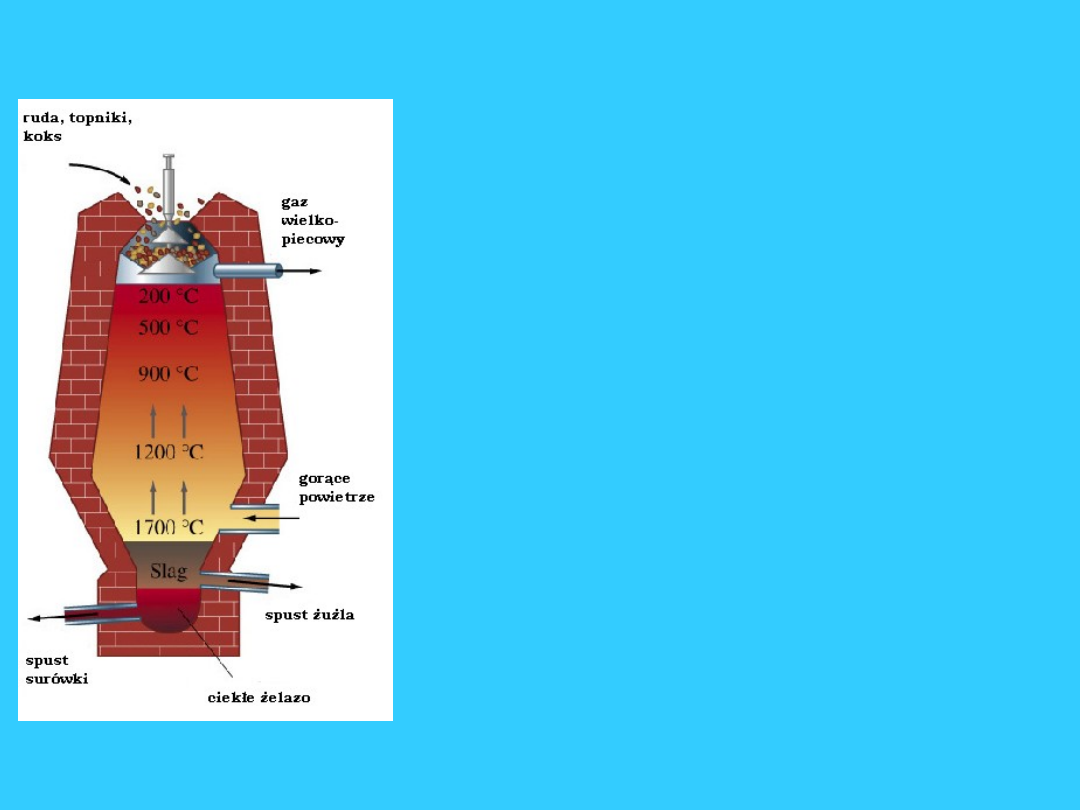
Metalurgia (pirometalurgia)
żelaza
• Ruda żelaza zawiera minerały tego metalu:Fe
2
O
3
-
hematyt, Fe
3
O
4
- magnetyt, Ponadto jako złoże
występuje głównie krzemionka (SiO
2
)
• Otrzymywanie żelaza z jego rud polega na redukcji tlenków żelaza
za pomocą węgla i tlenku węgla , który jest szczególnie czynnym
reduktorem , ponieważ jako gaz reaguje z tlenkami żelaza w całej
objętości pieca. Szybkość redukcji wzrasta ze wzrostem
temperatury , a wydzielanie produktów reakcji w stanie ciekłym
sprzyja usuwaniu zanieczyszczeń , dlatego proces przeprowadza
się w wysokich temperaturach w tak zwanych wielkich piecach. Są
to wielkie konstrukcje mające do 30 m wysokości i 2000 m
3
pojemności. Ładowanie pieca odbywa się od góry przez urządzenie
zasypowe , przez które wprowadza się: koks , rudę i topniki
(dolomit, wapień) , które ze złożem rudy tworzą w piecu łatwo
topliwą mieszaninę krzemianów wapnia , glinu , manganu zwaną
żużlem. Koks wprowadzany do wielkiego pieca spala się w
strumieniu gorącego powietrza
wdmuchiwanego przez dysze.
Wytworzony CO
2
przechodząc przez rozżarzone warstwy koksu
redukuje się do tlenku węgla.

13
13
Metalurgia (pirometalurgia)
żelaza
• Gorące gazy( CO i CO
2
) unosząc się ku górze ogrzewają wsad
wielkopiecowy zsuwający się ku dołowi . Procesy
zachodzące w warstwach rudy zależą od temperatury
wytworzonej w dolnej strefie pieca. W najwyższych jego
częściach następuje odwodnienie rudy , przy temperaturze
120-230 stopni Celsjusza . Redukcja rozpoczyna się w
temperaturze 420 stopni i początkowo polega na redukcji
Fe(III) do Fe(II). W miarę posuwania się ku dołowi i dalszego
wzrostu temperatury następuje redukcja tlenków do
metalu.W temperaturze 930 stopni redukująco działa
również węgiel.W miarę obsuwania się ładunku do dolnych ,
gorętszych części pieca , mających temp. większą niż 930
stopni, następuje stopienie żelaza i na skutek rozpuszczania
się w nim węgla i innych pierwiastków powstaje stop żelaza
z węglem (2,5-4,5%) oraz krzemem , fosforem , manganem.
Jest to właśnie surówka - produkt wielkiego pieca.
• Równocześnie z redukcją tlenków żelaza odbywa się też
reakcja pomiędzy topnikami i zanieczyszczeniami rudy. W
wyniku tych reakcji tworzy się ciekły żużel , który spływa w
dół pieca i jako lżejszy od surówki tworzy warstwę na jej
powierzchni.
14
14
Metalurgia (pirometalurgia)
żelaza
Proces wielkopiecowy, proces
prowadzony w wielkim piecu i
obejmujący: doprowadzanie
surowców (rud żelaza, koksu,
topników) przez górną część pieca,
wdmuchiwanie (od dołu) gorącego
powietrza i gazów spalinowych,
redukcję tlenków żelaza do metalu,
oddzielenie skały płonej, spust
surówki i żużla, odprowadzenie
gazów wielkopiecowych.
Gaz wielkopiecowy, produkt uboczny w
procesie wielkopiecowym. Skład zależy od
wsadu wielkopiecowego i zawarty jest
granicach: 10-16% tlenku węgla(IV), 23-
30% tlenku węgla(II) (czad), 0,3-4%
metanu, 52-60% azotu.
Na 1 tonę surówki wydziela się do 4000
m3 gazu wielkopiecowego. Gaz
wielkopiecowy nie oczyszczony zawiera
znaczą ilość pyłu. Wartość opałowa 3350-
3700 kJ/m3. Stosowany do opalania
nagrzewnic wielkopiecowych oraz baterii
koksowniczych
.
Proces wielkopiecowy, proces
prowadzony w wielkim piecu i
obejmujący: doprowadzanie
surowców (rud żelaza, koksu,
topników) przez górną część pieca,
wdmuchiwanie (od dołu) gorącego
powietrza i gazów spalinowych,
redukcję tlenków żelaza do metalu,
oddzielenie skały płonej, spust
surówki i żużla, odprowadzenie
gazów wielkopiecowych.
Gaz wielkopiecowy, produkt uboczny w
procesie wielkopiecowym. Skład zależy od
wsadu wielkopiecowego i zawarty jest
granicach: 10-16% tlenku węgla(IV), 23-
30% tlenku węgla(II) (czad), 0,3-4%
metanu, 52-60% azotu.
Na 1 tonę surówki wydziela się do 4000
m3 gazu wielkopiecowego. Gaz
wielkopiecowy nie oczyszczony zawiera
znaczą ilość pyłu. Wartość opałowa 3350-
3700 kJ/m3. Stosowany do opalania
nagrzewnic wielkopiecowych oraz baterii
koksowniczych
.

15
15
Metalurgia (pirometalurgia)
żelaza
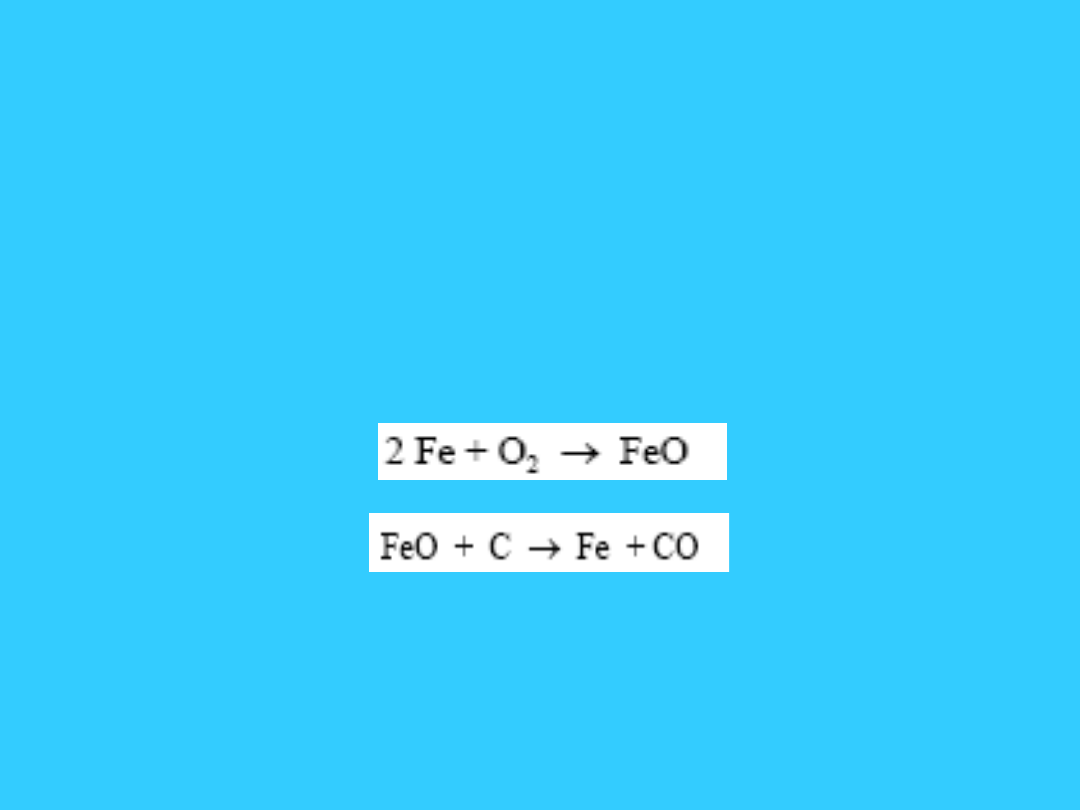
• W dolnej części pieca zachodzą reakcje
utleniania węgla, które prowadzą do
powstania tlenku węgla (II):
• C + O
2
= CO
2
• CO
2
+ C = 2 CO
• Tlenek ten łatwo reaguje ze stopioną,
w wysokiej temperaturze, pod
wpływem topników rudą żelaza.
Zachodzą następujące reakcje:
• 3 Fe
2
O
3
+ CO = 2 Fe
3
O
4
+ CO
2
• Fe
3
O
4
+ CO = 3 FeO + CO
2
• FeO + CO = Fe + CO
2
• Jest to tzw. redukcja częściowa,
redukcja właściwa, czyli redukcja
węglem zachodzi w dolnej strefie
wielkiego pieca, w której panuje
najwyższa temperatura, dochodząca do
ok. 1200 - 1500
o
C.
• FeO + C = Fe + CO

16
16
Metalurgia (pirometalurgia)
żelaza
• Surówka, produkt redukcji rudy żelaza w
wielkim piecu, będący stopem żelaza m.in. z
węglem, krzemem, manganem, siarką,
fosforem. Można wyróżnić tzw. surówkę białą
– gdy węgiel występuje głównie w formie
cementytu (Fe
3
C), twardą lecz trudną do
obróbki oraz surówkę szarą – gdy węgiel
występuje głównie w formie grafitu, mniej
wytrzymałą.
• Surówka przeznaczona jest do wyrobu stali,
staliwa, żeliwa oraz żelazostopów.

17
17
PROCES SPALANIA KOKSU
•SPALANIE ZUPEŁNE
C + O
2
CO
2
•SPALANIE NIEZUPEŁNE
C + 0.5 O
2
CO
•REAKCJA BOUDOUARDA
(400 – 950
o
C)
CO
2
+ C 2CO

18
18
Metalurgia (pirometalurgia)
żelaza
• Jednocześnie z reakcja pomiędzy węglem , a
tlenkami żelaza, odbywa się reakcja z
topnikami oraz innymi zanieczyszczeniami
obecnymi w mieszaninie. W efekcie powstaje
ciekły żużel, czyli produkt uboczny
zawierający stopione substancje mineralne.
Żużel jest lżejszy do surówki, więc oddziela
się od niej i wypływa na jej powierzchnię.
• Surówka oprócz żelaza zawiera:C 2,5 -
4 %, Si 0,2 - 3 %, P 0,1 - 2 % oraz
mangan i siarkę

19
19
Metalurgia (pirometalurgia)
żelaza

20
20
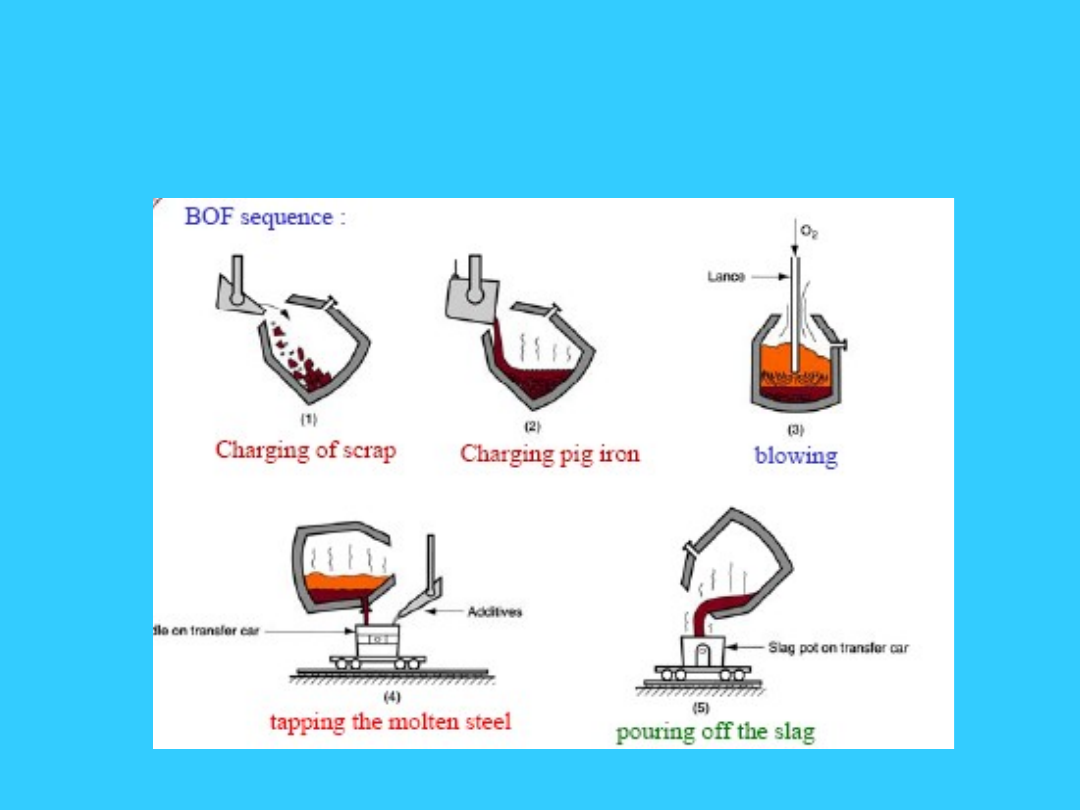
KONWERTOROWY PROCES
WYTAPIANIA STALI
metoda wytwarzania stali z ciekłej surówki, w
zbiornikach przechylnych zwanych konwertorami,
polegająca na wypalaniu węgla i innych
domieszek z surówki poprzez przedmuchiwanie
metalu powietrzem, mieszaniną powietrza lub
innych gazów z tlenem, albo samym tlenem, bądź
nadmuchiwanie tych gazów na powierzchnię
ciekłego metalu. W konwertorach tlenowych do
wsadu oprócz surówki dodaje się ok. 30% złomu.
K.p.w.s. jest bardzo wydajny; podstawowe metody
wytopu konwertorowego to proces
bessemerowski (wynaleziony 1865 przez H.
Bessemera) oraz proces tomasowski (wynaleziony
1877 przez S. Thomasa). Obecnie gł. zastosowanie
znajduje proces konwertorowy tlenowy,
opracowany 1949 w Austrii, a oznaczany skrótem
literowym LD od miejsca pierwszego zastosowania
(Linz i Donawitz).
21
21
KONWERTOROWY PROCES
WYTAPIANIA STALI
-Surówka zawiera około 4% węgla
-stal zawiera 0.1-1.2% węgla (większość stali
zawiera mniej niż 0.5% węgla)
Usunięcie węgla – przedmuchiwanie tlenu przez
stopioną surówkę

22
22
Konwertor - zbiornik z blachy stalowej, wyłożony materiałem
ogniotrwałym, służący do utlenienia w wysokich temperaturach
domieszek w ciekłym wsadzie, przez wdmuchiwanie go
powietrzem lub powierzchniowe wdmuchiwanie tlenu. Konwertory
dzielą się na hutnicze i odlewnicze. Konwertor hutniczy
stosowany jest do otrzymywania stali z ciekłej surówki
(świeżenie) oraz do otrzymania miedzi i kamienia niklowego. W
konwertorach stalownicznych płynną surówkę wlewa się przez
gardziel pochylonego konwertora. Powietrze doprowadzane przez
dyszę w wymiennej dennicy utlenia w ciekłej surówce domieszki
(krzem, mangan, węgiel, fosfor). Proces konwertorowy odbywa
się bez dostarczania ciepła z zewnątrz, a wzrost temperatury
wywołany jest ciepłem wydzielanym z reakcji utleniania
domieszek (częściowo również metalu). Dzięki dużej szybkości
reakcji procesu konwertorowego, wydajność konwertora jest
bardzo duża. Czas trwania wytopu wynosi ok. 10-20 minut, a
pojemność konwertora 25-100 ton. Do przerobu surówek
niskofosforowych stosowano konwertory Bessemera
(besemerowanie) o wyłożeniu kwaśnym (krzemionkowym), zaś do
surówek wysokofosforwoych używano konwertor Thomasa
(proces Thomasa) o wyłożeniu zasadowym (dolomitowym). W
latach 70. XX wieku zostały one wyparte przez znacznie
wydajniejsze konwertory tlenowe o wyłożeniu zasadowym
(konwertorowy proces tlenowy).
Konwertor - zbiornik z blachy stalowej, wyłożony materiałem
ogniotrwałym, służący do utlenienia w wysokich temperaturach
domieszek w ciekłym wsadzie, przez wdmuchiwanie go
powietrzem lub powierzchniowe wdmuchiwanie tlenu. Konwertory
dzielą się na hutnicze i odlewnicze. Konwertor hutniczy
stosowany jest do otrzymywania stali z ciekłej surówki
(świeżenie) oraz do otrzymania miedzi i kamienia niklowego. W
konwertorach stalownicznych płynną surówkę wlewa się przez
gardziel pochylonego konwertora. Powietrze doprowadzane przez
dyszę w wymiennej dennicy utlenia w ciekłej surówce domieszki
(krzem, mangan, węgiel, fosfor). Proces konwertorowy odbywa
się bez dostarczania ciepła z zewnątrz, a wzrost temperatury
wywołany jest ciepłem wydzielanym z reakcji utleniania
domieszek (częściowo również metalu). Dzięki dużej szybkości
reakcji procesu konwertorowego, wydajność konwertora jest
bardzo duża. Czas trwania wytopu wynosi ok. 10-20 minut, a
pojemność konwertora 25-100 ton. Do przerobu surówek
niskofosforowych stosowano konwertory Bessemera
(besemerowanie) o wyłożeniu kwaśnym (krzemionkowym), zaś do
surówek wysokofosforwoych używano konwertor Thomasa
(proces Thomasa) o wyłożeniu zasadowym (dolomitowym). W
latach 70. XX wieku zostały one wyparte przez znacznie
wydajniejsze konwertory tlenowe o wyłożeniu zasadowym
(konwertorowy proces tlenowy).

23
23
Konwerter Bessemera
24
24
KONWERTOROWY PROCES
WYTAPIANIA STALI

25
25
Pirometalurgia miedzi
Cu
2
S: Chalkocyt
Cu
2
S: Chalkocyt
CuFeS
2
: Chalkopiryt (50%
produkcji miedzi)
CuFeS
2
: Chalkopiryt (50%
produkcji miedzi)
Cu
2
0: Kupryt
Cu
2
0: Kupryt
Cu
2
CO
3
(OH)
2
: Malachit
Cu
2
CO
3
(OH)
2
: Malachit
Cu
2
S - chalkozyn
Cu
2
S - chalkozyn

26
26
Pirometalurgia miedzi
1) Ruda (~ 1%) Koncentrat (~20 to 35%)
• mielenie, flotacja
2) Prażenie i topienie
CuFeS
2
Cu
2
S (kamień ) Cu (blister)
~98% Cu
2FeOSiO
2
(żużel)
0.34 -1% Cu
1) Ruda (~ 1%) Koncentrat (~20 to 35%)
• mielenie, flotacja
2) Prażenie i topienie
CuFeS
2
Cu
2
S (kamień ) Cu (blister)
~98% Cu
2FeOSiO
2
(żużel)
0.34 -1% Cu
Kamień miedziowy, półprodukt w procesie otrzymywania miedzi z
rud i koncentratów tego pierwiastka. Stanowi stop siarczków
miedzi(II) i żelaza(II). Wytapiany z miedzi zawiera ok. 25% siarki i
ok. 10-65% miedzi, ponadto żelazo i inne substancje. Temperatura
topnienia 950-1100°C.
Kamień miedziowy, półprodukt w procesie otrzymywania miedzi z
rud i koncentratów tego pierwiastka. Stanowi stop siarczków
miedzi(II) i żelaza(II). Wytapiany z miedzi zawiera ok. 25% siarki i
ok. 10-65% miedzi, ponadto żelazo i inne substancje. Temperatura
topnienia 950-1100°C.
27
27
Pirometalurgia miedzi
Pierwszym etapem jest prażenie rudy
Wytapia się tzw. kamień miedziowy, tj.
mieszaninę siarczków miedzi i żelaza
Miedź surową otrzymuje się w procesie
konwertorowania:
2Cu
2
S + 3O
2
= 2Cu
2
O + 2SO
2
2Cu
2
O + Cu
2
S = 6Cu + SO
2
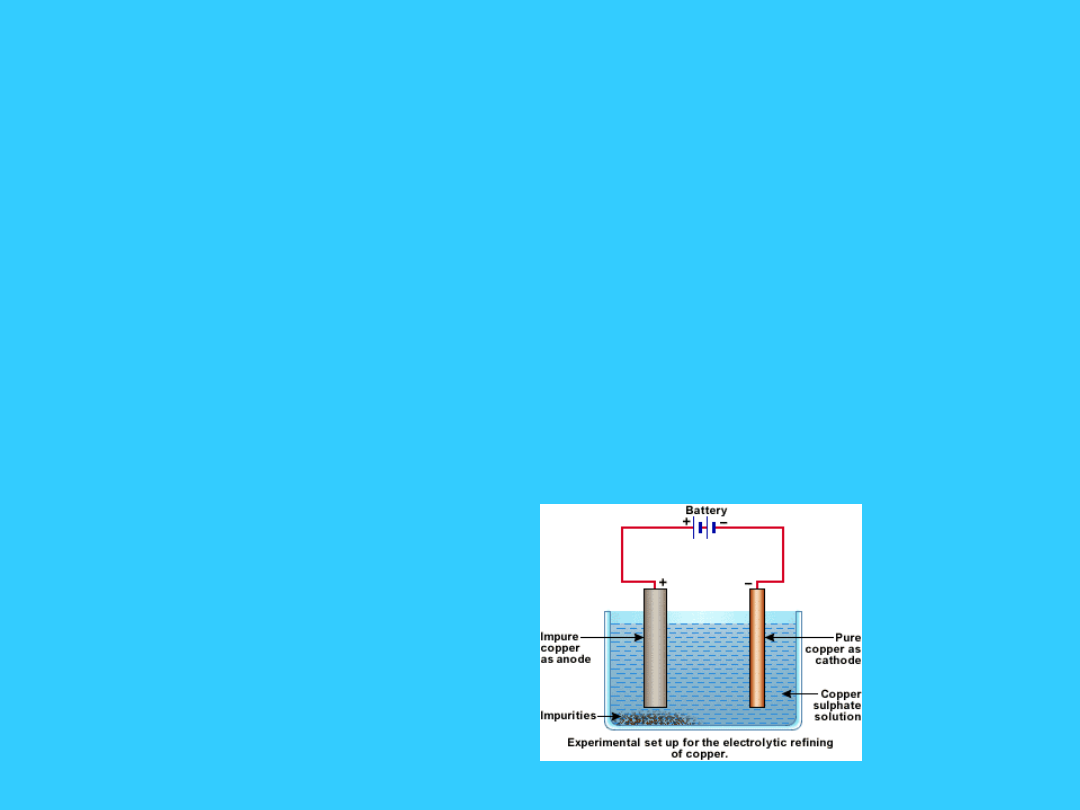
Ostatnim etapem jest oczyszczanie miedzi w
procesie
elektrorafinacji:
anoda: Cu = Cu
2+
+ 2e
katoda: Cu
2+
+ 2e = Cu
Pierwszym etapem jest prażenie rudy
Wytapia się tzw. kamień miedziowy, tj.
mieszaninę siarczków miedzi i żelaza
Miedź surową otrzymuje się w procesie
konwertorowania:
2Cu
2
S + 3O
2
= 2Cu
2
O + 2SO
2
2Cu
2
O + Cu
2
S = 6Cu + SO
2
Ostatnim etapem jest oczyszczanie miedzi w
procesie
elektrorafinacji:
anoda: Cu = Cu
2+
+ 2e
katoda: Cu
2+
+ 2e = Cu

28
28
Pirometalurgia innych
metali
Wiele metali występuje w formie siarczków.
Najczęściej
przerabia się je poprzez prażenie (w powietrzu):
2ZnS + 3O
2
= 2ZnO + 2SO
2
2MoS
2
+ 7O
2
= 2MoO
3
+ 4SO
2
CoS + 2O
2
= CoSO
4
HgS + O
2
= Hg + SO
2
Wiele metali występuje w formie siarczków.
Najczęściej
przerabia się je poprzez prażenie (w powietrzu):
2ZnS + 3O
2
= 2ZnO + 2SO
2
2MoS
2
+ 7O
2
= 2MoO
3
+ 4SO
2
CoS + 2O
2
= CoSO
4
HgS + O
2
= Hg + SO
2

29
29
Produkcja cynku

30
30

31
31
Pirometalurgia innych
metali
Z kolei rudę tlenkową poddaje się chlorowaniu w
obecności
węgla, np.:
TiO
2
+ C + 2Cl
2
= TiCl
4
+ CO
2
Tlenki redukuje się do metalu za pomocą
reduktorów:
ZnO + CO = Zn + CO
2
SnO
2
+ 2C = Sn + 2CO
WO
3
+ 3H
2
= W + 3H
2
O
TiCl
4
+ 2Mg = Ti + 2MgCl
2
3V
2
O
5
+ 10Al = 6V + 5Al
2
O
3
3Mn
3
O
4
+ 8Al = 9Mn + 4Al
2
O
3
Co
2+
+ 2e = Co (elektroliza)
Reduktorami w tych reakcjach są: C, CO, H
2
, Mg,
Al. Redukcja następuje też na katodzie.
Z kolei rudę tlenkową poddaje się chlorowaniu w
obecności
węgla, np.:
TiO
2
+ C + 2Cl
2
= TiCl
4
+ CO
2
Tlenki redukuje się do metalu za pomocą
reduktorów:
ZnO + CO = Zn + CO
2
SnO
2
+ 2C = Sn + 2CO
WO
3
+ 3H
2
= W + 3H
2
O
TiCl
4
+ 2Mg = Ti + 2MgCl
2
3V
2
O
5
+ 10Al = 6V + 5Al
2
O
3
3Mn
3
O
4
+ 8Al = 9Mn + 4Al
2
O
3
Co
2+
+ 2e = Co (elektroliza)
Reduktorami w tych reakcjach są: C, CO, H
2
, Mg,
Al. Redukcja następuje też na katodzie.

32
32
Hydrometalurgia
Hydrometalurgia jest metodą selektywnego
wydzielania metali z rud za pomocą procesów
zachodzących w roztworach wodnych.
Najważniejszym procesem jest tutaj ługowanie,
np.
Ługowanie roztworem H
2
SO
4
w obecności tlenu:
Cu
2
S + O
2
+ 4H
+
= 2Cu
2+
+ S + 2H
2
O
Ługowanie roztworami cyjanków w obecności
tlenu:
4Au + 8CN
-
+ O
2
+ 2H
2
O = 4Au(CN)
2-
+ 4OH
-
Ługowanie alkaliczne boksytów:
AlOOH + OH
-
+ H
2
O = [Al(OH)
4
]
-
Hydrometalurgia jest metodą selektywnego
wydzielania metali z rud za pomocą procesów
zachodzących w roztworach wodnych.
Najważniejszym procesem jest tutaj ługowanie,
np.
Ługowanie roztworem H
2
SO
4
w obecności tlenu:
Cu
2
S + O
2
+ 4H
+
= 2Cu
2+
+ S + 2H
2
O
Ługowanie roztworami cyjanków w obecności
tlenu:
4Au + 8CN
-
+ O
2
+ 2H
2
O = 4Au(CN)
2-
+ 4OH
-
Ługowanie alkaliczne boksytów:
AlOOH + OH
-
+ H
2
O = [Al(OH)
4
]
-

33
33
Hydrometalurgia
Pozostałe etapy procesów hydrometalurgicznych:
- selektywne koncentrowanie: ekstrakcja, procesy
membranowe, wymiana jonowa, flotacja jonowa,
- wydzielanie metalu (metali): elektroliza, cementacja,
redukcja ciśnieniowa wodorem
- elektroliza Cu
2+
+ 2e = Cu
- cementacja Cu
2+
+ Fe = Fe
2+
+ Cu
- redukcja wodorem Cu
2+
+ H
2
= Cu + 2H
+
Pozostałe etapy procesów hydrometalurgicznych:
- selektywne koncentrowanie: ekstrakcja, procesy
membranowe, wymiana jonowa, flotacja jonowa,
- wydzielanie metalu (metali): elektroliza, cementacja,
redukcja ciśnieniowa wodorem
- elektroliza Cu
2+
+ 2e = Cu
- cementacja Cu
2+
+ Fe = Fe
2+
+ Cu
- redukcja wodorem Cu
2+
+ H
2
= Cu + 2H
+

34
34
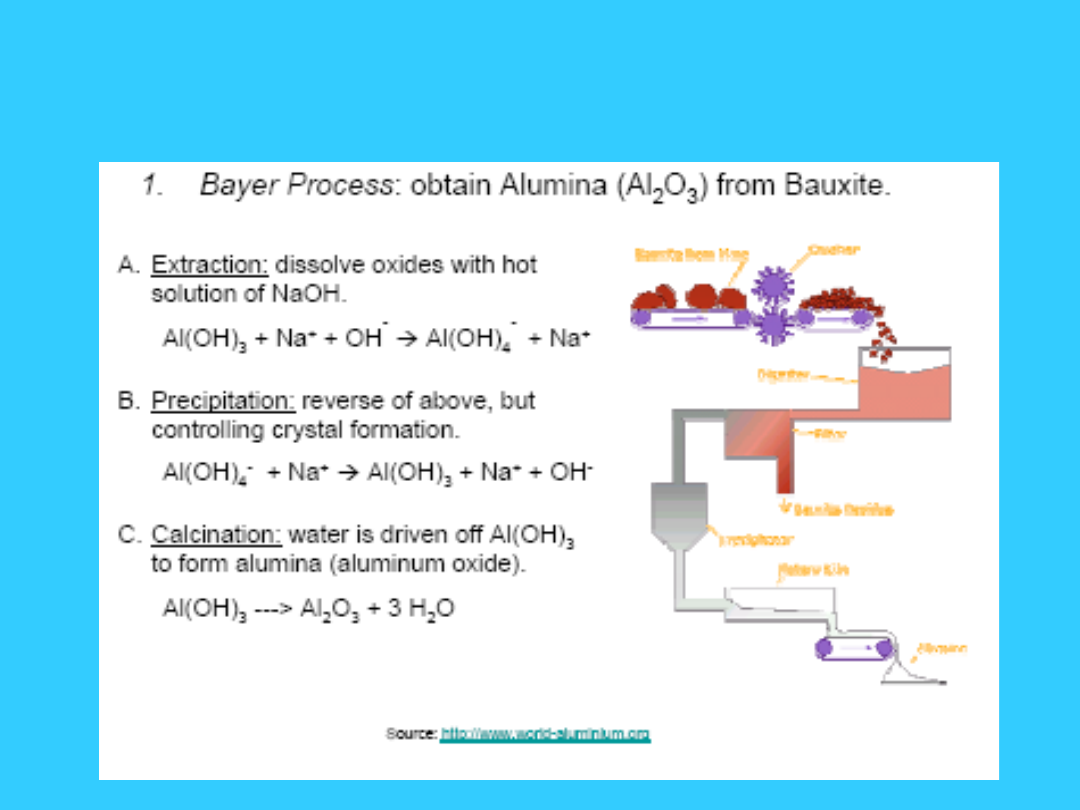
35
35
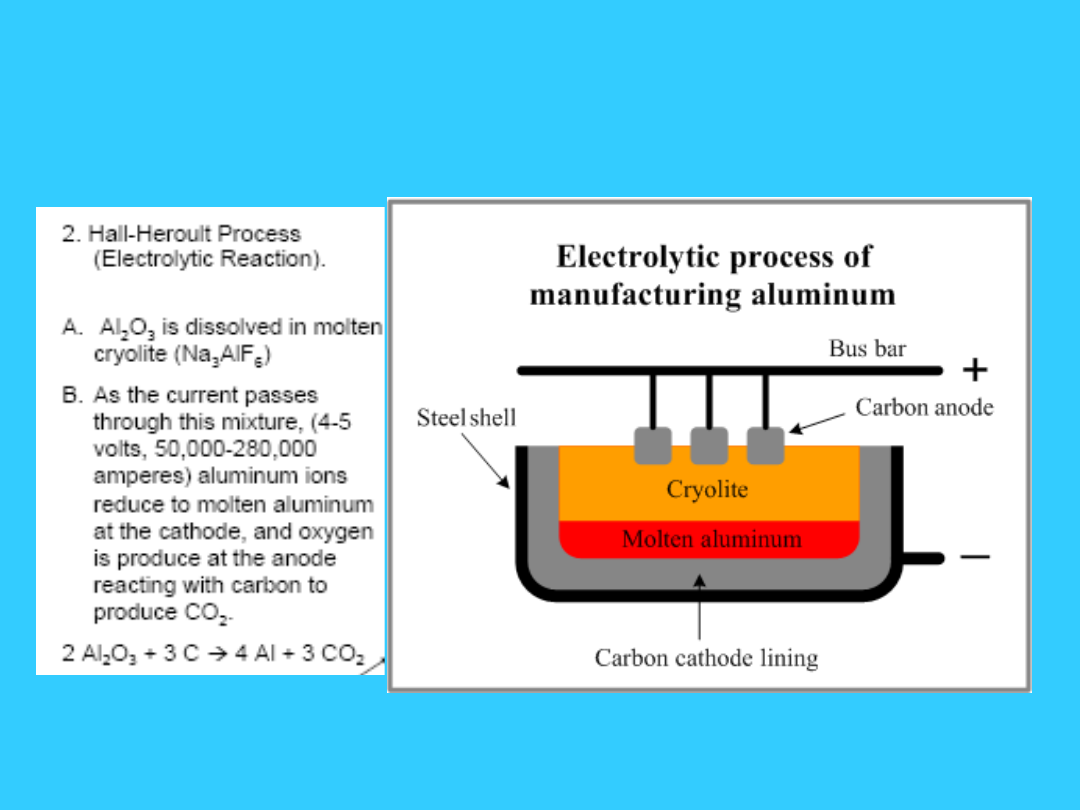
Otrzymywanie glinu
36
36
Otrzymywanie elektrolityczne
glinu
Elektroliza prowadzona
jest w stopionym kriolicie –
Na
3
AlF
6
.
Elektroliza prowadzona
jest w stopionym kriolicie –
Na
3
AlF
6
.

37
37
Otrzymywanie metali
wysokiej czystości
Często zależy nam na metalach o bardzo dużej
czystości. Wówczas przeprowadzamy związki
metali w połączenia lotne i następnie je
rozkładamy. Takimi związkami mogą być jodki
(np. tytanu i cyrkonu) lub karbonylki (np.
niklu):
TiI
4
= Ti + 2I
2
ZrI
4
= Zr + 2I
2
Ni(CO)
4
= Ni + 4CO
Często zależy nam na metalach o bardzo dużej
czystości. Wówczas przeprowadzamy związki
metali w połączenia lotne i następnie je
rozkładamy. Takimi związkami mogą być jodki
(np. tytanu i cyrkonu) lub karbonylki (np.
niklu):
TiI
4
= Ti + 2I
2
ZrI
4
= Zr + 2I
2
Ni(CO)
4
= Ni + 4CO

38
38
Otrzymywanie metali
wysokiej czystości
Często zależy nam na metalach o bardzo dużej
czystości. Wówczas przeprowadzamy związki
metali w połączenia lotne i następnie je
rozkładamy. Takimi związkami mogą być jodki
(np. tytanu i cyrkonu) lub karbonylki (np.
niklu):
TiI
4
= Ti + 2I
2
ZrI
4
= Zr + 2I
2
Ni(CO)
4
= Ni + 4CO
Często zależy nam na metalach o bardzo dużej
czystości. Wówczas przeprowadzamy związki
metali w połączenia lotne i następnie je
rozkładamy. Takimi związkami mogą być jodki
(np. tytanu i cyrkonu) lub karbonylki (np.
niklu):
TiI
4
= Ti + 2I
2
ZrI
4
= Zr + 2I
2
Ni(CO)
4
= Ni + 4CO

39
39
Otrzymywanie materiałów
wysokiej czystości
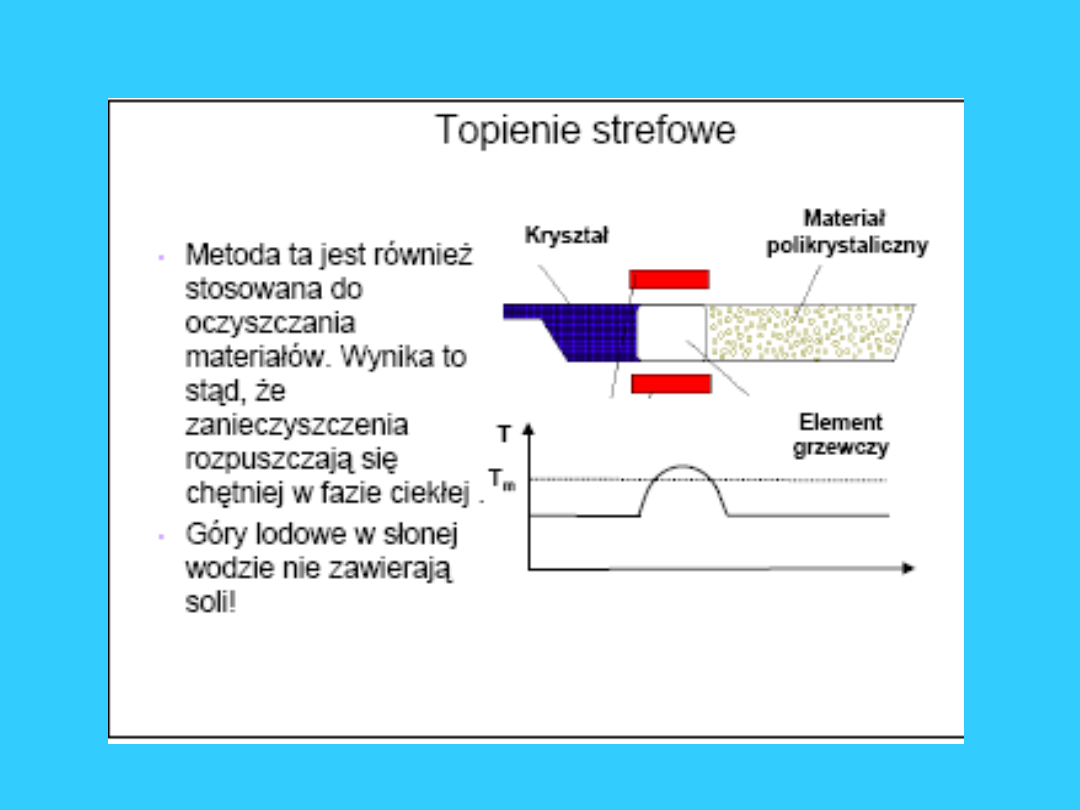
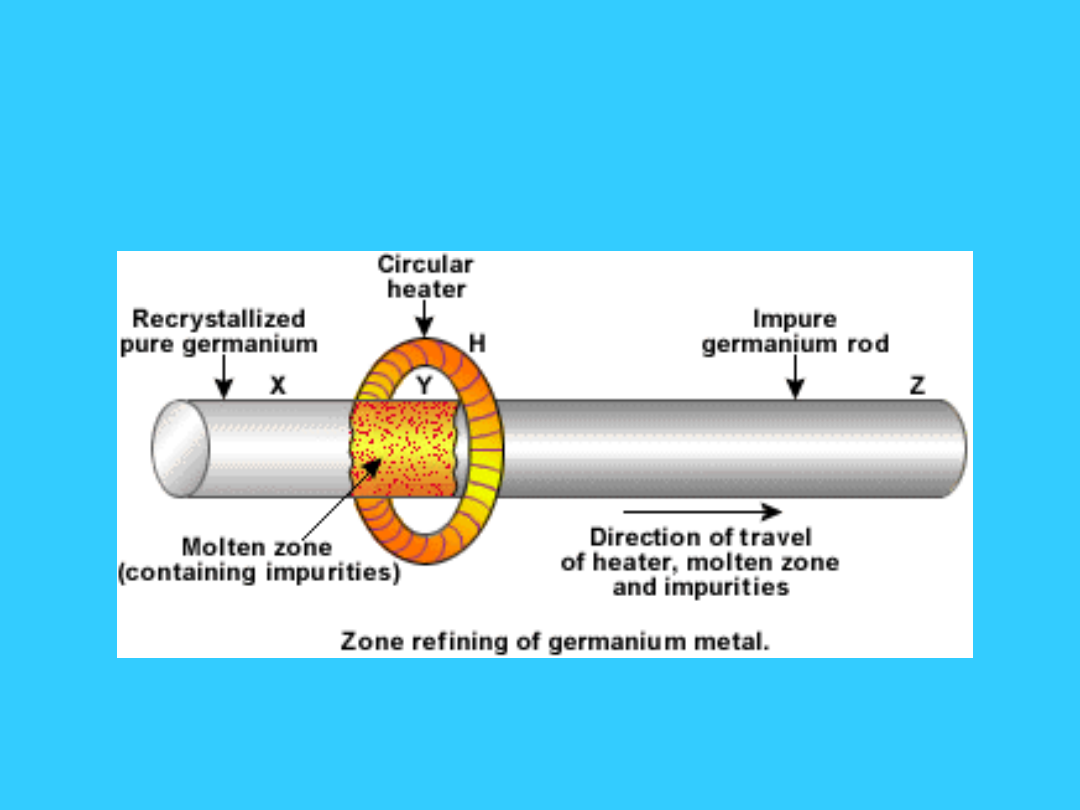
Topienie strefowe, metoda otrzymywania
czystych materiałów ze stopów. Stop
poddawany topieniu strefowemu odlany jest w
kształcie pręta, wzdłuż niego przesuwa się
pierścieniowy grzejnik, powodując lokalne
topienie stopu, a następnie jego krzepnięcie.
Kryształy wydzielające się w strefie krzepnięcia
wykazują wyższą czystość aniżeli wyjściowy
stop, tymczasem zanieczyszczenia przesuwają
się wraz ze strefą topioną do jednego z końców
pręta. Wielokrotne powtarzanie tej operacji, z
zachowaniem kierunku przesuwania grzejnika
pozwala na uzyskanie materiału o wysokiej
czystości.
Topienie strefowe jest stosowane do
otrzymywania materiałów półprzewodnikowych
(półprzewodniki).
Topienie strefowe, metoda otrzymywania
czystych materiałów ze stopów. Stop
poddawany topieniu strefowemu odlany jest w
kształcie pręta, wzdłuż niego przesuwa się
pierścieniowy grzejnik, powodując lokalne
topienie stopu, a następnie jego krzepnięcie.
Kryształy wydzielające się w strefie krzepnięcia
wykazują wyższą czystość aniżeli wyjściowy
stop, tymczasem zanieczyszczenia przesuwają
się wraz ze strefą topioną do jednego z końców
pręta. Wielokrotne powtarzanie tej operacji, z
zachowaniem kierunku przesuwania grzejnika
pozwala na uzyskanie materiału o wysokiej
czystości.
Topienie strefowe jest stosowane do
otrzymywania materiałów półprzewodnikowych
(półprzewodniki).
40
40
41
41
Topienie strefowe

42
42
Biometalurgia
• Bakterie typu ferrobacillus utleniają jony
Fe
2+
do Fe
3+
.
• Fe
2+
bakterie Fe
3+
• CuS + 2Fe
3+
= Cu
2+
+ 2Fe
2+
+ S
• Można tymi bakteriami roztwarzać metale
z ubogich złóż siarczkowych.
• Optymalne warunki: pH ok. 3,5;
temperatura = +28
o
C
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
Wykład 7. Metale
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
Leszek wyklad4 elektrochemia
Leszek wyklad9 teoria pasmowa ciala stalego
Leszek wyklad8a chlorowce
Leszek wyklad2
Leszek wyklad7
Leszek wyklad3
Leszek wyklad4
Leszek wyklad3
więcej podobnych podstron