
Nowe uregulowania
Nowe uregulowania
dotyczące tradycyjnych
dotyczące tradycyjnych
roślinnych produktów
roślinnych produktów
leczniczych
leczniczych
WALDEMAR ZIELIŃSKI
WALDEMAR ZIELIŃSKI

Nowe prawo farmaceutyczne w
Nowe prawo farmaceutyczne w
Unii Europejskiej
Unii Europejskiej
•
17 grudnia 2003 – drugie czytanie
17 grudnia 2003 – drugie czytanie
nowego prawa farmaceutycznego UE
nowego prawa farmaceutycznego UE
w Parlamencie Europejskim
w Parlamencie Europejskim
•
Dyrektywa 2001/83
Dyrektywa 2001/83
•
Rozporządzenie 2309/93
Rozporządzenie 2309/93

•
DIRECTIVE 2004/28/EC OF THE EUROPEAN
PARLIAMENT AND OF THE COUNCIL
of 31 March 2004
amending Directive 2001/82/EC on the Community
code
relating to veterinary medicinal products
L 136/58 Official Journal of the European Union 30.4.2004
•
DIRECTIVE 2004/24/EC OF THE EUROPEAN
PARLIAMENT AND OF THE COUNCIL
of 31 March 2004
amending, as regards traditional herbal medicinal
products,
Directive 2001/83/EC on the Community code
relating to medicinal products for human use
L 136/85 Official Journal of the European Union 30.4.2004

•
DYREKTYWA 2004/24/EC
(tradycyjne roślinne produkty lecznicze)
– Państwa Członkowskie powinny wprowadzić ją
do prawa narodowego 30.10.2005.
– Postanowienia Dyrektywy w stosunku do
tradycyjnych ziołowych produktów leczniczych
obecnych na rynku powinny być wprowadzone
w życie w ciągu 7 lat (Marzec 2011)
– Procedura rejestracji dotyczy roślinnych
produktów leczniczych z długą tradycja
stosowania, które nie spełniają warunków na
dopuszczenie do obrotu , zwłaszcza jako
produktu zawierającego składniki o
ugruntowanym zastosowaniu medycznym

•
Dla jakich produktów Dyrektywa
2004/24/EC nie ma zastosowania:
– roślinne produkty homeopatyczne
– roślinne produkty lecznicze, których
skuteczność może być wykazana „pełnym”
procesem dopuszczania do obrotu
– tradycyjne produkty medycyny chińskiej

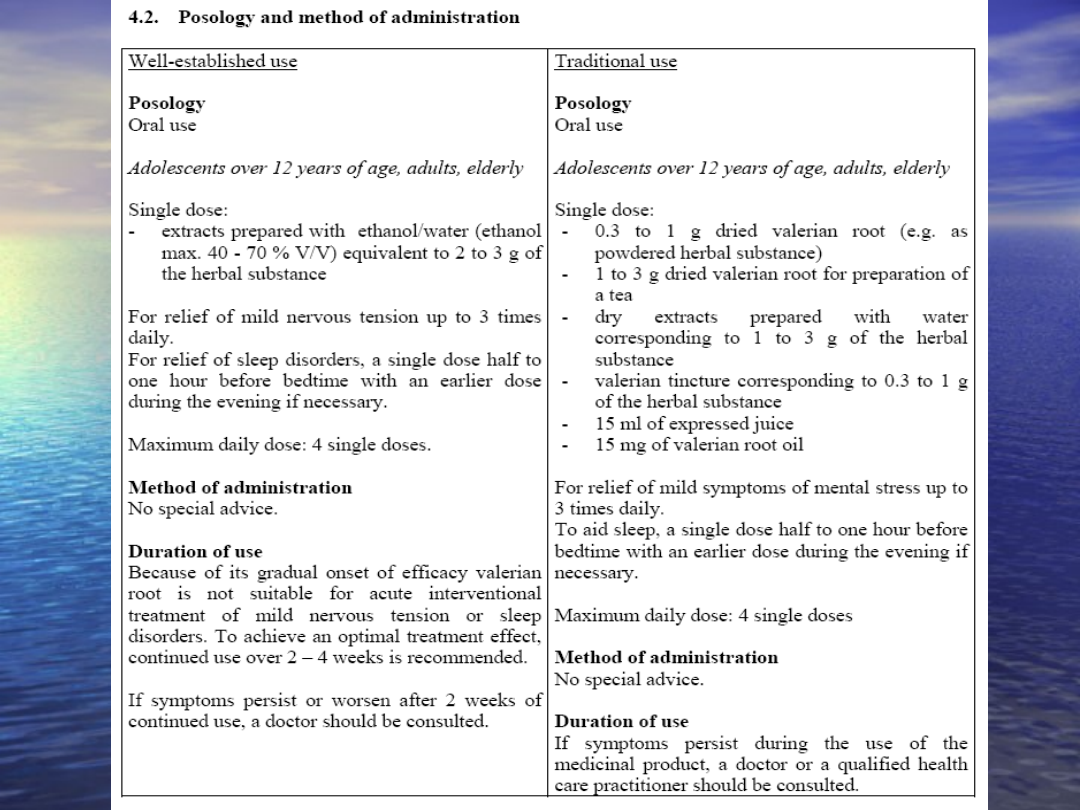
Tradycyjny roślinny produkt leczniczy
produkt ma wskazania właściwe wyłącznie dla
tradycyjnego ziołowego produktu leczniczego
z uwagi na jego skład i przeznaczenie może
być stosowany bez kontroli lekarza, wydawany
bez recepty i nie wymaga monitorowania
leczenia
jest przeznaczony do stosowania wyłącznie w
określonym stężeniu i sposobie dawkowania;

upłynął okres wystarczający do uznania, że
stosowanie tego produktu w lecznictwie ma charakter
tradycyjny
istnieją wystarczające dane w odniesieniu do
tradycyjnego zastosowania roślinnego produktu
leczniczego w zakresie skuteczności i
bezpieczeństwa;
jest przygotowany do stosowania doustnego,
zewnętrznego lub inhalacji;
może w składzie zawierać dodatek minerałów lub
witamin o potwierdzonym bezpieczeństwie
stosowania w danym składzie, jeżeli działanie witamin
lub minerałów ma charakter uzupełniający

Tradycyjny roślinny produkt
leczniczy
Uproszczona procedura rejestracji
•
Podstawowe dane dotyczące produktu
Podstawowe dane dotyczące produktu
•
Dokumentacja chemiczno-farmaceutyczna
Dokumentacja chemiczno-farmaceutyczna
•
Ws
Ws
kazania, przeciwwskazania i działania
kazania, przeciwwskazania i działania
niepożądane
niepożądane
•
D
D
ane bibliograficzne lub opinie ekspertów
ane bibliograficzne lub opinie ekspertów
stwierdzające, że roślinny produkt leczniczy lub
stwierdzające, że roślinny produkt leczniczy lub
jego odpowiednik był stosowany w celach
jego odpowiednik był stosowany w celach
leczniczych przez okres, co najmniej 30 lat, w tym
leczniczych przez okres, co najmniej 30 lat, w tym
co najmniej 15 lat, w państwie członkowskim Unii
co najmniej 15 lat, w państwie członkowskim Unii
Europejskiej, poprzedzających złożenie wniosku;
Europejskiej, poprzedzających złożenie wniosku;

•
Charakterystyk
Charakterystyk
a
a
Produktu Leczniczego z
Produktu Leczniczego z
wyjątkiem
wyjątkiem
danych klinicznych
danych klinicznych
•
P
P
rzegląd bibliograficzny dotyczący
rzegląd bibliograficzny dotyczący
bezpieczeństwa wraz z raportem eksperta
bezpieczeństwa wraz z raportem eksperta
•
N
N
ie jest
ie jest
konieczne
konieczne
przedstawi
przedstawi
a
a
ni
ni
e
e
dokumentu
dokumentu
potwierdzającego dopuszczenie do obrotu
potwierdzającego dopuszczenie do obrotu
tradycyjnego roślinnego produktu leczniczego
tradycyjnego roślinnego produktu leczniczego
w okresie
w okresie
co najmniej 30 lat, w tym co
co najmniej 30 lat, w tym co
najmniej 15 lat, w państwie członkowskim Unii
najmniej 15 lat, w państwie członkowskim Unii
Europejskiej
Europejskiej
. Wystarczające są opinie
. Wystarczające są opinie
ekspertów lub inne dokumenty.
ekspertów lub inne dokumenty.
Wymóg
Wymóg
trzydziestoletniego stosowania tradycyjnego
trzydziestoletniego stosowania tradycyjnego
roślinnego produktu leczniczego spełniony jest
roślinnego produktu leczniczego spełniony jest
również w przypadku, gdy liczba składników
również w przypadku, gdy liczba składników
roślinnego produktu leczniczego lub ich
roślinnego produktu leczniczego lub ich
zawartość została zmniejszona w tym okresie.
zawartość została zmniejszona w tym okresie.

W przypadku złożenia wniosku o
dopuszczenie do obrotu tradycyjnego
produktu leczniczego roślinnego stosowanego
w państwach członkowskich Unii Europejskiej
przez okres krótszy niż 15 lat, Prezes Urzędu
przekazuje do Komitetu do spraw Roślinnych
Produktów Leczniczych Europejskiej Agencji
Leków dokumentację tego produktu w celu
ustalenia
przez Komitet, czy zostały spełnione
pozostałe warunki konieczne do uznania
tradycyjnego stosowania tradycyjnego
produktu leczniczego roślinnego.

Jakość
Jakość
Spełnione muszą być wszystkie warunki jak
Spełnione muszą być wszystkie warunki jak
dla
dla
pełnego dopuszczenia do obrotu
pełnego dopuszczenia do obrotu
•
GMP
GMP
•
Pełny moduł III wg CTD (
Pełny moduł III wg CTD (
Common
Common
Technical Document)
Technical Document)

Struktura dokumentacji
Struktura dokumentacji
•
Pełny Moduł 1 i 3 CTD
Pełny Moduł 1 i 3 CTD
•
Moduł 2, 4, 5 dostosowane do wymagań
Moduł 2, 4, 5 dostosowane do wymagań
dla tradycyjnych roślinnych produktów
dla tradycyjnych roślinnych produktów
leczniczych
leczniczych

•
Module 2.3
•
Quality Overall Summary - herbal
•
INTRODUCTION
•
2.3.S DRUG SUBSTANCE (NAME,
MANUFACTURER)
•
2.3.S.1 General Information (name, manufacturer)
•
2.3.S.2 Manufacture (name, manufacturer)
•
2.3.S.3 Characterisation (name, manufacturer)
•
2.3.S.4 Control of Drug Substance (name,
manufacturer)
•
2.3.S.5 Reference Standards of Materials (name,
manufacturer)
•
2.3.S.6 Container Closure System (name,
manufacturer)
•
2.3.S.7 Stability (name, manufacturer)

•
Module 3
•
Quality - herbal
3.2.S. DRUG SUBSTANCE1 (NAME,
MANUFACTURER)
3.2.S. 1 General Information (name,
manufacturer)
3.2.S.2 Manufacture (name, manufacturer)
3.2.S.3 Characterisation
3.2.S.4 Control of Drug Substance
3.2.S.5 Reference Standards or Materials
3.2.S.6 Container Closure System
3.2.S.7 Stability

•
3.2.P. DRUG PRODUCT (NAME, DOSAGE FORM)
•
3.2.P.1 Description and Composition of the Drug
Product (name, dosageform)
•
3.2.P.2 Pharmaceutical Development (name, dosage
form)
•
3.2.P.2.3 Manufacturing Process Development (name,
dosage form)
•
3.2.P.2.4 Container Closure System (name, dosage
form)
•
3.2.P.2.5 Microbiological Attributes (name, dosage
form)
•
3.2.P.2.6 Compatibility (name, dosage form)
•
3.2.P.3 Manufacture
•
3.2.P.4 Control of Excipients
•
3.2.P.5 Control of Drug Product
•
3.2.P.6 Reference Standards or Materials (name,
dosage form)
•
3.2.P.7 Container Closure System (name, dosage form)
•
3.2.P.8 Stability

Wymagania dotyczące ulotki
Wymagania dotyczące ulotki
–
Stwierdzenie w ulotce oraz reklamie:
Stwierdzenie w ulotce oraz reklamie:
roślinny produkt leczniczy do stosowania
roślinny produkt leczniczy do stosowania
we wskazaniach wynikających wyłącznie z
we wskazaniach wynikających wyłącznie z
długotrwałego stosowania
długotrwałego stosowania
–
Konieczność konsultacji z lekarzem w
Konieczność konsultacji z lekarzem w
przypadku utrzymywania się objawów lub
przypadku utrzymywania się objawów lub
wystąpienia działań niepożądanych nie
wystąpienia działań niepożądanych nie
opisanych w ulotce
opisanych w ulotce

Odmowa rejestracji tradycyjnego
Odmowa rejestracji tradycyjnego
stosowania
stosowania
•
Odmienny od deklarowanego skład jakościowy i
Odmienny od deklarowanego skład jakościowy i
ilościowy
ilościowy
•
Jakość produktu niewłaściwa
Jakość produktu niewłaściwa
•
Wskazania wykraczające poza zakres
Wskazania wykraczające poza zakres
tradycyjnego stosowania
tradycyjnego stosowania
•
Produkt może być niebezpieczny w warunkach
Produkt może być niebezpieczny w warunkach
zwykłego stosowania
zwykłego stosowania
•
Dane dotyczące tradycyjnego stosowania są
Dane dotyczące tradycyjnego stosowania są
niepełne
niepełne
Decyzja o odmowie z uzasadnieniem przekazywana
Decyzja o odmowie z uzasadnieniem przekazywana
wnioskodawcy, Komisji Europejskiej i innym
wnioskodawcy, Komisji Europejskiej i innym
państwom UE
państwom UE

Committee for Herbal Medicinal
Committee for Herbal Medicinal
Products
Products
•
27 przedstawicieli krajów UE + max 5
27 przedstawicieli krajów UE + max 5
ekspertów
ekspertów
•
Status prawny podobny do innych
Status prawny podobny do innych
komiteów naukowych EMEA
komiteów naukowych EMEA

Committee for Herbal Medicinal
Committee for Herbal Medicinal
Products cd.
Products cd.
•
Monografie tradycyjnych ziołowych
Monografie tradycyjnych ziołowych
produktów leczniczych oraz ziołowych
produktów leczniczych oraz ziołowych
produktów leczniczych dopuszczanych do
produktów leczniczych dopuszczanych do
obrotu zgodnie z art. 10 (1) a(ii)
obrotu zgodnie z art. 10 (1) a(ii)
Dyrektywy 2001/83
Dyrektywy 2001/83
•
W
W
ykaz substancji
ykaz substancji
,
,
preparatów lub ich
preparatów lub ich
kombinacji do zastosowania w sk
kombinacji do zastosowania w sk
ł
ł
adzie
adzie
tradycyjnych zio
tradycyjnych zio
ł
ł
owych produktów
owych produktów
leczniczych
leczniczych
(wskazania, moc, droga
(wskazania, moc, droga
podania, bezpieczeństwo)
podania, bezpieczeństwo)
•
Opinie na potrzeby Państw Członkowskich
Opinie na potrzeby Państw Członkowskich
(< 15 lat)
(< 15 lat)
•
Postępowanie arbitrażowe między
Postępowanie arbitrażowe między
państwami członkowskimi
państwami członkowskimi

•
Komitet do spraw Roślinnych
Komitet do spraw Roślinnych
Produktów Leczniczych Europejskiej
Produktów Leczniczych Europejskiej
Agencji Leków, wyda
Agencji Leków, wyda
je
je
opini
opini
ę
ę
na
na
żądanie państwa członkowskiego
żądanie państwa członkowskiego
w
w
sprawie uznania tradycyjnego
sprawie uznania tradycyjnego
stosowania roślinnego produktu
stosowania roślinnego produktu
leczniczego lub odpowiadającego mu
leczniczego lub odpowiadającego mu
produktu
produktu
na podstawie
na podstawie
dołącz
dołącz
onej
onej
dokumentacj
dokumentacj
i
i

W przypadku, złożenia wniosku o
W przypadku, złożenia wniosku o
dopuszczenie do obrotu produktu
dopuszczenie do obrotu produktu
leczniczego roślinnego stosowanego w
leczniczego roślinnego stosowanego w
państwach członkowskich Unii
państwach członkowskich Unii
Europejskiej
Europejskiej
przez okres krótszy niż 15
przez okres krótszy niż 15
lat
lat
, do Komitetu do spraw Roślinnych
, do Komitetu do spraw Roślinnych
Produktów Leczniczych w Europejskiej
Produktów Leczniczych w Europejskiej
Agencji Leków
Agencji Leków
przekazywana jest
przekazywana jest
dokumentacj
dokumentacj
a
a
tego produktu w celu
tego produktu w celu
ustalenia czy zostały spełnione pozostałe
ustalenia czy zostały spełnione pozostałe
warunki konieczne do uznania
warunki konieczne do uznania
tradycyjnego stosowania roślinnego
tradycyjnego stosowania roślinnego
produktu leczniczego.
produktu leczniczego.

•
Monografia może być podstawą wniosku o
Monografia może być podstawą wniosku o
dopuszczenie do obrotu jako WEU lub dla
dopuszczenie do obrotu jako WEU lub dla
uproszczonej procedury dla tradycyjnych
uproszczonej procedury dla tradycyjnych
roślinnych produktów leczniczych. Stanowią
roślinnych produktów leczniczych. Stanowią
ocenę naukową roślinnego produktu
ocenę naukową roślinnego produktu
leczniczego im powinny być brane pod uwagę
leczniczego im powinny być brane pod uwagę
przez Państwa Członkowskie przy ocenie
przez Państwa Członkowskie przy ocenie
wniosków. Nie są jednak obowiązujące.
wniosków. Nie są jednak obowiązujące.
Jednakże niezaakceptowanie monografii
Jednakże niezaakceptowanie monografii
powinno być należycie uzasadnione.
powinno być należycie uzasadnione.

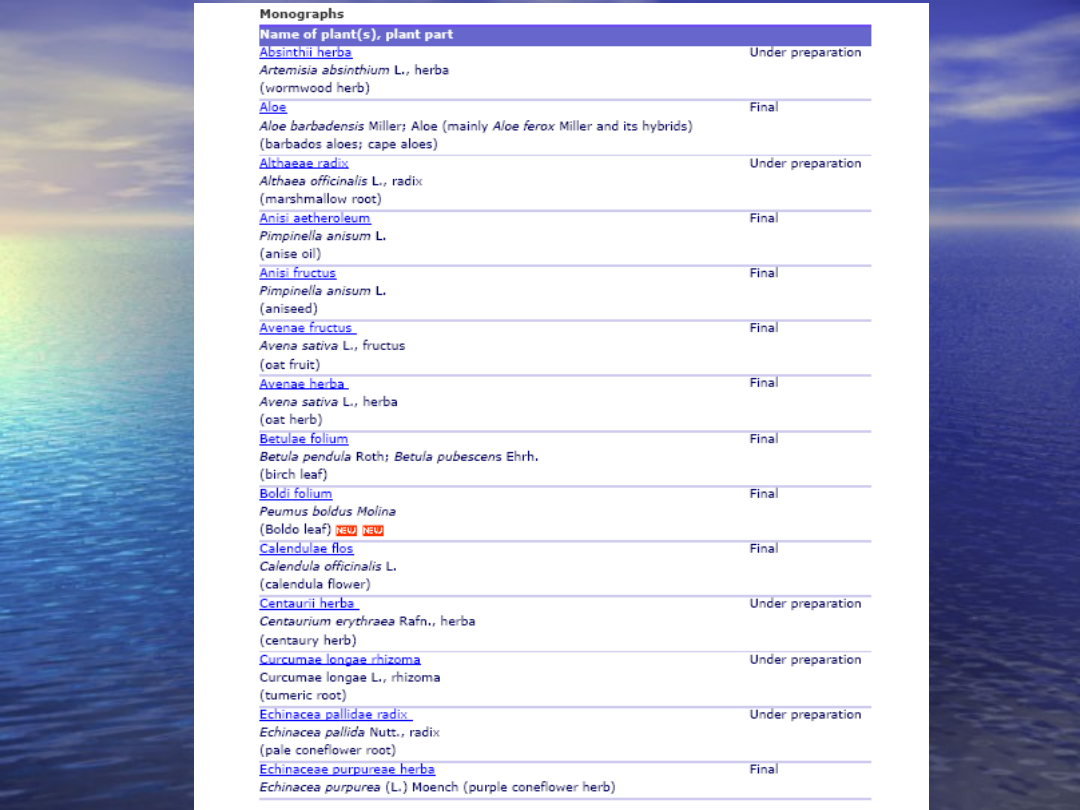
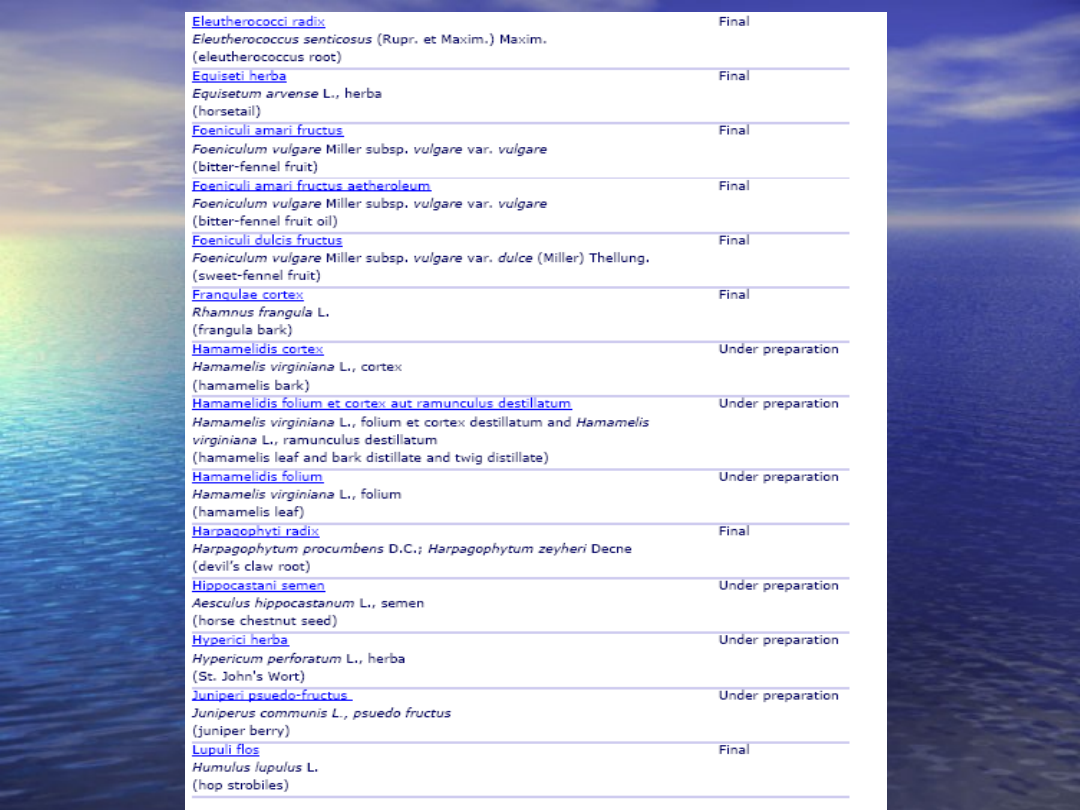
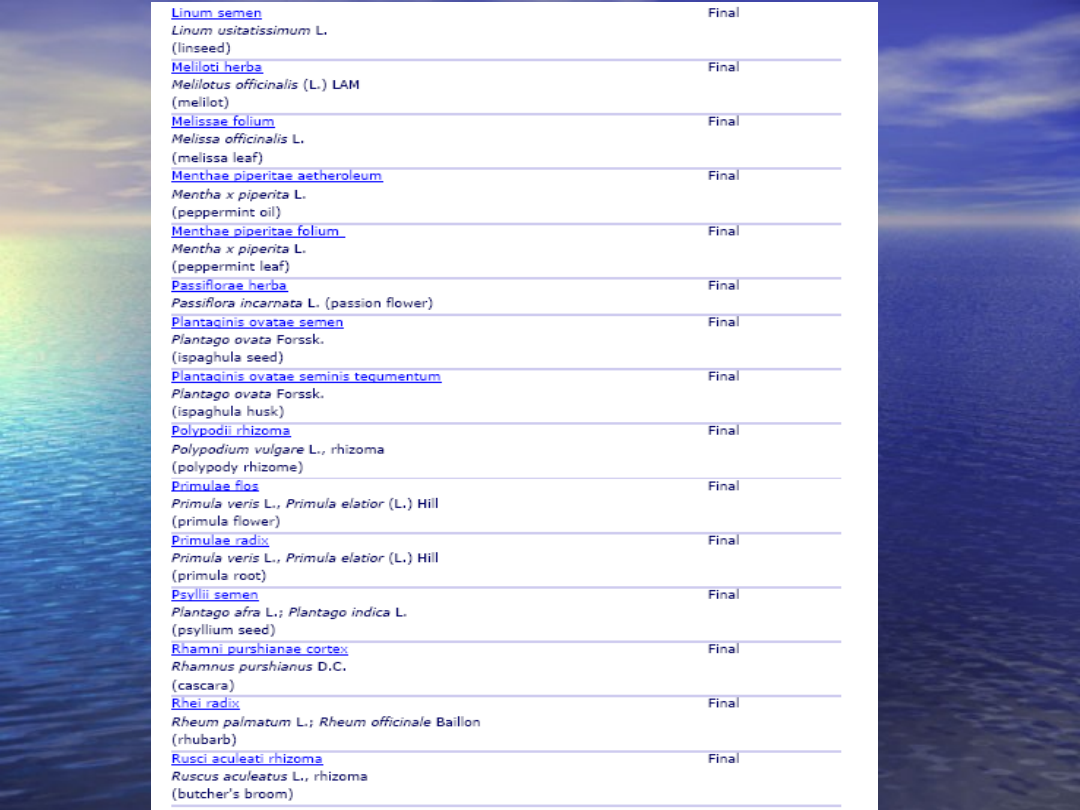
Monografiie wspólnotowe publikowane są
Monografiie wspólnotowe publikowane są
•
dla substancji roślinnych tradycyjne
dla substancji roślinnych tradycyjne
stosowanych
stosowanych
w produktach roślinnych
w produktach roślinnych
•
dla substancji roślinnych o ugruntowanym
dla substancji roślinnych o ugruntowanym
zastosowaniu medycznym
zastosowaniu medycznym
•
dla substancji roślinnych, dla których wykazano
dla substancji roślinnych, dla których wykazano
ugruntowane zastosowanie medyczne
ugruntowane zastosowanie medyczne
oraz tradycyjne stosowanie produktu roślinnego
oraz tradycyjne stosowanie produktu roślinnego






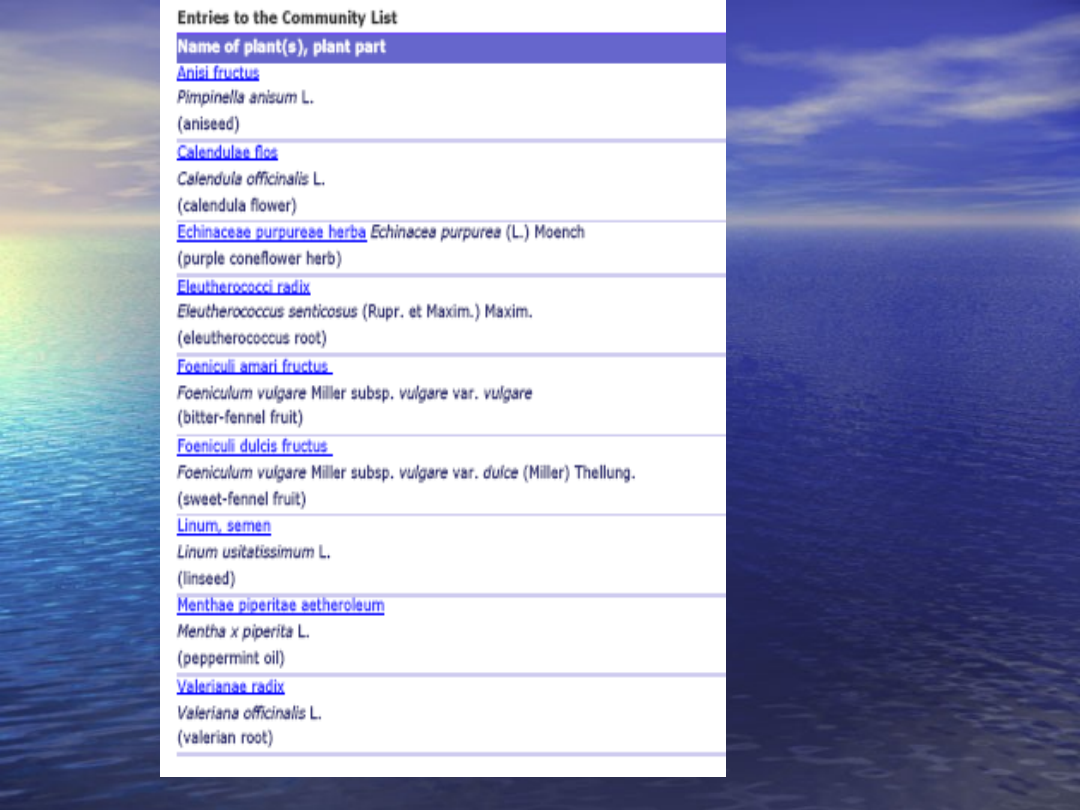
•Wykaz substancji, preparatów lub ich
kombinacji do zastosowania w składzie
tradycyjnych ziołowych produktów
leczniczych może być zastosowany w
miejsce raportu eksperta i dokumentacji
dowodzącej 30-letniego stosowania
•Wykaz ten jest prawnie wiążący dla
Państw Członkowskich. Władze
rejestracyjne nie mogą żądać
dodatkowych danych dotyczących
bezpieczenstwa oraz tradycyjnego
stosowania

Procedury europejskie
Procedury europejskie
•
G
G
dy dla tradycyjnego roślinnego produktu
dy dla tradycyjnego roślinnego produktu
leczniczego, opracowan
leczniczego, opracowan
a zostanie
a zostanie
monografi
monografi
a
a
wspólnotow
wspólnotow
a
a
,
,
może być on
może być on
przedmiotem
przedmiotem
procedury wzajemnego
procedury wzajemnego
uznawania lub zdecentralizowanej
uznawania lub zdecentralizowanej

Co wnosi nowe prawo w odniesieniu do
Co wnosi nowe prawo w odniesieniu do
roślinnych produktów leczniczych?
roślinnych produktów leczniczych?
•
Dostosowanie procedury i wymagań do
Dostosowanie procedury i wymagań do
specyfiki roślinnych produktów leczniczych
specyfiki roślinnych produktów leczniczych
•
3 typy dokumentacji: nowe badania (pełny
3 typy dokumentacji: nowe badania (pełny
wniosek), bibliografia i tradycyjny roślinny
wniosek), bibliografia i tradycyjny roślinny
produkt leczniczy (nowa procedura)
produkt leczniczy (nowa procedura)
•
2 procedury: dopuszczenie do obrotu i
2 procedury: dopuszczenie do obrotu i
tradycyjne stosowanie (
tradycyjne stosowanie (
traditional use
traditional use
registration)
registration)
•
Nowy komitet naukowy

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
Wstrzymanie Dyrektywy dotyczacej tradycyjnych ziolowych produktow leczniczych
Wyciągi ziołowe
Dyrektywa Dzwigowa 95 16 WE Czesc 1
Dyrektywa nr 2002 7 WE z 18 02 2002
Dyrektywa w sprawie oznakowania opakowań
DYREKTYWA 200291WE PARLAMENTU EUROPEJSKIEGO I RADY z dnia 16 grudnia 2002 r w sprawie charaktery
dyrektywa o składowiskach odpadów
Dyrektywa 1987 404 EWG Zbiorniki ciśnieniowe
Dyrektywa IED
Zgoda do Dyrektora, geologia, AGH
Niezwykle zdrowe napary ziołowe, Kuchnia
wychowanie dyrektywne i niedyrektywne
DYREKTYWY NOWEGO PODEJŚCIA, administracja
Kochana Nasza Pani Dyrektor
PREPARATY ZIOŁOWE ABOCA NATURA MIX
Głęboki peeling ziołowy
PREPARATY ZIOŁOWE ABOCA FITOROID
karne 04 15 WYKŁAD DYREKTYWY
więcej podobnych podstron