
1
Problemy do rozważenia...
• Jak tworzą się wiązania?
• Jakiego rodzaju wiązania?
• Jakie własności wynikają z rodzaju wiązań?
WIĄZANIA MIĘDZYATOMOWE
I WŁASNOŚCI MATERIAŁÓW
Ciekawy przykład - węgiel:
Dwie odmiany:
grafit
i
diament
grafit – miękki, "smarujący"
diament – najtwardszy znany materiał

2
Struktura Atomowa (Chemia)
• atom –
elektrony
– 9.11 x 10
-31
kg
protony
neutrony
• Liczba atomowa Z
= liczba protonów w jądrze atomu
= liczba elektronów (atom obojętny)
N
= liczba neutronów może być różna (
izotopy
)
• Masa atomowa
A
= masa 6.023 x 10
23
atomów
• Jednostka masy atomowej
= jma = u = 1/12 masy
12
C
(A = 12.0000)
A = Z + N
1 jma/atom = 1g/mol
C 12.011
H 1.008 etc.
}
1.67 x 10
-27
kg
Liczba Avogadra
3
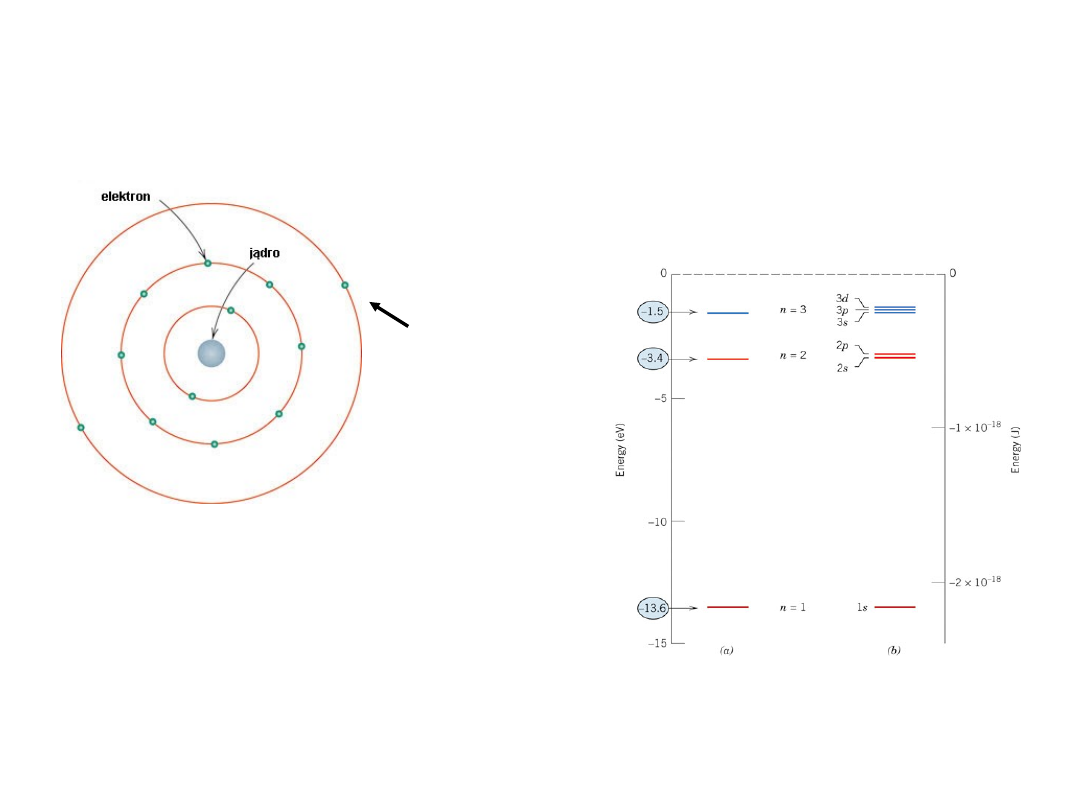
Model atomu wg Bohra
jądro – protony +
neutrony
Energie elektronów są skwantowane
Wartości energii (stany) – ściśle określone
wartości
Dozwolone stany
energetyczne dla
wodoru
Bardziej dokładny jest
model falowy – mechanika
kwantowa
Elektrony
walencyj
ne
4
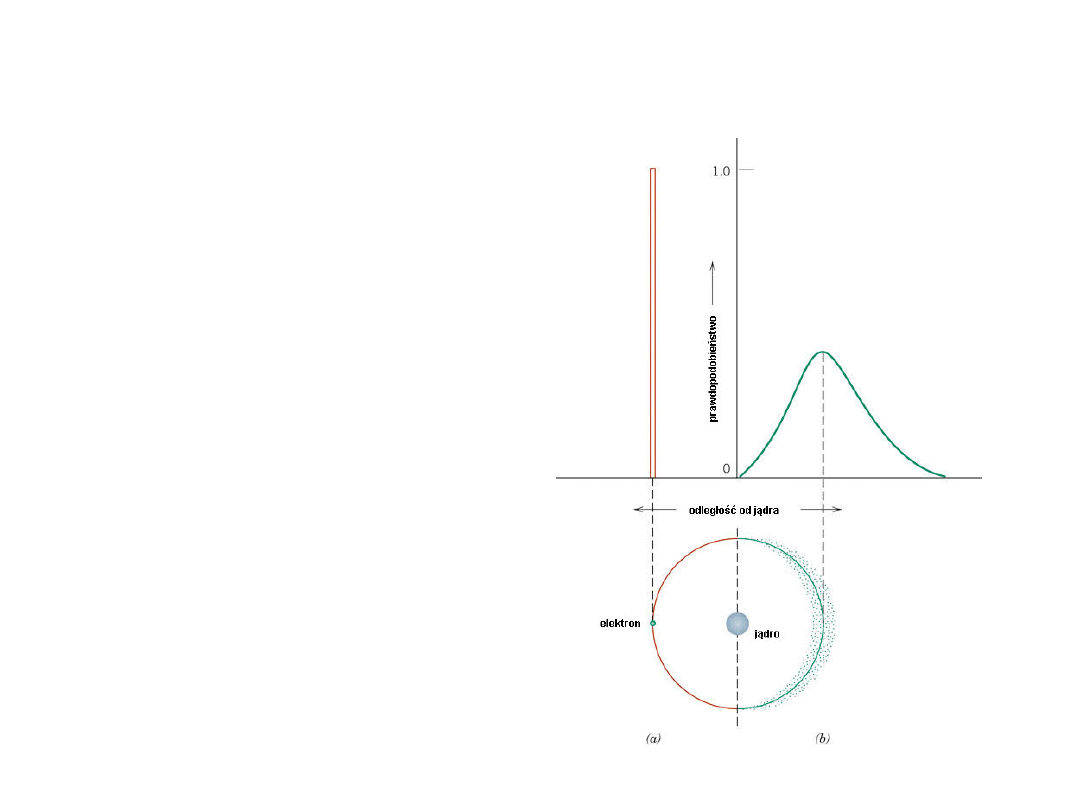
Model falowy
Elektrony wykazują
zarówno właściwości
falowe jak i
czasteczkowe
Położenie pojedynczego
elektronu jest
traktowane jako rozkład
prawdopodobieństwa
wokół jądra
Zasada Pauliego - w
atomie nie może być
więcej niż 2 elektronów
znajdujących się w tym
samym stanie

5
Struktura Elektronowa
• Elektrony mają właściwości falowe i korpuskularne +
zasada Pauli'ego:
– Elektrony zajmują ścisle określone stany energetyczne
zdefiniowane przez prawdopodobieństwo
(orbitale)
.
– Każdy orbital ma dyskretny poziom energii określony przez
liczby kwantowe
.
Liczby kwantowe Oznaczenie
n = główna (określa powłokę)
K, L, M, N, O (1, 2, 3, etc.)
l = poboczna (podpowłoka)
s, p, d, f (0, 1, 2, 3,…, n
-1)
m
l
= magnetyczna
1, 3, 5, 7 (-l ÷ +l)
m
s
= spin ½, -½
6
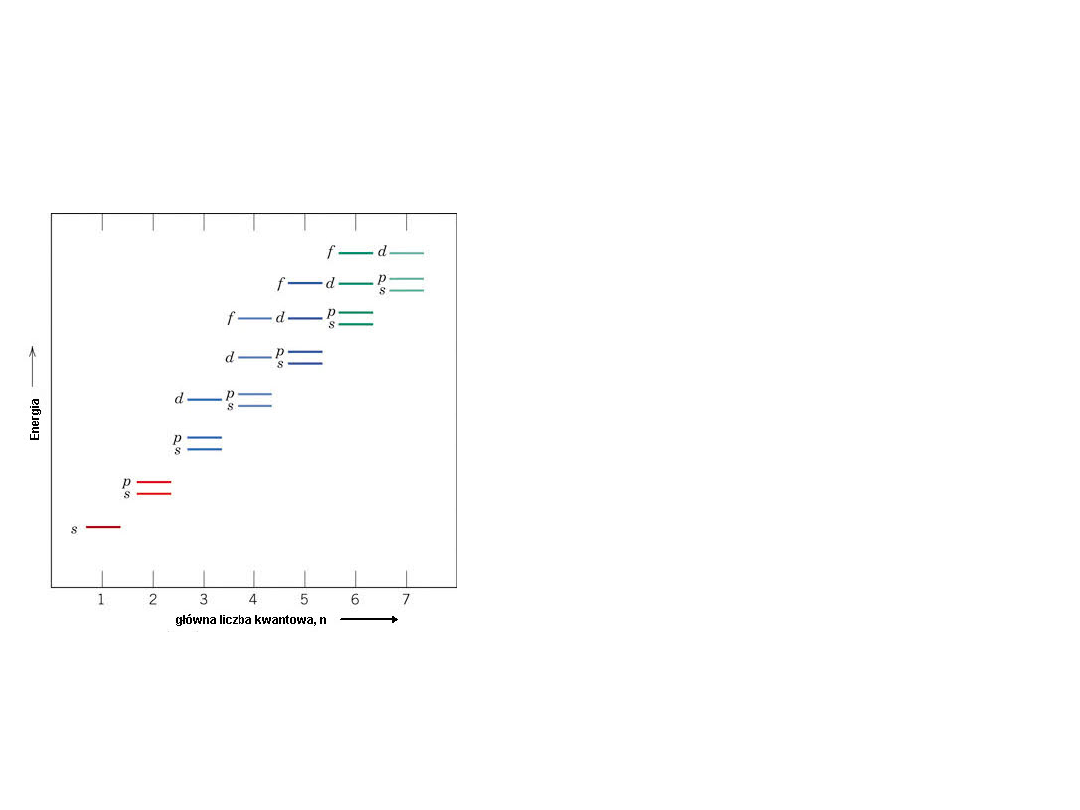
Stany Energetyczne Elektronów
Elektrony zajmują kolejne orbitale na
kolejnych powłokach tak aby atom jako
całość posiadał jak najniższą energię.
Znając
liczbę atomową
danego pierwiastka
można łatwo samemu ustalić jego
konfigurację elektronową
Reguły:
1.
Najpierw zapełnieniu ulegają orbitale "s",
potem "p", potem "d" i na końcu "f".
2.
Orbitale z wyższych warstw są zapełniane
dopiero po całkowitym zapełnieniu warstw
niższych.
3.
Na orbitalach s mogą być tylko 2
elektrony, na p 6, na d 10 i na f 14
4.
W pierwszej powłoce jest tylko orbital s, w
drugiej są orbitale s i p, w trzeciej s, p i d i
w końcu w czwartej i piątej pojawiają się
jeszcze orbitale f.
7
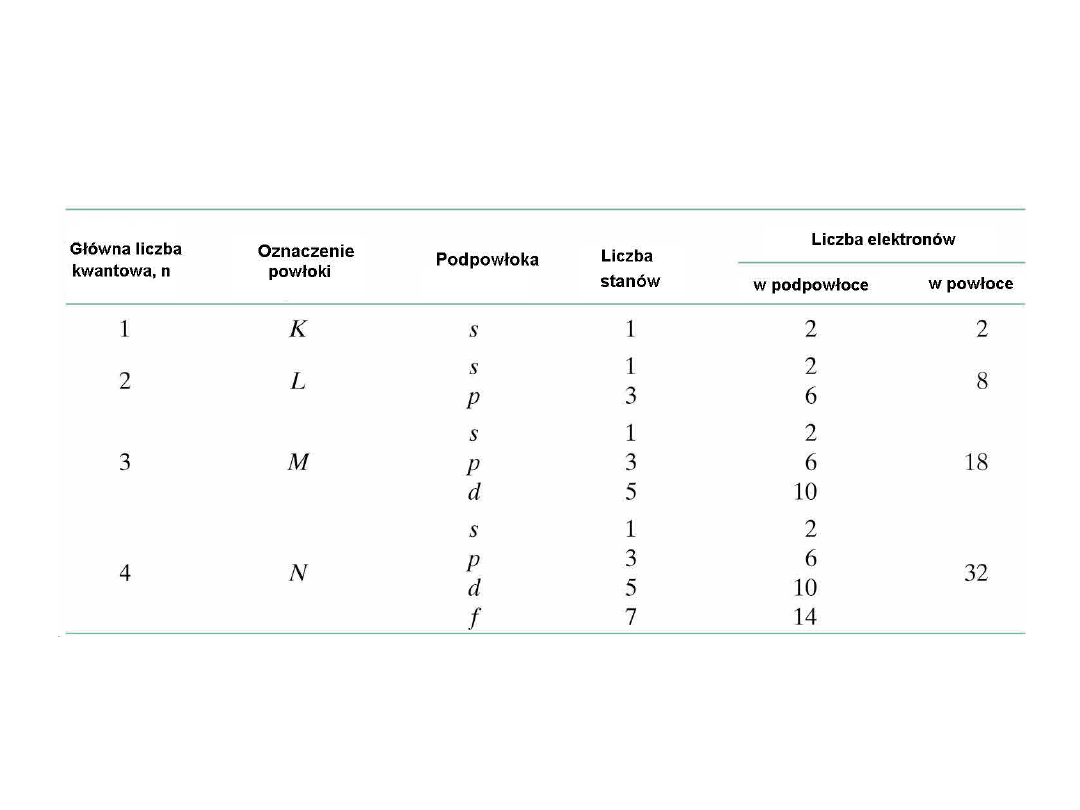
Liczba możliwych stanów energetycznych
elektronów w powłokach i podpowłokach

8
Większość pierwiastków ma konfigurację elektronową niestabilną
PRZEGLĄD PIERWIASTKÓW
Konfiguracja electronowa
(stabilna)
...
...
1s
2
2s
2
2p
6
3s
2
3p
6
(stabilna)
...
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
(stabilna)
Z
18
...
36
Pierwiastek
1s
1
1
Wodór
1s
2
2
Hel
1s
2
2s
1
3
Lit
1s
2
2s
2
4
Beryl
1s
2
2s
2
2p
1
5
Bor
1s
2
2s
2
2p
2
6
Węgiel
...
1s
2
2s
2
2p
6
(stabilna)
10
Neon
1s
2
2s
2
2p
6
3s
1
11
Sód
1s
2
2s
2
2p
6
3s
2
12
Magnez
1s
2
2s
2
2p
6
3s
2
3p
1
13
Aluminium
...
Argon
...
Krypton

9
Elektrony
• Elektrony walencyjne
–
elektrony w
najdalszej (zewnętrznej) powłoce, biorą udział
w tworzeniu wiązań międzyatomowych
• Elektrony walencyjne
wpływają
(poprzez wiązania) na nastepujące własności:
1)Chemiczne
2)Electryczne
3)Cieplne
4)Optyczne
Powłoka walencyjna
nie jest zwykle w
pełni obsadzona elektronami
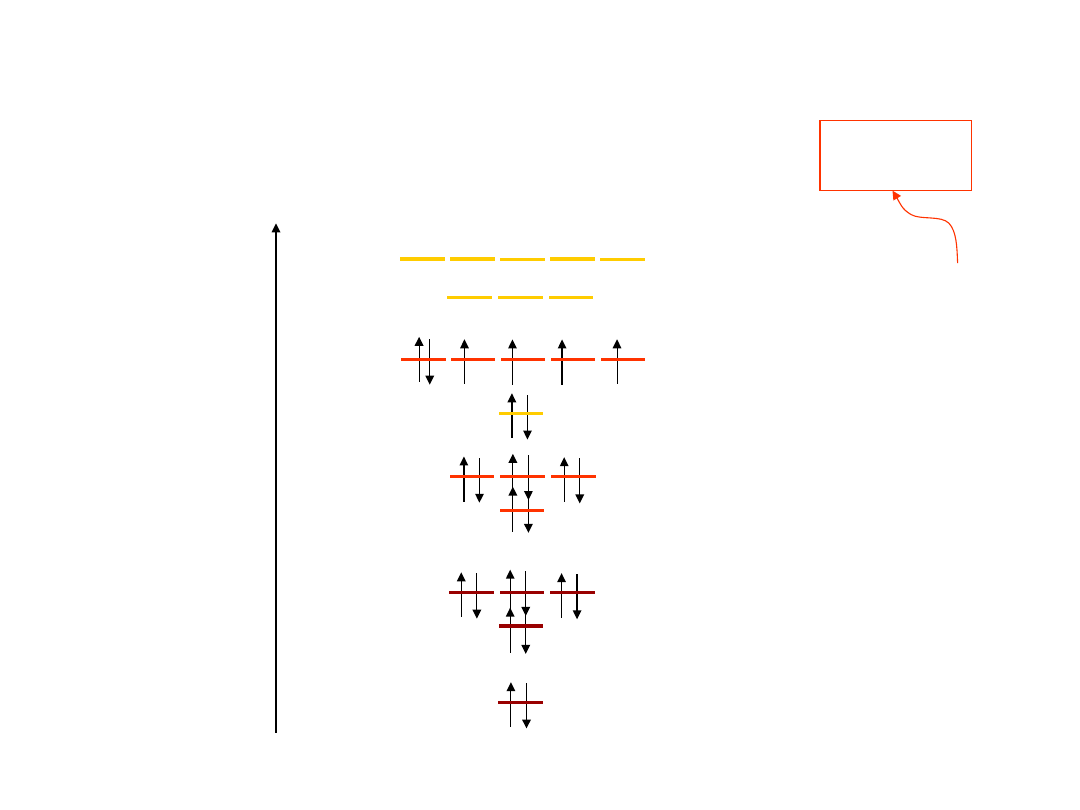
10
Konfiguracje Elektronowe
np: Fe, Z
=
26
Elektrony
walencyjne
1s
2s
2p
K n = 1
L n = 2
3s
3p
M n = 3
3d
4s
4p
4d
Energia
N n = 4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
11
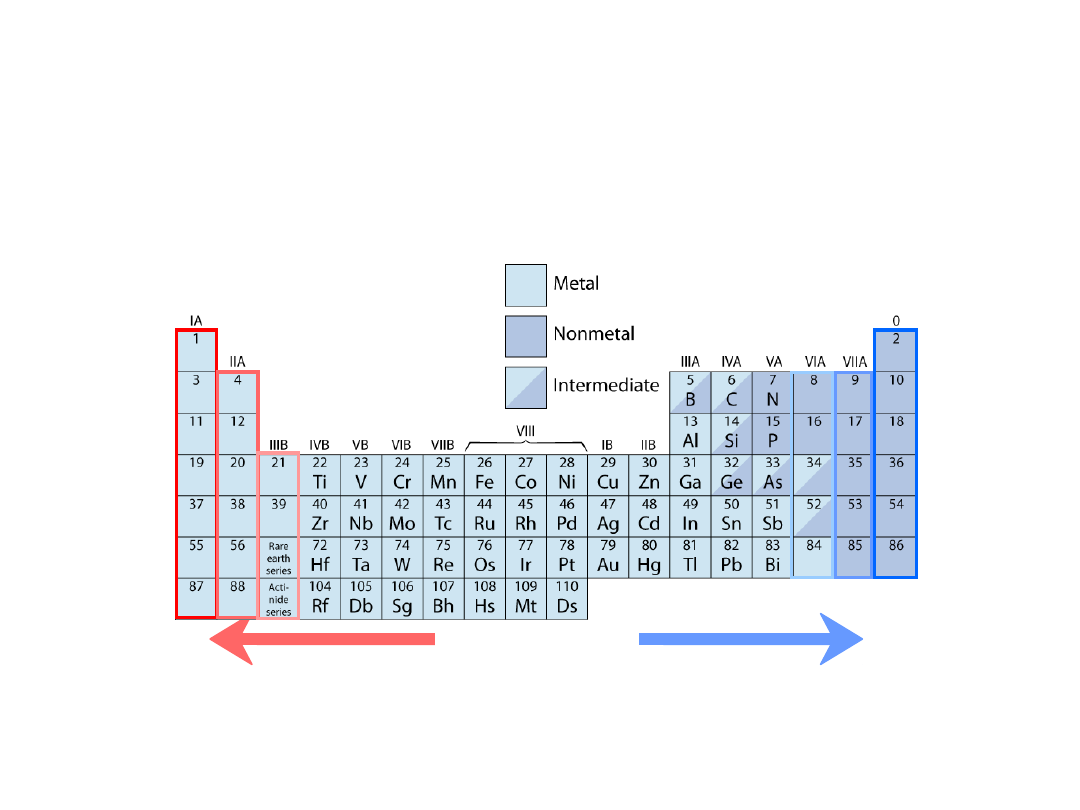
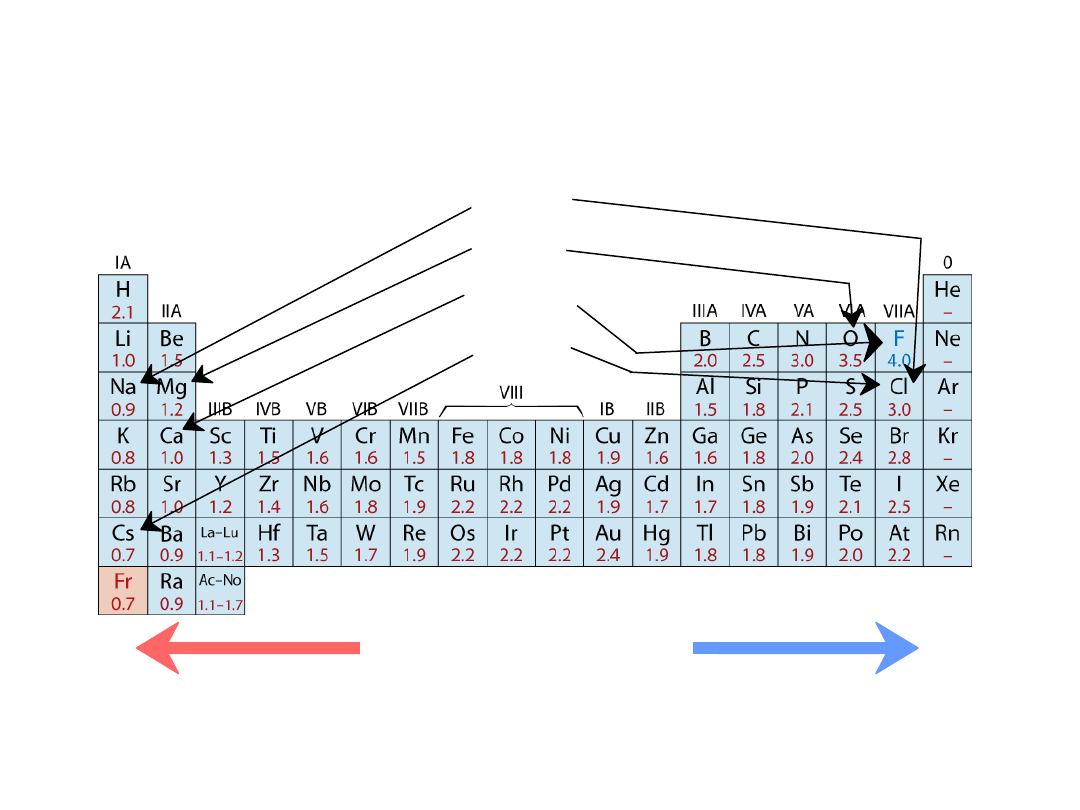
Układ okresowy pierwiastków
Kolumny:
Podobna struktura
walencyjna
Pierwiastki elektrododatnie:
chętnie oddają elektrony
i stają się jonami dodatnimi
Pierwiastki elektroujemne:
chętnie pobierają elektrony i stają się
jonami ujemnymi
o
d
d
a
je
1
e
o
d
d
a
je
2
e
o
d
d
a
je
3
e
g
a
z
d
o
s
k
.
p
rz
y
jm
u
je
1
e
p
rz
y
jm
u
je
2
e
O
Se
Te
Po At
I
Br
He
Ne
Ar
Kr
Xe
Rn
F
Cl
S
Li
Be
H
Na
Mg
Ba
Cs
Ra
Fr
Ca
K
Sc
Sr
Rb
Y
12
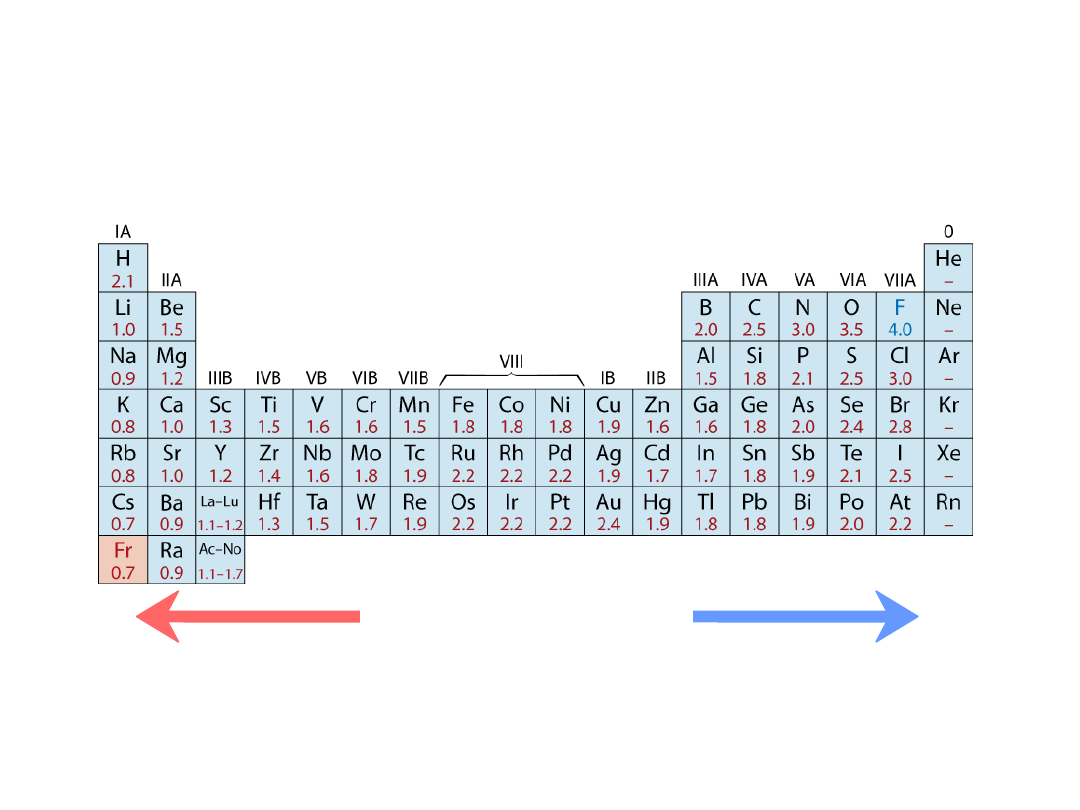
• Zakres od
0.7
do
4.0
,
Mniejsza elektroujemność
Większa elektroujemność
• Duże wartości: tendencja do przyjmowania elektronów
Elektroujemność
13
•
Występuje pomiędzy
+
i
-
jonami
•
Wymaga
transferu electronów
•
Wymagana duża różnica w elektroujemności
Przykład:
NaCl
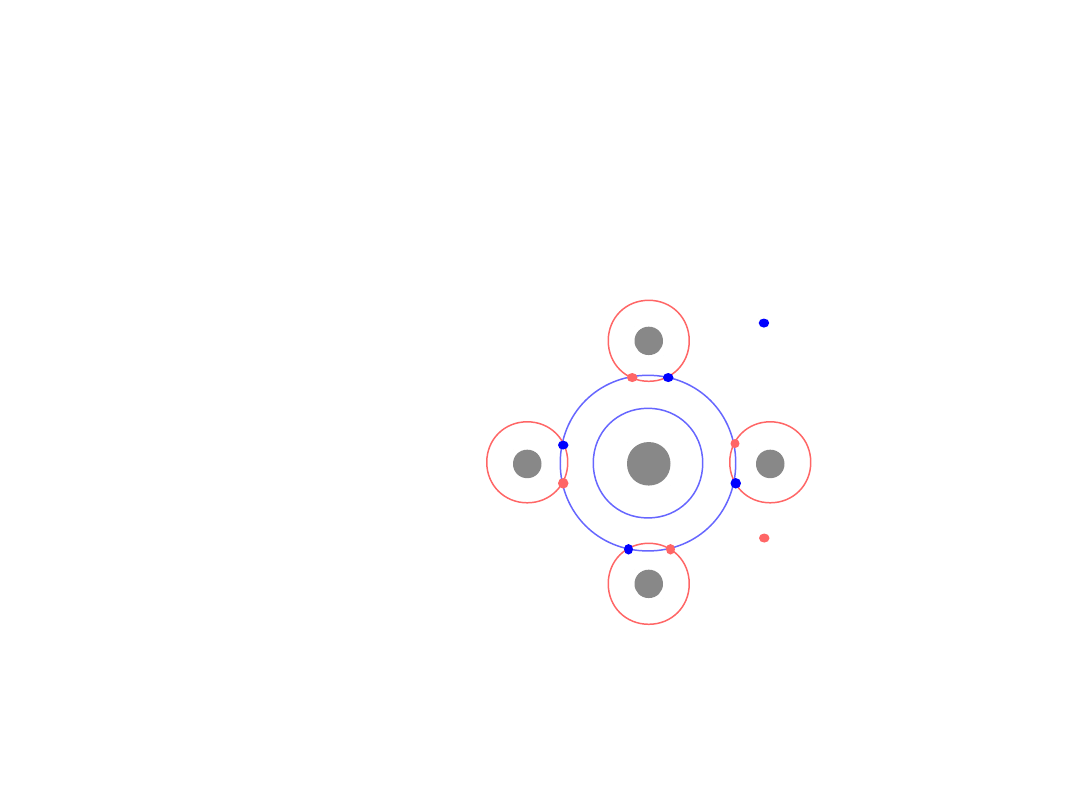
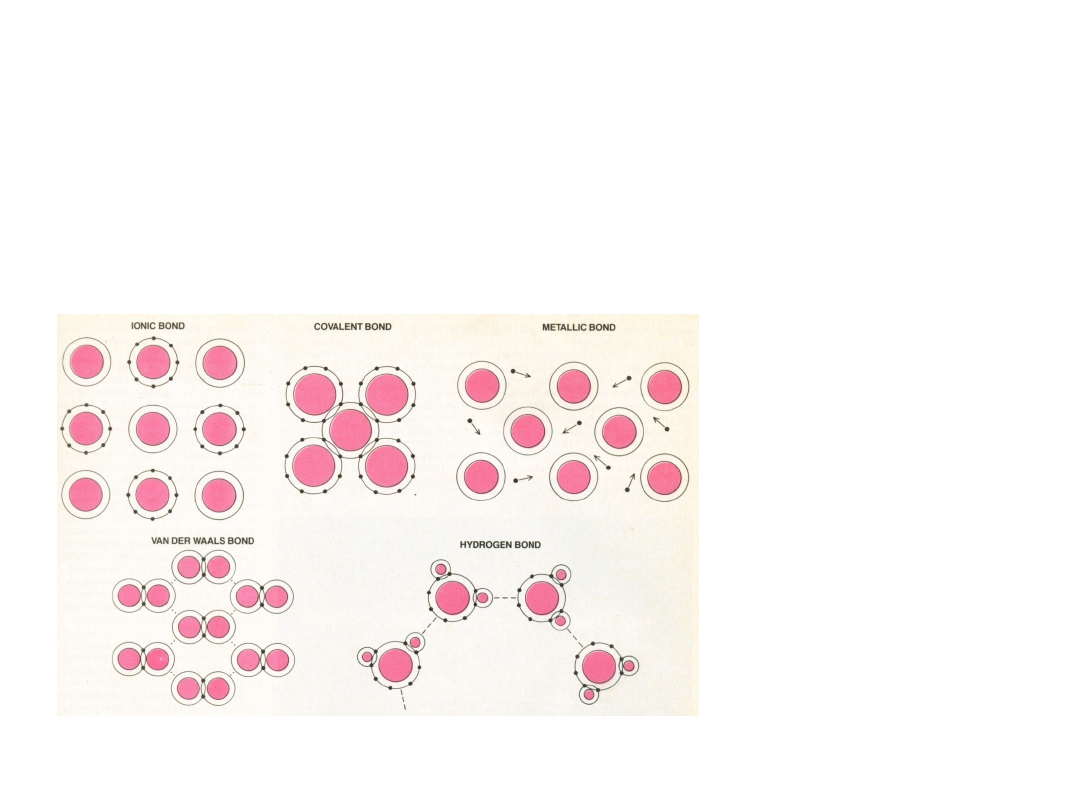
Wiązanie jonowe
Na (metal)
niestabilny
Cl (niemetal)
niestabilny
elektron
+
-
Przyciąganie
kolumbowskie
Na (kation)
stabilny
Cl (anion)
stabilny
Siły
Coulomba
Przejście elektronu z zewnętrznej powłoki Na do Cl prowadzi do
utworzenia trwalszej struktury elektronowej, gdyż powstały jon Na
+
ma
całkowicie zapełnioną zewnętrzną powłokę. Atom Cl przyłącza natomiast
chętnie elektron, gdyż jon Cl
–
ma wtedy również w pełni wypełnione
zewnętrzne podpowłoki (s,p)
14
Wiązanie jonowe –
metal
+
niemetal
dostarcza
przyjmuje
elektrony
elektrony
Różne elektroujemności
Np.:
Mg
O
Mg
1s
2
2s
2
2p
6
3s
2
O
1s
2
2s
2
2p
4
[Ne] 3s
2
Mg
2+
1s
2
2s
2
2p
6
O
2-
1s
2
2s
2
2p
6
[Ne]
[Ne]
15
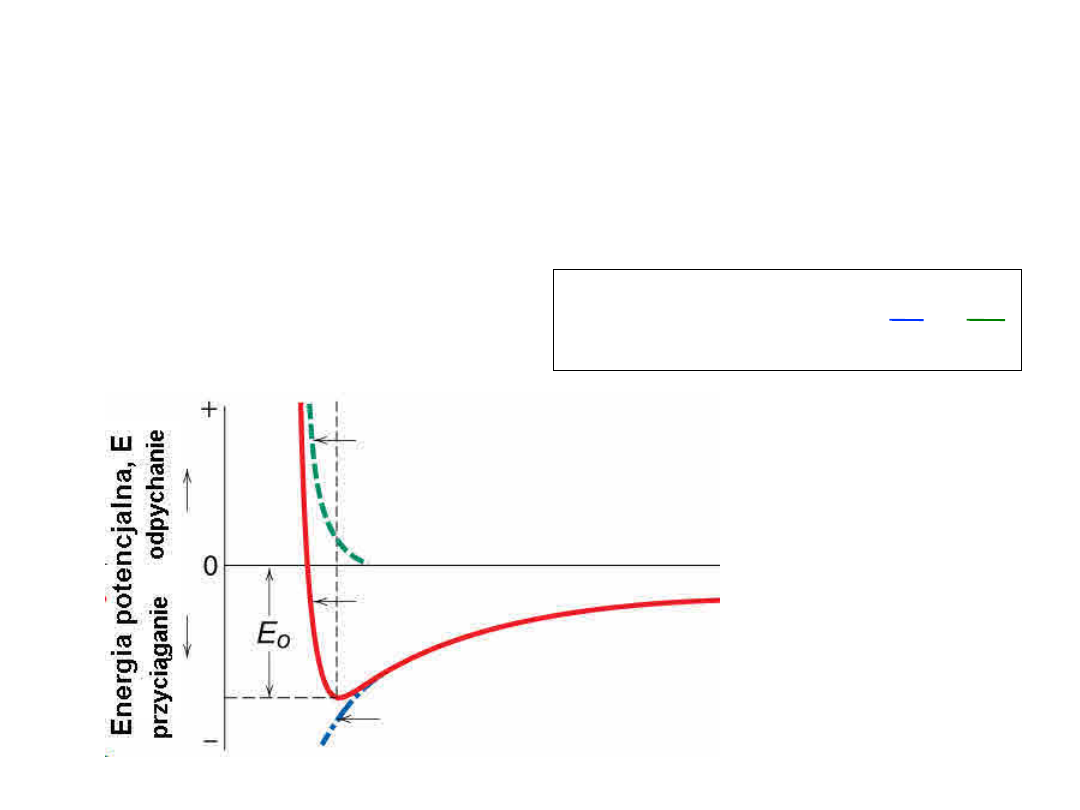
Wiązanie jonowe
Energia – minimum energii, najbardziaj stabilny układ
–
Równowaga pomiędzy
przyciąganiem
a
odpychaniem
r
A
n
r
B
E
N
=
E
A
+
E
R
=
Energia odpychania
E
R
Energia wypadkowa, E
N
Energia przyciągania, EA
Odległość międzyatomowa, r
16
Dominujące wiązanie w
Ceramikach
Przykłady wiązań jonowych
Oddają elektrony
Przyjmują elektrony
NaCl
MgO
CaF
2
CsCl
17
C: ma 4 el. walencyjne e
-
,
potrzebuje jeszcze 4
H: ma 1 el. walencyjny e
-
,
potrzebuje jeszcze 1
Elektroujemności są
porównywalne
Wiązanie kowalencyjne
• podobna
elektroujemność
wspólne elektrony
• Wiązania tworzą elektrony z orbitali
s
&
p
• Przykład:
CH
4
Elektrony od atomu
węgla
Elektrony od
atomów wodoru
H
H
H
H
C
CH4
Wiązanie kowalencyjne jest
kierunkowe
Wiązanie kowalencyjne polega na tworzeniu się wiążących par
elektronów należących jednocześnie do dwóch sąsiadujących ze sobą
atomów
W czystej postaci wiązania kowalencyjne występują w
diamencie, krzemie i
germanie
. Mają one również swój udział w metalach wysokotopliwych (np.
wolfram, molibden, tantal
). Wiązania kowalencyjne są bardzo mocne, gdyż do
ich zerwania (stopienia materiału) konieczne są bardzo wysokie temperatury.
18
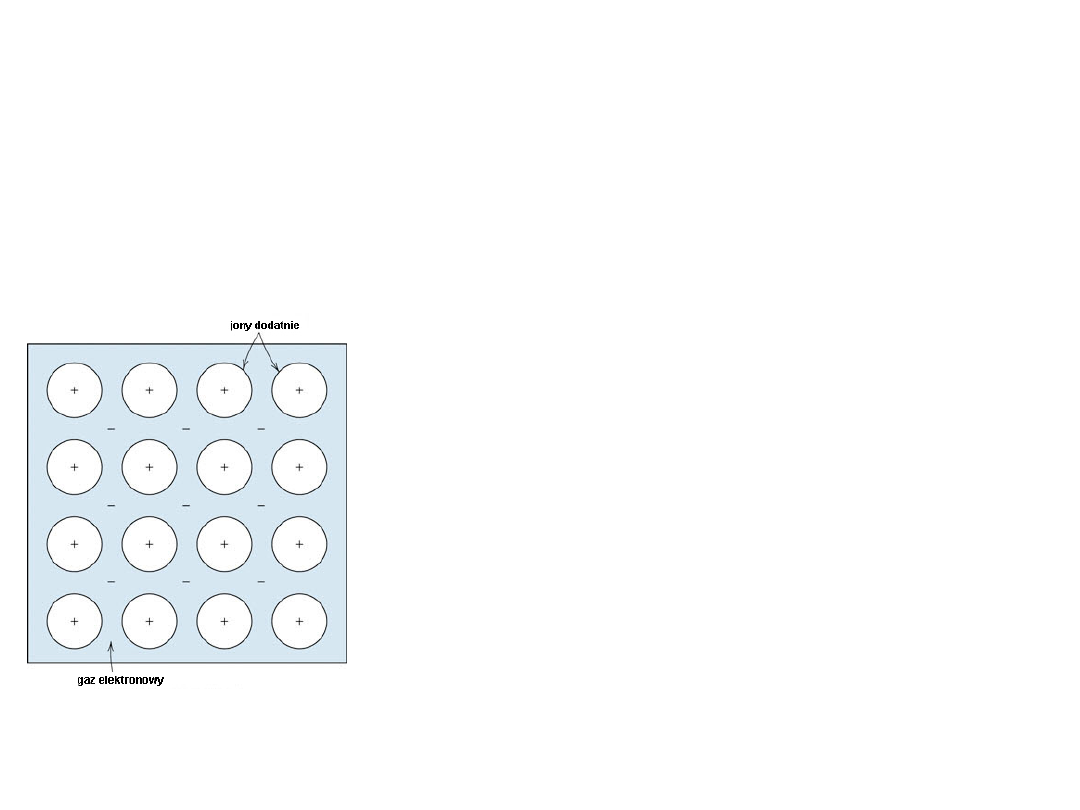
Wiązanie metaliczne
Wiązanie metaliczne
– chmura elektronów
nie związana z żadnym konkretnym jonem
Wiązanie metaliczne
nie ma charakteru
kierunkowego
Jeżeli metal przechodzi ze stanu pary w stan ciekły lub stały to
słabo związane z jądrem atomu elektrony walencyjne przestają
należeć do poszczególnych atomów i stają się elektronami
swobodnymi, stanowiącymi wspólną własność wszystkich
atomów.
Siła
wiązania metalicznego
zależy od energii
przyciągania między kationami i elektronami
swobodnymi oraz od energii odpychania
między samymi kationami i samymi
elektronami
19
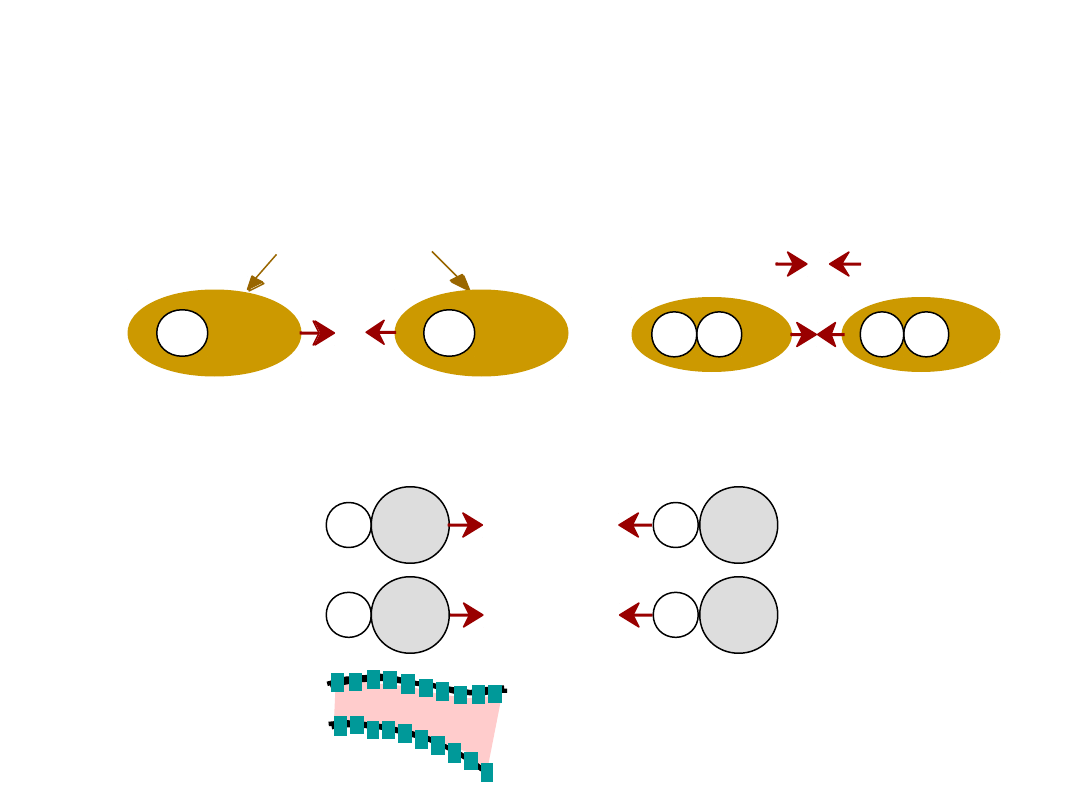
Wynika z oddziaływania pomiędzy
dipolami
•
Dipole trwałe
- cząsteczki
•
Dipole fluktuacyjne
przypadek ogólny:
ciekły HCl
polimer
WIĄZANIA WTÓRNE – Van der
Waalsa
asymetryczna chmura
elektronów
+
-
+
-
wiązanie
wtórne
H
H
H
H
H2
H2
wiązanie
wtórne
np: ciekły
H
2
H Cl
H Cl
wiązanie
wtórne
wiązanie
wtórne
+ -
+
-
Wiązanie w
tórne
20
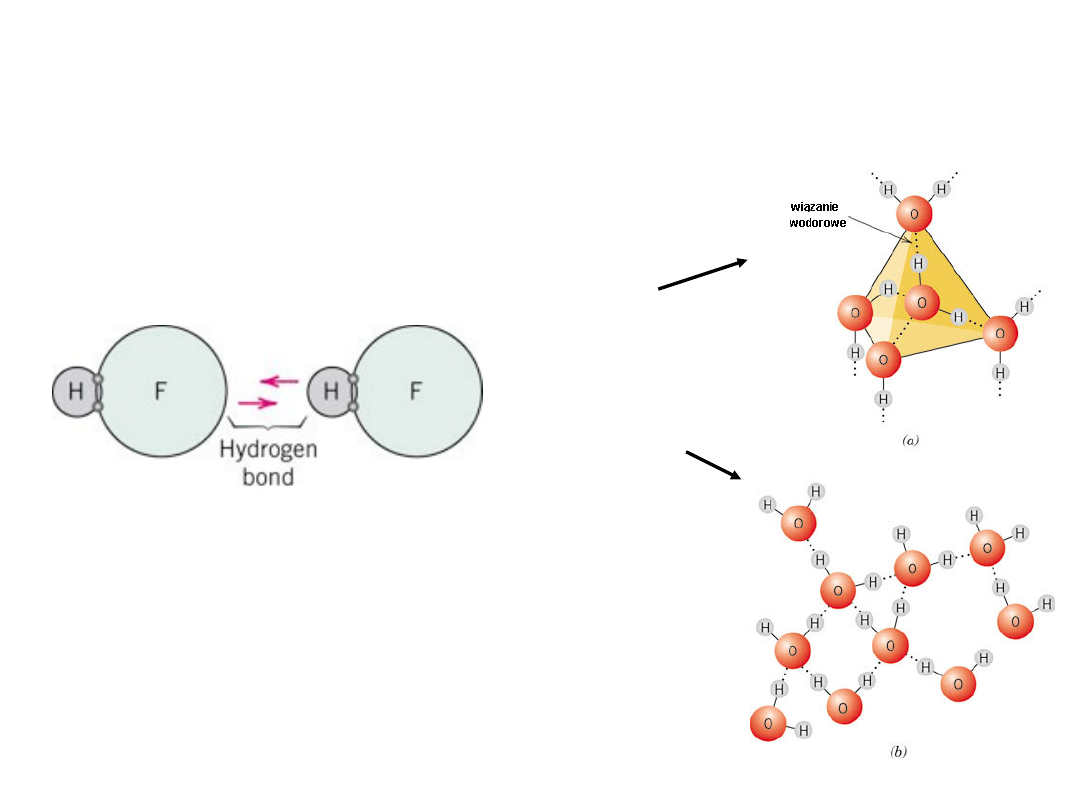
Wiązanie wodorowe
Wiązanie wodorowe w
HF
lód
woda
Szczególny przypadek wiązania
wtórnego, występuje pomiędzy
cząsteczkami zawierającymi
wodór
21
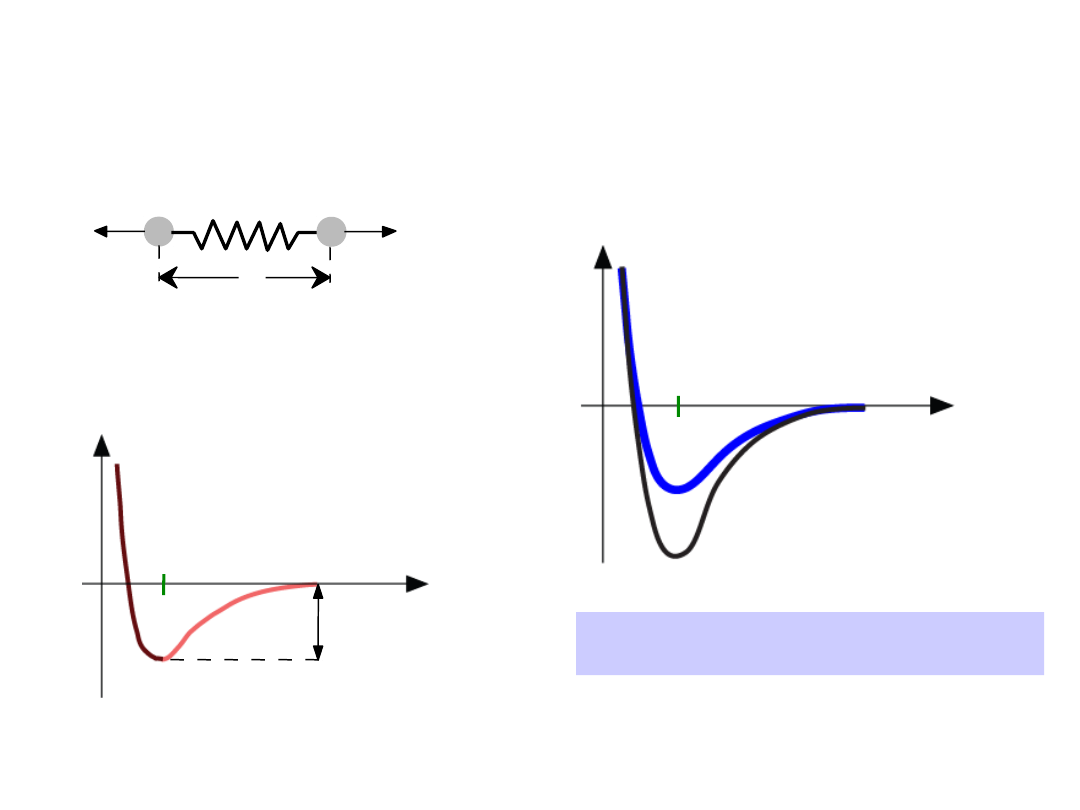
•
Długość wiązania
, r
•
Energia wiązania,
E
o
•
Temperatura topnienia
, T
m
T
m
jest większa, gdy E
o
jest większa
Własności zależne od typu
wiązania: T
m
r
o
r
Energia
r
większa T
m
mniejsza T
m
E
o
=
“energia wiązania”
Energia
r
o
r
Odległość

Energia różnych typów wiązań
22
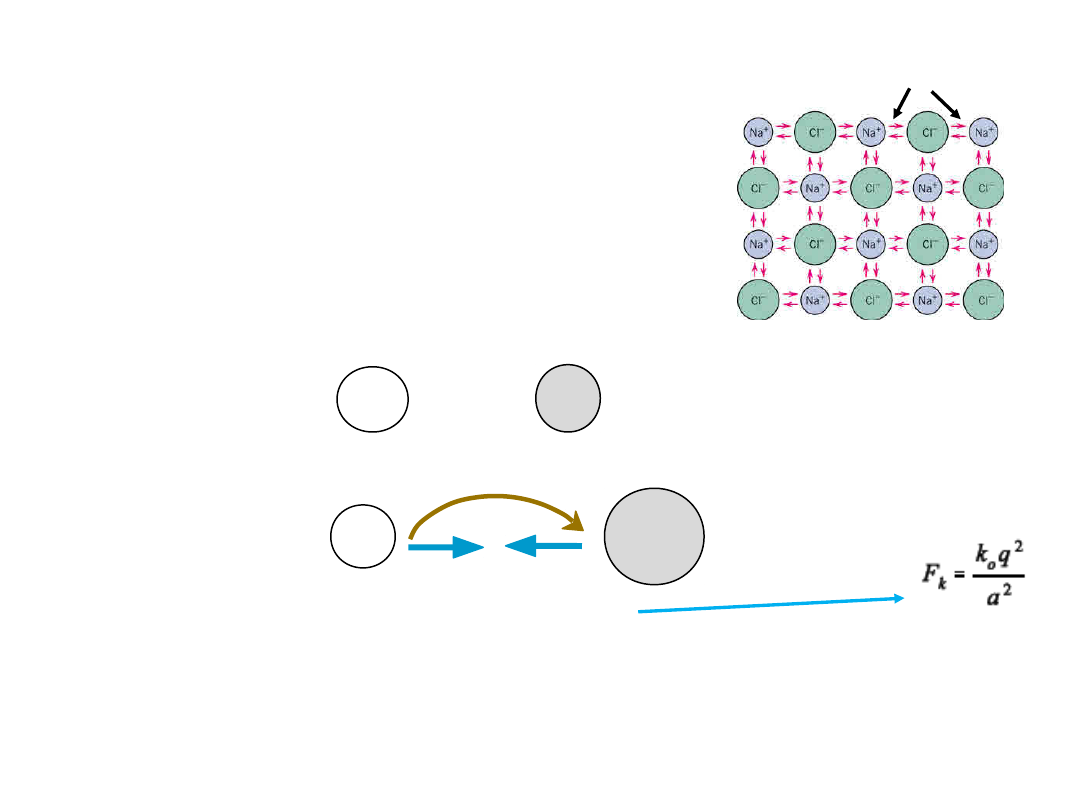
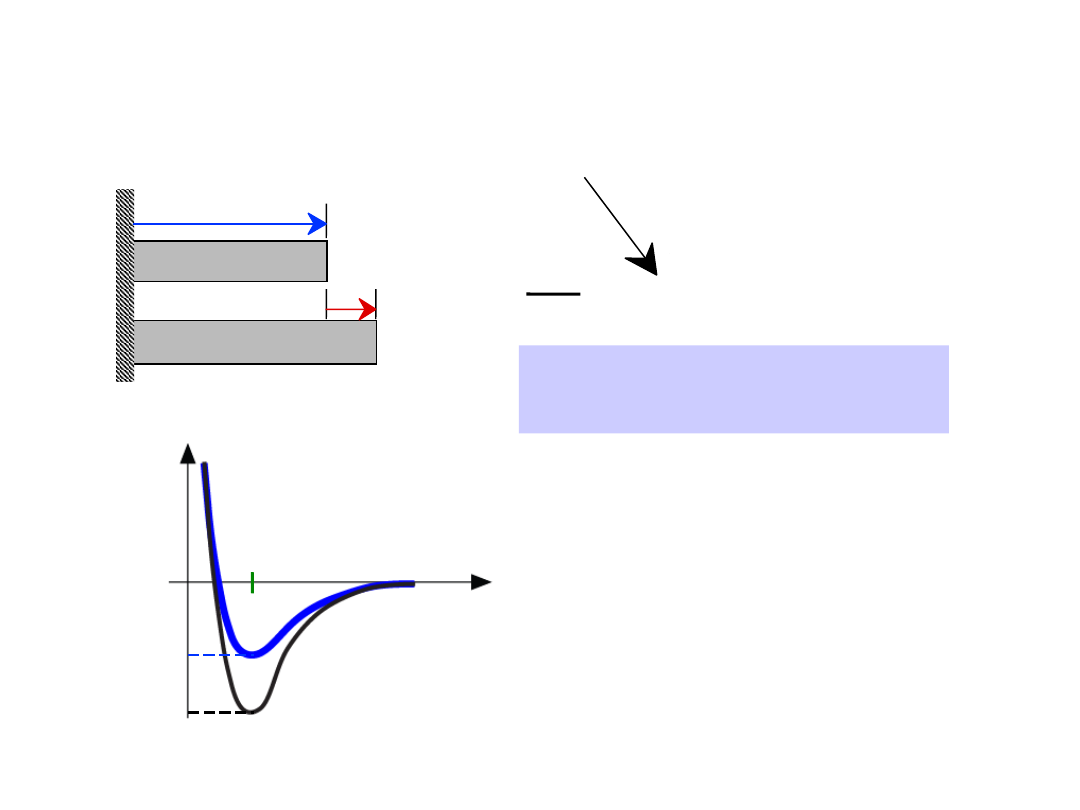
W wiązaniach jonowych siła wzajemnego przyciągania się jonów
przeciwnych jest po prostu rezultatem elektrostatycznego
przyciągania się ładunków przeciwnych znaków, wobec czego może
zostać wyrażona zależnością:
Między energią oddziaływania pomiędzy jonami (E) i siłą
oddziaływania (F) zachodzi związek:
Zależność energii oddziaływań
między atomami od odległości
a dla pozostałych typów
wiązań jest jakościowo
podobna. Duże różnice
występują natomiast w energii
wiązań
23
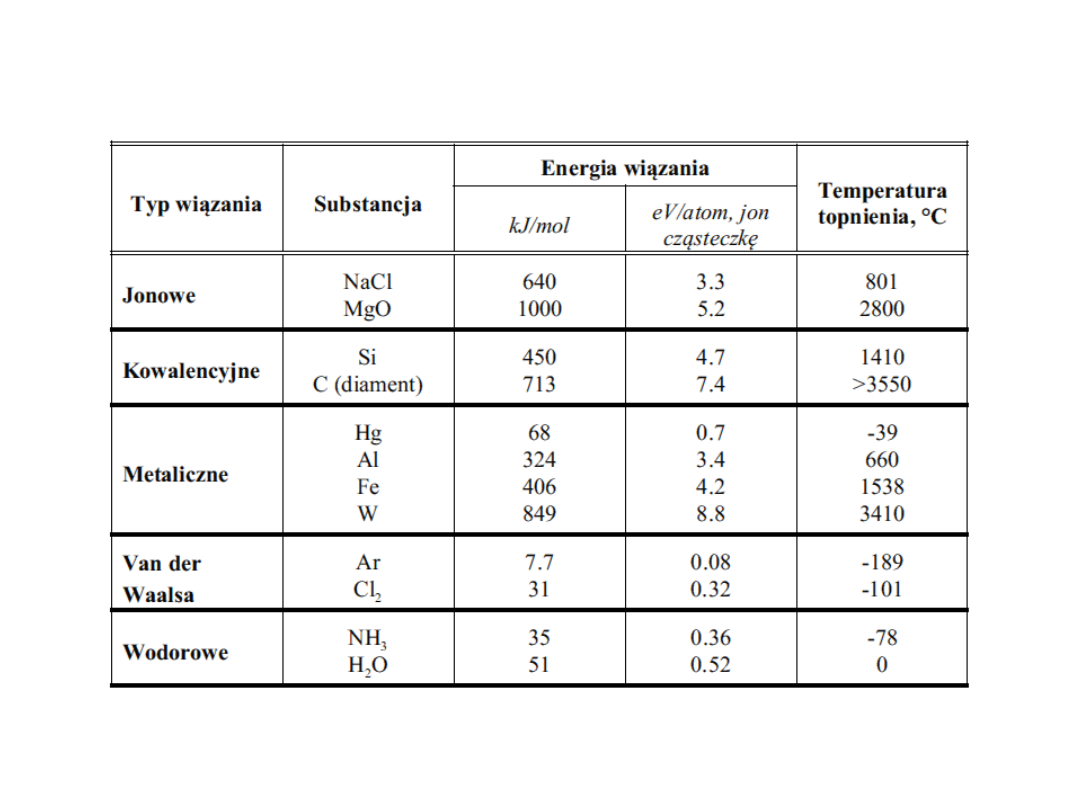
Energie wiązań i temperatury topnienia
dla różnych substancji
24
•
współczynnik rozszerzalności cieplnej
,
mniejsze, gdy E
o
jest
mniejsze
Własności zależne od typu
wiązania:
= (
2
T
)
L
T
-
1
L
o
L
długość,
Lo
Temp. T1
Temp. T2
r
o
r
większe
mniejsze
Energia
odległość
E
o
E
o
Materiały, dla których
energia
wiązania
między atomami jest duża,
charakteryzują się dużą
wytrzymałością i wysoką temperaturą
topnienia. Wiele innych własności
zależy również od kształtu krzywej
siła wiązania - odległość między
atomami lub energia wiązania -
odległość
25
Podsumowanie
Przechodzenie elektronów wartościowości od jednego atomu do
drugiego lub uwspólnianie elektronów przez atomy prowadzi do
utworzenia między atomami mocnych wiązań nazywanych
wiązaniami pierwotnymi (wiązania jonowe, kowalencyjne,
metaliczne).
Znacznie słabsze
wiązania wtórne są
natomiast
rezultatem
przyciągania się
ładunków
dodatnich i
ujemnych
powstałych bez
przechodzenia
elektronów.

26
Ceramiki
(jonowe & kowalencyjneg):
Metale
(metaliczne):
Polimery
(kowalencyjne i wtórne):
Duża energia wiązania
wysoka T
m
duża E
mały wsp.
Zmienna energia wiązania
średnia T
m
średnia E
średni
Własności kierunkowe
Wiązania wtórne dominują
niskal T
m
mała E
duży wsp.
Podsumowanie: Wiązania
pierwotne
Wiązanie w
tórne

27
Typ
Jonowe
Kowalencyjne
Metaliczne
Wtórne
Energia
Duża!
Zmienna
Duża - Diament
mała - Bizmut
Zmienna
duża - Wolfram
mała - Rtęć
najmniejsza
Uwagi
Bezkierunkowe (
ceramiki
)
Kierunkowe
(półprzewodniki,
ceramiki
łańcuchy polimerowe
)
Bezkierunkowe (
metale
)
Kierunkowe
Między łańcuchami (
polimer
)
Pomiędzy cząsteczkami
Podsumowanie
Document Outline
- WIĄZANIA MIĘDZYATOMOWE I WŁASNOŚCI MATERIAŁÓW
- Struktura Atomowa (Chemia)
- f01_02_pg18
- Model falowy
- Struktura Elektronowa
- Stany Energetyczne Elektronów
- Liczba możliwych stanów energetycznych elektronów w powłokach i podpowłokach
- PRZEGLĄD PIERWIASTKÓW
- Elektrony
- Konfiguracje Elektronowe
- Układ okresowy pierwiastków
- Elektroujemność
- Wiązanie jonowe
- Wiązanie jonowe – metal + niemetal
- Slide 15
- Przykłady wiązań jonowych
- Wiązanie kowalencyjne
- Wiązanie metaliczne
- WIĄZANIA WTÓRNE – Van der Waalsa
- Wiązanie wodorowe
- Własności zależne od typu wiązania: Tm
- Energia różnych typów wiązań
- Energie wiązań i temperatury topnienia dla różnych substancji
- Własności zależne od typu wiązania: a
- Podsumowanie
- Podsumowanie: Wiązania pierwotne
- Slide 27
Wyszukiwarka
Podobne podstrony:
Wyklad 4 Wiazania chemiczne w cialach stalych
Wyklad 1 Wiazania
Wyklad wiazania
Wyklad wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wyklad 8 Wiazania chemiczne
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
notatek pl wiazanie peptydowe i jego cechy wyklad
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
wiązania, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
4.Teoria wiązań, AGH różne, chemia wykłady
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
więcej podobnych podstron