
Woda jako środowisko
życia
•
Oddziaływania chemiczne w
roztworach wodnych
•
Mechanizmy regulacji gospodarki
wodnej w komórce i organizmie
•
Dysocjacja wody i równowaga
kwasowo-zasadowa
Dr Mirosława Ferens-Sieczkowska
Katedra Chemii i Immunochemii AM

Część I
Oddziaływania chemiczne
w roztworach wodnych
• Struktura i właściwości cząsteczek wody
• Woda jako rozpuszczalnik
• Słabe oddziaływania chemiczne w
środowisku wodnym
• Hydrofilowość i hydrofobowość związków
chemicznych
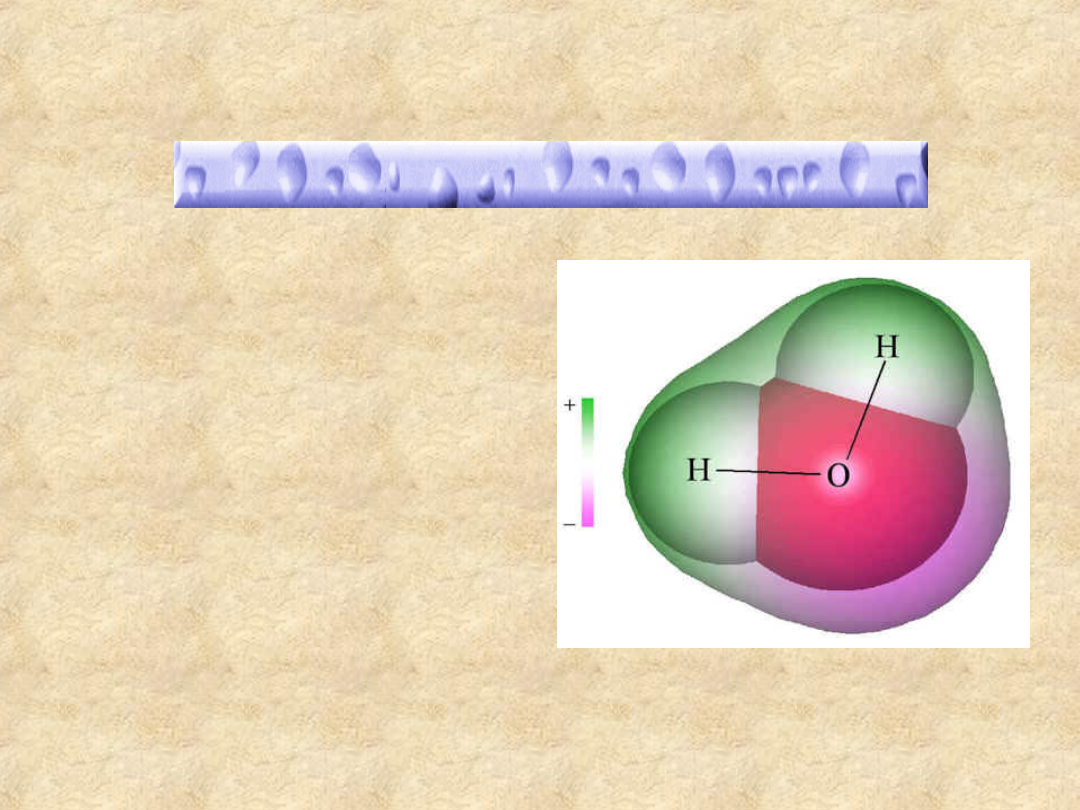
Cząsteczka wody
Przybliżony kształt i rozkład
ładunku w cząsteczce wody
Skład chemiczny komórki
Woda (H
2
O) 70 %
Jony nieorganiczne
(Na, K, Cl, PO4) 1 %
Małe cząsteczki (aminokwasy,
cukry, nukleotydy) 5 %
Makrocząsteczki (białka,
kwasy nukleinowe,
glikokoniugaty) 24 %
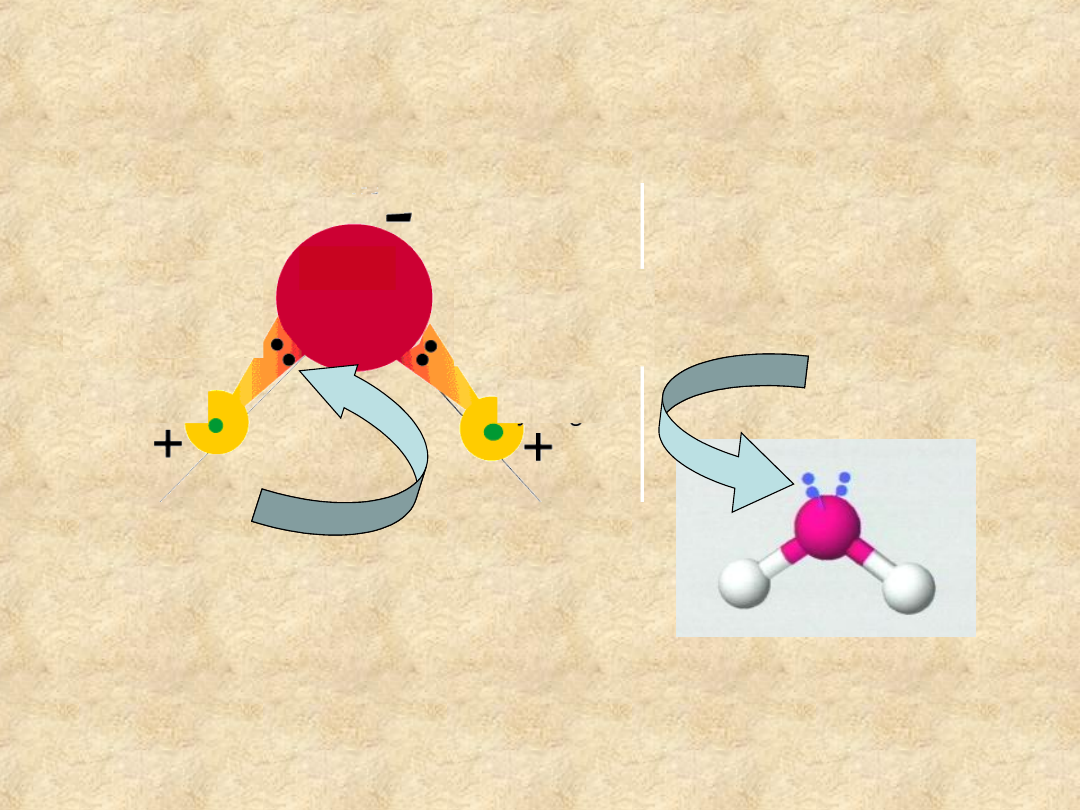
Cząsteczka wody jest
dipolem
Wolne pary
elektronów
atomu tlenu
Para elektronów wiązania
jest przesunięta w stronę
atomu tlenu
wiązanie
kowalencyjne
spolaryzowane
wiązanie
kowalencyjne
spolaryzowane
wodór
wodór
tlen
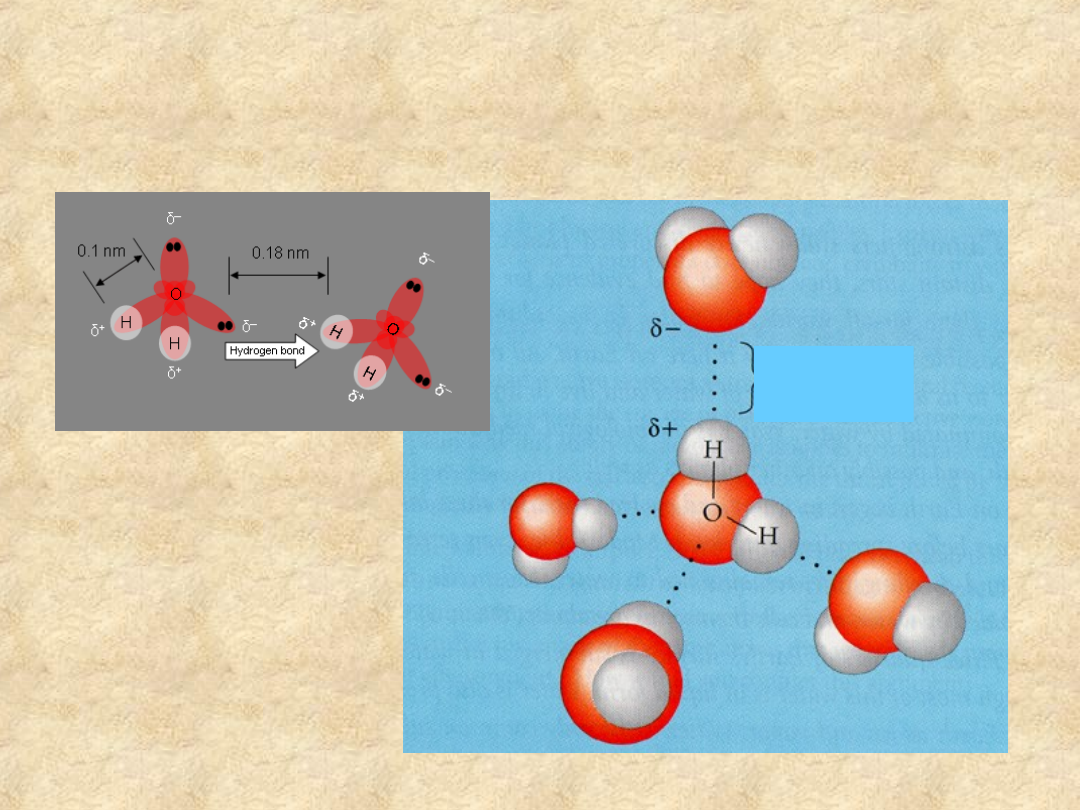
Dipole wody są zdolne do
oddziaływania ze sobą
Wolna para elektronowa tlenu
przyciąga proton o cząstkowym
ładunku dodatnim, jednocześnie
sama przemieszcza się w stronę
przyciąganego protonu.
Powstaje słabe oddziaływanie,
zwane wiązaniem wodorowym
wiązanie
wodorowe
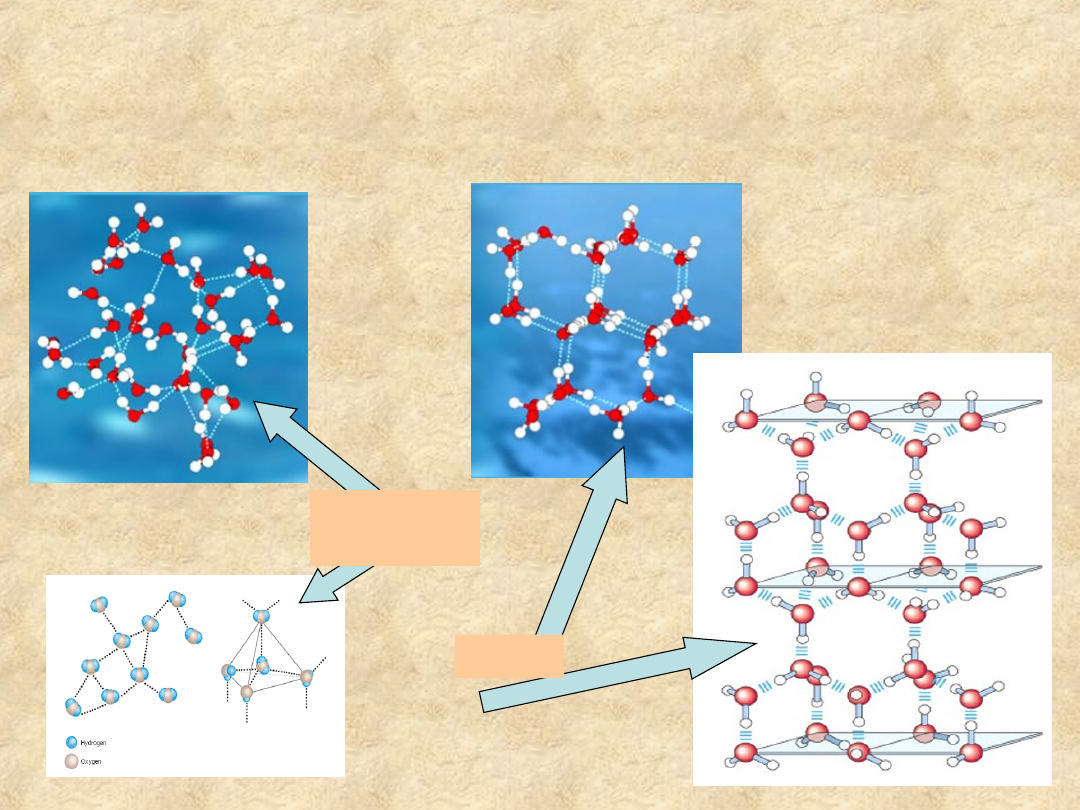
Oddziaływania wodorowe
porządkują strukturę wody
Faza
ciekła
Lód

Związki chemiczne mogą
oddziaływać z wodą w
różny sposób
Hydrofilowy = „lubiący wodę” - łatwo
rozpuszczający się w wodzie
Hydrofobowy = „bojący się wody” – niepolarny,
słabo rozpuszczający się
w wodzie, stroniący od wody
Woda jest rozpuszczalnikiem polarnym !
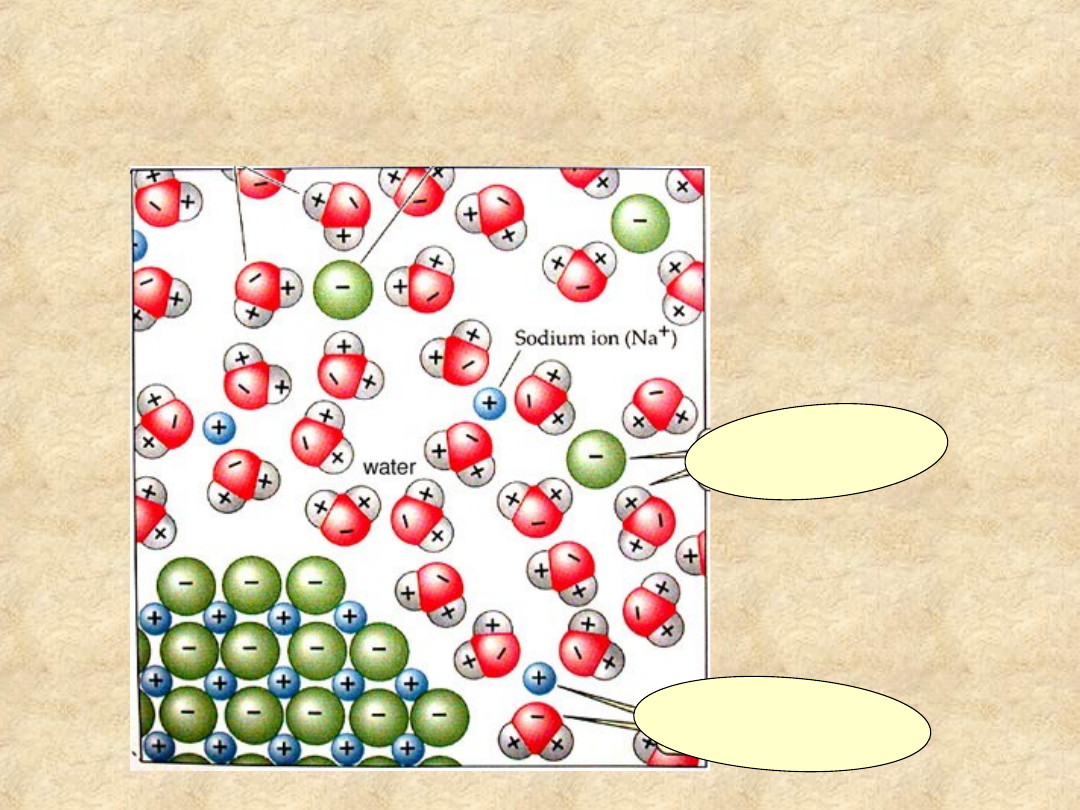
Woda łatwo rozpuszcza
wiele
soli
anion soli ot
oczony
przez cząste
czki wody
kation soli otoczony
przez cząsteczki wody
Dipole wody „wypłukują”
jony soli z kryształu
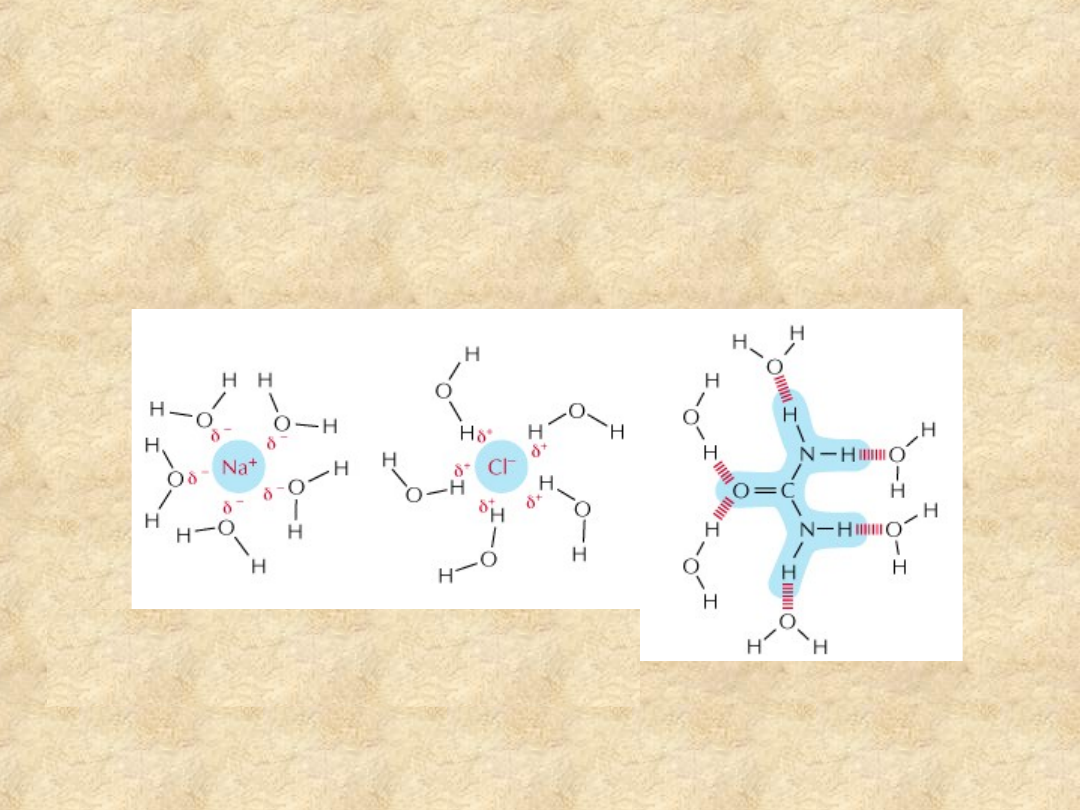
Przykłady ugrupowań i
związków hydrofilowych
• Wszystkie związki o strukturze jonowej lub
wiązaniu kowalencyjnym spolaryzowanym, np.:
sole, kwasy, zasady, alkohole, aminy
Związki jonowe jak NaCl rozpuszczają się,
gdyż cząsteczki wody są przyciągane
przez kationy sodu i aniony chloru
Substancje polarne, jak mocznik,
rozpuszczają się ponieważ ich
cząsteczki tworzą wiązania wodorowe
z otaczającymi cząsteczkami wody
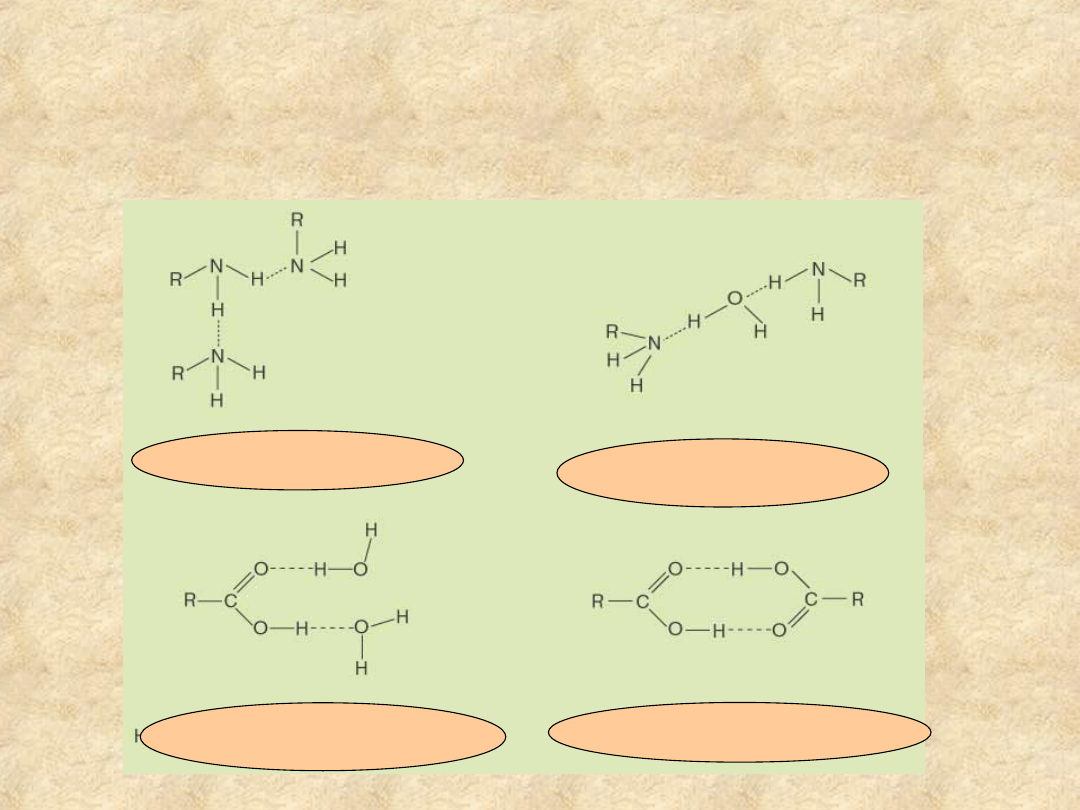
Wiązania wodorowe stabilizują
oddziaływania struktur polarnych w
roztworach wodnych
pomiędzy
cząsteczkami amin
pomiędzy wodą a
cząsteczkami amin
pomiędzy wodą a
cząsteczką kwasu
dimer kwasu na fazie stałej
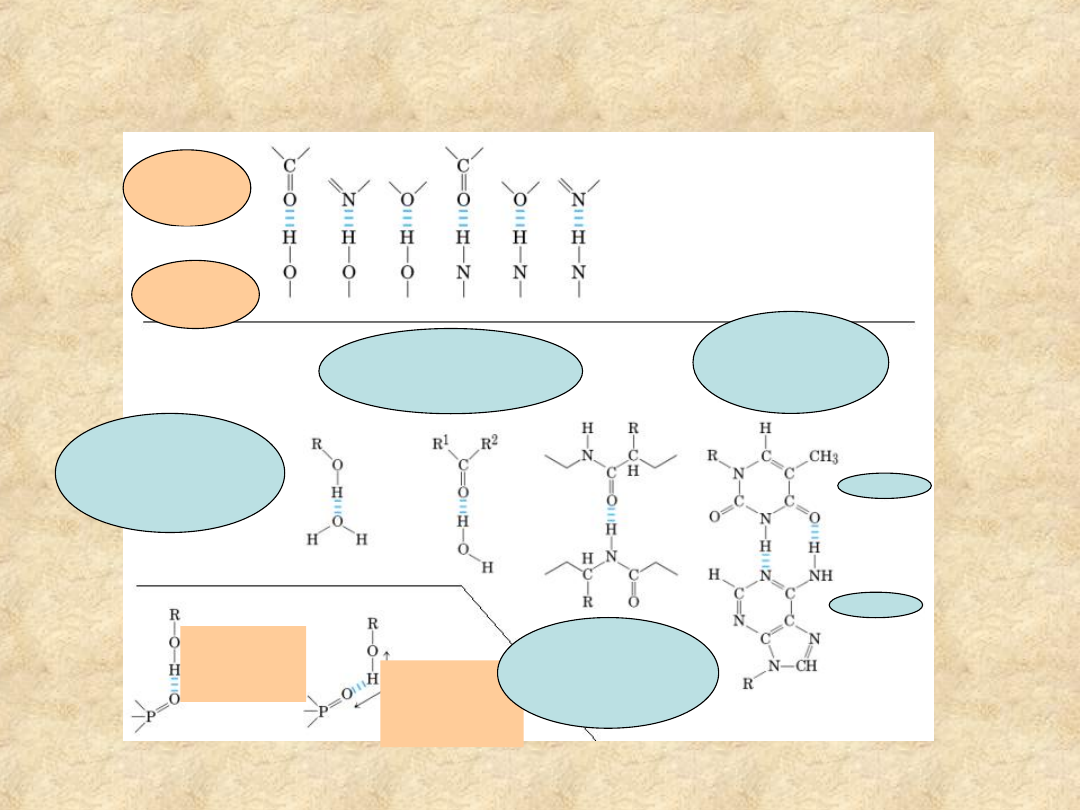
Wiązania wodorowe
tworzą
się…
akceptor
wodoru
donor
wodoru
tymina
adenina
…
pomiędzy
komplementarnymi
zasadami w DNA
…
pomiędzy grupami
hydroksylowymi alkoholu
a wodą
…pomiędzy
karbonylową grupą
ketonu a wodą
Silne
wiązanie
wodorowe
Słabsze
wiązanie
wodorowe
…pomiędzy
atomami ugrupowań
peptydowych
w białkach
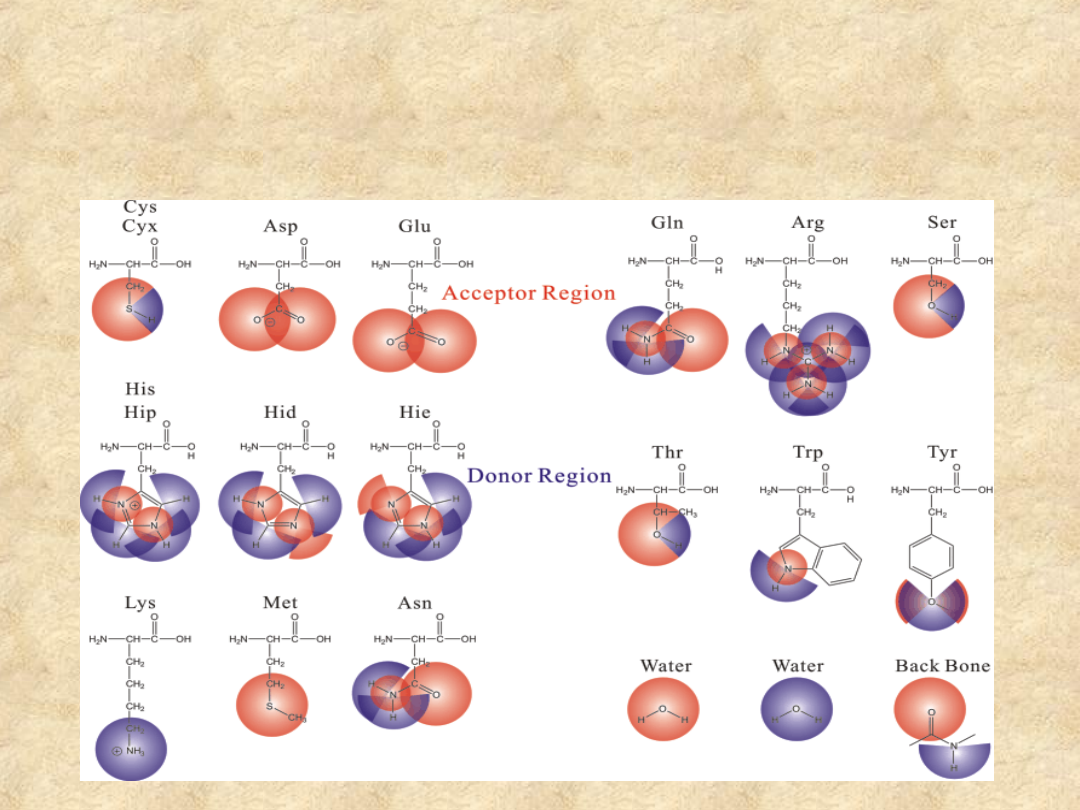
Potencjał tworzenia wiązań
wodorowych w grupach
bocznych aminokwasów
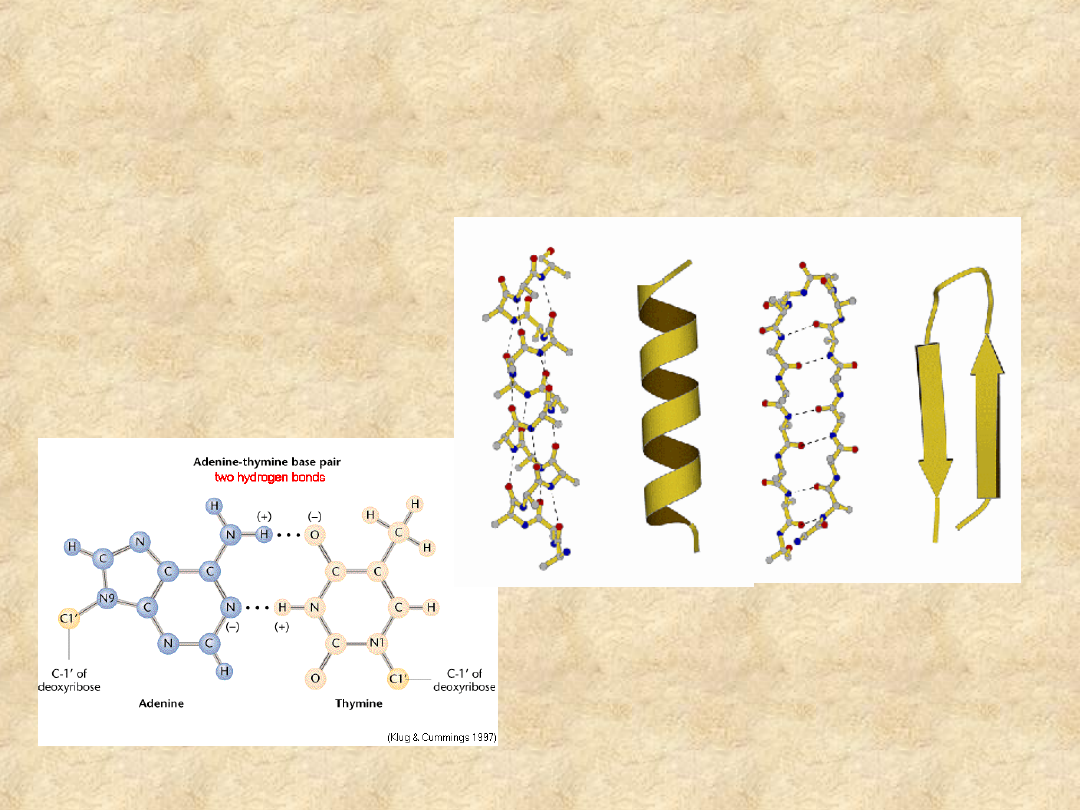
Wiązania wodorowe odgrywają
istotną rolę w stabilizacji
makromolekuł o funkcji
biologicznej
W kwasach nukleinowych…
… i w białkach

Hydratacja umożliwia
rozpuszczanie
makromolekuł
• Białka i inne związki makromolekularne
wymagają specjalnych oddziaływań
stabilizujących ich rozpuszczalność. Dipole
wody, przyciągane przez zewnętrzne polarne
regiony cząsteczki białka tworzą warstwę
hydratacyjną, która uniemożliwia przyciąganie
międzycząsteczkowe i sedymentację
.
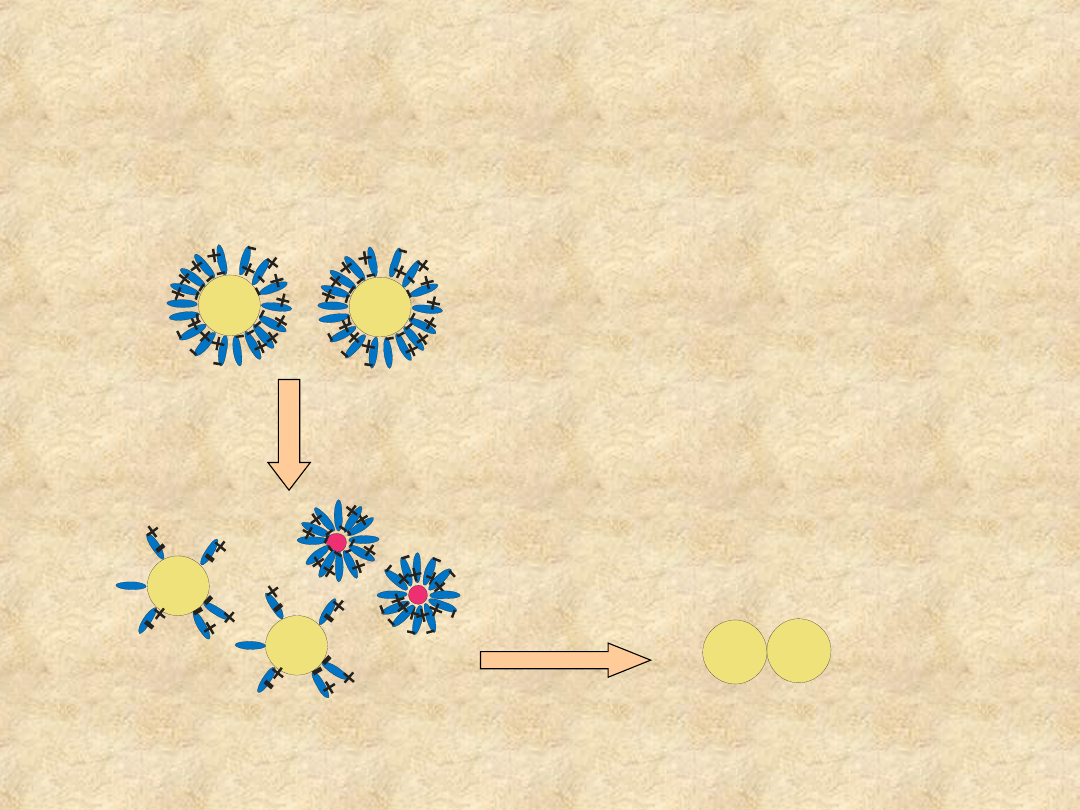
Rozpuszczalność koloidów
białkowych
+
+ +
+
+
-
--
-
+
+
-
+
+
+ +
+
+
-
--
-
+
+
-
+
+
+ +
+
+
-
--
-
+
+
+ +
+
+
-
--
-
+
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
++
+ +
-- -
+ +
+
+
+
--
-
dehydratacja
sedymentacja
Dipole wody mogą oddziaływać z
obdarzonymi ładunkiem grupami
funkcyjnymi na powierzchni cząsteczki
białka, co powoduje otoczenie każdej
cząsteczki warstwą wody hydratacyjnej
(„płaszcz wodny”).
Utrata wody hydratacyjnej zwiększa
oddziaływania różnoimiennych ładunków
na powierzchni białka, prowadząc do
jego agregacji i wytrącenia
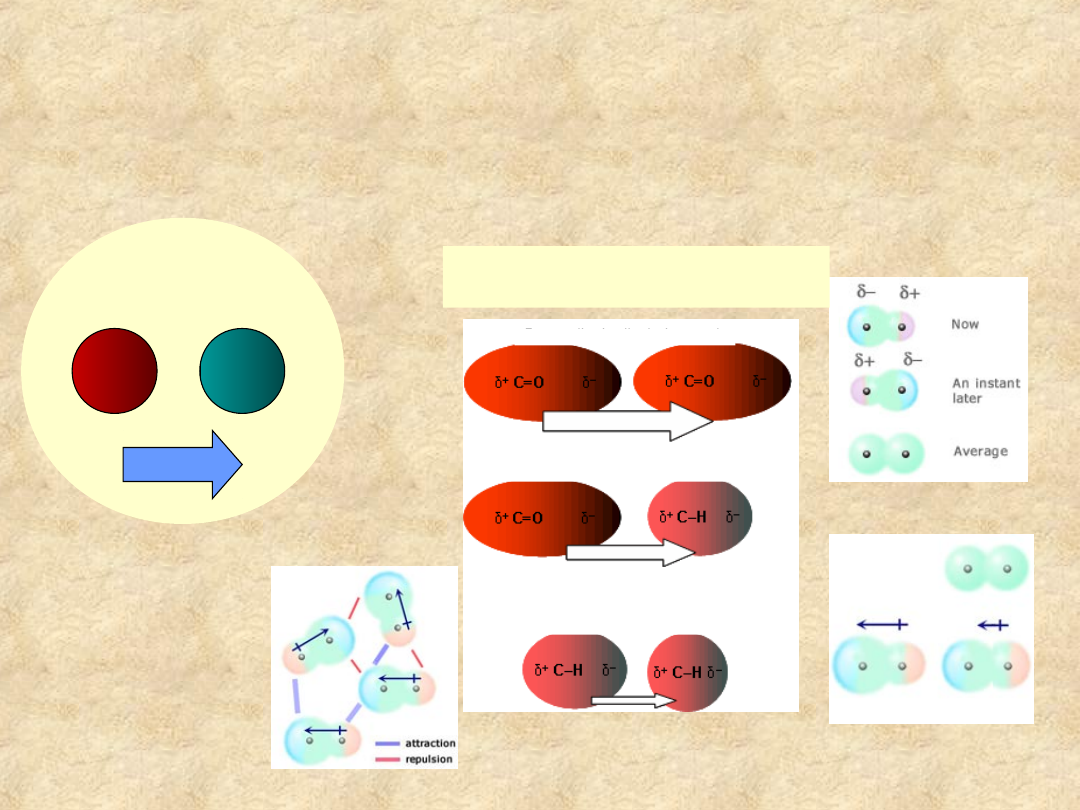
Inne oddziaływania chemiczne
w roztworach wodnych
Van der Waalsa
Jonowe
+
-
dipol - dipol
dipol – dipol indukowany
dyspersyjne
indukcja dipoli
moment dipolowy
aranżacja dipoli w roztworze
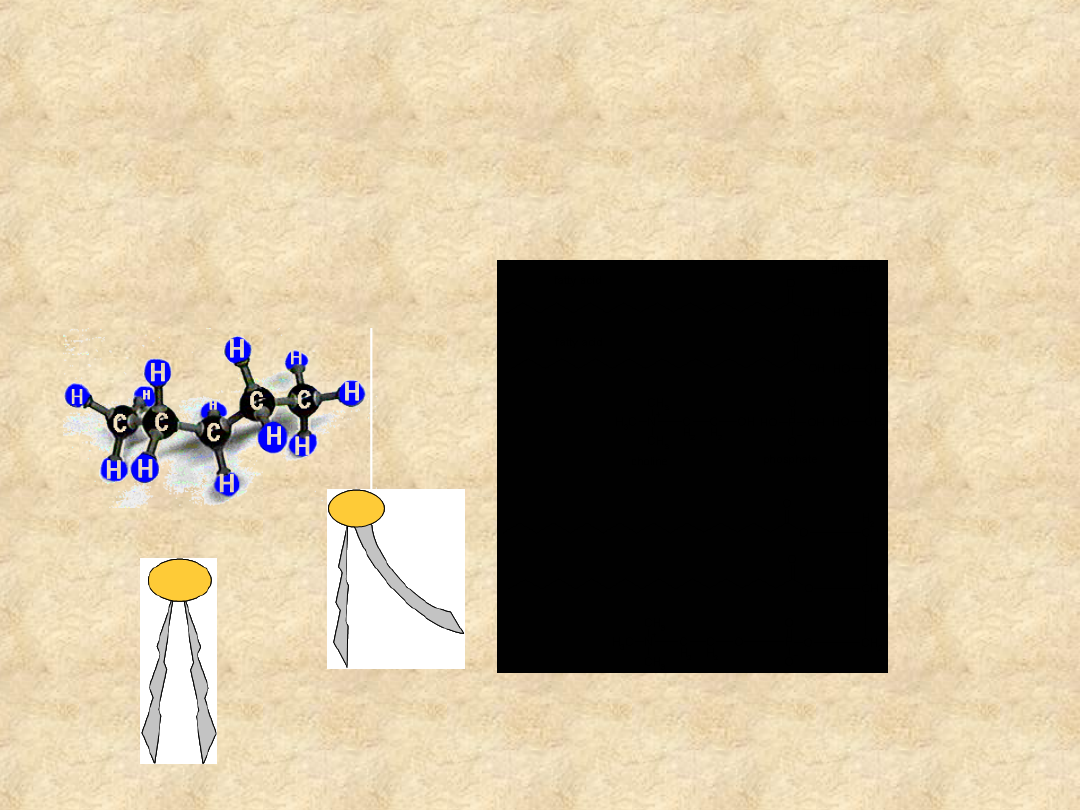
Hydrofobowość
• Jakie struktury chemiczne wykazują
hydrofobowość?
Węglowodory o łańcuchach prostych i rozgałęzionych, związki
aromatyczne o pierścieniach pojedynczych i skondensowanych
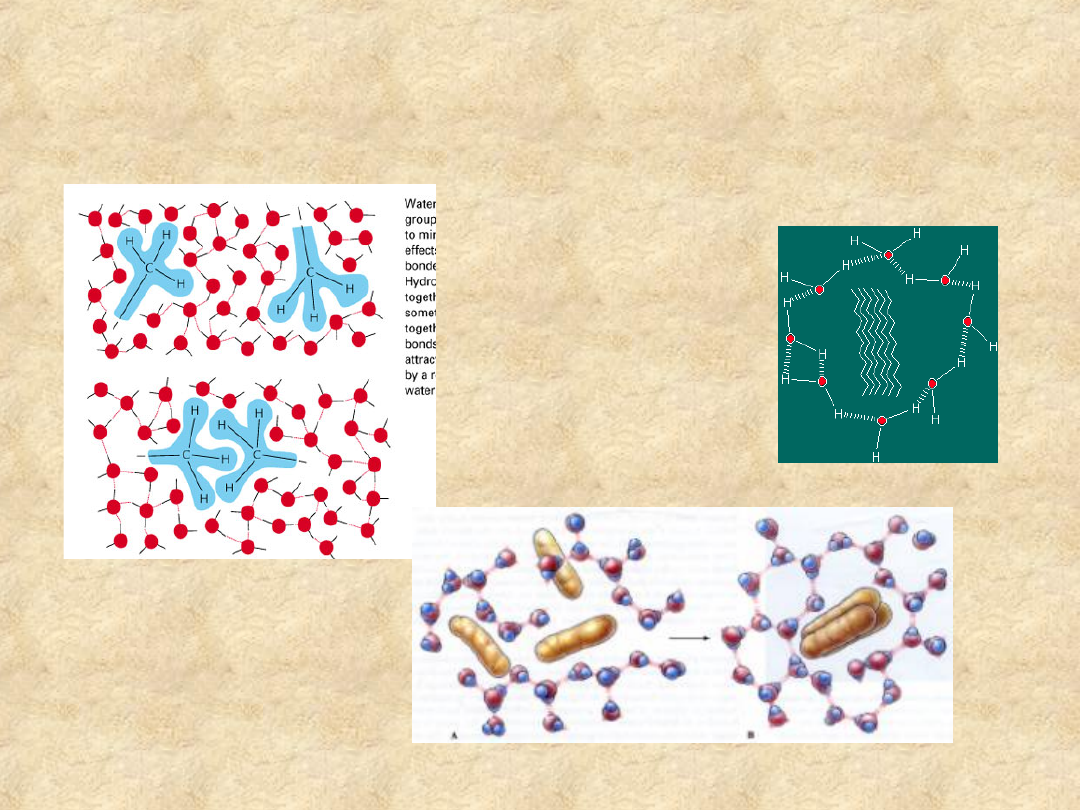
• Jak hydrofobowe struktury
zachowują się w wodzie?
Związki hydrofobowe
skupiają się ograniczając
powierzchnię kontaktu z
wodą
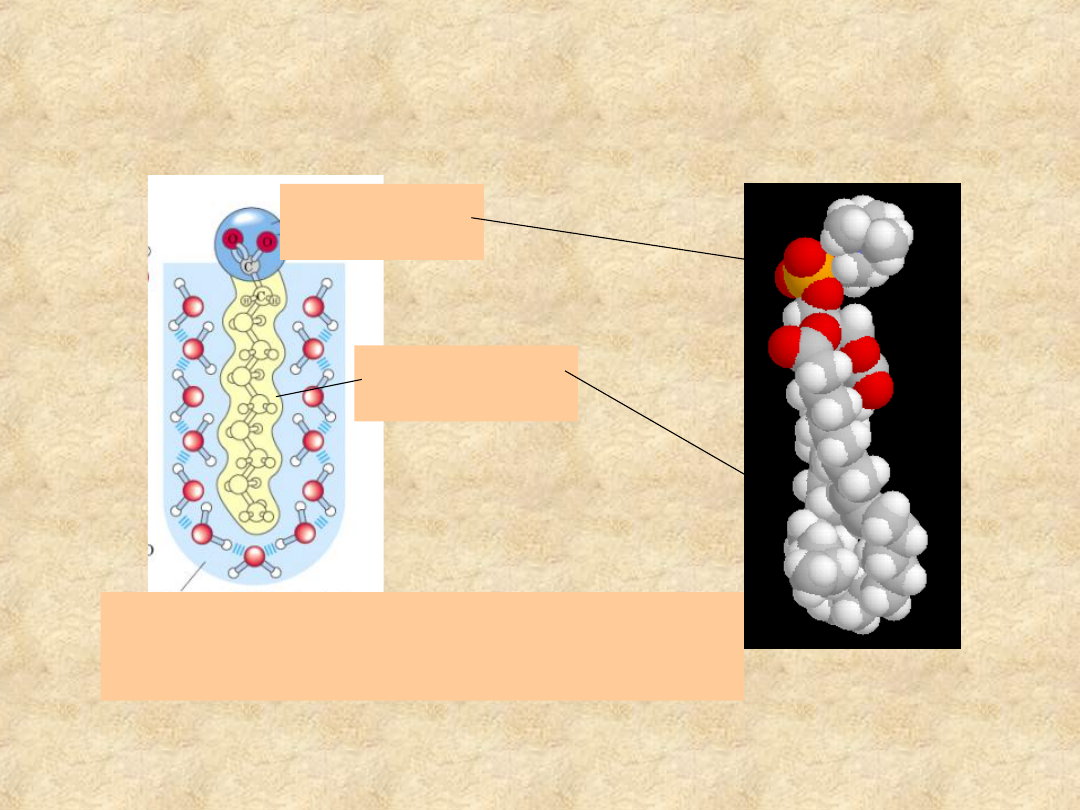
Związki amfipatyczne
Hydrofilowa
„główka”
Hydrofobowy
„ogon”
Wysoko uporządkowane cząsteczki wody
tworzą „klatkę” dokoła hydrofobowego
łańcucha alkilowego
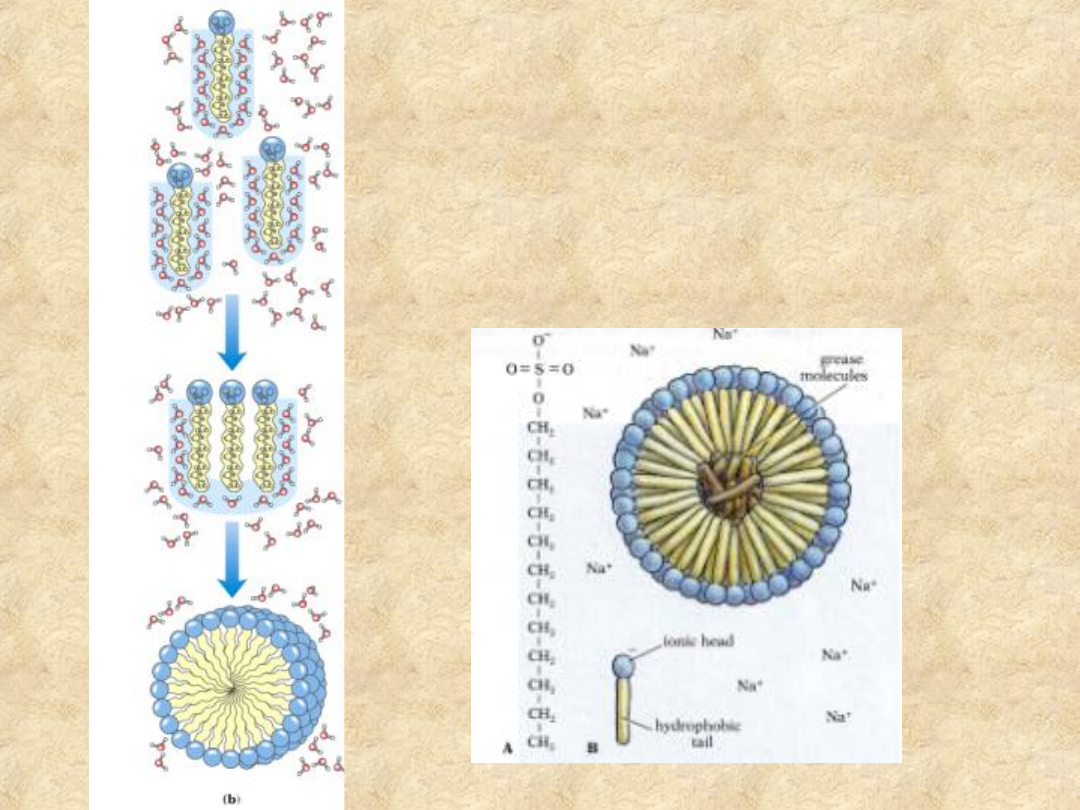
Oddziaływania
na granicy faz
Związki amfipatyczne w żywej materii
rozgraniczają fazę wodną od hydrofobowej
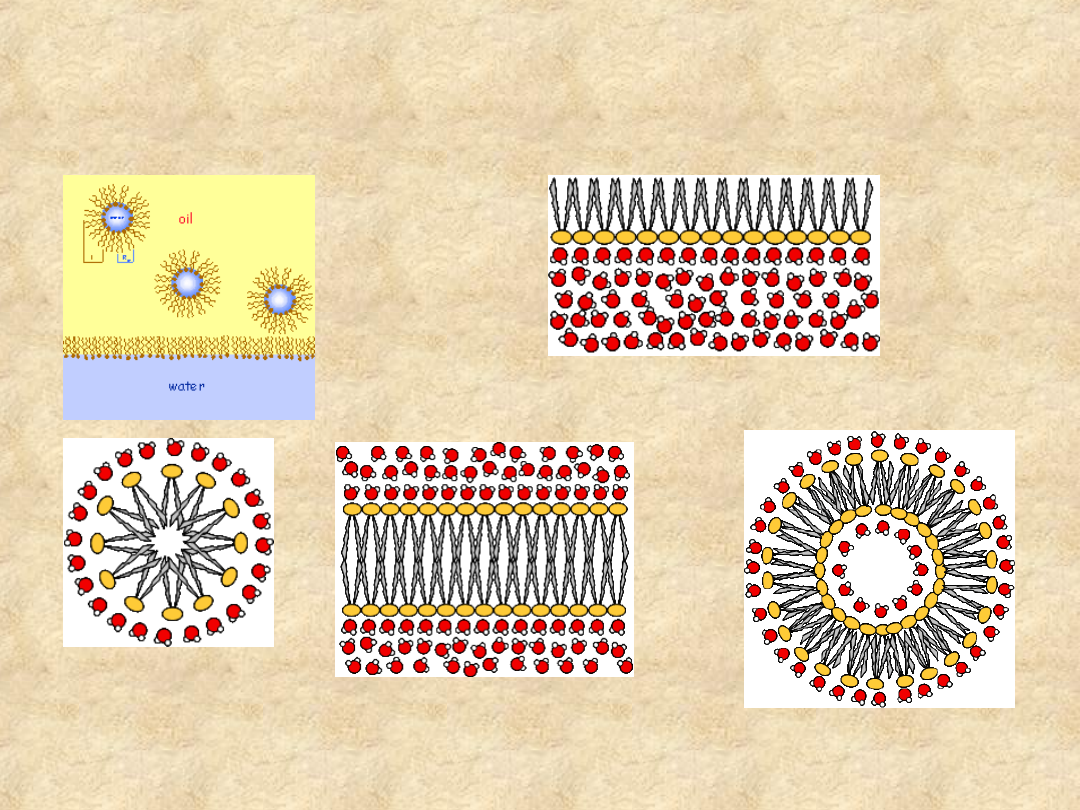
Dwufazowe układy
hydrofilowo - hydrofobowe
emulsja wody w
ciekłym tłuszczu
monowarstwa na granicy faz
micella
dwuwarstwa
dwuwarstwowa struktura
pęcherzykowa (liposom)
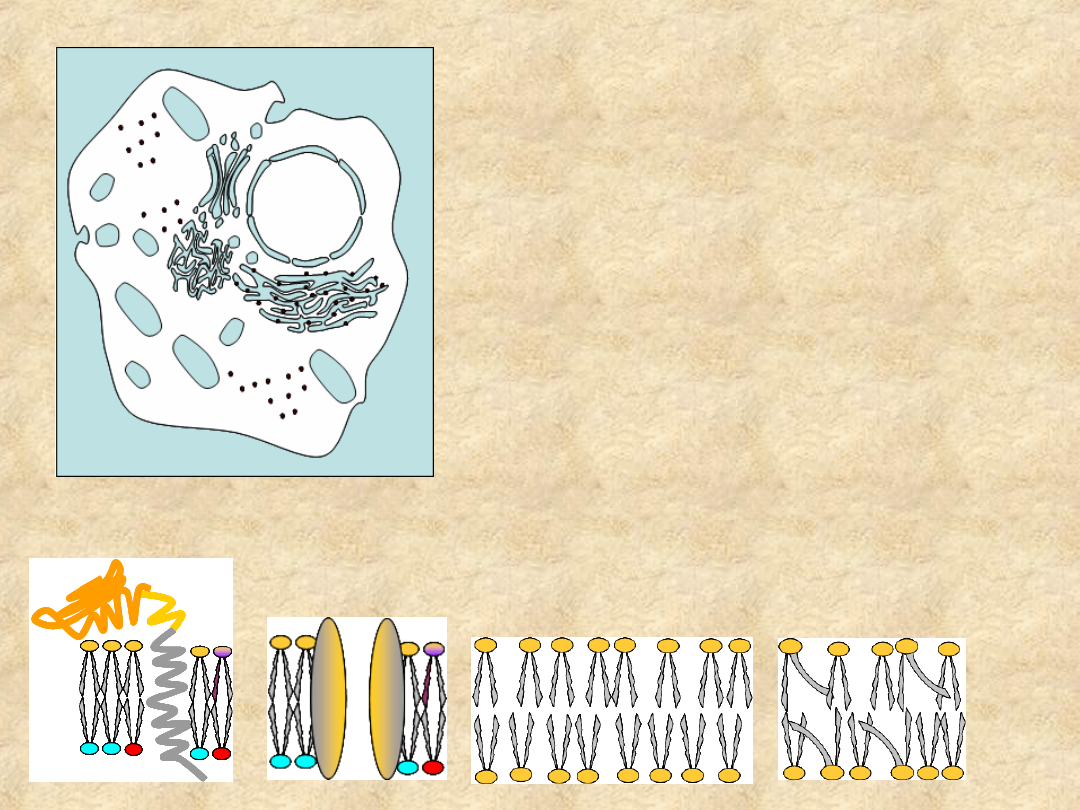
Komórka jest
zbiorem
pęcherzykowatych,
hydrofobowych
struktur
błoniastych,
rozdzielających
wodne koloidy
Struktura membrany warunkuje komunikację pomiędzy
poszczególnymi przedziałami

Część II
Mechanizmy regulacji
gospodarki wodnej w
komórce
• Dyfuzja, osmoza, ciśnienie osmotyczne
• Roztwory koloidowe i równowaga Gibbsa-
Donnana
• Kompartmentacja komórki a równowaga
osmotyczna

Homeostaza
• Celem homeostazy jest utrzymanie stałości
środowiska wewnętrznego ustroju, pomimo stale
zachodzących procesów chemicznych. Nieustannym
korektom służy skomplikowany system regulacji
• Na homeostazę ustroju składają się:
Izojonia
– równowaga składu jonowego płynów
ustroju
Izohydria
– równowaga kwasowo-zasadowa między
dawcami i biorcami protonu
Izotonia
– równowaga stężeń substancji
rozpuszczonych w płynach zewnątrz- i
wewnątrzkomórkowych, warunkująca stałość
ciśnienia osmotycznego
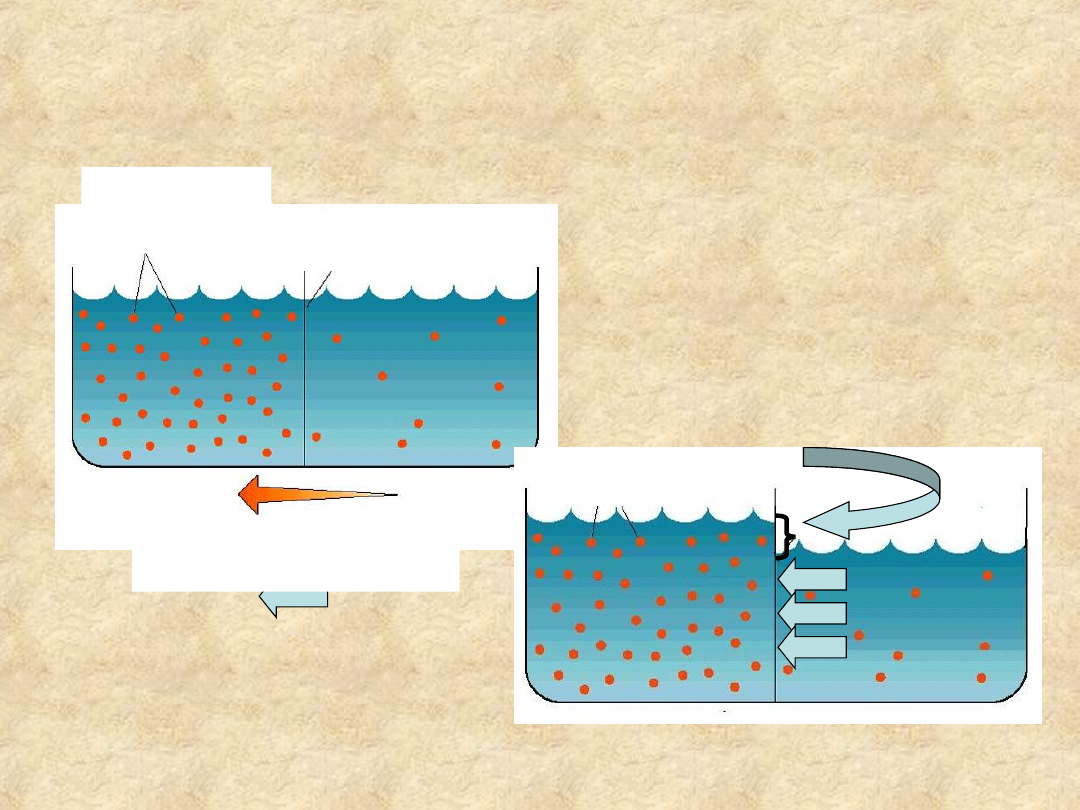
Osmoza: dyfuzja przez
błonę półprzepuszczalną
Gdy błona półprzepuszczalna rozdziela
przedziały o różnym stężeniu cząstek
osmotycznie czynnych, woda dyfunduje
do roztworu hipertonicznego
stan równowagi
ciśnienie hydrostatyczne
ciśnienie
osmotyczne
W stanie równowagi ciśnienie
hydrostatyczne równoważy
ciśnienie osmotyczne
Kierunek przepływu
wody
cząsteczki
związku
rozpuszczonego
membrana
półprzepuszczalna

• Stężenie substancji osmotycznie
czynnej (nie dyfundującej przez
błonę półprzepuszczalną)
determinuje ciśnienie wewnątrz
ograniczonego wodą przedziału,
jego objętość i przepływ wody
pomiędzy przedziałami
H
2
O
Erytrocyt
w roztworze
hipotonicznym
Komórka roślinna w roztworze
hipotoniczny
m
hipertonicznym
Równowaga wodna i osmotyczna
ustroju
• Białka jako wielkocząsteczkowe koloidy nie mogą
przenikać przez błony półprzepuszczalne, ale dzięki
występowaniu w formie anionów (rzadziej kationów)
wpływają na gospodarkę wodną, rozmieszczenie
dyfundujących przez błony elektrolitów oraz odczyn
środowiska
spadek ciśnienia onkotycznego
przestrzeń śródmiąższowa
ściana
naczynia
przepływ
wody
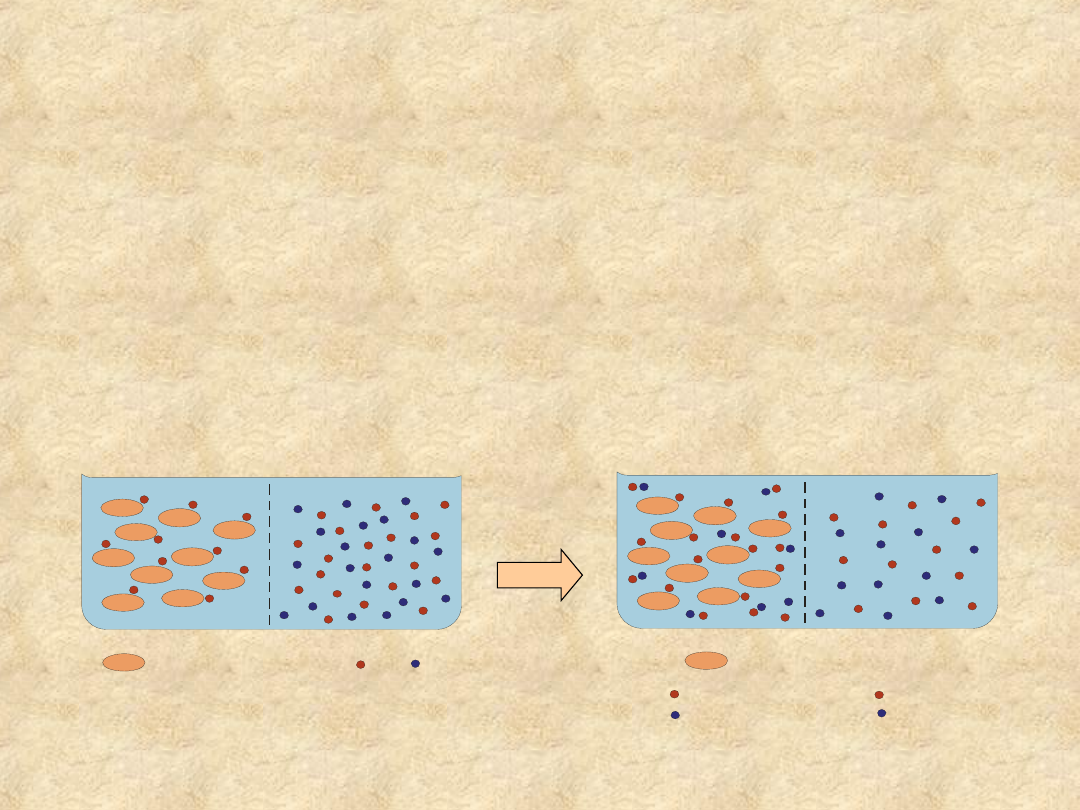
Równowaga Gibbsa-Donnana
• Jeśli w dwóch sąsiadujących przestrzeniach
rozdzielonych błoną półprzepuszczalnąznajdują się
różne stężenia niedyfundujących jonów
koloidalnych, to w stanie równowagi dyfundujące
jony elektrolitu rozmieszczone są nierównomiernie
• Czynnikiem determinującym gradient stężenia
jonów w stanie równowagi jest różnica stężeń białka
_
_
_
_
_
_
_
_
_
_
_
anion białczanowy (10)
Na
+
Cl
-
_
_
_
_
_
_
_
_
_
_
_
anion białczanowy (10)
Na
+
Cl
-
Na
+
Cl
-
18
8
12
12
20 20

Konsekwencje równowagi Gibbsa-
Donnana
• Skład elektrolitowy przestrzeni śródmiąższowej
różni się od składu elektrolitowego osocza;
czynnikiem decydującym jest różna zawartość
białek ocharakterze polianionu
• Stężenie polianionowego białka w krwince
czerwonej jest ~5x większe niż w osoczu, co
prowadzi do podwyższenia stężenia jonów
wodorowych – pH wewnątrz erytrocytu jest niższe
(7.19) niż w osoczu (7.4)
• Leki w formie anionowej będą lepiej wchłaniane z
przewodu pokarmowego, gdyż stężenie
niedyfundujących anionów koloidalnych jest w nim
wyższe niż w osoczu

Elektrolity w płynach ustrojowych
KATIONY
PŁYN POZAKOMÓRKOWY
PŁYN
WEWNĄTRZ-
KOMÓRKOWY
OSOCZE
PŁYN
ŚRÓDMIĄŻSZOW
Y
Na
+
K
+
Ca
2+
Mg
2+
142
5
5
3
145
4
2.5
2
10
150
-
40
Σ [kationy]
155
153.5
200
ANIONY
103
27
3
6
16
114
30
3
5.5
1
0-3
10
150
-
40
Cl
-
HCO
3
-
Fosforany i
siarczany
Aniony
organiczne
Białka
Σ [aniony]
155
153.5
200
Σ [kationy] + Σ
[aniony]
310
307
400

Znaczenie osmozy w
układach koloidowych dla
utrzymania homeostazy
organizmu
• Różnica stężeń białka w osoczu i w płynie
sródmiąższowym determinuje przepływ wody
między krwią a tkankami, a hipoalbuminemia osocza
może powodować obrzęki
• Mechanizmy równowagi Gibbsa-Donnana
umożliwiają tworzenie gradientów jonów i pH na
membranach śródkomórkowych

Część III
Dysocjacja wody i
równowaga kwasowo-
zasadowa

Dysocjacja wody, stężenie
jonów wodorowych i
współczynnik pH
HCl + H
2
O ---> H
3
O
+
+ Cl
-
pH
NH
3
+ H
2
O ---> NH
4
+
+ OH
-
pH
H
2
O + H
2
O H
3
O
+
+ OH
-
Z prawa działania mas:
[H
3
O+] [OH-] = K
dys
[H
2
O]
2
= 10
-14
[H
+
] = 10
-14
/[OH
-
]
- log [H
+
] = pH
pH + pOH = 14
w czystej wodzie
pH = pOH = 7

Równowaga kwasowo –
zasadowa w organizmie
• Prawidłowe funkcjonowanie żywego organizmu jest
możliwe w wąskim zakresie stężenia jonów wodorowych
• Zmiana pH większa niż 0,1 jednostki Soerensena może
być niebezpieczna dla organizmu
• Organizm dysponuje wielorakimi mechanizmami
utrzymania stężenia jonów wodorowych na stałym
poziomie (buforowania)
• Mechanizmy fizykochemiczne stanowią określone
układy buforowe, mechanizmy narządowe – czynność
płuc i nerek
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Woda jako środowisko życia
kubica, biologia z elementami mikrobiologii, Woda jako środowisko życia
Ewa Wysocka Katarzyna Tomiczek Szkola jako srodowisko zycia i codziennosc ucznia analiza teoretyczna
Temat – Gleba jako środowisko życia roślin
Gleba jako środowisko życia roślin
Miasto jako specyficzne srodowisko zycia roslinnego Wysocki
WODA JAKO ZANIECZYSZCZONE ŹRÓDŁO ŻYCIA Monika Klatka gr 6b
Grupa rówieśnicza jako środowisko wychowawcze ptt(1)
Najpierw przeczytaj FAQ Internetowe grupy dyskusyjne jako środowisko interakcyjne
DOM DZIECKA JAKO ŚRODOWISKO WYCHOWAWCZE, PSYCHOLOGIA, adopcja, dom dziecka, rodzina zastępcza, opiek
10. DOM DZIECKA JAKO ŚRODOWISKO WYCHOWAWCZE, Pytania do licencjata kolegium nauczycielskie w Bytomiu
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
Ćwiczenia infobrokerskie 1, Studia INiB, Internet jako środowisko informacyjne
klasa szkolna jako środowisko wychowawcze, metodyka, psych- ped
Dobra osobiste człowieka jako fundament życia społecznego
Nowe media jako środowisko wychowawcze (Pedagogika społeczna), Pedagogika, Studia stacjonarne I sto
Środowisko życia człowieka stanowi od?wna przedmiot zainteresowań zarówno filozofii
Woda utleniona,żródłem życia
Rodzina jako środowisko wychowawcze
więcej podobnych podstron