
WYKŁAD 10
1
PODSTAWY CHEMII
PODSTAWY CHEMII
ORBITALE ATOMOWE
ORBITALE ATOMOWE
WYKŁAD 10
2
PODSTAWY CHEMII
PODSTAWY CHEMII
część radialna
część radialna
część kątowa
część kątowa
)
,
(
)
(
,
,
m
l
l
n
m
l,
n,
Y
r
R
Ψ
WYKŁAD 10
3
PODSTAWY CHEMII
PODSTAWY CHEMII
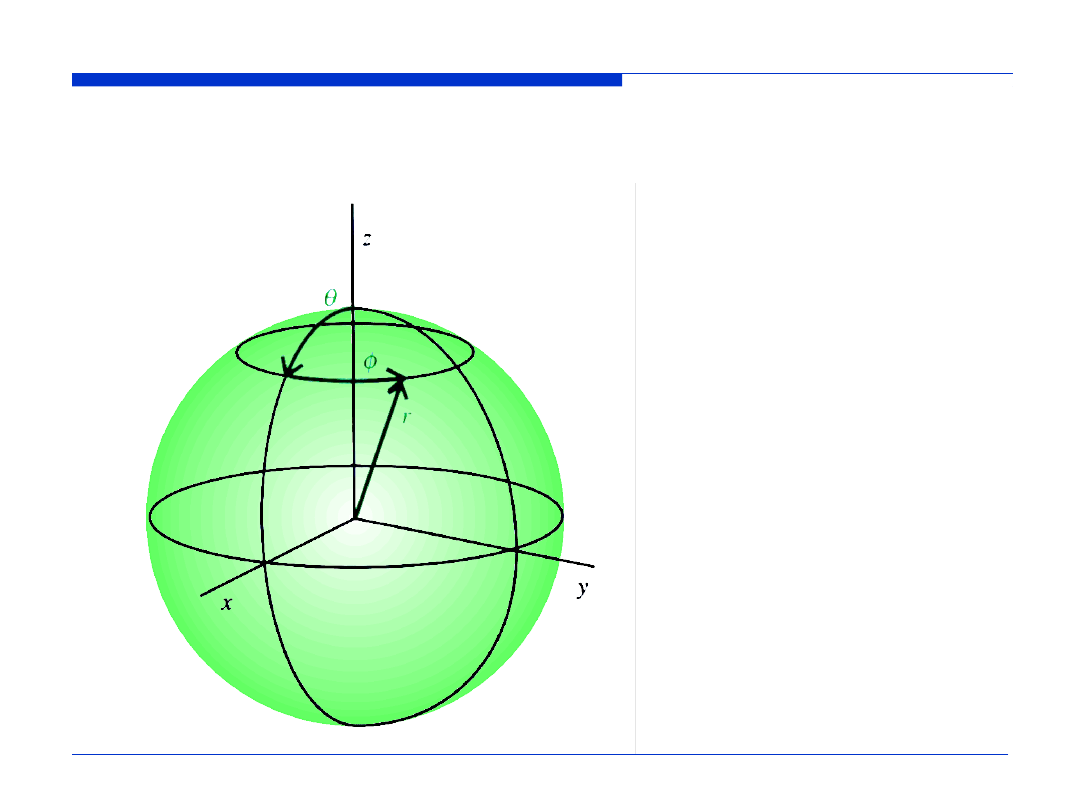
WSPÓŁRZĘDNE SFERYCZNE
WSPÓŁRZĘDNE SFERYCZNE
r
r
φ
φ
θ
θ
cos
sin
r
x
sin
sin
r
y
cos
r
z

WYKŁAD 10
4
PODSTAWY CHEMII
PODSTAWY CHEMII
ORBITALE ATOMOWE WODORU (1)
ORBITALE ATOMOWE WODORU (1)
n
n
l
l
m
m
symb
symb
ol
ol
funkc
funkc
ja
ja

WYKŁAD 10
5
PODSTAWY CHEMII
PODSTAWY CHEMII
ORBITALE ATOMOWE WODORU (2)
ORBITALE ATOMOWE WODORU (2)
n
n
l
l
m
m
symb
symb
ol
ol
funkc
funkc
ja
ja
WYKŁAD 10
6
PODSTAWY CHEMII
PODSTAWY CHEMII
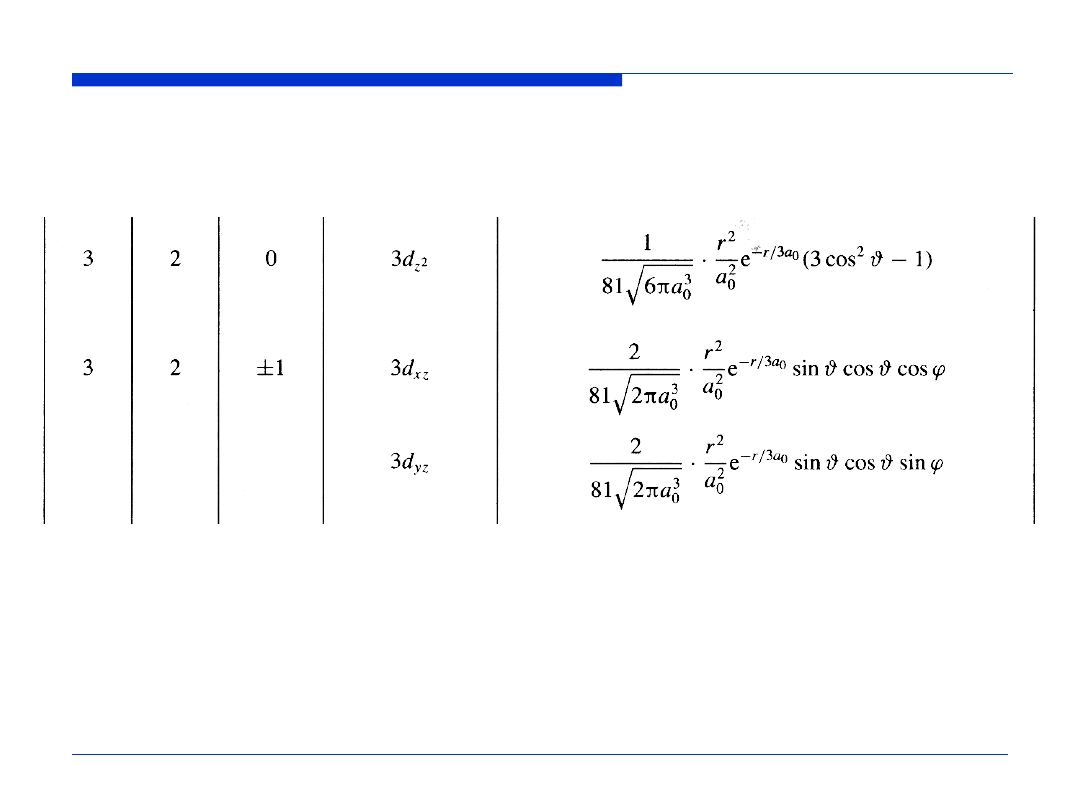
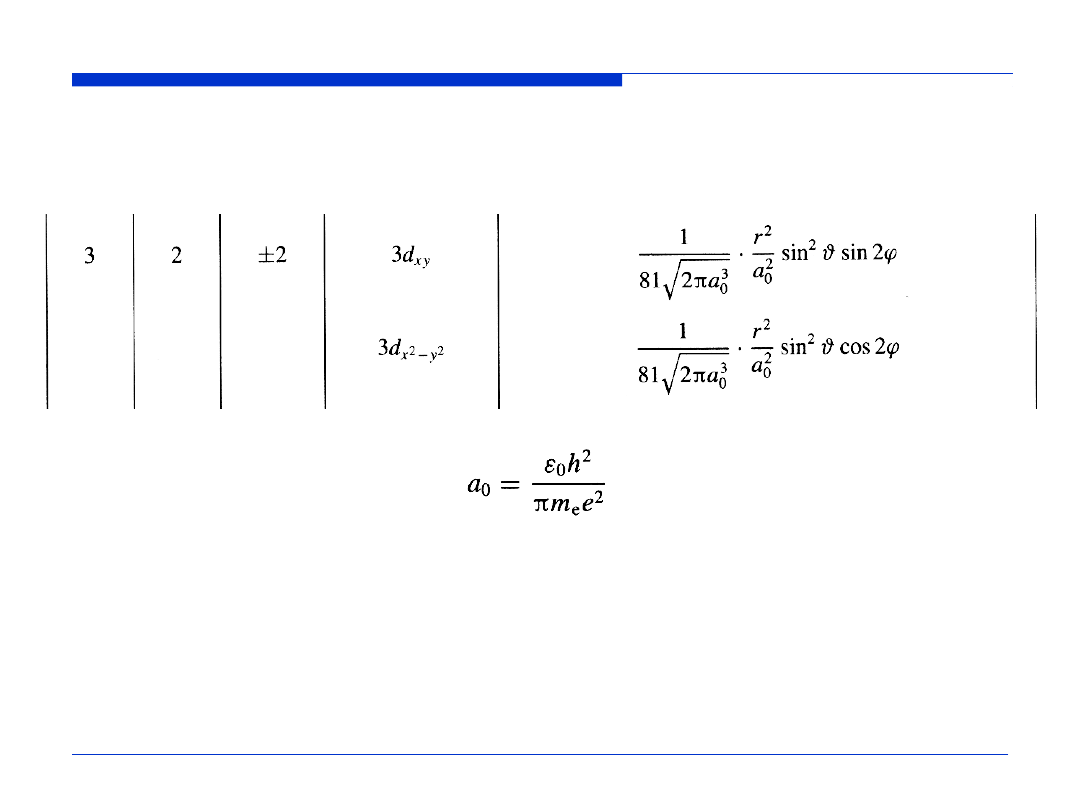
ORBITALE ATOMOWE WODORU (3)
ORBITALE ATOMOWE WODORU (3)
n
n
l
l
m
m
symb
symb
ol
ol
funkc
funkc
ja
ja
WYKŁAD 10
7
PODSTAWY CHEMII
PODSTAWY CHEMII
ORBITALE ATOMOWE WODORU (4)
ORBITALE ATOMOWE WODORU (4)
n
n
l
l
m
m
symb
symb
ol
ol
funkc
funkc
ja
ja
WYKŁAD 10
8
PODSTAWY CHEMII
PODSTAWY CHEMII
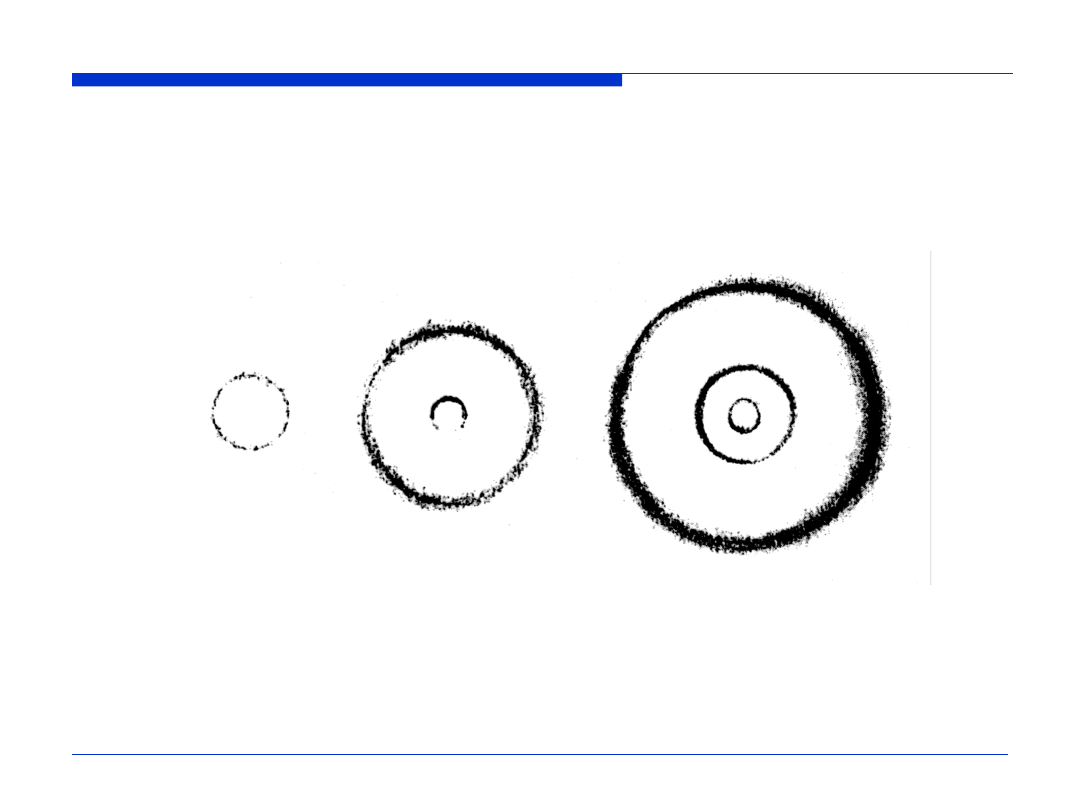
Rozkład gęstości prawdopodobieństwa napotkania elektronu
Rozkład gęstości prawdopodobieństwa napotkania elektronu
dla orbitali 1s, 2s i 3s (płaszczyzna
dla orbitali 1s, 2s i 3s (płaszczyzna
xz
xz
)
)
1s
1s
2s
2s
3s
3s
WYKŁAD 10
9
PODSTAWY CHEMII
PODSTAWY CHEMII
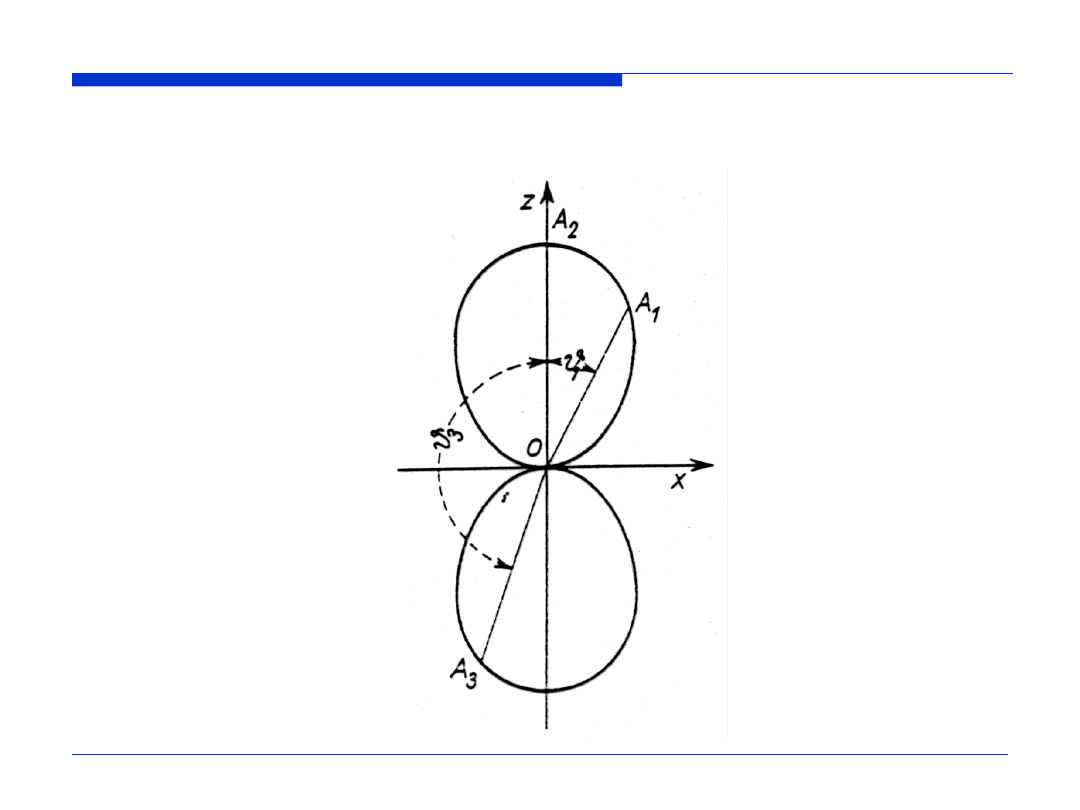
Wykres funkcji |Y(
Wykres funkcji |Y(
θ
θ
,
,
φ
φ
)|
)|
2
2
dla orbitalu p
dla orbitalu p
z
z
(płaszczyzna
(płaszczyzna
xz
xz
)
)

WYKŁAD 10
10
PODSTAWY CHEMII
PODSTAWY CHEMII
Rozkłady gęstości prawdopodobieństwa napotkania elektronu
Rozkłady gęstości prawdopodobieństwa napotkania elektronu
dla orbitali 2p
dla orbitali 2p
z
z
i 3p
i 3p
z
z
(płaszczyzna
(płaszczyzna
xz
xz
)
)
2p
2p
z
z
3p
3p
z
z
Prawdopodobieństwo napotkania elektronu w jej wnętrzu wynosiło np. 0.9, a
Prawdopodobieństwo napotkania elektronu w jej wnętrzu wynosiło np. 0.9, a
więc by prawdopodobieństwo napotkania go na zewnątrz bryły wynosiło 0.1.
więc by prawdopodobieństwo napotkania go na zewnątrz bryły wynosiło 0.1.
WYKŁAD 10
11
PODSTAWY CHEMII
PODSTAWY CHEMII
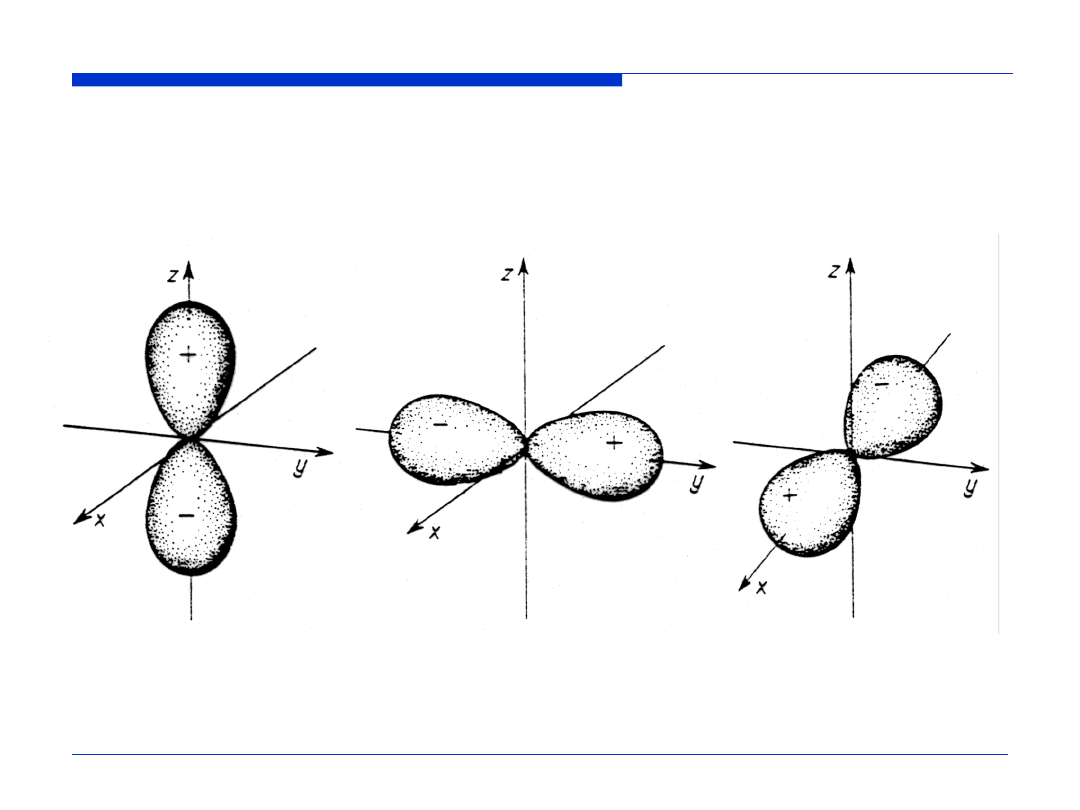
Wykresy funkcji |Y(
Wykresy funkcji |Y(
θ
θ
,
,
φ
φ
)|
)|
2
2
dla orbitali p
dla orbitali p
p
p
z
z
p
p
y
y
p
p
x
x
WYKŁAD 10
12
PODSTAWY CHEMII
PODSTAWY CHEMII
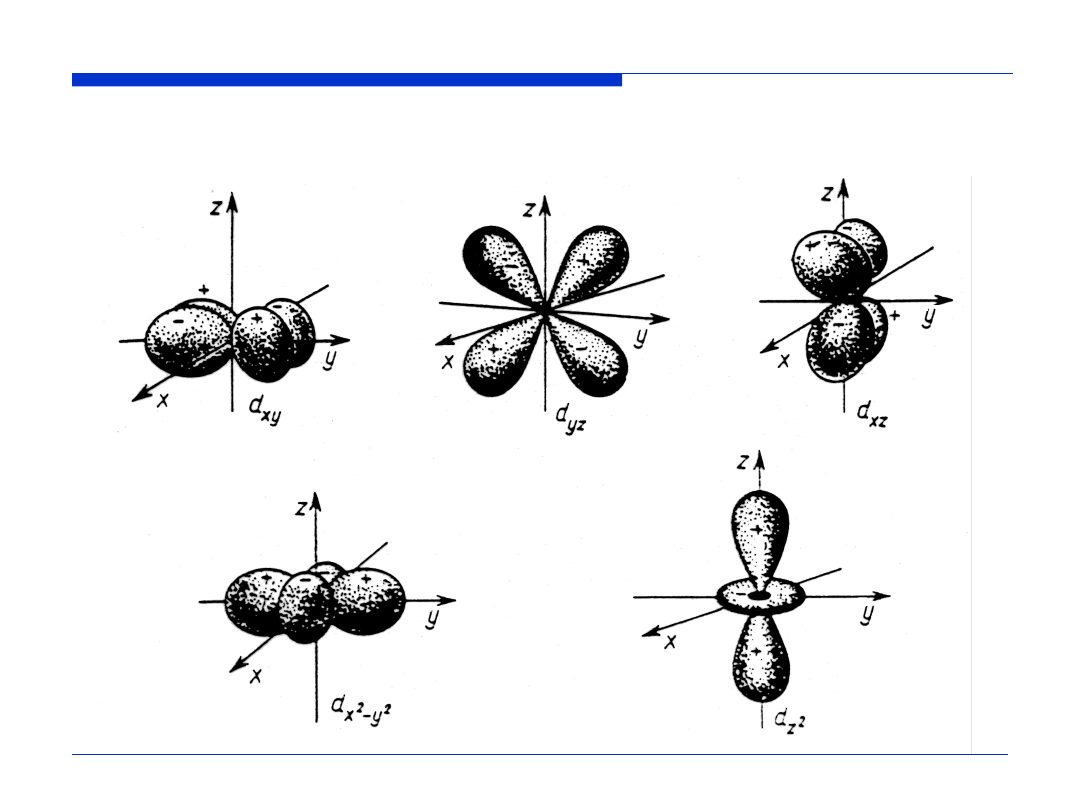
Wykresy funkcji |Y(
Wykresy funkcji |Y(
θ
θ
,
,
φ
φ
)|
)|
2
2
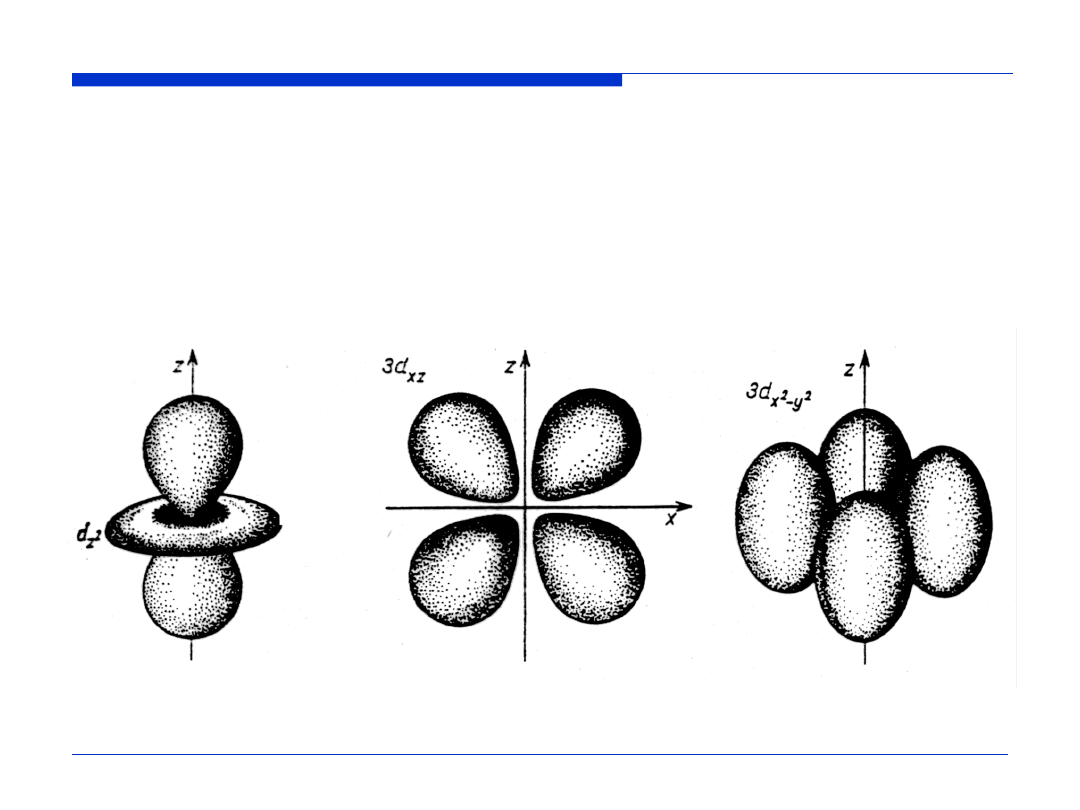
dla orbitali d
dla orbitali d
WYKŁAD 10
13
PODSTAWY CHEMII
PODSTAWY CHEMII
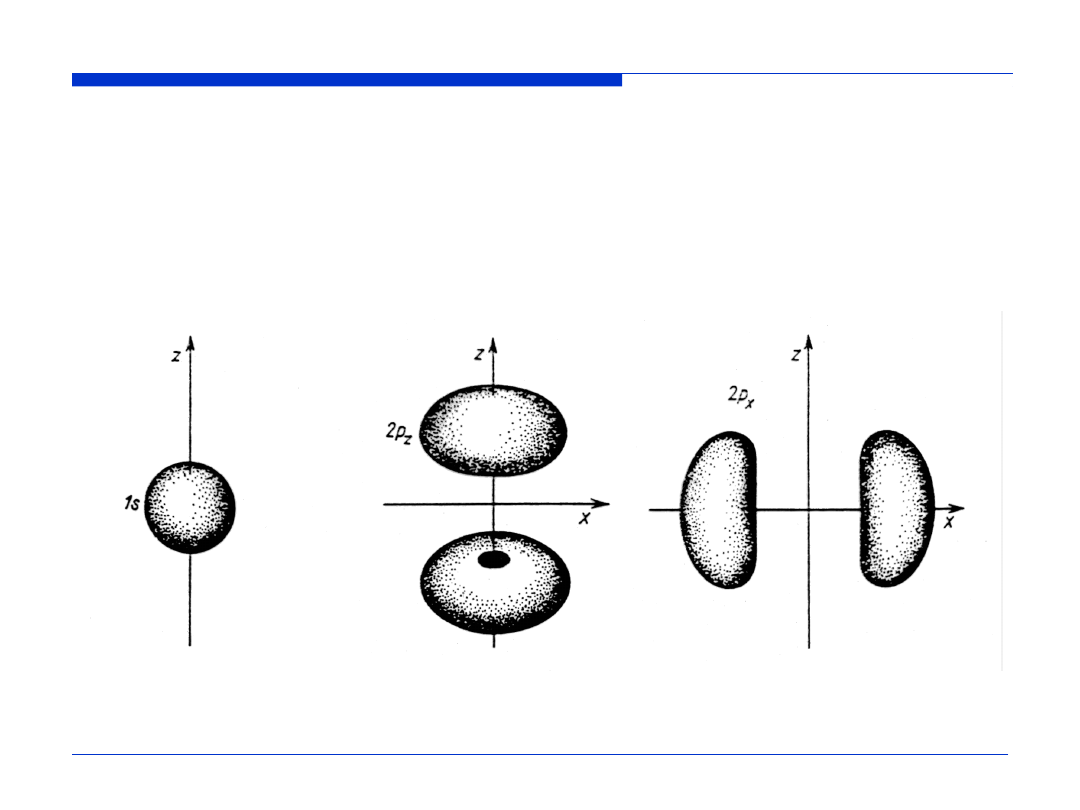
Kontury orbitali atomowych wodoru (1)
Kontury orbitali atomowych wodoru (1)
Kształt brył ograniczających przestrzeń, wewnątrz której można napotkać
Kształt brył ograniczających przestrzeń, wewnątrz której można napotkać
elektron z prawdopodobieństwem równym 0.9
elektron z prawdopodobieństwem równym 0.9
WYKŁAD 10
14
PODSTAWY CHEMII
PODSTAWY CHEMII
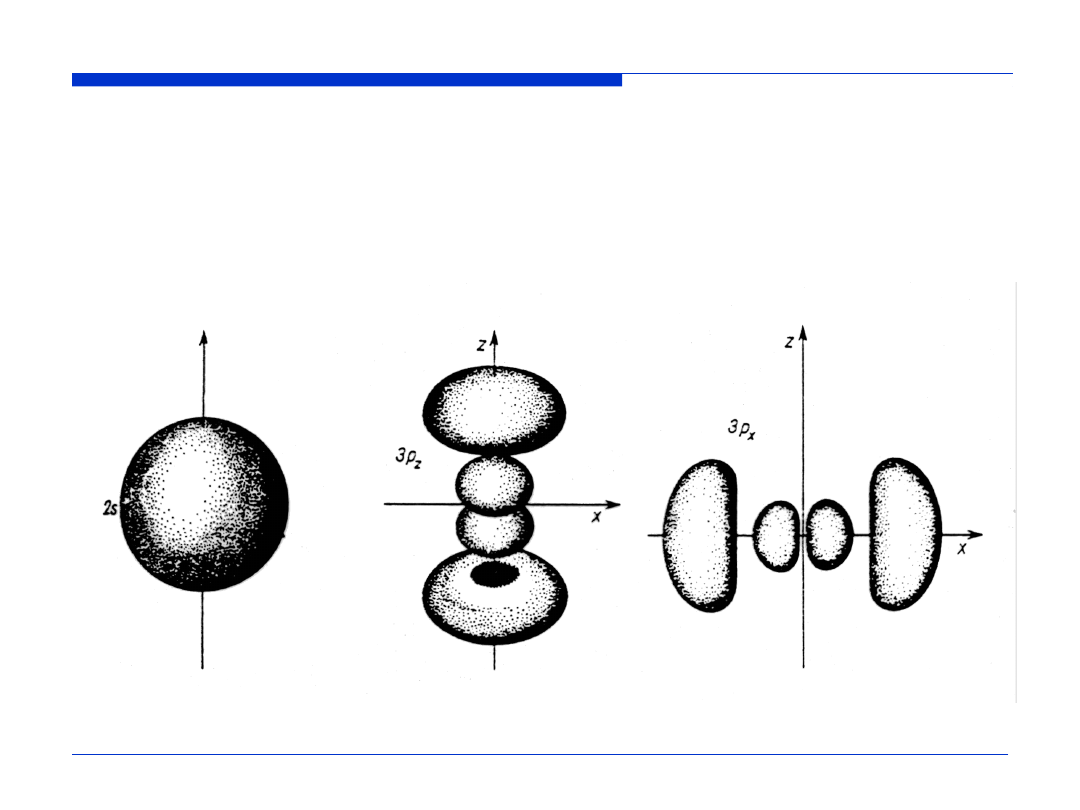
Kontury orbitali atomowych wodoru (2)
Kontury orbitali atomowych wodoru (2)
Kształt brył ograniczających przestrzeń, wewnątrz której można napotkać
Kształt brył ograniczających przestrzeń, wewnątrz której można napotkać
elektron z prawdopodobieństwem równym 0.9
elektron z prawdopodobieństwem równym 0.9
WYKŁAD 10
15
PODSTAWY CHEMII
PODSTAWY CHEMII
Kontury orbitali atomowych wodoru (3)
Kontury orbitali atomowych wodoru (3)
Kształt brył ograniczających przestrzeń, wewnątrz której można napotkać
Kształt brył ograniczających przestrzeń, wewnątrz której można napotkać
elektron z prawdopodobieństwem równym 0.9
elektron z prawdopodobieństwem równym 0.9
WYKŁAD 10
16
PODSTAWY CHEMII
PODSTAWY CHEMII
Spin elektronowy i spinorbital
Spin elektronowy i spinorbital
2
1
2
s
h
1)
s(s
Spin elektronu – własny moment pędu,
Spin elektronu – własny moment pędu,
nie mający odpowiednika w w mechanice klasycznej
nie mający odpowiednika w w mechanice klasycznej
2
1
lub
2
1
2
s
s
z
m
h
m
Składowa spinu wzdłuż wyróżnionego kierunku
Składowa spinu wzdłuż wyróżnionego kierunku
Spinorbital – pełna funkcja falowa, uwzględniająca orientację spinu
Spinorbital – pełna funkcja falowa, uwzględniająca orientację spinu
m
l
n
m
l
n
m
l
n
m
l
n
,
,
,
,
,
,
,
,
,
,
2
1
2
1

WYKŁAD 10
17
PODSTAWY CHEMII
PODSTAWY CHEMII
Atomy wieloelektronowe
Atomy wieloelektronowe

WYKŁAD 10
18
PODSTAWY CHEMII
PODSTAWY CHEMII
Atomy wieloelektonowe:
Atomy wieloelektonowe:
–
w równaniu Schr
w równaniu Schr
ö
ö
dingera należy uwzględnić wzajemne
dingera należy uwzględnić wzajemne
odpychanie elektronów
odpychanie elektronów
–
rozwiązaniem równania Schr
rozwiązaniem równania Schr
ö
ö
dingera jest wieloelektronowa
dingera jest wieloelektronowa
funkcja falowa (określona dla współrzędnych wszystkich
funkcja falowa (określona dla współrzędnych wszystkich
elektronów)
elektronów)
Przybliżenie jednoelektronowe:
Przybliżenie jednoelektronowe:
Funkcję wieloelektronową można przedstawić za pomocą funkcji
Funkcję wieloelektronową można przedstawić za pomocą funkcji
jednoelektronowych, czyli orbitali zbliżonych do orbitali znalezionych
jednoelektronowych, czyli orbitali zbliżonych do orbitali znalezionych
dla atomu wodoru
dla atomu wodoru
Konfiguracja elektronowa:
Konfiguracja elektronowa:
Przypisanie elektronów do poszczególnych funkcji
Przypisanie elektronów do poszczególnych funkcji
jednoelektronowych (orbitali)
jednoelektronowych (orbitali)
)
z
,
y
,
x
,
z
,
y
,
Ψ(x
2
2
2
1
1
1
WYKŁAD 10
19
PODSTAWY CHEMII
PODSTAWY CHEMII
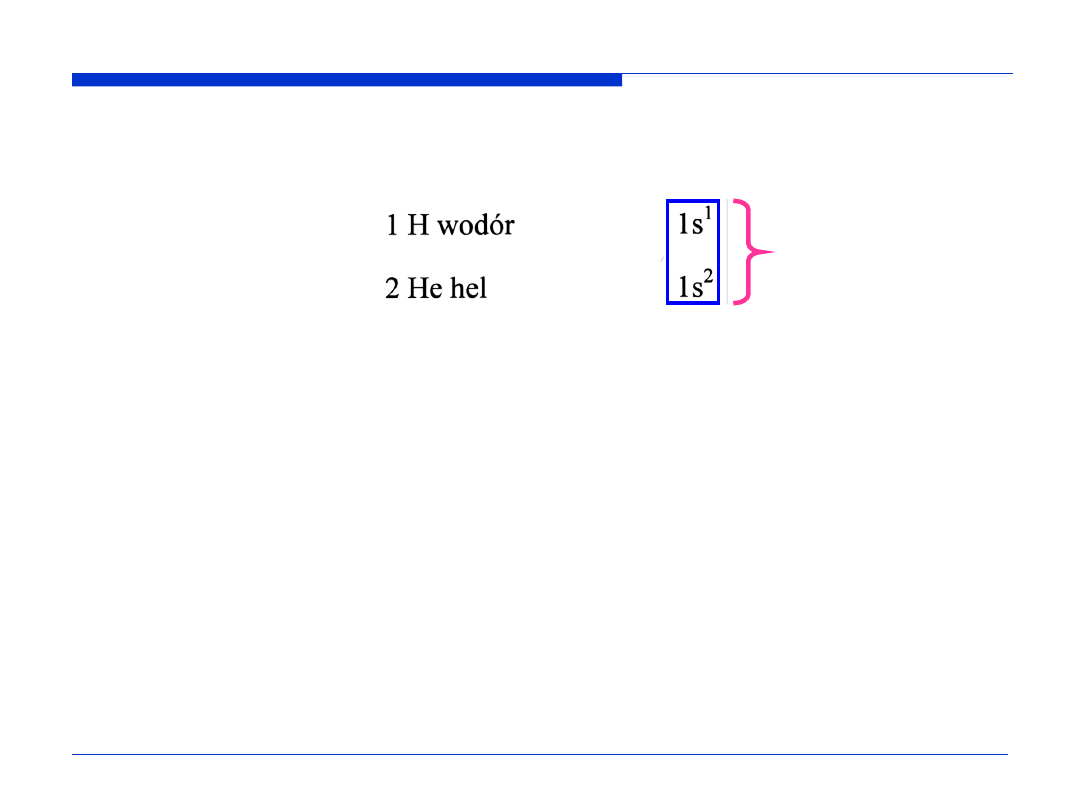
Dla atomów
Dla atomów
wieloelektronowych
wieloelektronowych
obserwuje się
obserwuje się
zmniejszenie
zmniejszenie
degeneracji poziomów
degeneracji poziomów
(powłok)
(powłok)
energetycznych
energetycznych
- energia elektronów
- energia elektronów
zależy od liczb
zależy od liczb
kwantowych
kwantowych
n
n
i
i
l
l
WYKŁAD 10
20
PODSTAWY CHEMII
PODSTAWY CHEMII
1
1
2
2
3
3
4
4
5
5
6
6
7
7
s
s
s
s
s
s
s
s
s
s
s
s
s
s
p
p
p
p
p
p
p
p
p
p
p
p
d
d
d
d
d
d
d
d
d
d
f
f
f
f
f
f
f
f
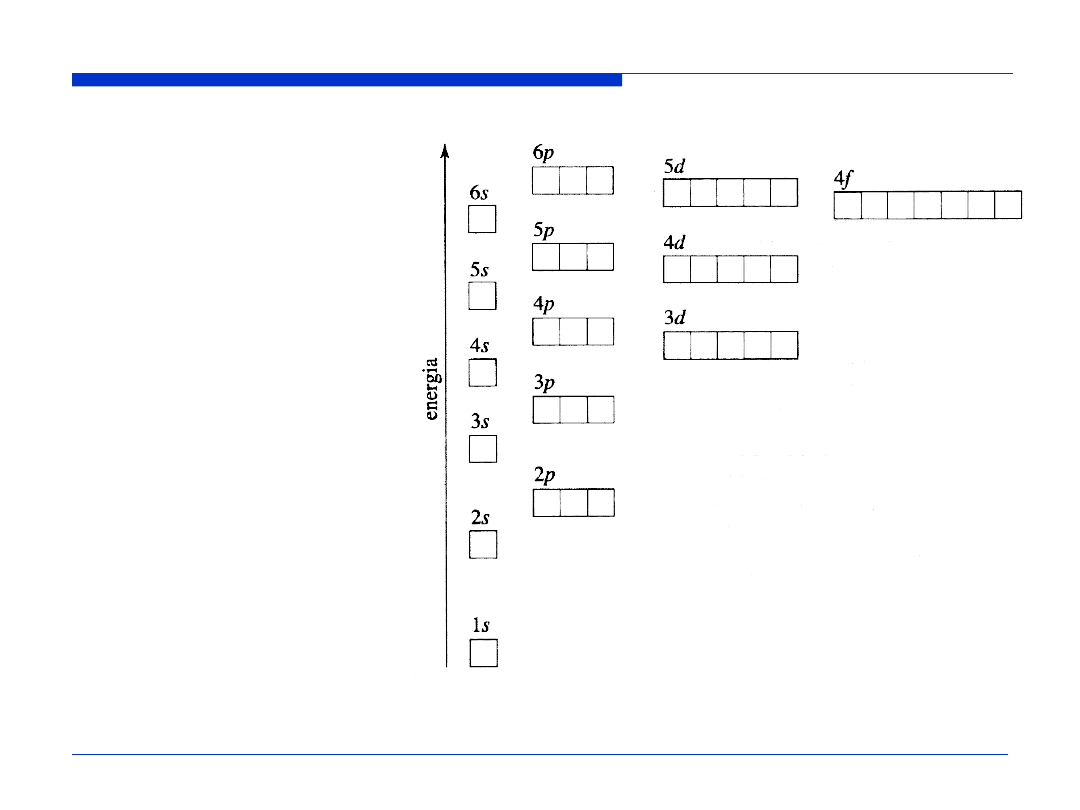
Kolejność zapełniania orbitali atomowych
Kolejność zapełniania orbitali atomowych

WYKŁAD 10
21
PODSTAWY CHEMII
PODSTAWY CHEMII
d
f
S
p
WYKŁAD 10
22
PODSTAWY CHEMII
PODSTAWY CHEMII
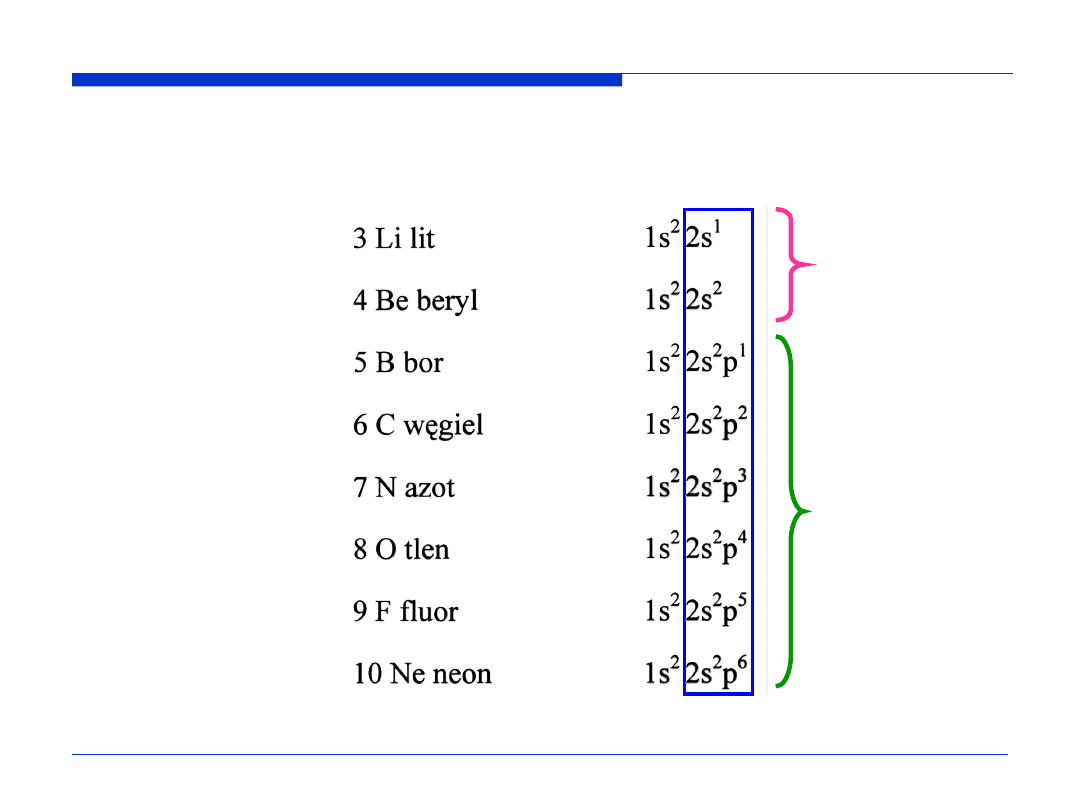
Okres 1
Okres 1
s
s
WYKŁAD 10
23
PODSTAWY CHEMII
PODSTAWY CHEMII
Okres 2
Okres 2
p
p
s
s

WYKŁAD 10
24
PODSTAWY CHEMII
PODSTAWY CHEMII
Okres 3
Okres 3
p
p
s
s

WYKŁAD 10
25
PODSTAWY CHEMII
PODSTAWY CHEMII
Okres 4
Okres 4
s
s
d
d

WYKŁAD 10
26
PODSTAWY CHEMII
PODSTAWY CHEMII
Okres 4 c.d.
Okres 4 c.d.
d
d
p
p
WYKŁAD 10
27
PODSTAWY CHEMII
PODSTAWY CHEMII
Odstępstwa
Odstępstwa
od reguł zapełniania orbitali atomowych
od reguł zapełniania orbitali atomowych
26
Fe
[
18
Ar]3d
6
4s
2
27
Co
[
18
Ar]3d
7
4s
2
28
Ni
[
18
Ar]3d
8
4s
2
44
Ru
[
36
Kr]4d
7
5s
1
45
Rh
[
36
Kr]4d
8
5s
1
46
Pd
[
36
Kr]4d
10
76
Os
[
54
Xe]4f
14
5d
6
6s
2
77
Ir
[
54
Xe]4f
14
5d
7
6s
2
78
Pt
[
54
Xe]4f
14
5d
9
6s
1
29
Cu
[
18
Ar]3d
10
4s
1
47
Ag
[
36
Kr]4d
10
5s
1
24
Cr
[
18
Ar]3d
5
4s
1
42
Mo
[
36
Kr]4d
5
5s
1

WYKŁAD 10
28
PODSTAWY CHEMII
PODSTAWY CHEMII
Konfiguracja kationów metali przejściowych:
Konfiguracja kationów metali przejściowych:
- atomy z bloku
- atomy z bloku
d
d
najpierw tracą elektrony walencyjne z orbitali
najpierw tracą elektrony walencyjne z orbitali
s
s
[Mn]: [Ar]3d
5
4s
2
[Mn
2+
]: [Ar]3d
5
[Fe]: [Ar]3d
6
4s
2
[Fe
2+
]: [Ar]3d
6
[Fe
3+
]: [Ar]3d
5
[Co]: [Ar]3d
7
4s
2
[Co
2+
]: [Ar]3d
7
[Co
3+
]: [Ar]3d
6
[Cu]: [Ar]3d
10
4s
1
[Cu
+
]: [Ar]3d
10
[Cu
2+
]: [Ar]3d
9
[Zn]: [Ar]3d
10
4s
2
[Zn
2+
]: [Ar]3d
10
[Ag]: [Kr]4d
10
5s
1
[Ag
+
]: [Kr]4d
10

WYKŁAD 10
29
PODSTAWY CHEMII
PODSTAWY CHEMII
REGUŁY SLATERA
REGUŁY SLATERA
WYKŁAD 10
30
PODSTAWY CHEMII
PODSTAWY CHEMII
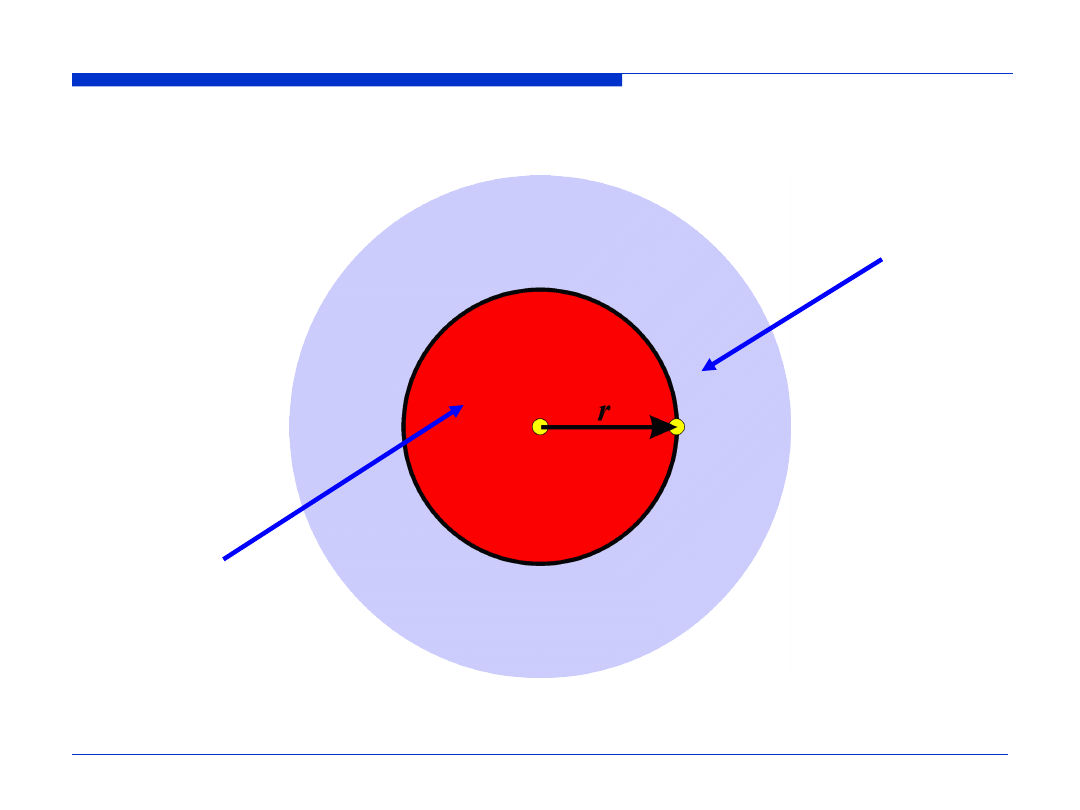
elektrony znajdujące się
na niższych powłokach
zmniejszają przyciąganie
przez jądro
elektrony znajdujące się
na wyższych powłokach
nie wpływają na
oddziaływanie z jądrem
Ekranowanie jądra
Ekranowanie jądra

WYKŁAD 10
31
PODSTAWY CHEMII
PODSTAWY CHEMII
PROPOZYCJE SLATERA
PROPOZYCJE SLATERA
1° Zachowujemy orbitale H-podobne
1° Zachowujemy orbitale H-podobne
2° Uwzględniamy ekranowanie elektronów zewnętrznych
2° Uwzględniamy ekranowanie elektronów zewnętrznych
przez wewnętrzne
przez wewnętrzne
3° Wprowadzamy efektywną liczbę atomową Z*
3° Wprowadzamy efektywną liczbę atomową Z*
4° Zachowujemy wzór na energię elektronu
4° Zachowujemy wzór na energię elektronu
2
2
2
4
2
*
8
n
h
e
m
Z
E
o
e
Z* = Z – S
stała ekranowania z
stała ekranowania z
reguł empirycznych
reguł empirycznych
Slatera
Slatera
WYKŁAD 10
32
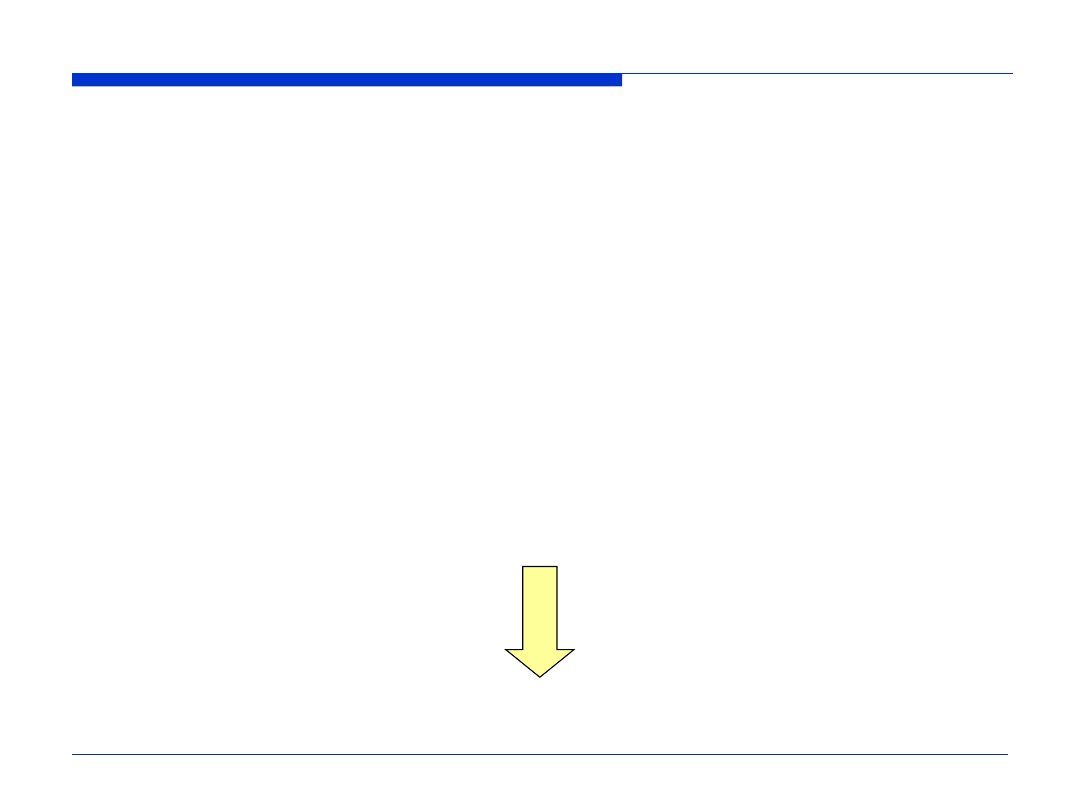
Wartości Z
Wartości Z
ef
ef
dla pierwiastków lekkich
dla pierwiastków lekkich
PODSTAWY CHEMII
PODSTAWY CHEMII
WYKŁAD 10
33
PODSTAWY CHEMII
PODSTAWY CHEMII
Wprowadzamy ugrupowania orbitali
Wprowadzamy ugrupowania orbitali
(1s) (2s2p) (3s3p) (3d) (4s4p) (4d
(1s) (2s2p) (3s3p) (3d) (4s4p) (4d
)
)
(4f) (5s5p) (5d) (5f) itd
(4f) (5s5p) (5d) (5f) itd
Wprowadzamy udziały elektronów w stałej ekranowania
Wprowadzamy udziały elektronów w stałej ekranowania

WYKŁAD 10
34
PODSTAWY CHEMII
PODSTAWY CHEMII
Reguły Slatera (ns
Reguły Slatera (ns
, np)
, np)
0.35
0.35
z tego samego ugrupowania
z tego samego ugrupowania
0
0
Elektrony na prawo
Elektrony na prawo
wyjątek 1s
wyjątek 1s
udział = 0.3
udział = 0.3
0.85
0.85
z ugrupowania (n-1)
z ugrupowania (n-1)
1.0
1.0
z ugrupowania (n-2), (n-3),.....itd
z ugrupowania (n-2), (n-3),.....itd
dla nd i nf
dla nd i nf
zanika ostatnie rozróżnienie
zanika ostatnie rozróżnienie
Dla wszystkich wcześniejszych elektronów udział = 1.0
Dla wszystkich wcześniejszych elektronów udział = 1.0

WYKŁAD 10
35
PODSTAWY CHEMII
PODSTAWY CHEMII
Z
Z
ef
ef
He 1s
He 1s
1.69
1.69
Na 1s
Na 1s
10.6
10.6
2s
2s
6.85
6.85
2p
2p
6.85
6.85
3s
3s
2.20
2.20

WYKŁAD 10
36
PODSTAWY CHEMII
PODSTAWY CHEMII
2
2
4
2
8
7
.
1
h
e
m
E
o
e
Przykłady:
Przykłady:
He: (1s)
He: (1s)
2
2
S = 1
S = 1
x
x
0.3 = 0.3
0.3 = 0.3
Z* = 2 – 0.3 = 1.7
Z* = 2 – 0.3 = 1.7
dla jednego
dla jednego
elektronu
elektronu
dla obu x 2
dla obu x 2
WYKŁAD 10
37
PODSTAWY CHEMII
PODSTAWY CHEMII
29
29
Cu: (1s)
Cu: (1s)
2
2
(2s2p)
(2s2p)
8
8
(3s3p)
(3s3p)
8
8
(3d)
(3d)
10
10
(4s)
(4s)
1
1
dla elektronu 4s
dla elektronu 4s
S = 10
S = 10
x
x
0.85 + 18
0.85 + 18
x
x
1.0 = 26.5
1.0 = 26.5
Z* = 29 – 26.5 = 2.5
Z* = 29 – 26.5 = 2.5
dla elektronu 3d
dla elektronu 3d
S = 9
S = 9
x
x
0.35 + 8
0.35 + 8
x
x
1.0 + 8
1.0 + 8
x
x
1.0 + 2
1.0 + 2
x
x
1.0 = 21.15
1.0 = 21.15
Z* = 29 - 21.15 = 7.85
Z* = 29 - 21.15 = 7.85
energia bardziej
energia bardziej
ujemna (niższa)
ujemna (niższa)
Cu
Cu
+
+
WYKŁAD 10
38
PODSTAWY CHEMII
PODSTAWY CHEMII
19
19
K: (1s)
K: (1s)
2
2
(2s2p)
(2s2p)
8
8
(3s3p)
(3s3p)
8
8
3d
3d
1
1
dla elektronu 3d
dla elektronu 3d
s = 18
s = 18
x
x
1.0 = 18
1.0 = 18
Z* = 19 – 18 = 1
Z* = 19 – 18 = 1
dla elektronu 4s
dla elektronu 4s
s = 8
s = 8
x
x
0.85 + 10
0.85 + 10
x
x
1.0 = 16.8
1.0 = 16.8
Z* = 19 – 16.8 = 2.2
Z* = 19 – 16.8 = 2.2
hipotetyczny
hipotetyczny
(1s)
(1s)
2
2
(2s2p)
(2s2p)
8
8
(3s3p)
(3s3p)
8
8
3d
3d
0
0
4s
4s
1
1
rzeczywisty
rzeczywisty
niższa energia – kolejność zapełniania orbitali
niższa energia – kolejność zapełniania orbitali
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
Konfiguracja elektronowa atomów
Konfiguracja elektronowa atomów (2)
10 całość, PWr, sprawozdania, Elektronika i elektrotechnika
10 fizyka atomowa, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Podstawy Automatyki Lab 10 CW3 Układy sekwencyjne elektroniczne
Temat 2 Konfiguracja elektronowa
Chemia wykłady, Chemia wykłady-mini, → ORBITALE ATOMOWE WODORU
ORBITALE ATOMOWE
Hybrydyzacja orbitali atomowych
Konfiguracje elektronowe, Inżynieria chemiczna i procesowa
mFAQ 10 4 WinCC V7 Konfiguracja struktury rozproszonej
Konfiguracja elektronowa pierwiastków
konfiguracje elektronowe pierwiastków
orbitale atomowe, Do matury, Chemia, Notatki
konfiguracja elektronowa zadania
10. Dyfrakcja i Polaryzacja - Teoria, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - L
konfiguracja elektronowa
Konfiguracja elektronów
Konfiguracji elektronowa
więcej podobnych podstron