
Chemia budowlana
dr inż. Beata Janowska
Części składowe atomu
• Atom jest elektrycznie obojętną mikrostruktrą
zbudowaną z dodatnio naładowanego jądra
otoczonego zespołem ujemnych elektronów.
Stanowi on najmniejszą ilość pierwiastka
zachowującą jego właściwości.
cząstk
a
symbo
l
masa
[u]
masa
przybliżo
na [u]
ładunek
[e]
proton
p
1,0072
78
1
+1
neutro
n
n
1,0086
15
1
0
elektro
n
e
0,0005
48
-1
1825
1

Atomowa jednostka masy – jest to
masy atomu węgla C-12
1g 6,02·10
23
u
Elementarna jednostka ładunku –
jest to wartość równa ładunkowi
elektrycznemu jaki ma elektron
e 1,6 ·10
-19
C
12
1

• Liczba atomowa Z – określa liczbę protonów
w danym atomie
• Liczba masowa A - określa sumę protonów i
neutronów w danym atomie
N = A – Z, N – liczba neutronów w danym jądrze
atomowym
nukleon - suma protonów i neutronów w
jądrze atomowym

• Pierwiastek
chemiczny
–
zbiór
atomów o tej samej wartości liczby
masowej A i atomowej Z
• Izotopy – zbiór atomów o tej samej
liczbie atomowej Z, a różnej wartości
liczby masowej A
• Izobary – zbiór atomów o tej samej
wartości liczby masowej A i różnej
liczbie atomowej Z

Budowa atomu
wodoru
teoria Nielsa Bohra
Bohr przyjął za
punkt wyjścia
model jądrowy
Rutherforda:
zakładający, że w
geometrycznym
środku atomu
znajduje się jądro
wokół, którego
krąży elektron

Postulaty Bohra
Postulat I
• Elektron w atomie może przebywać w jednym
z wielu stanów energetycznych ( tzw. stanów
stacjonarnych), w których jego energia ma
ściśle określoną stałą wartość
2
h
n
mvr
m – masa elektronu, V – prędkość, r – promień orbity, h=6,625 ·10
-34
J ·s
- stała Plancka, n – kolejne liczby całkowite

Postulat II
Elektron może pobrać kwant energii
docierającej do atomu z zewnątrz i przejść
do stanu stacjonarnego o wyższej energii
lub może oddać kwant energii w formie fali
elektromagnetycznej i przejść do stanu
stacjonarnego o niższej energii
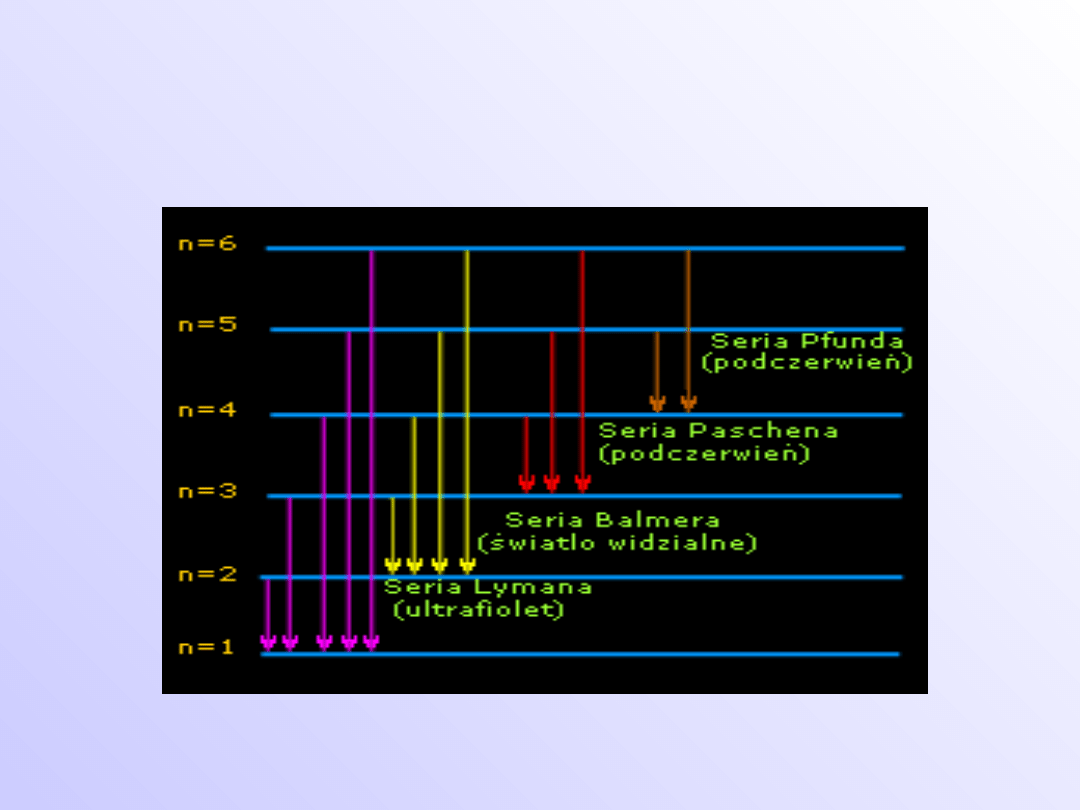
Schemat powstawania serii widma
emisyjnego wodoru.

Podstawy współczesnej teorii
kwantowej
• Elektron w atomie może przebywać w jednym z
wielu
możliwych
stanów
tzw.
stanów
kwantowych, z których każdy jest określony
skwantowanymi wartościami wielkości: energii
(n)- główna liczba kwantowa,
momentu pędu (krętu) (l) – orbitalna
(poboczna) liczba kwantowa,
rzutu momentu pędu na wyróżniony kierunek
(m) – magnetyczna liczba kwantowa,
spinu (S) – spinowa liczba kwantowa,
rzutu spinu na wyróżniony kierunek (m
s
) –
magnetyczna spinowa liczba kwantowa.

W żadnym stanie kwantowym elektron nie
wypromieniowuje ani nie pochłania energii, nie
zmienia wartości momentu pędu i spinu ani ich
orientacji przestrzennej
Nie można określić równocześnie dokładnego
położenia i pędu elektronu w danej chwili –
zasada nieoznaczoności Heisenberga
Ruch elektronu w atomie można opisać
równaniem
różniczkowym
(równaniem
Schrödingera), którego rozwiązaniem są funkcje
falowe i odpowiadające im wartości energii
H = E
Operator H działa na funkcję = (energia całkowita) razy
funkcja

Dla każdego stanu kwantowego można
obliczyć prawdopodobieństwo przebywania
elektronu w danej odległości od jądra oraz
określić
kształt
i
rozmiary
orbitalu
atomowego.
Orbital atomowy jest to najmniejszy obszar
przestrzeni wokółjadrowej, wewnątrz którego
prawdopodobieństwo znalezienia elektronu
ma określoną wartość (90%)
Zbiór stanów kwantowych o wspólnej wartości
głównej liczby kwantowej n – nazywamy powłoką
elektronową;
liczba
stanów
kwantowych
jest
określona iloczynem 2n
2
wartość n
1 2 3 4 5 6 7 ...
nazwa powłoki
K L M N O P Q ...
Główna liczba kwantowa n decyduje o wielkości
orbitalu

Zbiór stanów kwantowych, z których wszystkie
mają wspólną wartość głównej liczby kwantowej
n oraz wspólną wartość orbitalnej liczby
kwantowej l – nazywamy podpowłoką kwantową
– liczba stanów kwantowych wynosi 4l+2
wartość l 0 1 2 3 4 5 6 ...
symbol podpowłoki
s p d f g h i ...
Orbitalna liczba kwantowa l decyduje o kształcie
orbitalu
Orbitalna liczba kwantowa l przyjmuje wartości
od 0 do (n-1)

Zbiór stanów kwantowych o wspólnych
wartościach
głównej
n,
orbitalnej
l
i
magnetycznej m liczby kwantowej – nazywamy
poziomem orbitalnym. Liczba poziomów
orbitalnych w powłoce wynosi n
2
, a w
podpowłoce 2l+1. Do każdego poziomu
orbitalnego należą dwa stany kwantowe
różniące się orientacją przestrzenną spinu.
magnetyczna liczba kwantowa m decyduje o
orientacji przestrzennej orbitalu.
magnetyczna liczba kwantowa m przyjmuje
następujące wartości: od –l do +l z zerem
włącznie

Spinowa liczba kwantowa S nie wpływa na
zróżnicowanie
stanów
kwantowych
i
przyjmuje wartość równą ½
Magnetyczna spinowa liczba kwantowa m
s
określa liczbę stanów kwantowych w poziomie
orbitalnym i przyjmuje wartość –1/2 lub +1/2
Elektron może absorbować kwant energii
docierający do atomu z zewnątrz i przejść do
stanu kwantowego o wyższej energii lub może
emitować do otoczenia kwant energii w formie
fali elektro magnetycznej przechodząc do
stanu o niższej energii
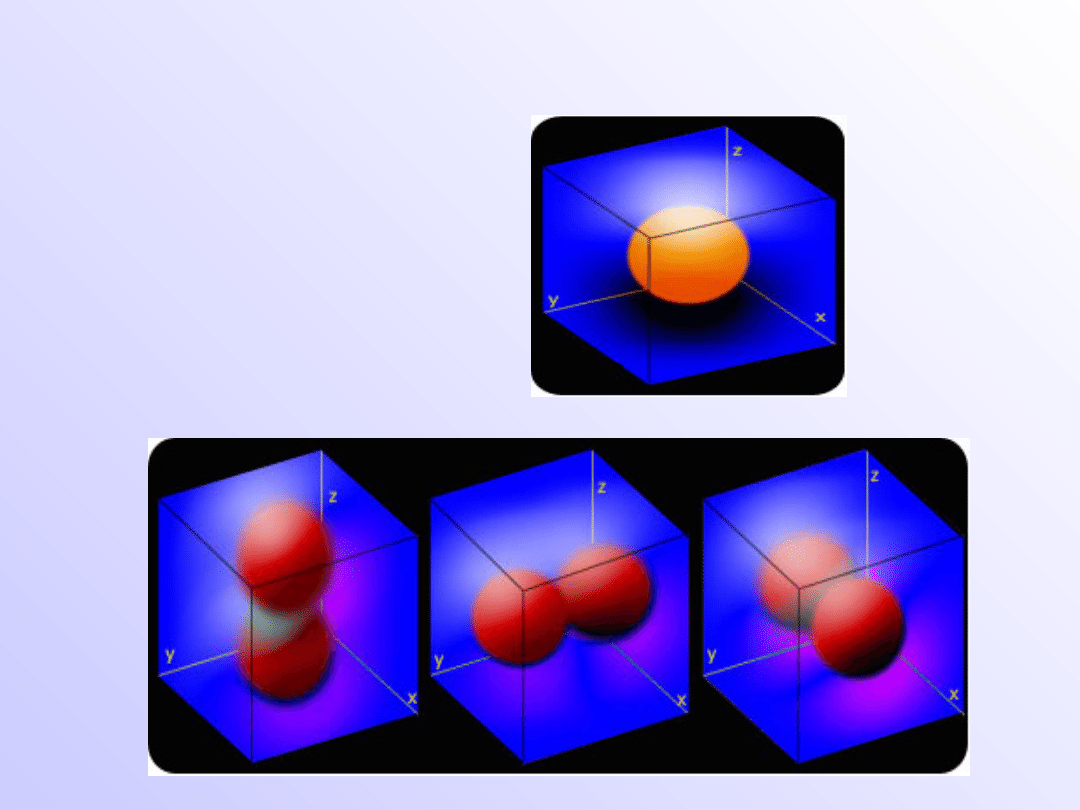
Kształty orbitali
Orbital typu s
Orbitale typu p
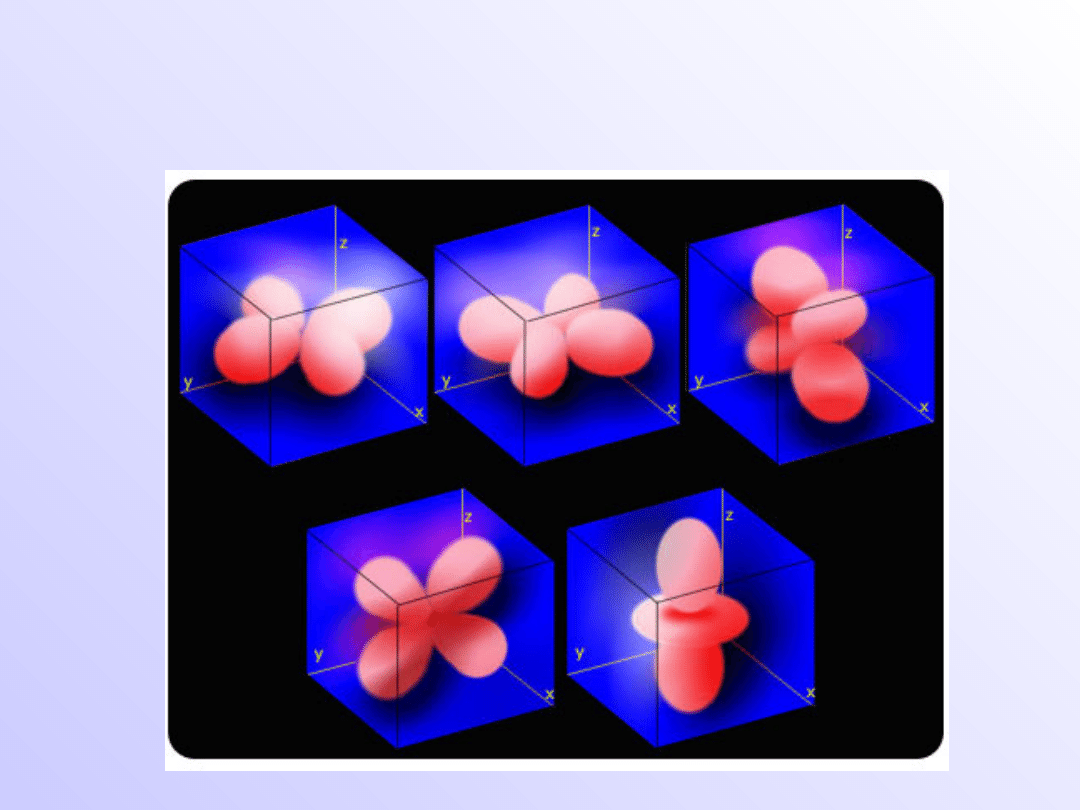
Orbitale typu d
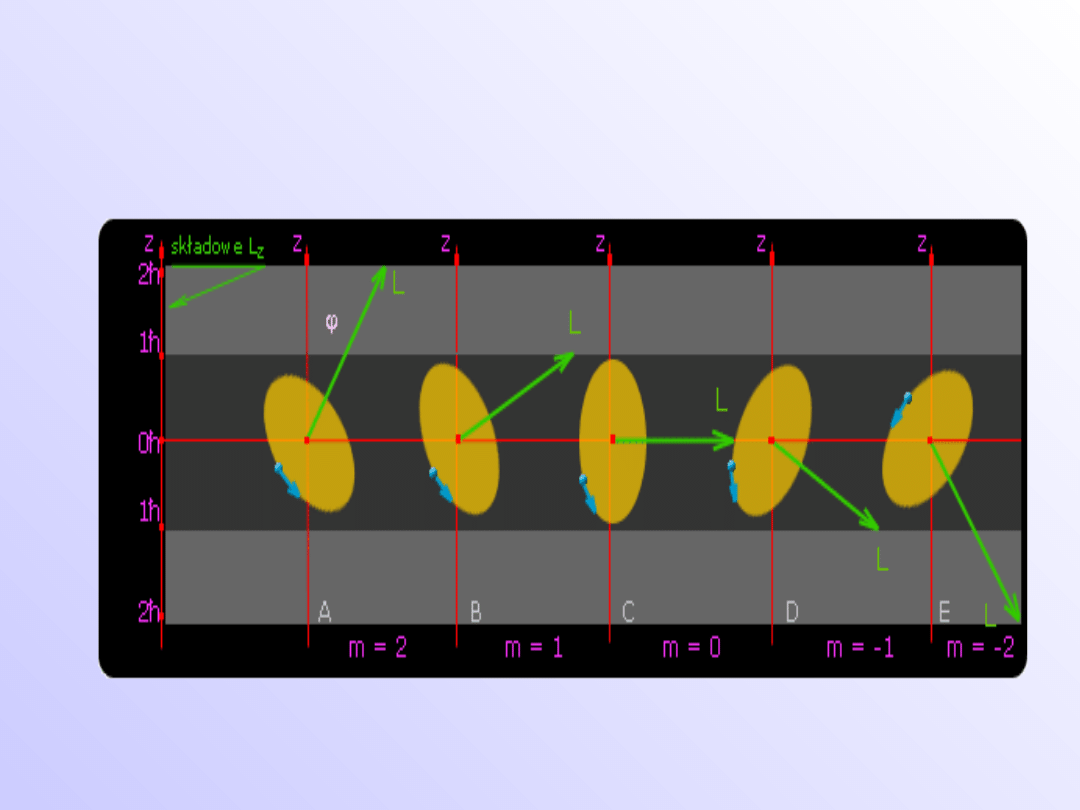
• Wektor orbitalnego momentu L jest skwantowany w
przestrzeni. Względem danego kierunku z dozwolone
są jedynie pewne ustawienia wektora L.
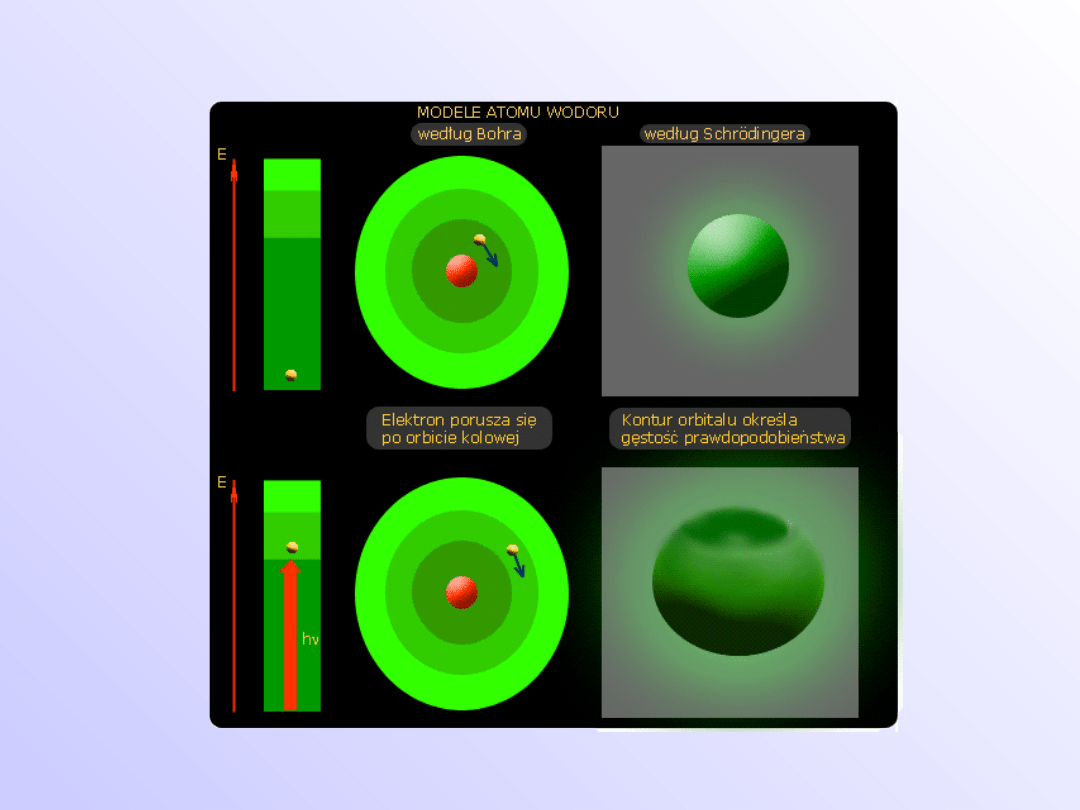
Modele atomu wodoru

Konfiguracja elektronowa
• Konfiguracja
elektronowa,
czyli
rozmieszczenie elektronów w atomie,
daje chemikowi cenne informacje,
pozwalające przewidywać właściwości i
zachowanie się pierwiastka w różnych
warunkach oraz reakcje chemiczne, w
jakie może wchodzić
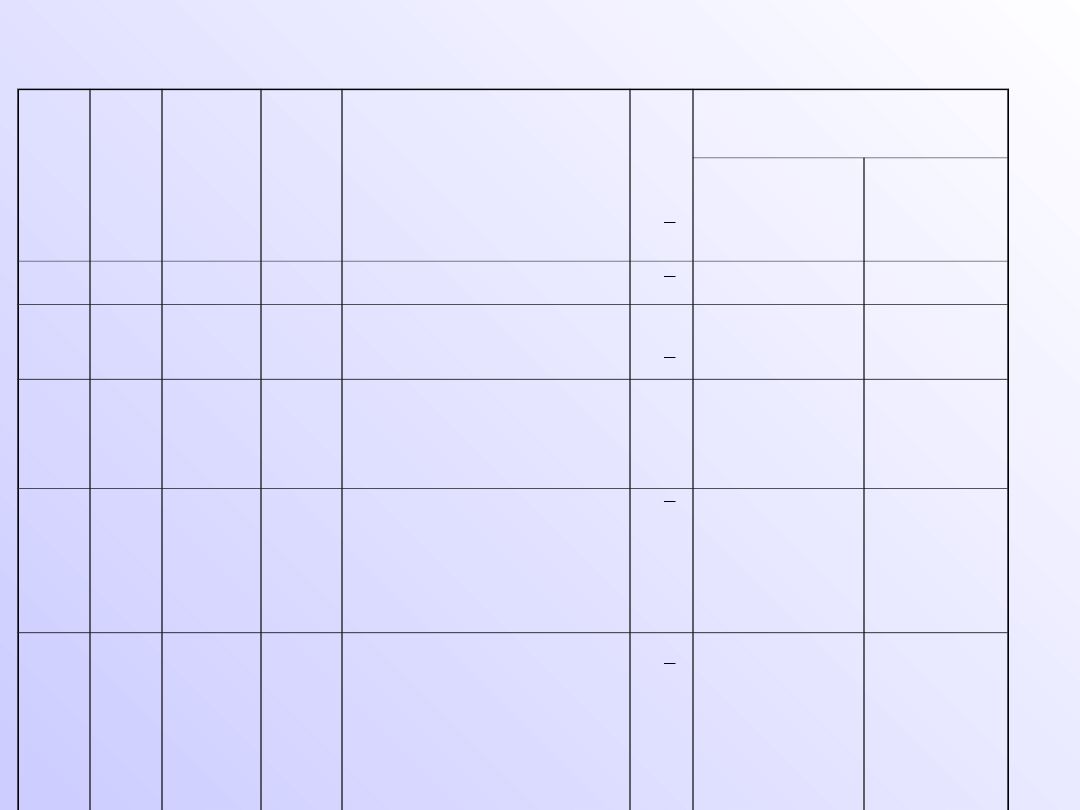
Rozmieszczenie elektronów na poziomach
kwantowych
n
po
wło
ka
l
pod
pow
łoka
m
m
s
Największa możliwa
liczba elektronów
W podpowłoce
W powłoce
1
K
0 (s)
1s
0
2
2
2
L
0 (s)
1 (p)
2s
2p
0
+1,0,-1
2
6
8
3
M
0 (s)
1 (p)
2 (d)
3s
3p
3d
0
+1,0,-1
+2, +1,0, -1,-2
2
6
10
18
4
N
0 (s)
1 (p)
2 (d)
3 (f)
4s
4p
4d
4f
0
+1,0,-1
+2, +1,0, -1,-2
+3,+2, +1,0, -1,-2,-3
2
6
10
14
32
5
O
0 (s)
1 (p)
2 (d)
3 (f)
4 (g)
5s
5p
5d
5f
5g
0
+1,0,-1
+2, +1,0, -1,-2
+3,+2, +1,0, -1,-2,-3
+4,+3,+2, +1,0, -1,-
2,-3,-4
2
6
10
14
18
50
2
1
2
1
2
1
2
1
2
1

Zakaz Pauliego :
W atomie nie mogą istnieć dwa elektrony,
których stan kwantowy nie różniłby się
przynajmniej jedną liczbą kwantową
Zasada Hunda
Liczba niesparowanych elektronów w danej
podpowłoce powinna być możliwie największa
Pary elektronów w danej podpowłoce tworzą
się dopiero po zapełnieniu wszystkich poziomów
orbitanych danej podpowłoki przez elektrony
niesparowane
elektrony
niesparowane
w
poziomach
orbitalnych danej podpowłoki mają jednakową
wartość spinu
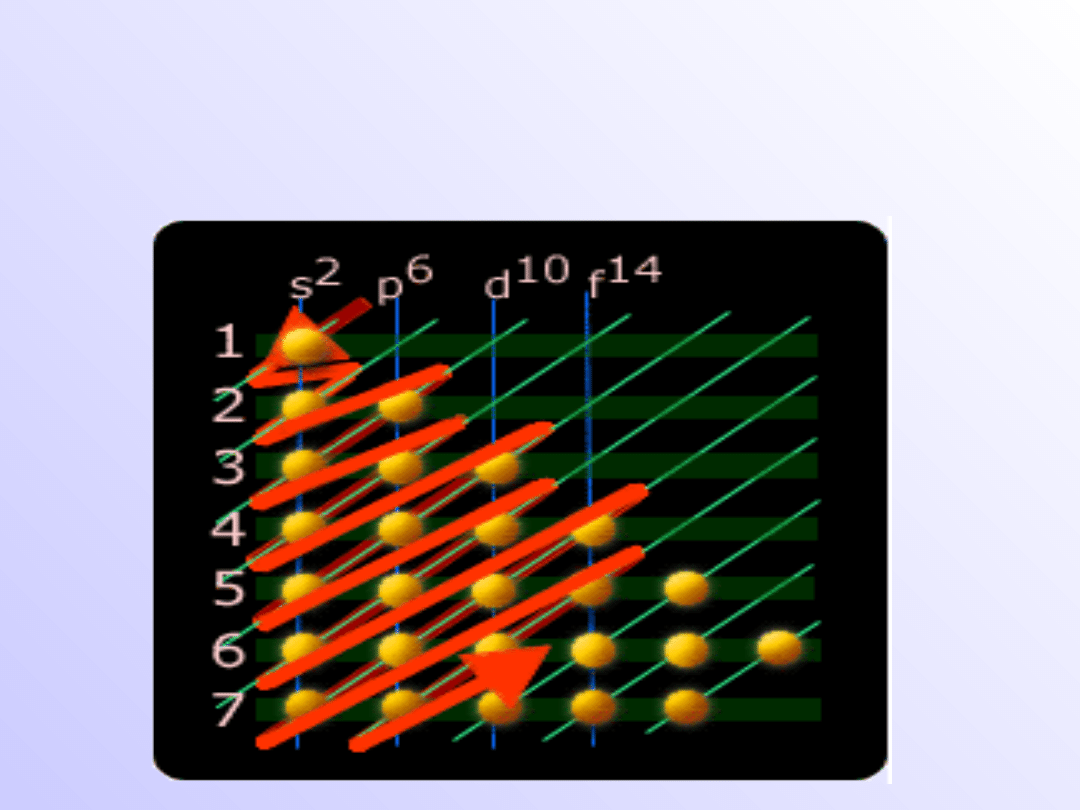
Kolejność obsadzania poziomów
energetycznych

Elektrony walencyjne
• Elektrony znajdujące się na ostatniej
powłoce słabo związane z jądrem atomu
–
decydują
o
właściwościach
chemicznych danego pierwiastka

Układ okresowy
pierwiastków
• Prawo okresowości w swojej
współczesnej wersji mówi, że
właściwości
pierwiastków
chemicznych
uporządkowanych
według
wzrastających
liczb
atomowych Z powtarzają się
okresowo.
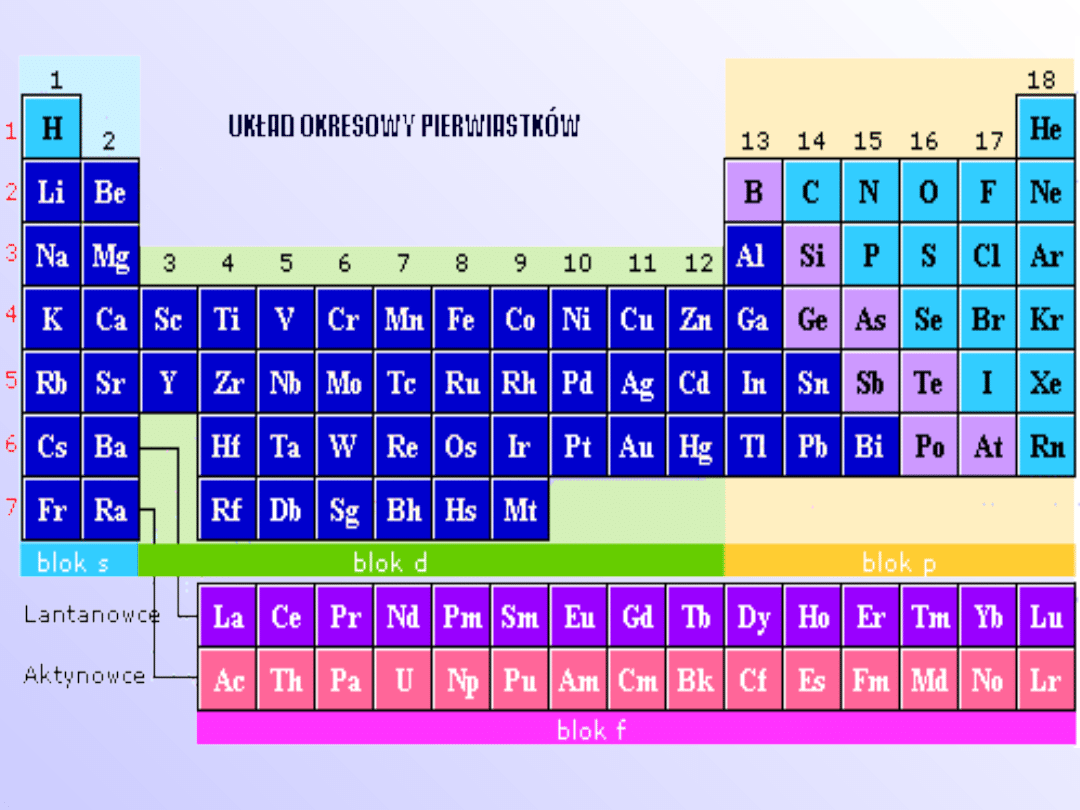

Skala elektroujemności Paulinga

Teorie tworzenia wiązań
chemicznych
• Cząsteczki powstają w wyniku połączenia się dwóch lub
więcej atomów. Atomy łączą się ze sobą tylko wtedy,
gdy energia cząsteczki jest mniejsza od sumy energii
poszczególnych atomów. Oznacza to, że proces
tworzenia się cząsteczki powinien być energetycznie
korzystny, a więc powinien prowadzić do osiągnięcia
przez układ minimum energii. A to oznacza, że w
procesie łączenia się atomów w cząsteczkę jest
uwalniana energia. Najczęściej uwalniana energia ma
postać ciepła.
• wszystkie atomy podczas reakcji chemicznych dążą do
uzyskania konfiguracji elektronowej najbliższego gazu
szlachetnego, czyli posiadania ośmiu elektronów -
oktetu elektronowego na zewnętrznej powłoce, lub
posiadania dwóch elektronów - dubletu elektronowego
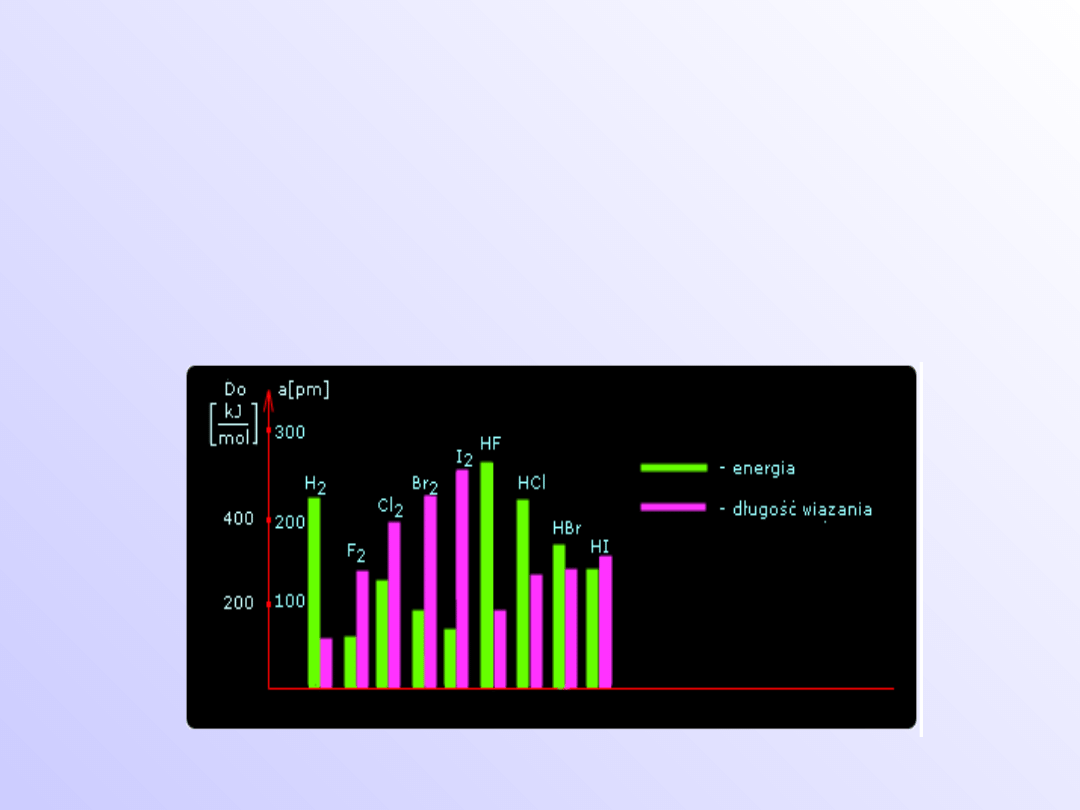
Wielkości charakteryzujące
wiązanie
• energia dysocjacji (energia wiązania)
• odległość pomiędzy atomami (długość
wiązania)
• kąt pomiędzy kierunkami wiązań (kąt
walencyjny).

Typy wiązań chemicznych
• wiązanie jonowe czyli elektrowalencyjne
• wiązanie atomowe czyli kowalencyjne
• wiązanie pośrednie czyli atomowe
spolaryzowane (kowalencyjne spolaryzowane)
• wiązanie donorowo-akceptorowe
(koordynacyjne)
• wiązanie wodorowe
• wiązanie międzycząsteczkowe czyli wiązanie
siłami van der Waalsa

Wiązanie jonowe (elektrowalencyjne)
• Wiązania jonowe występują w układach
złożonych z atomów skrajnie różniących się
elektroujemnością
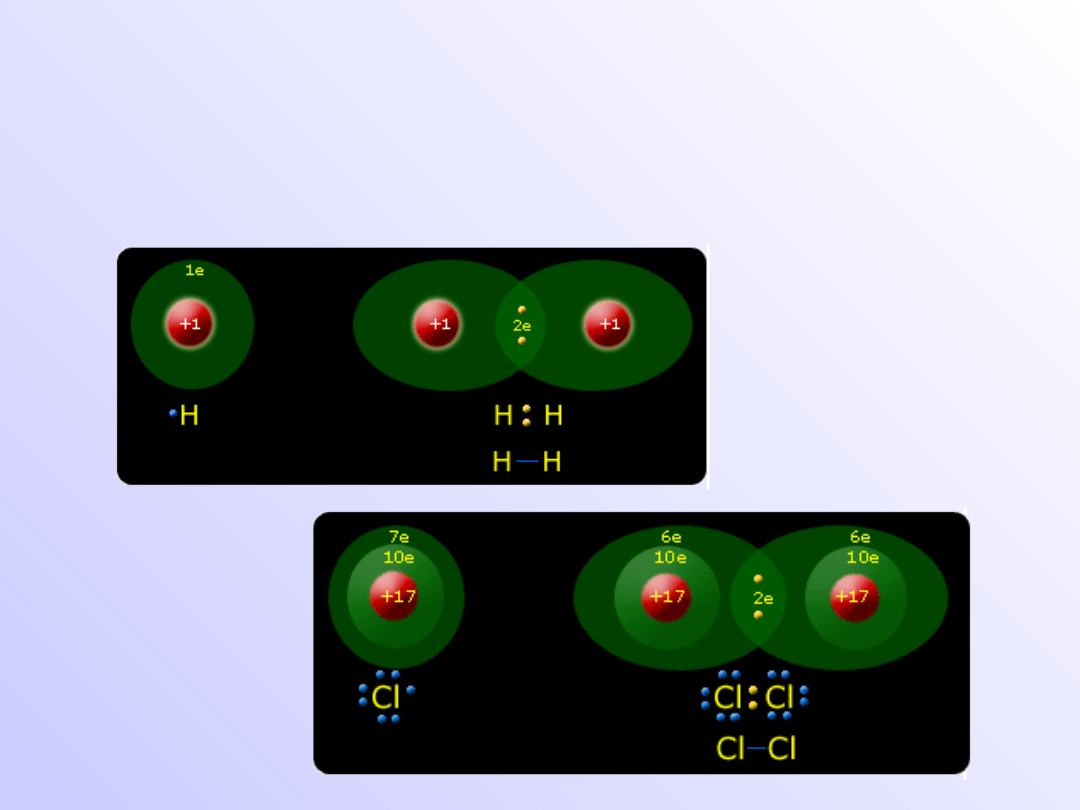
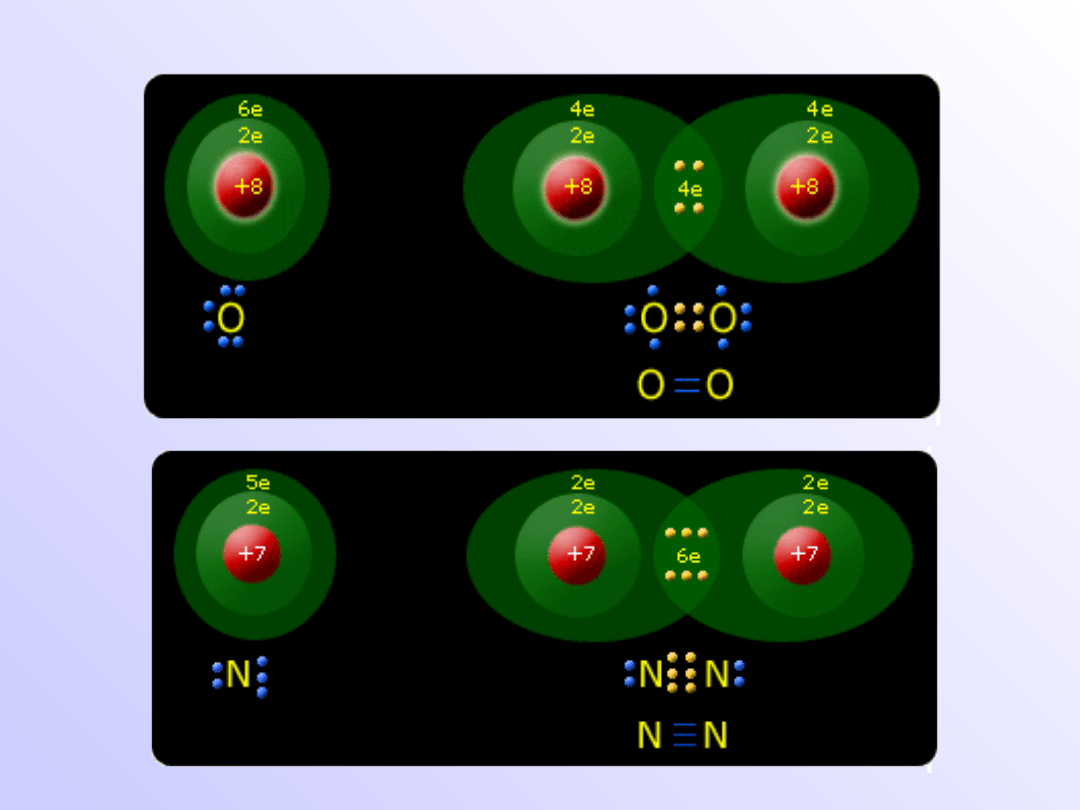
Wiązanie atomowe
(kowalencyjne)
• Wiązania atomowe (kowalencyjne) powstają, gdy
łączą
się
z
sobą
atomy
pierwiastków
elektroujemnych o takich samych wartościach
elektroujemnością

Wiązanie atomowe (kowalencyjne)
spolaryzowane
• Wiązanie
atomowe
spolaryzowane
jest
wiązaniem pośrednim między jonowym a
atomowym; powstaje wówczas, gdy łączą się
ze sobą atomy pierwiastków różniących się
elektroujemnością, lecz nie tak znacznie jak w
przypadku tworzenia wiązania jonowego.
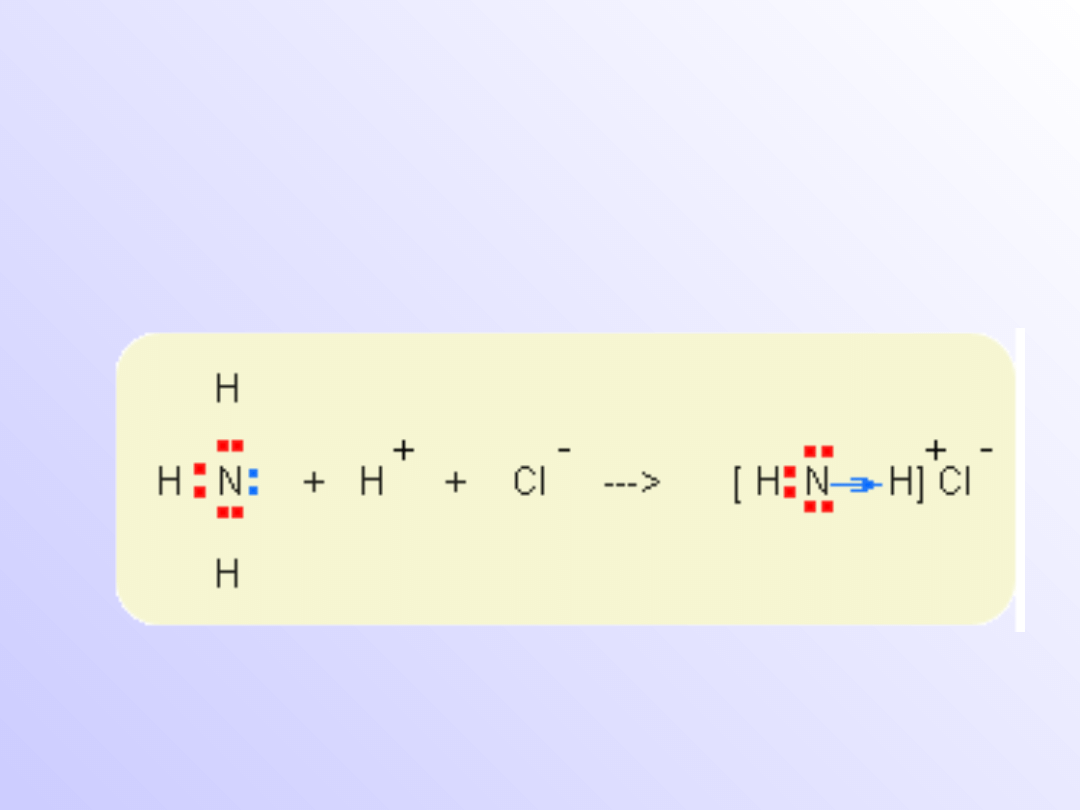
Wiązanie donorowo-akceptorowe
(koordynacyjne)
• Wiązanie donorowo-akceptorowe tym różni się
od wiązania atomowego lub atomowego
spolaryzowanego,
że
para
elektronowa
tworzących wiązanie oddawana jest przez
jeden z dwóch łączących się atomów.

Wiązanie metaliczne
• Pojęcie wiązania metalicznego stosowane jest
dla scharakteryzowania wiązania chemicznego
istniejącego pomiędzy atomami metalu w
stanie stałym kiedy mamy do czynienia z tzw.
siecią metaliczną.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
Wykład 1, budowa atomu, wiązania chemiczne
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
WYKŁAD (budowa atomu, CHEMIA
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
BUDOWA ATOMU teoria
Chemia II Budowa atomu
budowa atomu(1)
budowa atomu zadania
budowa atomu I
Budowa atomu ćwiczenie 5
budowa atomu
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
Budowa materii wykład 2
Prezentacja o budowach atomu id Nieznany
Zestaw zadań rachunkowych - światło i budowa atomu, kl 1 fizyka
1. Budowa atomu...., chemia(2)
Budowa atomu i wiązania chemiczne test odpowiedzi
4 6 budowa atomu,promieniotwórczosc izotopy
więcej podobnych podstron