
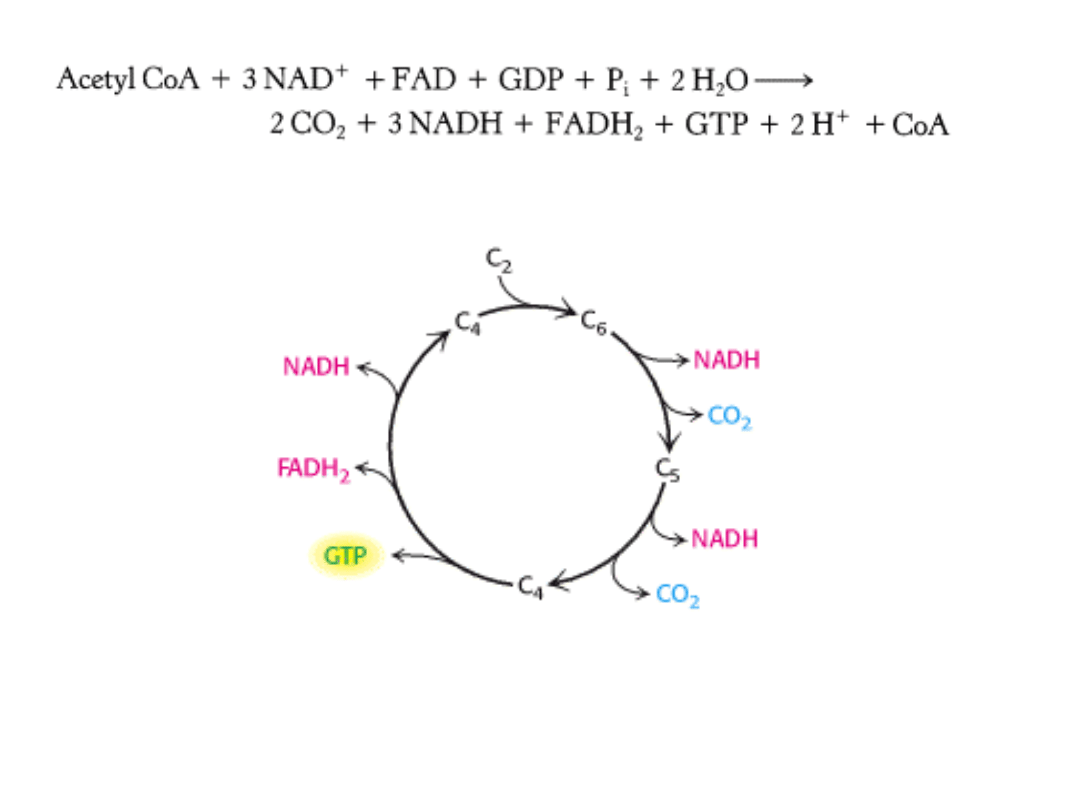
CYKL KWASU
CYTRYNOWEGO
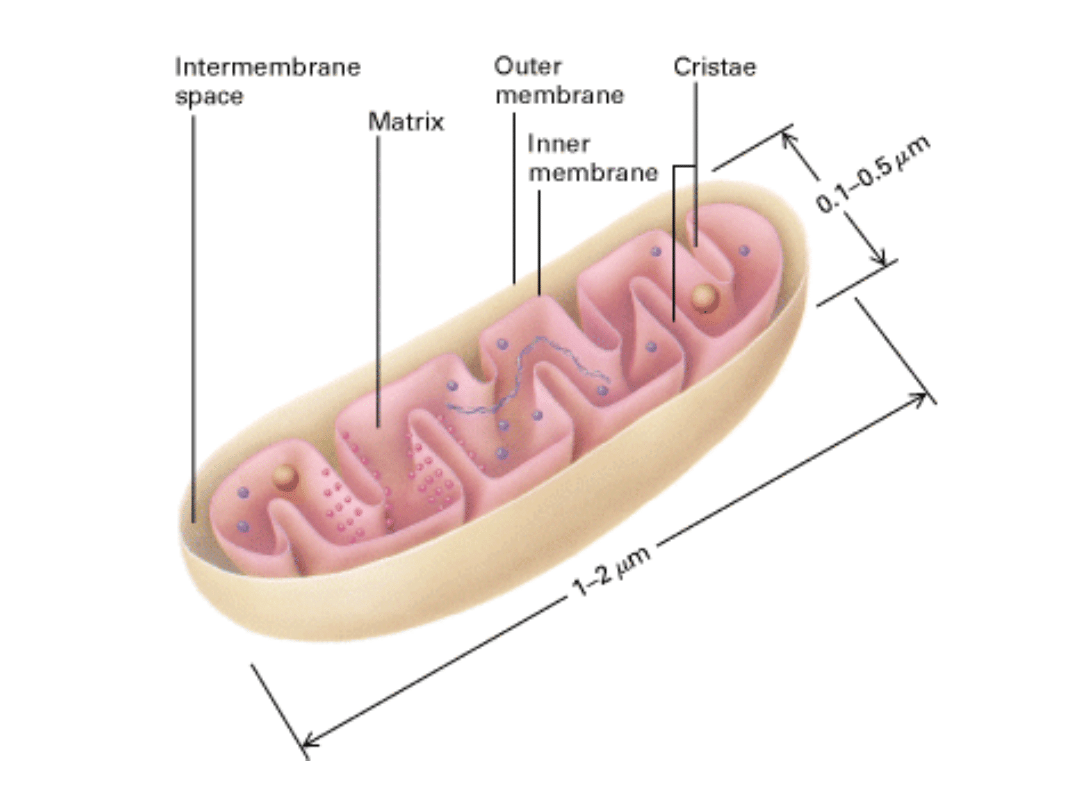
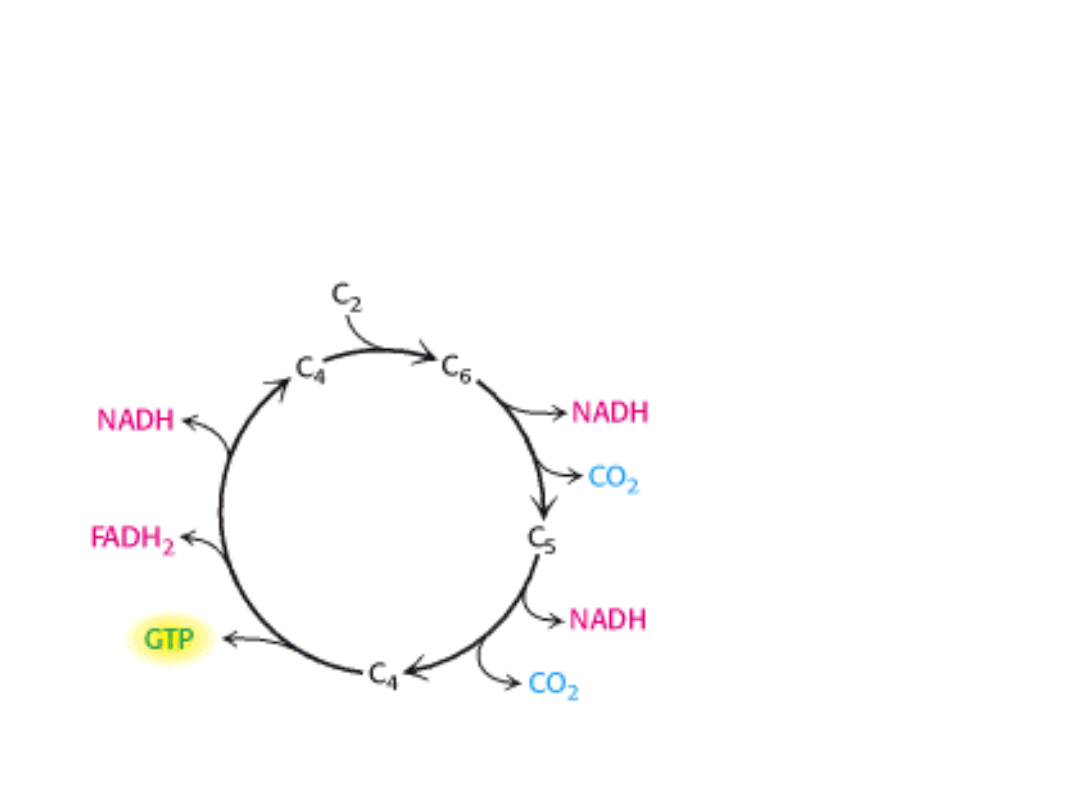
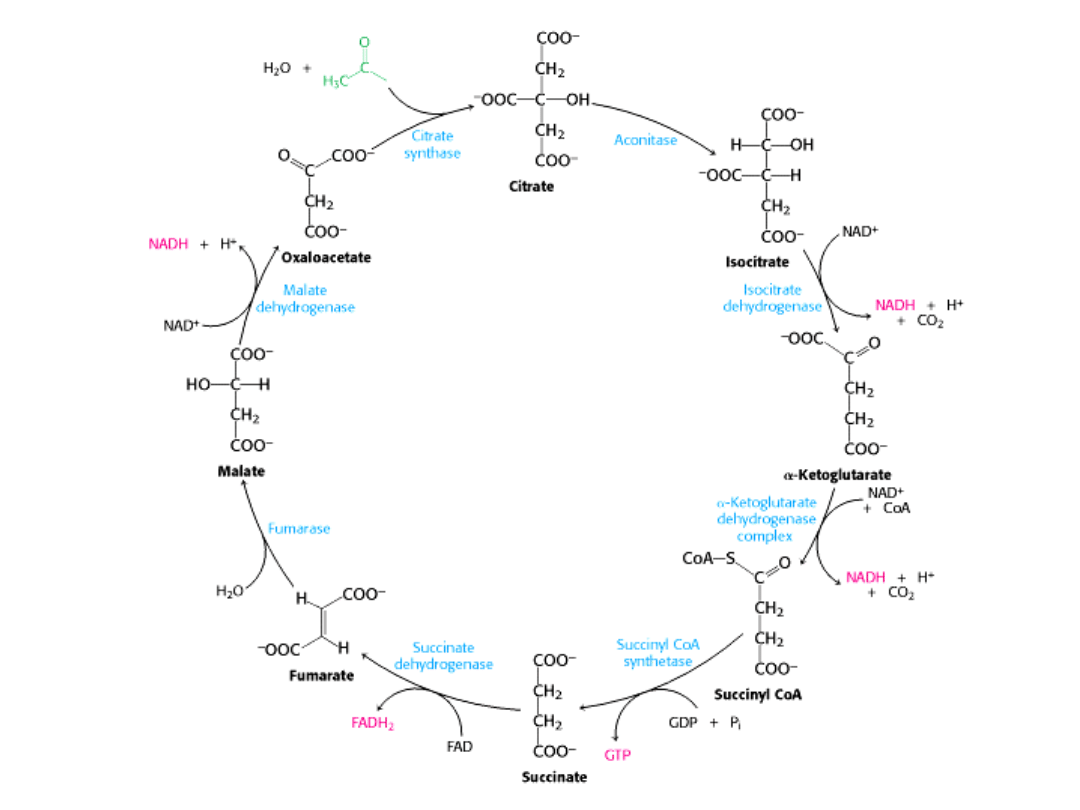
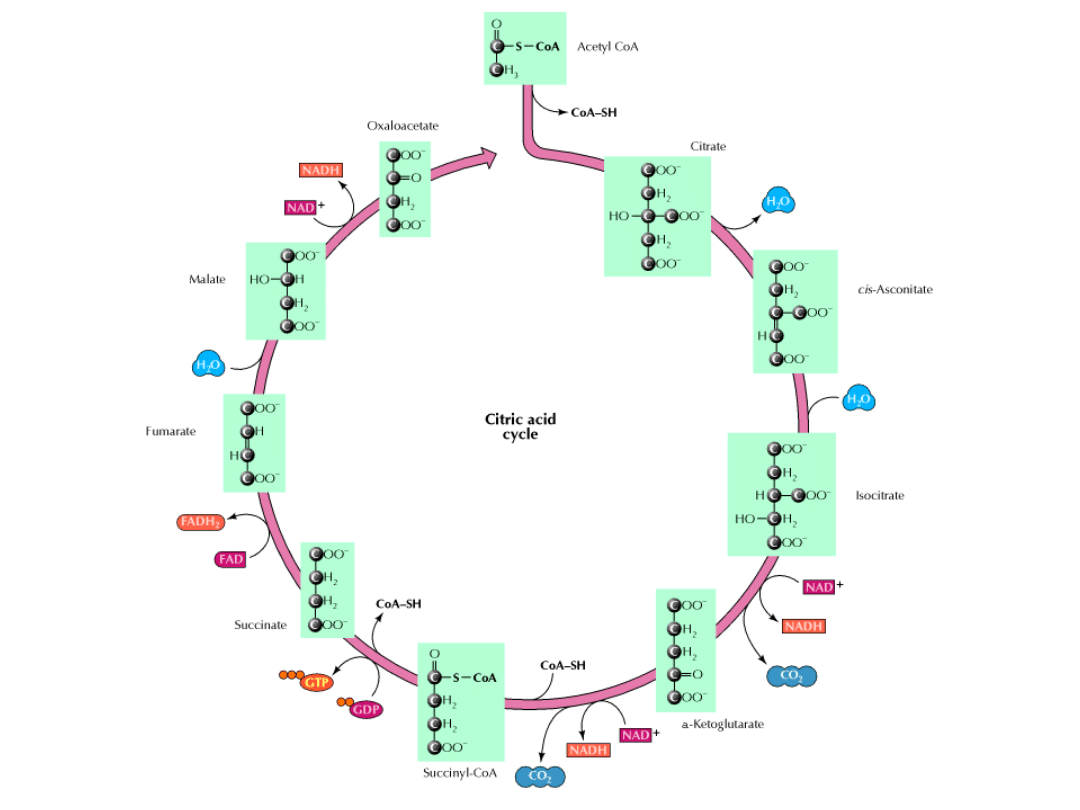
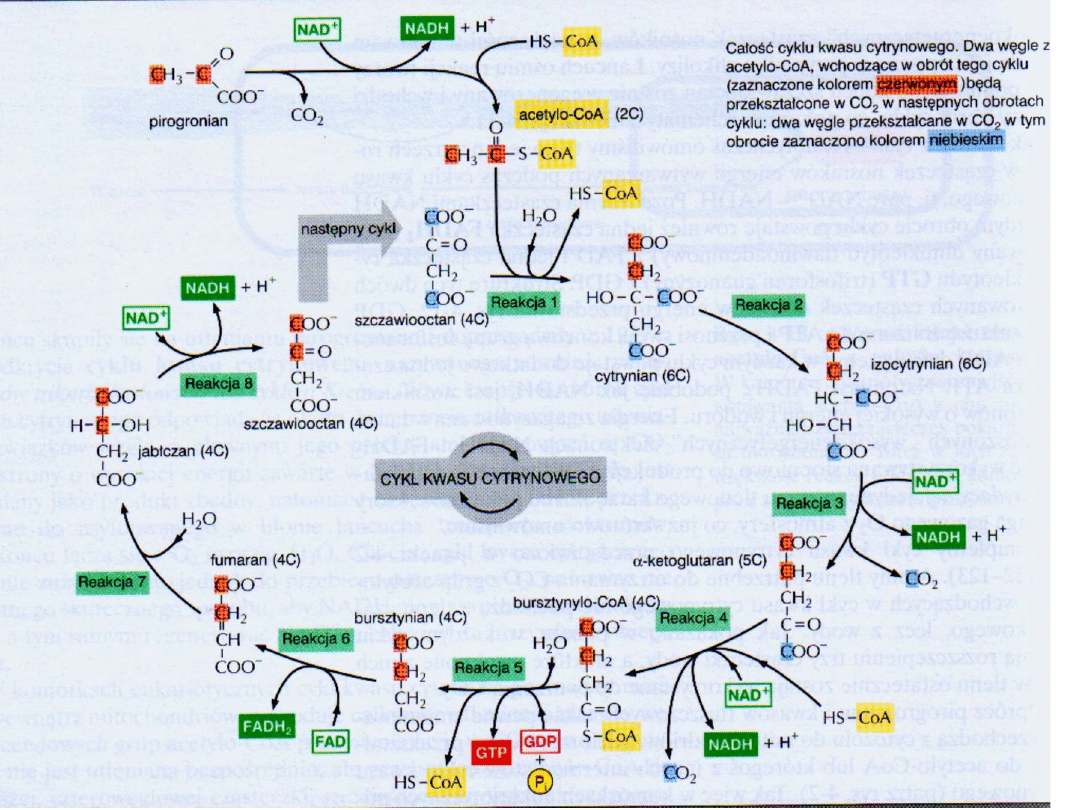
Cykl kwasu cytrynowego jest głównym ośrodkiem metabolicznym komórki.
Wprowadza do metabolizmu tlenowego wszystkie cząsteczki, które mogą zostać
przekształcone w grupy acetylowe lub kwasy dikarboksylowe.
Cykl obejmuje szereg reakcji utleniania i redukcji, w wyniku których grupa
acetylowa zostaje utleniona do 2 cząsteczek dwutlenku węgla.
„
Paliwem” w cyklu jest cząsteczka acetylo-CoA

POWSTAWANIE ACETYLO-CoA Z
PIROGRONIANU
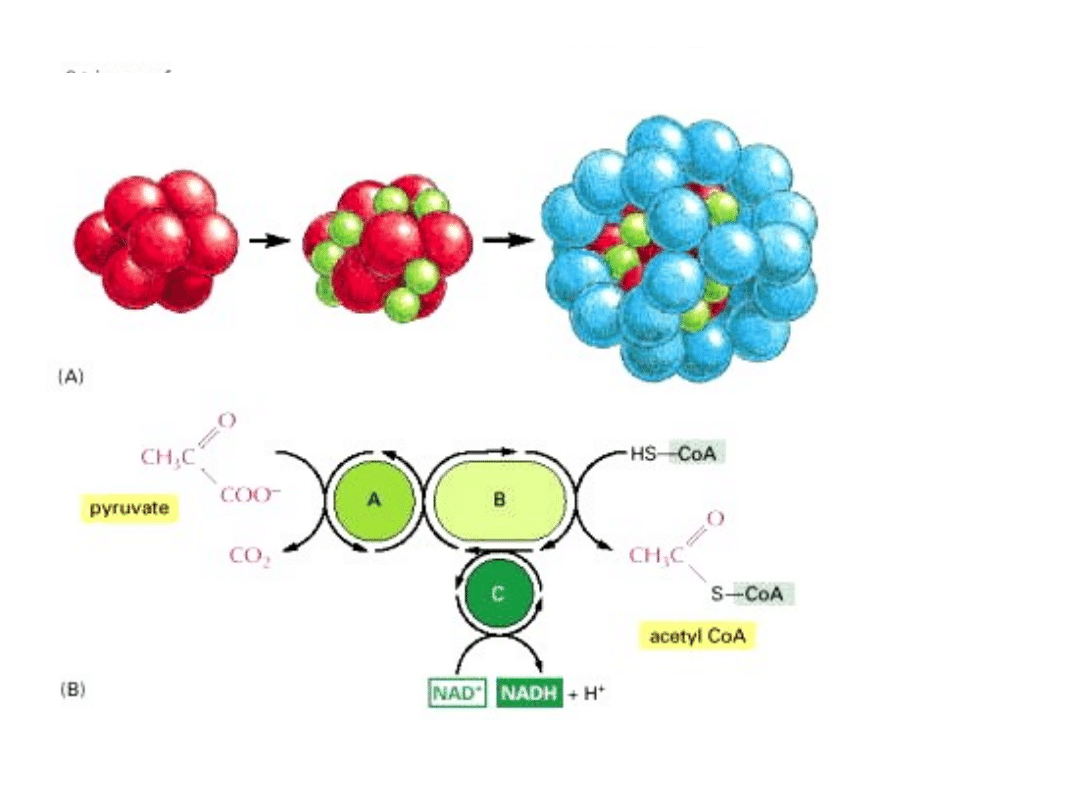
W warunkach tlenowych pirogronian zostaje przetransportowany do
mitochondriów.
W matriks mitochondrialnej pirogronian ulega oksydacyjnej
dekarboksylacji.
Jest to „pomost” pomiędzy glikolizą a cyklem kwasu cytrynowego.
pirogronian + CoA + NAD
+
acetylo-CoA + CO
2
+ NADH
TA REAKCJA JEST NIEODWRACALNA !!!!!
Enzym katalizujący –
KOMPLEKS DEHYDROGENAZY PIROGRONIANOWEJ
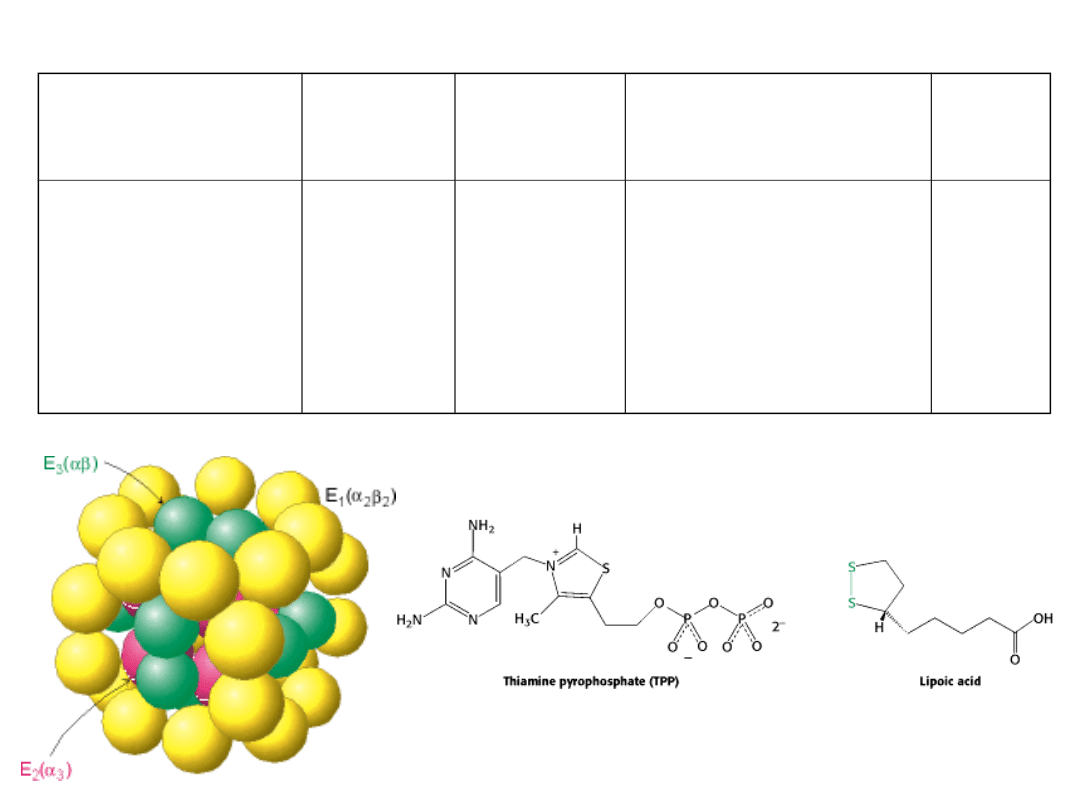
Jest to wielki kompleks trzech enzymów ściśle współpracujących ze
sobą.
Enzym
Liczba
łańcuchó
w
Grupa
prostetycz
na
Katalizowana
reakcja
Symbo
l
•Składnik o
aktywności
dehydrogenazy
pirogronianowej
Acetylotransferaza
dihydroliponianowa
•Dehydrogenaza
dihydroliponianowa
24
24
12
TPP
Lipoamid
FAD
Oksydacyjna
dekarboksylacja
pirogronianu
Przeniesienie grupy
acetylowej
Regeneracja utlenionej
formy lipoamidu
E
1
E2
E3
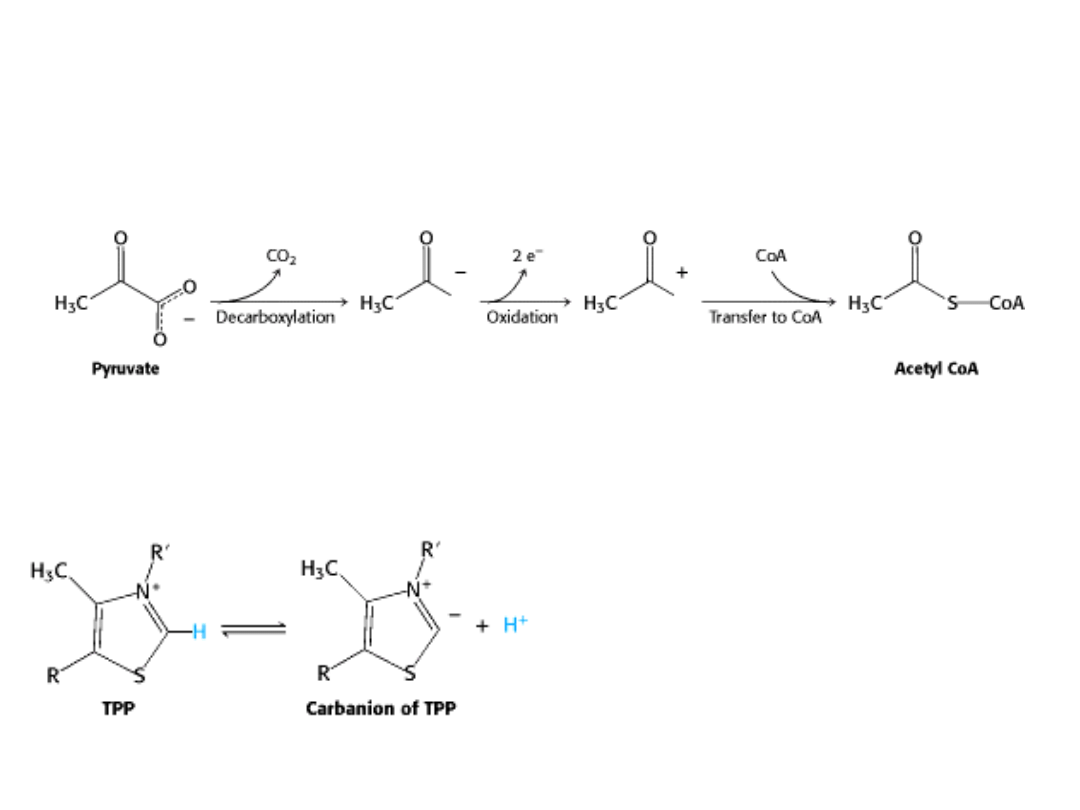
Przekształcanie pirogronianu w acetylo-CoA zachodzi w trzech etapach:
1. dekarboksylacja,
2. utlenianie,
3. przeniesienie grupy acetylowej na koenzym A.
I ETAP
W tym etapie pirogronian łączy się z pirofosforanem tiaminy i ulega dekarboksylacji
pierścień tiazolowy
Atom węgla w pierścieniu tiazolowym TPP,
znajdujący się pomiędzy atomami azotu
i siarki, jest bardziej kwaśny od większości
grup =CH- .
Wartość pK
a
wynosi ok. 10.
To centrum ulega JONIZACJI tworząc
KARBOANION, który szybko łączy się z
grupą karbonylową pirogronianu.
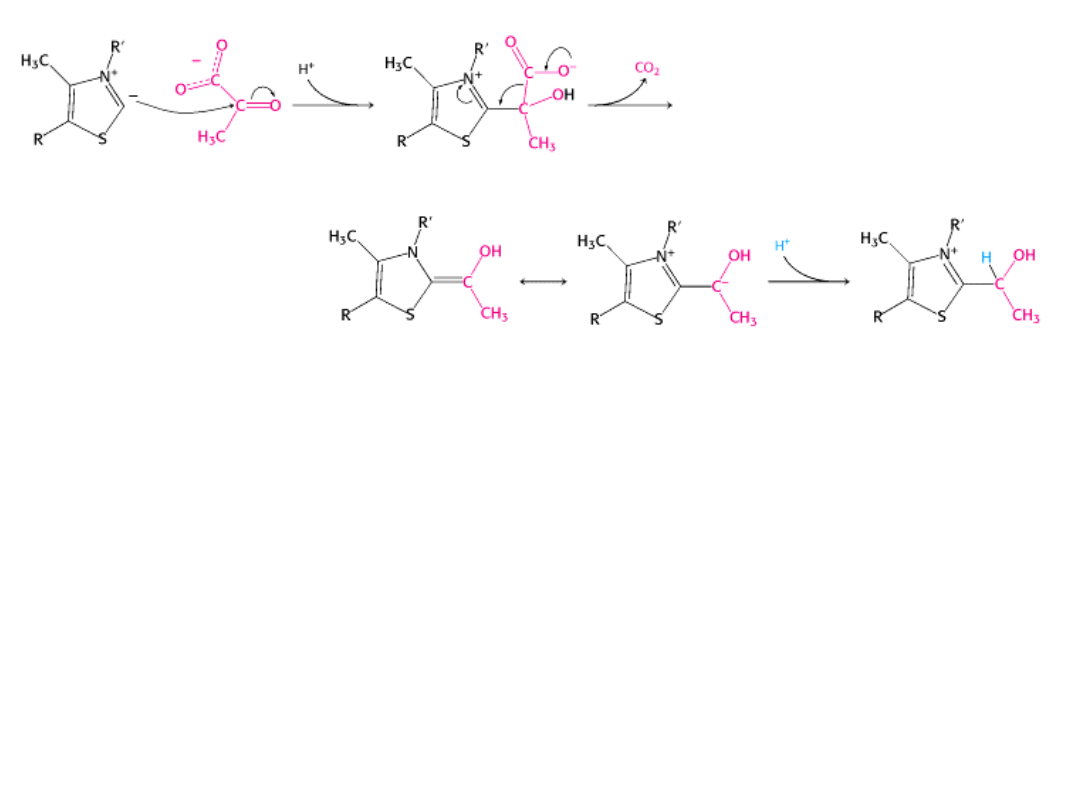
związek addycyjny
struktury rezonansowe hydroksyetylo-TPP
hydroksyetylo-TPP
pirogronian
1. Karboanion łączy się z grupą karbonylową pirogronianu i powstaje związek addycyjny.
Dodatnio naładowany pierścień TPP odciąga elektrony i stabilizuje ujemny ładunek
przenoszony na ten pierścień.
2. Dochodzi do dekarboksylacji pirogronianu.
3. Protonacja prowadzi do powstania pirofosforanu hydroksyetylotiaminy
(hydroksyetyleno-TPP).
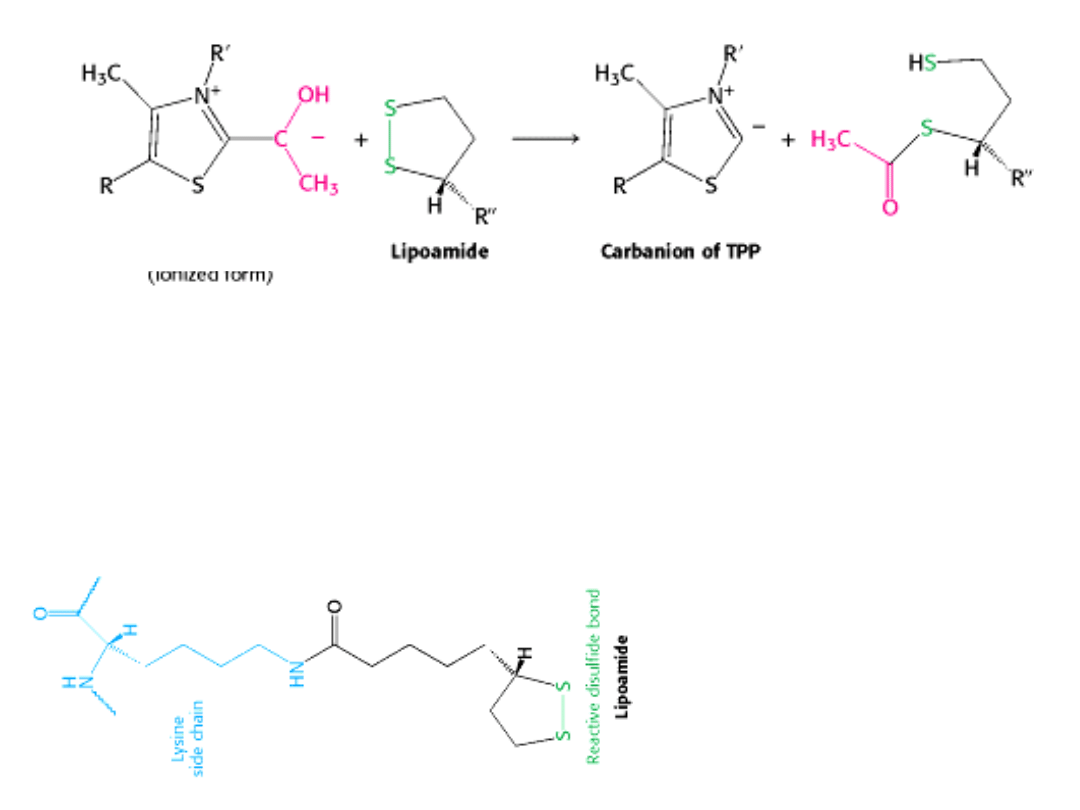
hydroksyetylo-TPP
acetylolipoamid
W tym etapie grupa hydroksyetylenowa przyłączona do TPP jest utleniana do grupy
acetylowej i jednocześnie przenoszona na lipoamid.
LIPOAMID
– pochodna kwasu liponowego związana z łańcuchem bocznym reszty
lizyny wiązaniem amidowym.
Utleniaczem w tej reakcji jest
wiązanie disiarczkowe lipoamidu,
które ulega redukcji do formy
dihydrosulfidowej.
Tworzy się
ACETYLOLIPOAMID
.
Ten etap jest także katalizowany przez
komponent E1 kompleksu dehydro-
genazy pirogronianowej.
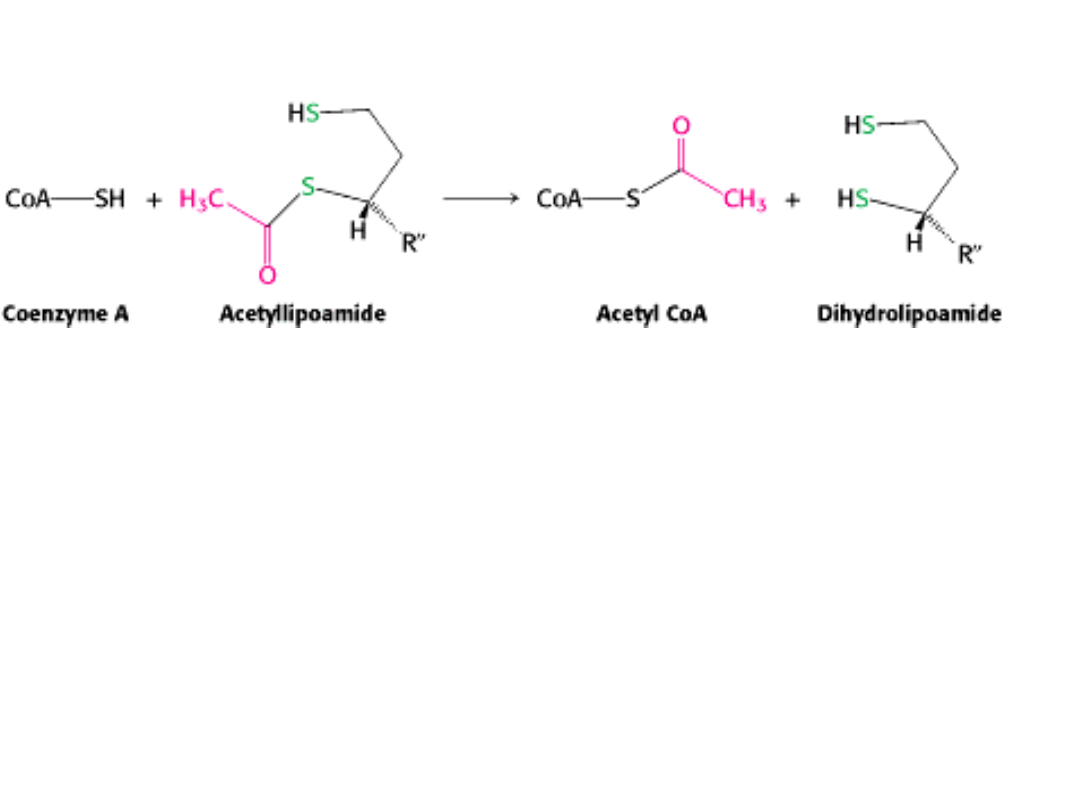
Trzeci etap polega na przeniesieniu grupy acetylowej z acetylolipoamidu na CoA
i utworzeniu acetylo-CoA.
Reakcję tę katalizuje
ACETYLOTRANSFERAZA DIHYDROLIPONIANOWA (E2).
Bogate energetycznie wiązanie tioestrowe zostaje zachowane w acetylo-CoA po przeniesie-
niu grupy acetylowej na CoA.
III ETAP
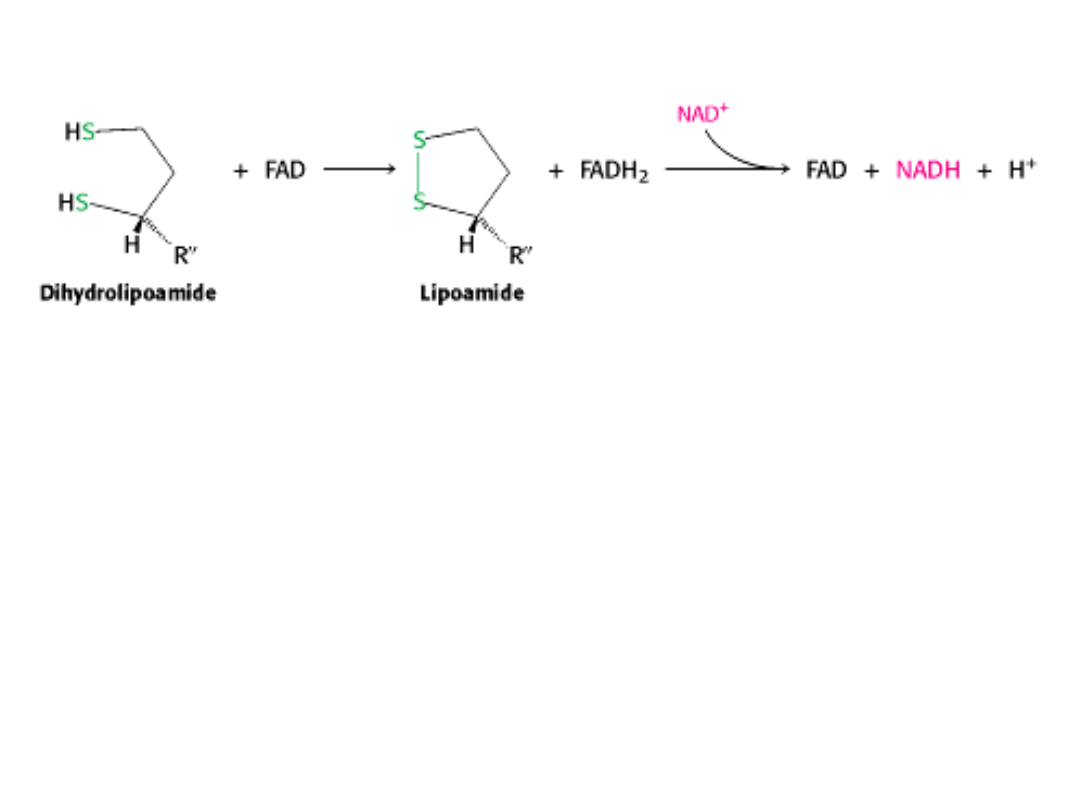
IV ETAP
Kompleks dehydrogenazy pirogronianowej nie może rozpocząć kolejnego cyklu katalitycz-
nego, dopóki dihydrolipoamid nie zostanie utleniony do lipoamidu.
Utleniona forma lipoamidu jest regenerowana przez
DEHYDROGENAZĘ
DIHYDROLIPONIANOWĄ (E3).
Dwa elektrony zostają przeniesione na grupę prostetyczna tego enzymu – FAD, a następnie
na NAD
+
.
Normalnie FAD przyjmuje elektrony od NADH. W tym przypadku jest owrotnie.
Jest to możliwe dzięki zmianie potencjału przenoszenia elektronów FAD, na skutek związania się
z enzymem.
Białka związane ściśle z FAD lub FMN nazywają się FLAWOPROTEINAMI.
8 trimerów
acetylotransferazy
6 dimerów
dehydrogenazy
dihydroliponianowej
12 dimerów składnika o aktywności
dehydrogenazy pirogronianowej
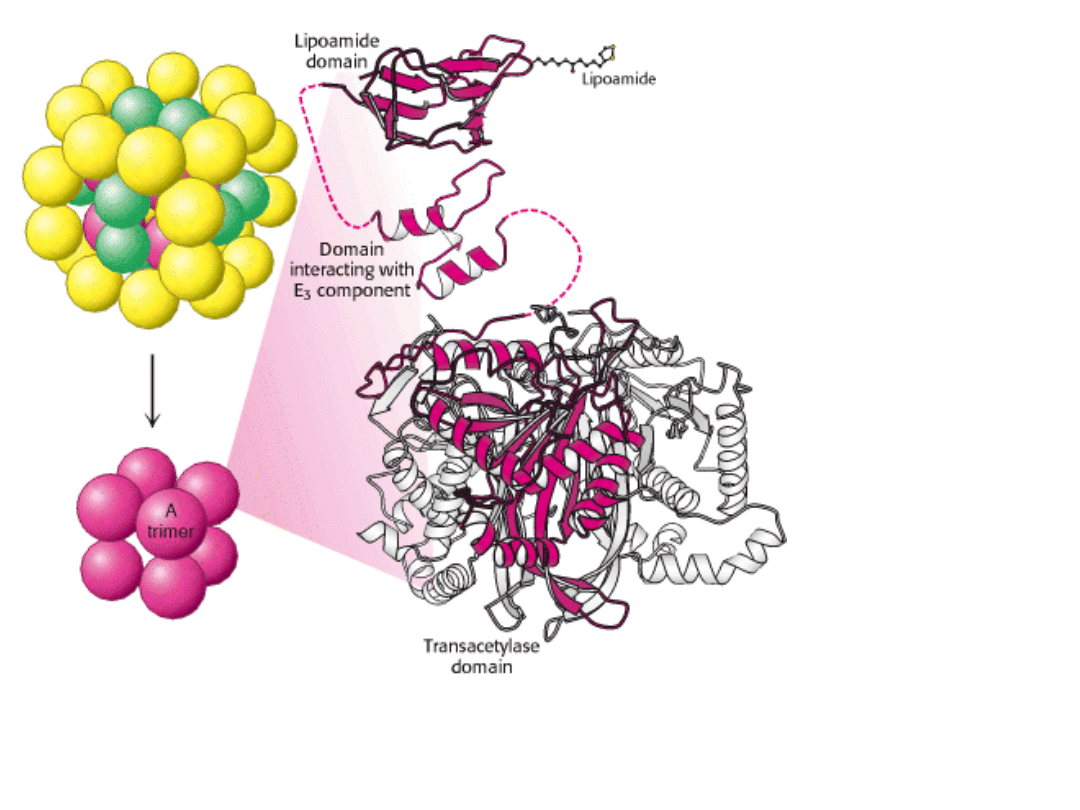
STRUKTURA RDZENIA
TWORZONEGO PRZEZ
ACETYLOTRANSFERAZĘ
Acetylotransferaza zawiera
8 katalitycznych trimerów
ułożonych w kształcie pustego
sześcianu.
Każda kulka przedstawia
trimer – 3 podjednostki E2
Każda podjednostka zawiera
trzy domeny.

W JAKI SPOSÓB MIEJSCA AKTYWNE ZA SOBĄ
WSPÓŁPRACUJĄ ?
1. Miejsce aktywne E1 znajduje się wewnątrz cząsteczki i jest połączone z
powierzchnią
enzymu hydrofobowym kanałem o długości 2 nm. Po dekarboksylacji pirogronianu
powstaje hydroksyetylo-TPP.
2. E2 wprowadza ramię lipoamido-lizynowe do kanału E1.
3. Grupa acetylowa jest przenoszona na lipoamid, a następnie acetylolipoamidowe
ramię opuszcza E1 i przez okienko o wymiarze 3 nm wchodzi do wnętrza
sześcianu, aby
połączyć się z miejscem aktywnym E2.
4. Grupa acetylowa zostaje przeniesiona na CoA, acetylo-CoA opuszcza sześcian,
natomiast zredukowane ramię przemieszcza się ruchem wahadłowym do centrum
E3.
5. W miejscu aktywnym E3 dihydrolipoamid zostaje utleniony.
6. Zregenerowany utleniony lipoamid szybko wchodzi do kolejnego cyklu reakcji.

REGULACJA AKTYWNOŚCI
DEHYDROGENAZY PIROGRONIANOWEJ
ZWIERZĘTA NIE POTRAFIĄ PRZEKSZTAŁCAĆ ACETYLO-CoA W GLUKOZĘ,
DLATEGO
TWORZENIE ACETYLO-CoA Z PIROGRONIANU JEST U NICH NIEODWRACALNE.
Aktywność Dehydrogenazy pirogronianowej jest ściśle regulowana na kilka
sposobów:
1. Hamowanie przez duże stężenie produktów reakcji
Acetylo-CoA hamuje aktywność acetylotransferazy (E2)
NADH hamuje aktywność dehydrogenazy dihydroliponianowej (E3).
2. Głównym mechanizmem regulacji jest
kowalencyjna modyfikacja składnika o
aktywności dehydrogenazy pirogronianowej (E1
).
A. Fosforylacja dehydrogenazy pirogronianowej (E1) przez specyficzną
kinazę hamuje aktywność kompleksu. Działanie specyficznej fosfatazy
przywraca tę aktywność.
B. Miejscem fosforylacji jest także transacetylaza (E2).
Zwiększenie stosunku NADH/NAD
+
, acetylo-CoA/CoA lub ATP/ADP wywołuje
fosforylację kompleksu aktywność zahamowana.
Pirogronian i ADP (mały ładunek energetyczny) HAMUJĄ kinazę
AKTYWUJĄ
dehydrogenazę.
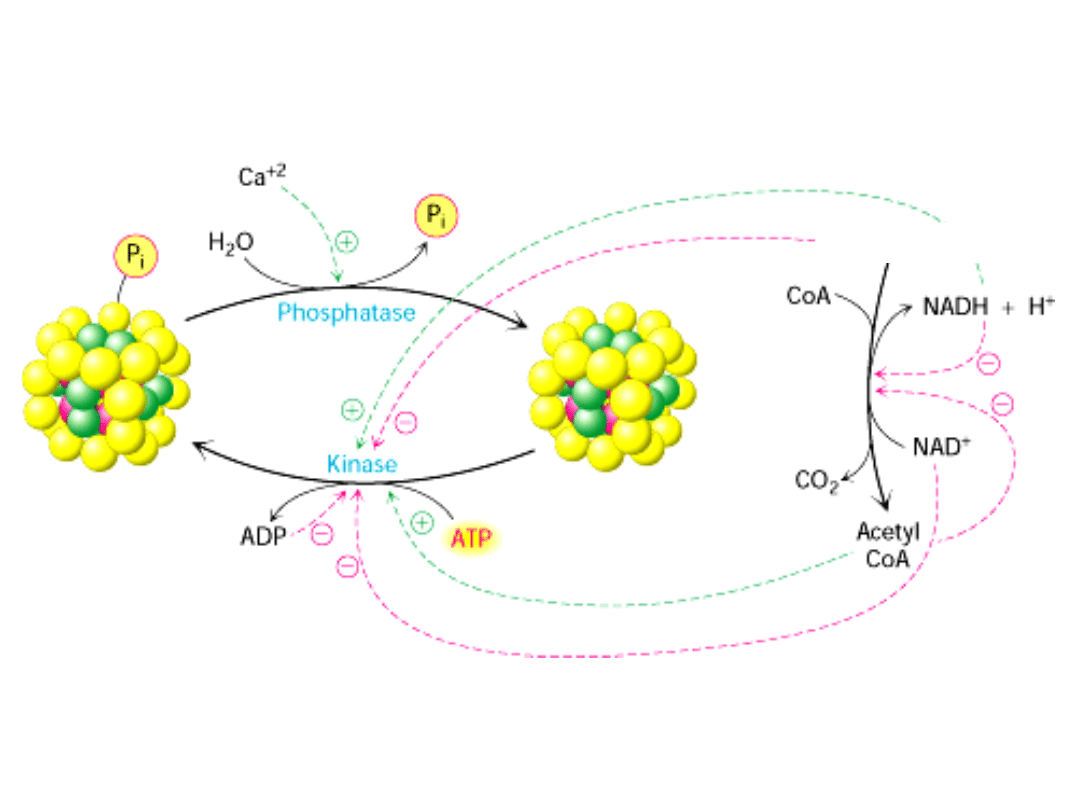
Dehydrogenaza
pirogronianowa
NIEAKTYWNA
Dehydrogenaza
pirogronianowa
AKTYWNA
Wazopresyna i agoniści receptorów α-adrenergicznych stymulują dehydrogenazę
pirogronianową, wpływając na stężenie wapnia.
Insulina stymuluje defosforylację kompleksu.
Pirogronian
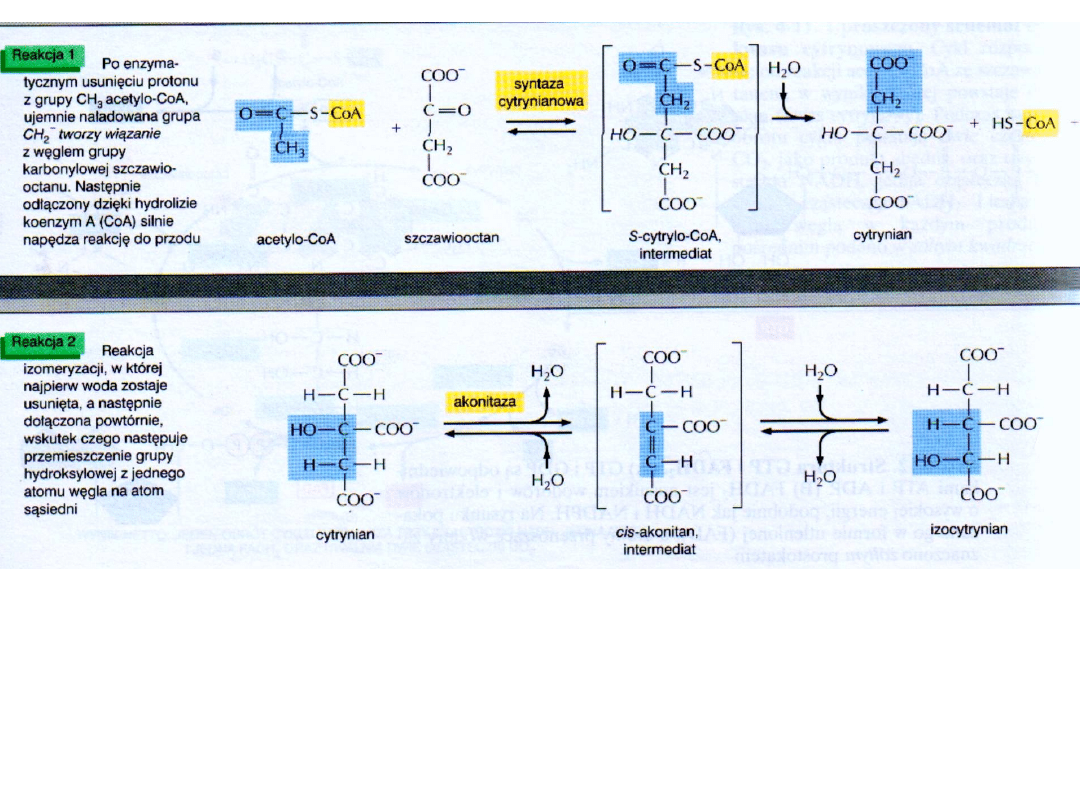
Położenie grupy hydroksylowej przy węglu 3 w cząsteczce cytrynianu uniemożliwia
przeprowadzenie dekarboksylacji oksydacyjnej. Może ona nastąpić dopiero po izomeryzacji
cytrynianu do izocytrynianu.
SYNTAZA CYTRYNIANOWA
Cykl kwasu cytrynowego zaczyna się od kondensacji związku czterowęglowego
(szczawiooctanu) z dwuwęglowym fragmentem acetylo-CoA.
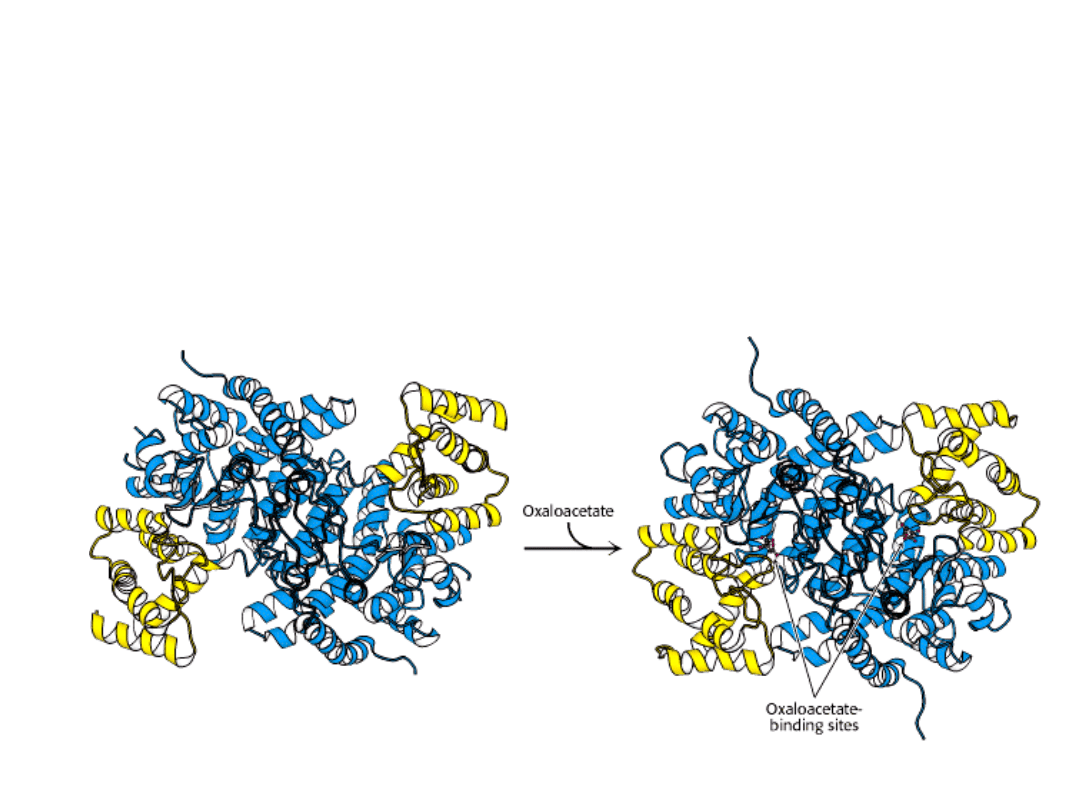
Syntaza cytrynianowa u ssaków jest dimerem.
Każde z miejsc aktywnych jest umieszczone w szczelinie, znajdującej się między dużą
(niebieski) i małą (żółty) domeną każdej podjednostki.
Enzym ten podczas katalizy ulega znacznym zmianom konformacyjnym.
Syntaza najpierw wiąże szczawiooctan.
Szczawiooctan
indukuje w syntazie dużą zmianę konformacyjną, prowadzącą
do utworzenia miejsca wiązania dla acetylo-CoA
. forma zamknięta.
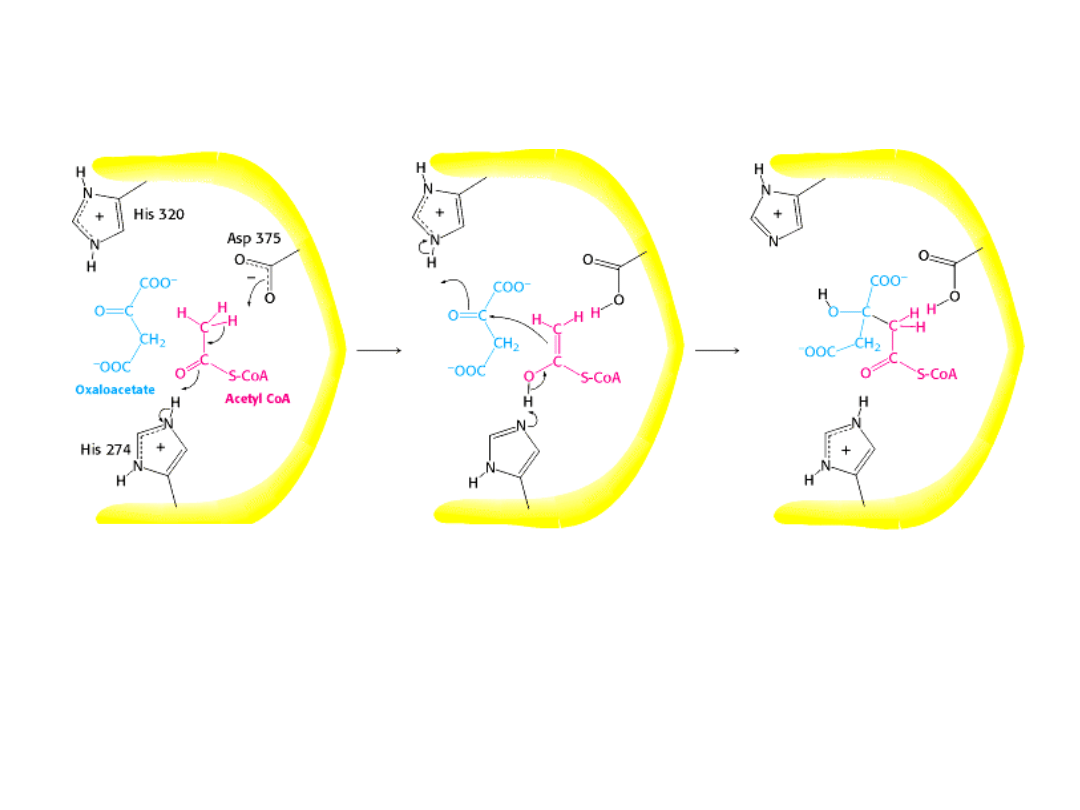
Syntaza cytrynianowa katalizuje reakcję kondensacji przez bliskie
zestawienie substratów,
odpowiednie ich zorientowanie przestrzenne i polaryzację określonych
wiązań.
Kluczową rolę odgrywają tu dwie reszty histydyny i reszta asparaginianu.
intermediat enediolowy
kompleks z cytrynylo-CoA
kompleks z substratem
His 274 oddaje proton na tlen grupy
karbonylowej Acetylo-CoA,co ułatwia
usunięcie protonu z grupy metylowej
przez Asp375.
Przeniesienie protonu z
His 320 na atom węgla gr.
karbonylowej szczawiooctanu
aktywuje go. Nastepnie w wyni-
ku oddziaływania enolu
acetylo-CoA z węglem grupy
karbonylowej zaktywowanego
szczawiooctanu powstaje
wiązanie węgiel-węgiel.
Utworzony cytrynylo-CoA indu-
kuje w enzymie dalsze zmiany
konformacyjne.
Miejsce aktywne całkowicie się
zamyka. His 274 bierze udział w
hydrolizie tioestru, ponownie
jako donor protonu.

ZNACZENIE INDUKOWANEGO
DOPASOWANIA
• Funkcją syntazy cytrynianowej jest hydroliza cytrynylo-CoA , a
nie acetylo-CoA.
• Acetylo-CoA nie połączy się z enzymem, dopóki szczawiooctan
nie zostanie związany, czyli będzie gotowy do kondensacji.
• Katalityczne reszty, decydujące o hydrolizie wiązania
tioestrowego, nie są ustawione w odpowiedniej pozycji, zanim
nie zostanie wytworzony cytrynylo-CoA.
INDUKOWANE DOPASOWANIE ZAPOBIEGA NIEPOŻĄDANEJ REAKCJI
UBOCZNEJ.
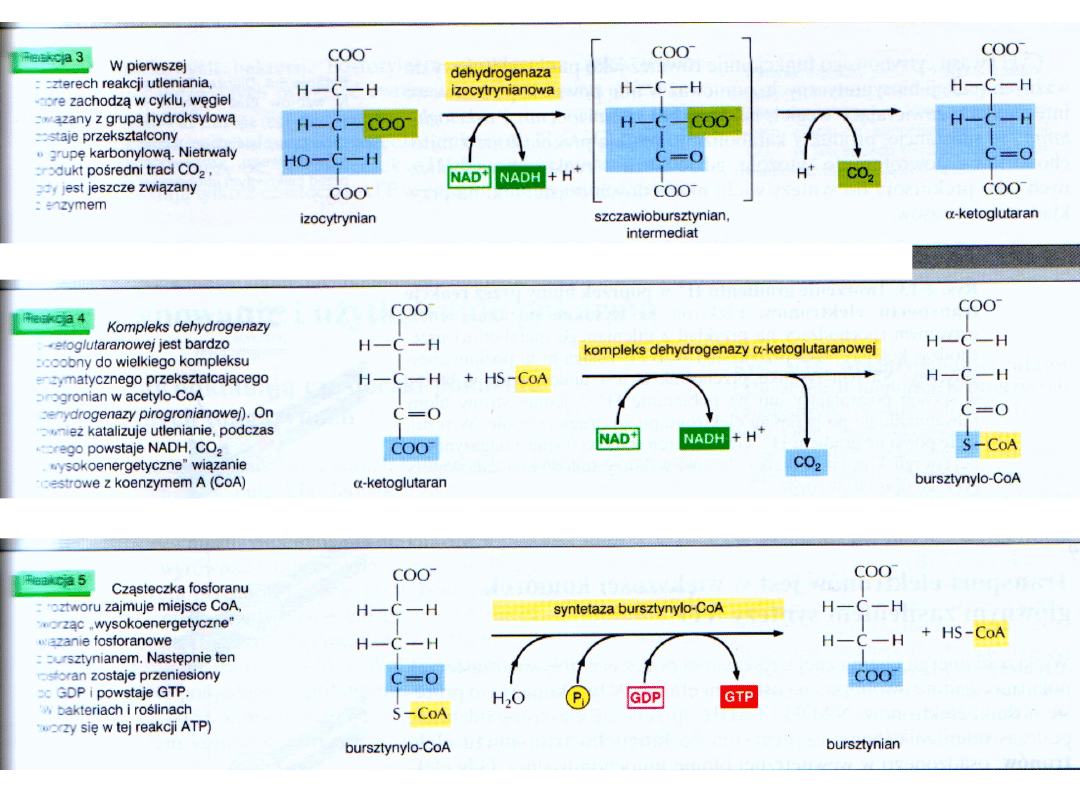
Kompleks dehydrogenazy
α-ketoglutaranowej wykazuje homologię z k. dehydrogenazy pirogronianowej
Szybkość tworzenia α-ketoglutaranu decyduje o szybkości działania całego cyklu.
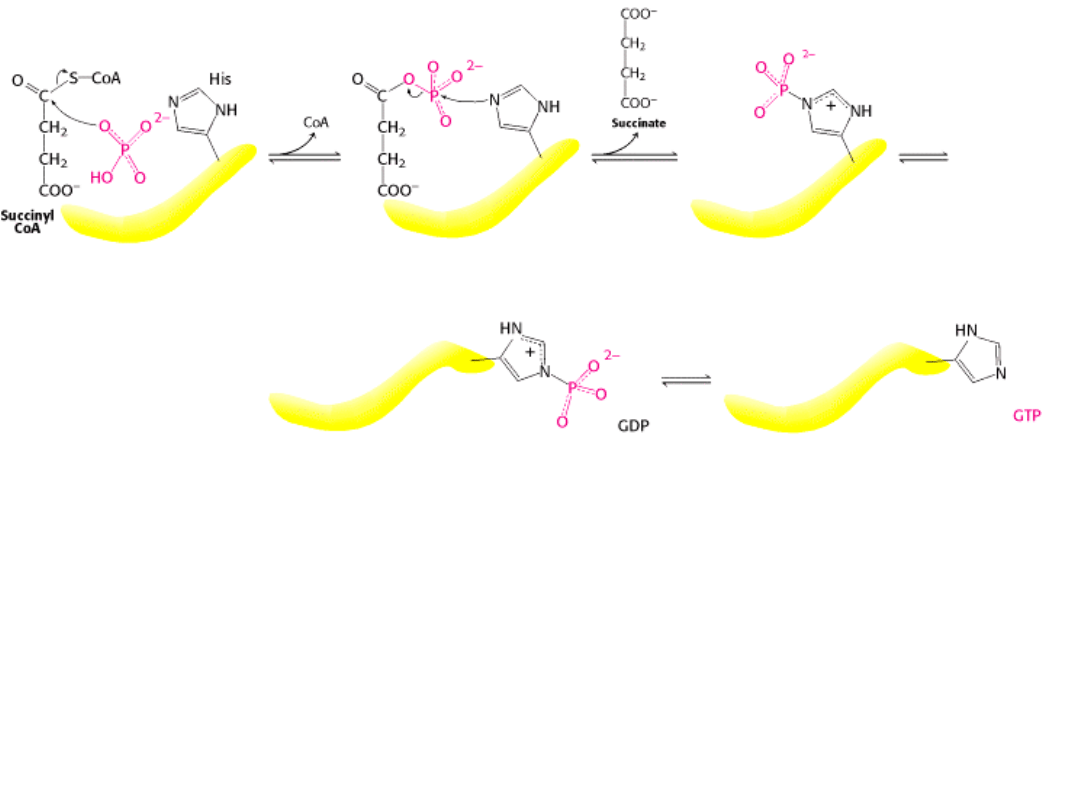
1. Reakcja rozpoczyna się od wymiany CoA na ortofosforan` powstaje inny związek
wysokoenergetyczny – BURSZTYNYLOFOSFORAN.
2. Reszta His syntetazy bursztynylo-CoA przyłącza grupę fosforanową powstaje
BURSZTYNIAN I FOSFOHISTYDYNA.
3. Ufosforylowana reszta histydyny obraca się w kierunku difosforanu nukleozydu i
przenosi na niego grupę fosforanową tworzy się trifosforan nukleozydu.
Syntetaza bursztynylo-CoA współdziała specyficznie z GDP lub ADP (zależnie od organizmu).
Jest to jedyny etap cyklu kwasu cytrynowego, na którym bezpośrednio, w rezultacie
FOSFORYLACJI SUBSTRATOWEJ, powstaje związek o wysokim potencjale przenoszenia
grup fosforanowych
.
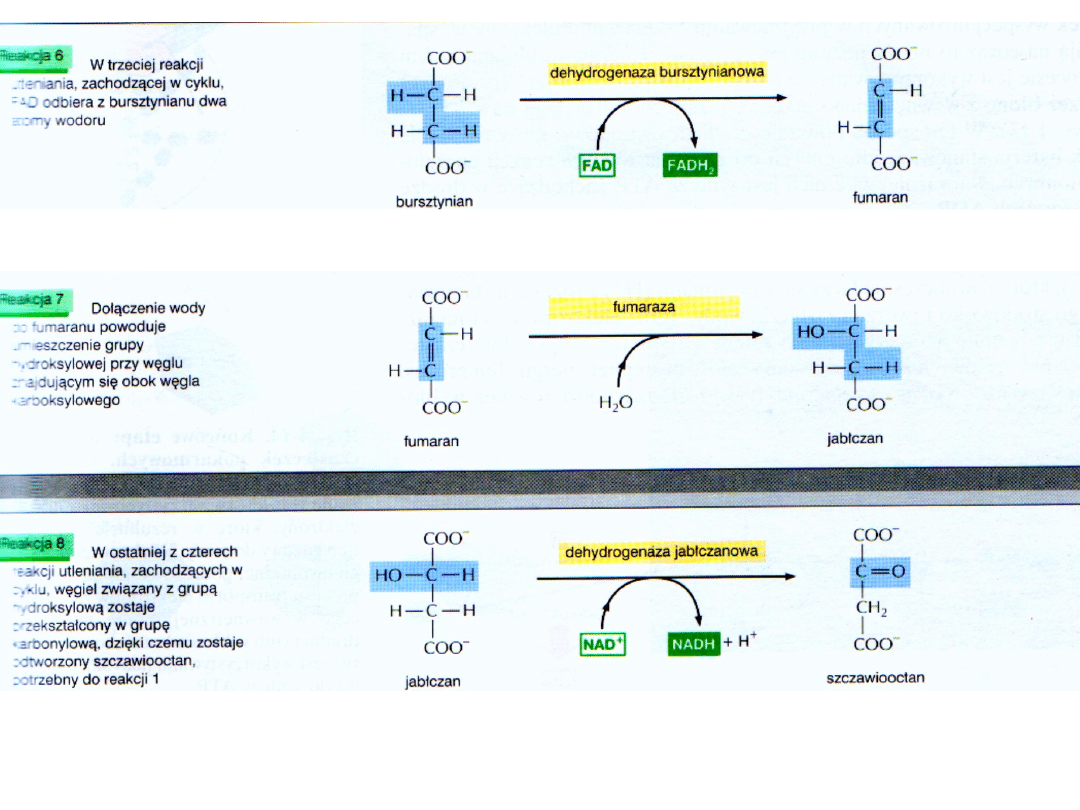
Akceptorem elektronow jest FAD, ponieważ zmiana energii swobodnej tej reakcji jest niewystarczająca do
zredukowania NAD
+
.
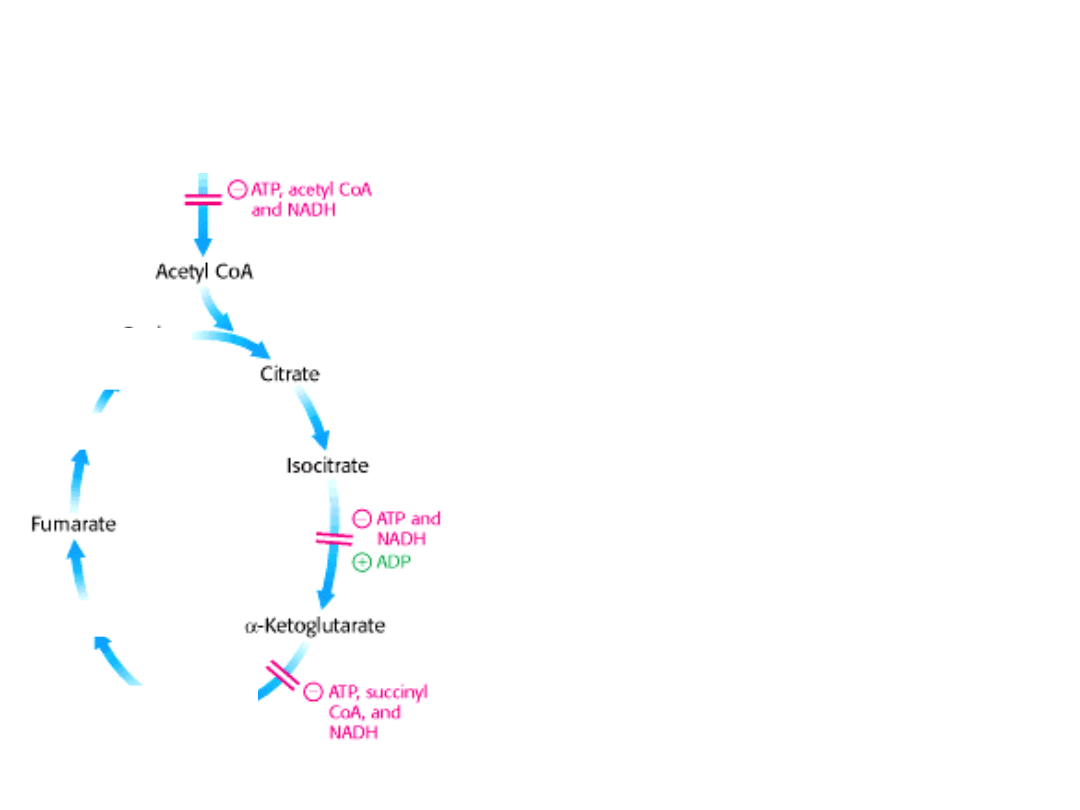
REGULACJA CYKLU KWASU
CYTRYNOWEGO
Jabłczan
Bursztynian
Szczawio
octan
Bursztynylo
CoA
Pirogronian
1. Dehydrogenazę izocytrynianową stymuluje
allosterycznie ADP większe powinowactwo do
substratów.
Wiązanie izocytrynianu, NAD
+
, Mg
2+
i ADP jest
wzajemnie kooperatywne.
NADH hamuje enzym przez bezpośrednie
wypieranie NAD
+
.
2. Regulacja dehydrogenazy α-ketoglutaranowej.
Hamowana przez produkty katalizowanej przez nią
reakcji – bursztynylo-CoA i NADH;
hamowana przez duży ładunek energetyczny
komórki.
1.
2.
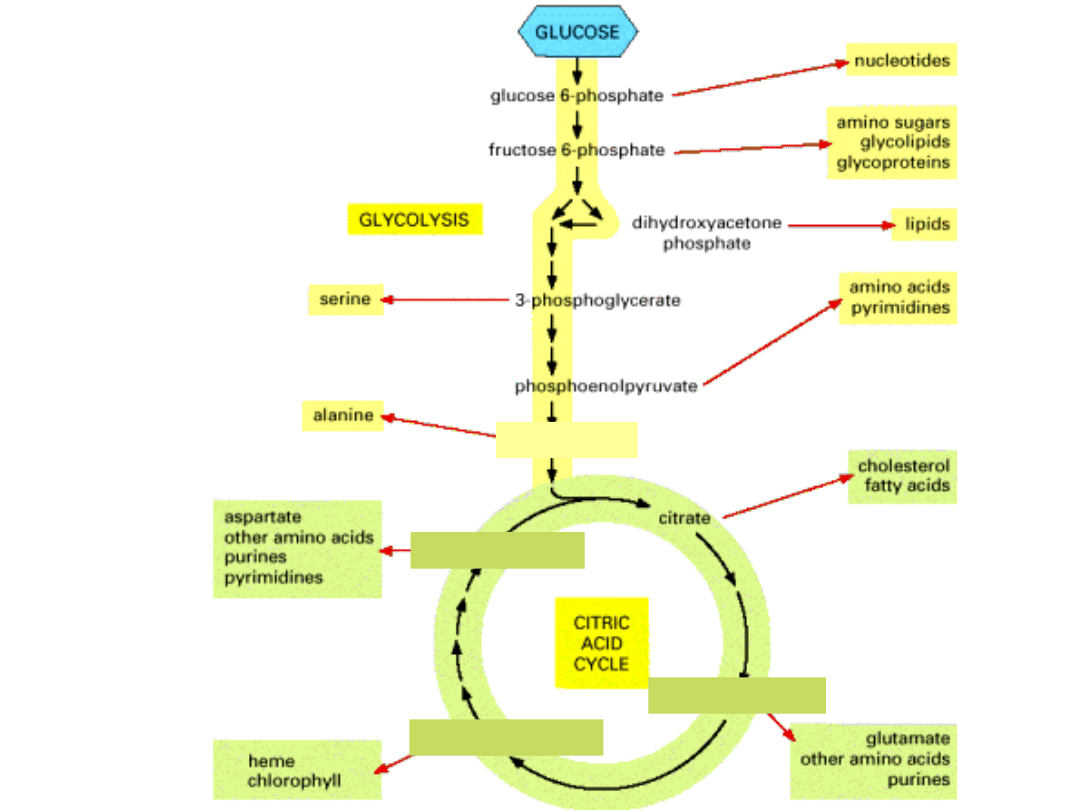
szczawiooctan
bursztynylo-CoA
α-ketoglutaran
pirogronian
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
Biochemia 7K Cykl kwasu cytrynowego
Cykl Krebsa cykl kwasu cytrynowego
Cykl Krebsa, cykl kwasu cytrynowego
14 BIOCHEMIA cykl kwasu cytrynowego 2id 15387 ppt
Cykl kwasu cytrynowego
Oleksyszyn, Biochemia II, zagadnienia do cykl kwasu cytrynowego
Cykl kwasu cytrynowego Krbsa
12 BIOCHEMIA cykl kwasu cytrynowegoid 13424 ppt
Biochemia wykład 14 Cykl kwasu cytrynowego
Biochemia 7 Cykl kwasu cytrynowego
11 Biochemia cykl kwasu cytrynowego
Biochemia 7K Cykl kwasu cytrynowego
glikoliza i cykl kwasu cytrynowego reakcje
więcej podobnych podstron