
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie, publiczne odtwarzanie i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można
dowolnie modernizować na potrzeby własne oraz do wykorzystania w szkołach podczas zajęć dydaktycznych.


SPIS TREŚCI
REAKCJE ZOBOJETNIANIA
HYDROLIZA SOLI
Rozpuszczalność
Jest to wielkość, którą wyznacza się doświadczalnie i wyraża
ona masę substancji rozpuszczonej wyrażoną w gramach, którą
możemy rozpuścić w 100 gramach rozpuszczalnika w określonej
temperaturze i ciśnieniu z utworzeniem roztworu nasyconego.
100
m
m
R
rozp
subst
m
s
– masa substancji rozpuszczonej w roztworze nasyconym w [g] ; m
rozp
– masa rozpuszczalnika w [g].
Każdą substancję można zaliczyć do jednej z trzech grup:
substancja praktycznie nierozpuszczalna (rozpuszczalność poniżej 0,1g
w 100g wody),
substancja słabo rozpuszczalna (rozpuszczalność w granicach 0,1-1g w
100g wody ),
substancja dobrze rozpuszczalna (rozpuszczalność ponad 1g w 100g
wody ).
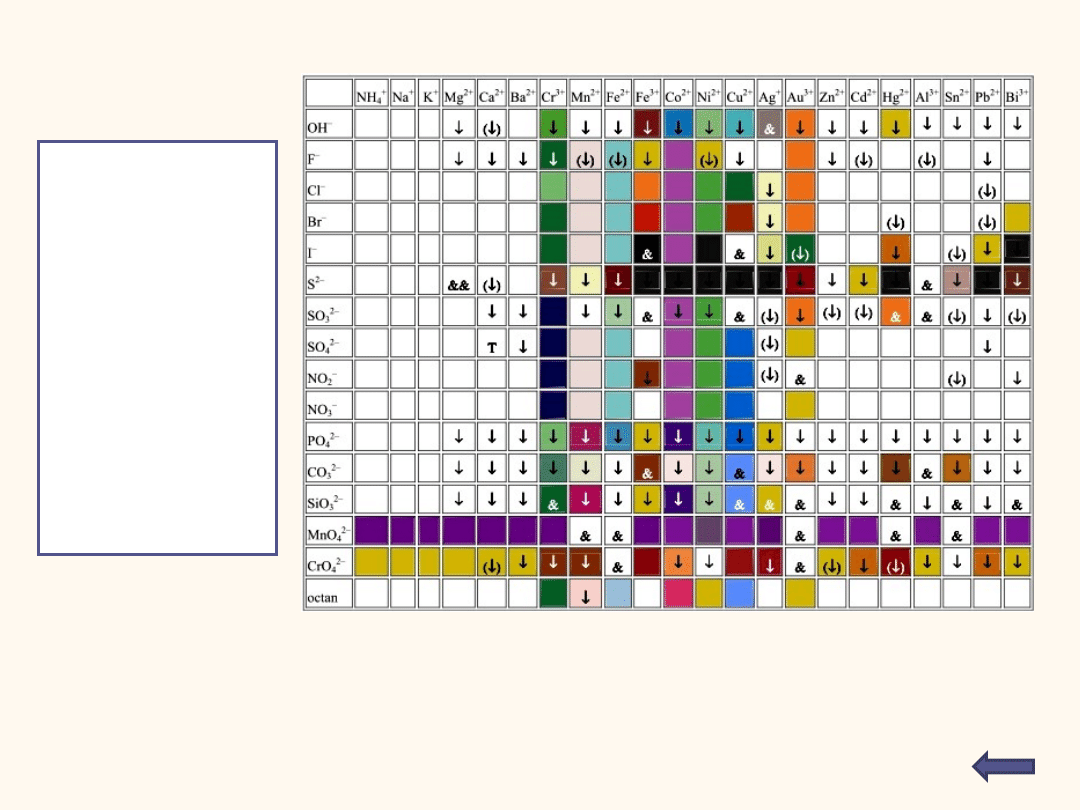
Tabela rozpuszczalności
Podane symbole wskazują co stanie się po zmieszaniu wodnych roztworów zawierających dane
jony:
puste pole oznacza iż związek powstający w wyniku reakcji jest dobrze rozpuszczalny w
wodzie
(↓) - substancja o niewielkiej rozpuszczalności, strąca się przy odpowiednim stężeniu
roztworu
↓ - substancja praktycznie nierozpuszczalna, strąca się z rozcieńczonych roztworów
& - zachodzą skomplikowane reakcje, lub substancja nie została otrzymana
Kolor tła odzwierciedla (w przybliżeniu) charakterystyczną barwę substancji
W tabeli
odszukujemy w
kolumnie
odpowiedni
anion, a w
wierszach
szukamy kationu.
Na skrzyżowaniu
znajduje się
informacja, czy
połączenie obu
jonów daje trudno
rozpuszczalny
osad.

STRĄCANIE OSADU
Po zmieszaniu dwóch roztworów zawierających jony pochodzące z
dysocjacji dwóch różnych substancji rozpuszczalnych w wodzie może
dojść do powstania nowej substancji, praktycznie nie rozpuszczalnej w
wodzie, czyli do strącenia osadu.
Reakcja strąceniowa jest to reakcja między jonami, które
łącząc się, dają trudno rozpuszczalny związek.
Reakcje strącania osadów dzieli się na 3 typy:
tworzenie trudno rozpuszczalnych soli
Ag
+
+ Cl¯ → AgCl↓,
tworzenie trudno rozpuszczalnych wodorotlenków
Cu
2+
+ 2OH¯ → Cu(OH)
2
↓,
tworzenie trudno rozpuszczalnych kwasów
SiO
3
2-
+ 2H
+
→ H
2
SiO
3
↓.
PRZYKŁAD
PRZYKŁAD
Korzystając z tabeli rozpuszczalności napisz w postaci cząsteczkowej i
jonowej :
A. Równanie reakcji chlorku wapnia z węglanem potasu
B. azotanu(V) żelaza(III) z zasadą sodową
3
2
3
2
3
2
3
2
3
3
2
2
CaCO
CO
Ca
2Cl
2K
CaCO
CO
2K
2Cl
Ca
2KCl
CaCO
CO
K
CaCl
3
3
3
3
3
3
3
3
3
3
Fe(OH)
3OH
Fe
3NO
3Na
Fe(OH)
3OH
3Na
3NO
Fe
3NaNO
Fe(OH)
3NaOH
)
Fe(NO

ILOCZYN ROZPUSZCZALNOŚCI
Nie ma związków całkowicie nierozpuszczalnym w danym
rozpuszczalniku.
Każda substancja rozpuszcza się w mniejszym lub większym stopniu.
W przypadku trudno rozpuszczalnych soli ta część soli, która uległa
rozpuszczeniu jest całkowicie zdysocjowana na jony.
W nasyconym roztworze soli występuje stan równowagi, między
osadem a częścią rozpuszczoną.
Stan równowagi jest stanem dynamicznym – jedne jony przechodzą z
kryształu do roztworu, a inne powracają z roztworu do fazy krystalicznej.
Pojęcie iloczynu rozpuszczalności stosuje się tylko do elektrolitów trudno
rozpuszczalnych!
Iloczyn rozpuszczalności jest to iloczyn stężeń jonów trudno
rozpuszczalnego elektrolitu w jego roztworze nasyconym, w danej
temperaturze.
W przypadku soli dysocjujących na dwa lub więcej jonów tego samego
rodzaju ich stężenia wyraża się w odpowiednich potęgach
Iloczyn rozpuszczalności jest to iloczyn stężeń jonów trudno
rozpuszczalnego elektrolitu w jego roztworze nasyconym, w danej
temperaturze.
W przypadku soli dysocjujących na dwa lub więcej jonów tego samego
rodzaju ich stężenia wyraża się w odpowiednich potęgach

Dysocjującej według
równania:
m
n
n
m
nB
mA
B
A
Iloczyn rozpuszczalności K
s
ma
postać:
n
m
m
n
s
]
[B
]
[A
K
gdzie: [A
n+]
– stężenie molowe kationów;
[B
m-
] – stężenie molowe anionów
Wartości iloczynów rozpuszczalności dla różnych substancji są dostępne
w postaci tabel i mają zastosowanie podczas określania warunków w
jakich wytrącają się osady.
Jeśli w roztworze są obecne dwa jony, które dają z jonem wprowadzonym
do roztworu trudno rozpuszczalne osady, to najpierw wytraci się osad
trudniej rozpuszczalny ( mniejsza wartość iloczynu rozpuszczalności)
przykła
d
przykła
d
Z roztworu zawierającego jony Cl
-
i I
-
po dodaniu jonów srebra, najpierw
wytraci się osad AgI ( K = 1,5∙10
-16
) później osad AgCl ( K =1,5∙10
-10
).

ZADANIA
ZADANIA
Napisz wyrażenie na iloczyn rozpuszczalności następujących soli:
CaCO
3
; PbCl
2
; Pb
3
(PO
4
)
2
2
3
4
3
2
S
2
2
S
2
3
2
]
[PO
]
[Pb
K
]
[Cl
]
[Pb
K
]
[CO
]
[Ca
K
S
Do 0,5 dm
3
0,008 molowego roztworu CaCl
2
dodano 0,5 dm
3
0,008
molowego roztworu Na
2
SO
4
. Czy w danych warunkach strąci się osad
CaSO
4
?
Dane:
C
m
CaCl
2
=0,008mol/dm
3
C
m
Na
2
SO
4
=0,008 mol/dm
3
VCaCl
2
=0,5 dm
3
VNa
2
SO
4
= 0,5 mol/dm
3
Wartość iloczynu rozpuszczalności CaSO
4
K
s
= 2,4*10
-5
2NaCl
CaSO
SO
Na
CaCl
4
4
2
2
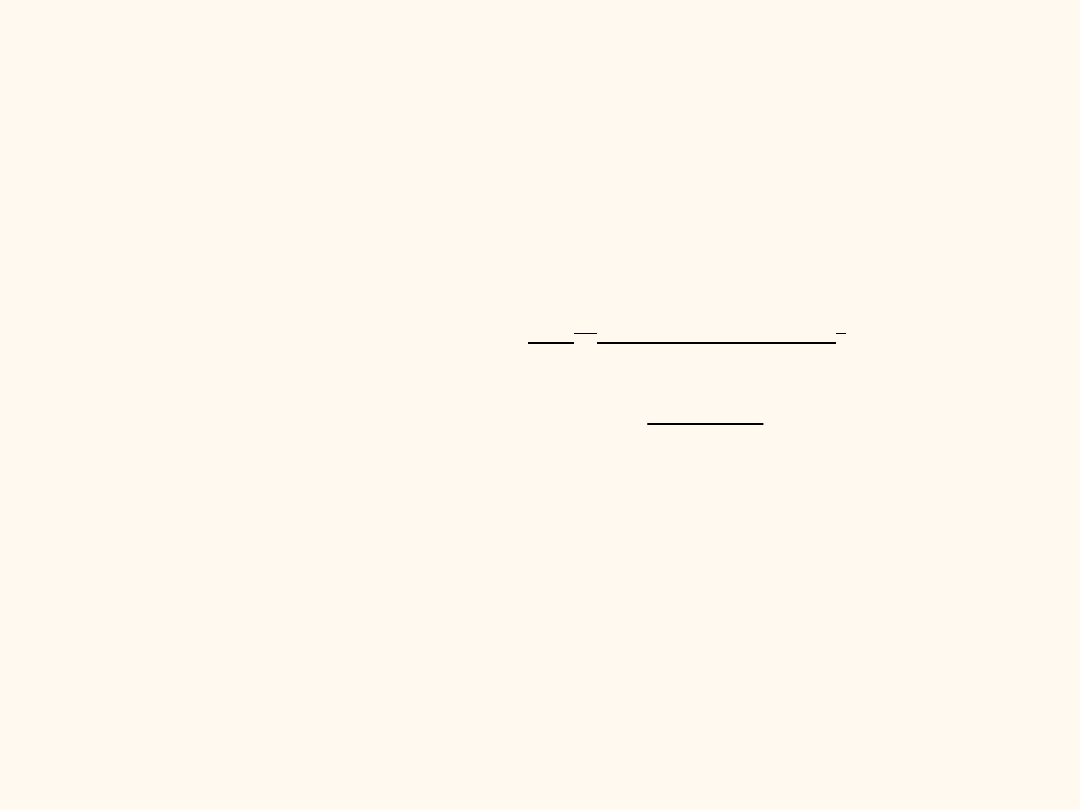
Ks = [Ca
2+
][SO
4
2-
]
Obliczmy stężenie jonów Ca
2+
po zmieszaniu roztworów
Przed zmieszaniem C
m
[Ca
2+]
wynosiło 0,008mol/dm
3
0,008 mola – 1 dm
3
0,004 mola – 0,5dm
3
Objętość roztworu po zmieszaniu V = 0,5dm
3
+0,5 dm
3
Stężenie jonów Ca
2+
po zmieszaniu [Ca
2+
] = 0,004 mol/dm
3
5
2
4
2
10
1,6
[0,004]
[0,004]
]
[SO
]
[Ca
Wartość iloczynu rozpuszczalności CaSO
4
K
s
= 2,4*10
-5
1,6∙ 10
-5
< K
s
Strącanie osadu soli trudno rozpuszczalnych zaczyna się po
przekroczeniu takich stężeń jonów, których iloczyn ma wartość K
so
tej soli;
Roztwór siarczanu(VI) wapnia jest nienasycony więc osad się nie
strąci.

Sprawdź czy wytrąci się osad PbCl
2
o iloczynie rozpuszczalności równym
K=1,6.10
-5
jeżeli zmieszamy ze sobą 200 cm
3
0,01 molowego roztworu
Pb(NO3)
2
z 800 cm
3
0,02 molowego roztworu NaCl.
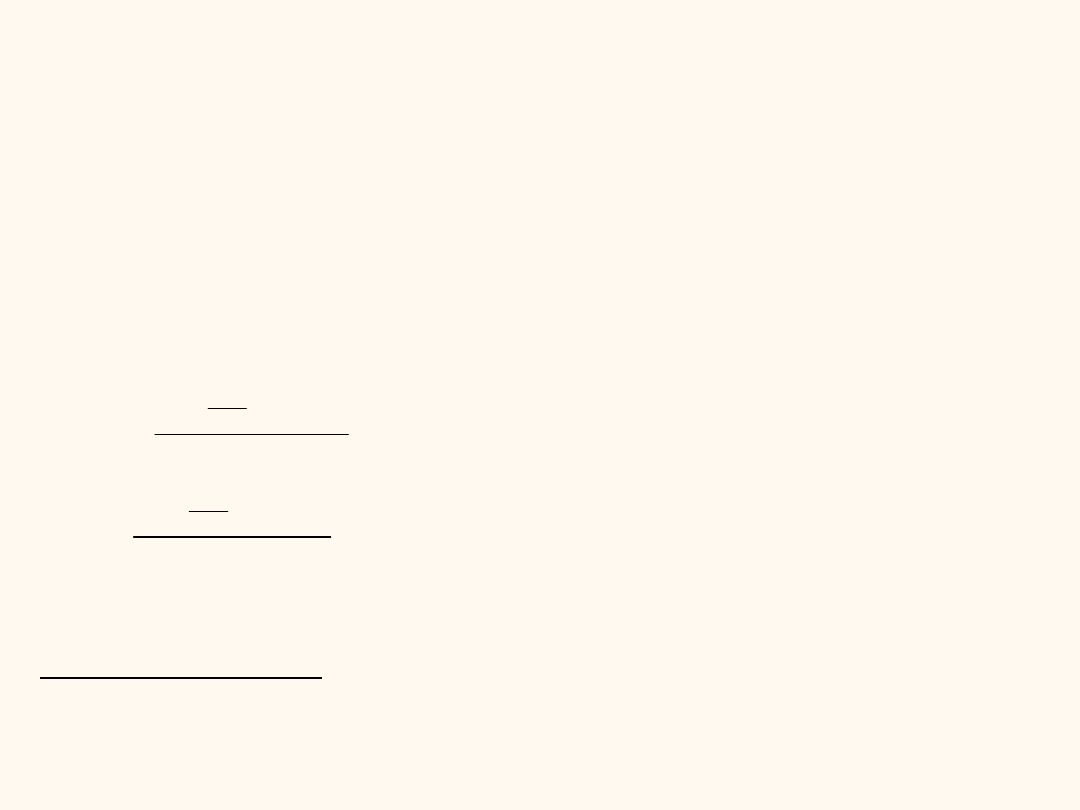
Sprawdź czy wytrąci się osad PbCl
2
o iloczynie rozpuszczalności równym
K=1,6.10
-5
jeżeli zmieszamy ze sobą 200 cm
3
0,01 molowego roztworu
Pb(NO3)
2
z 800 cm
3
0,02 molowego roztworu NaCl.
Dane:
[Pb(NO
3
)
2
] = 0,01 mol/dm
3
[NaCl] = 0,02 mol/dm
3
V
1
= 200 cm
3
= 0,2 dm
3
V
2
= 800 cm
3
= 0,8 dm
3
K=1,6
.
10
-5
2NaCl + Pb(NO
3
)
2
= PbCl
2
+2NaNO
3
PbCl
2
= Pb
2+
+2Cl
-
x =[Pb
2+
][Cl
-
]
2
(V = V
1
+V
2
= 0,2dm
3
+ 0,8dm
3
=1dm
3
)
∙
3
3
3
3
dm
mol
2
mol/dm
10
2
1dm
0,2dm
0,01
]
[Pb
3
3
2
3
3
dm
mol
mol/dm
10
1,6
1dm
0,8dm
0,02
]
[Cl
3
7
2
2
3
10
5,12
)
10
(1,6
10
2
x
x< K
Osad się nie wytrąci.

Efekt wspólnego jonu
• Dodanie jonu wspólnego z osadem
spowoduje zmniejszenie rozpuszczalności
trudno rozpuszczalnego elektrolitu.
• Obniżenie rozpuszczalności jest
proporcjonalne do ilości dodanego jonu,
• Powyżej pewnego stężenia dodatkowego
jonu następuje gwałtowny wzrost
rozpuszczalności na skutek tworzenia
związków kompleksowych

Efekt solny
Efekt solny polega na niewielkim
zwiększeniu rozpuszczalności
elektrolitu na skutek dodania do
roztworu soli, która nie reaguje z tym
elektrolitem.

Wiedząc, że K
AgCl
= 1,1 ∙10
-10
określ, ile gramów AgCl rozpuści się w 100
cm
3
wody
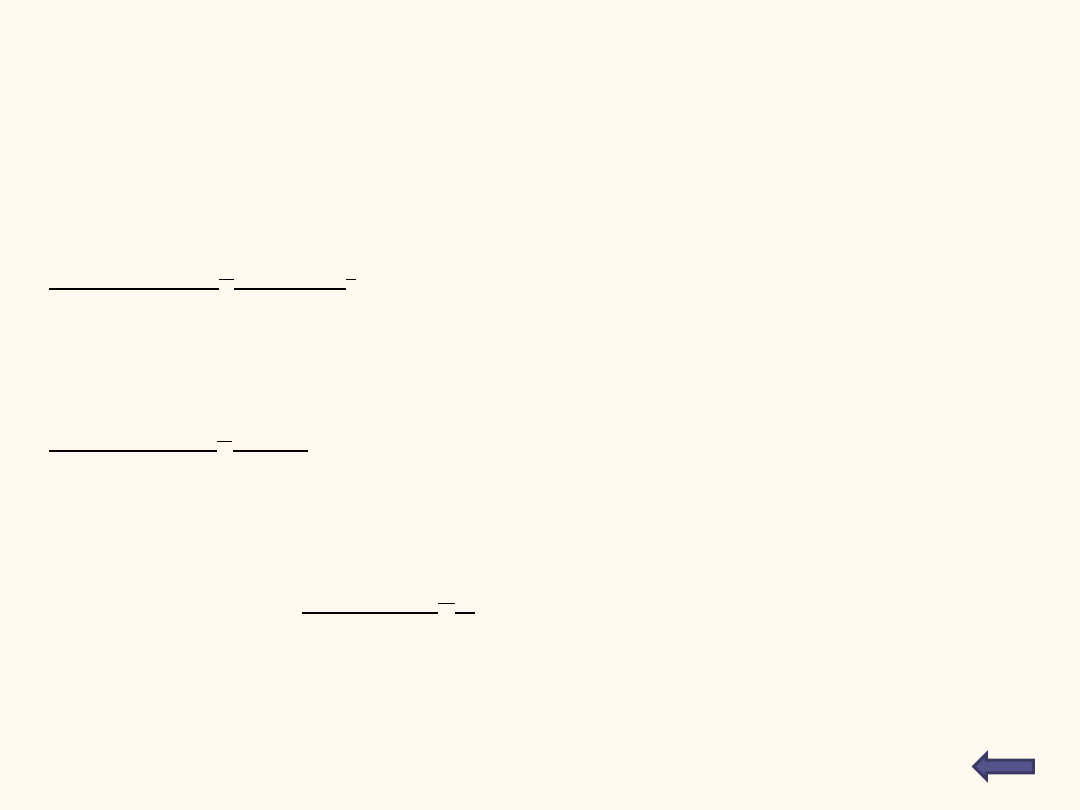
Wiedząc, że K
AgCl
= 1,1 ∙10
-10
określ, ile gramów AgCl rozpuści się w 100
cm
3
wody
Obliczmy stężenie molowe AgCl w roztworze nasyconym
K = [Ag
+
]∙[Cl
-
]
K = C
2
C = √K
C= 1,05 ∙10
-5
mol/dm
3
Obliczmy, ile moli AgCl znajduje się w 100 cm
3
tego roztworu
1,05∙10
-5
moli – 1 dm
3
n moli – 0,1 dm
3
n = 1,05∙10
-6
mola
Obliczmy ile to gramów
M AgCl = 143,4 g/mol
m = n ∙ M
m = 150,6 ∙10
-6
g = 1,5 ∙10
-4
g

REAKCJE ZOBOJĘTNIENIA
Według definicji Arrheniusa reakcja między kwasem i zasadą nazywa się
reakcją zobojętnienia.
Terminu „zobojętnianie” nie można przyjmować dosłownie, ponieważ
roztwór obojętny powstać może tylko w wyniku reakcji kwasu z zasadą o
zbliżonej mocy,
tak jak np. w reakcji 1 mola HCl z 1 molem NaOH.
W roztworach wodnych mogą mieć miejsce cztery możliwe przypadki,
obejmujące reakcje między kwasem i zasadą, które powszechnie nazywa
się reakcjami
zobojętniania.
Reakcja mocny kwas – mocna zasada
Reakcja słaby kwas – mocna zasada
Reakcja mocny kwas – słaba zasada
Reakcja słaby kwas – słaba zasada
Istotą reakcji zobojętniania jest łączenie się kationów wodoru
( jonów hydroniowych) i anionów wodorotlenkowych w
niezdysocjowane cząsteczki wody.
Każda reakcja pomiędzy kwasem i zasadą sprowadza się do
reakcji pomiędzy jonami H
+
(H
3
+
O) , a jonami OH¯

Odczyn roztworów wodnych
kwasów → kwaśny;
pH < 7,0
zasad → zasadowy;
pH > 7,0
Jaki jest odczyn roztworu wodnego soli - obojętny?
A.
NaCl → Na
+
+ Cl
-
pH = 7,0
B.
NH
4
Cl → NH
4
+
+ Cl
-
pH < 7,0
C.
CH
3
COONa → CH
3
COO
-
+ Na
+
pH > 7,0
HYDROLIZA SOLI
NH
4
Cl to sól słabej zasady i mocnego kwasu
CH
3
COONa to sól mocnej zasady i słabego kwasu
Roztwory obu tych soli nie wykazują odczynu obojętnego.
Przyczyną jest zjawisko hydrolizy.
Hydroliza soli to reakcja soli z wodą, która prowadzi do
utworzenia produktu słabo zdysocjowanego.
Reakcja B
hydrolizie ulegają kationy NH
4
+
Reakcja C
hydrolizie ulegają aniony CH
3
COO
-
Reakcja A
hydrolizie nie ulegają jony Na
+
czy Cl
-

Hydrolizie ulegają tylko te sole, których jony mają zdolność reagowania z
cząsteczkami wody.
Do takich soli należą:
sole słabych kwasów i mocnych zasad
( hydroliza anionowa)
sole słabych zasad i mocnych kwasów
( hydroliza kationowa)
sole słabych zasad i słabych kwasów
(anionowo – kationowa)
Hydroliza anionowa
Hydrolizie anionowej ulegają sole mocnych zasad i słabych kwasów
Octan sodu w wodzie jest całkowicie zdysocjowany:
Na
COO
CH
COONa
CH
3
3
Zdolność do reakcji z cząsteczkami wody ma anion octanowy, który
zgodnie z teorią Bronsteda stanowi zasadę anionową i może
przyjmować proton, przechodząc w słabo zdysocjowany kwas.
OH
COOH
CH
O
H
COO
CH
3
2
3
Wytworzony w tej reakcji nadmiar jonów OH
-
powoduje zasadowy odczyn
roztworu.

Hydroliza kationowa
Hydrolizie kationowej ulegają sole słabych zasad i mocnych kwasów.
W roztworze wodnym chlorku amonu znajdują się kationy amonowe i
aniony chlorkowe
Cl
NH
Cl
NH
4
4
Kation amonowy według teorii Bronsteda jest kwasem kationowym i w
reakcji z wodą jest protonodawcą.
O
H
NH
O
H
NH
3
3
2
4
Hydroliza anionowo - kationowa
W przypadku soli słabych zasad i słabych kwasów hydrolizie ulega
zarówno kation słabej zasady jak i anion słabego kwasu.
Podczas dysocjacji octanu amonu powstają: kwas kationowy NH
4
+
i
zasada octanowa CH
3
COO
-
Zachodzą reakcje hydrolizy:
W wyniku tej reakcji odczyn roztworu staje się kwaśny.
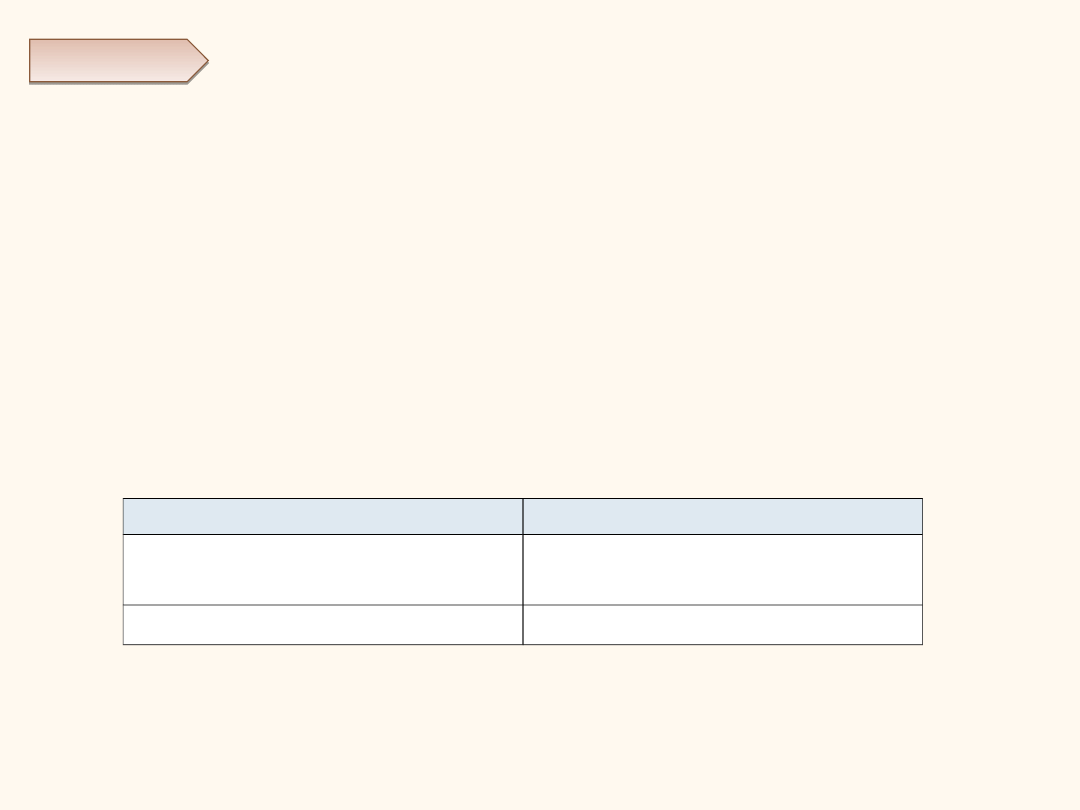
- zapis cząsteczkowy: Na
2
CO
3
+ 2H
2
O → 2NaOH + H
2
CO
3
;
- zapis jonowy: 2Na
+
+
CO
3
2-
+
2H
2
O
→ 2Na
+
+
2OH
-
+ H
2
CO
3;
- zapis jonowy skrócony:
CO
3
2-
+
2H
2
O
→ H
2
CO
3
+
2OH
-
.
- zapis cząsteczkowy: NH
4
NO
3
+ H
2
O → NH
3
.
H
2
O + HNO
3
;
- zapis jonowy:
NH
4
+
+NO
3
-
+
H
2
O
→ NH
3
.
H
2
O +
H
+
+ NO
3
-
- zapis jonowy skrócony:
NH
4
+
+
H
2
O
→ NH
3
.
H
2
O +
H
+
-zapis cząsteczkowy:(NH
4
)
2
CO
3
+2H
2
O →2NH
3
.
H
2
O + H
2
CO
3
;
-zapis jonowy: 2NH
4
+
+
CO
3
2-
+ 2H
2
O → 2NH
3
.
H
2
O + H
2
CO
3
PRZYKŁADY
PRZYKŁADY
Hydroliza
Sole
anionowa
Na
2
CO
3
; Na
2
S, NaNO
2;
CH
3
COOK
kationowa
NH
4
NO
3
; AlCl
3
; ZnCl
2;
Al
2
(SO
4
)
3

Jaki jest odczyn wodnych roztworów następujących soli?
1. NaCl, K
2
CO
3
, NH
4
ClO
4
, Na
2
HPO
4
.
Na
3
PO
4
, Al
2
(SO
4
)
3
, KNO
3
, CH
3
COONH
4
.
NaH
2
PO
4
, Zn(NO
3
)
2
, (NH
4
)
2
CO
3
, Na
2
SO
4
.
2. CH
3
COONa, AlCl
3
, (NH
4
)
2
S, NaClO
4
.
Do roztworu zawierającego 0,25 mola NH
3
, dodano 0,125 mola H
2
SO
4
.
Jaki odczyn będzie miał przygotowany roztwór?
Rozwiązanie;
substraty użyte są w stosunku 0,25 : 0,125 = 2 : 1, czyli w stosunku
stechiometrycznym, więc zaszła reakcja zobojętnienia:
2NH
3
+ H
2
SO
4
→ (NH
4
)
2
SO
4
.
Jednak odczyn roztworu będzie kwasowy, ponieważ jest to sól słabej
zasady i
mocnego kwasu, ulegnie hydrolizie kationowej
.

Bibliografia
„Chemia od A do Z” M. Klimaszewska
„Chemia 3” – S. Hejwowska
„Chemia medyczna” I. Żak
http://mwalnik.wodip.opole.pl
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Wyklad 11b Elektrolity cd , hydroliza, bufory, iloczyn rozpuszczaln
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
Z Rownowagi dys słabe hydroliza iloczyn rozpuszczalnosci
14. Hydroliza soli. Sole trudno rozpuszczalne, Studia, Chemia ogólna, Wykłady
Iloczyn rozpuszczalności soli trudno rozpuszczalnych
Iloczyn rozpuszczalności soli trudno rozpuszczalnych
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
iloczyn rozpuszczalności
Hydroliza soli id 207726 Nieznany
Hydroliza soli; strącanie osadów
Iloczyn rozpuszczalnosci roztwo Nieznany
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
pomiar ph i hydroliza soli
Iloczyn rozpuszczalności
chemia, Hydroliza soli i pH roztworów
Pomiar pH. hydroliza soli, Arkadiusz Swiniarski
więcej podobnych podstron