
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.

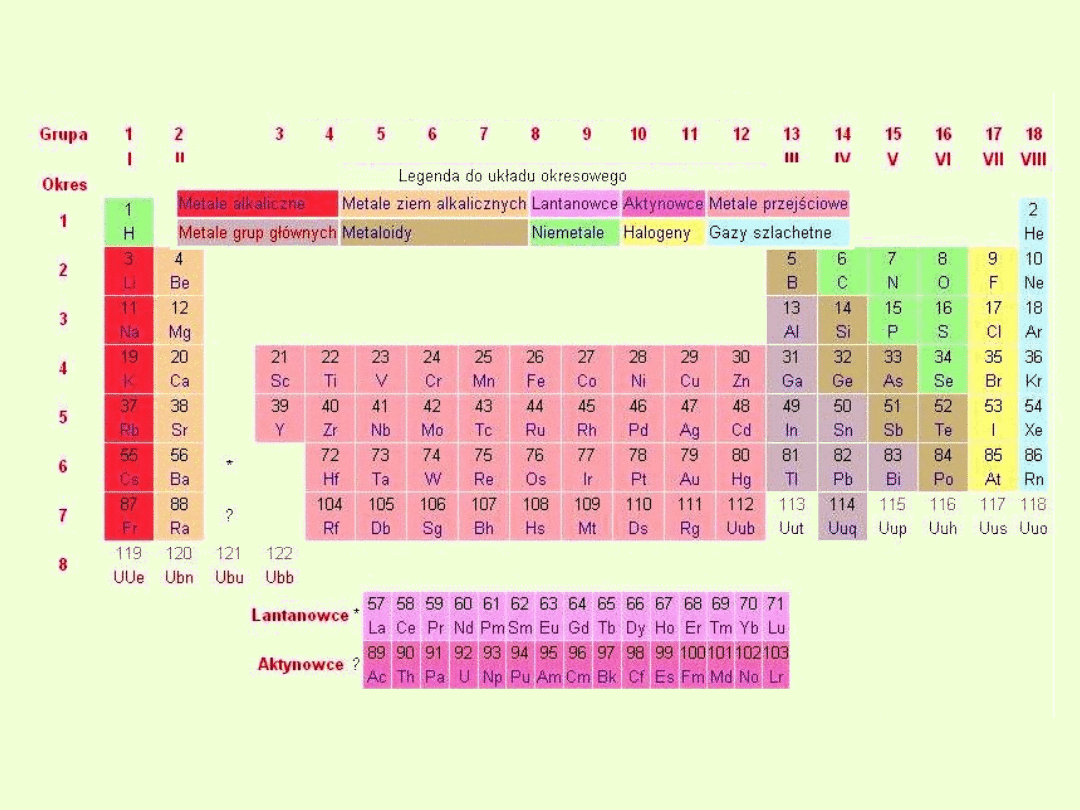
UKŁAD OKRESOWY PIERWIASTKÓW

Spis treści
Podstawowe pojęcia.
Próby klasyfikacji pierwiastków chemicznych w XIX wieku.
Prawo okresowości– kryterium klasyfikowania pierwiastków przez Mendelejewa.
Współczesny układ okresowy (tablica Wernera).
Grupy i bloki w układzie okresowym.
Nazewnictwo grup.
Okresy w układzie okresowym.
Informacje o pierwiastku wynikające z jego liczby atomowej, położenia w grupie
i w okresie.
Energia jonizacji (potencjał jonizacji).
Powinowactwo elektronowe.
Elektroujemność pierwiastków
►
Skala elektroujemności Paulinga.
►
Charakter elektroujemny i elektrododatni.
►
Reguła oktetu i dubletu
►
Na skróty
.
Zmienność charakteru chemicznego pierwiastków grup głównych wynikająca z
położenia w układzie okresowym.
Własności elektryczne i magnetyczne pierwiastków

Atomowa jednostka masy [u]
Atomowa jednostka masy [u] to 1/12 masy atomu izotopu węgla
C
12
Izotopy
Atomy posiadające tę samą liczbę atomową (liczbę protonów w
jądrze), ale różną liczbę neutronów
Liczba atomowa ( Z )
.
(liczba porządkowa)
Określa, ile protonów znajduje się w jądrze danego atomu. Jest
także równa liczbie elektronów niezjonizowanego atomu
Masa atomowa [M
A
]
Liczba określająca ile razy masa jednego reprezentatywnego
atomu danego pierwiastka chemicznego jest większa od 1/12 masy
atomu izotopu
12
C, przy czym pod pojęciem „reprezentatywnego
atomu” rozumie się atom o średniej masie wyliczonej
proporcjonalnie ze wszystkich stabilnych izotopów danego
pierwiastka, ze względu na ich występowanie na Ziemi.
Powłoka walencyjna
Ostatnia, najdalej odsunięta od jądra powłoka elektronowa atomu.
Elektrony na niej są najsłabiej związane z atomem i mogą
uczestniczyć w tworzeniu wiązań chemicznych.
W przypadku elektronów znajdujących się niżej zazwyczaj nie jest
to możliwe, choć są od tego liczne wyjątki.
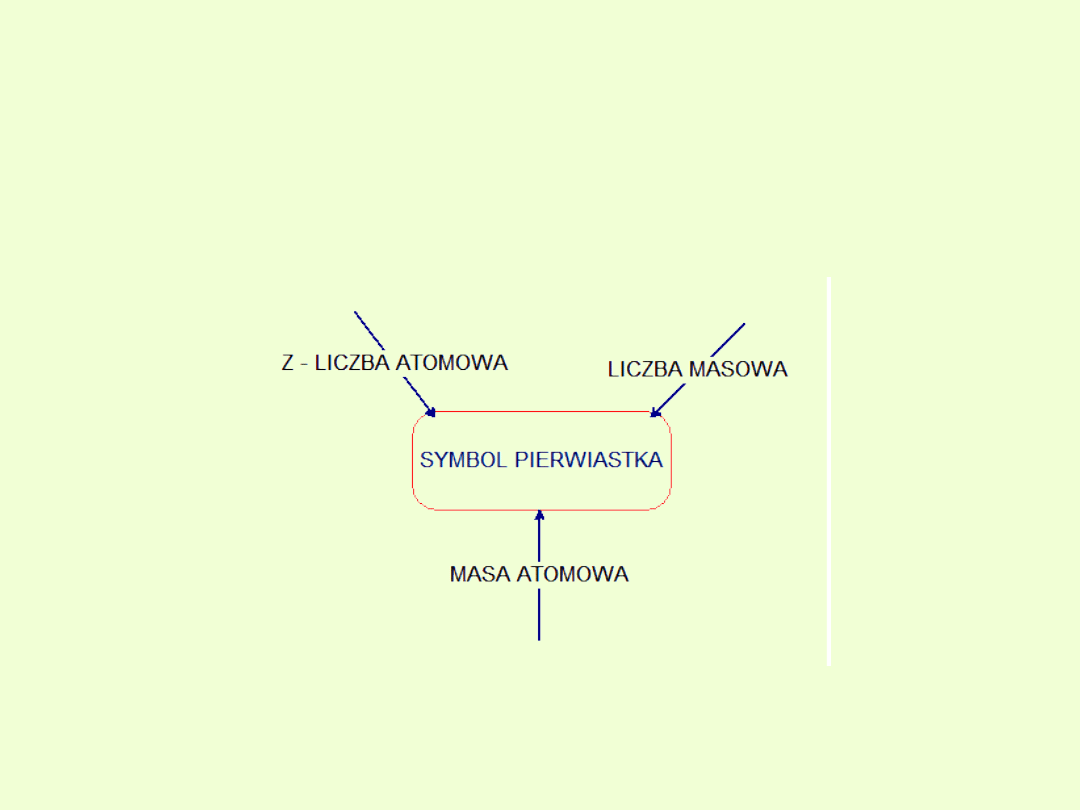
Liczba masowa (A)
to wartość opisująca liczbę nukleonów (czyli protonów i neutronów)
w jądrze (w nuklidzie) danego izotopu atomu danego pierwiastka.
Liczby masowej nie należy mylić z masą atomową pierwiastka, która
wyznaczana jest metodami chemicznymi, ani też z masą pojedynczego
izotopu.

Próby klasyfikacji pierwiastków chemicznych
1815
W.Prout zauważył, że masy atomowe większości
pierwiastków są w przybliżeniu liczbami całkowitymi i
postulował, aby za podstawowy budulec wszystkich z nich
przyjąć najlżejszy – wodór.
1829
Johann Wolfgang Döbereiner zestawił grupy składające się z
trzech
pierwiastków, o podobnych własnościach chemicznych i
cyklicznie wzrastających masach atomowych – triady
Döbereinera (znanych było 50 pierwiastków). Średnia
arytmetyczna mas pierwiastków skrajnych była w
przybliżeniu równa masie atomowej środkowego
pierwiastka
Oto pięć triad znalezionych przez Döbereinera (w
nawiasach
podano przybliżone masy atomowe). Pierwiastki te i dzisiaj
sąsiadują ze sobą w grupach układu okresowego.
Li (7) Ca (40) P (31) S (32) Cl (35,5)
Na (23) Sr (87,5) As (75) Se (79) Br (80)
K (39) Ba (137,5) Sb (122) Te (127,5) I (127)

1863
Antoine Beguyer de Chancourtois narysował na bębnie
spiralnie wznoszący się łańcuch nazw pierwiastków. Średnica
bębna
była tak dobrana, że łańcuch tworzył pełen obrót spirali co osiem
pierwiastków. Dzięki temu, patrząc wzdłuż linii prostopadłych do
podstawy bębna na jego powierzchni bocznej widziało się zawsze
pierwiastki o podobnych własnościach chemicznych.
"Wynalazek" bębna chemicznego jednak nikogo nie
zainteresował i wydawał się zwykłym dziwactwem.
1865
John Newlands ułożył pierwiastki według rosnących mas
atomowych.
i spostrzegł, że co ósmy z nich wykazuje podobne własności.
Jednakże tylko nieliczne pierwiastki, które trafiły do tej samej
„oktawy”
Newlandsa, były faktycznie do siebie podobne.
Ich twórca popełnił błąd, ustawiając jeden za drugim (bez
przerw)
wszystkie znane wtedy pierwiastki, na skutek czego w jednej
oktawie
znalazły się również całkiem odmienne substancje proste.

Prawo okresowości pierwiastków(1869
r.)
Własności pierwiastków (a także utworzonych
przez nie substancji prostych i złożonych),
uporządkowanych według wzrastających mas
atomowych, zmieniają się w sposób okresowy w
zależności od wielkości mas atomowych.
Mendelejew zrobił następujące założenia:
Nieznane dotąd pierwiastki zostaną odkryte.
Należy poprawić wartości mas atomowych wielu pierwiastków.
Przejście od pierwiastka o własnościach wyraźnie niemetalicznych do
pierwiastka o własnościach wyraźnie metalicznych nie może być zbyt
gwałtowne.
W układzie stworzonym przez Mendelejewa było zebranych ponad 90
pierwiastków, a ponadto zostawił on wolne miejsca dla pierwiastków
które jeszcze nie zostały odkryte, tam gdzie różnice między masami
atomowymi znanych przez niego pierwiastków były znaczne. Te puste
pola zapełniały się pierwiastkami jeszcze za życia rosyjskiego uczonego,
a właściwości i masy atomowe tych pierwiastków były zgodne z
przewidywaniami.

Współczesny układ okresowy (tablica
Wernera)
Dopiero:
•
odkrycie jądra atomu przez Ernesta Rutherforda (1911)
•
opublikowanie w 1913 roku przez jego ucznia, Henry'ego Moseleya,
tabeli liczby protonów, neutronów i elektronów w kolejnych
pierwiastkach,
•
zaproponowanie koncepcji orbit i sfer elektronowych przez Bohra,
•
sformułowanie zakazu Pauliego,
dało układowi okresowemu logiczne uzasadnienie oraz wyjaśniło
pochodzenie własności chemicznych pierwiastków.
Prawo Moseleya
W obrębie okresu liczba ładunków w jądrze atomu wzrasta o jedność
przy przejściu od jednego pierwiastka do następnego.
Współczesna interpretacja prawa okresowości
Własności fizyczne i chemiczne pierwiastków są periodyczną funkcją ich
liczby atomowej (liczby protonów w jądrze).
Okresowy charakter zmian własności pierwiastków wynika stąd, że
liczby elektronów w zewnętrznych powłokach zmieniają się w sposób
okresowy.
Prawo Moseleya
W obrębie okresu liczba ładunków w jądrze atomu wzrasta o jedność
przy przejściu od jednego pierwiastka do następnego.
Współczesna interpretacja prawa okresowości
Własności fizyczne i chemiczne pierwiastków są periodyczną funkcją ich
liczby atomowej (liczby protonów w jądrze).
Okresowy charakter zmian własności pierwiastków wynika stąd, że
liczby elektronów w zewnętrznych powłokach zmieniają się w sposób
okresowy.
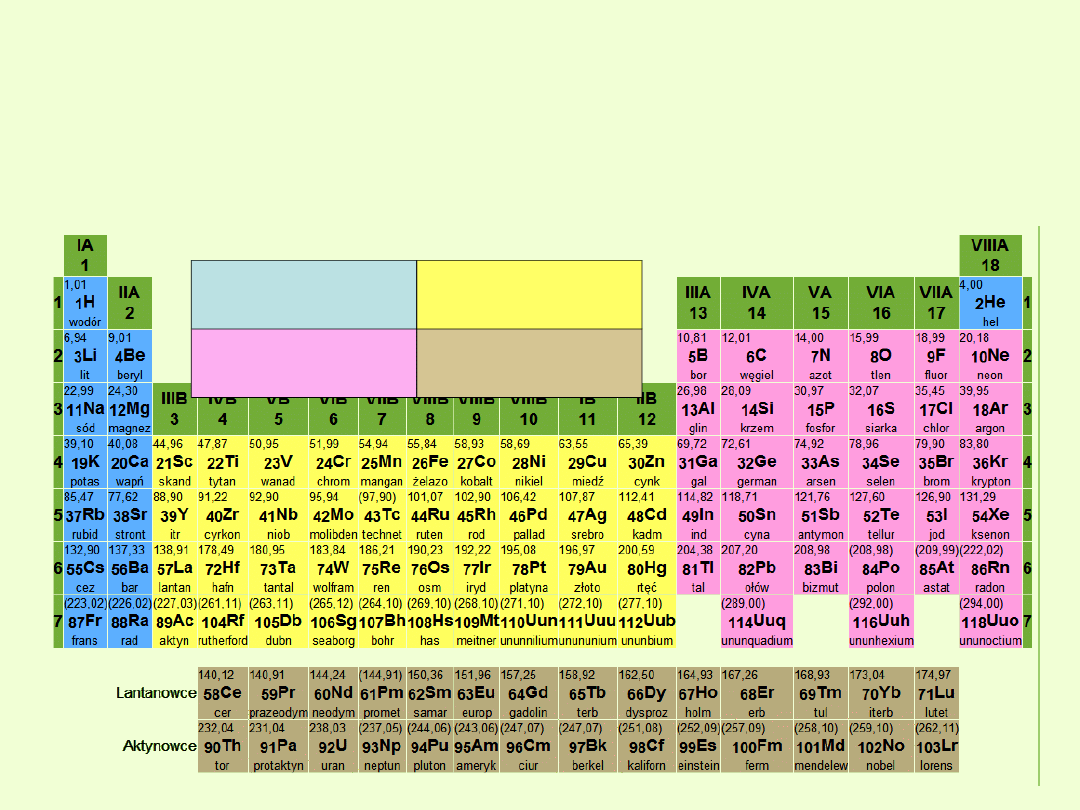
Układ okresowy w naturalny sposób dzieli się na bloki s, p, d i f,
odpowiadające różnej konfiguracji elektronów na zewnętrznej powłoce
atomów poszczególnych pierwiastków.
Pierwiastki bloku
s
Pierwiastki bloku
d
Pierwiastki bloku
p
Pierwiastki bloku
f
Do bloków s i p należą pierwiastki grup głównych, do bloku d
pierwiastki przejściowe, zaś do bloku f lantanowce i
aktynowce.
Pionowe kolumny w układzie okresowym nazywamy grupami.
W najnowszej, obowiązującej obecnie wersji układu wyróżniamy 18
grup
pierwiastków.
Pierwiastki w każdej grupie mają podobne konfiguracje zewnętrznych
powłok
elektronowych i dlatego mają podobne własności.
Budowa elektronowa jest podstawą podziału pierwiastków na bloki:
Blok s obejmuje pierwiastki grup 1 i 2.
W grupach tych zewnętrzne elektrony są na orbitalach s.
Blok p obejmuje pierwiastki grup 13 - 18.
W grupach tych rozbudowa zewnętrznych powłok następuje przez
umieszczanie nowych elektronów na orbitalach p.
Dlatego do bloku p należy sześć grup pierwiastków.
Blok d obejmuje pierwiastki grup 3 - 12.
Leżą one między pierwiastkami bloków s i p.
Cechą charakterystyczną pierwiastków z bloków d jest rozbudowa
podpowłok d do 10 elektronów.
Dlatego blok d obejmuje 10 grup pierwiastków.
Pierwiastki bloku d są czasem nazywane pierwiastkami przejściowymi,
bo w układzie okresowym są jakby pomostem między blokami s i p.
Grupy i bloki w układzie okresowym
W atomach pierwiastków bloku f następuje rozbudowa podpowłok f do
14 elektronów.
Pierwiastki te występują w okresach 6 i 7.
Ze względów praktycznych na rysunkach układu okresowego
pierwiastki bloku f umieszcza się osobno a nie w okresach, do których
należą.
Blok f umieszcza się w grupie 3.
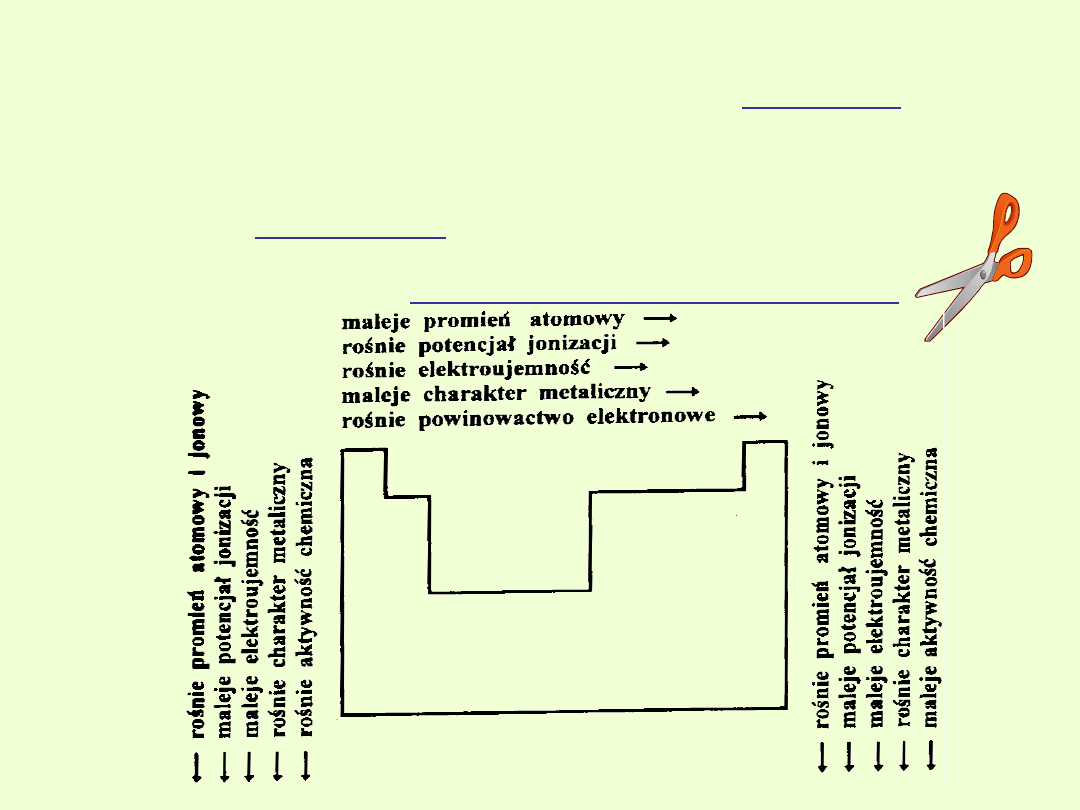
W obrębie grup promienie atomów wzrastają wraz ze wzrostem
liczb atomowych.
Wiąże się to ze wzrostem liczby powłok elektronowych, których wpływ na
wielkość średnicy atomu przewyższa wpływ wzrostu ładunku jądra,
decydującego o zmniejszeniu średnicy atomu.
1
2
13
14
15
16
17
18
IA
IIA
IIIA
IVA
VA
VIA
VIIA
VIII A
3
4
5
6
7
8
9
10
11
12
IIIB
IVB
VB
VIB
VIIB
VIIIB VIIIB VIIIB
IB
IIB

Nazewnictwo grup
Wszystkie grupy mają swoją nazwę. I tak
pierwiastki grupy bloku
s i p;
1 - nazywane są litowcami
2 - berylowcami
13 - borowcami
14 - węglowcami
15 - azotowcami
16 - tlenowcami
17 - fluorowcami
18 - helowcami (gazami szlachetnymi)
Pierwiastki bloku d:
3 - skandowce
4 - tytanowce
5 - wanadowce
6 - chromowce
7 - manganowce
11 - miedziowce
12 - cynkowce
W grupach 8, 9 i 10 są umieszczone tzw.
triady
, tj. żelazowce,
platynowce lekkie, platynowce ciężkie.
Pierwiastki bloku f :
czternaście pierwiastków, leżących w grupie trzeciej, są to
lantanowce (okres szósty) i aktynowce (okres siódmy).

Okresy w układzie okresowym
Poziome szeregi w okresowym układzie pierwiastków nazywamy
okresami.
Liczba okresów wynosi 7. Numer okresu odpowiada ilości powłok
elektronowych w atomach pierwiastków tego okresu.
Okres 1
Okres pierwszy ma tylko dwa pierwiastki, bo przy n = 1 powłoka
elektronowa
mieści tylko dwa elektrony.
Powłoka ta jest zatem całkowicie zapełniona w atomie helu
Okres 2
W okresie tym wypełnianie powłoki n = 2 kończy się na atomie
neonu,
w którym powłoka ta ma 8 elektronów.
n=2 mieści 8 elektronów i dlatego tyle właśnie pierwiastków jest w
okresie
Okres 3
W okresie trzecim wypełnianie powłoki n = 3 przebiega tak samo i
kończy się po osiągnięciu konfiguracji ośmioelektronowej w atomie
argonu.
W okresie trzecim nie następuje rozbudowa powłoki n = 3 do 18
elektronów przez wypełnienie orbitali l = 2 (orbitali d).
Zgodnie z regułą rozbudowy konfiguracji orbitale o niższych
energiach mają pierwszeństwo w przyjmowaniu elektronów, a więc
w okresie trzecim elektrony nie mogą zajmować podpowłoki d
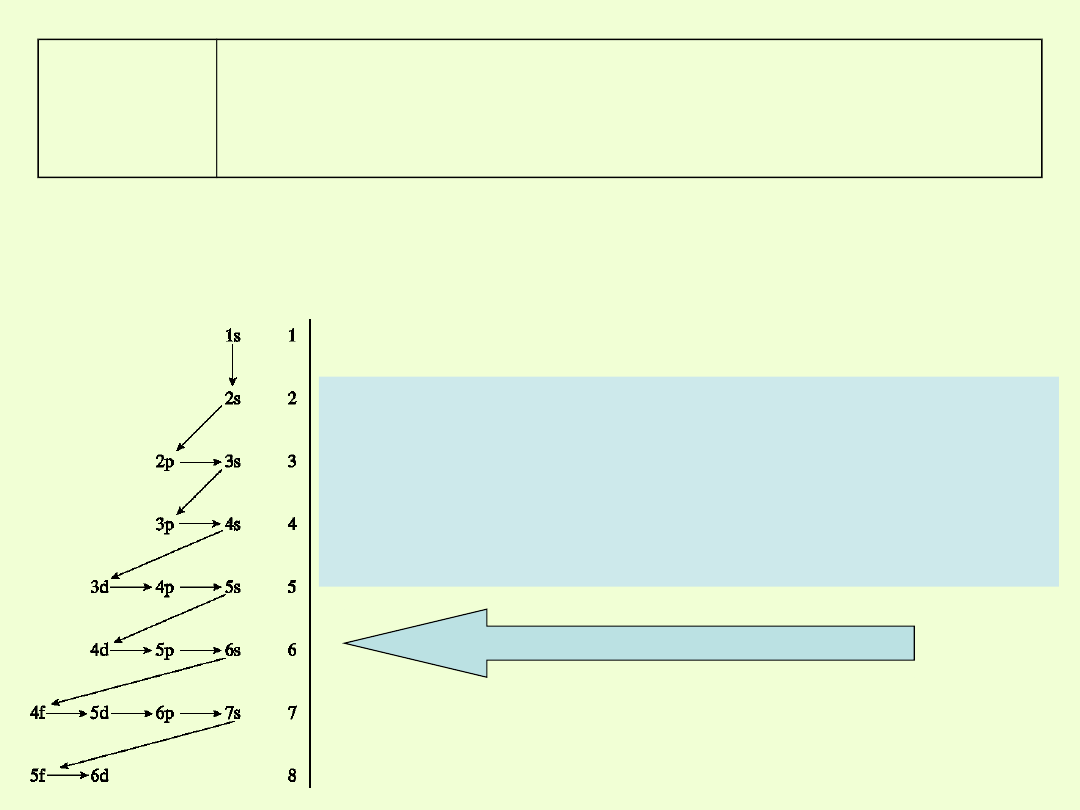
Okres 4
Po wypełnieniu podpowłoki 3p rozbudowuje się podpowłoka 4s,
czyli.
zaczyna się następny okres, w którym po wypełnieniu orbitalu 4s
rozbudowuje się podpowłoka 3d
Kolejność zapełniania powłok elektronowych
W obrębie okresu promienie atomów zmniejszają się malejąc w
danym okresie od strony lewej do prawej.
Wiąże się to ze wzrostem liczby protonów w jądrze, tzn. z silniejszym
przyciąganiem elektronów przez jądro.
Dla pierwiastków bloku s elektrony walencyjne to: ns
Dla pierwiastków bloku p elektrony walencyjne to: ns, np.
Dla pierwiastków bloku d elektrony walencyjne to: ns, (n-
1)d
Dla pierwiastków bloku f elektrony walencyjne to: ns, (n-
1)d, (n-2)f
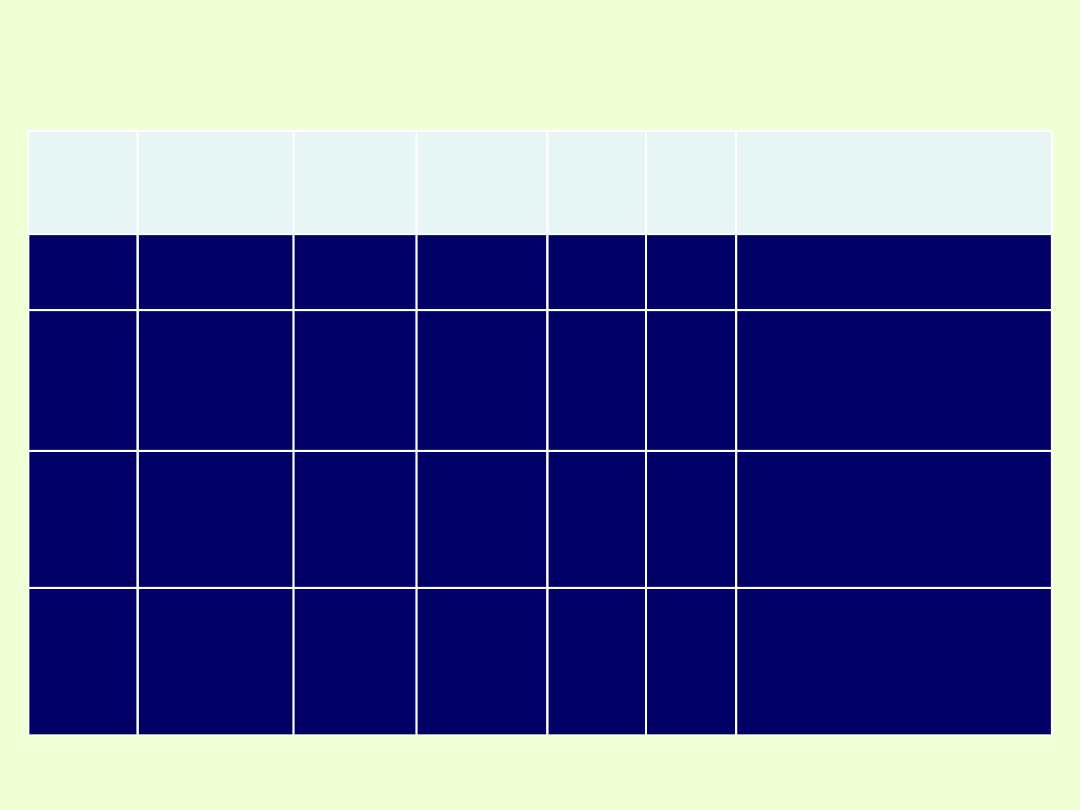
Informacje o pierwiastku wynikające z jego liczby atomowej,
położenia w grupie i w okresie.
Symbo
l
Nazwa
Liczba
atomow
a
Masa
atomow
a
Grupa
Okre
s
Konfiguracja
elektronowa
K
potas
19
39,1u
1 (IA)
4
blok s
1s
2
2s
2
p
6
3s
2
p
6
4s
1
I
jod
53
126,9u
17
(VIIA)
5
blok p
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
4d
10
5s
2
5p
5
Cu
miedź
blok d
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
1
(promocja
elektronu)
Ce
cer
58
140,1u
3
6
Blok f
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
4d
10
4f
2
5s
2
5p
6
6s
2

Współczesny układ okresowy polega na uszeregowaniu pierwiastków
według wzrastających liczb atomowych Z.
Liczba powłok elektronowych równa jest numerowi okresu, do którego
należy dany pierwiastek.
Liczba elektronów w powłoce walencyjnej pierwiastków grup głównych
jest równa numerowi grupy ( wyjątek stanowi hel).
Ze względu na konfigurację elektronową atomów pierwiastków układ
okresowy dzieli się na bloki energetyczne ( związane z lokalizacją
elektronów walencyjnych):
pierwiastki grup głównych – blok s (1, 2 grupa oraz He); blok p (13
-18)
pierwiastki przejściowe – blok d ( 3 – 12 grupa)
Lantanowce i aktynowce – blok f
Okres jest zbiorem pierwiastków uporządkowanych według
wzrastających liczb atomowych, które zawierają identyczną ilość
powłok atomowych.
Grupa jest szeregiem uporządkowanym według wzrastających liczb
atomowych o tej samej konfiguracji elektronowej zewnętrznych
powłok, mających zbliżone właściwości chemiczne.
W obrębie okresu promienie atomów zmniejszają się malejąc w danym
okresie od strony lewej do prawej. W obrębie grup promienie atomów
wzrastają wraz ze wzrostem liczb atomowych.
Na skróty
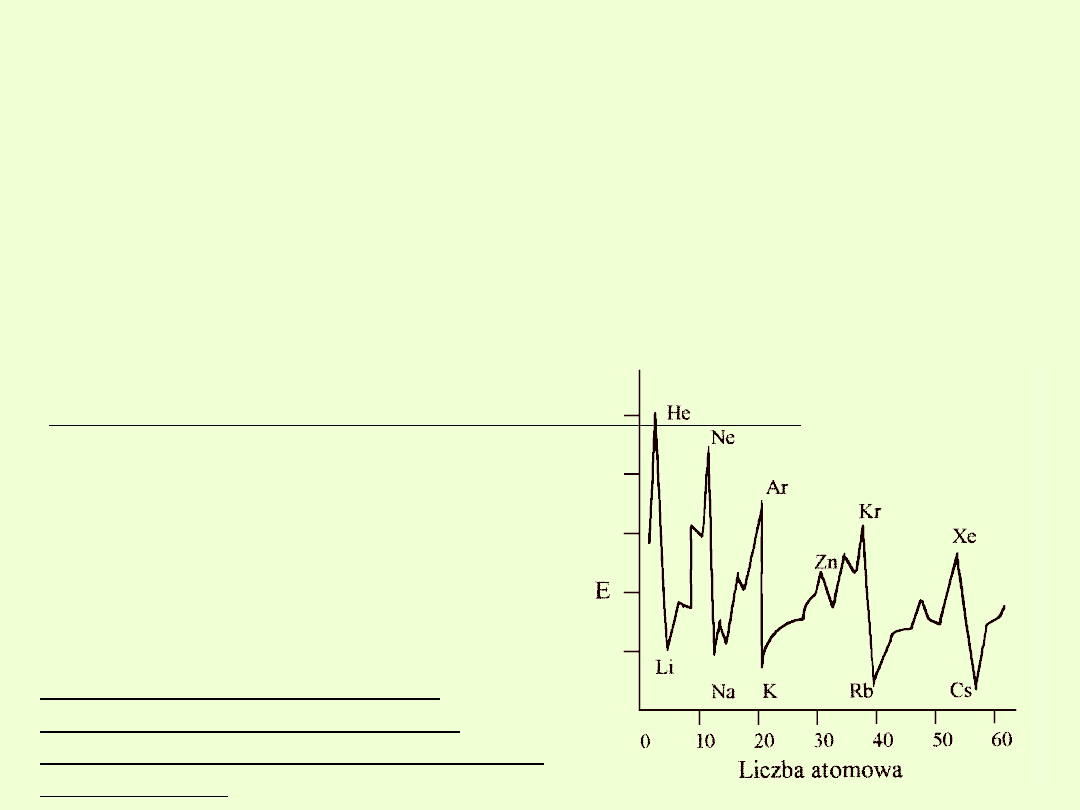
Energia jonizacji (potencjał jonizacji)
Energia jonizacji
jest to energia potrzebna do oderwania
jednego elektronu
od atomu.
W zależności od liczby oderwanych elektronów rozróżnia się pierwszą,
drugą itp. energię jonizacji.
Energia potrzebna do oderwania elektronu zależy od jego odległości od
jądra atomowego oraz od ładunku jądra (prawo Coulomba).
Wraz ze wzrostem ładunku jądra rośnie siła przyciągania elektronów i
dlatego
energia jonizacji powiększa się w obrębie okresu.
Gdy jednak zaczyna się nowy okres, to
energia jonizacji gwałtownie maleje, bo
nowy elektron pojawia się na powłoce o
większym promieniu.
Następne elektrony w nowym okresie
coraz silniej odczuwają wzrost ładunku
jądra i dlatego znów mamy wzrost
energii jonizacji w obrębie okresu.
W tej samej grupie układu
okresowego maleje energia
jonizacji przy wzroście promienia
atomowego.
Powinowactwo elektronowe
Powinowactwo elektronowe
jest to efekt energetyczny
towarzyszący przyłączaniu przez atom danego pierwiastka
dodatkowego elektronu do powłoki walencyjnej
.
Wraz ze wzrostem liczby atomowej:
1. W obrębie okresu powinowactwo elektronowe wzrasta ( maleje
promień atomu).
2. W obrębie grupy powinowactwo elektronowe maleje ( wzrasta promień
atomu).
Dla pewnej grupy pierwiastków wartości powinowactwa elektronowego
są ujemne.
Tymi pierwiastkami są np.; gazy szlachetne, beryl, magnez i azot
Ujemne powinowactwo elektronowe oznacza, że energia anionu jest
większa od
energii obojętnego atomu i przyłączenie elektronu do atomu wymaga
dostarczenia
energii.
Gazy szlachetne mają ujemne powinowactwa elektronowe, gdyż
przyłączany do
nich elektron musi zająć orbital znajdujący się poza zamkniętą powłoką,
daleko od jądra.

Elektroujemność pierwiastków
Elektroujemność
jest to zdolność atomu do przyciągania
elektronów obecnych w wiązaniu chemicznym.
Trudno stworzyć zadawalającą miarę liczbową elektroujemności, gdyż
nie jest ona właściwością atomów jako takich, ale zależy do pewnego
stopnia od połączeń chemicznych, w których biorą one udział. Niemniej
jednak stworzono kilka skal elektroujemności.
Skala elektroujemności Paulinga
Opiera się na energii wiązań. Przy jej tworzeniu
wykorzystano obserwacje doświadczalne.
Historycznie była to najwcześniej zastosowana
skala elektroujemności i choć brak jej ścisłego
uzasadnienia teoretycznego, jest ona nadal
szeroko stosowana.
Skala elektroujemności Paulinga
Opiera się na energii wiązań. Przy jej tworzeniu
wykorzystano obserwacje doświadczalne.
Historycznie była to najwcześniej zastosowana
skala elektroujemności i choć brak jej ścisłego
uzasadnienia teoretycznego, jest ona nadal
szeroko stosowana.
Skala elektroujemności pozwala na przybliżone szacowanie trwałości i
mocy wiązania.
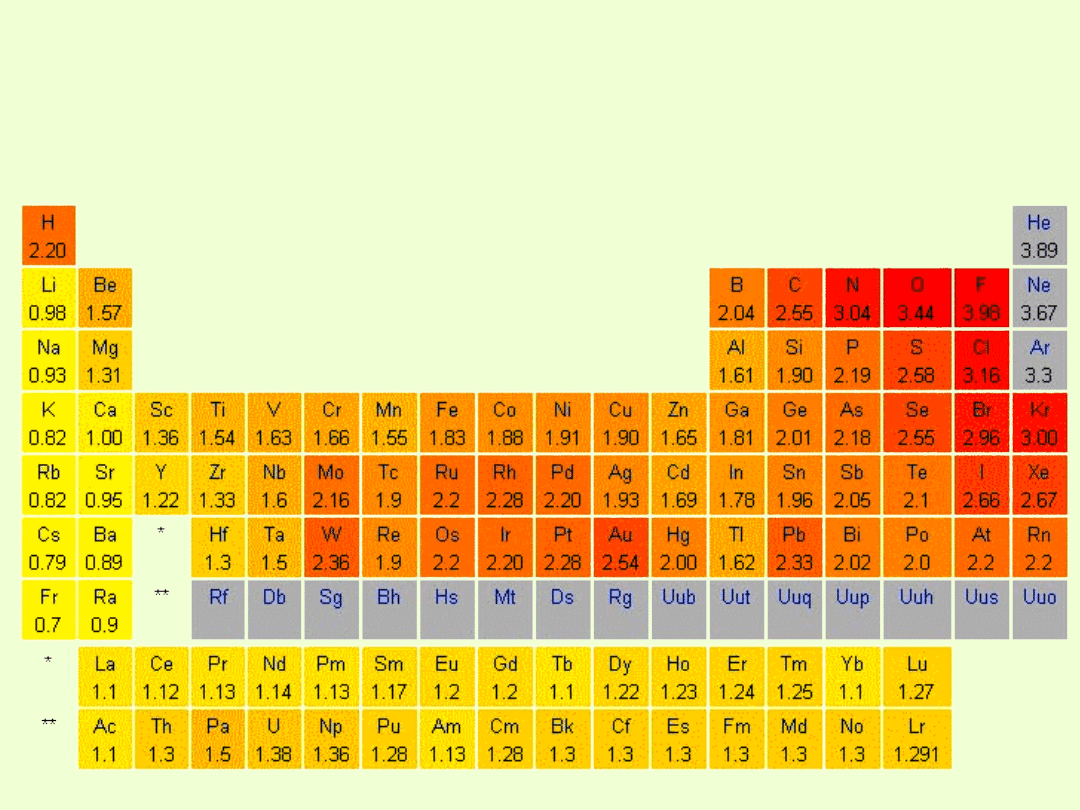
Skala elektroujemności pierwiastków Paulinga zawiera się w granicach
od 0,7 (cez) do 4,0 (fluor).
Na podstawie różnicy elektroujemności pierwiastków tworzących
wiązanie można określić typ tego wiązania:
jeśli różnica jest mniejsza od 0,4 -
wiązanie kowalencyjne
jeśli różnica mieści się w zakresie od
0,4 do 1,7 - wiązanie kowalencyjne
spolaryzowane
jeśli różnica jest większa niż 1,7 -
wiązanie jonowe
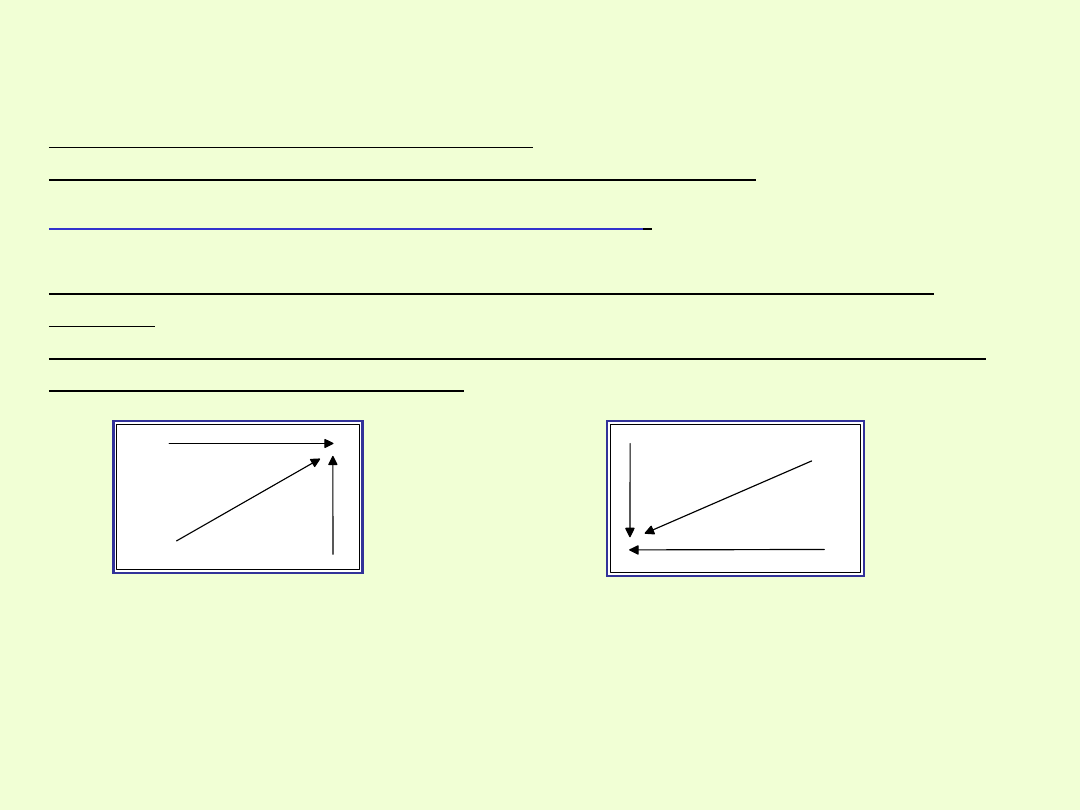
Wzrost elektrododatniości w
UO
Wzrost elektroujemności w
UO
Charakter elektroujemny (niemetaliczny)
pierwiastków zmienia się
wraz ze wzrostem liczb atomowych.
Maleje w grupie, a rośnie w okresie.
Najbardziej elektroujemnym pierwiastkiem jest fluor
Charakter elektrododatni ( metaliczny)
pierwiastków dotyczy
zdolności atomów do oddawania elektronów.
Wraz ze wzrostem liczb atomowych wzrasta w grupie, a maleje w
okresie.
Najbardziej elektrododatnim pierwiastkiem, wykazującym największy
charakter metaliczny jest cez.
Reguła oktetu i dubletu
Atomy dążą do uzyskania konfiguracji gazów szlachetnych, ponieważ jest
stabilna. Nazwy takich konfiguracji to dublet elektronowy i oktet
elektronowy.
Energia jonizacji
jest to energia potrzebna do oderwania jednego
elektronu
od atomu.
Powinowactwo elektronowe
jest to efekt energetyczny
towarzyszący przyłączaniu przez atom danego pierwiastka
dodatkowego elektronu do powłoki walencyjnej
.
Elektroujemność
jest to zdolność atomu do przyciągania
elektronów obecnych w wiązaniu chemicznym.
Na skróty
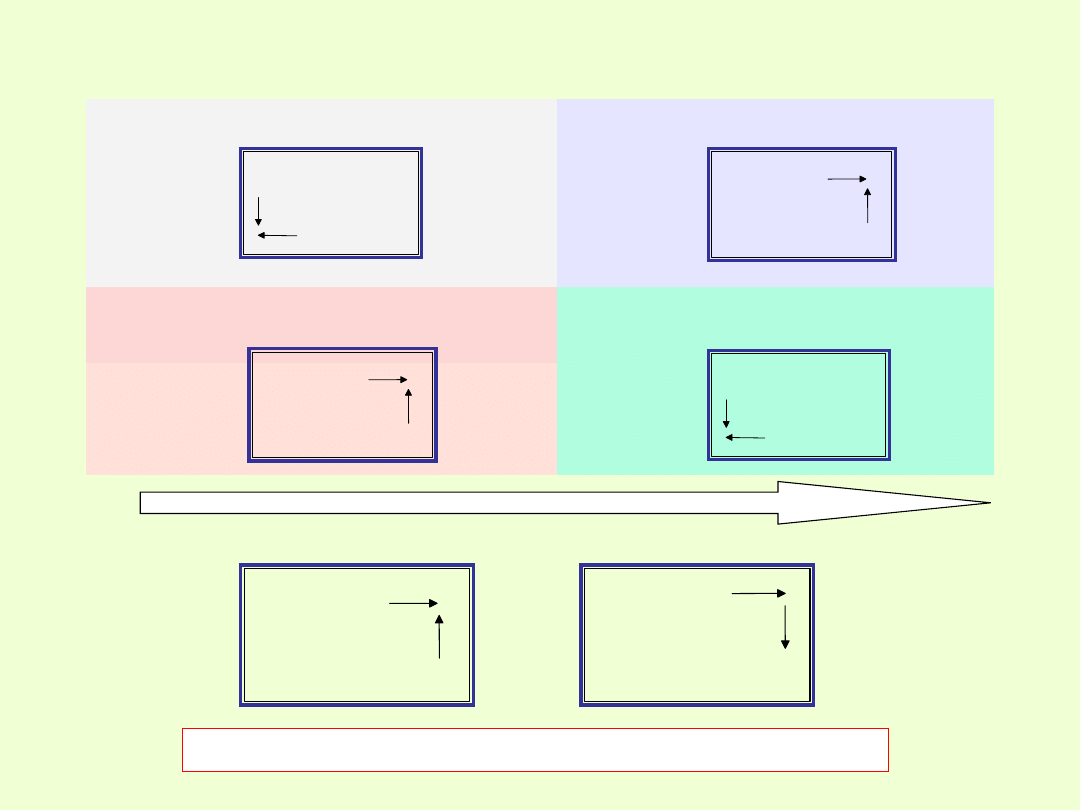
Metaliczność pierwiastków
Niemetaliczność
pierwiastków
Charakter kwasowy tlenków i
wodorków
Charakter zasadowy
tlenków i wodorków
Moc kwasów
tlenowych
Moc kwasów
beztlenowych
Wzrost maksymalnej wartościowości pierwiastka wobec tlenu
Wzrost mocy kwasów tlenowych i beztlenowych
Zmienność charakteru chemicznego pierwiastków grup głównych
wynikająca z położenia w układzie okresowym.

Pierwiastki grupy 1 są metalami i mają właściwości zasadotwórcze.
17 grupa –fluorowce, pierwiastki niemetaliczne, tworzące kwasy.
Zarówno kwasy tlenowe, jak i beztlenowe fluorowców są mocnymi
kwasami. Najmocniejsze kwasy tlenowe tworzą pierwiastki znajdujące
się w prawym górnym narożniku UOP,zaś w przypadku kwasów
beztlenowych moc kwasów można przedstawić następująco: HCl < HBr
< HI
Reaktywność chemiczna fluorowców rośnie w kierunku prawego,
górnego narożnika UOP.
W obrębie okresów układu okresowego pierwiastków obserwuje się
(wraz ze wzrostem liczby atomowej) zmianę właściwości od
metalicznych do niemetalicznych.
Granica między metalami i niemetalami, (choć trudno mówić o jakiejś
precyzyjnej granicy, jest to raczej dość płynne przejście) przebiega
ukośnie przez układ okresowy pierwiastków. Na granicy tej znajdują się
pierwiastki o charakterze przejściowym (amfotery).
Każdy okres zamknięty jest gazem szlachetnym, tworzącym grupę 18.
Pierwiastki grup 3 – 12 to na ogół metale o właściwościach bardziej
złożonych.
W grupach pobocznych mieszczą się, bowiem wyłącznie metale, czyli
pierwiastki tworzące zasady, i tzw. metaloidy, zwane niekiedy
półmetalami, czyli pierwiastki metaliczne z tendencją do tworzenia
kwasów na wyższych stopniach utlenienia ( wyższej wartościowości).
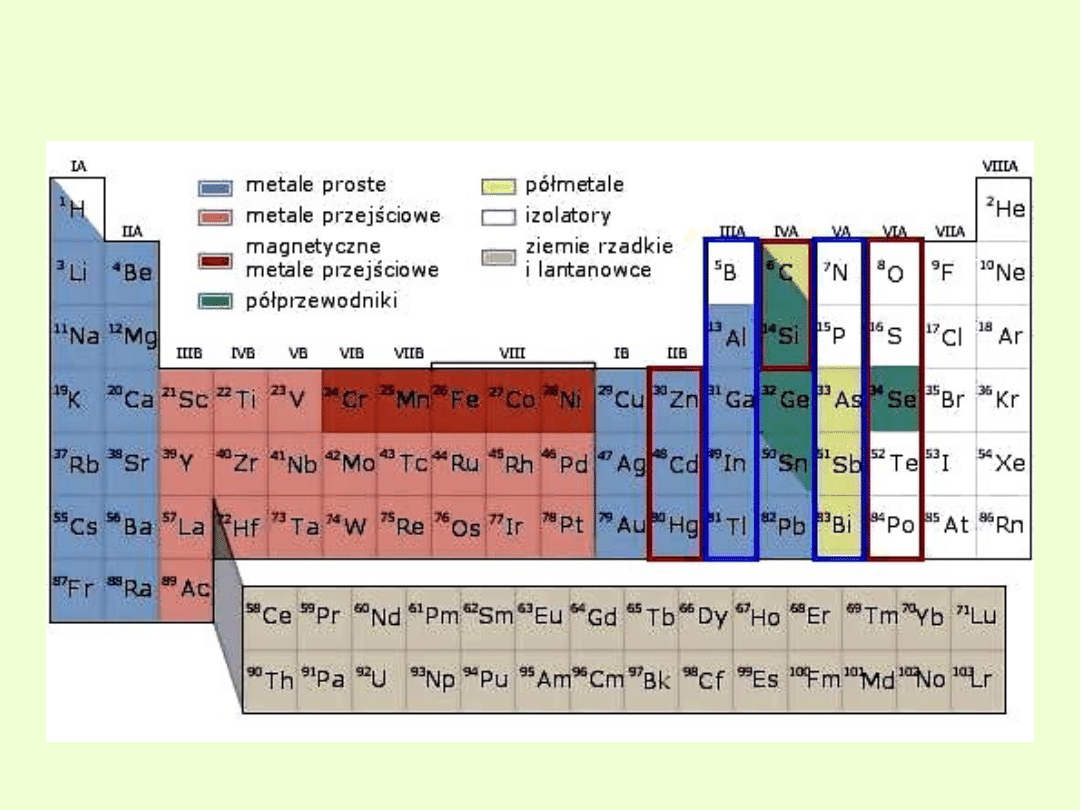
Własności elektryczne i magnetyczne
pierwiastków

Źródło
Program nauczania chemii dla liceum ogólnokształcącego, liceum
profilowanego i technikum -Szarota Styka-Wlazło, Maria Litwin
„ Chemia nieorganiczna” A.P. Cox
„ Repetytorium chemia od A do Z” M. Klimaszewska
Ilustracje:
http://www.chemik.edu.pl
http://www.meta-synthesis.com/webbook/35_pt/pt_database.php
http://www.lighting.pl/html/LED_Lediko/images/uklad_okresowy.jpg
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
Budowa atomu a układ okresowy pierwiastków chemicznych
Budowa atomu a układ okresowy pierwiastków chemicznych
Układ okresowy pierwiastków chemicznych, a budowa atomu2
UKŁAD OKRESOWY PIERWIASTKÓW
36 Atomy wieloelektronowe, układ okresowy pierwiastków
7 układ okresowy pierwiastków, wiązania chemiczne
Walkowiak, Chemia ogólna, Układ okresowy pierwiastków
Wyklad 6. Uklad okresowy pierwiastkow, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Powt. Dz. II, Powtórzenie wiadomości z działu II: Układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW (WERSJA SKRÓCONA) kolor, Dokumenty - chemia
Układ okresowy pierwiastków2, Chemia
Współczesny Układ Okresowy Pierwiastków, Chemia
uklad-okresowy-pierwiastkow
88 Uklad okresowy pierwiastkow 2
Układ okresowy pierwiastków chemicznych, szkoła. hist -gosp
Chemia Wykład 6 Układ Okresowy Pierwiastków
więcej podobnych podstron