

Spis treści
Ważniejsze kwasy – wartościowość reszt i nazewnictwo i
ch soli
Otrzymywanie soli
2. reakcja wodorotlenku z kwasem
3. reakcja tlenku metalu z kwasem
4. reakcja wodorotlenku z tlenkiem kwasowym
5. reakcja tlenku metalu z tlenkiem niemetalu
6. reakcja metalu z niemetalem
9. reakcja wodorotlenku z solą
11.inne metody otrzymywania soli
Definicja soli
Jest to związek chemiczny, którego cząsteczka zbudowana
jest z kationu (kationów) metalu i anionu (anionów) reszty
kwasowej.
Wzór ogólny soli obojętnej
A
B
n
n
m
m
M
–
oznacza symbol metalu
R
– oznacza wzór reszty
kwasowej
n
– oznacza ilość atomów metalu w
cząsteczce
m
– oznacza ilość reszt w cząsteczce
A
– wartościowość metalu w tym związku
B
–
wartościowość reszty kwasowej
Sole obojętne
zbudowane są z
kationów metalu (kationu amonowego) i
anionów reszty kwasowej
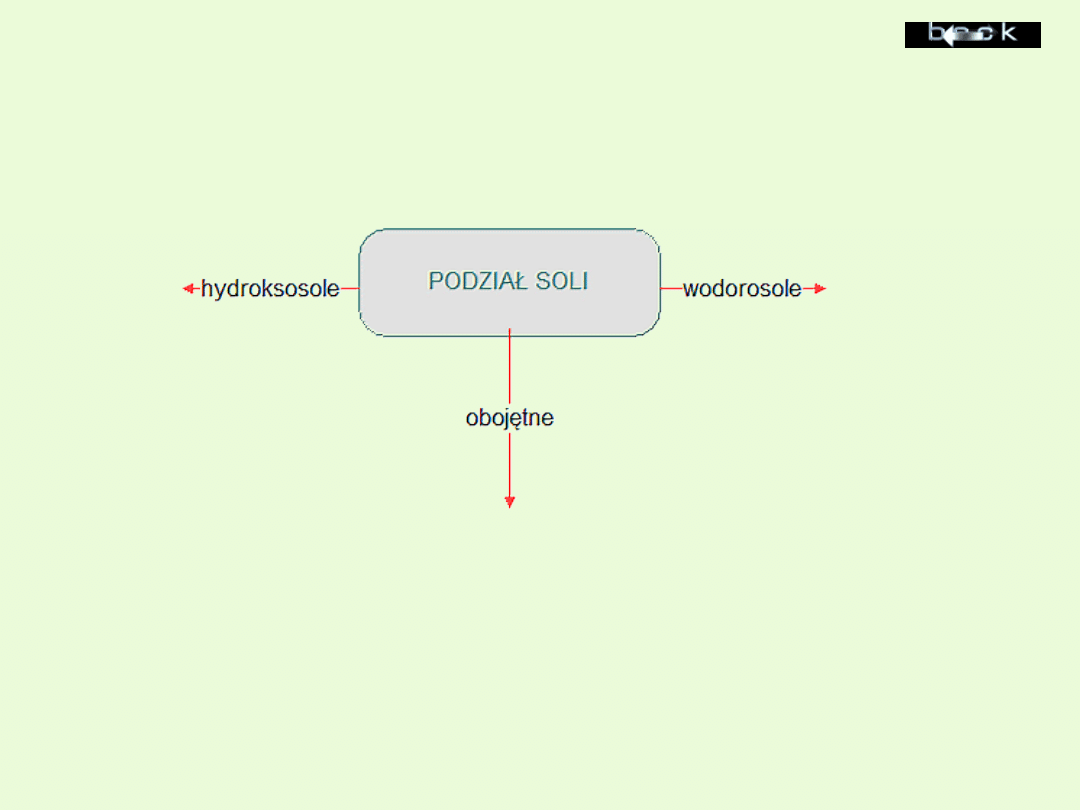
Wodorosole
są pochodnymi
kwasów wieloprotonowych,
w których nie wszystkie
atomy wodoru zostały
zastąpione kationem metalu
Hydroksosole
to sole, w
których część grup
wodorotlenowych
nie została zastąpiona
resztami kwasowymi. W
przyrodzie występują
stosunkowo rzadko
Np: wodorosiarczan
(VI) sodu NaHSO
4
,
diwodoroortofosforan(V)
potasu KH
2
PO
4
.
Np. :Mg(OH)Cl - chlorek
hydroksomagnezu,
[Al(OH)
2
]
3
PO
4
-
fosforan(V)
dihydroksoglinu
Sole uwodnione
(hydraty lub wodziany)- są to sole, które w swej
cząsteczce posiadają na trwale przyłączone cząsteczki wody (za pomocą
wiązań wodorowych w sieci krystalicznej). Woda zawarta w tych solach to
tzw. woda hydratacyjna.
Podział soli
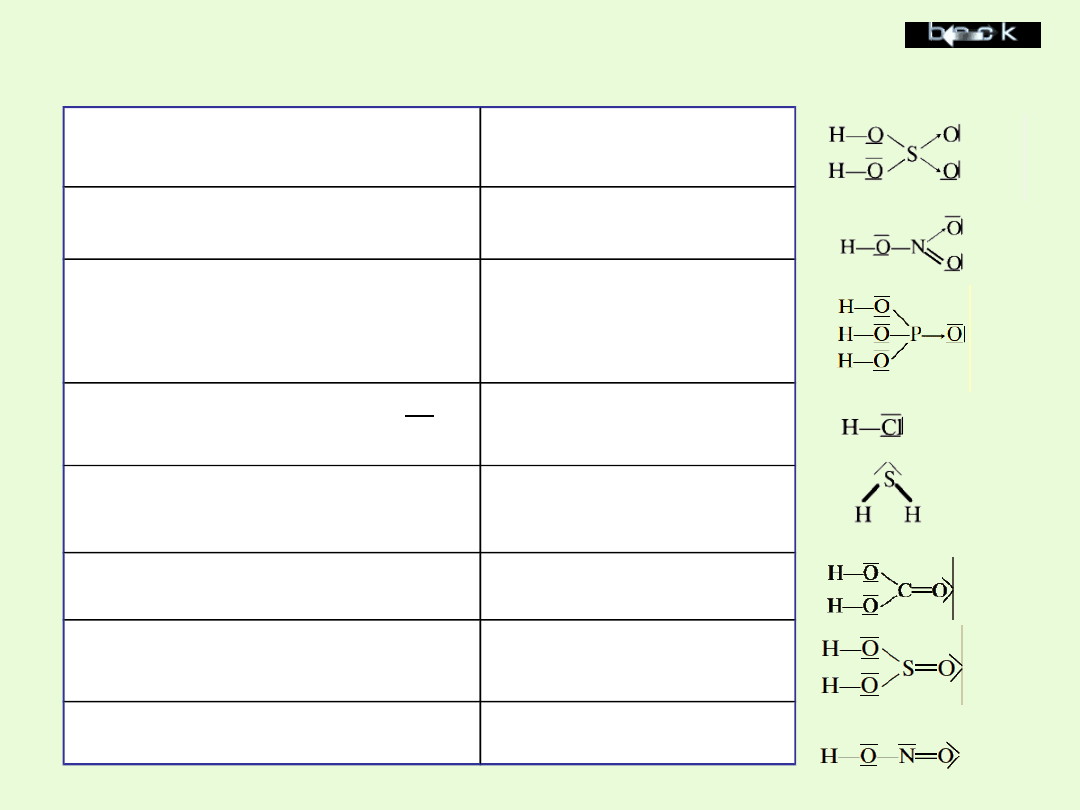
Ważniejsze kwasy – wartościowość reszt i nazewnictwo
ich soli
Kwas siarkowy (VI)
H
2
SO
4
II
SO
4
siarczan (VI)
Kwas azotowy (V)
H
NO
3
I
NO
3
azotan (V)
Kwas ortofosforowy (V)
H
3
PO
4
III
PO
4
ortofosforan
(V)
Kwas chlorowodorowy
H
Cl
I
Cl chlorek
Kwas siarkowodorowy
H
2
S
II
S siarczek
Kwas węglowy
H
2
CO
3
II
CO
3
węglan
Kwas siarkowy (IV)
H
2
SO
3
II
SO
3
siarczan (IV)
Kwas azotowy (III)
H
NO
2
I
NO
2
azotan (III)

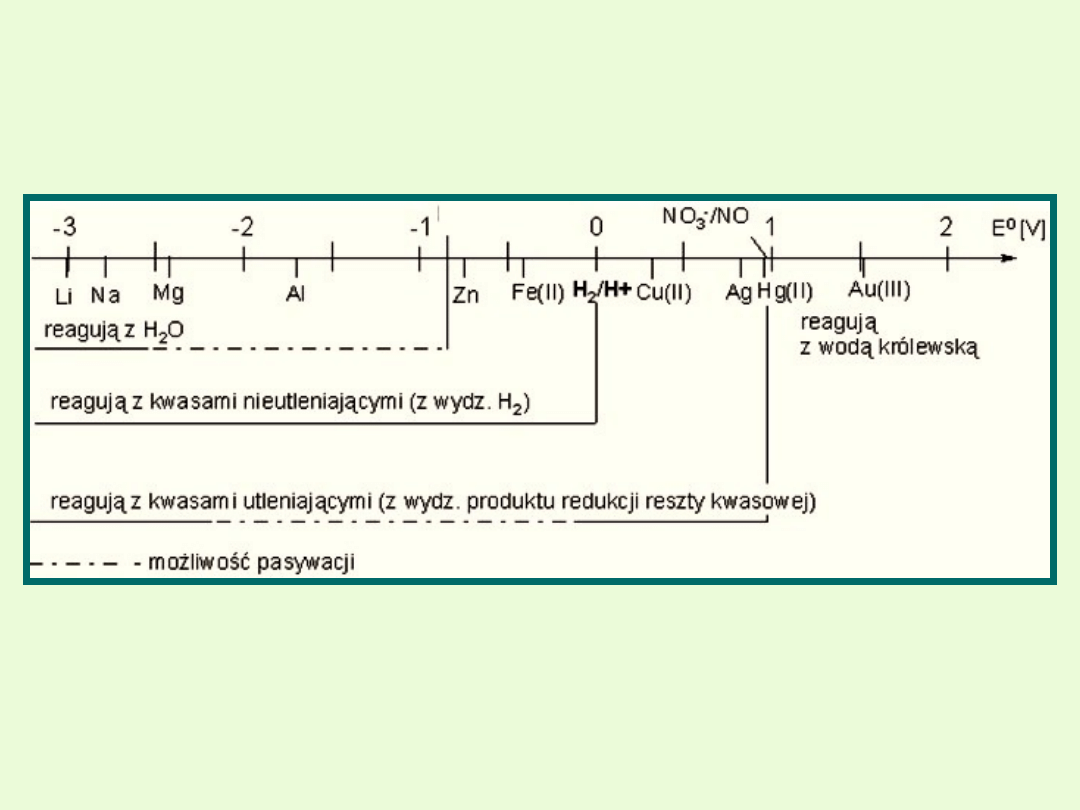
Aktywność metali
Szereg elektrochemiczny metali jest to zestawienie metali według
wzrastających potencjałów normalnych. Potencjał normalnej elektrody
wodorowej E
0
= 0
Każdy metal o niższym normalnym potencjale wypiera z roztworu
metal o potencjale wyższym, np. Zn + Pb
2+
→ Zn
2+
+ Pb
-reguła nie dotyczy litowców i berylowców, które z wodnych roztworów
nie wypierają innych metali –pierwszeństwo ma reakcja z wodą
[otrzymywanie wodorotlenków]. Mg i Be reagują z wodą na gorąco, więc
w temperaturze pokojowej mogą wypierać inne metale z roztworu.
-Al nie wydziela z roztworów zawierających jony Fe
2+
, Zn
2+,
Pb
2+
i
Cu
2+
metali, ponieważ ulega pasywacji –pokrywa się warstewką
ochronną swojego tlenku
Aktywność chemiczną metali określa się na podstawie możliwości
wyparcia wodoru z roztworu kwasu przez dany metal.
Wartości ujemne

Przykłady pasywacji
Al + HNO
3
→ nie zachodzi
Al + H
2
SO
4
stęż. → nie zachodzi
Fe + HNO
3
stęż. → nie zachodzi
Glin nie reaguje z kwasem azotowym (V) i ze stężonym kwasem siarkowym (VI).
Żelazo, chrom nie reagują ze stężonym kwasem HNO
3
, podczas gdy jego
rozcieńczone roztwory roztwarzają te metale, chociaż z bardzo różnymi
szybkościami.
Warstwą pasywującą są produkty utleniania metali (zwykle ich tlenki).
Metale o potencjałach ujemnych mogą wypierać wodór.
Są to metale aktywne, nazywane nieszlachetnymi.
Zn + 2H
+
→ Zn
2+
+ H
2
↑
Reakcja przebiega tym mniej energicznie, im bliższy zera jest potencjał
normalny metalu.
Metale o dodatnich potencjałach nie wypierają wodoru z kwasów.
Metale te nazywane są metalami szlachetnymi (Au, Pt) i półszlachetnymi
(Cu, Hg, Ag).
Im bardziej ujemny potencjał normalny metalu, tym większa jest jego
zdolność do utleniania się (oddawania elektronów).
K, Na, Ca, Mg, Al., Zn, Fe, Ni, Sn, Pb
,
H,
Bi, Cu, Hg, Ag, Pt, Au
Metale aktywniejsze od wodoru
–
potencjał ma wartość ujemną
2.
otrzymywanie soli – reakcja metalu z
kwasem
wodór
sól
metal
kwas
wodoru
od
zy
aktywniejs
jacy
nieutlenia
_
_
wodór
sól
metal
kwas
wodoru
od
zy
aktywniejs
jacy
nieutlenia
_
_
Metale o ujemnym potencjale elektrodowym rozpuszczają się w
kwasach nie utleniających z wydzieleniem wodoru:
Istotą tego procesu jest reakcja atomów aktywnego metalu z kationami
wodoru, w wyniku czego powstają kationy metalu i cząsteczki wodoru.
Kwasy, w których są redukowane kationy wodoru to kwasy nie
utleniające.
Należą do nich wszystkie kwasy beztlenowe.
Kwasy utleniające posiadają resztę kwasową, która może ulegać
redukcji.
Należą do nich
HNO
3
oraz
stężony H
2
SO
4
2
2H
n
Me
nH
Me
n

2
4
4
2
H
ZnSO
SO
H
Zn
Przykłady
2
2
2
2
2
2
H
Zn
H
2
Zn
H
Cl
2
Zn
Cl
2
H
2
Zn
H
ZnCl
HCl
2
Zn
Reakcja
utleniania
Reakcja redukcji
2
2
H
2e
2H
Zn
2e
Zn
2
H
3
3
Cl
Al
2
Cl
H
6
Al
2
0
2
H
3
Cl
6
3
Al
2
Cl
6
H
6
0
Al
2
0
2
H
3
3
Al
2
H
6
0
Al
2

Reakcje otrzymywania soli, charakterystyczne dla kwasów
utleniających
Kwasy utleniające posiadają resztę kwasową, która może ulegać redukcji.
Należą do nich
HNO
3
oraz
stężony H
2
SO
4
.
Reakcje stężonego kwasu azotowego (V) z metalami mniej
aktywnymi niż wodór (nie mogącymi wyprzeć wodoru z cząsteczki
kwasu):
Ag + 2HNO
3
--> AgNO
3
+ NO
2
+ H
2
O
Reakcje rozcieńczonego kwasu azotowego (V) z metalami mniej
aktywnymi niż wodór:
O
H
4
NO
2
)
Cu(NO
3
HNO
8
Cu
3
O
H
4
NO
2
Cu
3
H
NO
2
Cu
3
2
O
H
2
NO
H
4
e
3
NO
3
e
2
Cu
Cu
2
2
3
3
2
2
3
2
3
2
O
4H
2NO
)
3Cu(NO
8HNO
3Cu
2
2
3
3

Reakcje stężonego kwasu siarkowego (VI) z metalami, mniej aktywnymi
niż wodór:
Cu + 2 H
2
SO
4
--> CuSO
4
+ SO
2
+ 2 H
2
O
O
H
2
H
4
e
2
SO
Cu
e
2
Cu
2
2
4
2
o
2
SO
Reakcja metalu aktywniejszego od wodoru ze stężonym H
2
SO
4
Zn + 2H
2
SO
4
→ ZnSO
4
+SO
2
+ 2H
2
O
W przypadku HNO
3
stopień redukcji azotu zależy przede wszystkim od
aktywności metalu, warunków reakcji, stężenia kwasu.(NH
3
, N
2
O, NO,
NO
2
)
W reakcjach rozcieńczonego(1-2%)HNO
3
z bardzo aktywnymi metalami
(K, Na,Mg) wydziela się wodór, ponieważ metale te reagują z wodą,
tworząc wodorotlenek i wodór, Utworzony wodorotlenek, reaguje dalej z
HNO
3
na zasadzie reakcji zobojętniania. Metale, które w normalnym
warunkach praktycznie nie reagują z wodą, typu Zn, Fe, Ni, Pb zawsze
reagują z HNO
3
na zasadzie redukcji reszty kwasowej.
4Zn + 10HNO
3
→NH
4
NO
3
+ 4Zn(NO
3
)
2
+ 3H
2
O ( stężony HNO
3
).
Dla dociekliwych
Złoto czy platyna nie reagują ze stężonym kwasem azotowym (V),
jednak mieszanina tego kwasu ze stężonym kwasem solnym (woda
królewska), który nie jest kwasem utleniającym, jest utleniaczem
zdolnym je roztworzyć.
Przebieg reakcji można jakościowo uzasadnić regułą przekory.
Równowaga reakcji utleniania złota przez jony azotanowe(V):
1
O
H
3
(aq)
NO
3
(aq)
Au
(aq)
H
6
(aq)
NO
3
Au
2
2
3
3
przesunięta jest bardzo silnie w lewo (stała równowagi tej reakcji
można obliczyć na podstawie potencjałów standardowych redoks)
Wyższe od standardowego stężenia jonów azotanowych i wodorowych
przesuwają stan równowagi(1) w prawo.
Równocześnie w tym samym roztworze jony chlorkowe (o znacznym
stężeniu)
reagują z produktem reakcji (1) wg równania:
Stała równowagi reakcji (2) jest wysoka i prowadzi do obniżenia
stężenia Au
3+
, co powoduje przebieg reakcji(1) w prawo i pomimo
niekorzystnej
wartości jej stałej równowagi zachodzi ona praktycznie do końca.
(aq)(2)
AuCl
(aq)
Cl
4
(aq)
Au
4
3
2.
otrzymywanie soli – reakcja wodorotlenku z kwasem
a
bojetniani
reakcja zo
woda
sól
nek
wodorotle
Kwas
a
bojetniani
reakcja zo
woda
sól
nek
wodorotle
Kwas
Reakcja zobojętniania polega na łączeniu się jonów wodorowych
(hydroniowych H
3
O
+
) z jonami wodorotlenkowymi na niezdysocjowane
cząsteczki wody.
O
H
2
Cl
2
Ca
Cl
2
H
2
OH
2
Ca
O
H
2
CaCl
HCl
2
Ca(OH)
2
2
2
2
2
2
Przykład
y
O
H
SO
Na
2
SO
H
2
OH
2
Na
2
O
H
2
SO
Na
SO
H
NaOH
2
2
li
roztwór_so
2
4
2
4
2
4
2
4
2
O
2
H
3
3
4
PO
K
3
OH
3
K
3
3
4
PO
H
3
O
2
H
3
4
PO
3
K
OH
K
3
4
PO
3
H

Produktami niecałkowitego podstawiania grup OH w cząsteczce wodorotlenku
przez reszty kwasowe są hydroksosole.
Na przykład w Mg(OH)
2
obie grupy OH zostaną zastąpione resztami kwasowymi,
tworzy się sól obojętna:
Mg(OH)
2
+ 2HCl→ MgCl
2
+ 2H
2
O
jeżeli zostanie zastąpiona tylko jedna z nich, to produktem będzie hydroksysól:
Mg(OH)
2
+ HCl → Mg(OH)Cl + H2O
Mogą one powstawać w reakcji z zasadą przeprowadzonej przy odpowiednim
stosunku stechiometrycznym kwasu i zasady.
Wodorotlenki zawierające trzy grupy OH mogą, oprócz soli obojętnej, tworzyć dwa
rodzaje hydroksosoli:
Al(OH)
3
+ 3HCl → AlCl
3
+ 3H
2
O
Al(OH)
3
+ 2HCl → Al(OH)Cl
2
+ 2H
2
O
Al(OH)
3
+ HC l→ Al(OH)
2
Cl + H
2
O
Jeśli kationy metalu nie zastąpiły wszystkich kwasowych atomów wodoru to
powstają wodorosole.
Na przykład : 2NaOH + H
2
SO
4
→ Na
2
SO
4
+ 2H
2
O
jednak gdy tylko jeden kation sodu wyprze kation wodoru, to powstanie wodorsól:
NaOH + H
2
SO
4
→ NaHSO
4
+ H
2
O
Wodorosole mogą powstawać m.in. w reakcji wodorotlenku z kwasem,
przeprowadzonej w odpowiednim stosunku stechiometrycznym kwasu i zasady.

3.
otrzymywanie soli – reakcja tlenku metalu z
kwasem
woda
sól
talu
tlenek me
Kwas
woda
sól
talu
tlenek me
Kwas
O
2
H
2
3
NO
Cu
3
NO
H
2
CuO
O
2
H
Cl
K
2
Cl
H
2
O
2
K
Przykłady
Tlenki metali z grup od 1 do 13 bo tam głównie znajdują się metale
mogą reagować z kwasami, przy czym w grupach od 4 do 12, tylko
tlenki na najniższych stopniach utlenienia.
O
2
H
3
2
4
PO
3
Ca
O
Ca
3
4
PO
3
H
2
O
2
H
4
SO
2
O
2
Na
4
SO
2
H
Na
4.
otrzymywanie soli – reakcja wodorotlenku
metalu
z tlenkiem niemetalu
woda
sól
zasada
sowy
tlenek kwa
kwasowy
bezwodnik
woda
sól
zasada
sowy
tlenek kwa
kwasowy
bezwodnik
O
2
H
2
3
NO
Mg
5
O
2
N
2
OH
Mg
O
H
SiO
Na
NaOH
2
SiO
O
H
CaCO
Ca(OH)
CO
2
3
2
2
2
3
2
2
Przykład
y
5.
otrzymywanie soli – reakcja tlenku metalu
z
tlenkiem niemetalu
4
2
2
3
3
2
SO
Na
O
Na
SO
CaSO
CaO
SO
sól
sadowy
tlenek za
sowy
tlenek kwa
sól
sadowy
tlenek za
sowy
tlenek kwa
4
PO
3
Na
4
O
2
Na
6
10
O
4
P
3
CO
2
K
O
2
K
2
CO
Przykład
y
Tym sposobem można otrzymywać tylko sole kwasów tlenowych.

6.
otrzymywanie soli – reakcja metalu z
niemetalem
sól
niemetal
metal
sól
niemetal
metal
Jest to najprostszy sposób otrzymywania
soli beztlenowych
.
Należy jednak pamiętać, iż nie wszystkie metale wejdą w powyższą
reakcję.
II
S
e
2
0
S
I
K
2
e
2
0
K
2
S
2
K
S
K
2
Cl
Na
2
2
Cl
Na
2
Przykład
y
Zn + Cl
2
→ ZnCl
2
2Al + 3S → Al
2
S
3
METAL
+
NIEMETAL
KWAS
+
WODOROTLENEK
KWAS
+
METAL
KWAS
+
TLENEK METALU
WODOROTLENEK
+
TLENEK
NIEMETALU
S
Ó
L
┼
TLENEK METALU
+
TLENEK
NIEMETALU
WODA
WODÓR
WODA
WODA
Metody otrzymywania soli
7.
otrzymywanie soli – reakcja soli z kwasem
kwas
sól
sól _1
Kwas_1
kwas
sól
sól _1
Kwas_1
Przykład
y
2
2
2
3
2
2
3
3
2
3
CO
H
2
2
3
3
3
2
CO
O
H
H
2
CO
CO
O
H
NO
2
Na
2
NO
2
H
2
CO
Na
2
CO
O
H
NaNO
2
HNO
2
CO
Na
3
2
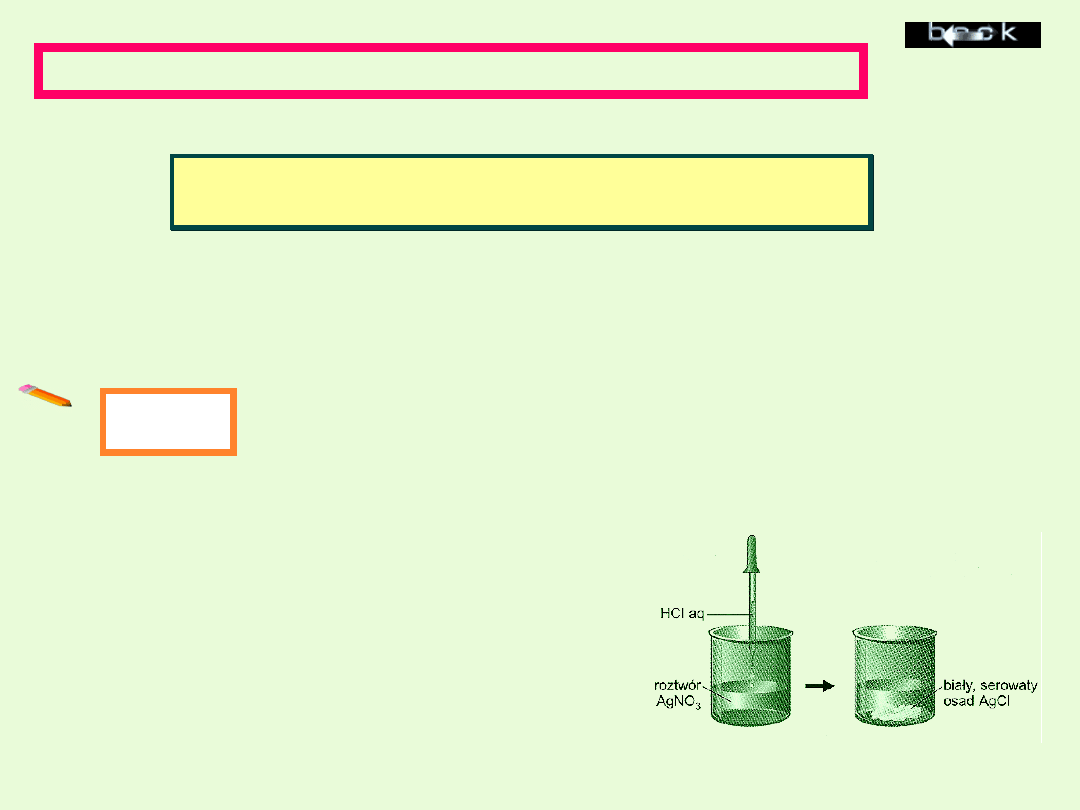
AgNO
3
+ HCl → AgCl ↓ +
HNO
3
Ag
+
+ NO
3
-
+ H
+
+ Cl
-
→ AgCl ↓ + H
+
+ NO
3
-
Ag
+
+ Cl
-
→ AgCl ↓
Reakcje soli z kwasem zachodzą tylko wtedy, gdy działający
kwas jest mocniejszy niż kwas, z którego powstała sól, lub gdy w
wyniku reakcji powstaje osad.
Każdy metal o niższym potencjale elektrodowym redukuje
kationy metalu o wyższym potencjale elektrodowym.
Metal mniej szlachetny powoduje wydzielanie metalu bardziej
szlachetnego z roztworu jego soli.
metal
sól
sól _1
1
metal
_
metal
sól
sól _1
1
metal
_
8.
otrzymywanie soli – reakcja metalu z solą
m
n
1
nMe
mMe
1
nMe
mMe
Przykład
y
Zn + CuSO
4
→ ZnSO
4
+ Cu
Zn + Cu
2+
+ SO
4
2-
→ Zn
2+
+ SO
4
2-
+
Cu
Zn + Cu
2+
→ Zn
2+
+ Cu
Cu + 2AgNO
3
→ Cu(NO
3
)
2
+ 2Ag
Cu + 2Ag
+
→ Cu
2+
+ 2Ag
Wydzielanie metali ma szerokie zastosowanie praktyczne, głównie przy
otrzymywaniu metali z wodnych roztworów ich soli oraz przy oczyszczaniu soli
metali od zanieczyszczeń jonami metali.

9.
otrzymywanie soli – reakcja wodorotlenku z
solą
nek
wodorotle
sól
sól 1
ek 1
wodorotlen
nek
wodorotle
sól
sól 1
ek 1
wodorotlen
OH
Na
2
4
SO
Ba
2
OH
Ba
4
SO
2
Na
OH
2
Na
2
4
SO
Ba
OH
2
2
Ba
2
4
SO
Na
2
4
SO
Ba
2
4
SO
2
Ba
Przykład
y
CaCO
CO
+
Ca
OH
2
+
Na
2
+
CaCO
CO
+
Na
2
+
OH
2
+
Ca
NaOH
2
+
CaCO
CO
Na
+
Ca(OH)
3
-
2
3
+
2
-
+
3
-
2
3
+
-
+
2
3
3
2
2
W reakcjach soli z zasadami są istotne tylko te procesy, w
których powstaje osad

Tabela rozpuszczalności soli
Barwa odpowiada kolorowi
roztworu lub osadu
Rozpuszczalna
Słabo rozpuszczalna
Praktycznie
nierozpuszczalna
W r-rze zachodzą
skomplikowane reakcje
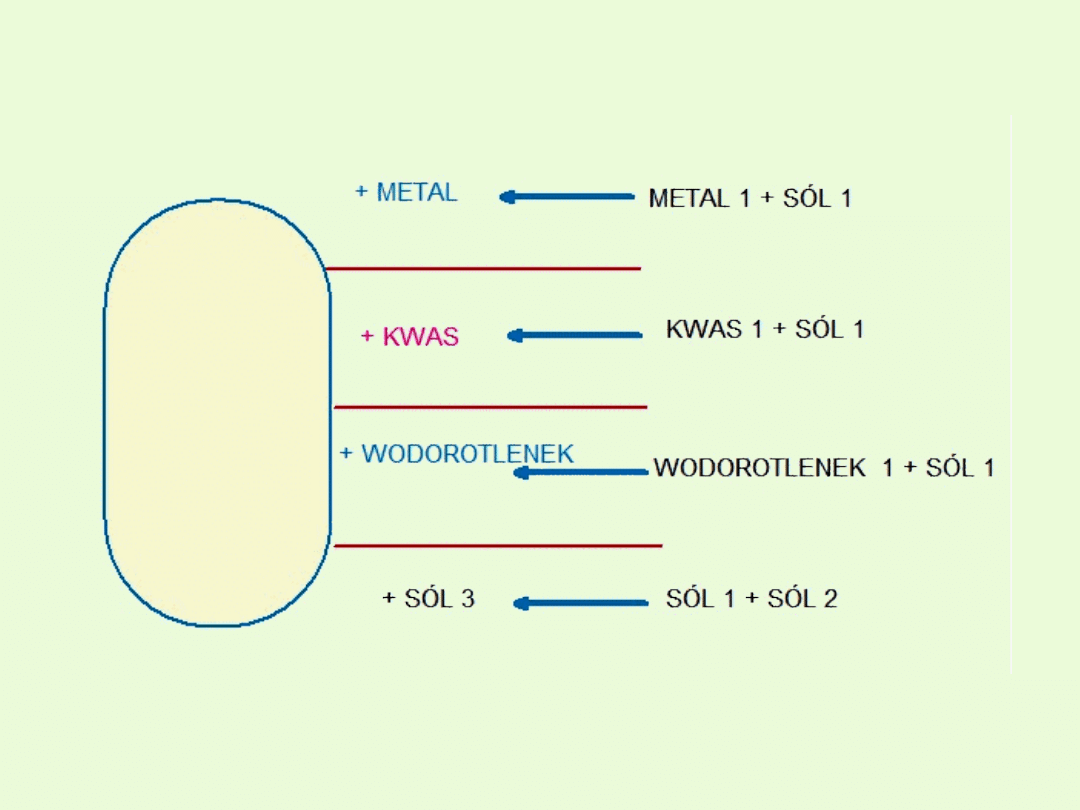
Warunkiem zajścia reakcji jest wytrącenie się jednej soli w
postaci osadu.
Pamiętajmy, że wszystkie azotany są dobrze rozpuszczalne w wodzie, natomiast
chlorki z wyjątkami. Do tych wyjątków zaliczamy chlorek srebra, talu, rtęci(I) i
ołowiu(II). Można bez większego błędu przyjąć, że poza nielicznymi wyjątkami,
sole metali leżących w 1 grupie są dobrze rozpuszczalne w wodzie.
( Tablica rozpuszczalności soli)
sól 3
sól
sól 2
sól 1
sól 3
sól
sól 2
sól 1
10.
otrzymywanie soli – reakcja soli z solą
3
KNO
2
2
PbI
KI
2
2
3
NO
Pb
3
NO
2
K
2
2
PbI
I
2
K
2
3
NO
2
2
Pb
2
PbI
I
2
2
Pb
Przykład
y
CdS
S
Cd
2Na
2Cl
CdS
S
2Na
2Cl
Cd
2NaCl
CdS
S
Na
CdCl
-
2
2
-
-
2
-
2
2
2
S
Ó
L
Metody otrzymywania soli

Metal + zasada
2Al +2H
2
O + 2NaOH → 2NaAlO
2
+ 3H
2
Reakcji tej ulegają jedynie nieliczne metale (Al, Zn)
Tlenek metalu + wodorotlenek
Al
2
O
3
+ 2NaOH → 2NaAlO
2
+ H
2
O
ZnO + 2KOH → K
2
ZnO
2
+ H
2
O
W ten sposób mogą reagować tylko tlenki amfoteryczne. Znajdziemy
je głównie w grupach od 4 do 13 oraz ostatnie pierwiastki grupy 14. W
grupach od 4 do 7 tylko tlenki na pośrednich stopniach utlenienia
wykazują charakter amfoteryczny
kwas + kwas
H
3
AsO
3
+ 3HCl → AsCl
3
+ 3H
2
O
Według takiego opisu zachodzą reakcje jedynie z metalami
amfoterycznymi, wykazującymi silniejsze właściwości kwasowe
niż zasadowe
Dla dociekliwych
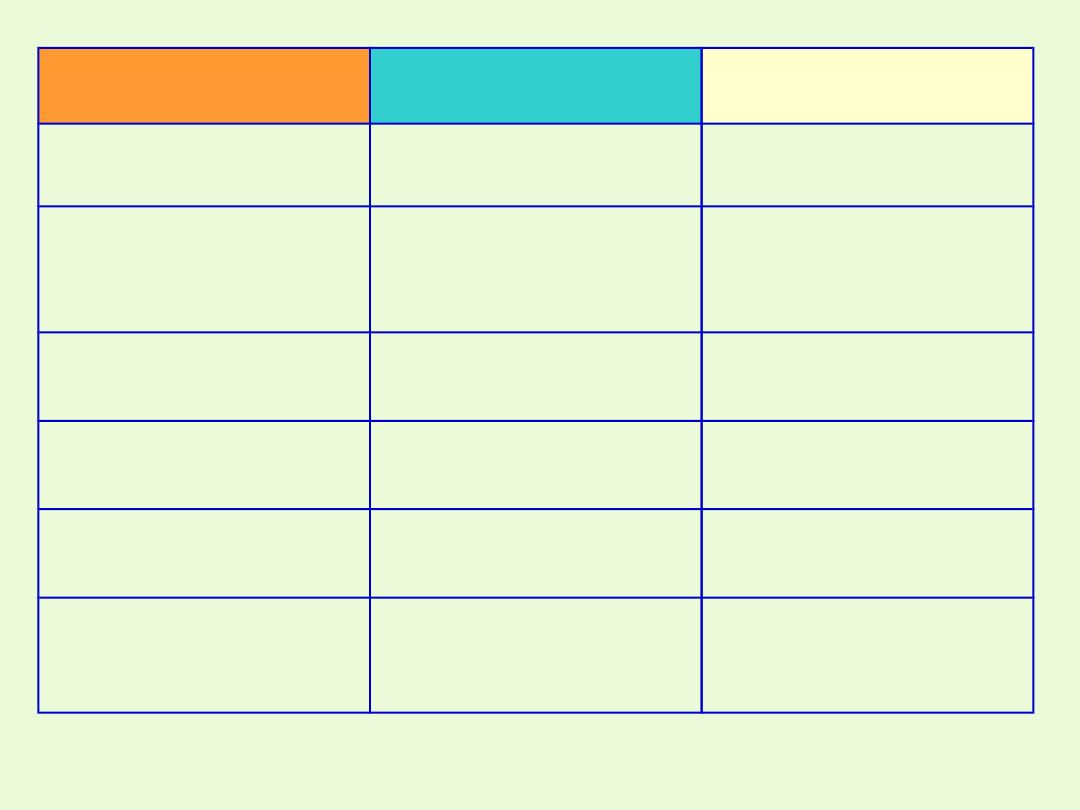
Sposób
otrzymywania
Produkty
Uwagi
Metal +niemetal
Sól kwasu
beztlenowego
Tylko sole kwasów
beztlenowych
Metal +kwas
Sól + wodór
Tylko metale
aktywniejsze od wodoru
(potencjał < 0) i kwasy
nie utleniające
Tlenek metalu + kwas
Sól + woda
Wodorotlenek metalu
+kwas
Sól + woda
Reakcja zobojętniania.
Tlenek metalu +tlenek
kwasowy
Sól
Tylko dla soli kwasów
tlenowych
Zasada +tlenek
kwasowy
Sól + woda
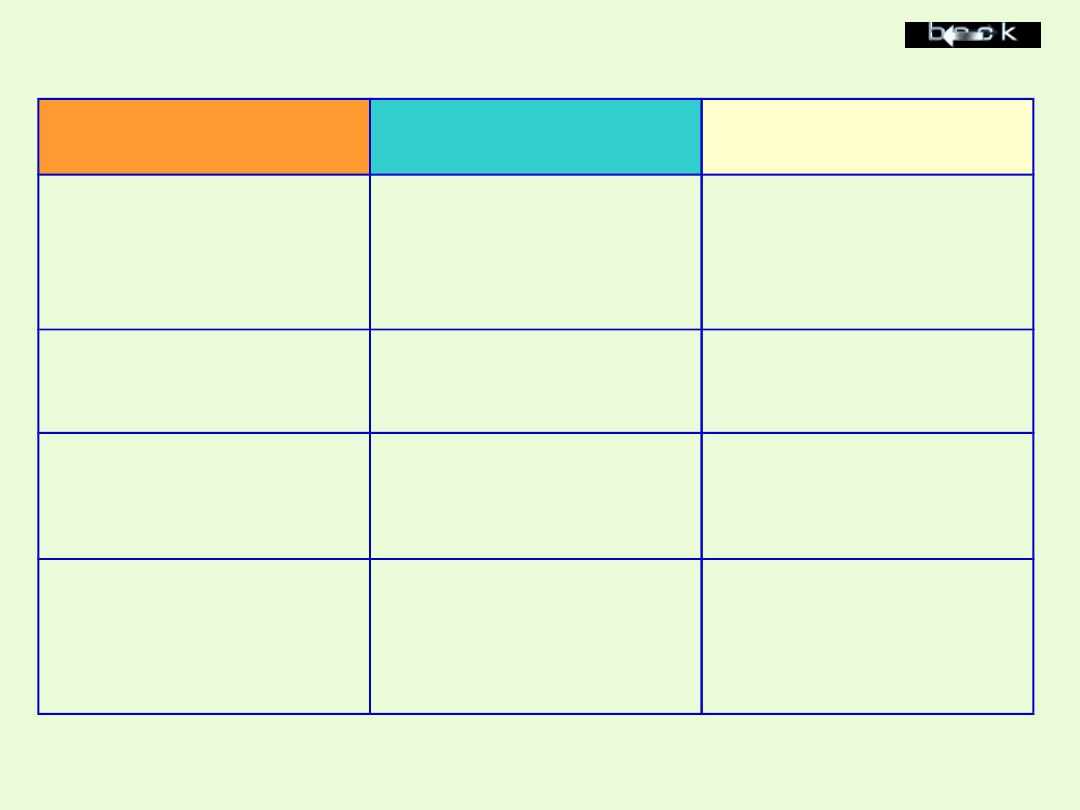
Sposób
otrzymywania
Produkty
Uwagi
Kwas1 + sól1
Kwas2 +sól2
Działający kwas jest
mocniejszy niż kwas, z
którego powstała sól, lub
gdy w wyniku reakcji
powstaje osad.
Sól1 + wodorotlenek1
Sól 2 + wodorotlenek2
Te procesy, w których
powstaje osad
Sól1 + sól2
Sól3 + Sól4
Obie sole-substraty są
dobrze rozpuszczalne w
wodzie, a sól-produkt
strąca się jako osad
Metal1 + sól1
Metal2 + sól2
Metal mniej szlachetny
powoduje wydzielanie
metalu bardziej
szlachetnego z roztworu
jego soli.

Vademecum Matura 2009 – Stanisława Hejwowska
Czasopismo „Chemia w szkole”
„Kompedium wiedzy z chemii dla gimnazjalisty” Beata Sobczyk
Ilustracje:
http://szkolne.eu/admin/produkty_pod/TAB_ROZPUSZCZALNOSCI.j
pg
http://mwalnik.wodip.opole.pl/chemia/reakcje_met/reakcje_met.ht
ml
Bibliografia
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
Chemia nowej ery 2 Kartkówki z doświadczeń Reakcje otrzymywania soli
Sposoby Otrzymywania soli
metody otrzymywania soli, Chemia
Chemia VII Otrzymywanie soli id 112956
9 Sposobów otrzymywania Soli
Chemia Metody otrzymywania soli; wodorosole i hydroksysole
otrzymywanie soli oraz dysocjaca, Wypracowania do szkoły, Chemia
10 metod otrzymywania soli
otrzymywanie soli
1u - otrzymywanie soli, dydaktyka, konspekty
METODY OTRZYMYWANIA SOLI, Liceum, testy
metody otrzymywania soli II G zadania, Sprawdziany, CHEMIA
metody otrzymywania soli
Chemia Otrzymywanie Soli
Równania reakcji Otrzymywania Soli oraz ich nazwy
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
chemia Metody otrzymywania soli
więcej podobnych podstron