
Nomenklatura związków
nieorganicznych

Nazwy jonów dodatnich – kationy
nazwę kationu tworzy się od nazwy
pierwiastka w dopełniaczu
• Li
+
- jon litu
• Cu
2+
- jon miedzi II
• Hg
22+
- jon dirtęci I
• H
+
- jon wodoru I lub hydron- (gdy liczba
przyłączonych cząsteczek nie jest znana lub
nieistotna)
• H
3
O
+
- jon oksoniowy lub oksonium
• NH
4+
- jon amonu lub jon amonowy,
amonium, azanium
• UO
22+
- jon uranylowy VI lub jon
dioksouranu VI

Nazwy anionów tworzy się za pomocą
końcówki „-owy” dołączonej do nazwy grupy
lub pierwiastka
• H
-
- jon wodorkowy
• OH
-
- anion
wodorotlenowy
• F
-
- jon fluorkowy
• S
2-
- jon siarczkowy
• C
4-
- jon węglikowy
• O
2-
- jon ditlenkowy(-1)
nazwa dopuszczalna-
anion ponadtlenkowy
• O
22-
- jon ditlenkowy (-2)
nazwa dopuszczalna-
anion nadtlenkowy
• O
3-
- jon tritlenkowy (-
1) nazwa
dopuszczalna anion
ozonkowy
• N
3-
- jon
triazotkowy(1-)
• NO
3-
- jon azotanowy V
• HSO
4-
- jon
wodorosiarczanowy VI
• SCN
-
- jon
tiocyjnianowy

Nazewnictwo tlenków
• Tlenki to związki o wzorze ogólnym E
n
O
m
E –jest
symbolem dowolnego pierwiastka z wyjątkiem fluoru
• Nazwy tlenków prostych tworzy się łącząc słowo
tlenek z nazwą pierwiastka w dopełniaczu a w
nawiasie podaje się stopień utlenienia
• Cl
2
O
7
– tlenek chloru VII
• NO
2
– tlenek azotu IV
• Al
2
O
3
– tlenek glinu
• FeO – tlenek żelaza II
• Cs
2
O tlenek cezu
• Pb
2
PbO
4
tlenek diołowiu II ołowiu IV –tlenek mieszany
• H
2
O
2
– nadtlenek wodoru

Podział tlenków
• Kwasowe – reagujące z zasadami- w reakcji
z wodą dają kwasy
• Zasadowe- reagujące z kwasami – w reakcji
z wodą dają zasady
• Amfoteryczne – reagują z kwasami i
zasadami
• Obojętne – niereagujące z kwasami,
zasadami i wodą – mogą rozpuszczać się w
wodzie na zasadzie fizycznej
rozpuszczalności
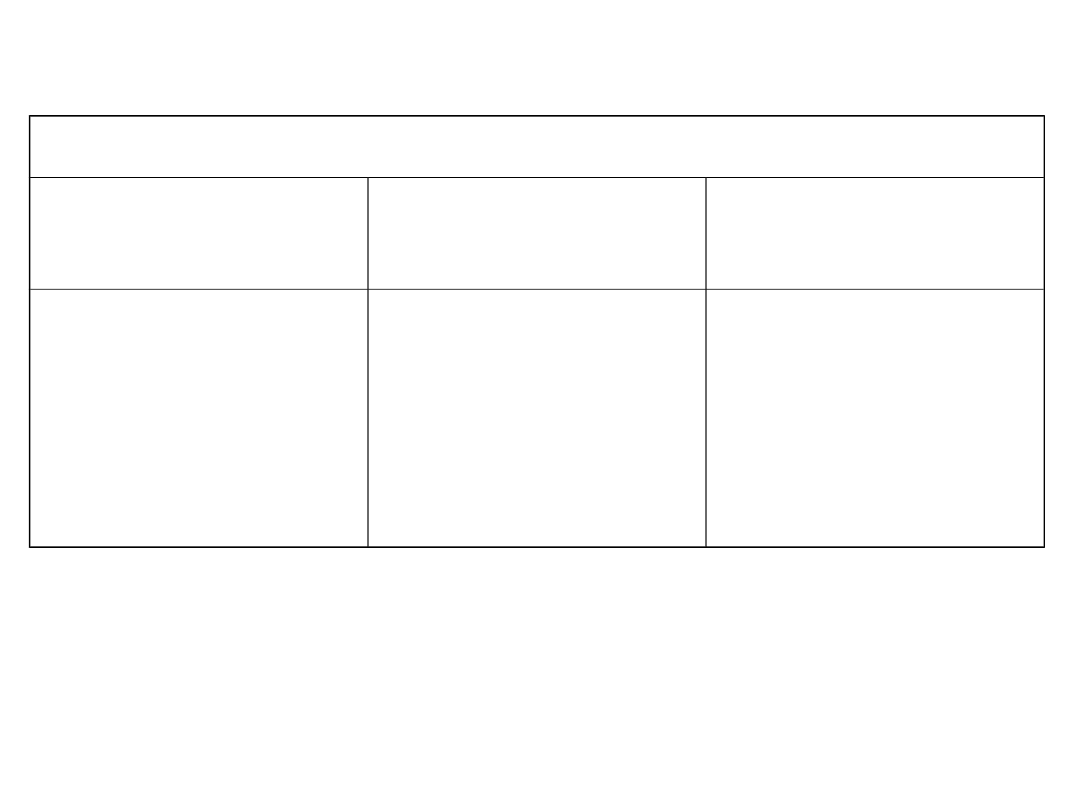
Tlenki reagujące z wodą
Tlenki
kwasowe
Tlenki
zasadowe
Tlenki
amfoteryczne
Niemetali
SO
2
, NO
2
Metali
CrO
3
, Mn
2
O
7
Metali K
2
O,
CaO
Półmetali
As
2
O
3
Metali V
2
O
5
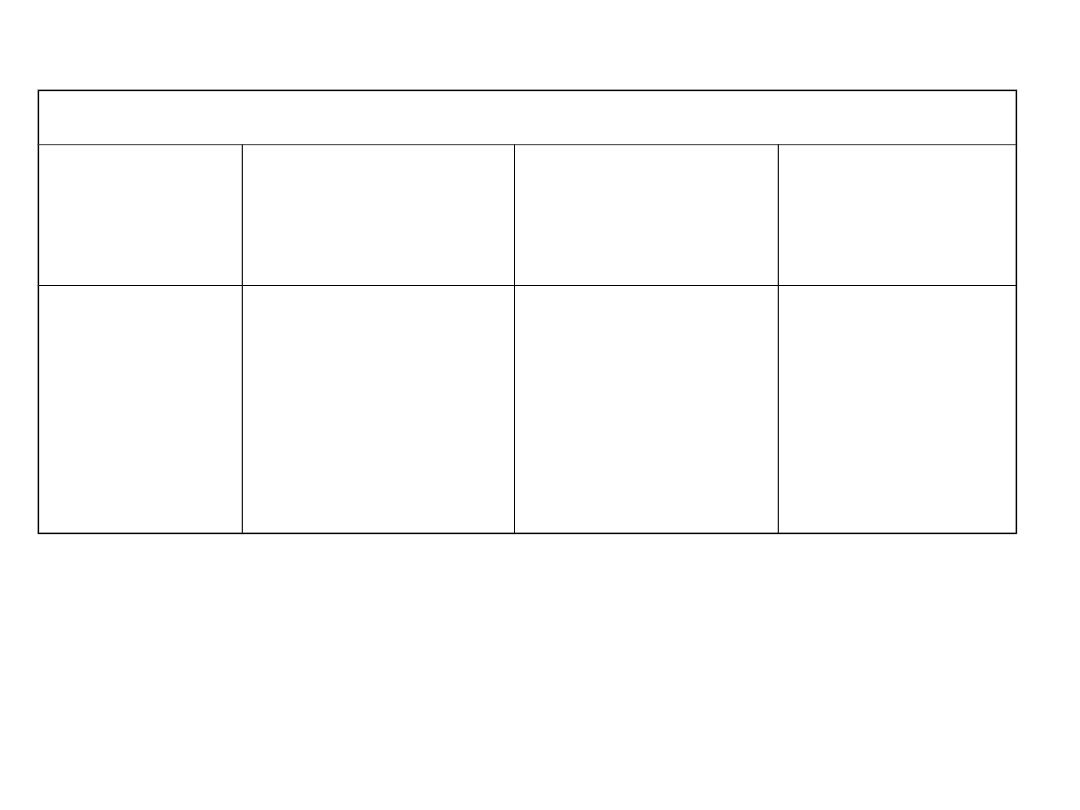
Tlenki niereagujące z wodą
Tlenki
obojętne
Tlenki o
charakterze
kwasowym
Tlenki o
charakterze
zasadowym
Tlenki
amfoterycz
ne
CO, SiO,
NO, N
2
O
Niemetali
SiO
2
Metali MoO
3
Metali NiO,
CrO
Półmetali
GeO
2
Metali
Al
2
O
3
, BeO,
ZnO

Nazewnictwo związków z
wodorem
• Związki z wodorem opisuje wzór ogólny E
n
H
m
lub
H
m
E
n
. Wybór właściwego wzoru zależy od relacji
elektroujemności danego pierwiastka i wodoru.
Wzór
Nazwa zwyczajowa
(dopuszczalna)
Nazwa
systematyczna
HF
HCl
HBr
HI
Fluorowodór
Chlorowodór
Bromowodór
jodowodór
Fluorek wodoru
Chlorek wodoru
Bromek wodoru
Jodek wodoru

Wzó
r
Nazwa zwyczajowa
(dopuszczalna)
Nazwa
systematyczna
B
2
H
6
CH
4
SiH
4
NH
3
N
2
H
4
PH
3
H
2
O
H
2
S
H
2
S
e
H
2
T
e
Diborowodór (6) lub
diboran (6)
Metan
Silan
Amoniak
Hydrazyna
Fosfina
Woda
Siarkowodór
Selenowodór
tellurowodór
Diborowodór (6) lub
diboran (6)
metan
Silan
Azan
Diazan
Fosfan
Oksydan
Sulfan
Selan
tellan

Nazewnictwo wodorotlenków
• Wzór ogólny wodorotlenków – M(OH)
n
gdzie M oznacza atom metalu
• Nazwy wodorotlenków tworzy się łącząc
słowo wodorotlenek z nazwą pierwiastka
w dopełniaczu w nawiasie podając stopień
utlenienia.
• KOH- wodorotlenek potasu
• Cu(OH)
2
– wodorotlenek miedzi II

Nazewnictwo kwasów
• Wzór ogólny kwasów H
n
R
• Kwasy beztlenowe nie zawierają w swojej
cząsteczce grupy E-O-H
• Nazwy anionów kwasów beztlenowych mają
końcówkę –owy, a nazwy soli tych kwasów –ek.
• Kwasy tlenowe- oksykwasy zawierają w swojej
cząsteczce grupę E-O-H
• Nazwy kwasów tlenowych mają końcówkę –
owy, nazwy ich anionów –anowy, a nazwy soli
-an

Kwasy beztlenowe
Wzór
kwasu
Wzór
reszty
kwasow
ej
Nazwa
zwyczajowa
Nazwa
systematyczna
Nazwa
soli
HF
(aq)
HCl
(aq)
HBr
(aq)
HI
(aq)
H
2
S
(aq)
HCN
(aq
)
NH
3
HNCO
F
-
Cl
-
Br
-
I
-
S
2-
CN
-
N
3
-
NCO
-
kwas
fluorowodorowy
kwas
chlorowodorowy
kwas
bromowodorowy
kwas jodowodorowy
kwas
siarkowodorowy
kwas
cyjanowodorowy
kwas
azotowodorowy
kwas izocyjanowy
Fluorek wodoru
Chlorek wodoru
Bromek wodoru
Jodek wodoru
Siarczek
(di)wodoru
cyjanek wodoru
Azydek wodoru
kwas
izocyjanowy
Fluorek
Chlorek
Bromek
Jodek
Siarczek
cyjanek
Azydek
izocyjani
an

Kwasy tlenowe
Wzór
kwasu
Wzór
reszty
kwasowej
Nazwa w systemie
Stocka
Nazwa soli
H
3
AsO
3
H
3
AsO
4
HNO
2
HNO
3
(HBO
2
)
n
H
3
BO
3
HClO
HClO
2
HClO
3
HClO
4
AsO
3
3-
AsO
4
3-
NO
2
-
NO
3
-
BO
2
-
BO
3
3-
ClO
-
ClO
2
-
ClO
3
-
ClO
4
-
kwas arsenowy III
kwas arsenowy V
kwas azotowy III
kwas azotowy V
kwas metaborowy
kwas ortoborowy
kwas chlorowy I
kwas chlorowy III
kwas chlorowy V
kwas chlorowy VII
Arsenian
III
Arsenian
V
Azotan III
azotan V
Metabora
n
Ortobora
n
Chloran I
Chloran
III
Chloran V
Chloran
VII

Kwasy tlenowe
Wzór kwasu
Wzór
reszty
kwasowe
j
Nazwa w systemie
Stocka
Nazwa soli
H
2
CrO
4
H
2
Cr
2
O
7
H
3
PO
3
(H
2
PHO
3
)
(HPO
3
)
n
H
3
PO
4
H
4
P
2
O
7
HIO
4
H
5
IO
6
H
4
SiO
4
(H
2
SiO
3
)
n
CrO
4
2-
Cr
2
O
7
2-
PHO
3
2-
PO
3
-
PO
4
3-
P
2
O
7
4-
IO
4
-
IO
6
5-
SiO
4
4-
SiO
3
2-
kwas chromowy VI
kwas dichromowy
VI kwas fosforowy
III
kwas
metafosforowy V
kwas
(orto)fosforowy V
kwas difosforowy V
kwas
(meta)jodowyVII
kwas ortojodowyVII
kwas
ortokrzemowy
kwas
metakrzemowy
Chromian VI
Dichromian
VI
fosforan III
metafosfora
n V
(orto)fosfora
n V
Difosforan V
(meta)jodan
VII
ortojodanVII
ortokrzemia
n
metakrzemia
n

Kwasy tlenowe
Wzór kwasu
Wzór
reszty
kwaso
wej
Nazwa w systemie
Stocka
Nazwa soli
HMnO
4
H
2
MnO
4
H
2
SO
3
(SO
2
•H
2
O)
H
2
SO
4
H
2
S
2
O
7
H
2
S
2
O
8
H
2
S
2
O
3
H
2
CO
3
(CO
2
•H
2
O)
HOCN
MnO
4
-
MnO
4
2-
SO
3
2-
SO
4
2-
S
2
O
7
2-
S
2
O
8
2-
S
2
O
3
2-
CO
3
2-
OCN
-
kwas manganowyVII
kwas manganowy VI
kwas siarkowy IV
kwas siarkowy VI
kwas disiarkowy VI
kwas peroksodisiarkowy
VI
kwas tiosiarkowy VI
kwas węglowy
kwas cyjanowy
manganianVII
manganian VI
siarczan IV
siarczan VI
disiarczan VI
peroksodisiarcza
n VI
Tiosiarczan VI
Węglan
cyjanian

Nazwy związków jonowych
• Nazwa związku jonowego składa się z nazwy
anionu i kationu w dopełniaczu, ewentualnie
także z cyfry rzymskiej określającej ładunek jonu
(stopień utlenienia) w przypadku gdy ten ładunek
może być różny.
• CuCl
2
– chlorek miedzi II
• Pb(NO
3
)
2
– azotan V ołowiu II
• Niektóre związki jonowe tworzą kryształy
zawierające jony związku i określoną liczbę
cząsteczek wody. Związki te noszą nazwę
hydratów.
• CuSO
4
•5H
2
O – pentahtydrat siarczanu VI miedzi II

Podział soli
• Sole obojętne o wzorze ogólnym M
n
R
m
• AuS
2
– siarczek złota I
• Wodorosole powstają w wyniku niecałkowitego
zapełnienia kationów wodorowych kwasu – o wzorze
ogólnym M
n
(HR)
m
– wodorosole mogą tworzyć jedynie
kwasy wieloprotonowe
• LiH
2
PO
4
– diwodorofosforan V litu
• Ca(HCO
3
)
2
– wodorowęglan wapnia
• Hydroksysole – powstają w wyniku niecałkowitego
zastąpienia anionów wodorotlenkowych wodorotlenku
– wzór ogólny- [M(OH)
k
]
n
R
m
– hydroksysole mogą
tworzyć wodorotlenki o większej niż jeden liczbie grup
wodorotlenowych.
• FeCl(OH) – chlorek wodorotlenek żelaza II
• AlF(OH)
2
– fluorek diwodorotlenek glinu

Związki kompleksowe
• Jeśli cząsteczka związku składa się z atomu
centralnego i większej liczby przyłączonych
do niego grup, niż wynika to z analizy
stopnia utlenienia to taki związek nazywamy
związkiem kompleksowym, a przyłączone do
atomu centralnego grupy – ligandami
• Ligandami mogą być jony – Cl
-
, CN
-
;
obojętne cząsteczki NH
3
, H
2
O, CO.
• Atomem centralnym w związkach
kompleksowych są zazwyczaj atomy lub jony
pierwiastków z bloku d

Związki kompleksowe
• Przy nazywaniu kompleksu metalu nazywamy
najpierw ligandy, a następnie jon lub atom
• Nazwy ligandów obojetnych to: woda- akwa;
amoniak-amina; tlenek węglaII (CO) - karbonyl,
tlenek azotu II (NO)- nitrozyl.
• Nazwy ligandów anionowych kończą się na „-o” –
Cl
-
- chloro, Br
-
- bromo, OH
-
- hydrokso, O
2-
- okso,
CN
-
-cyjano.
• Do wskazania liczby każdego typu ligandu używa
się greckich przedrostków (di-, tri-, tetra-..)
• Ligandy wymienia się w kolejności alfabetycznej
• K
4
[Fe(CN)
6
] – heksacyjanożelazian II potasu
• Na
2
[Zn(OH)
4
] – tetrahydroksocynkan sodu
• [Cr(H
2
O)
6
]Cl
3
– chlorek heksaakwachromu III
• [Fe(CO)
5
] – pentakarbonylżelazo 0
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
zwiazki nieorg 1 cz2
Identyfikacja roztworów związków nieorganicznych
Identyfikacja roztworów związków nieorganicznych
ZWIĄZKI NIEORGANICZNE W LECZNICTWIE
Właściwości niektórych pierwiastków i związków nieorganicznych(1), podręczniki szkoła średnia liceum
Zasady nomenklatury związków chemicznych, Chemia
Toksyczność związków nieorganicznych w środowisku i żywności, Rat med rok 2, Toksykologia
zajecia srodowe, Zadania powt systematyka, Zadania - Systematyka związków nieorganicznych
Klasyfikacja związków nieorganicznych (1)
Metody Oznaczania Związków Nieorganicznych 1
Chemia, Chemia - Systematyka związków nieorganicznych, OTRZYMYWANIE TLENKÓW:w drodze bezpośredniej s
Związki nieorganiczne węgla i ich właściwości 1, Chemia(2)
1 Systematyka związków nieorganicznych
Arkusz WSiP Systematyka związków nieorganicznych
Związki nieorganiczne
Metody Oznaczania Związków Nieorganicznych 2
więcej podobnych podstron