
ZAKŁAD OPAKOWALNICTWA I BIOPOLIMERÓW
CHEMIA ŻYWNOŚCI
Ćwiczenia laboratoryjne nr 4
Badanie właściwości i analiza jakościowa tłuszczów
Artur Bartkowiak, Szczecin 2003

Ekstrakcja tluszczów w aparacie Soxhleta
(M. Struszyński 1954: Analiza ilościowa i techniczna, t.3. PWT, Warszawa, s. 547-550)
Ilościowa ekstrakcja tluszczów metodą Soxhleta sprowadza się do przemywania eterem tkanki
wysuszonej do stałej wagi i rozdrobnionej - aż do całkowitego wymycia substancji
rozpuszczalnych w eterze. Oznacza się masę suchej, badanej próbki oraz masę pozostałości
lipidowej po odparowaniu i wysuszeniu do stałej masy ekstraktu eterowego. Zawartość tłuszczu
wyraża się w procentach suchej masy badanego materiału. Jeżeli ekstrakcja ogranicza się tylko
do ilościowego oznaczenia zawartości tłuszczów (wyekstrahowany materiał tłuszczowy nie jest
poddawany frakcjonowaniu i dalszym analizom), wówczas ilość tłuszczów można wyznaczyć z
różnicy masy suchej próbki badanej przed ekstrakcją i masy suchej pozostałości tkanki
uzyskanej po ekstrakcji. Unika się wówczas odparowywania dużych ilości rozpuszczalnika i
suszenia do stałej wagi kolby z pozostałością lipidową.
Dokładność ilościowego oznaczenia zawartości tłuszczów w materiale biologicznym zależy od
stopnia rozdrobnienia tkanki, zawartości wody, szybkości ekstrakcji, warunków suszenia
pozostałości lipidowej itp. W przypadku materiału bogatego w tłuszcz osiągalna dokładność
metody wynosi około 0,5%.
Materiał: Nasiona roślin oleistych, materiał zwierzęcy bogaty w tłuszcz
Odczynniki:
1) Eter ety1owy.
2) Bibuła celulozowa
Aparatura: Aparat Soxhleta (3 zestawy).
Aparat Soxhleta składa się z kolby a o pojemności 100-300 cm
3
(a), ekstraktora (b) chłodnicy
wodnej (c). Wszystkie te części połączone są za pomocą znormalizowanych szlifów według
schematu podanego na rys. 1.
Gdy ogrzewa się w koszu grzewczym kolbę (a) zawierającą eter (Uwaga! materiał palny), pary
eteru przedostają się do chłodnicy wodnej, gdzie ulegają skropleniu. Skroplony eter spływa do
ekstraktora i wymywa tłuszcz z materiału umieszczonego w torebce z bibuły. Po napełnieniu
syfonu ekstraktora wyciąg eterowy przelewa się do kolby. W stale ogrzewanej kolbie ekstrakcja
przebiega w sposób ciągły przy czym - zależnie od szybkości parowania rozpuszczalnika w
kolbie i pojemności ekstraktora - przelewy następują co 5-30 min.
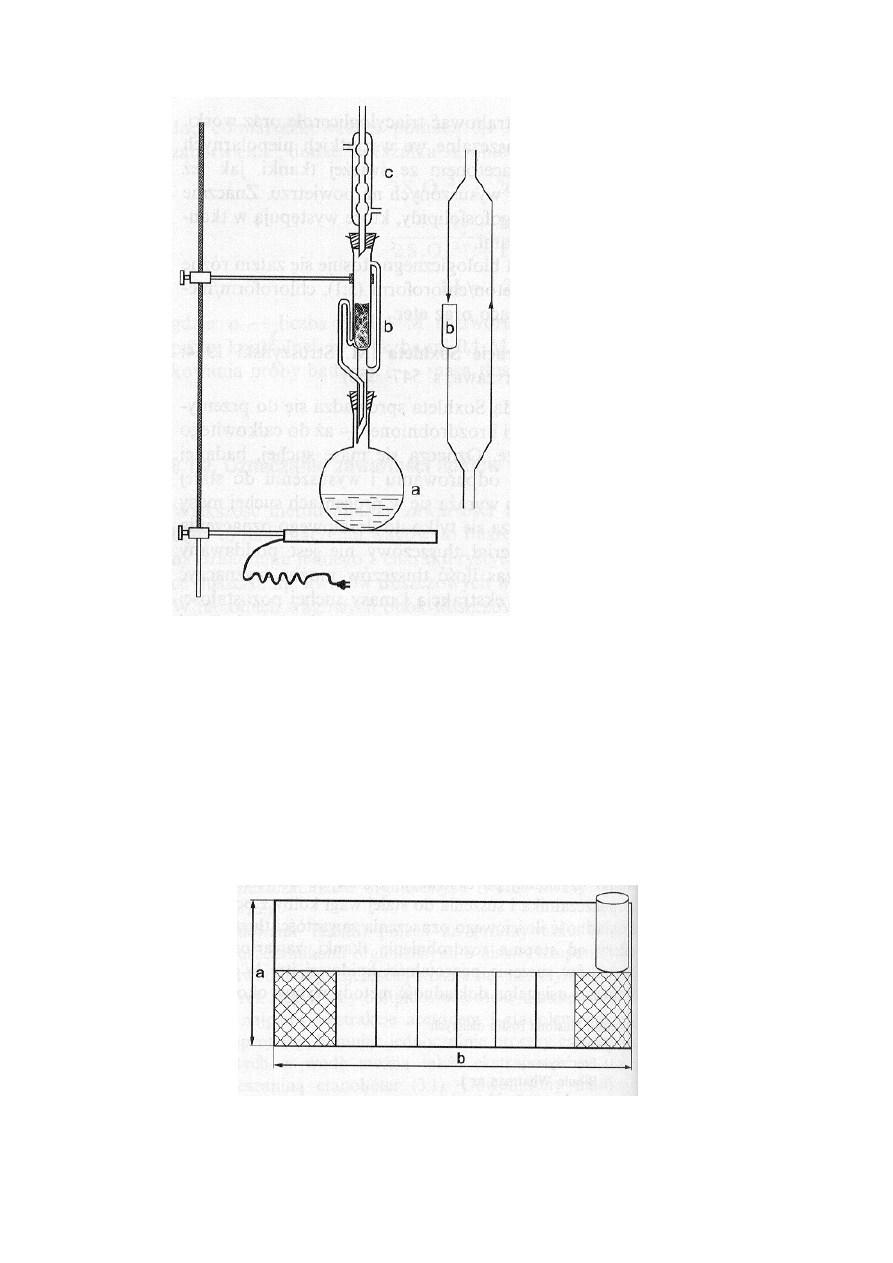
Rys. 1. Aparat Soxhleta: (a) – kolba, (b) – ekstraktor, (c) - chłodnica
Przygotowanie torebki z bibuły: Prostokąt bibuły o odpowiednich wymiarach (rys. 2) złożyć wzdłuż dłuższej osi na
połowę; po rozłożeniu wyciąć zakreskowane części i rozciąć dolną część na paski o szerokości 1,5-2 cm. Tak
przygotowaną bibułę nawinąć na walec o średnicy nieco mniejszej od średnicy ekstraktora. W miarę nawijania
każdy pasek zaginać tak, aby utworzyć dno torebki. Torebkę obwiązać nitką i ostrożnie zdjąć z walca.
Rys. 2. Torebka z bibuły: a – podwójna wysokość w aparacie Soxhleta, b – 2,5-krotny wymiar a
Wykonanie:

Do kolby (a) wrzucić porcelankę i starannie wysuszoną całość zważyć z dokładnością do 1 mg.
Kolbę połączyć z ekstraktorem i umieścić w łaźni wodnej. Następnie 2-5 g tkanki wysuszonej
do stałej wagi i roztartej starannie w moździerzu odważyć z dokładnością do 0,01% i przenieść
ilościowo do torebki. Torebkę umieścić w ekstraktorze tak, aby górna jej część znajdowała się
poniżej najwyższego punktu rurki przelewowej.
Ekstraktor napełnić eterem do zagięcia rurki syfonu i po spłynięciu rozpuszczalnika do kolby
dodać jeszcze około 0,5 objętości eteru (ilość eteru dodanego nie może przekraczać objętości
pustego ekstraktora). Ekstraktor połączyć z chłodnicą wodną i włączyć ogrzewanie kolby z
eterem (autotransformator w poz. 100). Następuje ciągłe napełnianie ekstraktora skroplonym
eterem i przelewanie eteru do kolby, w wyniku czego tłuszcze zostają wyekstrahowane z tkanki.
Czas potrzebny na całkowite odtłuszczenie wynosi dla większości tkanek 2-4 godz.
Koniec ekstrakcji można ustalić za pomocą próby odparowania eteru. W tym celu po
wyłączeniu ogrzewania i ustaniu wrzenia należy zdjąć chłodnicę i nieco eteru z ekstraktora
przenieść na czyste, odtłuszczone szkiełko zegarkowe. Proces ekstrakcji jest zakończony
wówczas, gdy po wyparowaniu eteru ze szkiełka nie pozostają na nim ślady tłuszczu.
Po skończonej ekstrakcji (w ćwiczeniu po 2 godz. Ekstrakcji – 3-4 pełne przelewy) przelać eter
z ekstraktora (przez boczną rurkę) do kolby, wyjąć torebkę, a ekstraktor ponownie połączyć z
kolbą i chłodnicą i oddestylować całą zawartość eteru z kolby do ekstraktora (opróżniać
ekstraktor gdy poziom ekstraktu za każdym razem przekroczy ¾ wysokości syfonu). Kolbę z
ekstraktem tłuszczowym wysuszyć w gorącej łaźni wodnej w ciągu 5 min i pozostawić do
następnego ćwiczenia w kolbie zamkniętej korkiem szklanym.
Następnie w ciągu 30 min w temp. 90°C suszyć w suszarce, do stałej wagi. Po wystudzeniu
zważyć kolbę z dokładnością do 1 mg. Zawartość tłuszczu wyrazić w procentach suchej masy
materiału odtłuszczanego.
% zawartość tłuszczu = 100
⋅(a -b)/c,
gdzie: a -masa kolby wraz z pozostałością lipidową w gramach, b -masa samej kolby w
gramach, c -ilość gramów odtłuszczanego materiału.

Podstawowe właściwości fizykochemiczne lipidów
Lipidy oraz związki pokrewne (steroidy i karotenoidy) są nierozpuszczalne w wodzie.
Rozpuszczają się natomiast dobrze w niepolarnych rozpuszczalnikach organicznych, takich jak
benzen, chloroform, aceton, toluen i eter, a w mniejszym stopniu także w etanolu i metanolu. W
lipidach rozpuszczają się związki o właściwościach hydrofobowych, tj. związki, które nie mają
grup hydrofilowych lub zawierają ich niewiele.
Ćwiczenie 1. Rozpuszczalność barwników i witamin w tłuszczach
a) Do 2 cm
3
wody destylowanej dodać nieco barwnika Sudan III. Obserwować czy barwnik
rozpuszcza się. Wprowadzić następnie 0,5 cm
3
oleju i zmieszać zawartość probówki.
Obserwować zachodzące zmiany rozpuszczalności.
Barwnik o dużej masie cząsteczkowej Sudan III, stosowany do wybarwiania tłuszczu w
preparatach histologicznych, zawiera tylko jedną grupę hydrofilową i długi, niepolarny łańcuch
węglowodorowy - dzięki temu jest dobrze rozpuszczalny w tłuszczach. Tłuszcze są również
dobrym rozpuszczalnikiem dla witamin z grupy A, D, E i K. Witamina A, wywodząca się z
karotenoidów, zawarta jest w tranie. W maśle i tranie występuje duża ilość witaminy z grupy D.
W olejach roślinnych znajdują się tokoferole, witaminy z grupy E. W tłuszczach roślinnych, a w
mniejszym stopniu także w tłuszczach zwierzęcych, występują karotenoidy nadające im
żółtoczerwone zabarwienie. Tłuszczom naturalnym często towarzyszą związki steroidowe,
zwłaszcza cholesterol, tworzący estrowe połączenia z kwasami tłuszczowymi.
Ćwiczenie 3. Wykrywanie steroidów. Próba Liebermanna i Burcharda.
Do 2 kropli tłuszczu (0,4 g) (olej roślinny, smalec, masło) rozpuszczonych w 1 cm
3
chloroformu
w suchych probówkach dodać 0,5 cm
3
bezwodnika kwasu octowego i ostrożnie po ściankach
probówek 2 krople stężonego roztworu H
2
SO
4
. Tworzące się produkty reakcji o barwie różowej
przechodzącej przez fioletową i niebieską w zieloną świadczą o obecności tej grupy produktów.
W warunkach bezwodnych stężony roztwór H
2
SO
4
i bezwodnik kwasu octowego odwadniają
cząsteczkę cholesterolu, co prowadzi do powstania dodatkowego podwójnego wiązania,

sprzężonego z wiązaniem podwójnym obecnym w cząsteczce cholesterolu. Związki zawierające
podwójne wiązania sprzężone są barwne i wybiórczo pochłaniają promienie świetlne o
określonej długości fali. W próbie Salkowskiego, W obecności stężonego roztworu H
2
SO
4
powstaje czerwony kwas disulfonowy dicholestadienu, natomiast w próbie Liebermanna i
Burcharda (H
2
SO
4
i bezwodnik kwasu octowego) - zielono zabarwiony kwas jedno- sulfonowy
dicholestadienu.
Mydła.
Tłuszcze pod wpływem przegrzanej pary wodnej ulegają hydrolizie, dając glicerol i wolne
kwasy tłuszczowe. Rozkład ten można również osiągnąć za pomocą hydrolizy zasadowej (KOH
lub NaOH), z tym że otrzymuje się wówczas odpowiednie sole kwasów tłuszczowych nazywane
mydłami, a sam proces nosi miano zmydlenia tłuszczu. Sole sodowe i potasowe kwasów
tłuszczowych dobrze rozpuszczają się w wodzie, tworząc micelarne roztwory koloidowe. Sole
metali dwuwartościowych (Ba
2+
, Ca
2+
, Pb
2+
) są natomiast nierozpuszczalne (mydła
nierozpuszczalne).
Mydła tworzą koloidy hydrofilowe lub hydrofobowe w zależności od środowiska. W roztworze
wodnym grupy polarne (-COONa) skierowane są na zewnątrz, a podstawniki hydrofobowe
(węglowodorowe) do wnętrza micelarnych kuleczek mydła. W rozpuszczalnikach organicznych
układ tych grup jest odwrotny (micela odwrócona). Grupy hydrofilowe i hydrofobowe mydła
ustawiają się zatem w charakterystyczny sposób na granicy faz i zmniejszają napięcie
powierzchniowe. Związki zmniejszające napięcie powierzchniowe są dobrymi emulgatorami.
Poza mydłami należą do nich detergenty i kwasy żółciowe. W ich obecności powstaje trwała
emulsja tłuszczu z wodą.
Ćwiczenie 4. Zmydlenie tłuszczów
W parownicy porcelanowej ogrzać około 5 g smalcu. Dodać następnie 8 cm
3
30% roztworu
NaOH, potem 5 cm
3
etanolu i mieszać, ogrzewając łagodnie przez kilka minut, aż do utworzenia
się jednolitej masy (mydła). Do otrzymanego mydła przeniesionego do kolby okrągłodennej
wprowadzić ok. 200 cm
3
wrzącej wody i ogrzewać aż do całkowitego rozpuszczenia się mydła.
a) Otrzymywanie mydła nierozpuszczalnego. Do 2 probówek zawierających po 2 cm
3
roztworu
mydła dodać po 0,5 cm
3
% roztworów CaCl
2
i/lub BaCl
2
. Wytrąca się osad nierozpuszczalnych
mydeł wapniowych i/lub barowych.
b) Tworzenie trwałej emulsji tłuszczu w obecności mydła. Do 2 probówek zawierających po 0,5
cm
3
oleju wprowadzić po 4 cm
3
wody lub mydła. Zawartość probówek silnie wstrząsnąć.
Zaobserwować i opisać rodzaj tworzących się układów.
Ćwiczenie 5. Liczba jodowa (LJ)
(M. Struszynski 1954: Analiza ilościowa i techniczna, t. 3. PWT, Warszawa, s. 478-480)
Zasada: LJ oznacza tę ilość gramów jodu, która zostaje przyłączona do 100 g tłuszczu. Liczba ta
wyraża ilościowo zawartość nienasyconych związków w tłuszczu.
Tłuszcze o dużej zawartości estrów nienasyconych kwasów tłuszczowych, np. oleje roślinne,
charakteryzują się dużą liczbą jodową (olej rzepakowy). Tłuszcze stałe o małej zawartości
nienasyconych wiązań mają natomiast małą liczbę jodową (np. masło, smalec).
Tłuszcz rozpuszczony w obojętnym rozpuszczalniku organicznym traktuje się nadmiarem
mianowanego roztworu chlorowca w takich warunkach, aby nastąpiło tylko jego przyłączenie, a
nie podstawienie. Następnie dodaje się roztwór jodku potasu. Nadmiar chlorowca ruguje jod,
który odmiareczkowuje się roztworem Na
2
S
2
0
3
. Z różnicy między ilością jodu uwolnionego w
próbie kontrolnej i badanej otrzymuje się tą ilość jodu, która została przyłączona przez daną
ilość badanego tłuszczu. Do ilościowego przyłączenia chlorowców nadają się ICl i IBr. Chociaż
reakcja przyłączenia czystego chloru zachodzi najenergiczniej, to jednak chlor podstawia
częściowo wodór. Czysty brom i jod reagują natomiast zbyt wolno i dlatego się ich nie
stosuje.
Materiał: Masło, olej.
Odczynniki:
1) Odczynnik Hanusa: 10 g IBr rozpuścić w 500 cm
3
CH
3
COOH lodowatego
2) 10% roztwór KI.
3) 0,1 M roztwór Na
2
S
2
0
3
4) 1% roztwór skrobi
5) Chloroform
Wykonanie: W naczyńku wagowym odważyć dokładnie 0,2 g oleju lub 0,4 g masła/smalcu.
Naczyńko wprowadzić ostrożnie do kolby stożkowej o pojemności 200-300 cm
3
z
doszlifowanym korkiem, zwilżonym uprzednio roztworem KI. Następnie dodać 10 cm
3
chloroformu i starannie rozpuścić odważkę tłuszczu. Dodać 15 cm
3
odczynnika Hanusa, kolbę
starannie zamknąć korkiem i po wymieszaniu pozostawić w ciemnym miejscu na 30 min.
Równolegle wykonać próbę kontrolną nie zawierającą tłuszczu. Po upływie tego czasu
wprowadzić 15 cm
3
10% roztworu KI (zmywając nim szyjkę kolby i korek) oraz ok. 50 cm
3
wody. W wyniku reakcji IBr i KI uwalnia się I
2
:
IBr + KI
→ I
2
+ KBr
Jod odmiareczkować za pomocą 0,1 M roztworu Na
2
S
2
0
3
(do słabo różowego zabarwienia),
dodać wskaźnika skrobiowego i skończyć miareczkowanie.
LJ = 1,269
⋅(a - b)/c,
gdzie: a -liczba cm
3
0,1 M roztworu Na
2
S
2
0
3
potrzebna do zmiareczkowania próby kontrolnej,
b -liczba cm
3
0,1 M roztworu Na
2
S
2
0
3
potrzebna do zmiareczkowania badanej próby, c -masa
tłuszczu w gramach.
Ćwiczenie 6. Liczba zmydlenia (LZ)
Zasada: LZ jest to liczba miligramów KOH potrzebna do zmydlenia 1 g i zobojętnienia
zawartych w nim wolnych kwas6w tłuszczowych. Znajomość liczby zmydlenia pozwala
wyznaczyć średnią masę cząsteczkową kwasów tłuszczowych wchodzących w skład danego
tłuszczu.
Tłuszcze zawierające stosunkowo dużą ilość estrów kwasów o mniejszej masie cząsteczkowej,
jak: masłowy, kaprylowy (masło, olej kokosowy) mają dużą liczbę zmydlenia. Natomiast
tłuszcze o dużym odsetku estrów długołańcuchowych kwasów tłuszczowych (olej rzepakowy,
słonecznikowy), mają małe liczby zmydlenia. Obecność substancji nie ulegających zmydleniu,
np. olejów mineralnych, zmniejsza liczbę zmydlenia. Domieszka takich substancji w ilości 1%
zmniejsza LZ o 1,7-2,5 jednostek.

Materiał: Masło, smalec, olej.
Odczynniki:
1) 0,5 M roztwór KOH
2) 96% roztwór etanolu
3) 0,5 M roztwór HCI
4) 1% etanolowy roztwór fenoloftaleiny.
Wykonanie: Do kolby stożkowej o pojemności 200- 300 cm
3
odważyć w naczyńku wagowym
ok. 1 g tłuszczu (2 powtórzenia dla każdego rodzaju tłuszczu), dodać 10 cm
3
0,5 M roztworu
KOH i 50 cm
3
etanolu. Zawartość kolby ogrzewać pod chłodnicą zwrotną w ciągu 20 min we
wrzącej łaźni wodnej. W wyniku hydrolizy tłuszcz zostaje rozłożony do glicerolu i kwasów
tłuszczowych, które z wodorotlenkiem potasu dają mydła. Nadmiar KOH odmiareczkować 0,5
M roztworem HCl wobec fenoloftaleiny. Równolegle należy wykonać próbę kontrolną, nie
zawierającą tłuszczu.
LZ = 28,055
⋅(a - b)/c,
gdzie: a -liczba cm
3
0,5 M roztworu HCl potrzebna do zmiareczkowania próby kontrolnej, b -
liczba cm
3
0,5 M roztworu HCl potrzebna do zmiareczkowania próby badanej, c -ilość gramów
tłuszczu.

IMIĘ I NAZWISKO GRUPA DATA
SPRAWOZDANIE Z ĆWICZENIA NR 4
Badanie właściwości i analiza jakościowa tłuszczów
Ćwiczenie 1. Rozpuszczalność barwników i witamin w tłuszczach
Barwnik Sudan III rozpuszcza się w…………………………..
Posiada właściwości………………………………….., ponieważ……………………………
Ćwiczenie 2. Wykrywanie steroidów. Próba Liebermanna i Burcharda.
1. W których probówkach znajdowały się następujące substancje: olej roślinny, smalec,
masło?
2. Czy na podstawie zmiany intensywności barwy można określić ilościowo zawartość
cholesterolu w badanych próbkach, (jeżeli tak to, w której próbce jest go najwięcej)?
3. Otrzymane wyniki skomentować/porównać z zawartością teoretyczną (Z.Sikorski,
Chemia Żywności, WNT 2000 lub inne poz. literaturowe).
Ćwiczenie 3. Mydła.
1. Co to są mydła?

IMIĘ I NAZWISKO GRUPA DATA
Ćwiczenie 4. Zmydlenie tłuszczów
1. Co decyduje o właściwościach emulgujących soli kw. tłuszczowych?
2. W jakich gałęziach przemysłu spożywczego, (do jakich wyrobów) i jakie inne
emulgatory są stosowane na bazie modyfikowanych tłuszczów (samodzielna praca w
bibliotece)?
Ćwiczenie 5. Liczba jodowa (LJ)
Wynik liczby jodowej substancji a) LJ=
substancji b) LJ=
Gdzie znajdowało się masło a gdzie olej roślinny, która to substancja?
Suma punktów ………

IMIĘ I NAZWISKO GRUPA DATA
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
Sprawozdanie 2 Badanie właściwości i analiza jakościowa kationów, Politechika Białostocka, budownict
TEMAT 2, TEMAT: BADANIE WŁAŚCIWOŚCI I ANALIZA JAKOŚCIOWA ANIONÓW
Badanie właściwości i analiza jakościowa kationów(2), Badanie właściwości i analiza jakościowa katio
Chemia żywnosci Cwiczenie 2 Wyodrebnianie badanie własciwosci i analiza jakosciowa sacharydow
Badanie wlasciwosci i analiza jakosciowa anionow(2), Studia, Chemia, chemia od Ines(1)
właściwości i analiza chemiczna tłuszczów, Studia
ZMYDLANIE TŁUSZCZÓW I BADANIE WŁAŚCIWOŚCI MYDEŁ, KOSMETOLOGIA, Chemia kosmetyczna
Badanie wlasciwosci tluszczow(2)
Cw 07 E 01 Badanie właściwości elektrycznych kondensatora pł
Analiza jakościowa kationów i anionów, Analiza jakościowa
wykorzystanie liczb charakterystycznych do?dania rodzaju i jakości tłuszczu ćw 2
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE CHLORKÓW I SIARCZANÓW
Cw 02 M 04A Badanie wlasciwos Nieznany
Badanie właściwości minerałów i skał
więcej podobnych podstron