Immunologia
– prelekcja 5.11.2007
Metody immunologiczne z zastosowaniem znaczników.
Służą one oznaczaniu substancji o charakterze białkowym w płynach ustrojowych.
Poszukiwany związek może być zarówno przeciwciałem jak i antygenem. Ogólna zasada wszystkich
metod polega na tym, że jeden ze składników kompleksu Ag-Ab wyznakowany jest znacznikiem
(markerem). Rodzaj tego znacznika dzieli metody na:
Fluorymetryczne – znacznikiem jest fluorochrom – barwnik fluoryzujący w świetle o krótkiej
fali (zielony, żółty, czerwony)
Radioimmunometryczne (RIA) – znacznikiem jest pierwiastek promieniotwórczy
Immunoenzymatyczne (EIA) – znacznikiem jest enzym
Chemiluminescenscyjne – znacznikami są określone substancje organiczne
Metody fluorymetryczne
Barwnikami są:
Izotiocyjanian fluoresceiny (FITC) – reaguje na światło zielone
Izotiocyjanian rodaminy B (RITC) – reaguje na światło czerwone
Emisję wzbudza wiązka światła o małej długości fali, aby ją uzyskać stosujemy:
Filtry przepuszczające promieniowanie indukujące fluorescencję
Filtry usuwające promieniowanie niepożądane
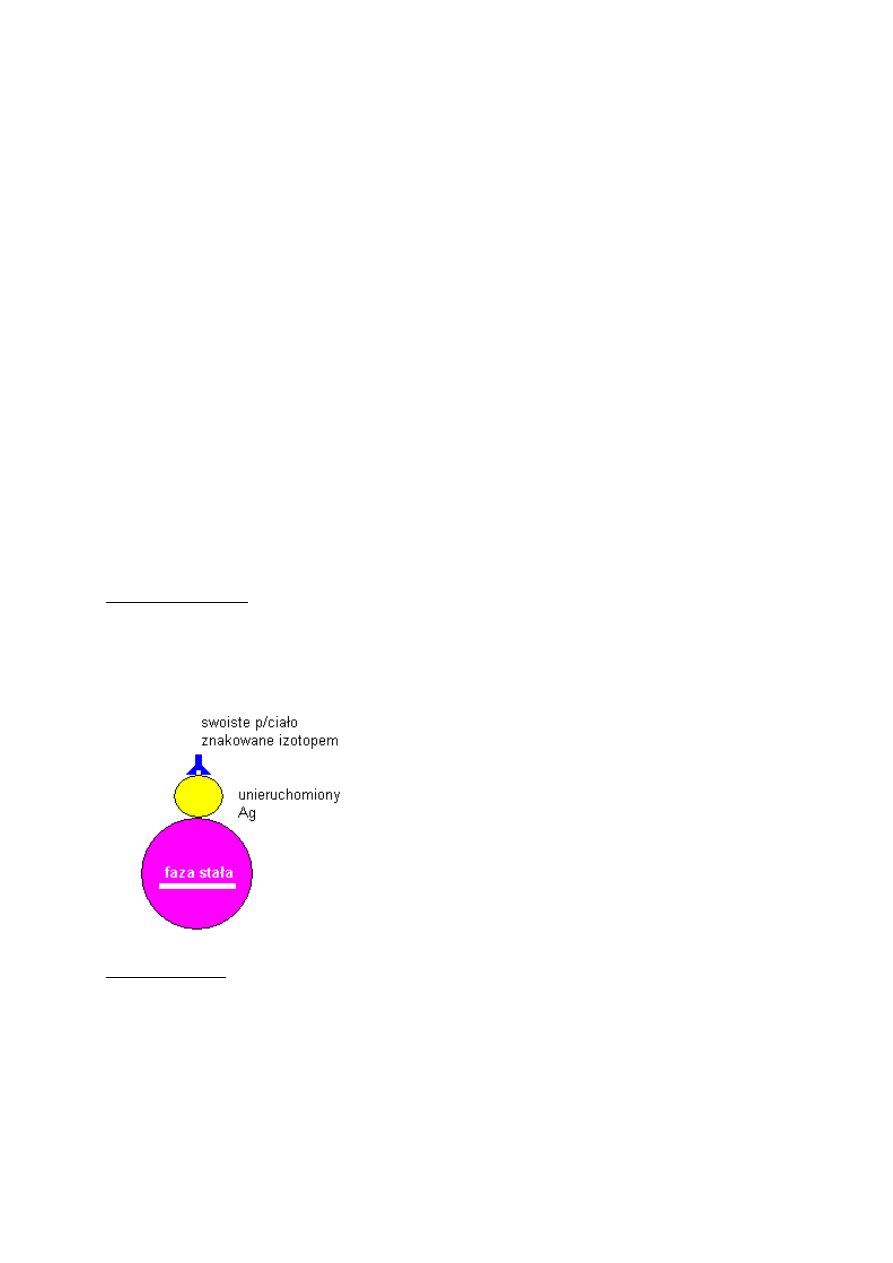
Metoda bezpośrednia
Jeden ze składników kompleksu (antygen) jest związany z fazą stałą (tkanki, komórki,
powierzchnia płytki polistyrenowej, kulki poliakrylamidowe), stanowi materiał poszukiwany.
Dodajemy znakowane przeciwciało swoiste dla antygenu doprowadzając do wytworzenia kompleksu
Ag + AbF*, o czym mierzymy fluorescencję tego kompleksu.
Metody pośrednie
Antygen związany jest z fazą stałą, poszukujemy przeciwciała. Najpierw dodajemy do mieszaniny
reakcyjnej badanego materiału, a potem znakowanego przeciwciała antyglobulinowego skierowanego
przeciw poszukiwanemu przeciwciału. Zalety metod pośrednich to:
Większa czułość i swoistość w porównaniu do metod pośrednich
Uniknięcie możliwości zmian swoistości przeciwciała podczas znakowania
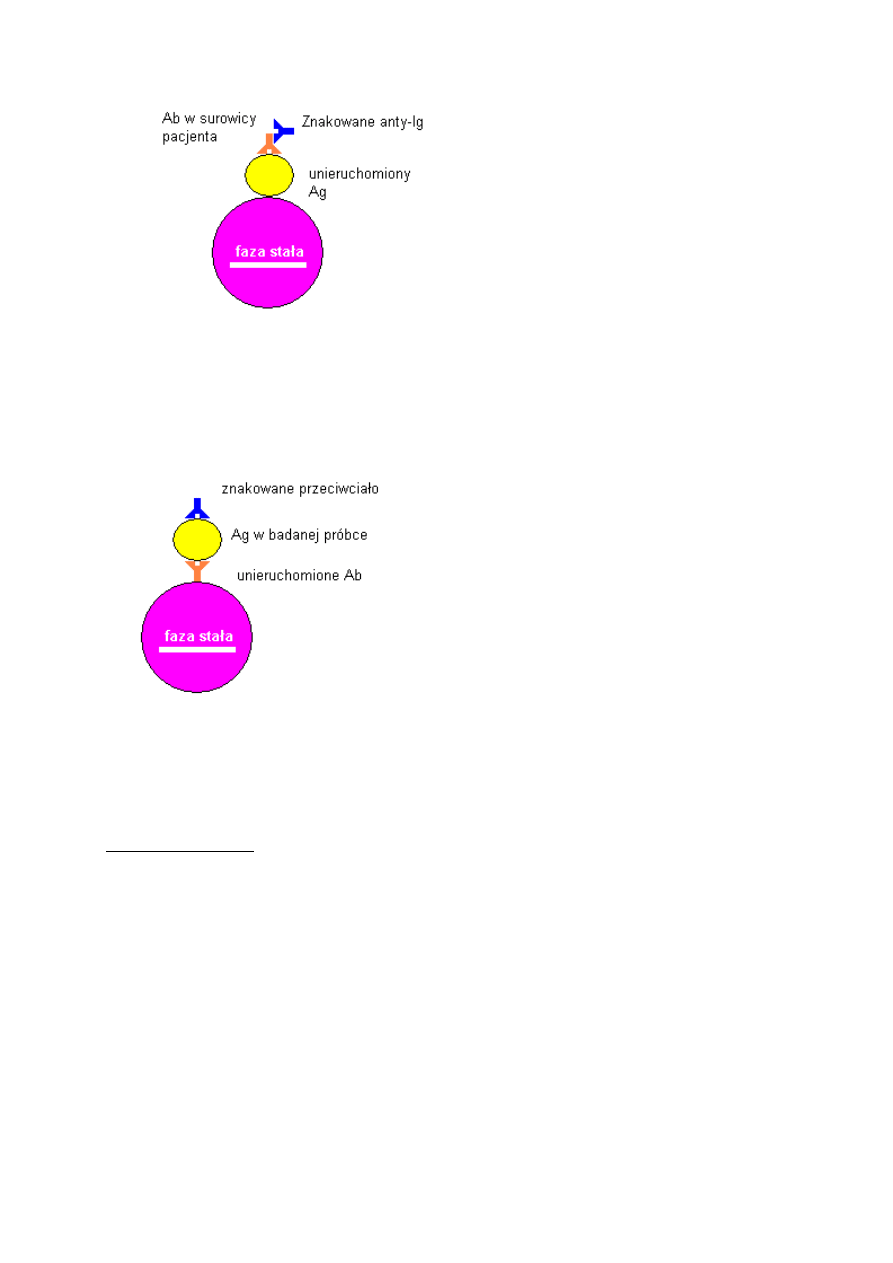
Odmianą metod pośrednich są tzw. metody „kanapkowe” (ang. „sandwich”), w których oznaczany
materiał jest antygenem. Do związanego z fazą stałą przeciwciała dodajemy badanego materiału, po
czym inkubujemy próbkę i dodajemy znakowanych przeciwciał przeciwko poszukiwanej substancji.
Nadmiar znakowanych przeciwciał odpłukujemy po czym oceniamy fluorescencję kompleksów Ab-
Ag_Ab* związanych z fazą stałą.
Metody radioimmunologiczne (RIA)
Polegają one na wykrywaniu reakcji Ag- swoiste Ab poprzez pomiar promieniowania
izotopów promieniotwórczych związanych z jednym ze składników kompleksu. Najczęściej
stosowane znaczniki to izotop
125
J i tryt
3
H.
Metoda kompetycyjna
Przebiega w dwóch etapach:
W pierwszym wyznakowany izotopem antygen łączy się z dodanym w niedoborze wolnym
przeciwciałem w kompleksy Ab-Ag* które odpłukujemy i mierzymy radioaktywność
mieszaniny reakcyjnej, proporcjonalną do ilości nie związanego znakowanego antygenu w
roztworze.
W drugim etapie do badanego materiału (z badanym Ag) dodajemy takie same ilości
znakowanego Ag* oraz przeciwciała (w niedoborze). Zachodzi konkurencja o przeciwciało
pomiędzy Ag i Ag*, a stosunek kompleksów Ab-Ag do Ab-Ag* zależy od ilości Ag w
badanym materiale. Im jest go więcej tym więcej „odbiera” on przeciwciała Ag*, które po
odpłukaniu kompleksów immunologicznych pozostaje w roztworze w większej ilości niż w
pierwszym etapie, wzmagając jego radioaktywność. Stężenie badanego Ag oceniamy poprzez
pomiar radioaktywności supernatantu mieszaniny reakcyjnej i odnosząc wynik do uzyskanego
w pierwszym etapie. Im więcej badanego antygenu tym zwiększa się radioaktywność
supernatantu w drugim etapie reakcji.

Metoda immunoradiometryczna
Jeden ze składników reakcji związany jest z fazą stałą. Może to być plastikowa próbówka
bądź mikropłytka którą opłaszczamy nie znakowanymi przeciwciałami, po czym dodajemy badanego
materiału (poszukujemy antygenu), a po inkubacji – znakowanego przeciwciała, uzyskanego przez
immunizację innego gatunku ludzkim poszukiwanym antygenem i inkubujemy ponownie. Nadmiar
nie związanych przeciwciał odpłukujemy, po czym mierzymy radioaktywność na płytce bądź w
próbówce.
Zastosowanie metod RIA
Ilościowe oznaczanie antygenów lub przeciwciał
Oznaczanie stężenia hormonów w płynach ustrojowych
Wykrywanie obecności białek towarzyszących nowotworom (np. antygenu rakowo-
płodowego i alfa-fetoproteiny)
Oznaczanie ilości swoistych przeciwciał klasy IgE w alergiach
Oznaczanie stężenia witamin i leków
Wykrywanie obecności autoprzeciwciał w schorzeniach autoimmunologicznych
W oparciu o techniki immunoradiometryczne opracowano dwa testy do oznaczania poziomu IgE o
danej swoistości w surowicy , oraz poziomu IgE w alergologii:
RAST (RadioAlergoSorbent Test)
RIST (RadioImmunoSorbent Test)
Metody immunoenzymatyczne (EIA)
Znacznikiem jednego ze składników reakcji jest enzym. Produkt reakcji katalizowanej przez
enzym jest barwnym a oznaczamy go metodami spektrofotometrycznymi. Metody te charakteryzują
się wysoką czułością oraz brakiem konieczności stosowania pierwiastków promieniotwórczych co
daje im przewagę nad metodami RIA.
Stosowane enzymy muszą spełniać takie warunki jak:
Rozpuszczalność
Stabilność
Łatwe i trwałe wiązanie się z białkiem
Nieobecność (lub występowanie w śladowych ilościach) w płynach ustrojowych
Łatwo dostępne substraty
Barwne produkty reakcji
Najczęściej stosujemy:
Peroksydazę chrzanową (HRP)
Fosfatazę alkaliczną (AP)
Oksydazę glukozową (GO)
Substratami dla enzymów są H
2
O
2
i związek chromogenny, dające w efekcie działania
enzymu zmianę zabarwienia.
Najczęściej stosowane chromogeny to:
Ortofenylodiamina (OPD)
Orto-dwuanizydyna
Kwas 5-aminosalicylowy (PAS)
P-nitrofenylofosforan sodowy
Metoda EIA pośrednia
Jest to metoda w której poszukujemy antygenu.
Reakcja przebiega w kilku etapach:
Połączenie poszukiwanego Ag ze swoistym przeciwciałem, inkubacja, płukanie

Dodanie przeciwciała antyglobulinowego przeciwko Ab znakowanego enzymem,
inkubacja, płukanie
Dodanie H
2
O
2
i chromogenu, reakcja barwna
Metoda ta ma różne modyfikacje. Najczęściej są to reakcje trójstopniowe, co zwiększa
czułość metody. Dzięki EIA możemy także oznaczać przeciwciała, w tym celu
wykorzystujemy odpowiednie antygeny związane np. ze ściankami próbówki bądź
mikropłytką.
Test ELISA (Enzyme-Linked Immunosorbent Assay)
Zastosowanie testu:
Wykrywanie obecności w płynach biologicznych antygenów i przeciwciał w
chorobach zakaźnych i pasożytniczych
Ocena ilościowego stężenia hormonów
Wykrywanie obecności autoantygenów.
Metody chemiluminescencyjne
Są oparte na pomiarze emisji fotonów w przebiegu reakcji chemicznej. Jeden z
reagentów oznakowany jest substancją organiczną – lucyferyną lub estrem akrydyny. W
przebiegu znacznikowej reakcji chemicznej zachodzi emisja promieniowania w zakresie
światła widzialnego, które mierzymy za pomocą luminometru. Emisja fotonów trwająca kilka
sekund przetwarzana jest na liczbę impulsów na minutę. Technika ta stosowana jest do
ilościowego pomiaru tak antygenu jak i przeciwciała.
Metody immunomorfologiczne (IF)
Dzielą się one na:
Metody immunofluorescencyjne – znacznikiem są flurorchromy
Metody immunoenzymatyczne – znacznikiem są enzymy
Z użyciem metali szlachetnych jako znacznika – wykorzystujemy np. roztwór
koloidalny złota otrzymywany z kwasu chlorozłotawego za pomocą reduktorów
(aldehyd mrówkowy, kwasy organiczne)
Materiał do badań stanowią:
Wycinki tkanek (bioptaty)
Zawiesina żywych komórek (krew)
Zawiesina żywych bakterii
Preparaty ogląda się w mikroskopie fluorescencyjnym.
Metoda immunomorfologiczna bezpośrednia
Znakowane jest przeciwciało, poszukujemy antygenu w badanym materiale, np.
wykrywanie antygenu Chlamydia trachomatis w wymazach z kanału szyjki macicy.

Metoda immunomorfologiczna bezpośrednia
Przebiega w dwóch etapach:
Inkubacja poszukiwanych nieznakowanych przeciwciał swoistych z antygenami
Identyfikacja utworzonych kompleksów po dodaniu znakowanych przeciwciał
antyglobulinowych
Jest to metoda czulsza od IF pośredniej.
Dwubarwna reakcja immunofluorescencji
Wykorzystujemy dwa fluorochromy emitujące światło o różnych barwach, co pozwala nam
na ocenę w preparacie dwóch różnych antygenów. Reakcja przebiega w kilku etapach:
Badany materiał inkubujemy ze znakowanymi przeciwciałami swoistymi dla
pierwszego antygenu (np. p/ciała przeciw białku SpoIIAB znakowane FITC, dającym
kolor zielony)
Następnie inkubujemy próbkę ze znakowanymi przeciwciałami swoistymi dla
drugiego antygenu (np. anty DNA znakowane RITC, dającym kolor czerwony)
Wynikiem reakcji jest dwukolorowy preparat oceniany w mikroskopie fluorescencyjnym.
Zastosowanie – np. wykrywanie komórek Baccillus subtilis przekształcających się w
przetrwalniki.
Technologia BIOCHIP
Wycinki tkanek, hodowle komórek lub rozmazy bakterii są umieszczane na
cieniutkich płytkach szklanych, które są dzielone na milimetrowej wielkości fragmenty
(BIOCHIPy), które są przyklejane automatycznie do szkiełek mikroskopowych. Technologię
tą można wykorzystać do wykrywania w jednej próbce przeciwciał przeciwko kilku
antygenom.
Metoda ta znalazła zastosowanie w diagnostyce infekcji układu oddechowego tak
bakteryjnych:
Botredella pertussis i parapertussis
Haemophilus influenzae
Leginonella pneumoniae
Klebsiella pneumoniae
Chlamydia trachomatis
Chlamydophila pneumoniae
Jak i wirusowych:
Herpes simplex virus 1
Wirusy oddechowe
Adenovirus
Influenza A i B virus
Parainfluenza virus 1-4
Coxsackie (A7, A9, A16, A24, B1 do B6)
Metody immunomorfologiczne immunoenzymatyczne (EIA)
Analogicznie do w/w testów immunoenzymatycznych, w metodach tych do
znakowania przeciwciał stosuje się enzymy katalizujące reakcje dające barwne produkty.
Detekcji kompleksów dokonuje się za pomocą metod immunohistochemicznych. Są to
metody jakościowe. Stosowane enzymy muszą spełniać takie same kryteria jak w przypadku
testów immunoenzymatycznych, stąd też w metodach tych najczęściej stosuje się wyżej
wymienione enzymy (peroksydazę chrzanową, fosfatazę alkaliczną, oksydazę glukozową),
natomiast stosowane chromogeny to:
Tetrachlorowodorek 3,3-dwuaminobenzydyny (DAB) – daje ciemnobrązowy produkt
nierozpuszczalny w wodzie.
3-amino-9-etylokarbazol (AEC) – daje czerwony produkt nierozpuszczalny w wodzie,
rozpuszczalny w alkoholu.
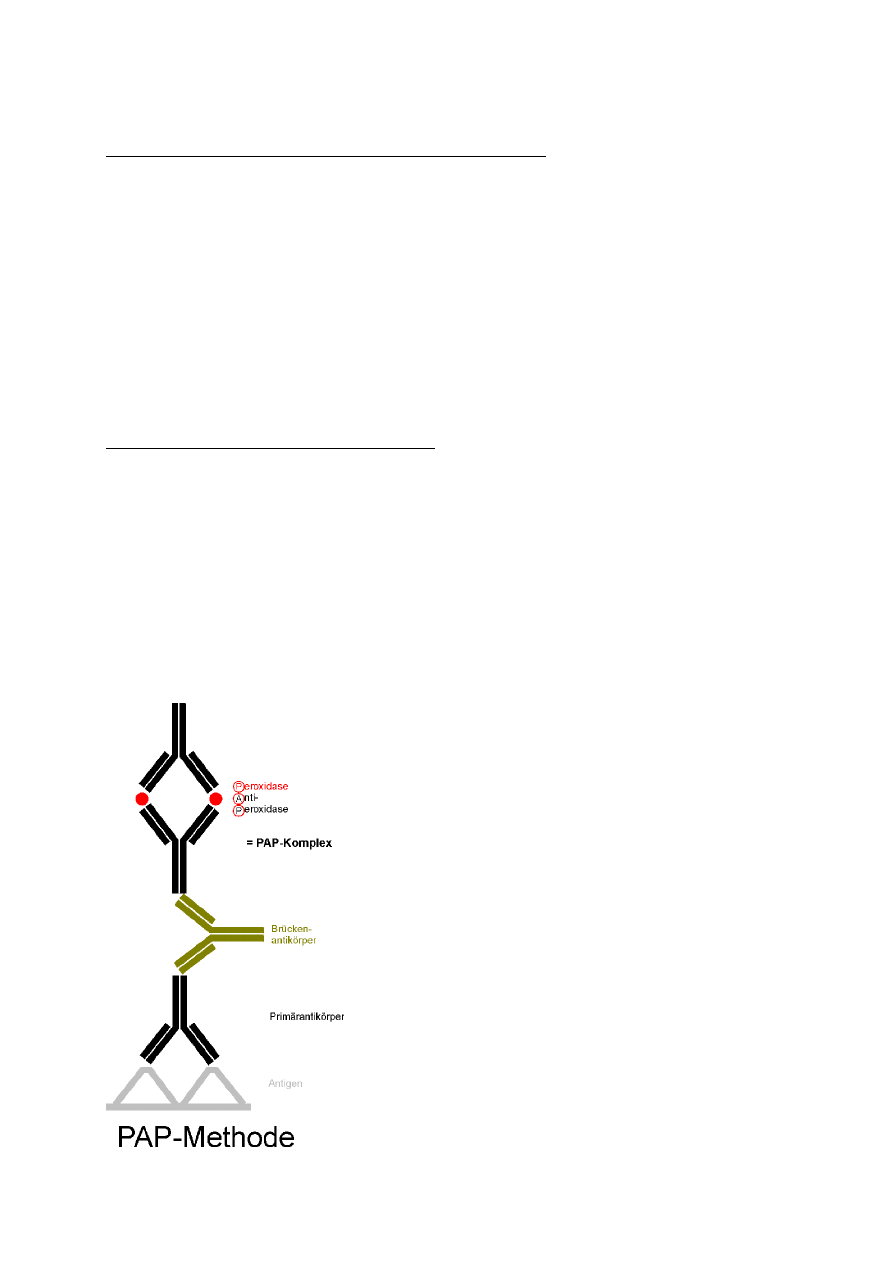
Reakcja peroksydaza-antyperoksydaza (PAP)
Składa się z dwóch etapów:
W pierwszym etapie wykrywamy antygen swoistym przeciwciałem
W drugim etapie dodajemy p/ciał znakowanych enzymem peroksydaza-
antyperoksydaza związanych za pomocą mostka – wiążą się one z kompleksem Ab-
Ag poprzez warstwę pośrednią nieznakowanych p/ciał reagujących z przeciwciałem
pierwotnym oraz kompleksem enzym-antyenzym
W trzecim etapie dodajemy H
2
O
2
i związek chromogenny
W czwartym etapie odczytujemy wynik reakcji – obecność poszukiwanego antygenu
oceniamy na podstawie wyniku badanej reakcji – obecności lub braku brązowego (lub
innego koloru) barwnika (zależy od chromogenu).
Zastosowanie metody to wykrywanie markerów nowotworowych w tkankach:
Typ nowotworu
Marker wykrywany immunoenzymatycznie
Mięsak gładkokomórkowy okrężnicy
Przeciwciała przeciwaktynowe
Łagodny przerost gruczołu krokowego
Receptory androgenowe
Rak przewodów żółciowych
Receptory Bcl-X
Chłoniak pochodzący z limf. T
CD3
Chłoniak Hodgkin’a
CD15
Rakowiak (nowotwór okresu płodowego)
Chromogranina A
Chłoniak
CPP32
Złośliwy międzybłoniak pochodzący z
nowotworu błony surowiczej
Cytokeratyna 5/6
Rak piersi
Receptor estrogenowy
Czerniak złośliwy
Kompleksy melaniny A
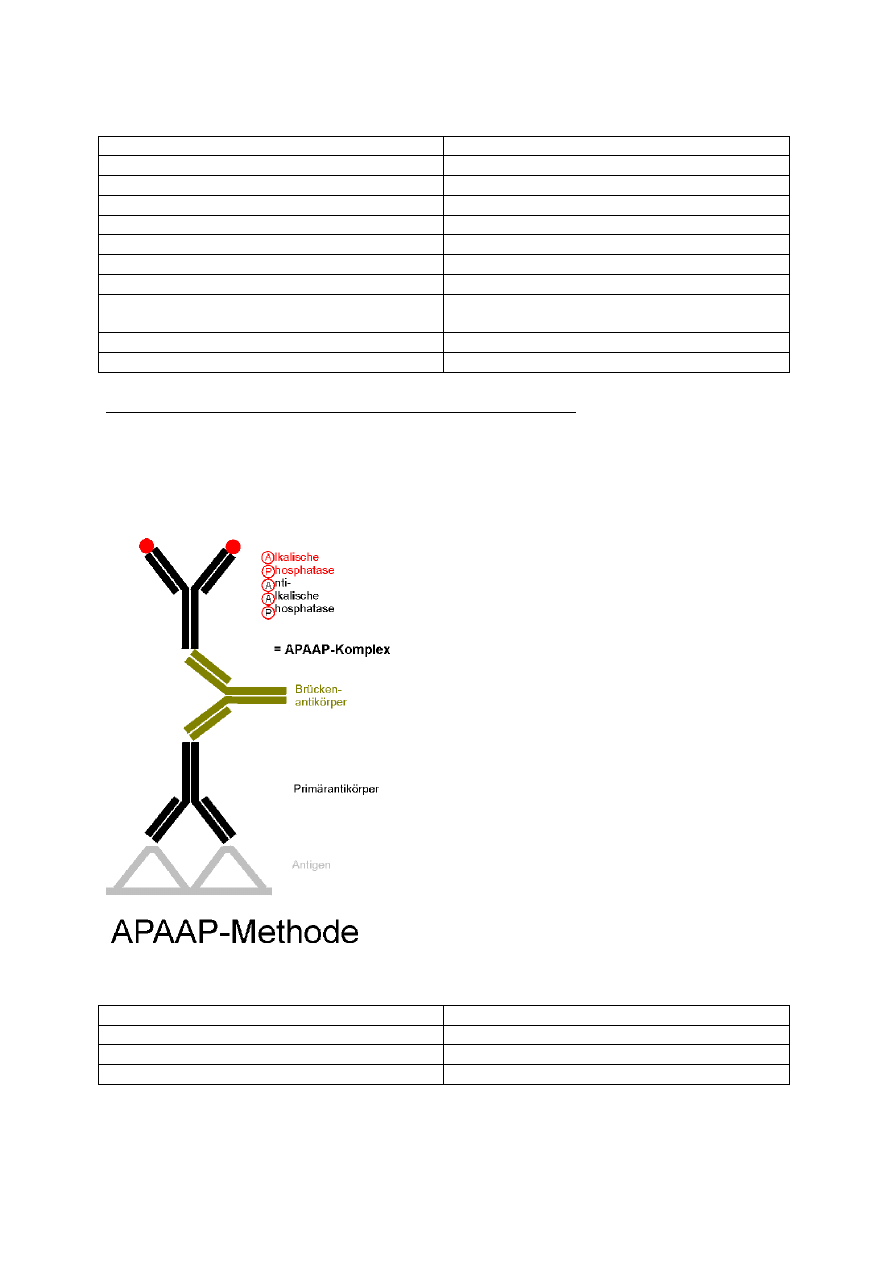
Reakcja fosfataza alkaliczna – antyfosfataza alkaliczna (APAAP)
Zasada metody jest podobna do reakcji PAP, różni się jedynie wykorzystywanym
kompleksem. Zastosowanie metody jest bardzo podobne, służy ona do wykrywania obecności
antygenów w tkankach. Barwne, czerwone produkty reakcji są dobrze widoczne w
mikroskopie świetlnym.
Zastosowanie metody:
Typ nowotworu
Marker wykrywany immunoenzymatycznie
Anaplasyczny chłoniak olbrzymiokomórkowy
CD30
Łuskowaty rak skóry
Nabłonkowy cz. wzrostu EGFR
Chłoniak obwodowy wyw. z limfocytów T
Granzym B
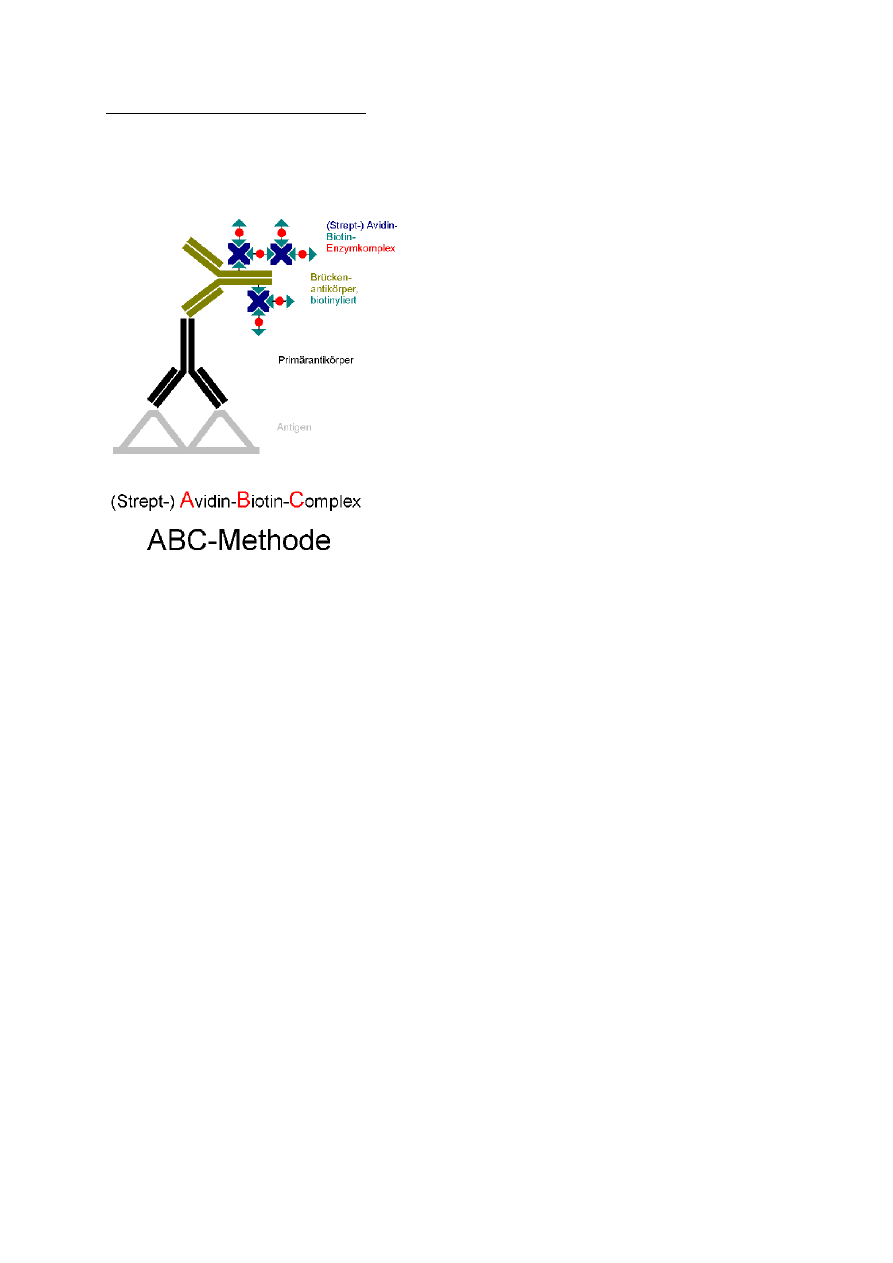
Reakcje z układem biotyna-awidyna
W metodzie tej wykorzystuje się wysokie powinowactwo biotyny (nisko
cząsteczkowej wit. H) do zasadowej glikoproteiny białka jaja kurzego – awidyny. Czasem
zamiast awidyny wykorzystuje się streptawidynę, izolowaną z bakterii Streptomyces avidini.
Cytometria przepływowa
Jest to nowoczesna metoda badawcza służąca do wieloparametrowej oceny komórek układu
krwiotwórczego. Pozwala ona na jednoczesne określenie:
Komórek krwi na podstawie ich wielkości i granularności (populacje erytrocytów,
granulocytów, limfocytów, monocytów i trombocytów)
Różnych rodzajów antygenów różnicowania (CD) i innych poprzez użycie przeciwciał
monoklonalnych znakowanych różnymi fluorochromami.
Warunkiem wykonania analizy cytometrycznej jest doprowadzenie posiadanego materiału do
zawiesiny pojedynczych komórek. Przy pobieraniu krwi do badań cytometrycznych stosujemy
odpowiedni antykoagulant:
EDTA i heparyna – dla pełnej krwi
Hirudyna – dla szpiku kostnego
W uzyskanej zawiesinie komórek należy określić ich żywotność. Po dokonaniu analizy można
komórki sortować na poszczególne frakcje stosując odpowiednie urządzenie pomiarowe, tzw. sorter
komórek.
Zasada metody polega na tym, że komórki kierowane są do kanału w strumieniu cieczy
pojedynczo, po czym wiązka niebieskiego bądź ultrafioletowego światła oświetla przepływające
komórki, ulegając ugięciu i rozproszeniu, a jeśli komórki zostały wyznakowane znacznikiem
fluorescencyjnym, także wzbudzając fluorescencję. Źródłem światła są lasery lub rtęciowe lampy
wysokociśnieniowe. Światło ugięte i rozproszone, a także fluorescencyjne zbierane jest przez
odpowiednio dopasowany układ optyczny, przesyłający je poprzez filtry zaporowe do detektorów.
Następnie dołączony system automatyki, sterowania oraz komputer zbiera i przetwarza uzyskane dane,
co pozwala na ocenę parametrów co najmniej 100 komórek na sekundę. Liczba mierzonych
parametrów zależy od rodzaju przyrządu.
Wykorzystywane w tej metodzie barwniki to fikobiliproteiny:
Fikoerytryna B, fikoerytryna R (światło czerwone)
Fikocyjanina C, fikocyjanina R (światło fioletowe)
Allofikocyjanina (światło zielone)
Do oznaczania DNA w komórce stosowany jest jodek propidyny.

Techniką cytometrii przepływowej możemy:
Określić liczebność populacji komórek w badanym materiale
Określić cechy morfologiczne (fenotyp) badanych komórek
Ocenić stan czynnościowy komórek
Oznaczyć stopień ekspresji antygenu na powierzchni komórek
Oznaczać ilościowo niektóre białka (cytokiny)
Wyznaczanie powyższych parametrów jest przydatne w diagnostyce klinicznej – umożliwia
monitorowanie stanu immunologicznego w trakcie choroby i leczenia.
Określić fenotyp komórek blastycznych w białaczkach ostrych
Diagnozować:
- chłoniaki
- białaczki przewlekłe
- zespoły mielodysplastyczne (MDS)
Oceniać DNA w komórkach białaczkowych
Poszukiwać choroby resztkowej (MRD)
Oceniać molekułę lekooporności (MDR)
Monitorować pacjentów po przeszczepach allogenicznych i szpiku
Badać komórki krwiotwórcze, retikulocyty i erytrocyty
Oceniać morfologicznie i czynnościowo płytki krwi
Określać jakościowo i ilościowo niedobory odpornościowe, oznaczać ilościowo klasy i
podklasy immunoglobulin
Diagnozować AIDS przez ocenę limfocytów CD4
Wykrywać erytrocyty płodu we krwi matki
Oznaczać ilościowo cytokiny
Najczęściej stosowane markery to:
CD45 leukocytów
CD3 limfocytów
CD19 i CD20 limfocytów B
CD15 neutrofili
CD16 i CD56 komórek NK
Wyszukiwarka
Podobne podstrony:
08 Immunologia prelekcja 11 19 2007id 7260 (2)
09 Immunologia prelekcja 11 26 2007id 7759 (2)
07 Immunologia prelekcja 11 12 2007id 6717 (2)
Immunologia - prelekcja 11.05.2007, immunologia
05 Immunologia prelekcja 10 29 2007id 5532 (2)
03 Immunologia prelekcja 10 15 2007id 4167 (2)
10 Immunologia prelekcja 12 02 2007id 10554 (2)
13 Immunologia prelekcja 12 17 2007id 14455 (2)
01 Immunologia prelekcja 10 01 2007id 2618 (2)
Immunologia - prelekcja 11.26.2007, immunologia
02 Immunologia prelekcja 10 08 2007id 3412 (2)
04 Immunologia prelekcja 10 22 2007id 4837 (2)
03 Immunologia prelekcja 10 15 2007id 4167 (2)
więcej podobnych podstron