
ARKUSZ I
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
•
Zdaj¹cy otrzymuje punkty tylko za ca³kowicie prawid³ow¹ odpowied.
•
Gdy do jednego polecenia s¹ dwie odpowiedzi (jedna prawid³owa, druga nieprawid³owa )
to zdaj¹cy nie otrzymuje punktów.
•
Je¿eli polecenie brzmi: Napisz równanie reakcji...,to w odpowiedzi zdaj¹cy powinien
napisaæ równanie reakcji chemicznej, a nie jej schemat.
•
Brak wspó³czynników w równaniu reakcji chemicznej obni¿a punktacjê o 1 pkt, je¿eli
punktacja za równanie jest równa 2 pkt.
•
Brak jednos
tek przy rozwi¹zaniu zadañ rachunkowych obni¿a punktacjê o 1 punkt.
•
Ca³kowicie poprawne rozwi¹zanie zadañ rachunkowych, uwzglêdniaj¹ce inny tok
rozumowania ni¿ w podanym opisie, nale¿y oceniæ pe³n¹ liczb¹ punktów.
Punktacja
Nr
zad.
Przewidywana odpowied
Za
czyn
noæ
Suma-
rycznie
1.
Odpowied: D 1
1
2.
Odpowied: B
1 1
3.
Odpowied: C
1 1
4.
Odpowied: A
1 1
5.
Odpowied: C 1
1
6.
Odpowied: C 1
1
7.
Odpowied: C lub B 1
1
8.
Za ka¿de prawid³owo napisane równanie reakcji po 1 pkt.
Równanie I Na
2
O + H
2
O 2Na
+
+ 2 OH
-
Równanie II OH
-
+ H
+
H
2
O
lub 2H
+
+ SO
4
2-
+ 2K
+
+ 2OH
-
2K
+
+ SO
4
2-
+ 2H
2
O
lub H
+
+ HSO
4
-
+ K
+
+ OH
-
K
+
+ HSO
4
-
+ H
2
O
Równanie III Fe
3+
+ 3 OH
-
Fe(OH)
3
lub Fe
3+
+ 3Cl
-
+ 3Na
+
+ 3OH
-
3Na
+
+ 3Cl
-
+ Fe(OH)
3
1
1
1
3
Za odpowied: Nie bêdzie mia³ odczynu obojêtnego roztwór
azotanu(III) sodu”; (nazwa lub wzór soli).
1
Za uzasadnienie np. „Azotan(III) sodu ulega w wodzie hydrolizie”
lub „siarczan(VI) sodu nie hydrolizuje” lub inne poprawne
uzasadnienie.
1
9.
Za napisanie równania reakcji: NO
−
2
+ H
2
O HNO
2
+ OH
−
1
3
Za okrelenie zmiany pH typu: pH zmaleje lub pH zmniejszy siê.
1
Za wyjanienie s³owne np.: W wyniku reakcji siarkowodoru z wod¹
wzronie stê¿enie jonów H
+
lub powstaje kwas lub powstaj¹ jony
H
3
O
+”.
1
10.
Za napisanie równania reakcji np.: H
2
S H
+
+ HS
−
lub
H
2
S 2H
+
+ S
2-
lub H
2
S + H
2
O H
3
O
+
+ HS
−
lub
H
2
S + 2H
2
O 2H
3
O
+
+ S
2
−
1
3
Egzamin maturalny z chemii, maj 2002 r.
1
Arkusz I
Za napisanie równania reakcji :CuSO
4
+ BaCl
2
CuCl
2
+ BaSO
4
lub pe³ne równanie jonowe.
1
11.
Za wyjanienia np.:
Stosuj¹c chlorek baru powstaje trudnorozpuszczalny osad.
Stosuj¹c NaCl otrzyma siê roztwór zawieraj¹cy mieszaninê jonów.
1
1
3
Za obliczenie masy molowej KMnO
4
(158 g?mol
-1
).
1
Za obliczenie na podstawie równania reakcji.
1
12.
Za poprawny wynik wraz z jednostk¹ (15,8g).
1
3
Za zapis wyra¿enia
K
=
12
,
1
)
72
,
0
(
)
84
,
0
(
2
2
⋅
1
13.
Za obliczenie wyniku
1,215 (nie wymagane jest podanie jednostek).
1
2
14.
Za ka¿d¹ prawid³owo wskazan¹ fazê 1 pkt.
Faza rozpraszaj¹ca – gaz lub powietrze lub mieszanina gazów.
Faza rozproszona –
py³ lub sta³e zanieczyszczenia lub sadza, wêgiel,
„C”.
1
1
2
15.
Odpowied: roztwór nienasycony.
1 1
16.
Za ka¿d¹ poprawn¹ nazwê zwi¹zku 1 pkt.
Nazwa zwi¹zku I pentan-2-on (2-pentanon)
Nazwa zwi¹zku II kwas 2-aminobutanowy
Nazwa zwi¹zku III 2,3,3-trimetylopentan
1
1
1
3
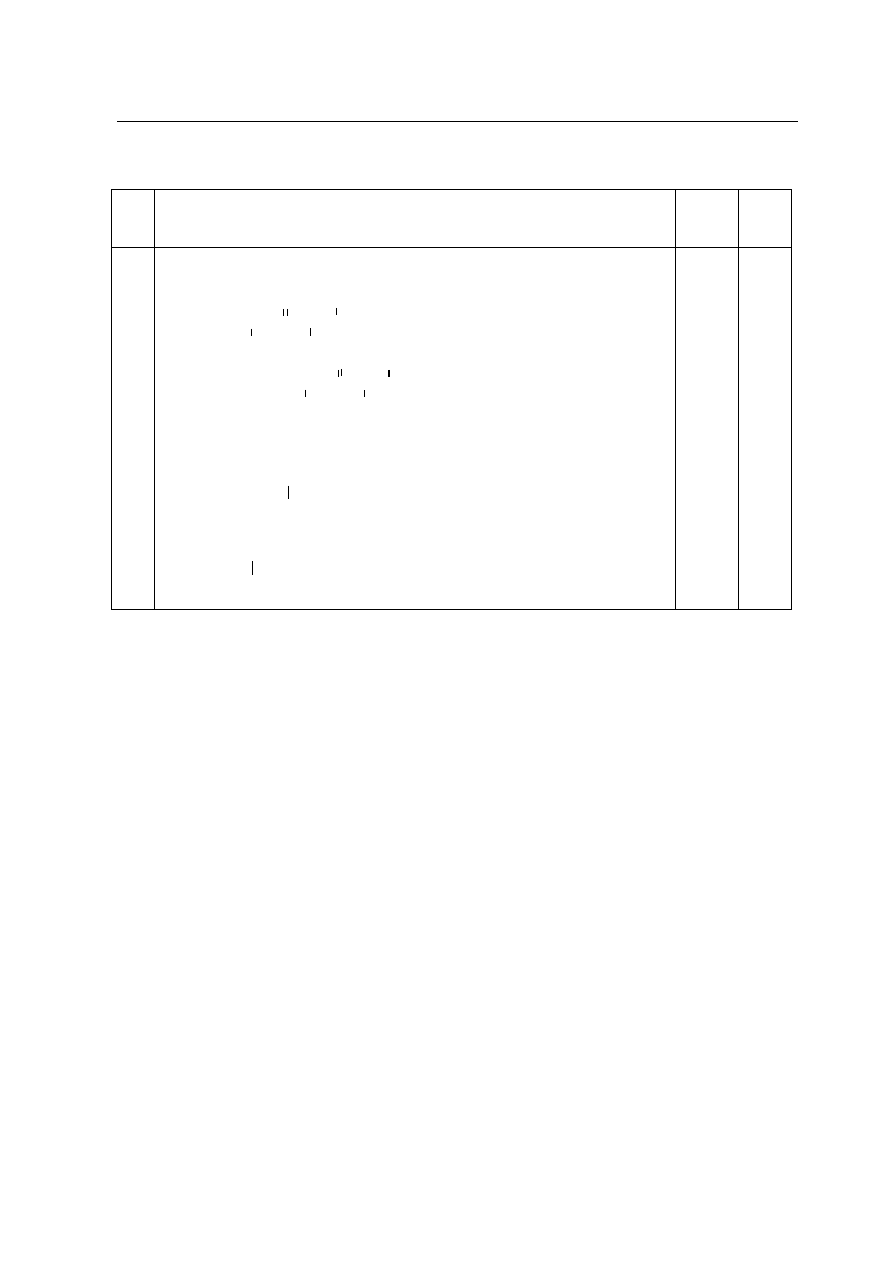
Za poprawnie podane trzy wzory 2 pkt, za poprawnie podane dwa
wzory – 1 pkt,
za poprawne przyporz¹dkowanie rzêdowoci 1 pkt.
CH
3
– CH – CH
2
– CH
2
alkohol I-
rzêdowy | |
CH
3
OH
alkohol II-
rzêdowy CH
3
– CH – CH – CH
2
– CH
3
| |
CH
3
OH
17.
CH
3
|
alkohol III-
rzêdowy CH
3
– C – CH
3
|
OH
3
Reakcja substytucji: C lub B lub C i B.
1
18.
Reakcja eliminacji: A.
1
2
Za prawid³owe obliczenie masy substancji rozpuszczonej.
1
19.
Za poprawn¹ wartoæ liczbow¹ wraz z jednostk¹ (5g).
1
2
2
Egzamin maturalny z chemii, maj 2002 r.
Arkusz I
20.
Za ka¿d¹ prawid³owo nazwan¹ grupê 1pkt.
Nazwa grupy A - grupa karboksylowa.
Nazwa grupy B - grupa hydroksylowa lub wodorotlenowa.
1
1
2
21. Za podanie wzoru dipeptydu
O CH
2
OH
CH
3
– CH – C – N – CH – COOH
NH
2
H
O CH
3
lub HO – CH
2
– CH – C – N – CH – COOH
NH
2
H
lub produkty kondensacji dwóch cz¹steczek
HO – CH
2
– CH – COOH
NH2
lub produkty kondensacji dwóch cz¹steczek.
CH
3
– CH – COOH
NH2
1
1
Egzamin maturalny z chemii, maj 2002 r.
3
Arkusz I
Wyszukiwarka
Podobne podstrony:
2002 MAJ OKE PR VI ODP
2002 MAJ OKE PP I ODP(1)
2002 MAJ OKE PP III ODP
2002 MAJ OKE PR VI ODP
2002 MAJ OKE PP I ODP(1)
PR geografia maj 2002 model odp
2002 MAJ OKE PR IV V ODP
2009 maj odp (2)
2002 MAJ OKE PP IIid 21662
2008 maj odp
2002 MAJ OKE PP III KRYTERIA OCENIANIA
2002 MAJ OKE PR V
więcej podobnych podstron