
Równowagi w roztworach
elektrolitów
ciąg dalszy
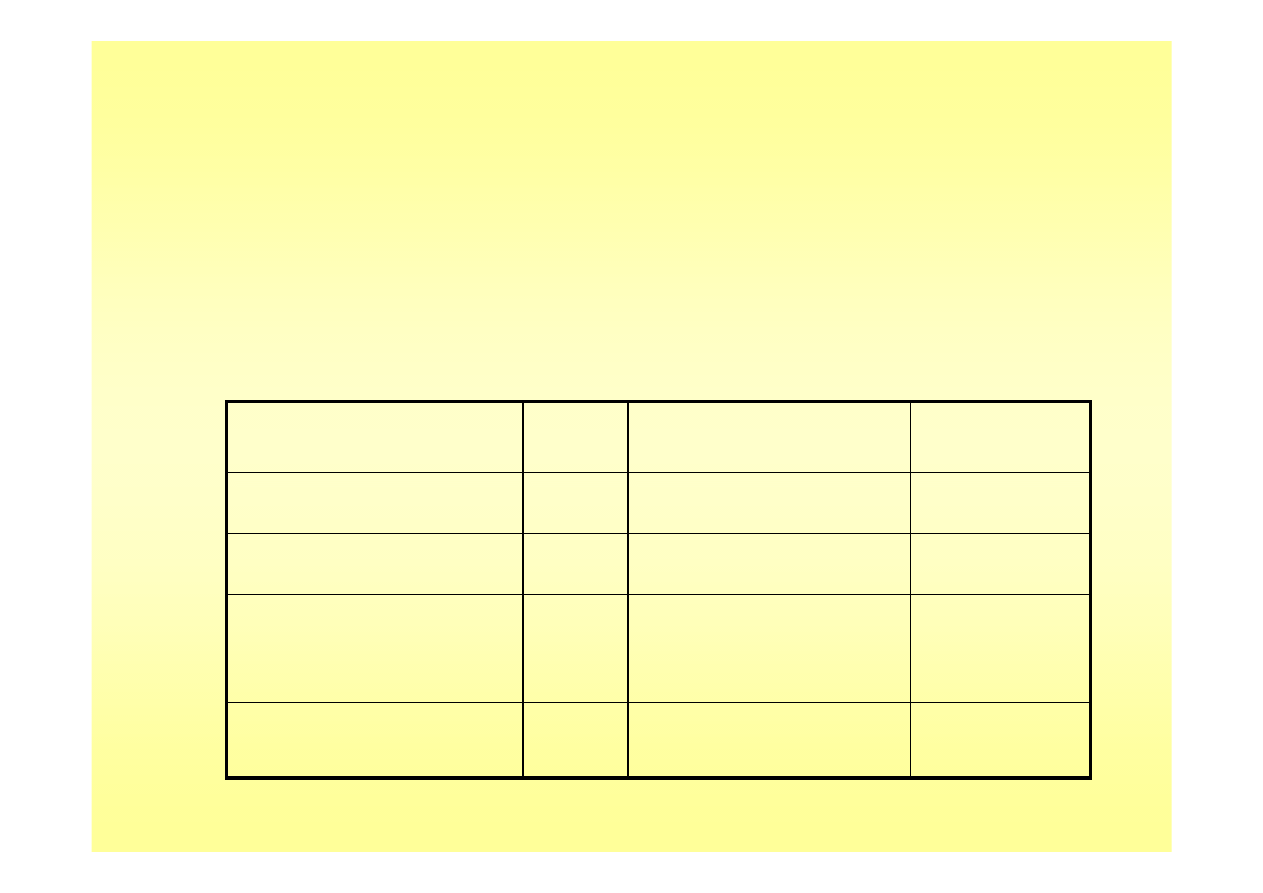
Dysocjacja elektrolitu mocnego
• Dysocjacja mocnego kwasu w jego roztworach:
HCl H O
H O
Cl
2
H O
3
2
+
⎯ →
⎯
⎯
+
+
−
stężenie kwasu
α
[H
3
O
+
]=[Cl
-
]
pH
0,1 (10
-1
)
1
1
1
1
0,1 (10
-1
)
1
0,01 (10
-2
)
0,01 (10
-2
)
2
0,001 (10
-3
)
0,001 (10
-3
)
3
10
-4
10
-4
4

Dysocjacja elektrolitu słabego (1)
• Dysocjacja
słabego kwasu
o stężeniu c
s
:
HR + H O
H O
R
s
2
3
s
← →
⎯
+
+
−
c
s
-α·c
s
α·c
s
α·c
s
Ustala się równowaga dysocjacji, i można
zastosować prawo rozcieńczeń Ostwalda:
K
[H O ] [R ]
[HR ]
K
1-
; [H O ] =
3
s
s
2
3
=
⋅
=
⋅
⋅
+
−
+
;
α
α
α
c
c
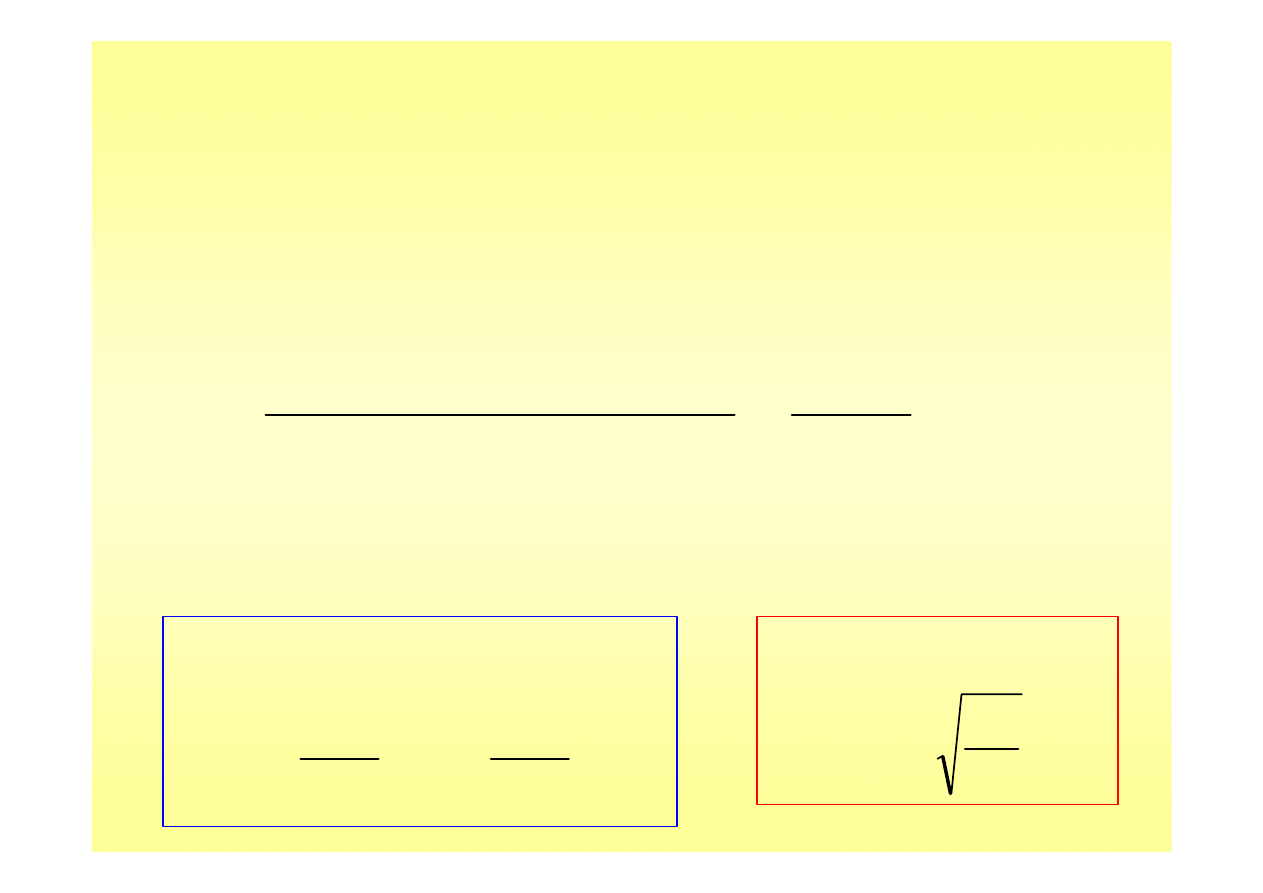
Dysocjacja elektrolitu słabego (2)
• Dysocjacja słabego kwasu w jego roztworach:
−
+
+
⎯→
←
+
COO
CH
O
H
O
H
COOH
CH
3
3
2
3
c
c
⋅
=
=
⋅
=
−
⋅
=
⋅
=
−
+
−
−
+
α
α
α
]
COO
CH
[
]
O
H
[
10
8
,
1
1
COOH]
[CH
]
COO
CH
[
]
O
H
[
3
3
5
2
3
3
3
d
K
0
0
2
2
=
−
⋅
+
=
−
⋅
+
⋅
c
K
c
K
K
K
c
d
d
d
d
α
α
α
α
dla << 1
α
α
α
K
c
K
c
d
d
≈
≈
2

Dysocjacja elektrolitu słabego (3)
• pH roztworów kwasu octowego
stężenie
kwasu
α
[H
+
]=c·α
[CH
3
COO
-
] =c·α
pH
1
0,0042
4,23· 10
-3
2,37
0,0133
0,0415
0,125
0,344
0,1 (10
-1
)
1,33· 10
-3
2,87
0,01 (10
-2
)
4,15· 10
-4
3,38
0,001 (10
-3
)
1,25 · 10
-4
3,90
10
-4
3,44 · 10
-5
4,46
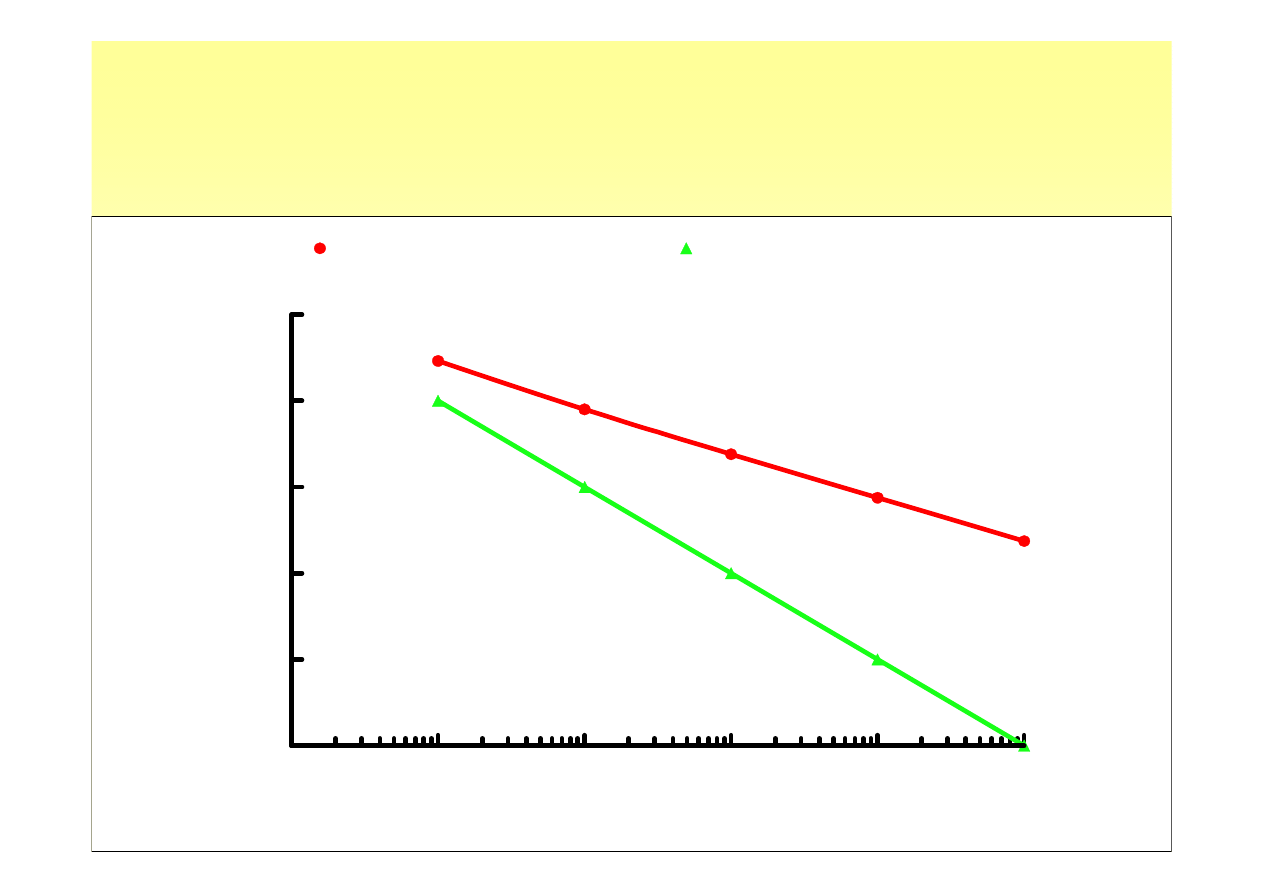
Równowaga dysocjacji
• pH w funkcji stężenia
0.00001
0.0001
0.001
0.01
0.1
1
0
1
2
3
4
5
kwas octowy
kwas solny
C[M/dm
-3
]
pH

Równowagi w roztworach elektrolitów (II)
Efekt wspólnego jonu
• Jeżeli w roztworze znajdują się dwa elektrolity o
wspólnym jonie, to następuje cofnięcie dysocjacji
słabego elektrolitu:
HR + H O
H O
R
HR + H O
H O
R
m
2
3
m
s
2
3
s
⎯ →
⎯
+
← →
⎯
+
+
−
+
−
Stężenie jonów H
3
O
+
jest praktycznie równe stężeniu
mocnego elektrolitu, a ponieważ występuje we wzorze
na stałą równowagi dysocjacji elektrolitu słabego,
wpływa na jego stopien dysocjacji.

Efekt wspólnego jonu (2)
• Efekt wspólnego jonu
– Jeśli w roztworze znajduje się równocześnie mocny
kwas (HCl) o stężeniu c
m
=0,1 M oraz słaby kwas
(CH
3
COOH) o stężeniu c
s
=0,1 M, to:
HCl H O
H O
Cl
2
H O
3
2
+
⎯ →
⎯
⎯
+
+
−
CH COOH H O
H O
CH COO
3
2
H O
3
3
2
+
←
→
⎯⎯
+
+
−
K
c
c
c
c c
c
CH COOH
H O
CH COO
CH COOH
m
CH COO
CH COOH
3
3
3
3
3
3
≈
⋅
≈
⋅
+
−
−
UWAGA! W rzeczywistości stężenie jonów wodorowych
jest sumą c
m
i stężenia jonów octanowych

Efekt wspólnego jonu (3)
• Stopień dysocjacji kwasu octowego w roztworze z
kwasem solnym i bez niego:
c
m
c
s
≅
α, stopień
dysocjacji
α dla
czystego
0,1
0,1
0,00002
0,00018
0,00156
0,00376
0,01
0,1
0,0133
0,0133
0,0133
0,001
0,1
0,0001
0,1
0,0133

Roztwory buforowe
Roztwory buforowe
mają zdolność
utrzymywania pH roztworu na stałym poziomie
(w przybliżeniu).
Składają się one z jednej lub kilku substancji, w
których istniejąca równowaga dysocjacji niweluje
dodatek silnego kwasu lub zasady.
Przykłady:
- mieszanina słabego kwasu i jego soli z mocną
zasadą (np.
CH
3
COOH i CH
3
COONa
);
- mieszanina słabej zasady i jej soli z mocnym
kwasem (np.
NH
4
OH i NH
4
Cl
);
- niektóre sole (np.
CH
3
COONH
4
);
- mieszanina dwóch soli (np.
KH
2
PO
4
i K
2
HPO
4
).

Mechanizm działania roztworu buforowego
K
c
c
c
c
c
c
CH COOH
H O
CH COO
CH COOH
H O
SÓL
KWAS
3
3
3
3
3
=
⋅
≈
⋅
+
−
+
c
c
c
c
CH COO
SÓL
CH COOH
KWAS
3
3
−
=
=
;
Bufor octanowy składa się z
kwasu octowego
i jego soli z
mocną zasadą
:
Kwas octowy jest elektrolitem słabym – jest zdysocjowany
częściowo, a sól – elektrolitem mocnym i zdysocjowanym
całkowicie. Zatem biorąc pod uwagę efekt wspólnego jonu
można napisać w przybliżeniu:
+
−
+
−
+
⎯→
⎯
+
⎯→
←
+
Na
COO
CH
COONa
CH
O
H
COO
CH
O
H
COOH
CH
3
3
3
3
2
3

Mechanizm działania roztworu buforowego
(2)
c
c
c
K
H O
KWAS
SÓL
CH COOH
3
3
+
≈
⋅
pH
pK
c
c
CH COOH
SÓL
KWAS
≈
+
⎛
⎝
⎜
⎞
⎠
⎟
3
log
Jeśli dodamy mocnego kwasu (przybywa jonów H
3
O
+
),
to dysocjacja kwasu ulegnie dalszemu cofnięciu, jeśli
mocnej zasady(przybywa jonów OH- ), jego dysocjacja
wzrośnie (równowaga dysocjacji wody!).
pH zmieni się nieznacznie, gdyż oba stężenia są
„pod logarytmem” ...

Działanie roztworu buforowego (3)
pH
pK
c
c
pK
CH COOH
CH COOH
SÓL
KWAS
≈
+
⎛
⎝
⎜
⎞
⎠
⎟ =
+ =
3
3
0 4 74
log
,
Bufor octanowy zawiera 1 m CH
3
COOH i 1 m CH3COONa,
jego pH wynosi zatem:
Jeżeli dodamy
0,1 mola mocnego kwasu
(HCl),
to efekt będzie taki, jakby stężenie soli zmalało,
a kwasu wzrosło:
pH
c
c
SÓL
KWAS
≈
+
−
+
⎛
⎝
⎜
⎞
⎠
⎟ =
−
=
4 74
0 1
0 1
4 74 0 08 4 66
,
log
,
,
,
,
,
Gdyby taką samą ilość kwasu dodać do czystej wody,
pH zmieniłoby się z 7 na 1 ...
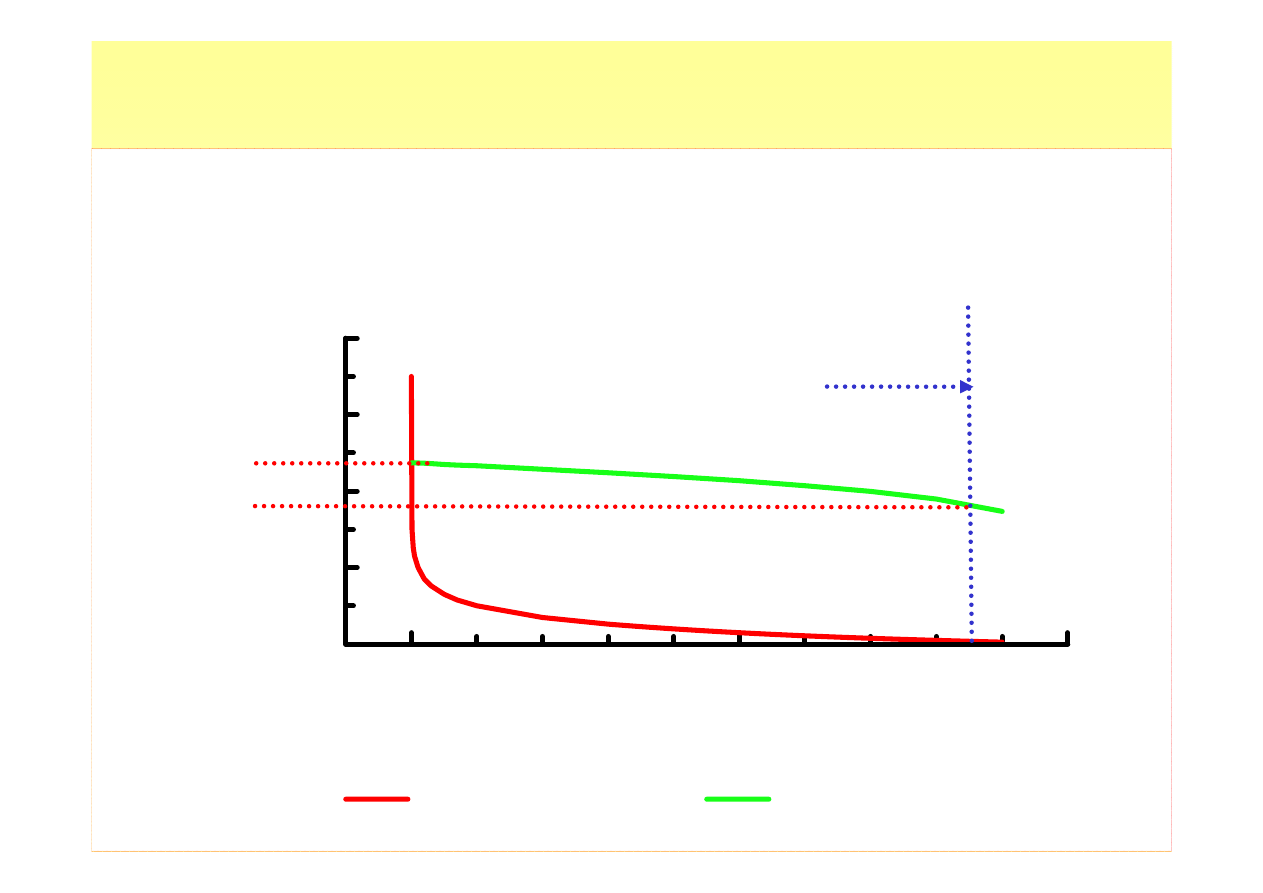
Działanie roztworu buforowego (4)
0.00
0.50
1.00
ilość mocnego kwasu [mol]
0
2
4
6
8
pH
bez buforu
z buforem
pojemność
roztworu
buforowego
1

Hydroliza soli

Hydroliza soli
• Hydroliza soli jest zjawiskiem związanym z reakcją jonów
powstałych z dysocjacji soli z wodą:
CH COONa + H O
CH COOH + NaOH
CH COONa
CH COO + Na
3
2
3
3
3
-
+
⎯ →
⎯
⎯ →
⎯
CH COO + H O + Na
CH COOH + OH + Na
3
-
2
+
3
-
+
← →
⎯
(sól jest elektrolitem mocnym i dysocjuje całkowicie,
woda jest elektrolitem słabym i dysocjuje częściowo)
zasada I
kwas II
kwas I
zasada II
zasada sodowa
jest elektrolitem mocnym i jest całkowicie
zdysocjowana, kwas octowy - elektrolit słaby - tylko
częściowo, zatem roztwór będzie miał odczyn
zasadowy ...

Hydroliza soli (2)
Stała równowagi reakcji hydrolizy:
K
c
c
c
c
h
OH
CH COOH
CH COO
H O
'
=
⋅
⋅
−
−
3
3
2
K c
K
c
c
c
c
c
h
H O
h
OH
CH COOH
H O
CH COO
H O
'
⋅
=
=
⋅
⋅
⋅
−
+
−
+
2
3
3
3
3
=
k
K
w
CH COOH
3
jeśli stężenie wody uznać za stałe oraz pomnożyć licznik i
mianownik przez stężenie jonów hydroniowych, to:
Skoro można zdefiniować stałą hydrolizy, to można
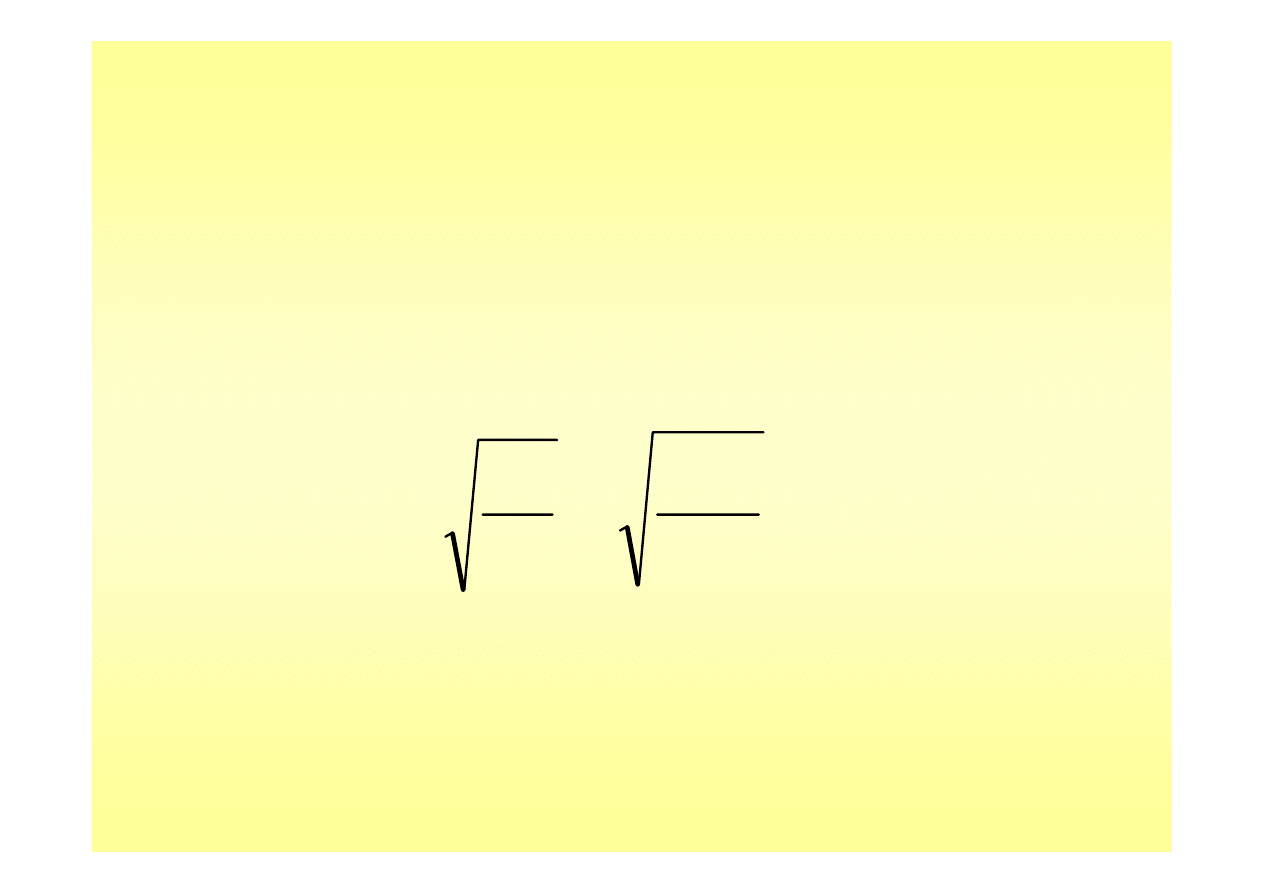
również określić stopień hydrolizy β
Hydroliza soli (3)
NH Cl
NH
Cl
NH
H O Cl
NH
H O
Cl
4
4
4
2
3
3
⎯ →
⎯
+
+
+
← →
⎯
+
+
+
−
+
−
+
−
K c
c
c
c
c
c
k
K
h
H O
H O
NH
OH
NH
OH
w
NH OH
'
⋅
=
⋅
⋅
⋅
=
+
−
+
−
2
3
3
4
4
kwas I
zasada II zasada I
kwas II
kwas solny jest elektrolitem mocnym i jest całkowicie
zdysocjowany, zasada amonowa - elektrolit słaby - tylko
częściowo, zatem roztwór będzie miał odczyn
kwaśny ...

Hydroliza soli (4)
Czy można obliczyć
pH
lub
pOH
roztworu soli po
jej hydrolizie ?
K
c
c
c
c
h
OH
CH COOH
CH COO
H O
'
=
⋅
⋅
−
−
3
3
2
c
c
K
c
OH
CH COO
h
CH COOH
−
−
=
⋅
3
3
c
c
c
c
c
CH COO
OH
CH COOH
s
OH
3
3
−
−
−
=
=
−
K
c
h
s
=
⋅
−
β
β
2
1
c
c
OH
s
−
= ⋅
β
Hydroliza soli (5)
Jaki jest odczyn 0,1 M roztworu CH
3
COONa ?
Przyjmijmy wartość stałej dysocjacji 1·10
-5
;
wówczas wartość stałej hydrolizy wynosi 1·10
-9
Jeśli stopień hydrolizy β jest niewielki, możemy
skorzystać z uproszczonego wzoru:
β
≈
=
=
−
−
K
c
h
s
10
0 1
10
9
4
,
wówczas c
OH
-
= 10
-4
·0,1=10
-5
; pOH wynosi 5, czyli pH=9
Hydroliza soli (6)
NaCl
Na
Cl
Na
H O Cl
Na
H O Cl
2
+
2
⎯ →
⎯
+
+
+
← →
⎯
+
+
+
−
+
−
−
chlorek sodowy jest solą
mocnej zasady NaOH
i
mocnego
kwasu HCl
, które są całkowicie zdysocjowane. Sól nie
ulega hydrolizie, a odczyn jej roztworu jest
obojętny
...
kwas
zasada
hydroliza
odczyn
obojetny
kwaśny
zasadowy
zależy od K
d
kwasu i
zasady
UWAGA !
dotyczy
kwasów i
zasad
dyso-
cjujących
jednostop-
niowo
mocny
mocna
brak
mocny
słaba
zachodzi
słaby
mocna
zachodzi
słaba
słaby
zachodzi

Hydroliza soli (7)
Jaki odczyn mają wodorosole, sole słabych
kwasów i mocnych zasad?
Zasadowy ???
Przypadki trochę bardziej skomplikowane
Dysocjacja kwasu węglowego:
−
−
+
−
+
−
−
+
−
+
⋅
=
+
⎯→
←
⋅
=
+
⎯→
←
3
HCO
2
3
CO
O
3
H
2
2
3
3
3
3
CO
2
H
3
HCO
O
3
H
1
3
3
3
2
K
CO
O
H
HCO
K
HCO
O
H
CO
H
c
c
c
a
c
c
K
1
=4,3·10
-7
K
2
=5,6·10
-11
NaHCO
Na
HCO
3
3
⎯ →
⎯
+
Dysocjacja wodorowęglanu sodowego NaHCO
3
:
+
−

Hydroliza soli (8)
Przypadki skomplikowane
H CO
OH
HCO
H O
H O
CO
2
3
3
2
3
3
2
+
←
→
⎯⎯⎯
+
←
→
⎯⎯⎯
+
−
−
+
−
hydroliza
dysocjacja
możliwe są dwie reakcje “konkurencyjne”
K
k
K
h
w
=
=
⋅
=
⋅
−
−
−
1
14
7
8
10
4 3 10
2 3 10
,
,
K
K
dys
=
=
⋅
−
2
11
5 6 10
,
Ponieważ K
dys
<< K
h
(3 rzędy!), a obie stałe mają taki
sam mianownik, przeważa hydroliza i roztwór ma
odczyn zasadowy
...

Hydroliza soli (9)
Przypadki skomplikowane
Dysocjacja wodorosiarczanu (IV) sodowego NaHSO
3
:
NaHSO
Na
HSO
3
3
⎯ →
⎯
+
+
−
Dysocjacja kwasu siarkowego (IV):
−
−
+
−
+
−
−
+
−
+
⋅
=
+
⎯→
←
⋅
=
+
⎯→
←
3
HSO
2
3
SO
O
3
H
2
2
3
3
3
3
SO
2
H
3
HSO
O
3
H
1
3
3
3
2
K
SO
O
H
HSO
K
HSO
O
H
SO
H
c
c
c
c
c
c
K
1
=1,7·10
-2
K
2
=6,2·10
-6

Hydroliza soli (10)
Przypadki skomplikowane
H SO
OH
HSO
H O
H O
SO
2
3
3
2
3
3
2
+
←
→
⎯⎯⎯
+
←
→
⎯⎯⎯
+
−
−
+
−
hydroliza
dysocjacja
możliwe są dwie reakcje “konkurencyjne”
K
k
K
h
w
=
=
⋅
=
⋅
−
−
−
1
14
2
13
10
1 7 10
5 9 10
,
,
K
K
dys
=
=
⋅
−
2
6
6 2 10
,
Ponieważ K
dys
>> K
h
(7 rzędów!), a obie stałe mają taki
sam mianownik, przeważa dysocjacja i roztwór ma
odczyn kwaśny ...
Jak z tego widać, nawet sól
mocnej zasady
i
słabego
kwasu
może mieć
odczyn kwaśny
...
Document Outline
- Równowagi w roztworach elektrolitów
- Dysocjacja elektrolitu mocnego
- Dysocjacja elektrolitu słabego (1)
- Dysocjacja elektrolitu słabego (2)
- Dysocjacja elektrolitu słabego (3)
- Równowaga dysocjacji
- Równowagi w roztworach elektrolitów (II) Efekt wspólnego jonu
- Efekt wspólnego jonu (2)
- Efekt wspólnego jonu (3)
- Roztwory buforowe
- Mechanizm działania roztworu buforowego
- Mechanizm działania roztworu buforowego(2)
- Działanie roztworu buforowego (3)
- Działanie roztworu buforowego (4)
- Hydroliza soli
- Hydroliza soli
- Hydroliza soli (2)
- Hydroliza soli (3)
- Hydroliza soli (4)
- Hydroliza soli (5)
- Hydroliza soli (6)
- Hydroliza soli (7)
- Hydroliza soli (8) Przypadki skomplikowane
- Hydroliza soli (9) Przypadki skomplikowane
- Hydroliza soli (10) Przypadki skomplikowane
Wyszukiwarka
Podobne podstrony:
IB wyk13 11
wyk13 Rown Maxwella
IB w5 co
IB w4 Aud pełny
IB w7
IB test 3
konspekty gimnazjum Lesson Plan Ib
IB math 2008 HL p1tz2ms
IB wyk11
ib 05 05
Pochodne funkcji, IB i IŚ, 2011 12
Calki, IB i IS, 2011 12 id 1073 Nieznany
IB zagadnienia
ib 06 06
PMM HO100 IB
E, wyk13
ib 12 05
więcej podobnych podstron