
Logistyka I
Lucyna Skrzypczyk
31 marzec 2011
Ćw. Nr 6
Wyznaczanie stosunku
dla powietrza metodą
Clementa – Desormesa.
1. Wstęp teoretyczny
Stan gazu określa się podając jego cztery parametry: – objętość, – temperaturę,
– masę oraz – ciśnienie. Jeżeli rozważymy przykład gazu w którym niezmienna jest jego
masa, wywnioskujemy, że wszystkie pozostałe jego parametry są ze sobą ściśle powiązane.
Ten związek ukazuje równanie stanu gazu doskonałego:
Równanie stanu gazu doskonałego opisuje związek między ciśnieniem
, objętością
,
i temperaturą
w dowolnym stanie początkowym i odpowiednio z tymi wielkościami
w stanie końcowym:
1
Równania te dla gazu w warunkach normalnych przyjmuje postać:
gdzie: – stała gazowa
– ilość moli gazu
Z równania wynikają prawa przemian: izotermicznej (stała masa oraz temperatura gazu),
izobarycznej (stała masa oraz ciśnienie gazu) oraz izochorycznej (stała masa oraz objętość
gazu).
Rozważmy pracę jaką wykonuje gaz w czasie rozprężania. W prostokątnym naczyniu
znajduje się gaz o objętości i nie zmiennej masie . Naczynie te z góry zamknięte jest
tłokiem którego pole powierzchni wynosi . Gaz zajmuje całą dostępną w naczyniu
przestrzeń. W skutek np. podgrzania gaz zwiększa swoją objętość i jednocześnie unosi tłok
o . Wykonana praca jest równa:
Korzystając z własności oraz otrzymujemy:
1
Horst Stöcker, Nowoczesne kompendium z fizyki; PWN Warszawa 2010, s. 671; 20.6.1

Jedną z własności fizycznych gazu jest jego ciepło właściwe. Określa ono ilość ciepła
potrzebną do ogrzania ciała o . Gdy rozważamy gazy najprościej posługiwać się
ciepłem, właściwym molowym (ilość ciepła potrzebna do ogrzania danej substancji
o . Ciepło właściwe danego gazu zależy od warunków w jakim odbywa się przemiana.
Różnicę tę widać przy porównaniu
(dla stałego ciśnienia) oraz
dla stałej objętości. Ich
różnica wynika z pierwszej zasady termodynamiki:
Całkowita energia wewnętrzna izolowanego układu jest wielkością stałą. Energii nie
można wytworzyć ani unicestwić, można ją tylko przekazywać z układu do układu.
2
gdzie:
- ciepło pobrane przez gaz
– zmiana energii wewnętrznej gazu
– praca gazu
W czasie ogrzewania izochorycznego gaz nie wykonuje pracy ( ), a w czasie
ogrzewania
izobarycznego
gaz
wykonuje
pracę
przeciw
silom
zewnętrznym.
ponieważ w tych samych warunkach do ogrzania tej samej masy o potrzebna
jest większa ilość ciepła.
3
Metoda wyznaczania stosunku tych wielkości (Clementa – Desormesa) opiera się
o związek ciśnienia w czasie rozprężania adiabatycznego
w czasie sprężania
izotermicznego oraz szukaną wartością
Korzystając ze wzoru otrzymujemy:
4
gdzie:
– różnica poziomów cieczy w manometrze wytworzona za pomocą pompki
– różnica poziomów cieczy w manometrze powstała po adiabatycznym
rozprężeniu gazu
2
Horst Stöcker, Nowoczesne kompendium z fizyki; PWN Warszawa 2010, s.685;21.1
3
Na podstawie J. Emich –Kokot, F. Gajda, C. Górecki, A. Ingram, R. Krupa, Z. Michno, A. Żurawska, Ćwiczenia
laboratoryjne z Fizyki (skrypt nr 279); Oficyna Edukacyjna, Opole 2007, s. 85-92, 11.
4
J. Emich –Kokot, F. Gajda, C. Górecki, A. Ingram, R. Krupa, Z. Michno, A. Żurawska, Ćwiczenia laboratoryjne
z Fizyki (skrypt nr 279); Oficyna Edukacyjna, Opole 2007, s. 92, (11.36)

2. Układ pomiarowy oraz przebieg ćwiczenia
Zestaw wykorzystany w tym ćwiczeniu składa się balonu szklanego B wypełnionego powietrzem o
objętości . Balon połączony jest z manometrem wodnym M na którym zaznaczona jest podziałka
pozwalająca mierzyć różnicę ciśnień atmosferycznego i ciśnienia powietrza w balonie. Oprócz tego
druga rurka łączy balon z pompką przez zawór Z.
Rys. schematyczny układu
Ćwiczenie przebiegało w dwóch fazach :
Faza pierwsza - pompką P zwiększano ciśnienie w balonie – zachodziło sprężanie izotermiczne, po
ustaleniu poziomów odczytywano różnicę ciśnień atmosferycznego i ciśnienia gazu w balonie
.
Faza druga – otwierano zawór aż do wyrównania ciśnień – rozprężanie adiabatyczne, następnie po
zamknięciu zaworu zachodziła przemiana izochoryczna (przy stałej objętości). Ciśnienie gazu
w balonie wzrasta do stanu równowagi – wtedy (po ok 3-4 min) odczytywano różnicę ciśnień po raz
drugi
.
Fazy pierwszą i drugą powtórzono jedenastokrotnie.
3. Tabela pomiarów
B
M
Z
A
P

4. Obliczenia
W celu obliczenia przyspieszenia dla wahadeł korzystamy ze wzoru:
5. Obliczanie niepewności pomiarowych
Niepewność standardowa typu :
( ) √
∑
(
)
( )
( ) √
( )
( )
( )
Suma kwadratów wynosi:
∑
( ) √
Niepewność złożona:
( ) √
Złożona niepewność standardowa:
( ) √(
)
(
)
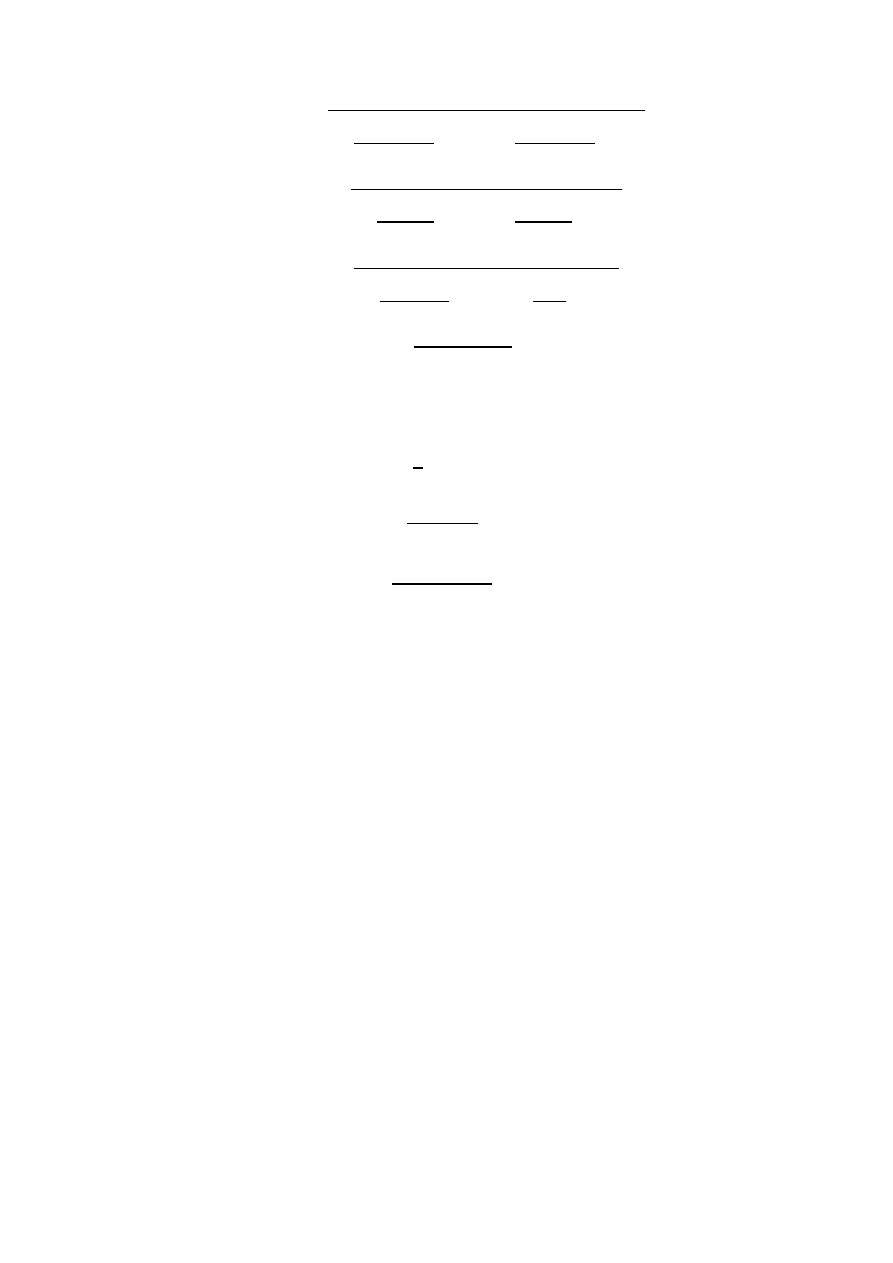
( ) √(
(
)
)
(
(
)
)
( ) √(
)
(
)
( ) √(
)
(
)
( ) √
( )
( )
dla
( )
|
|
| |
6. Wnioski:
Celem doświadczenia było wyznaczenie wartości współczynnika dla powietrza. Według
tablic wynosi ona w warunkach: ciśnienie oraz temperatura
. Warunki w których wykonano doświadczenie odbiegały od tych standardów w mniej lub
bardziej znaczny sposób. Wynik otrzymany w doświadczeniu ( ) wraz z niepewnościami
mieści w swoim zbiorze pomiar tablicowy i różni się od niego o .
Na błąd pomiaru w znacznym stopniu wpłynęły błędy eksperymentatora oraz dokładność
podziałki. Znaczenie dla różnicy otrzymanego wyniku miały również inne niż tablicowe warunki
w czasie wykonywania pomiarów.
Wyszukiwarka
Podobne podstrony:
cv id 121069 Nieznany
cv id 121069 Nieznany
zuchiewicz cv pl 0 id 593206 Nieznany
CV wzory nowoczesny id 121141 Nieznany
CV typ funkcjonalny id 121110 Nieznany
CV typ chronologiczny id 121109 Nieznany
zuchiewicz cv pl 0 id 593206 Nieznany
CV wzory nowoczesny id 121141 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
więcej podobnych podstron