
1
Wykład 4
4.2 Praca sprężania lub rozprężania gazu w cylindrze
4.1 I zasada termodynamiki
4.3 Energia wewnętrzna
4.4 I zasada termodynamiki jako zasada zachowania energii
4.5 Ciepło i ciepło właściwe
4.6 Ciepło właściwe gazu idealnego

2
4.1 I zasada termodynamiki
4.1.1 Wstęp – rodzaje pracy
I zasadę teromodynamiki sformułowaliśmy jako zasadę
zachowania energii. Sformułowanie jest stosunkowo proste, ale
zastosowanie tej zasady może stać się skomplikowane ze
względu na potrzebę uwzględnienia wszystkich form energii
biorących udział w procesie. W tym rozdziale będziemy chcieli
nadać temu prawu formę analityczną.
Pamiętamy powtórzone w Wykładzie 2 wyrażenie na prace
mechaniczną (1.1).
c
c
ds
F
s
d
F
W
cos
3
Wyrażenie to zawiera ustalenie znaku pracy.
Praca jest dodatnia wtedy gdy siła i przesunięcie mają ten
sam kierunek.
Praca jest ujemna, gdy mają one kierunek przeciwny.
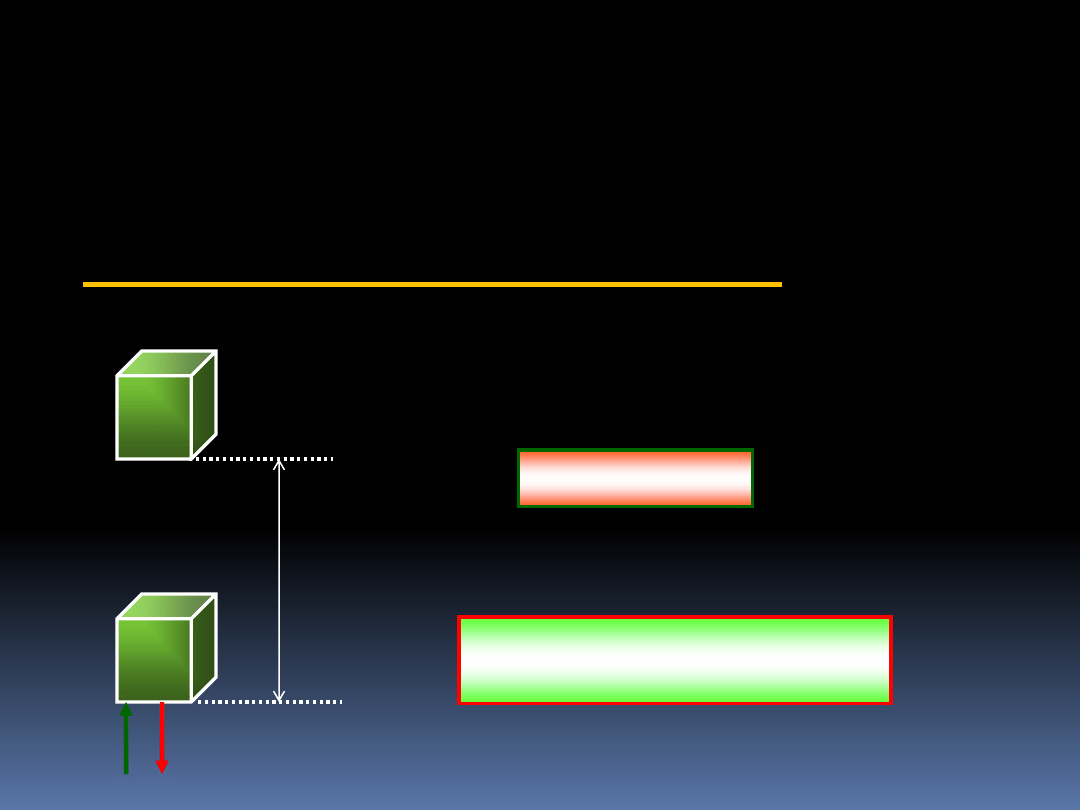
4.1.2 Praca w polu grawitacyjnym
m
P
F
W=P·h
Siła F którą musimy zadziałać aby podnieść
masę m jest równa liczbowo ciężarowi P
ciała.
h
h
h
o
mgh
ds
P
s
d
F
W
0
mg
P
F
Praca
(4.1)
4
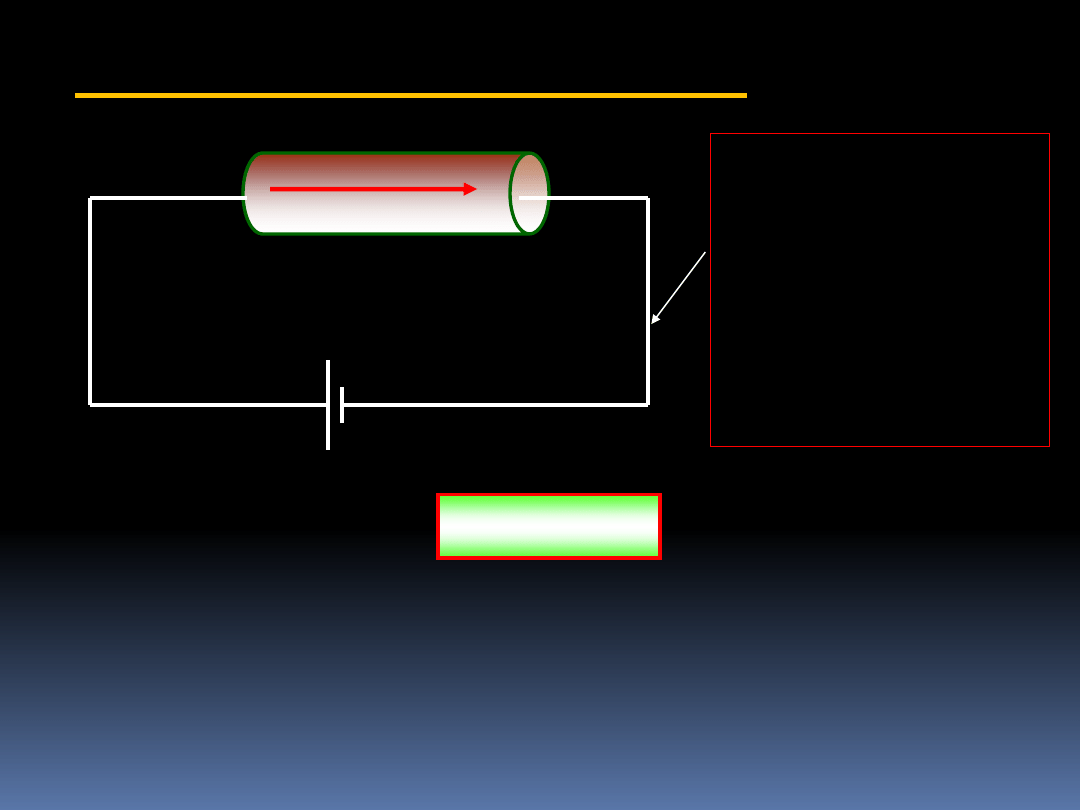
4.1.3 Praca prądu elektrycznego
I(A)
Ogniwo V
R
Wykonanie pracy
oznacza, że musi
istnieć siła
przesuwająca
ładunki w
odpowiednim
kierunku.
Praca prądu
elektrycznego:
t
I
V
W
(4.2)
Jak określimy znak pracy? Otóż jeśli ogniwo będzie naszym
układem termodynamicznym, to praca wykonana na spirali
będzie ujemna. Jeśli naszym układem termodynamicznym
będzie spirala, to praca będzie dodatnia.
5
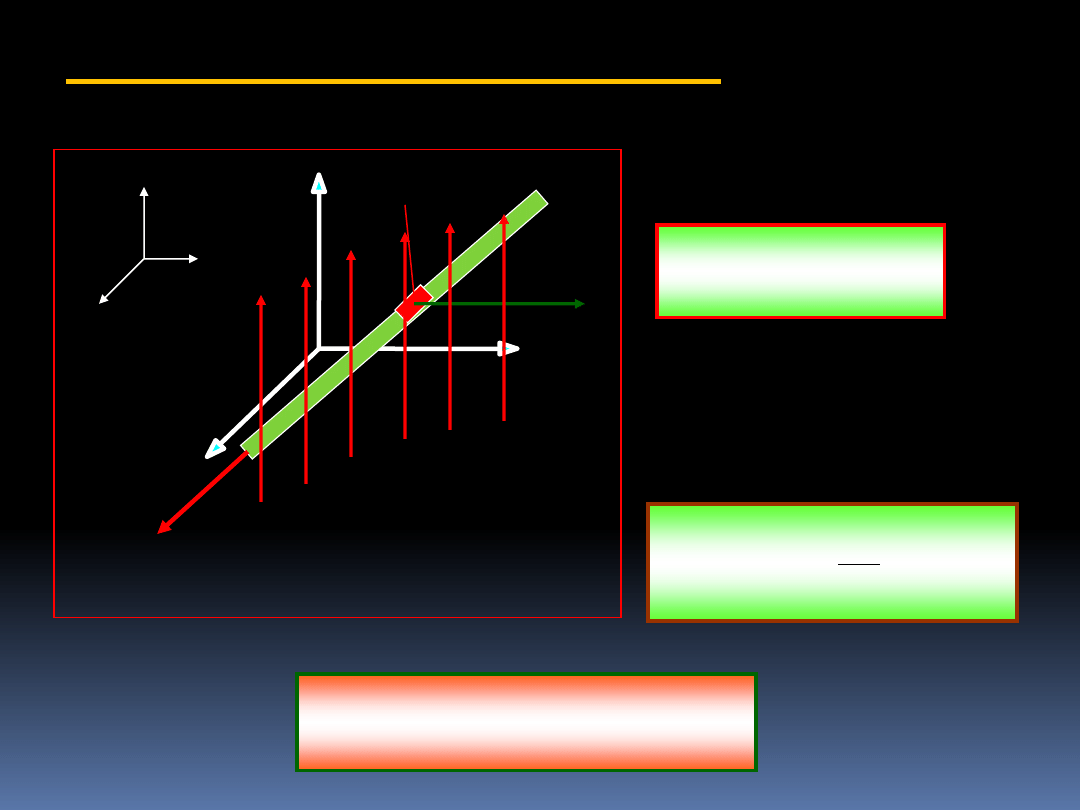
4.1.4 Praca pola magnetycznego
Wiemy, że:
B
v
q
F
(4.3)
Dla elementu długości
przewodnika ds mamy:
s
d
I
dt
s
d
dt
I
v
q
(4.4)
l
j
l
B
I
B
s
d
I
F
0
Czyli
B
X
z
y
I
v
ds
k
j
i

6
Praca wykonana na jednostkę czasu jest równa:
v
B
s
d
I
v
F
W
l
t
0
Czyli,
v
B
l
I
j
v
j
l
B
I
W
t
(4.5)
Ujemny znak pracy uzyskujemy dla przypadku, gdy
przewodnik traktujemy jako układ termodynamiczny.
Liczymy pracę wykonaną na przewodniku przez pole
magnetyczne. Ażeby poruszyć przewodnikiem musielibyśmy
zadziałać zewnętrzna siłą równą co do wielkości i odwrotnie
skierowaną. Praca wykonana przez tą siłę byłaby równa;
v
B
l
I
W
t
(4.5a)
7
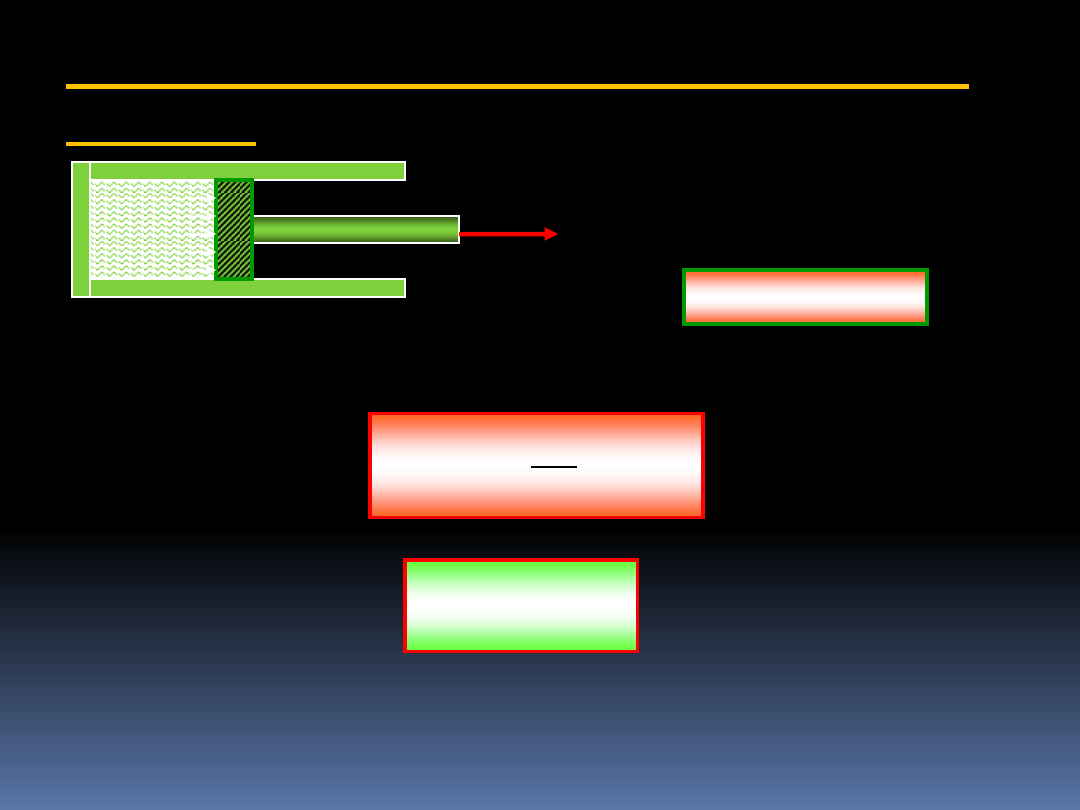
pA
4.2 Praca sprężania lub rozprężania gazu w
cylindrze
F = pA
Przesunięcie tłoka o
x
powoduje wykonanie
pracy
x
F
dW
Wiedzą że tłok ma powierzchnię A, otrzymujemy po krótkim
przekształceniu
dV
p
A
dV
A
p
dW
lub ogólniej
2
1
V
V
dV
p
W
(4.6)
Praca wykonana jest dodatnia wtedy gdy dV jest dodatnie.
Jest to praca wykonana na tłoku przez ciśnienie gazu.
8
Praca jest dodatnia, gdy tłok jest naszym układem
termodynamicznym.
Jeśli naszym układem będzie gaz, to praca dostarczona temu
układowi będzie ujemna. Wtedy;
2
1
V
V
dV
p
W
(4.6a)
Z powyższych rozważań wynika, że znak pracy zależy od
wyboru układu termodynamicznego.
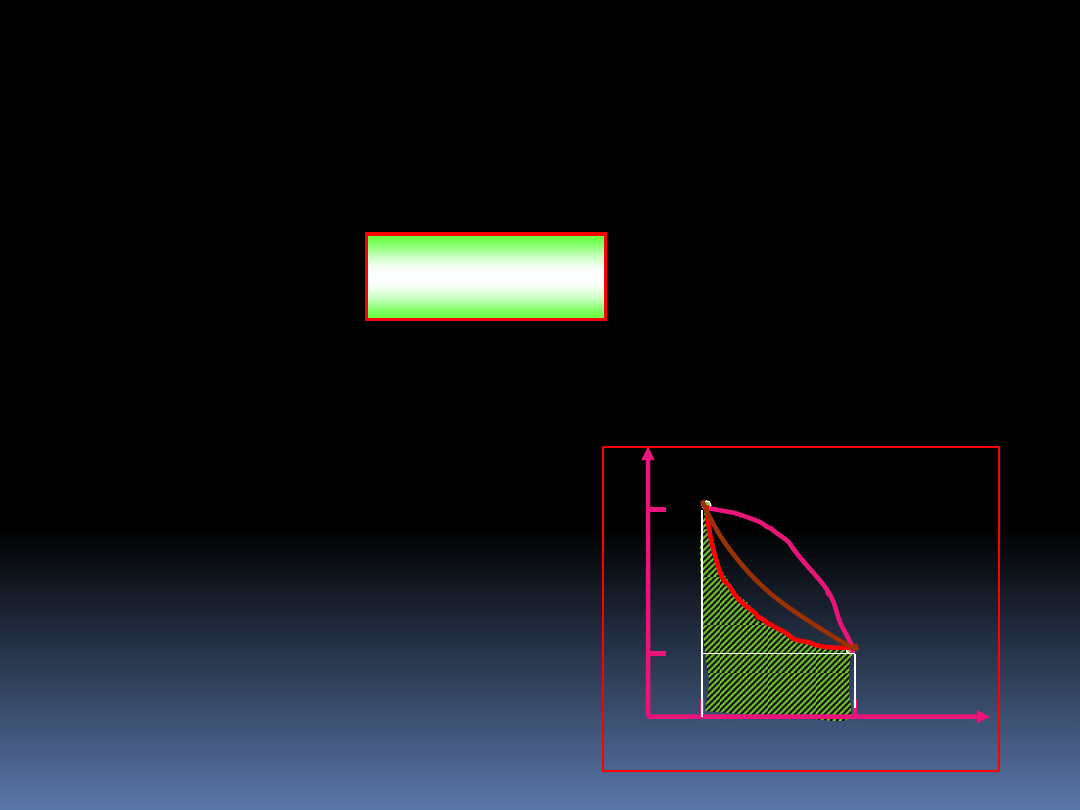
Graficzne przedstawienie
pracy wykonanej przez
rozprężający się gaz jest
pokazane obok. Drogi od
punktu 1 do punktu 2 mogą
być różne (różne przemiany
gazowe)
1
2
V
1
V
2
p
V

9
Gaz w cylindrze będziemy traktowali jako układ zamknięty.
Metody analizy układów otwartych omówimy później.
W cylindrze nie uwzględnialiśmy tarcia oraz możliwych
zjawisk nie-kwazistatycznych, czyli takich, że układ nie
przechodzi przez kolejne stany równowagi.
Należy również zaznaczyć, że wyrażenie na pracę
(4.6a) może być ważne również dla cieczy i ciał stałych.

10
4.3 Energia wewnętrzna
W poprzednim rozdziale podaliśmy przykłady określenia pracy
wykonanej przez układ lub na układzie termodynamicznym.
Stwierdziliśmy, że praca jest formą energii, która może
przekroczyć granice układu. Aby mogła zostać wykonana praca
musi istnieć oddziaływanie pomiędzy układem a jego
otoczeniem. Praca zależy od rodzaju przemiany i można ją
zauważyć, gdy układ przechodzi z jednego stanu do drugiego.
Pamiętamy, że w mechanice, elektromagnetyce itp.
poznaliśmy pojęcie energii potencjalnej.
Energia potencjalna grawitacji – jest to praca potrzebna do
podniesienia ciężaru ponad poziom odniesienia.
Energię kinetyczną możemy policzyć przez określenia pracy
potrzebnej do nadania ciału pewnej prędkości.

11
Pracę wykonana przez siłę nadającą na pewnej drodze
prędkość ciału możemy napisać następująco:
EK
v
m
dv
v
m
ds
dt
dv
m
s
d
F
W
2
2
1
(4.7)
Przyśpieszenie ciała od jednej prędkości do drugiej, powoduje
zmagazynowanie wykonanej pracy w postaci energii
kinetycznej.
)
(
2
1
2
1
2
2
1
2
2
1
v
v
m
dv
v
m
EK
EK
v
v
Identycznie jest z energią potencjalną.
W
EP
EP
EP
2
1
(4.8)
12
We wzorze (4.8) zmiana energii potencjalnej jest możliwa
tylko przez siły zachowawcze.
I zasada termodynamiki pozwala uogólnić pojęcie energii
potencjalnej.
Rozważmy układ przechodzący ze stanu I do stanu II.
Zakładamy, że układ ten jest dokładnie izolowany, tak że
nie ma wymiany ciepła w żadną stronę. Jedyne
oddziaływanie z otoczeniem może zachodzić przez pracę
taką, która nie zmienia energii potencjalnej.
I
II
E
I
E
II
Q=0
W
ad

13
Zmiana energii układu następuje przez dostarczenie pracy
adiabatycznej przez wszystkie siły działające na układ.
ad
I
II
W
E
E
E
(4.9)
Jest faktem doświadczalnym, że praca adiabatyczna
pomiędzy dwoma stanami układu jest zawsze taka sama.
Jeśli układ wykonuje pracę, to czyni to kosztem
wewnętrznych zasobów.
Przyjmujemy więc, że energia E jest własnością układu i
zależy tylko od stanu układu.
Jeśli dopuścimy takie samo przejście ze stanu I do II
znosząc izolację, to zmiana energii wewnętrznej układu jest
taka sama, gdyż stany są te same. Układ może jednak
wymienić ciepło z otoczeniem.

14
ad
W
Q
W
Inaczej
E
Q
W
(4.10)
(4.11)
Ciepło definiujemy jako dodatnie, gdy jest dodane do
układu, a ujemne, gdy jest oddawane przez układ.
Przypominam, że rozważania nasze dotyczyły układów
zamkniętych.

15
4.4 I zasada termodynamiki jako zasada
zachowania energii
Równanie (4.11) często podaje się jako analityczny zapis I
zasady termodynamiki. Należy pamiętać, że jest to zasada
zachowania energii. Ciepło, praca i energia wewnętrzna
stanowią tu różne formy energii.
Równanie to również możemy uważać jako definicję ciepła
przez pracę i energię wewnętrzną.
Dla układu izolowanego :
0
E
(4.12)
Całkowita energia wewnętrzna układu izolowanego nie
zmienia się.
Pamiętamy, że na energię wewnętrzną składa się energia
kinetyczna i potencjalna.
Jeśli do układu izolowanego dostarczymy pracy w sposób
pokazany na następnej stronie, to musi wzrosnąć całkowita
energia.

16
Praca
W
izolacja
Q=0
E=W=
U
Energia wewnętrzna wzrasta, bo
wykonaliśmy na układzie pracę.
Po dojściu cieczy do równowagi
stwierdzamy, że nastąpił wzrost
wewnętrznej energii termicznej.
Wzrost ten nastąpił na wskutek
przekazania dodatkowej energii
kinetycznej cząsteczkom cieczy.
Energię wewnętrzną „cieplną” oznaczymy przez U. Możemy
wtedy napisać;
chem
p
k
E
E
E
U
E
(4.13)
17
Jeśli rozważymy proces cykliczny w którym następuje mała
zmiana energii układu, wtedy I zasadę termodynamiki
możemy zapisać jako;
dQ
dW
dE
Ponieważ energia wewnętrzna jest funkcją stanu, jej zmiana
dla cyklu zamkniętego jest równa zero.
0
dW
dQ
(4.14)
Energia wewnętrzna jest funkcją stanu opisaną przez
0
dE

18
4.5 Ciepło i ciepło właściwe
Ciepło jest formą energii oddziaływania pomiędzy układem
termodynamicznym a otoczeniem. Ciepła nie możemy policzyć
przez zastosowanie wzoru na pracę (siła razy droga). Są więc
praca i ciepło zasadniczo różniącymi się typami energii.
Ciepło intuicyjnie łączymy z temperaturą systemu, gdyż
wzrasta ona gdy dodajemy ciepło do układu. Dawniej
myślano, że ciepło jest substancją, którą możemy
przekazywać z ciała do ciała.
Teraz wiemy, że ciepło nie jest substancją zawartą w
układzie, lecz ujawnia się tylko w czasie oddziaływania
układu z otoczeniem podczas przechodzenia układu z
jednego stanu do drugiego.
Pozostałością dawnej teorii jest pojęcie ciepłą właściwego:

19
y
y
dT
Q
d
C
'
(4.15)
Rozważmy układ termodynamiczny, dla którego zmiany energii
wewnętrznej są spowodowane jedynie zmianą wewnętrznej
energii cieplnej U. Załóżmy również, że oddziaływanie przez
pracę może zachodzić jedynie przez zmianę objętości systemu.
Dla takiego układu równanie (4.11) możemy zapisać
jako:
dU
pdV
Q
d
dU
W
d
Q
d
'
'
'
Pamiętając o konwencji znaku pracy, ciepło dodane do
układu piszemy jako;
pdV
dU
Q
d
'

20
Dla procesu ze stałą objętością dV=0. W oparciu o wzór
(4.15) mamy wtedy:
dT
c
du
dT
c
dQ
V
V
V
V
Małe litery odnoszą się do odpowiednich
wielkości na jednostkę masy.
Dla procesu przebiegającego przy stałej objętości, ciepło
właściwe wynosi:
V
V
T
u
c
(4.16)
Jeśli rozważymy proces przy stałym ciśnieniu, to transfer
ciepła na jednostkę masy wynosi:
p
p
p
pdv
u
Q
d
'
(4.17)

21
Wprowadźmy nową własność układu zwaną entalpią.
pv
u
h
(4.18)
Przy stałym ciśnieniu różniczka entalpii na jednostkę masy
ma postać:
p
p
p
dv
p
du
dh
(4.19)
Z równań (4.11), (4.17) i (4.19) wynika, że;
p
p
p
p
dT
c
dh
dQ
oraz
p
p
T
h
c
(4.20)
Ciepło właściwe wyrażamy w jednostkach kJ/kg ·
0
C .

22
4.6 Ciepło właściwe gazu idealnego
Możemy pokazać, że jeśli gaz spełnia równanie stanu
(2.8), ( ) to energia wewnętrzna u i entalpia h
są funkcjami temperatury.
Możemy wtedy napisać:
dT
c
u
u
u
T
T
v
2
1
1
2
dT
c
h
h
h
T
T
p
2
1
1
2
(4.21)
(
4.22)
Dla stałych wartości ciepła właściwego mamy:
)
(
1
2
1
2
T
T
c
u
u
v
)
(
1
2
1
2
T
T
c
h
h
p
(4.23)
(4.24)
Wiemy, że dh=c
p
dT i du=c
v
dT. Stąd
dT
c
c
du
dh
v
p
)
(
Wiemy również, że
dT
R
du
pv
d
du
dh
)
(

23
Czyli
dT
c
c
dT
R
v
p
)
(
oraz,
v
p
c
c
R
(4.25)
Rownanie (4.25) nazywa sie rownaniem Mayera
i jest sluszne dla jednego mola gazu
Wyszukiwarka
Podobne podstrony:
AGH Wyklad 6 id 52884 Nieznany
AGH Wyklad 8 id 52885 Nieznany (2)
AGH Wyklad 9 id 52886 Nieznany (2)
AGH Wyklad 3 id 52882 Nieznany (2)
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
ZP wyklad1 id 592604 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
or wyklad 1 id 339025 Nieznany
II Wyklad id 210139 Nieznany
cwiczenia wyklad 1 id 124781 Nieznany
BP SSEP wyklad6 id 92513 Nieznany (2)
MiBM semestr 3 wyklad 2 id 2985 Nieznany
algebra 2006 wyklad id 57189 Nieznany (2)
olczyk wyklad 9 id 335029 Nieznany
Kinezyterapia Wyklad 2 id 23528 Nieznany
więcej podobnych podstron