
Prof. dr hab. Roman Kaliszan, czł. koresp. PAN
Gdańsk, 2004
PODSTAWY BIOFARMACJI
I FARMAKOKINETYKI
LEK
Środek leczniczy
(substancja aktywna
farmakologicznie)
Środek
farmaceutyczny
(lekarstwo)
Biofarmacja
Technologia
postaci leku
Cechy
organizmu
Farmakodynamika
Farmakokinetyka
EFEKT TERAPEUTYCZNY
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

Kryteria jakości lekarstw
•
Skład jakościowy
•
Zawartość związków czynnych
•
Czystość
•
Dostępność biologiczna
J. Wagner
lata 1960-te: Nelson
M. Gibaldi
•
Cechy osobnicze
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

FARMAKOKINETYKA
Cechy osobnicze
pacjenta, środowisko
Farmakokinetyka
Indywidualizacja
i optymalizacja
terapii
(farmacja kliniczna)
Opis liczbowy zmian ilości (stężeń) środka leczniczego we krwi, tkankach,
organach, a także ilości metabolizowanej i wydalanej w czasie.
Cechy osobnicze:
wiek, płeć, masa
ciała, clearance,
genotyp,
immunologia,
interakcje, choroby
Środowisko:
pokarmy,
ksenobiotyki –
induktory i inhibitory
enzymatyczne
Specyficzne nośniki
leków i proleki
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
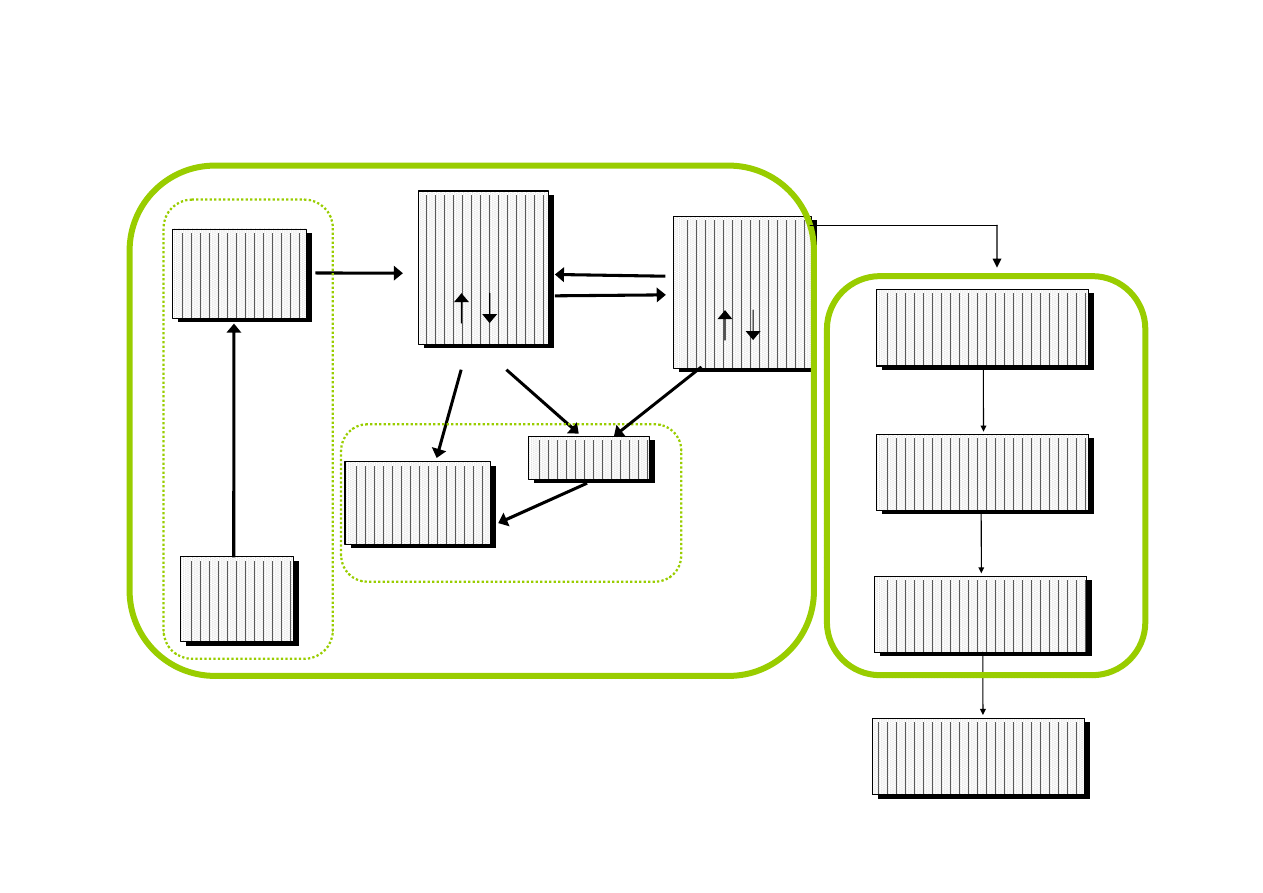
Kompleks
lek - receptor
Kompleks
lek - receptor
Bodziec
farmakol.
Bodziec
farmakol
.
Efekt
farmakol.
Efekt
farmakol.
Efekt
kliniczny
Efekt
kliniczny
Wyzwolenie
bodźca
Wzmocnienie
bodźca
Śr. leczniczy
gotowy do
absorpcji
Śr. leczniczy
gotowy do
absorpcji
Śr.
leczniczy
we krwi
Wolny
Związany
Śr.
leczniczy
we krwi
Wolny
Związany
Śr. leczniczy
w tkankach
Wolny
Związany
Śr. leczniczy
w tkankach
Wolny
Związany
Absorpcja
Dystrybucja
Śr. farm.
w miejscu
podania
Śr. farm.
w miejscu
podania
U
w
a
ln
ia
n
ie
Śr. leczniczy
i metabolity
wydalane
Śr. leczniczy
i metabolity
wydalane
Metabolity
Metabolity
W
y
d
a
la
n
ie
Metabolizm
Eliminacja
Faza farmakokinetyczna
LADME
S
u
b
fa
za
fa
rm
ac
eu
ty
cz
n
a
Reakcja z receptorem
F
aza
f
ar
m
ak
o
d
yn
am
ic
zn
a
Procesy, którym podlega lek w ustroju
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
T
ec
h
n
ol
ogi
a
far
m
ac
eu
ty
cz
n
a
F
a
rm
ac
ja
k
li
n
ic
zn
a
Nauka o czynnikach wpływających na dostępność biologiczną
(środka leczniczego z danego środka farmaceutycznego).
Badany wpływ:
−−−−
formy chemicznej (wolny związek, sól, ester, kompleks)
−−−−
stanu krystalicznego
−−−−
rodzaju postaci leku
−−−−
substancji pomocniczych
−
właściwości fizycznych postaci
(np. twardość, temperatura topnienia czopków)
−−−−
parametrów technologicznych
−−−−
drogi podania
−−−−
czynników fizjologicznych i patofizjologicznych
−−−−
równoczesnego podania innych leków
−−−−
diety, czynników środowiskowych
Cel: z danego środka leczniczego zrobić jak najlepszy środek farmaceutyczny
BIOFARMACJA
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

diss
a
k
k
<<
(
)
(
)
S
t
S
t
dC
K S
C
C
dt
dC
D
S C
C
dt
V h
= ⋅ ⋅
−
=
⋅
−
⋅
rozpuszczalność
≤≤≤≤
1% lub 0.1 mg/ml/cm
2
)
D
−−−−
współczynnik dyfuzji; V
−−−−
obj. roztworu; h
−−−−
grubość warstwy dyfuzyjnej;
S
−−−−
powierzchnia kontaktu z rozpuszczalnikiem;
C
S
−−−−
stężenie roztworu nasyconego; C
t
−−−−
stężenie aktualne
C
SO
– rozpuszczalność formy niezdysocjowanej
Sole Na i K
POLIMORFIZM
Równanie Boguskiego (1876)
(Noyesa-Whitney’a 1897)
0
0
(1 10
) kwasy
(1 10
) zasady
a
a
pH
pK
s
s
pH
pK
s
s
C
C
C
C
−
−
=
= +
=
= +
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

Światowa Organizacja Zdrowia
Produktem
generycznym
jest
produkt
farmaceutyczny, który może być stosowany
wymiennie
z
produktem
referencyjnym
używanym w badaniach biorównoważności
(często lek oryginalny), zwykle produkowany bez
licencji udzielonej przez wytwórcę leku
oryginalnego i wprowadzany do obrotu po
wygaśnięciu
patentu
lub
innych
praw
wyłącznych.
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

Parlament Europejski:
... należy wprowadzić regulacje umożliwiające
firmom farmaceutycznym rozpoczęcie, przed
wygaśnięciem
prawa
patentowego
lub
świadectwa ochrony dodatkowej (SPC), takich
doświadczeń laboratoryjnych i przygotowań
dokumentacyjnych, jakie są niezbędne dla
zarejestrowania
generycznego
środka
farmaceutycznego
opracowanego
we
Wspólnocie
Europejskiej,
który
winien
bezzwłocznie znaleźć się na rynku ...
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

Rok 2002 – Dz. U. Nr 152, 1265
USTAWA z dnia 30 sierpnia 2002 r.
o zmianie ustawy – Prawo farmaceutyczne
„Odpowiednikiem
oryginalnego
gotowego
produktu
leczniczego jest produkt leczniczy posiadający taki sam
skład jakościowy i ilościowy substancji czynnych, postać
farmaceutyczną i równoważność biologiczną wobec
oryginalnego produktu leczniczego potwierdzoną, jeżeli to
niezbędne,
właściwie
przeprowadzonymi
badaniami
dostępności
biologicznej;
pojęcie
odpowiednika
oryginalnego gotowego produktu leczniczego dotyczy
również
różnych
postaci
farmaceutycznych
o
niezmodyfikowanym
uwalnianiu,
przeznaczonych
do
podawania doustnego, zawierających tę samą substancję
czynną, w szczególności tabletek i kapsułek.”.
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

Duże znaczenie dla możliwości wprowadzania na rynek leków
generycznych po naszym wejściu do Wspólnoty będzie miało
przyjęcie zasady wyłączności danych, tzn. niemożność
powoływania się na wyniki badań klinicznych i toksykologicznych
zgłoszonych przez firmę rejestrującą lek na terenie UE po raz
pierwszy. Zasada ta zgodnie z dyrektywą 65/65 obowiązuje przez 6
i 10 lat. Obligatoryjnie 10 lat wyłączności dotyczy produktów
wysokiej technologii i biotechnologii, pozostałe leki zależnie od
decyzji kraju członkowskiego mają także 10 lat lub 6.
W Niemczech, Belgii, Francji, Włoszech, Holandii i Wielkiej Brytanii
wprowadzono 10-letni okres obowiązywania wyłączności danych
dla wszystkich leków. W Polsce, gdzie jeszcze przez kilka lat
możemy rejestrować leki chronione patentem procesowym,
przyjęcie zasady wyłączności klinicznych danych, zgłoszonych
w trakcie rejestracji przez firmę wprowadzającą lek oryginalny,
opóźni termin wprowadzania produktu na rynek. Ponadto, nawet
wówczas gdy produkt oryginalny uzyskał pierwszą rejestrację w
kraju członkowskim Wspólnoty 10 lat wcześniej, producent leku
generycznego może uzyskać zezwolenie na zapisanie tylko tych
wskazań terapeutycznych, jakie były uwzględnione w pierwotnym
zezwoleniu, nie może uzyskać zezwolenia na stosowanie swego
leku we wskazaniach, które były rejestrowane w okresie
późniejszym, bo te są także chronione.
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

WYMOGI ZAMIENNOŚCI FORMULACJI
PARENTERALNYCH DOBRZE
ROZPUSZCZALNYCH
W WODZIE ŚRODKÓW LECZNICZYCH
§
Wytwarzanie według zasad dobrej praktyki
wytwarzania (Good Manufacturing Practice –
GMP)
§
Zgodność ze specyfikacją farmakopealną
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

BRAK JEDNOZNACZNYCH
KRYTERIÓW ZAMIENNOŚCI:
• Szczepionki
• Surowice
• Preparaty krwiopochodne
• Produkty biotechnologii
• Leki roślinne
• Leki złożone
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

• LEK ORYGINALNY
Jest to środek farmaceutyczny nowatorskiego producenta po raz
pierwszy na świecie dopuszczony do dystrybucji (zwykle jako lek
opatentowany) w oparciu o udokumentowaną skuteczność terapeutyczną,
bezpieczeństwo stosowania i jakość
−−−−
zgodnie ze współczesnymi
wymogami naukowymi.
• LEK ODNIESIENIA (wzorcowy, standardowy, referencyjny)
Jest to środek farmaceutyczny, względem którego nowy środek
farmaceutyczny ma w zamierzeniu by
ć zamienny w praktyce klinicznej.
Zwykle lekiem odniesienia jest nowatorski lek oryginalny o uznanej
skuteczności, bezpieczeństwie stosowania i jakości. Jeśli nie da się
zidentyfikować nowatorskiego leku oryginalnego, to za lek odniesienia
można uznać pierwszy zarejestrowany lek synonimowy.
• LEK ODTWÓRCZY (generic)
Jest to środek farmaceutyczny opracowany zwykle z zamiarem
zapewnienia zamienności z nowatorskim lekiem oryginalnym, wytwarzany
na ogół bez licencji oryginalnego wytwórcy oraz wprowadzony do
dystrybucji po wygaśnięciu patentu lub innych praw wyłączności.
• LEK ZAMIENNY
Jest to środek farmaceutyczny, który jest równoważny terapeutycznie
z lekiem odniesienia.
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

BENURON
5 szt. 125 mg [....... zł]; 10 szt. 125 mg [3,21 zł]; 5 szt. 250 mg [....... zł]; 10 szt. 250 mg [3,21 zł]; 5 szt. 500 mg [....... zł]; 10 szt. 500 mg [3,87 zł];
10 szt. 1 g [6,34 zł]
Producent: Bene Arzneimittel GmbH
Subst. pomocn.:
CALPOL 80, CALPOL 125
10 szt. 80 mg [5,98 zł]; 10 szt. 125 mg [5,98 zł]
Producent: Glaxo Wellcome S.A.
Subst. pomocn.:
CODIPAR 250, CODIPAR 500
10 szt. 250 mg [5,59 zł]; 10 szt. 500 mg [6,32 zł]
Producent: Glaxo Wellcome S.A.
Subst. pomocn.:
EFFERALGAN
10 szt. 80 mg [5,66 zł]; 10 szt. 150 mg [5,74 zł]; 10 szt. 300 mg [5,63 zł]; 10 szt. 600 mg [6,86 zł]
Producent: UPSA Laboratoires
Subst. pomocn.: półsyntetyczne glicerydy*
PARACETAMOL
10 szt. 125 g [4,21 zł]; 10 szt. 250 mg [4,69 zł]; 10 szt. 500 mg [5,35 zł]
Producent Farmjug
Subst. pomocn.: Czopki 125 mg: lecytyna sojowa, Witepsol H 15
Czopki 250 mg i 500 mg: lecytyna sojowa, tłuszcz utwardzony
PARACETAMOL
10 szt. 80 mg [....... zł]; 10 szt. 125 mg [....... zł]; 10 szt. 250 mg [....... zł]; 10 szt. 500 mg [....... zł]
Producent Hasco-Lek
Subst. pomocn.:
PARACETAMOL
10 szt. 50 mg [5,19 zł]; 10 szt. 125 mg [5,19 zł]; 10 szt. 250 mg [5,19 zł]; 10 szt. 500 mg [5,19 zł]
Producent Farmina
Subst. pomocn.: masa czopkowa
Substancja lecznicza: PARACETAMOLUM
Postać leku: Czopki
Odpłatność
−
100%
PRZY PODEJMOWANIU DECYZJI O ZAMIENNOŚCI NALEŻY UWZGLĘDNIĆ FAKT, ŻE PREPARATY
RÓŻNIĄ SIĘ SKŁADEM PODŁOŻA, CO MOŻE WPŁYWAĆ NA PROFIL DOSTĘPNOŚCI BIOLOGICZNEJ.
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
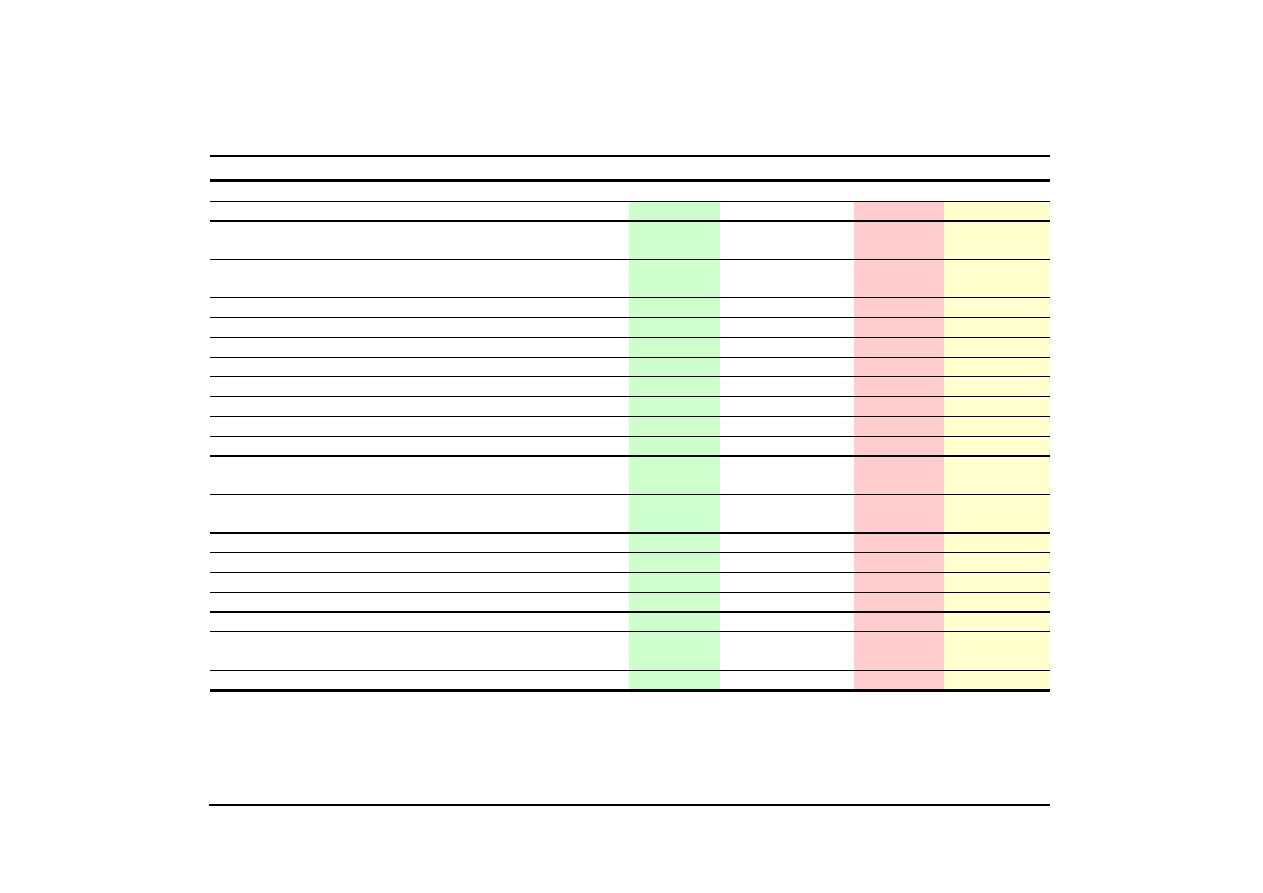
Spożycie leków w Polsce (1998 r.)
Dr T. J. Szuba
Lp.
Lek generyczny
Wartość
Lek markowy
Wartość
5:3
1
2
3
4
5
6
1
Ranigast (ranitidina) tabl. 150 mg x 20
61.133
Zantac, GB
1.124.694
18,4
2
Enarenal (enarapril) tabl. 5 mg x 20
Enarenal (enarapril) tabl. 10 mg x 20
25.369
39.375
Vasotec, US
Vasotec, US
1.042.288
1.068.613
41,1
27,1
3
Flegamina (bromhexina) syr. 80 mg/100 ml – 120 ml
Flegamina (bromhexina) tabl. 8 mg x 20
16.898
3.923
Bisolvon, D
Bisolvon, D
152.652
67.087
9,0
17,1
4
Furosemidum tabl. 40 mg x 20
7.590
Lassix, D
88.175
11,6
5
Estazolam tabl. 2 mg x 20
9.171
Prosom, US
534.549
58,3
6
Cinnarizinum tabl. 25 mg x 50
19.189
Stugeron, CH
292.659
15,3
7
Doxycyclinum cps 100 mg x 10
33.984
Vibramycin, US
950.760
28,0
8
Relanium (diazepam) tabl. 5 mg x 20
5.038
Valium, CH
73.921
14,7
9
Metocard (metoprolol) tabl. 50 mg x 30
16.566
Betaloc, S
165.972
10,0
10
Clotrimazol krem 1% - 20 g
8.842
Canesten, D
104.578
11,8
11
Polfilin (pentoxifillina) prol. tabl. 400 mg x 20
35.315
Trental, D
120.738
3,4
12
Captopril tabl. 25 mg x 20
Captopril tabl. 12,5 mg x 20
17.283
6.757
Capoten, US
Capoten, US
255.878
190.825
14,8
28,2
13
Majamil (diclofenac) tabl. 50 mg x 20
Majamil (diclofenac) tabl. 100 mg x 20
5.159
7.134
Voltaren, CH
Voltaren, CH
196.885
259.734
38,2
36,4
14
Metronidazol inj. 0,5% - 20 ml
7.020
Flagyl, F
77.561
11,0
15
Kordafen (nifedypina) tabl. 10 mg x 50
5.044
Adalat, D
139.225
27,6
16
Metoclopramid tabl. 10 mg x 50
3.131
Primperan, F
79.382
25,4
17
Staveran (verapamil) tabl. 40 mg x 20
4.220
Isoptin, D
22.832
5,4
18
Hydrocortison krem 1% - 15 g
5.250
Sanatison, D
40.515
7,7
19
Vitaminum A+E cps. 30 000 j.+70 mg x 30
Vitaminum E cps. 100 mg x 30
41.045
38.234
Rovigon, CH
Ephynal, CH
213.753
421.723
5,2
11,0
436.646
8.004.170
18,3
Wartość jest wyrażona w złotych polskich (PLN)
Stosowane w pracy kursy walut potrzebne do opracowania kolumny 6:
S:
D:
F:
SEK – 0,4826
DEM – 2,12
ARF – 0,6335
CH:
GB:
US:
GBP – 6,71
CHF – 2,57
USD – 4,075
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

PROJEKT WYTYCZNYCH WHO ODNOŚNIE WYMOGÓW
REJESTRACJI ZAPEWNIAJĄCYCH ZAMIENNOŚĆ
ODTWÓRCZYCH ŚRODKÓW FARMACEUTYCZNYCH
(WHO, Genewa 1994)
DEFINICJE BRANYCH POD UWAGĘ POJĘĆ:
Postać (forma) leku
Postacią (formą) leku jest wytwór producenta (środek
farmaceutyczny) przeznaczony do podawania pacjentowi, np.
tabletka, kapsułka, czopek, maść, itd.
Równoważność farmaceutyczna
Równoważnymi
farmaceutycznie
środkami
farmaceutycznymi są takie, które zawierają w tej samej postaci
leku ten sam środek leczniczy w odpowiedniej dawce molowej,
spełniający zdefiniowane normy i które są przeznaczone do
podawania tą samą drogą. Równoważność farmaceutyczna nie
gwarantuje równoważności terapeutycznej, gdyż różnice w
zakresie substancji uzupełniających i procesu produkcyjnego
mogą (niekiedy) spowodować różnice w działaniu leczniczym
podanego leku.
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

Równoważność biologiczna
Dwa
środki
farmaceutyczne
są
równoważne
biologicznie, jeśli są równoważne farmaceutycznie a ich
dostępności biologiczne po podaniu w tej samej dawce
molowej są na tyle podobne (nie różnią się statystycznie
znamiennie), że można oczekiwać od obu środków
farmaceutycznych
wywołania zasadniczo takich samych
efektów terapeutycznych (klinicznych).
Równoważność terapeutyczna
Dwa
środki
farmaceutyczne
są
równoważne
terapeutycznie, jeśli są równoważne farmaceutycznie, i jeśli
po ich podaniu w tej samej dawce molowej ich efekty,
zarówno w zakresie skuteczności jak i bezpieczeństwa, są
takie jakich można było oczekiwać na podstawie
odpowiednich badań (tzn. badań równoważności biologicznej,
działania farmakodynamicznego, efektów klinicznych lub in
vitro, analizy chemicznej i farmaceutycznej).
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

WYMÓG ZAMIENNOŚCI OBOWIĄZUJĄCY DLA
WIĘKSZOŚCI STAŁYCH, DOUSTNYCH
POSTACI ŚRODKA FARMACEUTYCZNEGO
Równoważność terapeutyczna
wykazana
1) Analiza chemiczna i farmaceutyczna środka
leczniczego, substancji pomocniczych oraz postaci
leku
2) Porównawcze pomiary dostępności biologicznej
3) Porównawcza ocena działania farmakologicznego
4) Porównawcze badania kliniczne skuteczności
leczniczej i występowania działań niepożądanych
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004

DOSTĘPNOŚĆ BIOLOGICZNA
• AUC – miara zaabsorbowanego ułamka dawki
podanej
• C
max
– największe obserwowane stężenie środka
leczniczego
• C
max
– czas wystąpienia Cmax
Ułamek podanej dawki dostający się do krwi i
szybkość, z jaką zachodzi proces wchłaniania.
Dostępność biologiczną określają trzy parametry
wyznaczane z krzywych zależności stężenia środka
leczniczego we krwi od czasu. Te trzy parametry to:
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
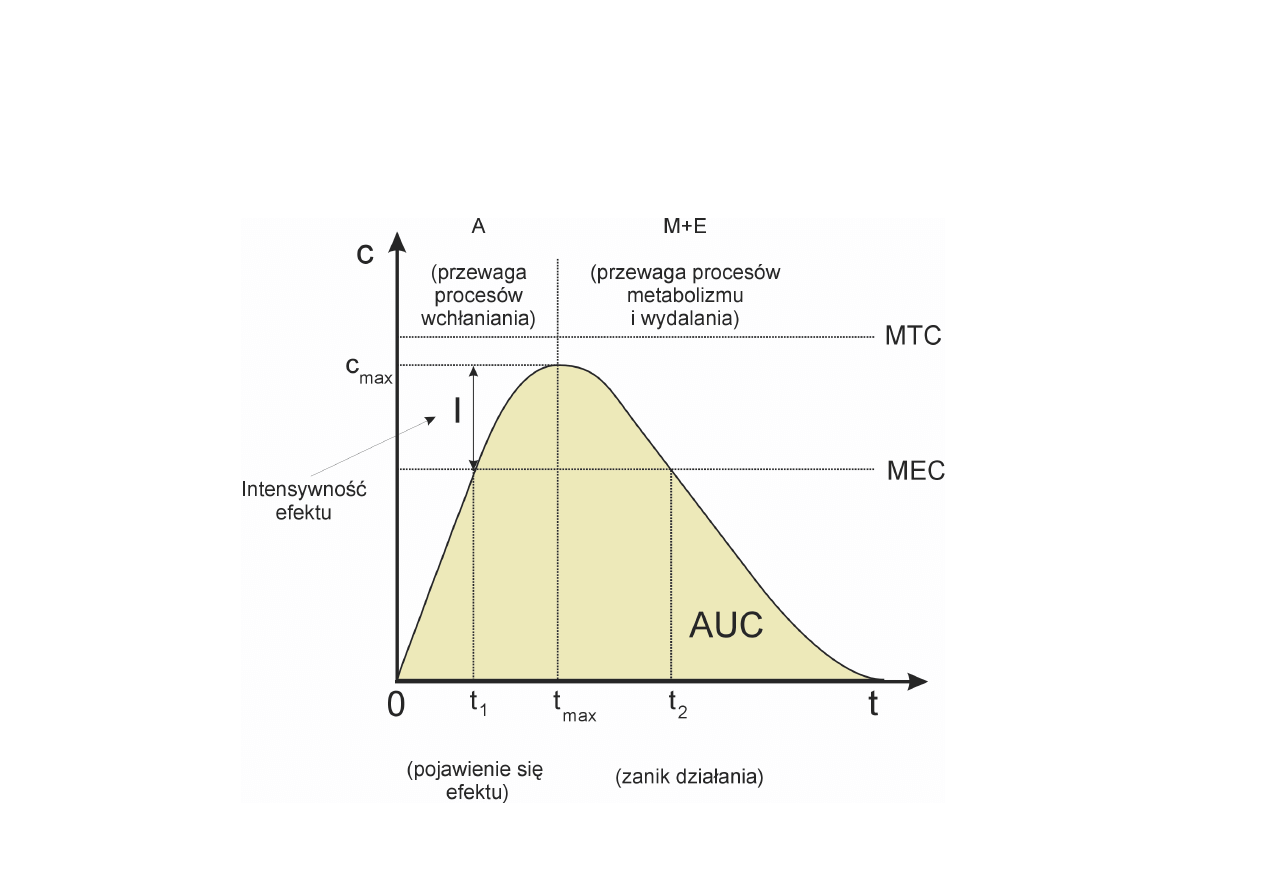
PARAMETRY OKREŚLAJĄCE
DOSTĘPNOŚĆ BIOLOGICZNĄ
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
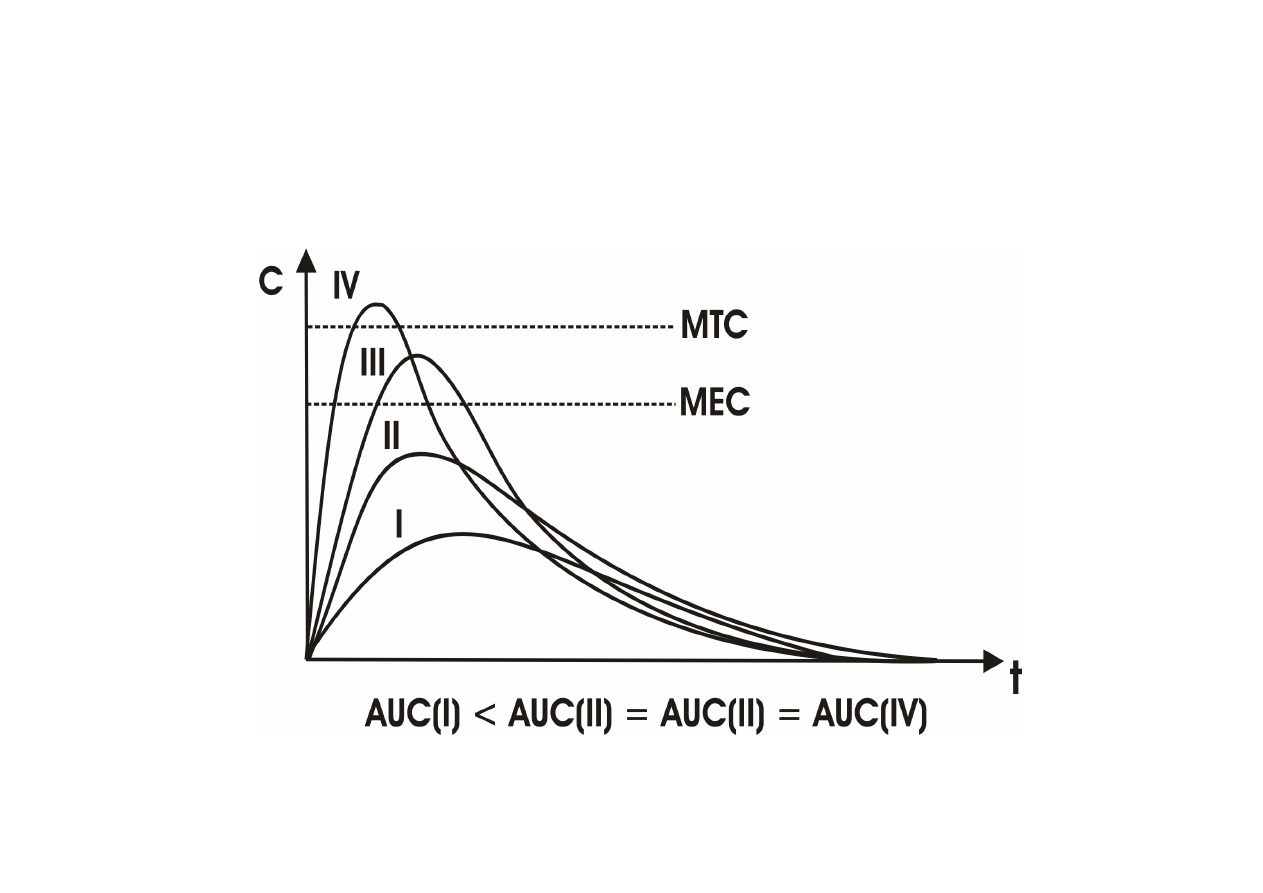
WPŁYW DOSTĘPNOŚCI BIOLOGICZNEJ NA
DZIAŁANIE LEKU
R. Kaliszan "Podstawy Biofarmacji i Farmakodynamiki„ - AMG 2004
Wyszukiwarka
Podobne podstrony:
3 Podstawy fizyki polprzewodnik Nieznany (2)
Ekologiczne podstawy systemu ws Nieznany
Podstawowe informacje o planowa Nieznany (4)
Podstawy programowania komputer Nieznany
FANUC podstawy programowania id Nieznany
PODSTAWY(1) id 368892 Nieznany
Badanie podstawowych ukladow cy Nieznany (2)
1 Podstawowe pojeciaid 9565 Nieznany (2)
Laboratorium Podstaw Fizyki id Nieznany
intuicja podstawowa id 219277 Nieznany
podstawy obliczen chemicznych i Nieznany
Podstawy techniki mikroprocesor Nieznany
Podstawy analizy fundamentalnej Nieznany
Podstawy systemow operacyjnych Nieznany
podstawowe informacje alzheimer Nieznany
podstawy diagnostyki i leczenia Nieznany
więcej podobnych podstron