
!!!Zagadnienia Na Chemie!!!
1. Atom
*Atom – podstawowy składnik materii. Składa się z małego dodatnio naładowanego jądra o dużej gęstości i otaczającej go
chmury elektronowej o ujemnym ładunku elektrycznym. Atomy mają rozmiary rzędu 10−10 m i masę rzędu 10−26 kg. Ponad
99,9% masy atomu jest zawarte w jego jądrze. Jądro atomowe zbudowane jest z nukleonów: protonów o dodatnim ładunku
elektrycznym i elektrycznie obojętnych neutronów. Chmurę elektronową tworzą elektrony związane z jądrem przez
oddziaływanie elektromagnetyczne. Atom jest elektrycznie obojętny, gdy liczba elektronów jest równa liczbie protonów. W
przeciwnym przypadku ma ładunek i nazywany jest jonem.
*Liczba masowa (A) – wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w jądrze atomu danego izotopu
danego pierwiastka. Liczbę masową izotopów pisze się tradycyjnie w górnym, lewym indeksie symbolu pierwiastka.
*Liczba atomowa ( Z ) - (liczba porządkowa) określa, ile protonów znajduje się w jądrze danego atomu. Jest także równa liczbie
elektronów niezjonizowanego atomu. Pojawia się ona w symbolicznym zapisie w lewym dolnym rogu.
*Masa atomowa (niepopr. ciężar atomowy) – liczba określająca ile razy masa jednego reprezentatywnego atomu danego
pierwiastka chemicznego jest większa od masy 1/12 izotopu 12C. Masa atomowa jest wyrażana w atomowych jednostkach
masy [u].
*Jon – atom lub grupa atomów połączonych wiązaniami chemicznymi, która ma niedomiar lub nadmiar elektronów w stosunku
do protonów. Jony zaś elektrycznie naładowane dodatnio lub ujemnie.
*Kation - jon o ładunku dodatnim. Podczas elektrolizy roztworu podąża do elektrody ujemnej zwanej katodą.
*Anion – jon o ładunku ujemnym. Anion to każde indywiduum chemiczne, które posiada nadmiar elektronów w stosunku do
protonów. Podczas elektrolizy anion podąża on do elektrody dodatniej, zwanej anodą.
2. Powłoki i Orbitale
Powłoka elektronowa (poziom energetyczny) – zbiór stanów kwantowych o tej samej wartości głównej liczby kwantowej.
W chemii za powłokę elektronową wokół danego atomu uważa się zbiór orbitali atomowych mających tę samą główną liczbę
kwantową n. Kolejnym wartościom n przypisane są kolejne powłoki: K, L, M, N, O, P i Q. Powłoki składają się z różnej liczby
podpowłok elektronowych, odpowiadających określonym rodzajom orbitali atomowych:
Symbol Powłoki
Główna Liczba
Kwantowa (n)
Maksymalna liczba
elektronów
Podpowłoki
Podpowłoka
Maksymalna liczba
elektronów
K
1
2
s
s
2
L
2
8
s, p
p
6
M
3
18
s, p, d
d
10
N
4
32
s, p, d, f
f
14
O
5
50
s, p, d, f, g
g
18
P
6
72
s, p, d, f, g, h
h
22
i
26
Atomy gazów szlachetnych mają całkowicie zapełnione powłoki elektronowe i ich symbole wykorzystywane są do skróconego
zapisu konfiguracji elektronowej, np. dla atomu baru:
* zapis pełny: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 5s2 5p6 6s2
* zapis skrócony: [Xe]6s2
gdzie [Xe] = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 5s2 5p6
Całkowicie zapełnione powłoki elektronowe są szczególnie korzystne energetycznie. Jest to przyczyną małej reaktywności
gazów szlachetnych, a dążenie do uzyskania konfiguracji elektronowej najbliższego gazu szlachetnego jest siłą napędową
tworzenia wielu wiązań chemicznych.
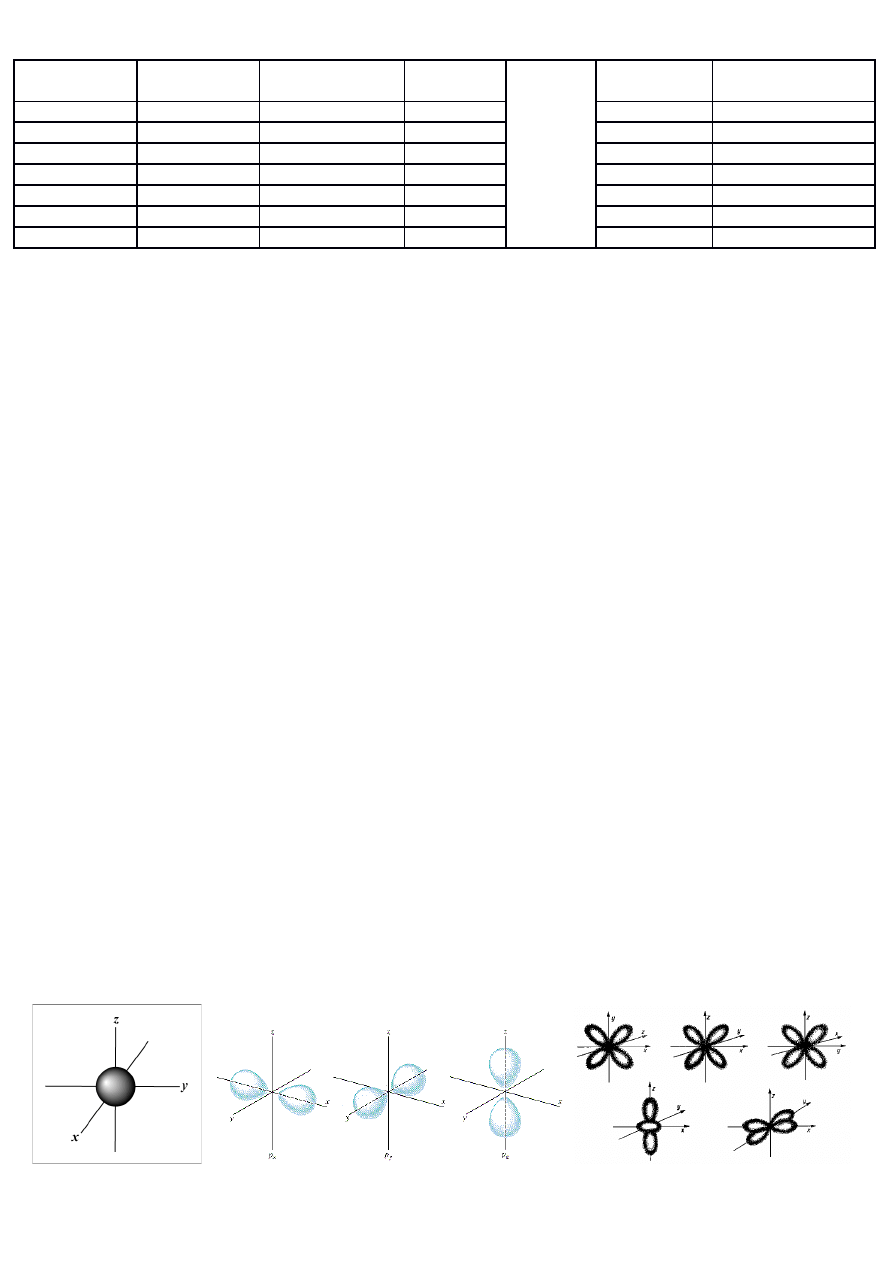
*Orbitale- Obrazem graficznym orbitalu jest fragment przestrzeni, w której prawdopodobieństwo znalezienia elektronu jest
największe.
1) Orbital typu s. Ma kształt sferyczny
2) Orbital typu p. Przypomina sferyczne ósemki. Jest Potrójnie zdegenerowany.
3) Orbital typu d. ,,Sferyczny krzyż”. 5-cio krotnie zdegenerowany

*Reguła Hunda- reguła mówiąca, że w atomie, w celu uzyskania najbardziej korzystnego energetycznie zapełnienia
orbitali atomowych, powinno być jak najwięcej elektronów niesparowanych. Elektrony ulegają sparowaniu po pojedynczym
zapełnieniu wszystkich form przestrzennych danych orbitali danej powłoki elektronowej.
1s
→
2s →
2p → 3s →
3p → 4s →
3d → 4p → 5s →
4d → 5p → 6s →
4f → 5d → 6p → 7s →
5 f → 6 d → 7 p
*Zakaz Pauliego - mówi, że w jednym atomie dwa elektrony muszą różnić się wartością przynajmniej jednej liczby
kwantowej (np. w jednym poziomie orbitalnym muszą mieć przeciwną orientację spinu).
3. Układ Okresowy
*Układ okresowy pierwiastków - zestawienie wszystkich pierwiastków chemicznych w postaci rozbudowanej tabeli,
uporządkowanych według ich rosnącej liczby atomowej, grupujące pierwiastki według ich cyklicznie powtarzających się
podobieństw właściwości, zgodnie z prawem okresowości Dmitrija Mendelejewa. Użyteczność układu okresowego wynika z
faktu, że w prostej formie przedstawia on zależność własności chemicznych pierwiastków i pośrednio także ich prostych
związków chemicznych od liczby występujących w nich protonów i elektronów. Definiuje też podział pierwiastków na grupy,
okresy i bloki
*Grupa (czasem zwana rodziną pierwiastków) jest pionową kolumną w układzie okresowym pierwiastków chemicznych.
Istnieje 18 grup w standardowym układzie okresowym. Określenie "rodzina" wywodzi się od podobnych właściwości, jakie
posiadają pierwiastki wchodzące w skład jednej grupy. Współcześnie podobieństwo chemiczne w obrębie grupy tłumaczy się
jednakową lub podobną konfiguracją elektronową powłoki walencyjnej atomów pierwiastków danej grupy. To właśnie układ
najbardziej zewnętrznych elektronów nadaje pierwiastkowi większość cech chemicznych.
Wyróżnia się dwa rodzaje grup:
* Grupy główne: grupy 1 i 2 oraz 13 do 18
* Grupy poboczne: grupy 3 do 12
*Okres. Prawo okresowości. Dzisiaj prawo okresowości brzmi:
Pierwiastki chemiczne ułożone zgodnie ze wzrastająca liczbą atomową wykazują okresowe powtarzanie się właściwości.
Prawo okresowości jest podstawą konstrukcji układu okresowego. W czasach Mendelejewa nie było logicznego uzasadnienia
tego prawa. Dopiero po odkryciu struktury atomu nabrało ono fizycznego znaczenia. Współcześnie wiadomo, że numer okresu
odpowiada numerowi powłoki walencyjnej atomu.
*Wyświetlenie pierwiastków ze względu na przynależnośc do bloku energetycznego
Kolorystyka układu w tym trybie przedstawia pierwiastki z bloku energetycznego s na niebiesko, pierwiastki z bloku
energetycznego p na różowo, pierwiastki z bloku energetycznego d na żółto, a pierwiastki z bloku energetycznego f na beżowo.
4. Związki Chemiczne i Mieszaniny.
*Izotopy: odmiany pierwiastka chemicznego różniące się liczbą neutronów w jądrze atomu. Izotopy tego samego pierwiastka
różnią się liczbą masową, ale mają tę samą liczbę atomową. Izotopy tego samego pierwiastka na ogół mają zbliżone własności
fizyczne i chemiczne. Jednak im większa jest różnica mas atomowych izotopów, tym większe mogą być różnice ich własności
fizycznych lub chemicznych. Izotopy danego pierwiastka mogą mieć inną gęstość, temperaturę wrzenia, topnienia i sublimacji.
Różnice te występują także w związkach chemicznych tworzonych przez te izotopy.
Podział Izotopów:
•
Trwałe:
(nie ulegają samorzutnej przemianie na izotopy tego samego lub innych pierwiastków)
•
Nietrwałe: zwane izotopami promieniotwórczymi (ulegają samorzutnej przemianie na inne izotopy, zazwyczaj
innego pierwiastka).
*Związek Chemiczny a mieszanina:
Mieszanina
Związek Chemiczny
powstaje w wyniku zmieszania składników
powstaje w reakcji chemicznej
ilości mieszanych składników są dowolne
należy użyć konkretnych ilości składników
składniki mieszaniny zachowują swoje właściwości (cechy)
ma inne właściwości niż składniki, z których powstał
składniki mieszaniny można rozdzielić prostymi metodami
związek chemiczny można rozłożyć na pierwiastki, z których
powstał tylko poprzez odpowiednią reakcję chemiczną
*Zawiesina - układ niejednorodny, dwufazowy, w postaci cząstek jednego ciała rozproszonych w drugim ciele, np. cząstek ciała
stałego w gazie lub cząstek cieczy w cieczy(mąka w wodzie). Gęstość fazy rozproszonej w zawiesinach jest na ogół większa niż
gęstość fazy rozpraszającej.
*Układ koloidalny – niejednorodna mieszanina, zwykle dwufazowa, tworząca układ dwóch substancji, w którym jedna z
substancji jest rozproszona w drugiej. Rozdrobnienie substancji rozproszonej jest tak duże, że fizycznie mieszanina sprawia
wrażenie substancji jednorodnej, jednak nie jest to wymieszanie na poziomie pojedynczych cząsteczek.Przykłady: pumeks,
piana mydlana, mgła, styropian.
*Roztwór to nierozdzielająca się w długich okresach czasu mieszanina dwóch lub więcej związków chemicznych. Skład
roztworów określa się przez podanie stężenia składników. W roztworach zwykle jeden ze związków chemicznych jest
nazywany rozpuszczalnikiem, a drugi substancją rozpuszczaną. Roztwory powstają w wyniku oddziaływania cząsteczek.

Podział Roztworów(jeden z wielu możliwychtypów podziału):
•
Nasycony: Roztwór, w którym w danych warunkach nie można juz rozpuścić więcej danej substancji
•
Nienasycony: Roztwór w którym w danych warunkach można jeszcze rozpuścić daną ilośc substancji
*Rozpuszczalność: jest to maksymalna liczba gramów substancji jaką można rozpuścić w 100g rozpuszczalnika w danej
temperaturze, aby otrzymać roztwór nasycony. Zależy od: rozpuszczalnika, subst. Rozpuszczonej, temperatury, ciśnienia.
*Stężenie: zawartość substancji rozpuszczonej w określonej ilości rozpuszczalnika lub roztworu. Rodzaje stężeń:
•
Procentowe: liczba gramów substancji rozpuszczonej zawartej w 100g roztworu, czyli % wagowy substancji do masy
roztworu, która przyjmuje sie za 100g.
///C
p
=m
s
/m
r
x 100%///
•
Molowe: Liczba moli substancji rozpuszczonej w 1 dm
3
roztworu.
///C
m
= n/V (mol/dm
3
)///
•
Molalne: Liczba moli substancji rozpuszczonej w 1000g(1 kg) rozpuszczalnika
///c=n/m
rozpuszczalnika
///
•
Ułamek Molowy: stosunek liczby moli danego składnika roztworu do sumy moli wszystkich składników roztworu.
///X
a
=n
a
/(n
a
+n
b
+......)///
5. Wiązania Chemiczne
*Wiązania Chemiczne. Wiązania tworzą elektrony zewnętrznej powłoki elektronowej atomu. Przy czym cząsteczki powstają
wówczas, gdy w wyniku reakcji każdy atom osiąga trwałą konfiguracje elektronową. Najtrwalsze konfiguracje mają atomy
gazów szlachetnych(8 elektronów walencyjnych). Reguła oktetu mówi nam, że cząsteczki dązą do obsadzenia powłoki
walencyjnej 8 elektronami. Atomy mogą przyjmować, oddawać lub uwspólniach elektrony walencyjne
*Elektroujemność to miara tendencji do przyciągania elektronów przez atomy danego pierwiastka, gdy tworzy on związek
chemiczny z atomami innego pierwiastka.
*Rodzaje Wiązań Chemicznych:
o Jonowe. Powstaje, gdy różnica elektroujemności pomiędzy łączocymi się pierwiastkami wynosi więcej niż 1,7.
Następuje rpzesunięcie elektronów w stronę pierwiastka bardziej elektroujemnego(staje się anionem). Mniej
elektroujemny pierwiastek staje sie kationem. Siła przyciągania elektrostatycznego utrzymuje dwa atomu ze
sobą. Cechy związków z przewagą wiazania jonowego:
Ciała stałe
Duża siła wzajemnego przyciągania
Dobrze rozpuszczalne w rozpuszczalnikach polarnych

Szybko zachodzące reakcje
Twarde kryształy o wysokiej temp. Wrzenia i topnienia.
o Kowalencyjne (atomowe). Jest wynikiem uwspólnienia pary elektronowej, rpzy czym każdy atom dostarcza jeden
elektron. Powstają, gdy różnica elektroujemności jest BARDZO MAŁA. Np O
2
H
2
. Cechy:
Ciała w stanie stałym
Mała siła wzajemnego przyciagania
Niewielka odpornośc na dzialanie czynnikow mechanicznych
Rozpuszczają sie w rozpuszczalnikach niepolarnych
Stosunkowo wolne reakcje.
o Kowalencyjne Spolaryzowane: Pośrednie między w. Jonowym a atomowym. Tworzy się, jeśli granica elektroujemności
zawiera sie w przedziale (0.4 ; 1.7). Uwspólniona para elektronów jest przesunięta w stronę pierwiastka bardziej
elektroujemnego. Cząsteczki tworzą dipole i cząsteczki dwubiegunowe.
o Metaliczne: Wiązanie metaliczne - ogólna nazwa dla wszelkich wiązań chemicznych występujących bezpośrednio
między atomami metali.
Wiązania między atomami metalu, jeśli występują w izolowanej formie (np. w związkach metaloorganicznych) są w
zasadzie typowymi wiązaniami kowalencyjnymi, wyróżniają się jednak w stosunku do analogicznych wiązań między
niemetalami dwiema istotnymi cechami:
*ulegają one łatwiejszej polaryzacji pod wpływem np. pola elektrycznego ze względu na to, że ogólnie w
metalach elektrony walencyjne są słabiej związane z jądrami atomów niż w niemetalach
*nawet jeśli formalnie są wiązaniami pojedynczymi, ze względu na występowanie w metalach dużej liczby
walencyjnych orbitali d zachodzi zjawisko ich nakładania się.
Cechy te powodują, że w kryształach metali powstają pasma zdelokalizowanych elektronów, które mogą swobodnie się
przemieszczać pod wpływem przyłożonego napięcia elektrycznego, dzięki czemu metale są dobrymi przewodnikami
elektrycznymi. Ubocznym skutkiem tej delokalizacji jest też istnienie w metalach trójwymiarowej sieci silnych wiązań,
co warunkuje dużą wytrzymałość mechaniczną metali, wysokie temperatury topnienia, kowalność, duży współczynnik
rozszerzalności cieplnej i inne cechy charakterystyczne dla metali
o Wodorowe
o Van der Waalsa
6. Krystalografia
*Ciało Stałe: każda substancja, która nie jest płynna, czyli zachowuje kształt i jest nieściśliwa. Ciało stałe jest pojęciem mało
precyzyjnym i mogą w nim występować w rzeczywistości różne stany skupienia materii zwane bardziej precyzyjnie fazami
fizycznymi.
*Ciało krystaliczne – rodzaj ciała stałego, w którym cząsteczki, atomy lub jony nie mają pełnej swobody przemieszczania się w
objętości ciała i zajmują ściśle określone miejsca w sieci przestrzennej – mogą jedynie drgać wokół położenia równowagi.
Monokryształy- materiał będący w całości jednym kryształem
Polikryształy- materiał będący zlepkiem wielu monokryształów(ziaren)
*Ciało Amorficzne- Ciało będące w stanie amorficznym jest ciałem stałym (tzn. nie może płynąć), ale tworzące je cząsteczki są
ułożone w sposób dość chaotyczny, bardziej zbliżony do spotykanego w cieczach.
*Anizotropia- Wykazywanie odmiennych właściwości (rozszerzalność termiczna, przewodnictwo elektryczne, współczynnik
załamania światła, szybkość wzrostu i rozpuszczania kryształu) w zależności od kierunku. Ciała anizotropowe wykazują różne
właściwości w zależności od kierunku, w którym dana właściwość jest rozpatrywana.
*Kryształy Rzeczywiste: Naturalny lub otrzymany sztucznie kryształ, posiadający defekty w strukturze zewn. i wewnętrznej.
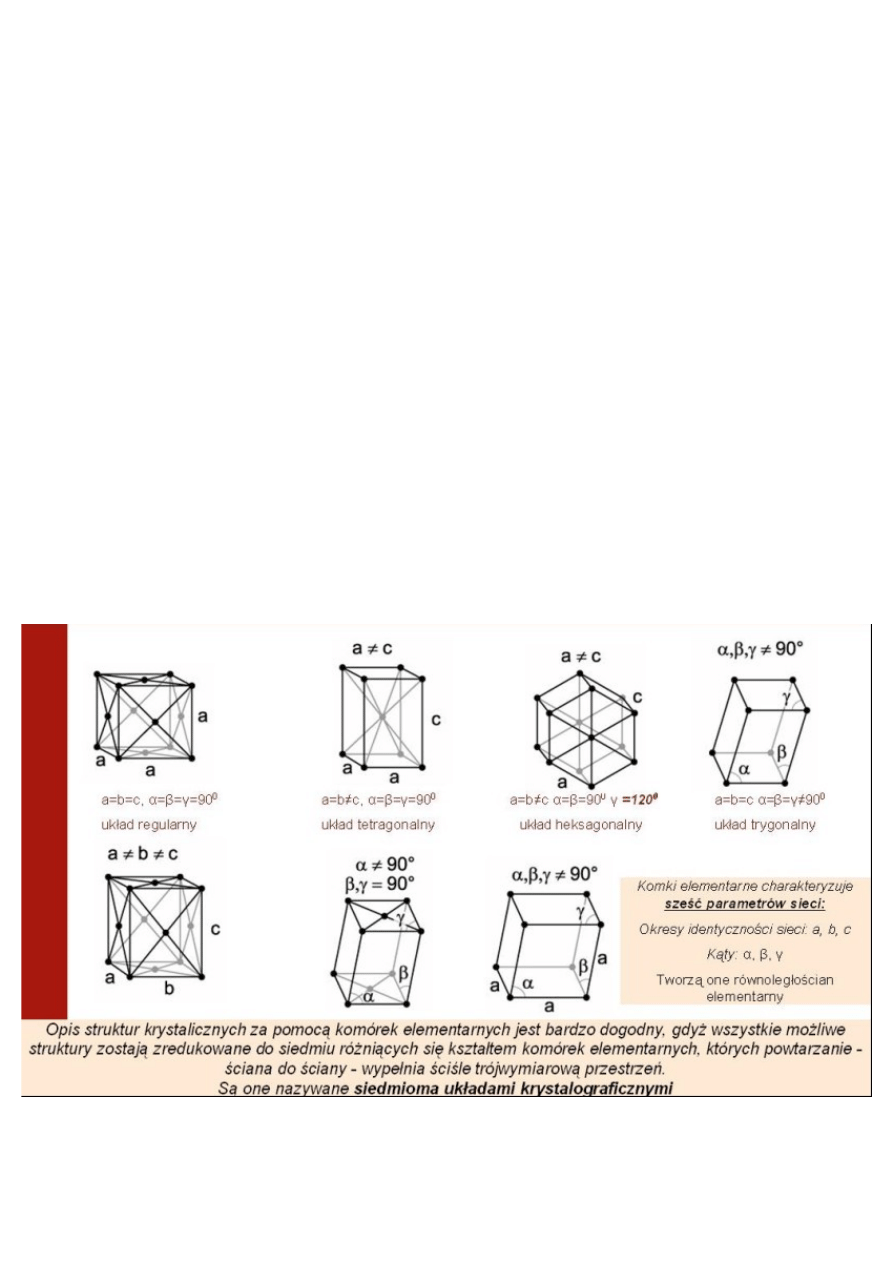
*Układy Krystalograficzne:
Oprócz 6 parametrów sieci kryształy charakteryzuje:
Liczba koordynacyjna(najbliższych sąsiadów)
Odległość między najbliższymi atomami w krysztale

Liczba atomów w komórce elementarnej
Współczynnik ,,upakowania”
*Defekty Sieci krystalicznych:
niedoskonałości kryształów polegające na punktowym lub warstwowym zerwaniu regularności
ich sieci. Defekty występują praktycznie we wszystkich rzeczywistych kryształach. Wynikają one z natury procesu krystalizacji.
Podział Defektów:
Punktowe: Zakłócenia budowy krystalicznej umiejscowione wokół punktu. Np. Wakansy(wolne miejsca w sieci
krystalicznej) lub wyjście atomu na powierzchnie kryształu,
Liniowe:
1. Dyslokacja Krawędziowa: wywołuje obecnośc w przestrzeni sieci dodatkowej półpłaszczyzny
obsadzonej atomami
2. Dyslokacja Śrubowa: powstają w wyniku przesunięcia płaszczyzn atomowych
Powierzchniowe
Warstwowe
7. Gazy, ciecze, ciała stałe.
*Gazy: Nie mają określonego kształtu ani objętości, przyjmuja kształt i objętośc zbiornika w którym sie znajduja. Wywierają
ciśnienie na ścianki naczynia w którym się znajdują, gdyż dążą do zajęcia jak największej objętości. Gaz jest zbiorem cząsteczek
w ciągłym ruchu a ich prędkośc zależy od temperatury gazu.
*Prawo Avogadra: W jednakowych warunkach temperatury ciśnienia dana liczba cząsteczek dowolnego gazu zajmuje stałą
objętość.(1 mol ok 22,4 dm
3
).
*Prawa Daltona:
"Ciśnienie wywierane przez mieszaninę gazów jest równe sumie ciśnień wywieranych przez składniki
mieszaniny, gdyby każdy z nich był umieszczany osobno w tych samych warunkach objętości i temperatury,
jest ono zatem sumą ciśnień cząstkowych."
"Objętość zajmowana przez mieszaninę gazów jest równa sumie objętości, które byłyby zajmowane przez
składniki mieszaniny, gdyby każdy z nich był umieszczony osobno w tych samych warunkach ciśnienia i
temperatury, czyli jest równa sumie objętości cząstkowych."
*Ciecze- stan pośredni pomiędzy gazem a ciałem stałym. Zachowują własną objętość, przyjmując kształt naczynia. Znaczna
gęstość i lepkość. Mała ściśliwość i rozszerzalność cieplna.

*Lepkość: Opór przeciwdziałający płynięciu cieczy. Im większa lepkość cieczy tym wolniejszy jest jej przepływ. Zazwyczaj
wraz ze wzrostem temperatury lepkość maleje.
*Napięcie powierzchniowe: Siła działająca na powierzchnie cieczy. Jest przyczyną tworzenia przez ciecze kropelek i
wykazywania przez substancje działania kapilarnego.
*Ciekłe kryształy: substancje wykazujące płynność lepkich cieczy, lecz występuje w nich pewne uporządkowanie cząsteczek.
*Metale-Cechy: połysk, kowalność, ciągliwośc, przewodnictwo elektryczne. Miarą zdolności substancji do przewodzenia
elektryczności jest opór. Ze względu na opór substancje dzieli się na: Przewodniki, Półprzewodniki, Izolatory, Nadprzewodniki.
Podział półprzewodników:
Typu n: elektrycznośc jest przenoszona przez nadmiar elektronów
Typu p: elektrycznośc jest przenoszona przez dziury elektronowe
Samoistny: Monokryształ półprzewodnika pozbawionego defektów sieci
*Stopy: Mieszaniny dwóch lub większej ilości metali. Podział stopów:
Homogeniczne: atomy róznych metali są rozmieszczone równomiernie. Np. Mosiądz, brąz
Heterogeniczne: Stanowią mieszaniny obszarów krystalicznych o różnym składzie. Np. Lut.
*Teoria Pasmowa Ciał Stałych: Dotyczy dwóch poziomów energetycznych: najbardziej zewnętrznego poziomu obsadzonego
elektronem i najbliższego mu poziomu wzbudzonego. Poziomy te pod wpływem oddziaływania elektrostatycznego ulegają
rozszczepieniu na wiele poziomów tworzących pasma energetyczne: walencyjne i przewodnictwa. W ramach pasma elektrony
poruszają się swobodnie, dzięki małym różnicom energii pomiędzy poziomami. Na każdym poziomie tworzącym mogą być
dwa elektrony.
7) Chemia organiczna
- Chemia org. węglowodory, grupy węglowodorów, izomeria węglowodorów, źródła węglowodorów, węgle kopalne, gaz
ziemny,ropa naftowa i jej przerób, produkty charakterystyczne,
-polimery, tworzywa sztuczne, rodzaje i charakterystyka
Wyszukiwarka
Podobne podstrony:
Notatki 03 PRODUKT id 322319 Nieznany
projekt 04 01 10r na rm id 3979 Nieznany
podloga na gruncie id 364776 Nieznany
Na egzamin id 312078 Nieznany
Kompozyty na kolo id 243183 Nieznany
Notatki caly semestr id 321889 Nieznany
Igloo na zal id 69618 Nieznany
odpowiedzi na pytania 2 id 3325 Nieznany
Operacje na macierzach id 33628 Nieznany
POZWOLENIA NA BRON id 380565 Nieznany
opracowanie na kolosa id 338294 Nieznany
Konspekt nr 5 na cw 6 id 245644 Nieznany
Notatki 06 Cena id 322321 Nieznany
Odpowiedzi na otwarte id 332578 Nieznany
Na egzamin 2 id 312084 Nieznany
gotowa na sukces id 193702 Nieznany
ODPOWIEDZI NA PYTANIA 4 id 3325 Nieznany
gotowa na sukces 2 id 193703 Nieznany
najwazniejszy pdf na HES id 313 Nieznany
więcej podobnych podstron