
KARDIOLOGIA PRAKTYCZNA
DLA LEKARZY RODZINNYCH
I STUDENTÓW MEDYCYNY
TOM II
FARMAKOLOGIA KLINICZNA
Pod redakcją:
Mirosława Dłużniewskiego
Artura Mamcarza
Patryka Krzyżaka
AKADEMIA MEDYCZNA
WARSZAWA 2002

© Copyright by Mirosław Dłużniewski, Artur Mamcarz
& Patryk Krzyżak
ISBN 83-88559-78-8
Druk i oprawa:
B-2 Sp. z o.o.
Projekt graficzny serii:
Urszula Janiszewska
Korekta:
Magdalena Zielonka
Katedra i Klinika Kardiologii
II Wydziału Lekarskiego Akademii Medycznej w Warszawie
ul. Kondratowicza 8, 03-242 Warszawa
tel.: (22) 326 58 24, fax: (22) 326 58 26
web site: www.amkard.waw.pl
e-mail: klinika@amkard.waw.pl

KARDIOLOGIA PRAKTYCZNA
DLA LEKARZY RODZINNYCH
I STUDENTÓW MEDYCYNY
TOM II
FARMAKOLOGIA KLINICZNA

Autorzy:
Dr n. med. Wojciech Braksator
Lek. med. Ewa Burbicka
Lek. med. Marek Chmielewski
Lek. med. Agnieszka Cudnoch-Jędrzejewska*
Lek. med. Katarzyna Cybulska
Prof. dr hab. n. med. Mirosław Dłużniewski
Lek. med. Agnieszka Domagała
Lek. med. Włodzimierz Gierlak
Dr n. med. Iwonna Grzywanowska-Łaniewska
Lek. med. Maciej Janiszewski
Lek. med. Edyta Kostarska-Srokosz
Dr n. med. Jarosław Król
Prof. dr hab. n. med. Jerzy Kuch
Dr hab. n. med. Marek Kuch
Dr hab. n. med. Artur Mamcarz
Dr n. med. Witold Pikto-Pietkiewicz
Lek. med. Katarzyna Sadkowska
Dr n. med. Jacek Sawicki
Dr n. med. Joanna Syska-Sumińska
Dr n. med. Edmund Szczepańczyk
Dr n. med. Andrzej Światowiec
Lek. med. Monika Tomaszewska-Kiecana
Lek. med. Karol Wrzosek
z Katedry i Kliniki Kardiologii II Wydziału Lekarskiego AM
* z Katedry i Zakładu Fizjologii Doświadczalnej i Klinicznej AM

Szanowne Koleżanki, Szanowni Koledzy!
Nasi młodsi Koledzy Studenci!
Pisząc wstęp do I tomu „Kardiologii Praktycznej” wspomniałem o zaję-
ciach z kardiologii prowadzonych w ramach Podyplomowej Szkoły Kardiolo-
gicznej, o wnioskach i doświadczeniach z nich wypływających.
Okazuje się, że największym zainteresowaniem cieszą się zajęcia z farma-
kologii klinicznej i dyskusje na temat konkretnych przypadków chorych. Ina-
czej mówiąc, nasi Koledzy chcą wiedzieć, jak praktycznie leczyć chorych, ja-
kie leki stosować, u kogo i w jakich dawkach. Także to, jakich efektów, jakiej
skuteczności można się spodziewać i jakich ewentualnych objawów niepo-
żądanych. Dyskutujemy o „naszych” chorych, ale tak naprawdę to są ci sami
pacjenci, których leczą nasi Koledzy – mamy te same problemy, te same wąt-
pliwości. Nie udajemy – życie uczy pokory zarówno w Poradni Rejonowej,
jak i w Klinice.
Dlatego też II tom to „Farmakologia Kliniczna” – omawiamy w nim bar-
dzo praktycznie wszystkie ważne grupy leków kardiologicznych.
Jakie leki kardiologiczne „są ważne”? Wszystkie te, których skuteczność
została udowodniona. Tak dziś można mówić o:
lekach
β-adrenolitycznych (β-blokerach): zmniejszają one śmiertelność
chorych w ostrym zawale serca, w prewencji wtórnej chorych po zawale
serca, u chorych z niewydolnością serca, są wreszcie bezpiecznymi i sku-
tecznymi lekami przeciwarytmicznymi – w każdym z tych przypadków
klinicznych zmniejszają liczbę nagłych zgonów!;
inhibitorach konwertazy angiotensyny (ACE-I): intrygującej grupie le-
ków wpisujących się w ogromną większość patomechanizmów wielu
chorób serca – skutecznej w zawale serca, zwłaszcza u chorych z uszko-
dzoną lewą komorą, w asymptomatycznej i ciężkiej niewydolności serca
oraz (na co jest coraz więcej dowodów) w chorobie niedokrwiennej ser-
ca;
inhibitorach reduktazy HMG-CoA (statynach): czy to już leki wieńco-
we? na pewno wskazane w prewencji wtórnej, także coraz chętniej sto-
sowane w prewencji pierwotnej oraz w ostrych zespołach wieńcowych,
a więc może już u wszystkich chorych i zagrożonych?;
antagonistach kanałów wapniowych: różnorodna i dynamicznie rozwi-
jająca się grupa leków o bardzo ciekawym i uzasadnionym działaniu,
wpisującym się w patogenezę chorób serca, ale mającą za sobą niejed-
noznaczne doświadczenia kliniczne;
1

lekach przeciwpłytkowych, przeciwzakrzepowych, metabolicznych
i wreszcie azotanach, z komentarzem i ciekawymi dowodami kliniczny-
mi – to treść kolejnego tomu Kardiologii Praktycznej.
Koleżanki i Koledzy Studenci!
Pamiętam dokładnie, jak trudne było przyswojenie sobie wiedzy na temat
leków, zwłaszcza że próbowano nauczyć nas ich właściwości w oderwaniu od
zajęć klinicznych. Kolejny tom „Kardiologii Praktycznej” powinien ułatwić
Wam przyswojenie wiedzy, którą będziecie posługiwać się w następnych la-
tach Waszego dorosłego życia Klinicznego.
Z życzeniami przyswojenia praktycznej wiedzy
Prof. dr hab. n. med. Mirosław Dłużniewski
Kolejny tom ukaże się podobnie jak poprzedni dzięki pomocy firmy
Schwarz Pharma, świetnie rozumiejącej, że wspólnie działamy dla dobra na-
szych pacjentów.
2

SPIS TREŚCI
1. Azotany – dlaczego i kiedy stosować?
Marek Chmielewski, Karol Wrzosek, Artur Mamcarz
5
2. Glikozydy naparstnicy – czy jeszcze potrzebne?
Andrzej Światowiec, Wojciech Braksator
19
3. Leki moczopędne
Andrzej Światowiec, Iwonna Grzywanowska-Łaniewska
26
4. Leki beta-adrenolityczne – zastosowanie kliniczne
Marek Kuch, Joanna Syska-Sumińska
43
5. Beta-adrenolityki w niewydolności serca
Joanna Syska-Sumińska, Marek Kuch
59
6. Inhibitory konwertazy angiotensyny
– panaceum nowego tysiąclecia
Iwonna Grzywanowska-Łaniewska,
Monika Tomaszewska-Kiecana, Joanna Syska-Sumińska
69
7. Antagoniści receptora AT
1
we współczesnej kardiologii
Maciej Janiszewski, Agnieszka Cudnoch-Jędrzejewska,
Artur Mamcarz
92
8. Antagoniści kanałów wapniowych
Ewa Burbicka, Monika Tomaszewska-Kiecana,
Jacek Sawicki
104
9. Czy statyny to nowa aspiryna w kardiologii XXI wieku?
Witold Pikto-Pietkiewicz, Mirosław Dłużniewski
118
10. Fibraty – aktualne miejsce w leczeniu hiperlipidemii
Witold Pikto-Pietkiewicz, Artur Mamcarz
143
11. Hiperlipidemia – wskazania do leczenia skojarzonego
Joanna Syska-Sumińska, Iwonna Grzywanowska-Łaniewska
156
12. Kwas acetylosalicylowy – ugruntowana pozycja w nowoczesnej
kardiologii
Włodzimierz Gierlak, Agnieszka Domagała,
Katarzyna Sadkowska, Marek Kuch
165
13. Przewlekłe leczenie przeciwzakrzepowe – pochodne kumaryny oraz
inhibitory trombiny
Włodzimierz Gierlak, Agnieszka Domagała,
Katarzyna Sadkowska, Marek Kuch
171
3

14. Tienopirydyny – nadzieja w leczeniu ostrych zespołów wieńcowych?
Włodzimierz Gierlak, Agnieszka Domagała,
Katarzyna Sadkowska, Marek Kuch
180
15. Leki fibrynolityczne – czy wszystko już wiemy?
Włodzimierz Gierlak, Agnieszka Domagała,
Katarzyna Sadkowska, Marek Kuch
186
16. Heparyna niefrakcjonowana i heparyny drobnocząsteczkowe
Włodzimierz Gierlak, Agnieszka Domagała,
Katarzyna Sadkowska, Marek Kuch
197
17. Inhibitory receptora glikoproteinowego IIb/IIIa
– nadzieja nowoczesnej kardiologii?
Włodzimierz Gierlak, Agnieszka Domagała,
Katarzyna Sadkowska, Marek Kuch
210
18. Leki metaboliczne
Jerzy Kuch, Edmund Szczepańczyk
216
19. Leki antyarytmiczne – kiedy i jak (nie) stosować?
Jarosław Król, Monika Tomaszewska-Kiecana,
Edyta Kostarska-Srokosz, Mirosław Dłużniewski
228
20. Hormonalna terapia zastępcza – nadzieja czy rozczarowanie?
Katarzyna Cybulska, Joanna Syska-Sumińska,
Iwonna Grzywanowska-Łaniewska
235
4

I.
AZOTANY – DLACZEGO I KIEDY STOSOWAĆ?
Marek Chmielewski, Karol Wrzosek, Artur Mamcarz
WSTĘP
Azotany nazywane potocznie nitratami, należą do najstarszych leków
wieńcowych stosowanych od przeszło 100 lat, początkowo w celu przerywa-
nia bólu dławicowego, a następnie w jego zapobieganiu. Związki stosowane
w kardiologii są estrami kwasu azotowego. Ze względu na podstawowy me-
chanizm działania zaliczane są do grupy hemodynamicznych leków wieńco-
wych. Pierwszym krokiem w historii azotanów było zsyntetyzowanie nitro-
gliceryny (NTG) w 1846 roku przez Sobrero, który zaobserwował, że
umieszczenie niewielkiej jej ilości na języku powoduje bóle głowy. W 1867
roku Brunton zaprezentował pierwsze doniesienie o skuteczności zastoso-
wania inhalacji azotanem amylu (amylum nitrosum) w celu przerwania bólu
dławicowego. Ważnym wydarzeniem było odkrycie przez Murrella w 1879
roku faktu, że podana podjęzykowo nitrogliceryna działa podobnie jak azo-
tan amylu. Od tego momentu rozpoczęło się szerokie rozpowszechnienie ni-
trogliceryny, jako leku przerywającego ból wieńcowy. Krótki czas działania
nitrogliceryny oraz stosowanego w inhalacjach azotanu amylu oraz nieak-
tywność po podaniu doustnym uniemożliwiały stosowanie ich w profilaktyce
niedokrwienia. Dopiero w 1946 roku synteza dwuazotanu izosorbidu
(ISDN), który wykazuje kilkugodzinny okres działania i jest aktywny po po-
daniu doustnym, umożliwiła stosowanie azotanów w zapobieganiu atakom
dusznicy bolesnej (epizodom niedokrwienia mięśnia sercowego).
W toku badań nad farmakokinetyką preparatu (lata 70-te) wykazano, że
ISDN jest rozszczepiany w organizmie do dwóch aktywnych metabolitów,
którymi są 2-monoazotan izosorbidu (IS-2-MN) oraz 5-monoazotan izosor-
bidu (IS-5-MN). IS-5-MN powstaje w ilości odpowiadającej ok. 70% wyj-
ściowego ISDN. Siła działania obydwu monoazotanów jest podobna, ale róż-
nią się one istotnie czasem półtrwania biologicznego. Korzystniejszy
w terapii dusznicy bolesnej, dłuższy czas T
1/2
posiada 5-monoazotan
(IS-5-MN) i to właśnie on jest substancją czynną wszystkich leków z grupy
monoazotanów (ISMN). Mówiąc o monoazotanach (mononitratach) mamy
na myśli jedną substancję czynną, którą jest 5-monoazotan (ISMN – ten
skrót będzie używany w dalszej części).
Do historii przeszedł już azotan amylu, jeszcze do niedawna mający zasto-
sowanie w diagnostyce wad serca. Dziś w praktyce klinicznej nie jest już uży-
wany.
5

Choć w ostatnich latach – w erze leczenia trombolitycznego – pojawiły się
kontrowersje dotyczące stosowania azotanów w ostrych stanach wieńcowych,
jak i przewlekle, głównie za sprawą dwóch dużych badań klinicznych (GISSI
3, ISIS 4), to jednak w praktyce klinicznej są one nadal ważną grupą leków
wieńcowych, a w celu przerywania bólu dławicowego lekiem z wyboru.
MECHANIZMY KOMÓRKOWE DZIAŁANIA AZOTANÓW
Azotany rozszerzają naczynia krwionośne poprzez zwiotczenie mięśniów-
ki gładkiej. Przede wszystkim dotyczy to żył, ale także w stopniu zależnym
od coraz większej dawki – tętnic. Podobnie jak endogenny nitrat – EDRF
(Endothelial Derived Relaxating Factor) chemicznie będący tlenkiem azotu,
który produkowany jest przez komórki śródbłonka – egzogenne, organicz-
ne azotany aktywują cyklazę guanylową miocytów, co prowadzi do we-
wnątrzkomórkowego wzrostu cGMP. Ważne jest, że efekt naczyniorozsze-
rzający po podaniu organicznych azotanów zachodzi również w naczyniach
z uszkodzonym śródbłonkiem. W konsekwencji wzrostu stężenia wewnątrz-
komórkowego cGMP dochodzi do aktywacji białek błonowych i w efekcie
przemieszczenia jonów Ca
2+
na zewnątrz komórki. Powoduje to defosfory-
lację łańcuchów lekkich miozyny i w konsekwencji relaksację miocytu. Ist-
nieje ścisła zależność między poziomami wewnątrzkomórkowego cGMP
a stopniem zwiotczenia mięśniówki gładkiej naczyń. Im wyższe stężenie
cGMP w miocytach, tym bardziej zwiotczałe są mięśnie gładkie. Obserwo-
6
Tabela 1: Historia stosowania azotanów
1846
synteza nitrogliceryny przez Sobrero;
od 1879
stosowane do przerywania bólu wieńcowego;
od 1950
dodatkowo jako zapobieganie bólom wieńcowym;
od 1970
nowe wskazania:
• niewydolność krążenia,
• ostra faza zawału serca;
od 1980
odkrycie nieznanych efektów działania azotanów:
• hamują agregację płytek,
• zwiększają odkształcalność erytrocytów,
• poprawiają lepkość krwi,
• poprawiają metabolizm niedokrwionego mięśnia
sercowego;
od 1987
ustalenie, że EDRF = NO (endogenny nitrat);

wane podczas stosowania azotanów zjawisko tolerancji na leczenie (brak
efektu farmakologicznego stosowanych leków) może być m.in. związane ze
zmniejszeniem poziomów cGMP, cysteiny i glutationu. Obecność dwóch
ostatnich substancji jest konieczna do tego, aby egzogenny azotan wywołał
rozkurcz mięśniówki gładkiej (uczestniczą w odszczepianiu NO z egzogen-
nego azotanu). Wewnątrzkomórkowy niedobór cysteiny, która uczestniczy
w transformacji azotanów (odszczepianiu grupy NO) jest związany ze zjawi-
skiem tolerancji na azotany, do której dochodzi w sytuacji, gdy w sposób cią-
gły utrzymywane jest terapeutyczne stężenie (>200 ng/ml osocza) leku.
W praktyce klinicznej w przypadkach przewlekłego podawania azotanów,
aby wyeliminować zjawisko tolerancji stosowana jest przerwa terapeutyczna
– czyli okres kilku godzin w ciągu doby, kiedy stężenie leku w osoczu zmniej-
sza się poniżej poziomu terapeutycznego, a więc poniżej 200 ng/ml. W 1987
roku wykazano, że EDRF (śródbłonkowy czynnik naczyniorozszerzający),
będący w warunkach fizjologicznych jedną z głównych substancji naczynio-
rozszerzających produkowanych przez śródbłonek jest tlenkiem azotu (NO).
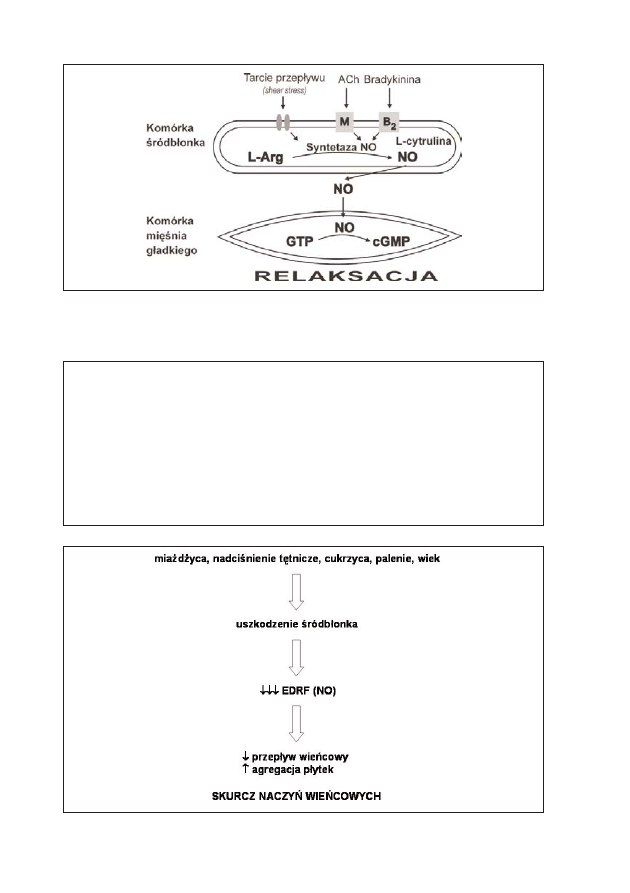
Tlenek azotu powstaje z L-argininy. Reakcja katalizowana jest przez enzym
śródbłonkowy – syntetazę NO (tab. 2).
Najsilniejszym bodźcem dla komórki śródbłonka do produkcji NO jest
przepływ krwi, czyli tarcie. Powstały w śródbłonku NO dyfunduje do miocy-
tów mięśniówki gładkiej naczyń krwionośnych. Tam poprzez stymulację przej-
ścia GTP w cGMP wyzwala rozkurcz mięśniówki gładkiej naczyń (ryc. 1).
Śródbłonek jest największym organem endokrynnym, który bierze udział
w syntezie i rozkładzie substancji wazoaktywnych (tab. 3). Różne czynniki
patologiczne: miażdżyca, nadciśnienie tętnicze, cukrzyca, palenie tytoniu,
wiek prowadzą do uszkodzenia śródbłonka i w konsekwencji niedoboru NO
(ryc. 2).
7
Tabela 2: Główne cechy endogennego tlenku azotu (EDRF = NO)
• powstaje z L-argininy;
• rozkładany jest przez hemoglobinę i wolne rodniki tlenowe;
• utrzymuje podstawowy tonus mięśniówki w naczyniach;
• jest odpowiedzialny za rozkurcz naczynia zależny od większego
przepływu krwi w naczyniu;
• zmienia odpowiedź naczyń na czynniki obkurczające;
• jest to ENDOGENNY NITRAT.
8
Tabela 3: Śródbłonek – największy organ endokrynny
• ilość komórek: 6 x 10
23
;
• powierzchnia: 700-1000 m
2
;
• masa: 1,5 kg;
• aktywność metaboliczna:
- synteza NO,
- rozkład substancji wazoaktywnych,
- aktywność ACE.
Rycina 1: Synteza tlenku azotu (NO) w śródbłonku – fizjologiczny mechanizm działania
Rycina 2: Efekt uszkodzenia śródbłonka

Efekt komórkowy azotanów jest związany z działaniem uwalnianego z nich
tlenku azotu. Azotany wywierają dokładnie takie samo działanie komórko-
we, jak endogenny nitrat – EDRF (NO). Efekt działania azotanów jest nie-
zależny od śródbłonka. Działają skutecznie w miejscach pozbawionych en-
dothelium powodując wzrost stężenia cGMP w komórkach miocytów.
HEMODYNAMICZNE EFEKTY DZIAŁANIA AZOTANÓW
Wszystkie rodzaje organicznych azotanów wywierają podobne działanie na na-
czynia krwionośne: silnie rozkurczają mięśniówkę gładką naczyń żylnych, umiar-
kowanie wpływają na rozkurcz ściany dużych i małych tętnic. W konsekwencji
głównym mechanizmem przeciwniedokrwiennym jest spadek obciążenia wstępne-
go serca (preload), wtórny do zmniejszonego powrotu żylnego. W tym miejscu na-
leży powiedzieć, że ten mechanizm, czyli zmniejszenie obciążenia wstępnego okre-
śla podstawowe przeciwwskazania do stosowania azotanów, a są nimi wszystkie
stany, które przebiegają z niewydolnością prawej komory – zarówno wtedy, gdy
upośledzone jest napełnianie (np. tamponada serca), jak też jej czynność skurczo-
wa (np. zawał prawej komory). Zmniejszenie powrotu żylnego będzie w tych sta-
nach pogłębiało niewydolność prawej komory i może dramatycznie zmniejszyć
rzut serca. Oprócz wpływu na mięśniówkę gładką układu żylnego azotany także
wpływają na mięśniówkę gładką tętnic systemowych powodując umiarkowane
zmniejszenie obciążenia następczego (afterload). Oba mechanizmy zmniejszają
zapotrzebowanie mięśnia sercowego na tlen. Istotą korzystnego wpływu azota-
nów na spadek konsumpcji tlenowej przez mięsień sercowy jest – co należy pod-
kreślić – spadek ciśnienia napełniania lewej komory, a tym samym mniejsze ob-
ciążenie skurczowe mięśnia. Azotany zwiększają także podaż tlenu do
niedokrwionego mięśnia sercowego – bezpośrednio rozszerzają tętnice wieńco-
we i zwiększają przepływ podwsierdziowy. Fakt, że działają zarówno w naczyniach
prawidłowych, jak i w naczyniach z uszkodzonym śródbłonkiem (np. przez proces
miażdżycowy) sprawia, że nie powodują zjawiska podkradania (tab. 4).
9
Tabela 4: Hemodynamiczne efekty działania azotanów
ZMNIEJSZENIE zapotrzebowania miokardium na tlen poprzez:
•
¯¯¯ obciążenia wstępnego (rozszerzenie żył);
•
¯ obciążenia następczego (rozszerzenie tętnic).
ZWIĘKSZENIE podaży tlenu w miokardium poprzez:
•
¯ oporu naczyń wieńcowych;
•
przepływu podwsierdziowego (zrelaksowany mięsień sercowy
– mniej napięty w fazie rozkurczu – jest łatwiej perfundowany przez
krew z krążenia wieńcowego).
ZASTOSOWANIE KLINICZNE AZOTANÓW
W praktyce wykorzystywane są trzy preparaty: nitrogliceryna (NTG), dwu-
azotan izosorbidu (ISDN) oraz 5-monoazotan izosorbidu (ISMN). Różnią
się one farmakokinetyką. NTG i ISDN dobrze i szybko wchłaniają się po po-
daniu podjęzykowym i dlatego w formie preparatów krótkodziałających
chętnie są stosowane do przerywania bólu wieńcowego. Monoazotany zaś
(ISMN) zdecydowanie lepiej wchłaniają się po podaniu doustnym. W od-
różnieniu od ISDN monoazotany nie podlegają procesowi metabolicznej
transformacji podczas pierwszego przejścia przez wątrobę. W konsekwencji
biodostępność ISMN po podaniu doustnym wynosi 90-100% (tab. 5).
Stosowanie azotanów wymaga zachowania kilkugodzinnej przerwy tera-
peutycznej w ciągu doby. Konwencjonalne preparaty ISDN i ISMN są daw-
kowane 2 razy na dobę, co 6 godzin (np. 8:00 i 14:00). Takie dawkowanie
zapewnia ok. 6–8-godzinną przerwę terapeutyczną w ciągu nocy. Nieprze-
strzeganie tego wymogu prowadzi do rozwoju tolerancji na leczenie, która
głównie jest związana z wyczerpaniem grup sulfhydrylowych, których dono-
rem jest cysteina. Dawkowanie tylko raz na dobę (stosowanie preparatów
o przedłużonym działaniu) zabezpiecza pacjenta przed rozwojem tolerancji
na leczenie.
Problem rozwoju tolerancji na leczenie jest problemem złożonym. Z jed-
nej strony, tolerancja może być związana z osłabieniem działania leków na
poziomie komórkowym:
• upośledzona biotransformacja azotanów w wątrobie (dotyczy NTG
i ISDN);
10
Tabela 5: Podział azotanów
BIODOSTĘPNOŚĆ PO PODANIU
PREPARATY
doustnym
podjęzykowym
T
1/2
*
triazotan glicerolu
różna
20-100%
1-3 min.
(nitrogliceryna, NTG)
dwuazotan izosorbidu
różna
100%
50 min.
(ISDN)
5-monoazotan
100%
(–) 4-10
h
izosorbidu (ISMN)
* biologiczny okres półtrwania (T
1/2
)

• wyczerpanie zapasu grup sulfhydrylowych w śródbłonku;
•
produkcji nadtlenków = przyśpieszony rozpad tlenku azotu;
•
aktywności fosfodiesterazy = wzmożony rozpad cGMP.
Z drugiej strony może wynikać ze zniesienia efektu klinicznego przez me-
chanizmy kompensacyjne (tzw. pseudotolerancja) – zbyt duży spadek ciśnie-
nia tętniczego powoduje:
•
aktywności układu renina-angiotensyna-aldosteron;
•
wydzielania ADH i katecholamin;
•
produkcji ET-1;
•
objętości osocza;
•
czynności serca spowodowany odruchem z baroreceptorów.
Główną przyczyną tolerancji jest, o czym należy pamiętać, ciągłe podawa-
nie leku bez zachowania przerwy terapeutycznej. Stałe utrzymywanie tera-
peutycznego stężenia leku (200-300 ng/ml osocza) wyczerpuje zapas grup
sulfhydrylowych w śródbłonku, a są one niezbędne do odszczepiania z azota-
nów tlenku azotu. Są dwa sposoby na uniknięcie tego zjawiska:
• 1 raz na dobę
stosowanie leków tylko raz na dobę (preparaty o przedłużonym działa-
niu, które tak naprawdę zachowują stężenie terapeutyczne tylko przez
14-16 godzin w ciągu doby i tym samym spełniają wymogi kilkugodzinnej
przerwy terapeutycznej);
lub
• 2 razy na dobę
stosowanie niesymetryczne w ciągu doby preparatów konwencjonalnych;
oznacza to, że lek jest podawany np. rano i w porze obiadu (zwykle 8:00
i 14:00); koniec działania dawki przyjętej o godzinie wypada ok. 20:00-
21:00 i tym samym do rana stężenie leku spada poniżej poziomu tera-
peutycznego. Możliwe jest również stosowanie leków w godzinach po-
południowych i wieczornych, np. o godz. 14:00 i 20:00, jeśli problemem
są bóle nocne.
Formy preparatów, jakie stosujemy w praktyce klinicznej to:
1. szybko działające tabletki i spraye do stosowania na śluzówki jamy ust-
nej podjęzykowo i dopoliczkowo – do stosowania doraźnego (NTG,
ISDN);
11

2. tabletki i kapsułki do stosowania doustnego o średnim i długim czasie
działania (NTG, ISDN, ISMN);
3. plastry z preparatami działającymi przezskórnie (NTG):
plastry z nitrogliceryną szczególnie polecane są w sytuacjach, gdy istnie-
je potrzeba stosowania azotanu w formie o przedłużonym działaniu,
a nie można go podać doustnie – najczęściej ma to miejsce podczas za-
biegów chirurgicznych u pacjentów ze stabilnym przebiegiem choroby
wieńcowej – plaster z NTG przyklejony w dniu operacji zapewnia stałe
stężenie azotanu przez kilkanaście godzin;
4. roztwory do stosowania parenteralnego (NTG):
z praktycznego punktu widzenia roztwory te należy rozcieńczyć solą fi-
zjologiczną do objętości całkowitej 50 ml (25 mg NTG na 50 ml soli fi-
zjologicznej), a następnie stosować w pompie infuzyjnej z prędkością re-
gulowaną w zależności od parametrów hemodynamicznych (ciśnienie
tętnicze krwi, tętno) w zakresie 20-100 µg/min – w praktyce oznacza to
przepływ w pompie infuzyjnej od 1 do 5 ml tak sporządzonego roztworu
na godzinę.
Azotany są stosowane w różnych postaciach choroby niedokrwiennej serca
(dusznica bolesna stabilna, dusznica bolesna niestabilna, zawał mięśnia serco-
wego) oraz w niewydolności krążenia. Wskazania do stosowania azotanów zo-
stały określone w Standardach Polskiego Towarzystwa Kardiologicznego (PTK).
AZOTANY W DUSZNICY BOLESNEJ
Dusznica bolesna jest głównym wskazaniem do stosowania azotanów. Ich
główne działanie opiera się tutaj na profilaktyce bólu oraz poprawie hemo-
dynamiki serca. Należy jednak powiedzieć, że w świetle dowodów nauko-
wych nie wykazano, aby leki z tej grupy wydłużały przeżycie pacjentów z cho-
robą wieńcową. Wprawdzie skutecznie ograniczają objawy chorobowe (ilość
bólów wieńcowych) i poprawiają jakość życia, ale nie powinny być lekiem
pierwszego wyboru w chorobie wieńcowej. Odstępstwem od tego sposobu
myślenia jest leczenie dusznicy bolesnej I stopnia wg Kanadyjskiego Towa-
rzystwa Kardiologicznego (CCS). W tej postaci epizodycznej dusznicy poja-
wiającej się przy dużych wysiłkach jedynym zalecanym lekiem wieńcowym
jest krótko działający azotan (NTG lub ISDN) stosowany interwencyjnie.
W praktyce w zaawansowanych postaciach dusznicy bolesnej (wyższe klasy
wg CCS) najczęściej łączymy stosowanie różnych leków wieńcowych, a dłu-
go działający azotan jest elementem leczenie skojarzonego. Szczególnie ko-
rzystne wydaje się być leczenie azotanami w skojarzeniu z lekami
β-adreno-
litycznymi, dzięki czemu zapobiega się odruchowej tachykardii.
12

Zalecane leczenie w zależności od stopnia zaawansowania dolegliwości
dusznicowych przedstawiono w tabeli 6 (czterostopniowa klasyfikacja dusz-
nicy bolesnej wg CCS).
Postulowane w standardach PTK dawkowanie w dusznicy bolesnej może
być zwiększone – standardy amerykańskie (AHA, 1999 rok) dopuszczają sto-
sowanie wyższych dawek – 120-240 mg ISMN i ISDN na dobę. W praktyce
nie przekraczamy dawki 100 mg ISMN na dobę.
AZOTANY W OSTRYM ZAWALE SERCA
Standardem postępowania, w miejscu zachorowania, u osoby z podejrze-
niem klinicznym ostrego zawału mięśnia sercowego jest unieruchomienie
chorego, podanie kwasu acetylosalicylowego i krótko działającego azotanu
podjęzykowo, czyli NTG lub ISDN (najlepiej po zmierzeniu ciśnienia tętni-
czego). Ustąpienie lub zmniejszenie bólu po podaniu podjęzykowym nie ma
jednak wartości diagnostycznej, jak to zwykło się uważać w przeszłości. Po
przewiezieniu pacjenta do Oddziału Intensywnej Opieki Kardiologicznej
13
Tabela 6: Azotany w dusznicy bolesnej – wskazania do leczenia
KLASA wg CCS
LEKI ZALECANE W DUSZNICY BOLESNEJ
I
leki przeciwpłytkowe, azotan interwencyjnie
(NTG, ISDN);
leki przeciwpłytkowe, jeden z hemodynamicznych
II
leków wieńcowych, np. azotan o przedłużonym
działaniu na stałe;
leki przeciwpłytkowe, azotan o przedłużonym
III
działaniu (ISMN, ISDN, NTG) w skojarzeniu
IV
z
β-adrenolitykiem, antagonistą kanałów wapnio-
wych;
Tabela 7: Azotany w dusznicy bolesnej – dawkowanie
1 RAZ DZIENNIE
2 RAZY DZIENNIE
NTG
15 mg
6,5 mg
ISDN
60-80 mg
20-40 mg
ISMN
40-100 mg
20-40 mg

kontynuowane jest leczenie azotanami. Zwykle jest to dożylny wlew roztwo-
ru nitrogliceryny. W epoce leczenia trombolitycznego, wskazania do poda-
wania azotanów w ostrym zawale serca zredukowano do określonych sytuacji
klinicznych. Dwa duże badania kliniczne GISSI 3 (19 000 chorych) i ISIS
4 (58 000 chorych) oceniały wpływ nitratów podawanych od 1 doby zawału
przez 4-6 tygodni w grupie chorych poddanych leczeniu fibrynolitycznemu.
Wyniki obu badań wykazały brak wpływu nitratów na zmniejszenie śmier-
telności po 5 tygodniach oraz w okresie późniejszym. W badaniu GISSI
3 u chorych powyżej 70 roku życia oraz u kobiet zaobserwowano 10% spa-
dek łącznej częstości zgonów i zaburzeń czynności lewej komory. Do tej po-
ry te dwa badania wzbudzają kontrowersje. Według niektórych autorów, nie
można wykluczyć korzyści, bo są one maskowane przez jednoczesne podanie
leków trombolitycznych i kwasu salicylowego. Inni twierdzą, że w obu bada-
niach zastosowane punkty końcowe były niewłaściwe. Nie ma więc żadnego
formalnego potwierdzenia skuteczności regularnie stosowanych nitratów
w ostrej fazie zawału serca. Walka z bólem zawałowym oraz dobra kontrola
hemodynamiki pod warunkiem monitorowania w warunkach intensywnej
opieki sprawiają, że azotany są nadal stosowane w ostrych incydentach ser-
cowych. Podkreślenia wymaga fakt, że nie wszyscy pacjenci z ostrym zawa-
łem mięśnia sercowego wymagają leczenia azotanami w OIOK. W przypad-
ku ostrego zawału leczonego w OIOK, mówiąc o azotanach mamy na myśli
roztwór nitrogliceryny, inne preparaty, jeśli to konieczne zastępują dożylny
wlew NTG w kolejnych dobach zawału (2-3 doba).
Przesłanki do stosowania azotanów w ostrym zawale mięśnia sercowego
wymieniono w tabeli 8.
Badania Jurgdutta przemawiały nawet za ograniczeniem strefy martwicy
w ostrym zawale mięśnia sercowego oraz poprawę czynności lewej komory
w odpowiedzi na wczesne dożylne podanie azotanów. Z czasem zostały pod-
dane krytycznej ocenie.
14
Tabela 8: Azotany w zawale – mechanizmy działania
• zmniejszanie kurczu w miejscu zakrzepu;
• poprawa przepływu wieńcowego w miejscu, gdzie zakrzep został
rozpuszczony przez leczenie trombolityczne;
• poprawa przepływu w kolateralach
® poprawa funkcji mięśnia
® ¯ uszkodzenie miokardium;
•
¯ obciążenia serca ® ¯ zapotrzebowania na tlen.
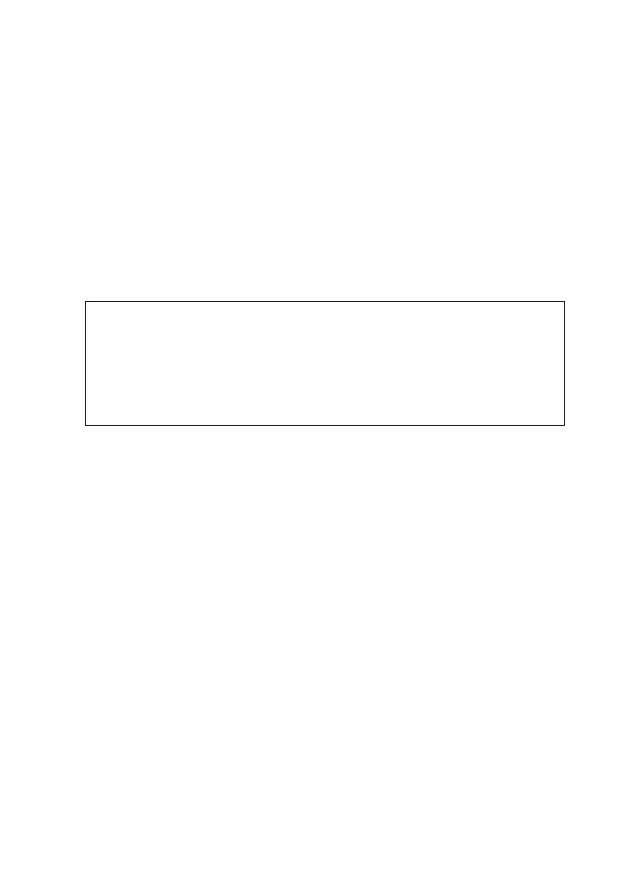
Nie każdy zawał mięśnia sercowego powinien być leczony przy użyciu azo-
tanów. Z całą pewnością po uwzględnieniu oczywistych przeciwwskazań (np.
wstrząs) typowym wskazaniem do podania azotanów są rozległe zawały z ob-
jawami niewydolności lewej komory, wysokie wartości ciśnienia tętniczego
i nawroty stenokardii, mimo skojarzonego leczenia (leki przeciwpłytkowe,
β-blokery, narkotyczne leki przeciwbólowe). Nie ma przesłanek do stosowa-
nia wlewów nitrogliceryny w zawałach bez cech niewydolności lewokomoro-
wej, zwłaszcza w niedużych zawałach ściany dolnej, które w 30-70% przy-
padków z racji wspólnego unaczynienia współistnieją z zawałami prawej
komory (ryzyko sprowokowania ostrej hipotonii poprzez pogłębienie ostrej
niewydolności prawokomorowej).
Przeciwwskazania do stosowania azotanów w ostrym zawale serca
• wstrząs;
• hipotonia poniżej 100 mm Hg;
• zawał prawej komory.
Dawkowanie azotanów w ostrym zawale serca
• dawka: 20-100 µg/min;
• roztwór 20 mg NTG w 50 ml 0,9% NaCl;
• przepływ 1-5 ml/h w pompie infuzyjnej.
AZOTANY W NIEWYDOLNOŚCI KRĄŻENIA
Azotany nie są lekami pierwszego rzutu w leczeniu niewydolności krąże-
nia. Wprawdzie w połączeniu z wazodylatatorem, jakim jest dihydralazyna
wykazały swą skuteczność w zmniejszaniu śmiertelności pacjentów z niewy-
dolnością krążenia, samodzielnie stanowiąc alternatywę dla nieskutecznego
15
Tabela 9: Azotany w zawale mięśnia sercowego – wskazania do stosowania wg PTK (Kard. Pol., 1997 rok)
• zawał z objawami niewydolności lewej komory
(najczęściej rozległy zawał w lokalizacji przednio-bocznej);
• utrzymywanie się i nawroty bólu zawałowego;
• w nadciśnieniu tętniczym;
• w niewydolności zastawki mitralnej.
lub źle tolerowanego leczenia klasycznego (inhibitory konwertazy angioten-
syny, diuretyki,
β-adrenolityki). Azotany w niewydolności krążenia są dobrze
tolerowane, zmniejszają uczucie duszności, odciążają niewydolną lewą ko-
morę, co sprawia, że pacjenci odczuwają w wyniku stosowania tych leków
subiektywną poprawę. Skuteczne w zmniejszeniu objawów niewydolności
serca, samodzielnie nie wpływają na zmniejszenie śmiertelności.
Najlepiej zastosować monoazotany o przedłużonym działaniu, jeśli dwa
razy dziennie, to z zachowaniem przerwy terapeutycznej, celem uniknięcia
tolerancji.
Jak każda grupa leków, również i azotany nie są pozbawione działań
ubocznych.
DZIAŁANIA NIEPOŻĄDANE AZOTANÓW
• bóle głowy – najczęściej występujący objaw niepożądany stosowania azo-
tanów; występują najczęściej na początku leczenia, natomiast utrzymują-
ce się ponad 3 doby bóle głowy są wskazaniem do zmiany leku, np. na
monoazotan (mniejsza ilość bólów głowy podczas leczenia monoazota-
nami) lub jeśli pacjent przyjmuje już monoazotan, zamiana na inny pre-
parat z tej samej grupy; utrzymujące się mimo tych zabiegów bóle głowy
są wskazaniem do przerwania leczenia;
• zaczerwienienie skóry, uczucie fali gorąca (azotany rozszerzają naczynia
obwodowe);
• hipotonia, omdlenie;
16
Tabela 10: Wskazania do stosowania azotanów w niewydolności krążenia
• nietolerancja lub przeciwwskazania do ACE-inhibitorów;
• korzystne połączenie z wazodylatatorami obwodowymi;
• element terapii skojarzonej (ACE-I /
β-adrenolityk / diuretyk / na-
parstnica).
Tabela 11: Azotany w niewydolności krążenia – dawkowanie
DOCELOWO
MAKSYMALNIE
ISDN
120 mg
240 mg
IS-5-MN
40-100 mg
120 mg

• tachykardia (zwiększenie o maks. 10%);
• nasilenie dolegliwości wieńcowych (paradoksalnie leki przeciwniedokr-
wienne mogą spowodować zaostrzenie dolegliwości dławicowych – zbyt du-
ży spadek ciśnienia tętniczego powoduje odruchową tachykardię i w tym
mechanizmie zwiększa zapotrzebowanie mięśnia sercowego na tlen);
• objawy alergiczne (rzadko);
• ostre zatrucie: niepokój, sinica, methemoglobinemia (bardzo rzadko).
PRZECIWWSKAZANIA DO STOSOWANIA AZOTANÓW
• kardiomiopatia przerostowa z zawężeniem drogi odpływu z lewej komo-
ry – spadek oporu obwodowego może spowodować nasilenie zwężenia
(wzrost gradientu);
• ostra niewydolność prawej komory (zaciskające zapalenie osierdzia,
tamponada serca, zawał prawej komory, zator płucny);
• wstrząs, hipotonia poniżej 100 mm Hg;
• alergia na lek;
• jaskra z wąskim kątem przesączania (przeciwwskazanie względne
– zwłaszcza w odniesieniu do monoazotanów);
• krwotok mózgowy, uraz czaszki.
Azotany wchodzą też w interakcje, co implikuje ograniczenia w ich stoso-
waniu w różnych sytuacjach klinicznych:
• nasilają hipotensyjne działanie leków przeciwnadciśnieniowych;
• nasilają hipotensyjne działanie alkoholu;
• mogą wywoływać hipotonię u pacjentów zażywających sidenafil – osoby
z udokumentowaną chorobą niedokrwienną serca przyjmujące przewle-
kle azotany nie powinny zażywać preparatu Viagra; przy doraźnym sto-
sowaniu azotanów, jest to dopuszczalne.
Pomimo ograniczenia wskazań do stosowania azotanów, kontrowersyjnych
wyników badań oceniających przeżywalność chorych leczonych azotanami,
nic nie zapowiada zmierzchu najstarszej grupy leków wieńcowych.
Zapamiętaj!
1. Azotany są donorem tlenku azotu (NO) endogennej substancji śródbłonko-
wej, która rozszerza naczynia krwionośne (żyły i tętnice).
17

2. Azotany (NTG, ISDN, ISMN) są najstarszą grupą hemodynamicznych le-
ków wieńcowych.
3. Głównym efektem działania przeciwniedokrwiennego azotanów jest
zmniejszenie powrotu żylnego (preload).
4. Aby uniknąć zjawiska tolerancji podczas przewlekłego leczenia azotanami,
należy stosować przerwę terapeutyczną.
5. Najczęściej w leczeniu przewlekłym stosujemy ISMN o przedłużonym dzia-
łaniu 1 raz na dobę.
6. Krótko działające azotany bardzo silnie obniżają ciśnienie tętnicze krwi.
7. Nie każdy zawał mięśnia sercowego jest wskazaniem do rutynowego stoso-
wania azotanów (wlew nitrogliceryny).
8. Azotany nie zmniejszają śmiertelności pacjentów z chorobą niedokrwienną
serca (zmniejszają objawy, nie wpływając na przeżywalność).
9. Azotany są lekami zmniejszającymi objawy w niewydolności krążenia.
Polecane lektury:
M. Bilińska: Monoazotany o przedłużonym działaniu w leczeniu stabilnej
choroby wieńcowej; Medipress Kardiologia, 2002, suplement 6, 3-10.
M. Chmielewski: Monoazotany w leczeniu choroby niedokrwiennej serca;
Medipress Kardiologia, 1998, suplement 4, 3-8.
Z. Gaciong: Jak leczyć azotanami? Dawkowanie, tolerancja, działania niepo-
żądane; Medipress Kardiologia, 2002, suplement 4, 3-8.
M. Kośmicki: Choroba wieńcowa w praktyce lekarza rodzinnego: Azotany;
Termedia, Poznań, 2001, 143-160.
R. Jansen i wsp.: Independent determinants of the efficacy of nitrate therapy;
Int J Clin Pharmacol, 2000, 38, 563-7.
18

II.
GLIKOZYDY NAPARSTNICY – CZY JESZCZE
POTRZEBNE?
Andrzej Światowiec, Wojciech Braksator
Lecznicze właściwości glikozydów naparstnicy znane są od ponad 200 lat.
Jest to więc niezwykle „zasłużona” grupa leków, szczególnie w leczeniu nie-
wydolności serca, niemniej od lat wzbudza zaciekawienie i kontrowersje.
MECHANIZM DZIAŁANIA
Według powszechnie akceptowanej teorii Akera i Brady’ego mechanizm
działania jest następujący. Glikozydy naparstnicy blokują pompę jonową
w błonie komórkowej komórek mięśnia roboczego serca. Hamując ATP-azę
Na/K-zależną powodują zwiększenie zawartości wewnątrzkomórkowego
Na
+
, co aktywuje wymianę Na
+
/Ca
2+
i na tej drodze zwiększa wewnątrzko-
mórkowe stężenie wapnia. W ten sposób następuje ułatwienie sprzężenia
elektromechanicznego, czyli dodatni efekt inotropowy.
Inotropowo dodatnie działanie glikozydów naparstnicy występuje zarówno
w sercu wydolnym, jak i niewydolnym – różnice są tutaj jednak zasadnicze.
W sercu niewydolnym skutkiem wzmożonego inotropizmu jest zwiększe-
nie wskaźnika dp/dt, a więc wielkości i szybkości narastania ciśnienia w ko-
morach – objętość wyrzutowa oraz objętość minutowa serca ulega zwiększe-
niu. Sympatykotonia obwodowa będąca w niewydolności krążenia
mechanizmem kompensacyjnym, zmniejsza się wraz z ponaparstnicowym
obniżeniem ciśnienia żylnego oraz poprawą kurczliwości komór – w konse-
kwencji spada opór obwodowy.
W sercu zdrowym wzmożony inotropizm powoduje zmniejszenie napływu
żylnego do serca oraz mniejsze napięcie włókien w okresie późnego rozkur-
czu – w konsekwencji objętość wyrzutowa oraz minutowa nieznacznie się
zmniejsza. Mało tego – opór obwodowy wzrasta. Innymi słowy – podanie na-
parstnicy pacjentowi z wydolnym sercem jest błędem – nie mamy szans na
poprawę, pojawia się jedynie możliwość ubocznych działań leku.
Chronotropowo ujemne działanie glikozydów naparstnicy, a więc zwalnia-
jące czynność serca, wynika z ich hamującego wpływu na automatyzm węzła
zatokowego oraz samych przedsionków i komór, a działanie dromotropowo
ujemne z upośledzenia przewodzenia w węźle przedsionkowo-komorowym.
Dodatkowo glikozydy zwiększają napięcie nerwu błędnego, co potęguje
zwalniający wpływ na rytm serca.
19
Zarówno chronotropowe, jak i dromotropowe ujemne działanie glikozydów
naparstnicy występuje tylko w dawkach terapeutycznych. Po osiągnięciu toksycz-
nego stężenia w surowicy, glikozydy co prawda jeszcze silniej upośledzają auto-
matyzm węzła zatokowego i przewodzenie w węźle przedsionkowo-komo-
rowym, ale za to zwiększają automatyzm oraz pobudliwość przedsionków,
komór i węzła A-V. Rezultatem tych paradoksalnych zachowań układu bodźco-
przewodzącego mogą być różnorodne zaburzenia rytmu i przewodzenia (tab. 1).
Bogate i często sprzeczne obserwacje kliniczne dotyczące glikozydów na-
parstnicy skłoniły badaczy do zaprojektowania dużych, randomizowanych ba-
dań mających na celu zobiektywizowanie tych ocen. Pierwsze programy ba-
dawcze powstały w początku lat 90-tych – badania PROVED i RADIANCE
wykazały, że glikozydy naparstnicy są wartościowym składnikiem 3-lekowej
terapii i zmniejszają ryzyko dekompensacji niewydolnego krążenia. Klasycz-
na terapia 3-lekowa to ACE-I + diuretyk + naparstnica. Badanie CADS
potwierdziło powyższe obserwacje w odniesieniu do chorych po zawale ser-
ca – podkreślano jednak niekorzystny wpływ digoksyny na ilość ostrych incy-
dentów wieńcowych, w tym nagłych zgonów sercowych. Retrospektywne ba-
danie SPRINT z 1995 r. utwierdziło badaczy w negatywnej ocenie
glikozydów – stwierdzono, iż digoksyna w dawce 0,25 mg/dobę jest niezależ-
nym czynnikiem ryzyka zgonu w 1 roku po zawale serca.
Dopiero przeprowadzone na dużej populacji amerykańsko-kanadyjskie
badanie znane pod nazwa DIG (Digitalis Investigation Group), wykazało
20
Tabela 1: Najczęstsze ponaparstnicowe zaburzenia rytmu i przewodzenia
• ekstrasystolie komorowe
(zwykle wieloośrodkowe, najczęściej jednak jest to bigeminia i trigeminia);
• częstoskurcz komorowy
(również wielokształtny, do migotania komór włącznie);
• częstoskurcz przedsionkowy z blokiem (PAT)*;
• częstoskurcz węzłowy lub zastępczy rytm węzłowy;
• ekstrasystolie nadkomorowe i/lub węzłowe;
• migotanie przedsionków;
• bradykardia zatokowa <40/min;
• blok przedsionkowo-komorowy I, II i III stopnia;
• rozkojarzenie przedsionkowo-komorowe.
* niektórzy autorzy podkreślają, że jest to najbardziej typowe zaburzenie u chorych przenaparstnicowanych

brak wpływu glikozydów naparstnicy na ogólną śmiertelność w niewydolno-
ści serca. Badanie to przeprowadzono w latach 1991-95, wzięło w nim udział
7788 chorych z rozpoznaną niewydolnością serca i niską frakcją wyrzutową
lewej komory (LVEF <45%). Stwierdzono, iż prawdopodobieństwo zgonu
z powodu zaburzeń rytmu wzrasta o około 13%, ale jednocześnie prawdopo-
dobieństwo zgonu z powodu progresji niewydolności krążenia spada o oko-
ło 20%. Konkludując – śmiertelność ogólna w niewydolności serca nie ulega
zmianie. Odnotowano ponadto wyraźny spadek ilości oraz czasu trwania ho-
spitalizacji i poprawę w zakresie wydolności serca mierzonej wielkością frak-
cji wyrzutowej. Od czasu opublikowania wyników tego badania w 1997 ro-
ku panuje opinia, iż glikozydy naparstnicy co prawda nie przedłużają życia,
ale niewątpliwie poprawiają jego komfort, a naparstnica pozostaje jedynym
lekiem inotropowo dodatnim, który w przewlekłej terapii nie prowadzi do
zwiększenia ryzyka zgonu.
Stężenie lecznicze digoksyny w surowicy krwi wynosi 1-1,5 ng/ml. Aby osią-
gnąć takie stężenie, dorosły człowiek z prawidłową funkcją nerek i wątroby
powinien przyjmować lek przewlekle w małej dawce (0,1-0,25 mg/dobę), nie
przekraczając 0,5 mg/dobę. Objawy zatrucia naparstnicą mogą się pojawić
przy stężeniu leku w surowicy krwi wyższym od 2 ng/ml, a przy stężeniu po-
wyżej 2,6 ng/ml są prawie pewne. Toksyczne działanie glikozydów polega na
silnym zablokowaniu pompy jonowej, co skutkuje zwiększonym wewnątrz-
komórkowym stężeniem jonów sodu oraz zmniejszonym wewnątrzkomór-
kowym stężeniem jonów potasu. Następstwem takiego przesunięcia stężeń
Na
+
/K
+
jest zmniejszenie potencjału komórki i zwiększenie jej skłonności
do samoistnej aktywności elektrycznej.
Kliniczną implikacją powyższych zależności jest wąski zakres działania te-
rapeutycznego glikozydów naparstnicy, czyli niewielki stosunek stężenia tok-
sycznego do stężenia terapeutycznego, wynoszący dla glikozydów 1,5-2,0.
Należy pamiętać, że u osób w wieku podeszłym, a także w różnorodnych sy-
tuacjach klinicznych dochodzi do zmniejszenia ilości elementów kurczliwych
w mięśniu sercowym – innymi słowy zmniejsza się liczba receptorów, czyli
cząsteczek błonowej ATP-azy dla glikozydów. Powoduje to obniżenie grani-
cy toksycznego stężenia glikozydów nasercowych, a to ułatwia wystąpienie
objawów niepożądanych.
Stabilizacja granicy toksyczności dla glikozydów jest zależna od stężenia elek-
trolitów w surowicy krwi. Wysokie stężenie jonów potasu i magnezu zmniejsza,
a wysokie stężenie jonów wapnia zwiększa wrażliwość na naparstnicę.
Preparaty naparstnicy stosowane w praktyce najczęściej, a więc digoksyna
oraz
β-metylodigoksyna wchłaniają się z przewodu pokarmowego w 80-90%.
21

Prawokomorowa niewydolność krążenia może bardzo istotnie zaburzyć pro-
ces wchłaniania – zaleca się więc u tych chorych rozpoczynanie terapii od
dożylnych preparatów naparstnicy.
Szybkość działania glikozydów jest z kolei odwrotnie proporcjonalna do
ich skłonności do wiązania się z białkami osocza. Digoksyna i
β-metylodi-
goksyna wiążą się z nimi w ok. 30-40%, a ich dobowa inaktywacja wynosi ok.
20% – zjawisko kumulacji leku w ustroju jest więc w przypadku tych dwóch
preparatów na średnim poziomie.
Z klinicznego punktu widzenia najważniejsze czynniki zmieniające wrażli-
wość mięśnia sercowego na naparstnicę przedstawiono w tabelach 2 i 3.
22
Tabela 2: Czynniki zwiększające wrażliwość na naparstnicę
• hipokaliemia, hipomagnezemia, hiperkalcemia / zasadowica;
• ostry zawał serca;
• niewydolność nerek*;
• kacheksja z jakiejkolwiek przyczyny (najczęściej choroby nowotworowe);
• przewlekła niewydolność oddechowa (hipoksja) – rozedma płuc, POChP;
• niedoczynnośc tarczycy**;
• niektóre leki:
– diuretyki (głównie furosemid i tiazydy),
– aminy katecholowe, kortykosterydy, insulina,
–
β-adrenolityki, antagoniści kanałów wapniowych
(werapamil, dilitiazem),
– chinidyna i leki z grupy Ia,
– amiodaron,
– heparyna, tetracykliny.
* zmniejszone wydalanie, a co za tym idzie kumulacja leku
** zwolniony metabolizm i w konsekwencji kumulacja leku
Tabela 3: Czynniki zmniejszające wrażliwość na naparstnicę
• hiperkaliemia, hipermagnezemia, hiperkalcemia, hiponatremia / kwasica;
• nadczynność tarczycy;
• leki wzmagające metabolizm wątroby:
– barbiturany,
– fenytoina,
– niesterydowe leki przeciwzapalne.

Gdy poziom kreatyniny w surowicy wzrasta dwukrotnie – czyli do ok. 2,0 mg%
– dobowa dawka naparstnicy powinna być zmniejszona o połowę.
W dawkach leczniczych glikozydy naparstnicy wykazują szereg innych (rza-
dziej podkreślanych) pozytywnych działań:
• nie zmieniają przepływu wieńcowego, a nawet mogą go zwiększać dzię-
ki wydłużeniu fazy rozkurczu, zmniejszeniu ciśnienia późnorozkurczo-
wego w komorach i zwiększeniu objętości wyrzutowej serca;
• zwiększają diurezę poprzez poprawę przepływu nerkowego, a także
zwiększone wydalanie jonów sodu (bezpośredni wpływ na kanaliki ner-
kowe);
• zwiększają nieznacznie siłę skurczową mięśni gładkich oraz mięśni szkie-
letowych.
23
Tabela 4: Główne wskazania do stosowania glikozydów naparstnicy
• zaawansowana zastoinowa niewydolność serca (skurczowa):
III i IV grupa wg NYHA;
• skurczowa niewydolność serca z powiększonym promieniem lewej
komory;
• migotanie przedsionków z przyspieszoną czynnością serca.
Tabela 5: Przeciwwskazania do stosowania glikozydów naparstnicy
• blok przedsionkowo-komorowy II i III stopnia*;
• zespoły preekscytacji (np. WPW);
• kardiomiopatia przerostowa;
• stenoza aortalna;
• restrykcja i/lub konstrykcja serca;
• niewydolność rozkurczowa lewej komory;
• zespół tachykardia-bradykardia**.
* w przypadku bloku p-k I st. zalecana jest duża ostrożność (monitorowanie czasu P-Q)
** stosowanie glikozydów jest dopuszczalne po uprzednim zabezpieczeniu chorego elektrodą czasową
lub stałą stymulacją

Stosowanie glikozydów naparstnicy w ostrym zawale serca od dawna bu-
dziło kontrowersje – uważano, że skoro naparstnica zwiększa siłę skurczu,
to musi też zwiększać zapotrzebowanie energetyczne mięśnia sercowego.
Dzisiaj mamy w swoim arsenale coraz doskonalsze ACE-I, azotany, diure-
tyki, a także
β-adrenolityki wraz z wiedzą o ich przydatności w leczeniu nie-
wydolnego serca. Wykorzystując możliwości tych leków sięgamy jednak nie-
rzadko po naparstnicę. Wiadomo, że w niewydolnym sercu dochodzi do
powiększenia promienia lewej komory. Zwiększenie w związku z tym objęto-
ści skurczowej i rozkurczowej powoduje wzrost napięcia skurczowego, a co
za tym idzie wzrost zapotrzebowania energetycznego mięśnia sercowego –
mówi o tym prawo Laplace’a. Jednak wzrost inotropizmu po zastosowaniu
glikozydów powoduje lepsze opróżnianie lewej komory, co skutkuje zmniej-
szeniem jej promienia, a więc również i zmniejszeniem wydatku energetycz-
nego serca.
Zastosowanie glikozydów naparstnicy w niewydolnym sercu w ostrej fazie
zawału, ma więc swoje uzasadnienie patofizjologiczne, niemniej ze wszech
miar pożądana jest rozwaga ze strony lekarza i rozsądna decyzja komu i dla-
czego warto naparstnicę podać.
Zapamiętaj!
1. W sercu wydolnym glikozydy naparstnicy nie działają inotropowo i ich po-
danie naraża pacjenta jedynie na działania niepożądane.
2. Wąski zakres działania terapeutycznego glikozydów powoduje częste działa-
nia niepożądane. Hipokaliemia ułatwia ich wystąpienie.
3. Idealnym pacjentem do przewlekłej terapii glikozydami naparstnicy jest
chory z zastoinową niewydolnością serca i utrwalonym migotaniem przed-
sionków.
4. W uzasadnionych przypadkach naparstnica może być zastosowana w ostrej
fazie zawału serca.
5. Gdy poziom kreatyniny w surowicy wzrasta dwukrotnie (ok. 2,0 mg%), do-
bowa dawka naparstnicy powinna być zmniejszona o połowę.
Polecane lektury:
E. Braunwald: A Textbook of Cardiovascular Medicine; W. B. Saunders Co,
Philadelphia, 1997.
L. Giec, Z. S. Herman: Farmakoterapia chorób układu sercowo-naczyniow-
ego; PZWL, 1998.
24

J. Korewicki: Niewydolność serca – zarys patofizjologii i zasady leczenia; Me-
dical Science Review, 1999.
The Task Force of the Working Group on Heart Failure of the European So-
ciety of Cardiology Guidelines: The treatment of heart failure; Eur Heart J,
1997; 18: 736-753.
W. S. Colucci, E. Braunwald: Atlas niewydolności serca; VIA MEDICA,
2001.
25
III.
LEKI MOCZOPĘDNE
Andrzej Światowiec, Iwonna Grzywanowska-Łaniewska
WSTĘP
Z definicji lek moczopędny jest to taki preparat, który działając bezpo-
średnio na nerki, zwiększa diurezę (objętość moczu).
Do połowy XX wieku znana była tylko jedna grupa klinicznie użytecznych
diuretyków – były to organiczne związki rtęci, których właściwości moczo-
pędne zostały odkryte w 1919 roku. Jednakże znaczna toksyczność tych
związków oraz możliwość jedynie pozajelitowego ich stosowania sprawiły,
że ich przydatność terapeutyczna okazała się niewielka. Nową erę w leczeniu
moczopędnym zapoczątkowało wprowadzenie do terapii acetazolamidu (w
roku 1953), pierwszego diuretyku stosowanego doustnie. Od tamtej pory
zsyntetyzowano setki diuretyków, z których do dnia dzisiejszego w codzien-
nej praktyce klinicznej stosujemy zaledwie kilkanaście z nich.
Spośród różnych podziałów leków moczopędnych, najwłaściwszy z klinicz-
nego punktu widzenia wydaje się podział uwzględniający miejsce działania
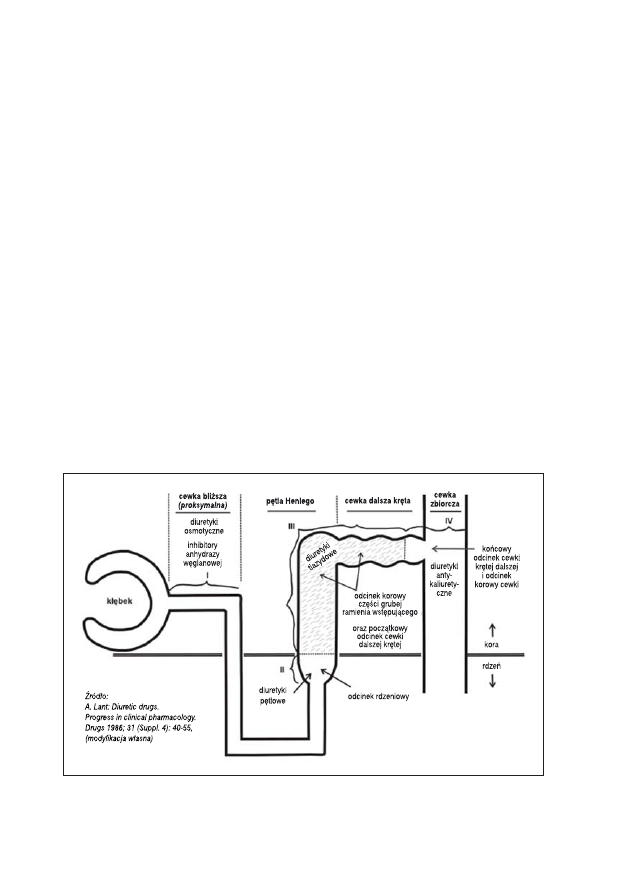
diuretyku na poziomie nefronu (tab. 1, ryc. 1).
26
Rycina 1: Schemat nefronu z czterema głównymi miejscami, w których diuretyki hamują zwrotne
wchłanianie sodu
Działanie wszystkich leków moczopędnych polega przede wszystkim na
hamowaniu wchłaniania sodu w określonych częściach nefronu. Siła działa-
nia konkretnego leku moczopędnego zależy z jednej strony od jego stężenia
w odpowiedniej dla niego części nefronu, z drugiej zaś, od stężenia sodu
w cewkach nerkowych. Hiponatremia w znacznym stopniu znosi moczopęd-
ny efekt działania diuretyków.
Siłę działania natriuretycznego określa się podając, jaki procent przesą-
czonego sodu, a w ślad za nim obligatoryjnie wody, ulega wydaleniu z mo-
czem przy maksymalnym działaniu danego leku moczopędnego u zdrowego
człowieka. Możliwy jest zatem jeszcze inny (równie istotny klinicznie) po-
dział diuretyków – podział według siły działania natriuretycznego (tab. 2).
Wiedza o punkcie uchwytu leku moczopędnego na poziomie nefronu
umożliwia odpowiedzialne kojarzenie diuretyków, co pozwala zwiększyć ich
Tabela 1: Podział leków moczopędnych uwzględniający miejsce działania na poziomie nefronu
I
cewka bliższa (proksymalna)
inhibitory anhydrazy węglanowej
diuretyki osmotyczne
II
odcinek rdzeniowy części grubej
diuretyki pętlowe
ramienia wstępującego pętli Henlego
III
odcinek korowy części prostej
diuretyki tiazydowe
cewki dalszej
diuretyki tiazydopodobne
IV odcinek korowy cewki zbiorczej
diuretyki antykaliuretyczne
Tabela 2: Podział diuretyków według siły działania natriuretycznego
GRUPA LEKÓW
SUBSTANCJA
SIŁA
DZIAŁANIA
diuretyki antykaliuretyczne
spironolakton,
amilorid, triamteren
diuretyki osmotyczne
mannitol
ok. 5%
inhibitory anhydrazy
acetazolamid
węglanowej
diuretyki tiazydowe
hydrochlorotiazyd
5-10%
diuretyki tiazydopodobne
chlortalidon, indapamid
diuretyki pętlowe
furosemid, torasemid,
kwas etakrynowy
>15%*
* wg niektórych autorów nawet do 30%
27

efekt moczopędny oraz zmniejszyć ryzyko wystąpienia przynajmniej niektó-
rych objawów ubocznych. Znakomitym przykładem takiego kojarzenia le-
ków moczopędnych jest jednoczesne podawanie diuretyku pętlowego (np.
furosemidu) i antykaliuretycznego (np. spironolaktonu). Diuretyk pętlowy
zwiększa napływ jonów sodu do części dystalnej nefronu, gdzie podlegają
one wymianie na jony potasowe i/lub wodorowe – tam „czeka” już diuretyk
antykaliuretyczny, który hamuje tę wymianę, czego efektem końcowym jest
zwiększenie natriurezy i zmniejszenie kaliurezy. Unikamy w ten sposób naj-
większego i najczęściej występującego niebezpieczeństwa leczenia moczo-
pędnego – hipokaliemii wraz z jej konsekwencjami.
CHARAKTERYSTYKA GRUP LEKÓW
Inhibitory anhydrazy węglanowej
Diuretyki należące do tej grupy wykazują nie tylko słabe działanie moczo-
pędne (wydalanie 2-4% całkowitej ilości jonów sodu i wody filtrowanych
w kłębkach), ale i krótkotrwałe – utrzymuje się ono jedynie 3-4 dni, szybko
rozwija się kwasica metaboliczna oraz znaczna hipokaliemia. Oczywiste jest
więc, że w miarę wprowadzania nowszych grup leków moczopędnych, inhibi-
tory anhydrazy węglanowej całkowicie straciły na znaczeniu.
Obecnie wykorzystywane jest ich pozanerkowe działanie, polegające na
zmniejszaniu wytwarzania cieczy wodnistej oka, a co za tym idzie obniżaniu
ciśnienia śródgałkowego (jaskra). Ponadto znajdują jeszcze zastosowanie ja-
ko leczenie wspomagające w stanach padaczkowych oraz w chorobach prze-
biegających z demielinizacją włókien nerwowych rdzenia.
Diuretyki osmotyczne
Są to małocząsteczkowe związki, które w kłębkach nerkowych bardzo ła-
two przenikają z osocza do przesączu kłębowego, a potem nie ulegają wchła-
nianiu zwrotnemu w cewkach. Dzięki tej właściwości powodują wysokie ci-
śnienie osmotyczne płynu cewkowego już w cewce bliższej (proksymalnej),
co uniemożliwia tam fizjologiczne (aż 66% całości przesączanego Na i obli-
gatoryjnie wody) wchłanianie jonów sodu i chloru. W konsekwencji bardzo
duże ilości płynu cewkowego przedostają się do dalszych odcinków nefronu,
gdzie nie mogą już zostać wchłonięte i zostają wydalone jako mocz ostatecz-
ny. W wyniku tak powstałej diurezy osmotycznej, z ustroju wydalone zostają
duże ilości jonów Cl
–
, K
+
, H
+
, Ca
2+
i Mg
2+
, a przede wszystkim Na
+
. W sy-
tuacji, gdy leki z tej grupy (najczęściej jest to mannitol) stosowane są w du-
28

żych dawkach i przez dłuższy czas, stosunek wydalanej wody do wydalanych
jonów Na staje się większy niż jest w osoczu – dochodzi do hipernatremii
i ciężkiego odwodnienia hipertonicznego. Ponadto zwiększone wydalanie jo-
nów K
+
i H
+
doprowadza do ciężkiej hipokaliemii i zasadowicy metabolicz-
nej.
Ze względu na możliwość tak ciężkich powikłań oraz gwałtowne działa-
nie, mannitol stosowany jest rzadko. Wskazania do jego użycia zostały za-
wężone do ostrych zatruć (głównie barbituranami i salicylanami) i leczenia
obrzęku mózgu. Znajduje też niekiedy zastosowanie jako lek zapobiegający
ostrej niewydolności nerek u chorych poddawanych długotrwałym zabiegom
chirurgicznym.
Głównym przeciwwskazaniem do stosowania mannitolu jest lewokomoro-
wa niewydolność krążenia – wskutek zwiększenia ciśnienia osmotycznego
płynów pozakomórkowych może on doprowadzić do zwiększenia objętości
krwi krążącej i przyczynić się do powstania obrzęku płuc. Przeciwwskazane
jest również stosowanie mannitolu u chorych z niewydolnością nerek. Jedno-
razowa dawka mannitolu, to 250 ml 20% roztworu podanego we wlewie do-
żylnym. Dawkę można powtórzyć kilkakrotnie w ciągu doby, w zależności
od konkretnej sytuacji klinicznej.
Diuretyki pętlowe
Nazywane też w piśmiennictwie diuretykami pętli Henlego, są bez wątpie-
nia najsilniej działającymi lekami moczopędnymi. Leki należące do tej gru-
py (bumetanid, furosemid, torasemid, kwas etakrynowy) różnią się dość
istotnie budową chemiczną, niemniej wszystkie działają w tym samym miej-
scu w nefronie, w podobny sposób i z porównywalnym efektem. Głównym
przedstawicielem tej grupy jest furosemid, który hamuje wchłanianie zwrot-
ne sodu, chloru i potasu w stosunku molowym 1:2:1. Podany dożylnie działa
już po kilku minutach, szczyt działania osiąga po ok. 30 minutach i działa do
3 godzin. Podany doustnie zaczyna działać po ok. 30 min., szczyt działania
osiąga po 2 godzinach, a kończy działanie po ok. 6 godzinach. Znajduje więc
zastosowanie w tych ostrych i przewlekłych stanach chorobowych, które
przebiegają z retencją sodu i wody (tab. 3).
Dobowa dawka doustna furosemidu wynosi zwykle 40-120 mg. Często sto-
sowane są znacznie większe dawki dożylne sięgające kilkuset miligramów
(chociażby w niewydolności nerek, czy też w celu wymuszenia obfitej diure-
zy w ostrych zatruciach egzogennych). Należy jednak pamiętać, aby tak du-
że dawki leku podawać we wlewach kroplowych nie przekraczając 5 mg/min.
– z uwagi na zagrożenie trwałą utratą słuchu (ototoksyczność jest powikła-
29
niem typowym dla wszystkich diuretyków pętlowych). Dożylna dawka furo-
semidu podawanego w jednorazowym bolusie nie powinna przekraczać
80 mg. Przeciętne dobowe dawki kwasu etakrynowego wynoszą 25-100 mg,
bumetanidu 0,5-4 mg, torasemidu 5-50 mg, a nawet 100 mg. Torasemid jest
najnowszym diuretykiem pętlowym i różni się od innych leków tej grupy tym,
że metabolizuje się głównie w wątrobie, co sprawia, że jego czas działania
wynosi aż 12 godzin.
Najbardziej ototoksycznym diuretykiem pętlowym jest kwas etakrynowy,
z tego też powodu jest on stosowany rzadko. Zagrożenie ototoksycznością
wzrasta przy jednoczesnym stosowaniu diuretyków pętlowych i antybioty-
ków aminoglikozydowych. Zaburzenia metaboliczne występują rzadziej niż
podczas stosowania diuretyków tiazydowych. Diuretyki pętlowe są bez-
względnie przeciwwskazane w pierwszym trymestrze ciąży.
Diuretyki antykaliuretyczne
Leki oszczędzające potas dzielą się na dwie grupy:
• antagoniści aldosteronu (aldakton, spironolakton);
• bezpośrednie inhibitory wydzielania potasu (amilorid, triamteren).
Obie grupy leków działają w tym samym miejscu nefronu – w końcowej
części cewki krętej dalszej i odcinku korowym cewki zbiorczej. Jednakowy
30
Tabela 3: Główne wskazania do stosowania diuretyków pętlowych
• ostra niewydolność lewej komory serca (OBRZĘK PŁUC);
• ostra niewydolność nerek*;
• obrzęk mózgu;
• nadciśnienie tętnicze**;
• przewlekła niewydolność serca;
• przewlekła niewydolność nerek;
• niewyrównana marskość wątroby;
• zespół nerczycowy.
* furosemid wykorzystywany jest tutaj jako swoisty starter diurezy w początkowej fazie niewydolności
(ale należy pamiętać o uprzednim nawodnieniu chorego i wykluczeniu przeszkody mechanicznej
w drogach moczowych)
** tylko ze wskazań nagłych, w celu szybkiego obniżenia ciśnienia systemowego (w terapii przewlekłej
brak uzasadnienia, chyba że nadciśnieniu towarzyszy niewydolność serca i/lub nerek)

jest też efekt ich działania – stosunkowo słaby diuretyczny i natriuretyczny
z jednoczesnym hamowaniem wydalania jonów potasu, wodoru i magnezu.
Wydalanie jonów potasu nigdy nie jest całkowicie zahamowane, a tylko
zmniejszone. Podstawą podziału na dwie grupy jest różny mechanizm działa-
nia. Amilorid i triamteren hamują reabsorpcję jonów sodu bezpośrednio
w komórkach nabłonkowych cewki, co automatycznie blokuje wychodzenie
z komórki jonów potasowych i wodorowych. Antagoniści aldosteronu blo-
kują natomiast cytoplazmatyczny receptor aldosteronowy, uniemożliwiając
w ten sposób powstanie specyficznego mRNA będącego nośnikiem infor-
macji dla syntezy białek transportujących Na
+
i K
+
. Ponieważ synteza białek
jest procesem wymagającym czasu, jasne staje się znane w praktyce opóź-
nienie w działaniu tej grupy leków i utrzymywanie się tego działania jeszcze
po zaprzestaniu leczenia. Trwa to zwykle 2-4 dni.
Aldosteron odgrywa kluczową rolę w patogenezie niewydolności serca,
istotną w patologii mięśnia sercowego w przebiegu nadciśnienia tętnicze-
go. Jest jednym z najważniejszych czynników wpływających na retencję so-
du i wody. W początkowym etapie upośledzenia funkcji mięśnia sercowego
wtórny hiperaldosteronizm jest zjawiskiem kompensacyjnym. Ostatecznie
staje się jednak czynnikiem sprawczym dalszego uszkodzenia serca i po-
głębia objawy jego niewydolności. Hiperaldosteronizm wiąże się z istot-
nym statystycznie wzrostem śmiertelności w przebiegu niewydolności ser-
ca. Również w nadciśnieniu tętniczym przebiegającym z wtórnym
hiperaldosteronizmem stanowi on czynnik ryzyka zwiększonej śmiertelno-
ści – niezależny od wysokości ciśnienia tętniczego. Aldosteron zwiększając
retencję sodu i wody zwiększa obciążenie serca. Obniżając stężenie jonów
K
+
i Mg
2+
sprzyja powstawaniu zaburzeń rytmu serca. Jest jednym z czyn-
ników przebudowy samego mięśnia sercowego – zwiększając zawartość ko-
lagenu w miokardium przyczynia się do zwiększenia sztywności ścian, a co
za tym idzie zmniejszenia podatności mięśnia sercowego i w konsekwencji
dysfunkcji rozkurczowej.
Z chwilą wprowadzenia do terapii inhibitorów enzymu konwertującego
angiotensynę (ACE-I), pojawiły się nadzieje na rozwiązanie problemu wtór-
nego hiperaldosteronizmu. Okazało się jednak, że normalizacja stężenia al-
dosteronu w surowicy po zastosowaniu ACE-I ma charakter przejściowy i po
ok. 3 miesiącach leczenia jego stężenie zaczyna wyraźnie wzrastać, a po roku
obserwuje się takie wartości, jak przed włączeniem ACE-I. Dlaczego tak się
dzieje nie wiadomo – rozważane jest zjawisko tachyfilaksji, zjawisko „wymy-
kania się” aldosteronu spod kontroli układu R-A-A i wiele innych.
Spironolakton jest antagonistą aldosteronu. Budowa jego cząsteczki che-
micznej jest bardzo zbliżona do digoksyny, w związku z czym posiada słaby,
31

ale jednak dodatni wpływ inotropowy na serce. Wydłuża ponadto okres re-
frakcji (niepobudliwości) komórek układu bodźcoprzewodzącego serca oraz
czas trwania potencjału błonowego – możemy więc mówić o ujemnym efek-
cie chronotropowym. W badaniach na modelach zwierzęcych hamuje gro-
madzenie się kolagenu w mięśniu sercowym oraz jego włóknienie. Nie ma
jednoznacznej odpowiedzi na pytanie o miejsce antagonistów aldosteronu
w leczeniu niewydolności serca, jak również o to, którzy pacjenci odniosą
korzyść z ich przyjmowania. Nie udowodniono również, że hamowanie hi-
peraldosteronizmu przedłuża życie. Wiadomo jednak, że dołączenie spiro-
nolaktonu do wcześniejszej terapii (ACE-I, naparstnica, diuretyk pętlowy),
powoduje zwiększenie diurezy, natriurezy, redukcję ciężaru ciała i poprawę
kliniczną u 80% pacjentów z zaawansowaną niewydolnością serca oraz 30%
redukcję śmiertelności w tej grupie chorych (badanie RALES).
Dotychczasowe doświadczenia kliniczne pokazują, iż łączne stosowanie
antagonistów aldosteronu i ACE-I jest bezpieczne pod warunkiem, że pa-
cjent ma wydolne nerki, a stężenie potasu jest systematycznie kontrolowa-
ne (groźba hiperkaliemii). Pożądany efekt osiąga się stosując zazwyczaj do-
bową dawkę spironolaktonu 25-50 mg, niekiedy 100 mg/dobę. Czas trwania
efektu diuretycznego pojedynczej dawki spironolaktonu wynosi 8-12 h.
Wpływ hipotensyjny spironolaktonu jest umiarkowany i lek ten nie jest stoso-
wany w terapii niepowikłanego nadciśnienia tętniczego. Istnieją preparaty zło-
żone będące połączeniem spironolaktonu i hydrochlorotiazydu – znajdują one
zastosowanie w leczeniu nadciśnienia, ale w Polsce nie są rozpowszechnione.
Szczególnym zastosowaniem spironolaktonu jest pierwotny hiperaldostero-
nizm, gdzie lek ten stosowany jest w dawkach sięgających 300-400 mg/dobę.
Główne objawy niepożądane w trakcie leczenia spironolaktonem to impotencja
i ginekomastia u mężczyzn oraz bolesność piersi u kobiet.
Wspomniane wcześniej preparaty – amilorid i triamteren – mają podob-
ną siłę działania moczopędnego co antagoniści aldosteronu i taki sam wpływ
na cewkowe wydalanie jonów sodu, potasu i wodoru. W żaden sposób nie
korelują z poziomem aldosteronu. Amilorid zwiększa wydalanie jonów wap-
nia, w związku z czym przeciwwskazaniem do jego stosowania jest kamica
nerkowa i osteoporoza. Triamteren zaburza metabolizm glukozy (hiperglike-
mia) oraz zwiększa poziom kwasu moczowego w surowicy (hiperurykemia).
Oba leki ujawniają swoje działanie po ok. 2 godz. od podania, utrzymuje się
ono do 10-12 godzin. Wywierają umiarkowany efekt hipotensyjny. Zwykle
są kojarzone z innymi lekami moczopędnymi i występują jako preparaty zło-
żone, najczęściej w połączeniu z hydrochlorotiazydem.
32

Duże zainteresowanie wzbudza ostatnio triamteren. W badaniach na izo-
lowanych tkankach wykazywał działanie inotropowo dodatnie na serce,
a jednocześnie silne działanie antyarytmiczne w mechanizmie wydłużania
potencjału czynnościowego komórek mięśnia sercowego. Siła efektu anty-
arytmicznego porównywalna była z amiodaronem. Diuretyki oszczędzające
potas są przeciwwskazane podczas ciąży i w okresie karmienia piersią.
Diuretyki tiazydowe i tiazydopodobne
Diuretyki te stanowią niejednorodną grupę, do której zalicza się ponad
sto preparatów, ale w dzisiejszej praktyce klinicznej zastosowanie znajdują
tylko nieliczne.
We wszystkich lekach tej grupy występuje wspólny element budowy –
trzon, którym jest pierścień benzenowy z podstawioną grupą sulfamylową.
Różnica polega na tym, że w przypadku tiazydów, trzon ten jest wbudowany
w cząsteczkę benzotiodiazyny, a w przypadku leków tiazydopodobnych, wbu-
dowywany jest w różne inne struktury. Wszystkie te leki łączy wspólne miej-
sce działania w nefronie, różni zaś siła i czas działania moczopędnego po-
szczególnych preparatów.
Spośród wielu tiazydów stosowanych w przeszłości i obecnie (chlorotia-
zyd, benzotiazyd, politiazyd, bendroflumetiazyd, metyklotiazyd), lekiem naj-
lepiej poznanym i stosowanym najpowszechniej zarówno w Europie, jak
i w USA jest hydrochlorotiazyd. Jego dobowa dawka wynosi zazwyczaj 12,5-
25 mg, czasem 50 mg, lek jest podawany 1
×/dobę, a czas jego działania mo-
czopędnego ocenia się na 18-24 h.
Najlepiej poznanym i najpowszechniej od lat stosowanym w świecie diu-
retykiem tiazydopodobnym jest chlortalidon, zalecany zazwyczaj w dawce
dobowej 12,5-50 mg. Czas trwania jego działania diuretycznego waha się od
24 do 72 godz. i jest podawany zwykle 1
× na 24 lub 48 h.
Interesującym preparatem tiazydopodobnym jest indapamid, który oprócz
typowego dla tiazydów działania diuretycznego, zmniejsza reaktywność na-
czyń i w konsekwencji opór obwodowy. Dzięki tym właściwościom jest sku-
tecznym lekiem hipotensyjnym już w bardzo niewielkiej dawce dobowej
(1,25 mg), a efekt hipotensyjny utrzymuje się przez 24 h. Prawdopodobnie
dzięki tak minimalnej dawce rzadko powoduje zaburzenia lipidowe, będące
zwykle częstym objawem ubocznym podczas stosowania tiazydów. Udoku-
mentowano ponadto, że w dawce 2,5 mg/dobę powoduje regresję przerostu
lewej komory.
33

Diuretyki tiazydowe i tiazydopodobne mają swoją ugruntowaną pozycję
w kardiologii, a w szczególności w farmakoterapii nadciśnienia tętniczego.
Potęgują działanie wszystkich innych leków hipotensyjnych. Jest to poza tym
jedyna grupa leków moczopędnych wykorzystywana w monoterapii nadci-
śnienia. W dużym programie badawczym Systolic Hypertension in the Elderly
(SHEP) przeprowadzonym w 1991 roku, chlortalidon w dawce dobowej 12,5
mg skutecznie obniżał ciśnienie tętnicze u prawie 50% badanych. Podobne
rezultaty osiągnięto stosując hydrochlorotiazyd w dawce 25 mg/dobę.
Uważa się, że skuteczność diuretyków tiazydowych jako pojedynczego le-
ku jest zbliżona do skuteczności hipotensyjnej leków innych klas. Przy czym
lepiej na diuretyki reagują chorzy w wieku starszym oraz rasy czarnej – u pa-
cjentów młodych monoterapię nadciśnienia powinno się jednak rozpoczy-
nać od leków innych niż diuretyki.
Trzeba pamiętać, iż monoterapię diuretykiem tiazydowym można prowa-
dzić tylko u tych chorych z nadciśnieniem tętniczym, którzy mają wydolne
nerki, ponadto należy wykazać się cierpliwością – stwierdzono, iż pełne dzia-
łanie hipotensyjne diuretyków może ujawnić się dopiero po 4 tygodniach.
Jeżeli decydujemy się na monoterapię, to z wykorzystaniem małych dawek
leku. Badania kliniczne dowodzą, że zwiększanie dawki diuretyku nie ma
istotnego wpływu na dalsze obniżanie ciśnienia, zwiększa natomiast ryzyko
wystąpienia objawów niepożądanych. Rozwiązaniem jest wtedy włączenie
do terapii drugiego leku hipotensyjnego – najczęściej jest to (w zależności
od obrazu klinicznego) antagonista kanałów wapniowych,
β-adrenolityk lub
inhibitor enzymu konwertującego angiotensynę (ACE-I).
Reakcja ciśnienia tętniczego na podawane diuretyki tiazydowe zależy
przede wszystkim od aktywności reninowej osocza danego pacjenta. Chorzy
z wyjściowo niską aktywnością układu R-A-A, u których po podaniu diurety-
ku wzrost aktywności reniny jest niewielki, dobrze reagują na te leki. Wyso-
ka aktywność reninowa osocza skutkuje utrzymywaniem się znacznego opo-
ru obwodowego. Postępowaniem z wyboru jest wtedy zablokowanie układu
R-A-A przez włączenie do terapii ACE-I.
Diuretyki tiazydowe i tiazydopodobne z uwagi na tę samą budowę rdze-
nia aktywnego oraz to samo miejsce działania w nefronie, mogą powodować
wystąpienie jednakowych efektów niepożądanych: hiponatremię, hipochlo-
remię, hipokaliemię, hipomagnezemię, hiperkalcemię, zasadowicę oraz hi-
perurykemię. Diuretyki tiazydowe i tiazydopodobne są przeciwwskazane
w ciąży i w okresie karmienia piersią.
34
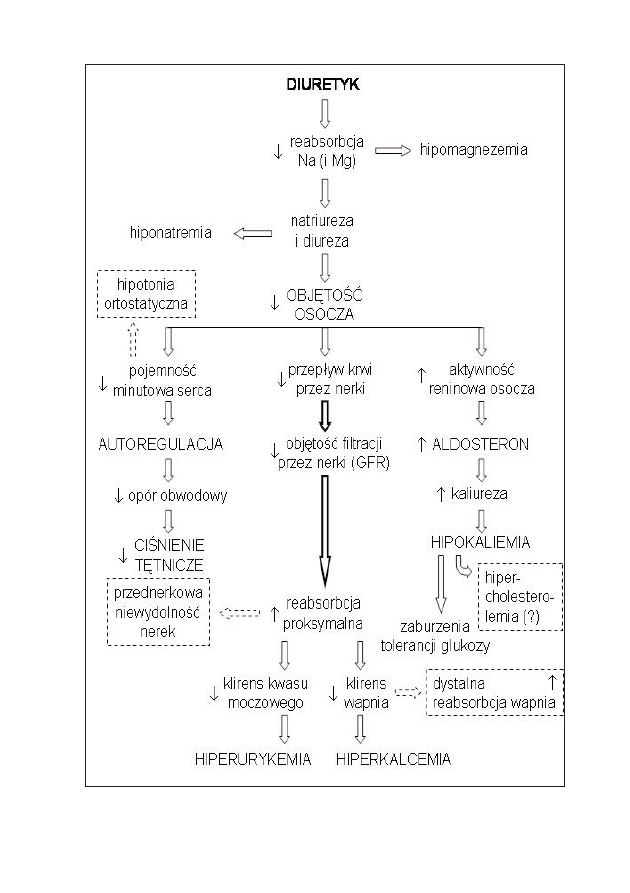
35
Rycina 2: Schemat działania leków moczopędnych (tiazydów i diuretyków pętlowych) – mechanizmy
niekorzystnych następstw biochemicznych i metabolicznych

UWAGI PRAKTYCZNE
Oporność na leczenie
Leczenie moczopędne ma swoje zalety, wady i ograniczenia. Dobra znajo-
mość farmakokinetyki leków pozwala minimalizować niektóre niepożądane
objawy, nigdy ich jednak w całości nie wyeliminuje. Jednym ze zjawisk, któ-
re do pewnego stopnia możemy modyfikować jest oporność na leczenie na-
triuretyczne. Istnieje wiele przyczyn tej oporności – najważniejsze z nich wy-
dają się być następujące:
• nadmierna podaż sodu w diecie – każdy pacjent, u którego rozpoczyna-
my leczenie moczopędne, powinien być poinformowany o konieczności
ograniczenia soli kuchennej w codziennych posiłkach;
• pokarm zaburza wchłanianie i dostępność biologiczną diuretyków – leki
powinny być zażywane o stałych porach dnia i nie w trakcie posiłków;
• u chorych z upośledzeniem funkcji nerek (poziom kreatyniny w surowi-
cy >2,5 mg% i/lub klirens kreatyniny <30 ml/min.) tiazydy nie są sku-
teczne – konieczne są diuretyki pętlowe;
• niesteroidowe leki przeciwzapalne (w tym powszechnie stosowana i zale-
cana w kardiologii aspiryna) osłabiają działanie większości diuretyków.
Objawy niepożądane
Mechanizm większości objawów niepożądanych występujących podczas
stosowania diuretyków jest następstwem swoistej aktywności farmakodyna-
micznej leku. Również w tym obszarze możliwa jest ingerencja lekarza, jako
że objawy niepożądane są wprost proporcjonalne do dawki leku i czasu jego
stosowania. Wykazano na przykład, że kiedy podawano hydrochlorotiazyd
w dawce 50 mg co 12 godzin, hipokaliemia była o wiele bardziej nasilona niż
wówczas, gdy ten sam lek podawano w dawce 100 mg 1
× na dobę. W bada-
niu Multiple Risk Factor Intervention Trial (MRFIT) przy podawaniu długo
działającego chlortalidonu obserwowano trzykrotnie częściej hipokaliemię,
niż przy podaży hydrochlorotiazydu. Zauważmy jednak, że w żadnym z tych
badań nie udało się uniknąć hipokaliemii – jest to po prostu niemożliwe. Ist-
nieje tylko jedna droga przeciwdziałania efektom ubocznym – stosowanie
najmniejszej skutecznej dawki leku.
36

• Hipokaliemia
Sekrecja potasu jest tym większa, im większe jest stężenie sodu w płynie
docierającym do cewki krętej dystalnej i cewki zbiorczej. Diuretyki tiazydo-
we oraz pętlowe właśnie w takim mechanizmie osiągają swoją skuteczność
natriuretyczną. Wzmożone wydalanie potasu z moczem jest więc zjawiskiem
nieuniknionym podczas terapii tymi lekami. Zauważono, że w miarę trwa-
nia terapii (zwykle po kilku miesiącach) wydalanie potasu z moczem, w spo-
sób naturalny ulega zmniejszeniu – zaczynają działać mechanizmy adapta-
cyjne, które nie zostały jeszcze do końca poznane. Sugeruje się stopniowe
zmniejszanie wydzielania aldosteronu, który jest w dużej mierze odpowie-
dzialny, za sekrecję potasu. Nie budzi natomiast wątpliwości fakt, że stopień
hipokaliemii zależy od dawek stosowanych leków. Stwierdzono, że stężenie
potasu w surowicy <3,5 mmol/l występuje u 20% leczonych hydrochlorotia-
zydem w dawce dobowej
≥50 mg oraz u 5-10% leczonych dawką 12,5-25
mg/dobę.
Od dawna znana jest rola hipokaliemii w inicjowaniu komorowej aktyw-
ności ekotopowej, prowadzącej do zaburzeń rytmu i nagłego zgonu serco-
wego. W dużych, randomizowanych badaniach klinicznych, w których diu-
retyki były pierwszym, a czasem jedynym stosowanym lekiem, częstość
nagłych zgonów albo się nie zmniejszała (jak oczekiwano w związku z nor-
malizacją ciśnienia), albo wzrastała. W dwóch z tych badań ryzyko nagłego
zgonu było niemal dwukrotnie większe u pacjentów, którzy przyjmowali du-
że dawki tiazydów, w porównaniu z leczonymi mniejszymi dawkami tiazy-
dów w połączeniu z lekami oszczędzającymi potas. Dodatkowe czynniki, jak
przerost mięśnia lewej komory, niedokrwienie mięśnia sercowego, czy też
przyjmowanie glikozydów naparstnicy (i wiele innych), na które nakłada się
hipokaliemia – potęgują zagrożenie arytmią komorową.
Jedynym wyjściem z sytuacji jest systematyczna kontrola jonogramu i su-
plementacja potasu, najlepiej w postaci chlorku potasu. Często potas poda-
wany jest dożylnie – wyłącznie we wlewach kroplowych. Pożądane jest po-
nadto ograniczenie w diecie sodu i spożywanie pokarmów bogatych w potas.
Kojarzenie diuretyków pętlowych i tiazydowych z
β-adrenolitykami, a przede
wszystkim z inhibitorami konwertazy (ACE-I) zmniejsza zagrożenie hipo-
kaliemią. Zawsze warto rozważyć możliwość dołączenia do terapii diuretyku
antykaliuretycznego.
• Hipomagnezemia
Niemal zawsze towarzyszy hipokaliemii, o czym nie zawsze pamiętamy.
Powodowana jest przede wszystkim przez diuretyki pętlowe oraz duże daw-
37

ki diuretyków tiazydowych (umiarkowane dawki tiazydów rzadko są przy-
czyną hipomagnezemii). Niski poziom magnezu może być przyczyną zabu-
rzeń rytmu, nie poddających się leczeniu lekami antyarytmicznymi, ani nie
ustępujących po uzupełnieniu potasu! Postępowaniem z wyboru jest suple-
mentacja. W zależności od potrzeb, preparaty magnezu podawane są doust-
nie (najlepiej w postaci węglanu magnezu) lub we wlewach kroplowych.
Zaburzenia metaboliczne
• Hiperlipidemia
Pierwsze doniesienia o hipercholesterolemii, powodowanej przez diurety-
ki tiazydowe, pojawiły się już na początku lat 60-tych. Od tamtej pory wiele
badań potwierdziło niekorzystny wpływ tiazydów na gospodarkę lipidową.
Stwierdzono ponadto, że diuretyki pętlowe i oszczędzające potas nie wpły-
wają w sposób istotny na profil lipidowy.
W przeprowadzonej metaanalizie wszystkich kontrolowanych i nie kon-
trolowanych badań klinicznych, opublikowanych w latach 1966-93, stwier-
dzono, że diuretyki tiazydowe i tiazydopodobne w dawkach większych niż
odpowiednik 50 mg hydrochlorotiazydu, powodują istotne statystycznie
zmiany stężeń badanych lipidów. Wzrost stężeń dotyczył cholesterolu całko-
witego, frakcji LDL oraz trójglicerydów – nie zaobserwowano istotnych
zmian stężeń frakcji HDL cholesterolu. W tej samej analizie stwierdzono, iż
stężenia cholesterolu ulegają obniżeniu wraz z upływem czasu (trwaniem le-
czenia moczopędnego). Znane badanie Treatment of Mild Hypertension Stu-
dy (TOMHS, 1996 rok) z chlortalidonem potwierdziło jednak niekorzystny,
utrzymujący się przez 48 miesięcy, wpływ leku na profil lipidów. Są to bardzo
istotne i niepokojące dane, gdyż niekorzystny wpływ diuretyków na metabo-
lizm lipidów, może zmniejszać korzyść terapii hipotensyjnej, w odniesieniu
do choroby niedokrwiennej serca. Z drugiej strony wykazano, że skuteczne
obniżenie ciśnienia tętniczego (oparte na monoterapii tiazydami), zmniej-
sza zachorowalność na chorobę niedokrwienną serca i ostre incydenty wień-
cowe u pacjentów z nadciśnieniem tętniczym i nieprawidłowym profilem li-
pidowym. Mechanizm zaburzeń lipidowych powodowanych przez diuretyki
nie jest znany. Wiadomo, że niekorzystne zmiany stężenia cholesterolu cał-
kowitego korelują z obniżoną tolerancją glukozy, a ta z kolei z hipokaliemią.
• Zaburzenia tolerancji glukozy i oporność na insulinę
Niektóre leki moczopędne (tiazydy, tiazydopodobny chlortalidon i oszczę-
dzający potas triamteren) upośledzają tolerancję glukozy, wyrażającą się
38

wzrostem glikemii na czczo i patologiczną krzywą glikemii po obciążeniu
glukozą. Utrudniają ponadto kontrolę jawnej cukrzycy i wywołują oporność
na insulinę. Podobnie jak w przypadku innych objawów ubocznych, zaburze-
nia te są ściśle powiązane z wielkością dobowych dawek leków. Podczas sto-
sowania niskich dawek odpowiadających 12,5 mg hydrochlorotiazydu, wyżej
wspomnianych efektów nie obserwuje się prawie wcale.
Znaczenie wywoływanych przez diuretyki działań diabetogennych nie jest
do końca jasne. W dużych kontrolowanych badaniach klinicznych nie stwier-
dzono, aby u chorych przyjmujących leki moczopędne, ryzyko wystąpienia
cukrzycy było większe, niż u chorych leczonych lekami hipotensyjnymi inny-
mi niż diuretyki. Niemniej, inne badania dowodzą, iż hiperinsulinemia jest
niezależnym czynnikiem ryzyka choroby niedokrwiennej serca. Co więcej,
niektórzy badacze obserwowali wzrost śmiertelności i progresję neuropatii
cukrzycowej, związane ze stosowaniem diuretyków u chorych na cukrzycę.
Jak widać z powyższych rozważań, opinie badaczy co do znaczenia diurety-
ków w przebiegu cukrzycy są rozbieżne. Pewne jest jedno – ich stosowanie
u chorych z cukrzycą powinno być ostrożne i bez wątpienia w jak najmniej-
szych dawkach.
INNE OBJAWY NIEPOŻĄDANE
Hiponatremia
Hiponatremia (Na
+
w surowicy <130 mmol/l) szczególnie łatwo występu-
je u chorych leczonych diuretykami pętlowymi. Zdarza się również u pacjen-
tów leczonych tiazydami. Ciężka hiponatremia (Na
+
<120 mmol/l) przeja-
wiać się może kurczem mięśni, nudnościami, bólami głowy, zaburzeniami
psychicznymi, sennością, aż do śpiączki włącznie – rozwija się jednak ona
bardzo rzadko. Ponieważ w obrazie klinicznym dominują zwykle objawy cho-
roby podstawowej, hiponatremia często nie jest rozpoznawana, a powinna
być skorygowana w ciągu pierwszych 24 godzin. Postępowanie polega na od-
stawieniu diuretyku i zmniejszeniu podaży płynów. Podaż sodu nie jest zale-
cana, ale w przypadku ciężkiej hiponatremii (<120 mmol/l) pożądane jest
podanie chlorku sodowego (zwykle jest to stężony 10% NaCl w niewielkiej
ilości, np. 250 ml 0,9% NaCl).
Hiperkalcemia
Nie jest częstym powikłaniem, a jeśli występuje, to głównie w przebiegu
leczenia tiazydami. Wówczas wydalanie wapnia przez nerki może zmniejszać
39

się nawet o 40-50%. Co ciekawe, tak duże zmniejszenie wydalania, skutkuje
bardzo niewielkim przyrostem stężenia wapnia w surowicy – średnio
o 0,1-0,2 mg% – prawdopodobnie w wyniku jednoczesnego zmniejszenia
wchłaniania wapnia w jelicie cienkim oraz zwiększonego deponowania go
w kościach. Jest faktem, że u pacjentów w podeszłym wieku leczonych tiazy-
dami, stwierdza się mniejsze nasilenie osteoporozy i złamań szyjki kości udo-
wej. Ponadto terapia tiazydami jest praktycznym sposobem leczenia wspo-
magającego kamicy nerkowej, spowodowanej hiperkalcemią (np.
w przebiegu nadczynności przytarczyc).
Hiperurykemia
Według niektórych badaczy, zwiększone stężenie kwasu moczowego w su-
rowicy, stwierdza się u około 30% chorych na nadciśnienie tętnicze, nie
przyjmujących żadnych leków hipotensyjnych. Terapia diuretykami,
a w szczególności tiazydowymi i tiazydopodobnymi, zwiększa jeszcze ten od-
setek. Niemniej w przeprowadzonych dużych badaniach Hypertension Detec-
tion and Follow-Up Program stwierdzono, iż hiperurykemia powodowana
przez tiazydy, niezwykle rzadko powoduje wystąpienie dny moczanowej
(w pięcioletniej obserwacji 3696 chorych – 15 epizodów). Uważa się w związ-
ku z tym, że bezobjawowa hiperurykemia w przebiegu terapii diuretykami
nie powinna być leczona.
Impotencja
W następstwie stosowania diuretyków (w szczególności tiazydów) impo-
tencja występuje częściej, niż w wyniku stosowania innych leków hipoten-
syjnych. Już w dużym, randomizowanym badaniu MRC z 1981 roku sygna-
lizowano to zjawisko. Obecnie dysponujemy danymi z dwóch wielkich
badań porównawczych: TOMHS oraz Veteran Administration Cooperative
Study – opublikowanych w połowie lat 90-tych. W badaniach tych po raz
pierwszy porównano preparaty z wszystkich klas leków hipotensyjnych, sto-
sowanych w monoterapii nadciśnienia tętniczego. W badaniu TOMHS by-
ły to: chlortalidon (diuretyk tiazydopodobny), acebutolol (
β-adrenolityk),
amlodypina (antagonista kanałów wapniowych), enalapril (inhibitor enzy-
mu konwertującego angiotensynę – ACE-I) oraz doksazosyna (
α -adreno-
lityk). Ostatnią, szóstą grupę badanych, stanowili pacjenci przyjmujący pla-
cebo. Każda z badanych grup liczyła przynajmniej 200 pacjentów.
Całkowita skuteczność hipotensyjna ocenianych pięciu leków była niemal
jednakowa; zaznaczone niewielkie różnice odnosiły się do wieku i rasy pa-
cjentów. Nie zanotowano też istotnych różnic statystycznych w odniesie-
40

niu do efektów ubocznych porównywanych leków, poza jednym – impoten-
cją. Występowała ona dwukrotnie częściej u mężczyzn przyjmujących
chlortalidon (17,1% chorych w obserwacji 24-miesięcznej), niż w grupie
placebo (8,1%). W innych grupach leków wartości procentowe nie odbie-
gały istotnie od grupy placebo, przy czym zdecydowanie najniższe były
w grupie pacjentów przyjmujących doksazosynę.
W ostatnich 20 latach przeprowadzano liczne badania oceniające wpływ
leków hipotensyjnych na jakość życia – Quality of Life (QoL) – stosując róż-
ne kwestionariusze i skale ocen. Dziewięć z tych badań spełniających ostre
kryteria porównawcze opublikowano w 1991 roku – obejmowały one łącz-
nie 1620 chorych leczonych podstawowymi grupami leków. Metaanaliza
obejmowała ocenę wpływu leków na pięć parametrów: funkcje seksualne,
sen, sprawność psychomotoryczną, nastrój i ogólne samopoczucie. We
wszystkich dziewięciu badaniach wykazano istotnie korzystny wpływ na ba-
dane parametry QoL, z jednym wyjątkiem – funkcji seksualnej. Odnosiło się
to zresztą do wszystkich grup leków i różnice nie były istotne.
Wspomniane wyżej badania TOMHS (1993 rok) i Veteran Administration
(1995 rok) przyniosły ogromną ilość obserwacji. Warto może zatrzymać się
na bardzo istotnym i aktualnym zagadnieniu, jakim jest przerost mięśnia le-
wej komory (left ventricle hypertrophy – LVH).
W badaniu TOMHS oceniano wpływ leków hipotensyjnych z 5 grup na re-
gresję przerostu (obserwacja 1-roczna). Najkorzystniejszy efekt zaobserwo-
wano w grupie chorych leczonych chlortalidonem (zmniejszenie masy lewej
komory o 21 gramów) i amlodypiną (o 16 gramów). Skuteczność obydwu le-
ków była znamiennie wyższa niż pozostałych.
W programie Veteran Administration oceniano efekty leczenia kaptopri-
lem (ACE-I), hydrochlorotiazydem (tiazyd), atenololem (
β-adrenolityk),
prazosyną (
α-adrenolityk), klonidyną (agonista ośrodkowych receptorów
α) i diltiazemem (antagonista kanałów wapniowych). W obserwacji 1-rocz-
nej, największą redukcję masy lewej komory, stwierdzono u pacjentów
przyjmujących kaptopril (o 14,9 g), hydrochlorotiazyd (o 14,0 g) i atenolol
(o 5,0 g). Jednak wśród pacjentów o największej masie lewej komory
(>350 g), najskuteczniej, bo aż o 66 g, zmniejszał ją hydrochlorotiazyd. Co
prawda, w wielu innych randomizowanych programach oceniających regre-
sję LVH, prym wiodą inhibitory konwertazy (ACE-I) i w nieco mniejszym
stopniu antagoniści kanałów wapniowych, nie może to jednak zmienić do-
brej opinii o diuretykach. Artykuł nie wyczerpuje oczywiście całości zagad-
nienia. Staramy się przedstawić tę grupę leków w obiektywnym świetle. Ich
wartość potwierdziły liczne próby kliniczne, a ich pozycja jest w wielu sytu-
41

acjach niezagrożona. Warto również pamiętać o ekonomicznym aspekcie
problemu – są to leki tanie.
Zapamiętaj!
1. Hiponatremia znosi moczopędny efekt działania diuretyków.
2. Najczęstszym i najgroźniejszym powikłaniem leczenia moczopędnego jest
hipokaliemia.
3. Diuretyki tiazydowe, tak rozpowszechnione w leczeniu nadciśnienia tętni-
czego, powodują istotne zaburzenia metaboliczne. Nakazuje to rozwagę
w leczeniu chorych z współistniejącą cukrzycą i/lub hiperlipidemią.
4. Ototoksyczne działanie diuretyków pętlowych sprawia, że nie należy ich łą-
czyć z antybiotykami aminoglikozydowymi. Jednorazowa dożylna dawka
furosemidu nie powinna przekraczać 80 mg.
5. Leki moczopędne są przeciwwskazane w ciąży i w okresie karmienia pier-
sią. W I trymestrze ciąży są absolutnie zakazane.
Polecane lektury:
L. Giec, Z. S. Herman: Farmakoterapia chorób układu sercowo-naczynio-
wego; PZWL, 1998.
R. Haiat, G. Leroy: Leczenie chorób sercowo-naczyniowych; Przegląd naj-
ważniejszych badań klinicznych, VIA MEDICA, 2000.
J. Kupersmith, P. C. Deedwania: Farmakoterapia chorób serca; Urban &
Partner, 1998.
N. M. Kaplan: Nadciśnienie tętnicze; Urban & Partner, 1999.
W. S. Colucci, E. Braunwald: Atlas niewydolności serca; VIA MEDICA,
2001.
42

IV.
LEKI BETA-ADRENOLITYCZNE – ZASTOSOWANIE
KLINICZNE
Marek Kuch, Joanna Syska-Sumińska
Leki
β-adrenolityczne, potocznie nazywane β-adrenolitykami lub β-bloke-
rami, to zróżnicowana grupa lekowa, której wspólnym mechanizmem działa-
nia jest blokada receptora
β-adrenergicznego.
Poczynając od końca lat siedemdziesiątych XX wieku i praktycznie nie-
przerwanie przez prawie 30 lat do chwili obecnej, leki
β-adrenolityczne są
jedną z najważniejszych grup lekowych, stosowanych w kardiologii, a zwłasz-
cza w chorobie niedokrwiennej serca. Ta stale wysoka pozycja leków
β-ad-
renolitycznych związana jest niewątpliwie z dużą wszechstronnością i wielo-
kierunkowością działania w chorobach sercowo-naczyniowych. Pod koniec
lat siedemdziesiątych i na początku lat osiemdziesiątych, liczne badania kli-
niczne udowodniły, że leki
β-adrenolityczne zmniejszają śmiertelność w nie-
wyselekcjonowanej grupie chorych po zawale serca. Dziesięć lat później, po
nieudanych badaniach nad tak zwanymi lekami „stricte” antyarytmicznymi,
okazało się, że leki
β-adrenolityczne jako grupa, są także najbezpieczniej-
szymi lekami o działaniu antyarytmicznym. Trzeci sukces leków
β-adrenoli-
tycznych przypadł na przełom tysiącleci, kiedy to po opublikowaniu wyni-
ków trzech międzynarodowych wieloośrodkowych badań (CIBIS II,
MERIT-HF, COPERNICUS), podważone zostało jedno z klasycznych prze-
ciwwskazań dla tej grupy lekowej – przewlekła, zastoinowa niewydolność
serca.
Poszerzenie wskazań do stosowania leków
β-adrenolitycznych niewątpli-
wie było również związane ze stałą ewolucją tej grupy lekowej. Leki pierw-
szej generacji praktycznie zastąpione zostały przez bardziej selektywną
w działaniu – w stosunku do serca – generację drugą. Powstała nowa, trzecia
generacja leków
β-adrenolitycznych, o silnie wyrażonym, różnorodnym dzia-
łaniu rozszerzającym naczynia krwionośne (tab. 1).
43
MECHANIZMY KOMÓRKOWE DZIAŁANIA LEKÓW
BETA-ADRENOLITYCZNYCH
Działanie leków
β-adrenolitycznych na poziomie komórki, polega na blo-
kowaniu błonowego receptora, połączonego z cyklazą adenylową (zarówno
receptor
β
1
, jak i
β
2
), a więc hamowaniu tzw. drugiego przekaźnika (second
messenger), którym jest cykliczny AMP (c-AMP). Wpływa to pośrednio,
przez wysokoenergetyczne związki fosforowe (ATP) i jony Ca
2+
, na układ
białek kurczliwych (troponina-aktyna-miozyna), powodując rozkurcz mię-
śniówki (ryc. 1).
Rycina 1: Mechanizm działania leków beta-adrenolitycznych na poziomie komórki
44
Tabela 1: Leki beta-adrenolityczne
I GENERACJA
II GENERACJA
III GENERACJA
nieselektywne
selektywne
ββ
1
naczyniorozszerzające
• propranolol
• acebutolol
• bucindolol
• nadolol
• atenolol
• celiprolol
• timolol
• esmolol
• carvedilol
• sotalol
• metoprolol
• nebivolol
• oxprenolol
• betaxolol
• alprenolol
• bisoprolol

EFEKTY BLOKADY RECEPTORÓW BETA-ADRENERGICZNYCH
Z historycznego punktu widzenia, idealny lek
β-adrenolityczny miał być
kardioselektywny, mieć właściwości stabilizujące błony komórkowe i wykazy-
wać wewnętrzną aktywność sympatykomimetyczną. Praktyka kliniczna jed-
nak szybko zweryfikowała tak pojętą klasyfikację leków
β-adrenolitycznych.
Liczne badania kliniczne, ukierunkowane na ocenę śmiertelności po zawale
serca, nie udowodniły przewagi leków kardioselektywnych (metoprolol, ate-
nolol) nad nieselektywnymi (propranolol, sotalol, timolol). Wykonane póź-
niej pod kątem leczenia przewlekłej niewydolności serca metaanalizy wspo-
mnianych badań – jak również ostatnio przeprowadzone badania (CIBIS II,
MERIT-HF, COPERNICUS), szczególnie poświęcone temu problemowi –
również nie wykazały wyższości kardioselektywności (bisoprolol, metopro-
lol) nad nieselektywnością (carvedilol) leków
β-adrenolitycznych. Tak więc
wyniki badań klinicznych pozwalają sądzić, że kardioselektywność, nie jest
cechą decydującą o skuteczności leków
β-adrenolitycznych. Można nato-
miast przyjąć, że oddziaływanie przede wszystkim na receptor
β
1
, jest nie-
wątpliwie cechą pożądaną w przypadku współistnienia ze schorzeniami ser-
ca innych chorób, takich jak astma oskrzelowa lub przewlekła nieswoista
choroba oskrzelowo-płucna, zwłaszcza przebiegających z dużą komponentą
kurczową.
Inaczej wygląda natomiast sprawa z wewnętrzną aktywnością sympatyko-
mimetyczną (ISA – intrinsic sympathetic activity) przejawiającą się, oprócz
efektu blokującego receptor
β, również słabym pobudzającym wpływem na
receptor
β-adrenergiczny. Leki posiadające silnie wyrażoną tę cechę (pin-
dolol, alprenolol, oxprenolol), niekorzystnie wypadły w badaniach przepro-
wadzonych w chorobie niedokrwiennej serca, głównie u chorych po zawale
serca. Nie dość, że nie zwiększały przeżywalności, to wręcz zwiększały śmier-
telność w grupie otrzymującej lek. Jedynym lekiem z tej grupy mającym
obecnie znaczenie kliniczne w chorobie niedokrwiennej serca pozostaje ace-
butolol – lek o słabym efekcie pobudzającym receptor
β, co zostaje wyko-
rzystywane u chorych, którzy powinni otrzymywać lek
β-adrenolityczny,
a mają względnie wolną częstość serca.
Jeszcze inaczej wygląda aktualna ocena działania stabilizującego błony ko-
mórkowe. Jest to słaby, nieswoisty wpływ pozareceptorowy (acebutolol, al-
prenolol, oxprenolol, pindolol), z którym wiązano działanie antyarytmiczne
leków
β-adrenolitycznych. Wykazano jednak, że działanie antyarytmiczne
w głównej części jest związane z efektem blokowania
β-adrenoreceptora, na-
tomiast nieswoista aktywność błonowa, ma znikomą wartość w tym zakre-
sie. Przykładem klinicznym popierającym tę tezę, jest lek
β-adrenolityczny
45

o silnym działaniu antyarytmicznym – sotalol – który jest całkowicie pozba-
wiony działania błonowego.
Przewartościowanie „klasycznych” zalet leków
β-adrenolitycznych wywar-
ło wpływ na aktualny kierunek rozwoju tej grupy lekowej. Uległa ona wy-
raźnej polaryzacji, rozchodząc się praktycznie w dwóch kierunkach. Do
pierwszego, zaliczono leki
β-adrenolityczne w ujęciu klasycznym, a więc
kardioselektywne. Do tej bardzo homogennej grupy, należą leki wysoce se-
lektywne w stosunku do receptora
β
1
(metoprolol, bisoprolol). Leki te od-
działują na receptor
β
1
, który w sercu znajduje się w dużej przewadze nad
receptorem
β
2
. Efekt kliniczny oparty jest na zmniejszeniu zużycia tlenu
przez mięsień sercowy, poprzez zmniejszenie kurczliwości i napięcia mię-
śnia serca, ale przede wszystkim poprzez zwolnienie częstości rytmu ser-
ca, co jest działaniem najbardziej oszczędzającym tlen. Co więcej, wiado-
mo, że w chorobach serca dochodzi zarówno do zmniejszenia liczby
receptorów (downregulation), jak i zmniejszenia ich powinowactwa do amin
katecholowych. Dotyczy to przede wszystkim receptorów
β
1
. Tak więc se-
lektywna blokada receptorów
β
1
, odnawiałaby wrażliwość, jak i zwiększała
ich liczbę (upregulation). Rozwój tej grupy opiera się właściwie na uzyska-
niu leków o jednym mechanizmie działania – jak największej kardioselek-
tywności.
Drugi kierunek badań nad lekami
β-adrenolitycznymi kładzie nacisk na
wielokierunkowe działania tych leków, zarówno w stosunku do serca, jak
i naczyń systemowych. Stąd też jest to grupa leków bardzo zróżnicowana.
Należą tutaj przede wszystkim leki nieselektywne, oddziałujące na naczynia
poprzez receptor
β
2
, ale również receptor
α
1
i/lub kanały wapniowe (carve-
dilol). Niemniej jednak znajduje się w tej grupie również lek kardioselek-
tywny, działający naczyniorozszerzająco (nebivolol). Ten ostatni lek być mo-
że będzie mógł stanowić połączenie pomiędzy obydwiema opisywanymi
powyżej grupami leków
β-adrenolitycznych, gdyż przy wysokiej kardioselek-
tywności, jednocześnie rozszerza naczynia, działając na mięśniówkę gładką
za pośrednictwem tlenku azotu.
Sam efekt nieselektywności leku w stosunku do receptora
β może mieć
również korzystne działanie w chorobach serca, powodujących zmianę sto-
sunku receptorów
β
1
do
β
2
, na niekorzyść tego pierwszego. W warunkach fi-
zjologicznych stosunek receptorów
β
1
do
β
2
w sercu wynosi 77% do 23%.
Wraz z narastaniem dysfunkcji lewej komory, a przede wszystkim w prze-
wlekłej niewydolności serca, stosunek ten ulega zmianie i wynosi 60% do
40%, co powoduje wzrost znaczenia receptorów
β
2
. Wiadomo również, że
efekt chronotropowy, jakkolwiek zależy przede wszystkim od receptorów
β
1
,
to jest prawdopodobnie wypadkową działania obu receptorów
β, a recepto-
46
ry
β
2
znajdują się w dużej liczbie w węźle zatokowo-przedsionkowym i mogą
być mediatorem wpływu amin katecholowych na serce.
Ta niejednoznaczność korzystnych działań leków
β-adrenolitycznych spo-
wodowała, że aktualne spojrzenie na działanie tej grupy lekowej, oparte jest
znacznie mocniej na uzyskiwanych efektach klinicznych. Można je podzie-
lić na: efekt hemodynamiczny, efekt metaboliczno-humoralny oraz efekt an-
tyarytmiczny. Jest to całkowicie sztuczny podział, gdyż wszystkie te efekty
wzajemnie przeplatają się ze sobą. Przykładem obrazującym tę ścisłą zależ-
ność, jest zwolnienie czynności serca po zastosowaniu leków
β-adrenolitycz-
nych, stanowiące efekt hemodynamiczny, a dające w rezultacie zmniejsze-
nie zapotrzebowania na tlen, co z kolei jest efektem metabolicznym. Podział
ten jest jednak pomocny z praktycznego punktu widzenia przy omawianiu
działania leków
β-adrenolitycznych.
Najdłużej znanym i najlepiej poznanym działaniem leków
β-adrenolitycz-
nych jest ich wpływ na serce i układ naczyniowy (efekt hemodynamiczny)
(ryc. 2). Blokada receptora
β-adrenergicznego, działając wielokierunkowo,
zmniejsza zapotrzebowanie mięśnia sercowego na tlen. Wydłużając z kolei
czas trwania rozkurczu serca, leki
β-adrenolityczne zwiększają endokardial-
ny przepływ wieńcowy i poprawiają odżywianie mięśnia sercowego. Leki
β-
adrenolityczne działają więc na dwa najważniejsze mechanizmy „ratujące”
serce poprzez zmniejszenie deficytu tlenowego. Można więc powiedzieć, że
leki
β-adrenolityczne mają wręcz idealny profil działań w chorobie niedo-
krwiennej serca. Wyniki badań przeprowadzonych u chorych z przewlekłą
niewydolnością serca potwierdziły wcześniejsze spostrzeżenia, że najbardziej
tlenochłonnym jest działanie chronotropowe. Zwiększenie przeżywalności
w okresie odległym, jest więc związane przede wszystkim ze zwolnieniem
przez leki
β-adrenolityczne średniej dobowej częstości rytmu serca. Spo-
strzeżeniem ostatnich lat jest ochronne działanie leków
β-adrenolitycznych
47
Rycina 2: Blokada receptora beta-adrenergicznego – efekt hemodynamiczny

w stosunku do blaszek miażdżycowych w naczyniach wieńcowych. Zwolnie-
nie czynności serca, obniżenie ciśnienia tętniczego, zmniejszenie kurczliwo-
ści, a w efekcie zmniejszenie pracy serca, to mechanizmy zmniejszające ryzy-
ko pęknięcia blaszki znajdującej się w tętnicy wieńcowej.
Z efektem hemodynamicznym ściśle związany jest, niemniej ważny, efekt
metaboliczno-humoralny blokady receptorów
β (szczegółowo opisany w roz-
dziale XVIII). Ten bardzo bogaty i wielokierunkowy efekt jest jednak zróż-
nicowany, w zależności od działania poszczególnych leków. Trudno wręcz
mówić w takim przypadku o „efekcie grupy” leków
β-adrenolitycznych. Nie-
zależnie jednak od zróżnicowanego działania, wydaje się, że w zwiększeniu
przeżywalności chorych leczonych lekami
β-adrenolitycznymi w okresie od-
ległym, efekt metaboliczny odgrywa bardzo ważną rolę, nie mniejszą od
efektu hemodynamicznego.
Ostatnim z efektów blokady receptora
β, który warto podkreślić, jest dzia-
łanie antyarytmiczne, gdyż zaburzenia rytmu serca należą do obrazu klinicz-
nego większości chorób serca. Efekt antyarytmiczny oparty jest na podsta-
wowym działaniu leków
β-adrenolitycznych, czyli zmniejszeniu lub
zablokowaniu aktywności adrenergicznej (szczegółowy opis w rozdziale
XIX). W efekcie leki
β-adrenolityczne zmniejszają występowanie arytmii,
a co za tym idzie zagrożenie nagłym zgonem sercowym.
ZASTOSOWANIE KLINICZNE LEKÓW BETA-ADRENOLITYCZNYCH
Wskazania do stosowania leków
β-adrenolitycznych w chorobach układu
sercowo-naczyniowego są bardzo szerokie (tab. 2). Na szczególną uwagę za-
sługuje ich zastosowanie w leczeniu choroby niedokrwiennej serca, przewle-
kłej zastoinowej niewydolności serca, nadciśnieniu tętniczym oraz zaburze-
niach rytmu serca.
Wskazania do stosowania leków blokujących receptor
β-adrenergiczny
w chorobie niedokrwiennej serca obejmują niemalże wszystkie jej formy
(ryc. 3). Wyjątek stanowią jedynie postacie naczyniokurczowe, w których po-
dawanie leków
β-adrenolitycznych nie jest wskazane, gdyż może nasilić
kurcz naczynia. Ogólnie należy przyjąć zasadę, że im cięższa postać choroby
niedokrwiennej serca, tym znaczenie tej grupy lekowej większe.
W leczeniu dusznicy bolesnej stabilnej leki
β-adrenolityczne są ważną, jed-
ną z trzech (leki
β-adrenolityczne, antagoniści kanałów wapniowych, azota-
ny) podstawowych grup terapeutycznych w tej chorobie. Mimo przeprowa-
dzenia licznych badań klinicznych nie stwierdzono, czy połączenie dwóch
lub trzech leków wieńcowych jest korzystniejsze od skutecznej
β-blokady.
48

Badania porównujące monoterapię przy użyciu leków
β-adrenolitycznych
z lekami blokującymi kanały wapniowe, również nie przyniosły jednoznacz-
nej odpowiedzi, która z grup jest skuteczniejsza w leczeniu stabilnej duszni-
cy bolesnej. Na ogół przyjmuje się, że leki
β-adrenolityczne są włączane,
bądź dołączane, począwszy od II klasy klasyfikacji dławicy piersiowej według
Kanadyjskiego Towarzystwa Chorób Serca i Naczyń (CCS). Niemniej jed-
nak należy przyjąć, że ta forma choroby niedokrwiennej serca nadal wyma-
ga indywidualnego doboru leku, bądź połączenia leków wieńcowych. Jest
jednak również prawdą, że w większości przypadków chorych leczonych le-
49
Tabela 2: Wskazania do zastosowania leków beta-adrenolitycznych
• choroba niedokrwienna serca (w tym niedokrwienie bezbólowe);
• nadciśnienie tętnicze (pierwotne i wtórne);
• nadkomorowe i komorowe zaburzenia rytmu (zapobieganie i le-
czenie);
• tachykardia zatokowa;
• zespół wydłużonego QT;
• zespół wazo-wagalny;
• wypadanie płatka zastawki mitralnej;
• pheochromocytoma;
• tętniak rozwarstwiający aorty;
• kardiomiopatia przerostowa;
• kardiomiopatia rozstrzeniowa;
• przewlekła niewydolność serca.
Rycina 3: Wskazania do stosowania leków beta-adrenolitycznych w chorobie niedokrwiennej serca

kami
β-adrenolitycznymi, są one stosowane w różnych kombinacjach skła-
dających się ze wspomnianych grup lekowych. Pozwala to wykorzystać za-
równo korzystne działania, jak i zniwelować niekorzystne efekty poszczegól-
nych grup leków.
Leki
β-adrenolityczne szczególnie skuteczne są w leczeniu postaci wysił-
kowej dusznicy bolesnej. Leki te zmniejszają częstość występowania bólów
wieńcowych, epizodów przemijającego niedokrwienia, jak również podwyż-
szają próg tolerancji wysiłku. Dużą skuteczność wykazują również w leczeniu
bezbólowej formy choroby niedokrwiennej serca (nieme niedokrwienie).
Skuteczność leków
ββ-adrenolitycznych jest tym większa, im większa jest sty-
mulacja adrenergiczna (szybka czynność serca, podwyższone ciśnienie tętni-
cze, przewlekły bądź ostry stres).
W niestabilnej dusznicy bolesnej największe korzyści z podawania leków
β-adrenolitycznych mają pacjenci, u których nie były one wcześniej stosowa-
ne. Niemniej jednak, gdy były one podawane przed wystąpieniem okresu
niestabilności, powinny być kontynuowane. W niestabilnej chorobie wień-
cowej, leki
β-adrenolityczne są na ogół stosowane w politerapii; w połącze-
niu z azotanami, a często również z antagonistami kanałów wapniowych, gdy
skuteczność ich jest niewystarczająca. Być może relatywnie mniejsza sku-
teczność leków
β-adrenolitycznych w leczeniu niestabilnej dusznicy bolesnej
w porównaniu do terapii prewencyjnej związana jest z występowaniem dole-
gliwości już w spoczynku, nie będących następstwem wzrostu ciśnienia tętni-
czego i wzmożonej czynności serca.
Pozycja leków
β-adrenolitycznych, jakkolwiek silna w prewencji pierwotnej
choroby niedokrwiennej serca, nie jest tak znacząca, jak w prewencji wtórnej
po przebytym zawale serca.
Leki
β-adrenolityczne w zawale serca są stosowane zarówno w ostrej fa-
zie w postaci dożylnej, jak i w prewencji wtórnej pozawałowej w formie do-
ustnej. Dotychczas najwięcej uwagi badacze poświęcili zastosowaniu leków
β-adrenolitycznych w prewencji wtórnej. Jest to całkowicie zrozumiałe, gdyż
mimo, że leki te są skuteczne prawie w każdej postaci choroby niedokrwien-
nej serca, to właśnie po zawale serca korzyści z ich stosowania są najwięk-
sze. Liczne badania pokazały, że leki
β-adrenolityczne nie tylko zwiększają
przeżywalność po zawale serca, ale także zmniejszają liczbę nagłych zgonów
i ponownych zawałów serca. W pięciu największych próbach klinicznych
(ISIS-1, MIAMI, BHAT, TIMOLOL STUDY, GMT) przebadano łącznie
blisko 30 000 chorych, u których włączano lek w ostrej fazie zawału serca
(tab. 3). Badania te, mimo że nie są jednorodne pod względem czasu roz-
poczęcia podawania leku, czasu trwania leczenia, ani też czasu obserwacji
50
i co być może najważniejsze – użyto w nich zarówno leków kardioselektyw-
nych, jak i nieselektywnych – to jednak dały jednoznaczną redukcję śmiertel-
ności, która osiągnęła od 12,5% do 39,5%. Przekładając te dane na prakty-
kę kliniczną, można wyliczyć, że oznacza to uratowanie od 19 do 64 chorych
na 1000 leczonych w grupie otrzymującej lek w stosunku do grupy otrzymu-
jącej substancję nieaktywną. Podsumowując wyniki wszystkich prób stwier-
dzono, że leki
β-adrenolityczne zmniejszają o 30% śmiertelność w niewyse-
lekcjonowanej grupie chorych po zawale serca. Tak więc standardem
postępowania po zawale serca, jest podawanie leków
ββ-adrenolitycznych
u wszystkich chorych, którzy nie mają przeciwwskazań do stosowania tej
grupy leków.
Niekwestionowana jest pozycja leków blokujących receptory
β-adrener-
giczne w leczeniu nadciśnienia tętniczego. Beta-adrenolityki są jedną z sze-
ściu grup lekowych, stosowanych w monoterapii nadciśnienia tętniczego,
jakkolwiek z powodzeniem są również stosowane w dwu- i wielolekowej te-
rapii złożonej. Leki
β-adrenolityczne, obok diuretyków, są szczególnie prefe-
rowane w Stanach Zjednoczonych Ameryki Północnej ze względu na ko-
rzystny profil efektywności w stosunku do poniesionych kosztów.
Mechanizm działania leków
β-adrenolitycznych pierwszej i drugiej genera-
cji polega przede wszystkim na zmniejszeniu pracy serca. W przypadku le-
ków trzeciej generacji dodatkowym ważnym elementem jest bezpośredni
51
Tabela 3: Leki beta-adrenolityczne w zawale serca
BADANIE
TIMOLOL
BHAT
GMT
MIAMI
ISIS-1
STUDY
n=1884
n=3887
n=1395
n=5778
n=16027
nabór
chorych
7-28 doba
5-21 doba
<48 h
<24 h
<12 h
lek
timolol
propranolol metoprolol
metoprolol
atenolol
śmiertelność
↓30%: 1 doba
lek vs placebo
↓39,5%
↓28%
↓36%
↓12,5% ↓9%: 12 m-cy
czas
obserwacji
33 m-ce
25 m-cy
3 m-ce
15 dni
12 m-cy
„uratowani
chorzy”
64
48
22
19
48

wpływ na mięśniówkę, albo za pośrednictwem receptora tętniczego, efekt
naczyniorozszerzający naczynia krwionośne.
Leki
β-adrenolityczne są szczególnie skuteczne w nadciśnieniu tętniczym
ze znacznie wyrażonym pobudzeniem układu współczulnego. Są one leka-
mi z wyboru w leczeniu nadciśnienia tętniczego towarzyszącego chorobie
niedokrwiennej serca, gdyż obniżenie ciśnienia tętniczego przy ich użyciu
odbywa się w głównej mierze przez zmniejszenie pracy serca, a więc obniże-
nie zapotrzebowania na tlen. Inną grupą chorych, która odnosi korzyści z le-
czenia
β-adrenolitykami, są pacjenci z nadciśnieniem tętniczym zależnym od
wysiłku fizycznego.
Efekt antyarytmiczny leków
β-adrenolitycznych oparty jest na zmniejsze-
niu lub zablokowaniu aktywności adrenergicznej, a następnie zmniejszeniu
niedokrwienia i komórkowej utraty potasu, jak również podwyższeniu progu
migotania komór. Ostatecznie leki
β-adrenolityczne zmniejszają występo-
wanie groźnych złożonych arytmii komorowych, a co za tym idzie zagrożenie
nagłym zgonem sercowym (SCD – sudden cardiac death). Leki
β-adrenoli-
tyczne siłą działania ustępują lekom I i III grupy według Vaughana-Willia-
msa, niemniej jednak przy zachowanej wysokiej skuteczności mają najlepszy
profil bezpieczeństwa (niskie ryzyko proarytmii, mało efektów ubocznych)
ze wszystkich leków antyarytmicznych. Wyjątek stanowi sotalol, zaliczany
do grupy III według Williamsa, oceniany jako najskuteczniejszy wśród leków
β-adrenolitycznych, ale jednocześnie o najwyższym ryzyku wystąpienia dzia-
łania proarytmicznego.
W tym miejscu przypomnieć należy, że leki
β-adrenolityczne, zmniejsza-
jąc niedokrwienie mięśnia sercowego, zmniejszają również bóle wieńcowe –
najsilniejszy czynnik stresowy stymulujący, poprzez aminy katecholowe, wy-
stępowanie groźnych arytmii komorowych. W związku ze swoim wielokie-
runkowym działaniem,
β-adrenolityki są więc lekami pierwszego rzutu w le-
czeniu arytmii komorowych, w przebiegu choroby niedokrwiennej serca.
Leki
β-adrenolityczne są skuteczne w przywracaniu rytmu zatokowego
w niektórych postaciach częstoskurczu pochodzenia nadkomorowego. W mi-
gotaniu i trzepotaniu przedsionków, leki te są mniej skuteczne (wyjątek sta-
nowić mogą napadowe tachyarytmie nadkomorowe w przebiegu nadczyn-
ności tarczycy), ale jednocześnie najbezpieczniejsze, co ma niewątpliwe
znaczenie w terapii przewlekłej. Dla odmiany leki
β-adrenolityczne są sku-
teczne, zarówno w monoterapii, jak i w terapii złożonej (zwłaszcza z prepa-
ratami naparstnicy), w zwolnieniu i kontroli czynności komór w migotaniu
i trzepotaniu przedsionków. Szczególnie przydatne są w zapobieganiu nad-
miernemu przyspieszeniu czynności komór podczas wysiłku fizycznego.
52

Największą skuteczność, co wynika z ich mechanizmu działania, wykazu-
ją leki
ββ-adrenolityczne w zwalczaniu zaburzeń rytmu serca, w stanach
wzmożonego napięcia układu współczulnego i nadmiernego wydzielania ka-
techolamin.
Leki
β-adrenolityczne są stosowane ponadto w leczeniu zespołu wydłużo-
nego QT. Wyjątek stanowi sotalol, którego mechanizm działania polega na
wydłużeniu QT, a więc jest w tym zespole przeciwwskazany.
Zastosowaniu
β-adrenolityków w przewlekłej zastoinowej niewydolności
serca poświęcony jest oddzielny rozdział.
ZASADY STOSOWANIA LEKÓW BETA-ADRENOLITYCZNYCH
Nie ma ogólnie przyjętych dawek dla leków
β-adrenolitycznych. Można
jedynie mówić o pewnych wskazaniach terapeutycznych. Do takich należy
rozpoczynanie leczenia od małych dawek (np.: dla metoprololu – od 12,5
mg doustnie, bisoprololu – od 1,25 mg, carvedilolu od 3,125 mg), stosując
dalej lek we wzrastających dawkach, aż do osiągnięcia pożądanego efektu
klinicznego (ustąpienie bólów wieńcowych, ustąpienie zmian
niedokrwiennych w elektrokardiogramie). Pomocnymi, niemniej jedynie
orientacyjnymi wskazówkami, jest osiągnięcie częstości serca w granicach 60
uderzeń na minutę w spoczynku oraz wzrost ciśnienia tętniczego o około 20
mm Hg przy wykonywaniu umiarkowanego wysiłku fizycznego. Coraz
częściej, zwłaszcza po badaniach w przewlekłej niewydolności serca, mówi
się o możliwości obniżenia częstości serca do 50 uderzeń na minutę, pod
warunkiem dobrej tolerancji przez pacjenta. Problem natomiast, przy
podawaniu leków
β-adrenolitycznych, zwłaszcza w formie dożylnej w ostrych
postaciach choroby niedokrwiennej serca (ostry zawał serca, niestabilna
dusznica bolesna), może stanowić niskie ciśnienie skurczowe krwi. Trudno
jest ustalić dolny pułap, poniżej którego nie powinno się obniżać ciśnienia
w spoczynku. Panuje tutaj znaczna indywidualna zmienność. W pewnym
przybliżeniu można powiedzieć, że nie powinno ono być niższe niż 100 mm
Hg u osób z normotensją. U osób z nadciśnieniem tętniczym dążymy do
osiągnięcia prawidłowych wartości ciśnienia tętniczego w sposób powolny.
Generalną zasadą jest dawkowanie leków
ββ-adrenolitycznych przede
wszystkim pod kontrolą obrazu klinicznego.
U pacjentów z niestabilną dusznicą bolesną i ostrym zawałem serca,
dawkowanie
β-adrenolityków nie odbiega zasadniczo od schematu
podanego dla stabilnej postaci dusznicy bolesnej. Różnicę stanowi pierwsza
doba, gdyż leki te podawane powinny być początkowo dożylnie, z następową
53

kontynuacją doustną. Zwrócić trzeba szczególną uwagę, na dużą chwiejność
ciśnienia tętniczego w tych postaciach choroby niedokrwiennej serca,
zwłaszcza we wspomnianej pierwszej dobie. W praktyce klinicznej oznacza
to rozpoczynanie podawania leku od małych, powtarzanych dawek, w
postaci bolusów dożylnych, pod kontrolą tętna i ciśnienia tętniczego
(przykładowo dla metoprololu: 2,5 mg + 2,5 mg + 5 mg i.v.).
W ostrych postaciach choroby niedokrwiennej serca stosowane powinny
być leki
β-adrenolityczne o krótszym okresie działania, podawane 2-3 razy
dziennie. W leczeniu ambulatoryjnym oraz późniejszych fazach ostrych
zespołów wieńcowych preferowane są natomiast formy o przedłużonym
działaniu, stosowane 1-2 razy w ciągu doby.
Zaletą dużego zróżnicowania w obrębie grupy leków
β-adrenolitycznych
jest możliwość indywidualnego doboru najkorzystniejszego preparatu dla
chorego. Ma to szczególne znaczenie w odniesieniu do wyjściowej częstości
rytmu serca. Chorzy ze znaczną tachykardią wymagają podawania leków
o dużym efekcie zwalniającym (np.: bisoprolol, a w następnej kolejności
metoprolol czy atenolol). Chorzy ze względnie wolną czynnością serca, są
natomiast kandydatami do leków o słabszym efekcie zwalniającym (np.:
acebutolol).
Różnorodność preparatów pozwala również na dobór leków
β-adre-
nolitycznych w zależności od objawów lub chorób współistniejących z i/lub
wikłających chorobę niedokrwienną serca. I tak, w przypadku choroby
niedokrwiennej w stadium przewlekłej niewydolności serca, lekami
sprawdzonymi są: bisoprolol, metoprolol oraz carvedilol. W chorobie
niedokrwiennej serca, z towarzyszącym nadciśnieniem tętniczym, prefe-
rowanymi byłyby
β-adrenolityki, z silnie wyrażoną komponentą naczyniową
(carvedilol). Silne działanie przejawia też acebutolol. W komorowych
zaburzeniach rytmu wikłających chorobę niedokrwienną serca, lekami
β-adrenolitycznymi pierwszego rzutu, często są metoprolol lub bisoprolol,
ze względu na swoje wszechstronne działanie w tej chorobie. Natomiast
w przypadku ich niedostatecznej skuteczności, zwłaszcza w złożonych
formach komorowych zaburzeń rytmu, cennym lekiem jest sotalol.
PRZECIWWSKAZANIA I EFEKTY UBOCZNE
Przedstawiając liczne zalety leków blokujących receptor
β-adrenergiczny,
należy również wspomnieć o przeciwwskazaniach do ich stosowania oraz
efektach niepożądanych (tab. 4 i tab. 5). Leki
β-adrenolityczne uważane są
za leki bezpieczne, pod warunkiem przestrzegania przeciwwskazań do ich
stosowania. Grupa bezwzględnych przeciwwskazań jest stosunkowo nielicz-
54

na. Nie zapominać należy, iż przewlekła niewydolność serca, mimo że jest
wskazaniem do stosowania leków
β-adrenolitycznych – to stan jej niewyrów-
nania (obrzęki, zastój), jak również ostra niewydolność serca – stanowią
przeciwwskazania do tego typu leczenia. Inne klasyczne przeciwwskazania
to: wolna czynność serca (<60/min.), a zwłaszcza objawowa bradykardia
oraz niskie systemowe ciśnienie tętnicze. Granica pomiędzy efektem ubocz-
nym, a efektem pożądanym stosowania leków
ββ-adrenolitycznych jest jed-
nak często nieostra i zależna od oczekiwanego celu klinicznego. Stąd też gra-
nica tolerowanej bradykardii i
hipotonii powinna być ustalana
indywidualnie. Przeciwwskazanie bezwzględne do podawania tych leków,
stanowią bloki przedsionkowo-komorowe II i III stopnia, natomiast przy po-
dawaniu leku pacjentom z blokiem przedsionkowo-komorowym I stopnia
trzeba zachować ostrożność, gdyż może to nasilać stopień bloku przewodze-
nia. Wśród pacjentów z niskim ciśnieniem tętniczym, pewien stopień zagro-
żenia stanowi znaczna, przedłużająca się hipotonia z objawami klinicznymi.
Przeciwwskazanie mogą stanowić również wybrane sytuacje kliniczne: choro-
ba węzła zatokowo-przedsionkowego, szczególnie z objawami zespołu MAS,
cukrzyca leczona insuliną ze skłonnością do stanów hipoglikemicznych. Le-
ki o nieselektywnym działaniu
β-adrenolitycznym nie powinny być stosowa-
ne, zwłaszcza u chorych z cukrzycą o chwiejnym przebiegu. Warto jednak
przede wszystkim podkreślić, że ogólne korzyści ze stosowania leków
ββ-adre-
nolitycznych u chorych z cukrzycą, znacznie przewyższają efekty niepożą-
dane tych leków. Objawy złej tolerancji
β-adrenolityków objawiające się za-
burzeniami dyspeptycznymi, zaburzeniami centralnego układu nerwowego,
odczynami alergicznymi, zaburzeniami z zakresu układu krwiotwórczego czy
uszkodzeniem wątroby, pojawiają się w praktyce bardzo rzadko.
Wśród objawów niepożądanych stosowania leków
β-adrenolitycznych, na-
leży przede wszystkim wspomnieć o niekorzystnym wpływie na profil lipido-
wy surowicy krwi. Leki te podwyższają umiarkowanie cholesterol całkowity,
frakcję VLDL i poziom trójglicerydów oraz obniżają frakcję HDL. W przy-
padku jednak leczenia chorych po zawale serca, niekorzystny wpływ na lipi-
dy krwi ginie wśród licznych korzystnych efektów
β-adrenolityków w tej gru-
pie chorych. W stabilnej dusznicy bolesnej, bardzo zbliżona skuteczność
różnych grup leków hemodynamicznych (leki
β-adrenolityczne, antagoniści
kanałów wapniowych) pozwala na dobór odpowiedniej grupy lekowej w za-
leżności od profilu lipidowego u chorego. Coraz więcej pytań ze strony pa-
cjentów dotyczy możliwości wystąpienia różnie wyrażonych zaburzeń poten-
cji podczas przyjmowania leków
β-adrenolitycznych. Jest to efekt uboczny,
który może być wywołany nie tylko przez tę grupę lekową, jakkolwiek leki
β-adrenolityczne ustępują w nim jedynie lekom moczopędnym. Nadal otwar-
55

tym pozostaje natomiast problem, czy formy o przedłużonym działaniu, da-
ją mniej wyrażone zaburzenia potencji. Wśród potencjalnych efektów nie-
pożądanych, należy również wspomnieć o tak zwanym zjawisku odbicia po
nagłym odstawieniu leków
β-adrenolitycznych. Jest ono dobrze znane i mi-
mo tworzenia nowych generacji leków, nie straciło na ważności. Problem
może jednak stanowić sytuacja, w której u chorego występują objawy jawnej
niewydolności serca, a podawane są duże dawki
β-adrenolityków. Niewąt-
pliwie o konieczności i trybie odstawienia leków, przede wszystkim decydu-
je „klinika”, a więc stopień nasilenia objawów niewydolności serca. W miarę
możliwości jednak leki
ββ-adrenolityczne nie powinny być odstawione od ra-
zu. Wydaje się, że bezpiecznie dla chorego można zmniejszyć dawkę leku
o 50%, co jednak wymaga monitorowania w warunkach szpitalnych.
56
Tabela 4: Przeciwwskazania do zastosowania leków beta-adrenolitycznych
KARDIOLOGICZNE
• ciśnienie skurczowe <100 mm Hg;
• bradykardia <60/minutę (względne);
• blok przedsionkowo-komorowy I stopnia z czasem P-Q >240 ms;
• wyższe stopnie bloku przedsionkowo-komorowego;
• ostra niewydolność serca;
• niewyrównana przewlekła niewydolność serca.
NIEKARDIOLOGICZNE
• objawy spastyczne oskrzeli;
• cukrzyca ze skłonnością do hipoglikemii;
• objawy alergiczne (występują rzadko);
• zła tolerancja leku;
• zaburzenia z centralnego układu nerwowego (względne);
• ciąża (względne).

Zapamiętaj!
1. Najważniejszy efekt blokady receptora
β-adrenergicznego to zmniejszenie
zapotrzebowania na tlen, zwiększenie przepływu wieńcowego i poprawa
odżywienia mięśnia sercowego.
2. Kliniczne działanie leków
β-adrenolitycznych można podzielić na: efekt
hemodynamiczny, efekt metaboliczno-humoralny oraz efekt antyaryt-
miczny.
3. Leczenie
β-adrenolitykami rozpocząć należy od małych dawek, zwiększając
je aż do osiągnięcia pożądanego efektu klinicznego.
4.
Aktualny rozwój leków
β-adrenolitycznych odbywa się w dwóch
kierunkach:
• leków o jak największej kardioselektywności,
• leków o wielokierunkowym działaniu w stosunku do serca i naczyń
systemowych.
57
KARDIOLOGICZNE
• hipotonia;
• bradykardia, rzadziej blok przedsionkowo-komorowy;
• nasilenie objawów niewydolności serca;
• zjawisko „odbicia” po nagłym odstawieniu leku.
METABOLICZNE
• hipoglikemia (zwłaszcza
β-adrenolityki nieselektywne);
• niekorzystny wpływ na lipidy surowicy krwi: VLDL, TG, HDL
(
β-adrenolityki bez wewnętrznej aktywności sympatykomimetycznej).
INNE
• kurcz oskrzeli (
β-adrenolityki nieselektywne);
• nasilenie chromania przestankowego (zwłaszcza
β-adrenolityki
nieselektywne);
• zaburzenia potencji;
• objawy ze strony ośrodkowego układu nerwowego
(zwłaszcza
β-adrenolityki lipofilne).
Tabela 5: Objawy niepożądane, które mogą występować przy zastosowaniu leków beta-
adrenolitycznych

Polecane lektury:
Polskie Towarzystwo Kardiologiczne: Standardy postępowania w chorobach
układu krążenia; Kardiologia Polska, 1997, t. XLVI, Suplement.
E. Braunwald, D. B. Zipes, P. Libby: Heart Disease – Textbook Cardiova-
scular Medicine; W. B. Sanders Company, (wydanie IV), Philadelphia,
2001.
K. Kawecka-Jaszcz: Nadciśnienie tętnicze – leczenie beta-blokerami (wybra-
ne aspekty); Kardiologia Polska, 1994, 40, 318.
Opracowanie zbiorowe pod redakcją M. Dłużniewskiego: Zaburzenia ryt-
mu serca; AKCYDENS, Warszawa, 1997.
M. Wierzchowiecki: Nowe generacje beta-blokerów; Kardiologia Polska,
1994, 40, 311.
58

V.
BETA-ADRENOLITYKI W NIEWYDOLNOŚCI SERCA
Joanna Syska-Sumińska, Marek Kuch
EPIDEMIOLOGIA NIEWYDOLNOŚCI SERCA
Występowanie objawowej niewydolności serca (NS) w populacji europej-
skiej szacuje się na około 2%, co oznacza, że choruje na nią ponad 10 mln
osób. Zachorowalność wzrasta wraz z wiekiem, a postępujące starzenie się po-
pulacji ogólnej jest przyczyną wzrostu częstości występowania NS. Rokowanie
w NS jest złe, blisko połowa chorych umiera w okresie 4 lat, a wśród pacjentów
z ciężką niewydolnością serca ponad 50% umiera w okresie 1 roku.
Główną przyczyną NS jest choroba wieńcowa, zwłaszcza współistniejąca
z nadciśnieniem tętniczym.
Ostatnie dziesięciolecie przyniosło istotne zmiany w leczeniu niewydolno-
ści serca. Obecnie terapia ukierunkowana jest nie tylko na zmniejszenie ob-
jawów klinicznych, ale przede wszystkim na zapobieganie progresji choroby
oraz zmniejszenie śmiertelności. Znaczne postępy w terapii NS wiążą się
z rozwojem wiedzy o patofizjologicznych uwarunkowaniach tego zespołu
chorobowego. Istotnym elementem tej wiedzy jest uwzględnienie ważnej ro-
li stymulacji neurohormonalnej w rozwoju niewydolności i jej objawów,
a w tym wzmożonej aktywacji współczulnej.
EFEKTY AKTYWACJI WSPÓŁCZULNEJ W ZDROWYM
I NIEWYDOLNYM MIĘŚNIU SERCOWYM
Upośledzenie funkcji serca prowadzi między innymi do wzrostu napięcia
układu współczulnego, skutkiem czego jest wzrost poziomu noradrenaliny
uwalnianej z zakończeń nerwowych. W początkowych fazach NS aktywacja
układów neurohormonalnych przynosi wymierne korzyści, natomiast prze-
dłużające się pobudzenie doprowadza do wzrostu oporu obwodowego,
zwiększenia obciążenia serca, zmian strukturalnych w sercu i naczyniach,
a w konsekwencji do pogorszenia pracy serca i zgonu chorego. W warun-
kach fizjologicznych układ współczulny dostosowuje pracę serca do stopnia
obciążenia. Odbywa się to poprzez modyfikację faz cyklu serca – skurczu
i rozkurczu.
Katecholaminy poprawiają kurczliwość mięśnia serca poprzez:
1. stymulację receptorów beta i wzrost poziomu cAMP,
2. aktywację ATP-azy wapniowej w siateczce sarkoplazmatycznej kardio-
59

miocytów wtórnie do wzrostu stężenia cAMP; powoduje to wzrost siły
skurczu, a także przyspiesza rozkurcz mięśnia umożliwiając optymalne
wypełnienie komory w fazie rozkurczu,
3. przyspieszenie częstości rytmu serca; w zdrowych miocytach siła skur-
czu komórek wzrasta proporcjonalnie do częstości rytmu. Zjawisko to
znane jest pod nazwą „efektu Bowditcha”.
Utrzymująca się stymulacja adrenergiczna wraz ze wzrostem poziomu krą-
żącej noradrenaliny doprowadza do uszkodzenia miocytów i osłabienia
kurczliwości, a co za tym idzie do spadku rzutu serca. Klinicznie objawia się
to wyraźnym obniżeniem tolerancji wysiłku u pacjentów z NS.
Następujące zjawiska uczestniczą w uszkodzeniu mięśnia serca:
1. Zmniejszenie gęstości receptorów
β
1
-adrenergicznych w błonie komórko-
wej – zjawisko „downregulation”.
W niewydolnym mięśniu sercowym dochodzi do zmiany proporcji między
ilością receptorów
β
1
i
β
2
. Prawdopodobnie jest to mechanizm chroniący
miocyty przed nadmierną stymulacją adrenergiczną. Obniżeniu ulega popu-
lacja receptorów
β
1
oraz poziom mRNA odpowiedzialnego za syntezę „de
novo” receptorów
β
1
. Gęstość receptorów
β
2
nie ulega istotnym zmianom.
Dochodzi do zachwiania proporcji między populacją
β
1
i
β
2
receptorów.
W zdrowym sercu wynosi ona 70-80/20-30%, w niewydolnym mięśniu ulega
obniżeniu do 60/40%. Tym samym rośnie ekspozycja receptorów
β
2
. Jedno-
cześnie podnosi się poziom białka Gi będącego inhibitorem przekazu ko-
mórkowego, który fizjologicznie odbywa się za pośrednictwem receptora
β
1
.
2. Wzrost poziomu cytokin, które osłabiają przekaz za pośrednictwem
β-receptorów.
3. Obniżenie aktywności ATP-azy wapniowej siateczki śródplazmatycznej.
Ten mechanizm powoduje osłabienie siły skurczu, a przyspieszenie czyn-
ności serca skutkuje spadkiem kurczliwości mięśnia (ujemny efekt Bowdit-
cha), tym samym zwolnienie rytmu za pomocą leków
β-adrenolitycznych po-
winno poprawiać kurczliwość mięśnia sercowego.
Katecholaminy odpowiedzialne są za szereg innych niekorzystnych efek-
tów. Stymulują przerost miocytów, uruchamiają zjawisko kontrolowanej
śmierci komórki (apoptozy), doprowadzają do degeneracji miofibryli, a tak-
że nasilają niedokrwienie mięśnia sercowego, zwiększając wydatek energe-
tyczny komórki. Poziom noradrenaliny (wskaźnik aktywności współczulnej)
60

u chorych z niewydolnością serca ma znaczenie prognostyczne. Udowodnio-
no bliską zależność między wysokim stężeniem noradrenaliny (>400 pg/ml),
a śmiertelnością.
PRZESŁANKI PATOFIZJOLOGICZNE DO STOSOWANIA LEKÓW
BETA-ADRENOLITYCZNYCH W NIEWYDOLNOŚCI SERCA
Początkowo sądzono, że korzyści wynikające ze stosowania
β-adrenolity-
ków u chorych z NS, wynikają z bezpośredniego wpływu tych leków na po-
ziom noradrenaliny oraz wzrost gęstości receptorów
β
1
. Analiza przeprowa-
dzonych badań klinicznych z zastosowaniem różnych
β-adrenolityków
u chorych z NS nie potwierdziła jednak tej wstępnej hipotezy. Okazało się,
że zbliżone efekty kliniczne uzyskano zarówno przy stosowaniu metoprolo-
lu, który zwiększa gęstość receptorów
β
1
, jak i karwedilolu, który takich dzia-
łań nie wykazuje. Podobne obserwacje dotyczą wpływu na poziom noradre-
naliny – metoprolol nie obniża stężenia noradrenaliny, natomiast karwedilol
znamiennie go redukuje.
Próba wytłumaczenia mechanizmów odpowiedzialnych za korzystne dzia-
łania leków
β-adrenolitycznych w niewydolności serca, skłoniła do precyzyj-
nego przeanalizowania efektów pobudzenia receptorów
β-adrenergicznych.
Sygnał z
β-receptorów przenoszony jest dzięki sprzężeniu receptora z biał-
kiem Gs pod wpływem agonisty (katecholaminy). Prowadzi to do aktywacji
cyklazy adenylowej, kinazy białkowej, fosforylacji kanału wapniowego L
i fosfolambanu. Wzrost napływu wapnia przez kanał i jego wychwytywanie
przez siateczkę endoplazmatyczną zwiększa siłę skurczu i ułatwia rozkurcz.
W niewydolnym mięśniu sercowym sprzężenie receptora z białkiem Gs jest
zablokowane, a sygnał z aktywowanych receptorów
β ulega przełączeniu na
białko Gi, które hamuje cyklazę adenylową, a tym samym obniża poziom
cAMP. Wzrost poziomu białka Gi zwiększa aktywność fosfodiesterazy i fos-
fatazy, które nasilają rozpad cAMP. Zmniejszeniu ulega inotropizm oraz
rozkurcz mięśnia sercowego.
LEKI BLOKUJĄCE RECEPTORY BETA-ADRENERGICZNE
• hamują nadmierną aktywność białka Gi i tą drogą poprawiają kurczli-
wość, a może przede wszystkim fazę rozluźniania mięśnia sercowego;
• poprawiają wypełnienie rozkurczowe lewej komory, zmniejszają jedno-
cześnie wydatkowanie energii;
• hamują martwicę komórek mięśnia sercowego zarówno przez hamowa-
nie zjawiska apoptozy, jak i pośrednio przez zmniejszenie niedokrwienia;
61

• przeciwdziałają proarytmicznemu wpływowi katecholamin;
• poprawiają perfuzję w warstwie podwsierdziowej mięśnia sercowego.
BADANIA KLINICZNE Z ZASTOSOWANIEM LEKÓW
BETA-ADRENOLITYCZNYCH U CHORYCH Z NIEWYDOLNOŚCIĄ
SERCA (NYHA II-IV)
Badania nad skutecznością
β-adrenolityków u pacjentów z różnymi posta-
ciami niewydolności krążenia prowadzone są od ponad dwudziestu lat. Oce-
niano w nich wpływ leczenia na wybrane parametry hemodynamiczne, ro-
kowanie i jakość życia pacjentów. Ze względu na stosunkowo małe grupy
włączane wówczas do programów, niemożliwa była rzetelna analiza śmiertel-
ności i umieralności. Opierano się na podsumowujących metaanalizach,
z których najwięcej informacji wniosły przedstawione przez Doughty’ego
i wsp. w 1997 roku oraz Lechata w 1998 roku. Przeanalizowali oni ponad
trzydzieści poprawnie przeprowadzonych badań klinicznych, do których
zrandomizowano ponad trzy tysiące chorych z niewydolnością skurczową
serca. Metaanalizy wykazały znamienną redukcję śmiertelności w grupie le-
czonej
β-adrenolitykami w porównaniu z grupą placebo.
Badanie amerykańskie z zastosowaniem karwedilolu (US Carvedilol Stu-
dy – USCS) u pacjentów z niewydolnością serca było pierwszym, które wyka-
zało, że zablokowanie receptorów
β-adrenergicznych istotnie poprawia prze-
żywalność w tej grupie chorych. Karwedilol należy do nieselektywnych
β-adrenolityków, charakteryzuje się aktywnością antagonistyczną w stosun-
ku do receptorów
α
1
-adrenergicznych oraz właściwościami antyoksydacyj-
nymi. W małych dawkach, poniżej 12,5 mg/dobę blokuje jedynie receptor
β
1
, w większych blokuje wszystkie trzy receptory adrenergiczne, hamując jed-
nocześnie niekorzystne efekty biologiczne – przerost miocytów i apoptozę.
Próba obejmowała cztery studia kliniczne, do których zakwalifikowano po-
nad tysiąc chorych. Stwierdzono zaskakujące zmniejszenie śmiertelności
z wszystkich przyczyn u pacjentów leczonych karwedilolem o 65% w porów-
naniu z grupą otrzymującą placebo. Środowisko lekarskie odniosło się do
tych wyników z niedowierzaniem i dopiero opublikowanie wyników dużych,
prawidłowo skonstruowanych, randomizowanych badań CIBIS II (Cardiac
Insufficiency Bisoprolol Study) z bisoprololem oraz MERIT-HF (Metoprolol
CR/XL Randomized Intervention Trial in Congestive Heart Failure) z meto-
prololem, jednoznacznie potwierdziło istotną redukcję śmiertelności w gru-
pach leczonych
β-adrenolitykiem.
Bisoprolol należy do II generacji kardioselektywnych antagonistów recep-
tora
β
1
. Posiada 120 razy większe powinowactwo do receptora
β
1
niż
β
2
. Ba-
62

danie CIBIS II zostało wstrzymane przez Komisję Etyczną ze względu na
obserwowaną 32% redukcję śmiertelności z wszystkich przyczyn w grupie le-
czonej bisoprololem. Do badania włączono 2647 pacjentów w klasie czyn-
nościowej NYHA od II do IV, z frakcją wyrzutową poniżej 35%. Bisoprolol
był dołączany do terapii inhibitorem konwertazy oraz diuretykiem. Więk-
szość grupy badanej stanowili mężczyźni (81%), a 835 chorych znajdowało
się w III klasie NYHA. Okres obserwacji wynosił średnio 1,3 lat. Statystycz-
nie istotnemu zmniejszeniu o 44% uległa liczba nagłych zgonów, niezna-
miennie statystycznie o 26% zredukowano zgony spowodowane postępem
niewydolności serca. Terapia bisoprololem wiązała się również z redukcją
częstości hospitalizacji z powodu nasilenia NS o 32% (p<0,001).
Metoprolol jest kardioselektywnym
β-adrenolitykiem z 75 razy silniejszym
powinowactwem do receptora
β
1
niż
β
2
. Pierwszym wieloośrodkowym, kon-
trolowanym placebo badaniem z użyciem metoprololu, było badanie MDC
(Metoprolol in Dilated Cardiomyopathy). W wymienionej próbie, która obję-
ła 383 chorych, metoprolol w średniej dawce 108 mg/dobę nieznamiennie
redukował zgony, w stosunku do grupy kontrolnej, poprawiał natomiast
funkcję lewej komory, jakość życia, zmniejszał ilość hospitalizacji, a także
poprawiał tolerancję wysiłku.
Największym badaniem potwierdzającym założenie, że dołączenie me-
toprololu do konwencjonalnej terapii u chorych z NS zmniejsza śmiertel-
ność, było badanie MERIT-HF. Badanie zostało przedwcześnie zakończo-
ne na wniosek Komisji Etycznej ze względu na zaobserwowaną 34%
redukcję śmiertelności w grupie otrzymującej metoprolol CR/XL. Do ba-
dania włączono 3991 chorych w II-IV klasie czynnościowej NYHA, z frak-
cją wyrzutową nie większą niż 40%. Większość pacjentów (97%) była w II
i III klasie NYHA, jedynie 3-4% chorych demonstrowała objawy klinicz-
ne odpowiadające IV klasie czynnościowej. Osiągnięto znamienne zmniej-
szenie śmiertelności z wszystkich przyczyn, jak i śmiertelności z przyczyn
sercowo-naczyniowych. Zaobserwowano jednocześnie znamienną reduk-
cję nagłych zgonów o 41% (p=0,0002) oraz zgonów wynikających z po-
stępu niewydolności serca o 49% (p=0,023). Reasumując można powie-
dzieć, że dołączenie metoprololu do konwencjonalnej terapii pacjentów
z umiarkowaną niewydolnością serca, redukuje śmiertelność w tej gru-
pie, konieczność hospitalizacji, poprawia klasę czynnościową i jakość ży-
cia chorych.
Przedstawione wyżej programy stanowiły wiarygodną przesłankę do zasto-
sowania leków
β-adrenolitycznych u pacjentów z łagodną i umiarkowaną
niewydolnością skurczową serca oraz brakiem przeciwwskazań do takiego
leczenia. Nierozstrzygnięta była natomiast kwestia zastosowania tej grupy
63

leków u chorych z zaawansowaną niewydolnością serca, będących w IV kla-
sie czynnościowej NYHA. Pośrednio, na podstawie retrospektywnych analiz
przeprowadzonych badań klinicznych wnioskowano, że
β-adrenolityki mo-
gą przynosić korzyści również w tak obciążonej grupie pacjentów. Najwięk-
sze badania oceniające skuteczność i bezpieczeństwo stosowania
β-adreno-
lityków u chorych z zaawansowaną niewydolnością serca to badanie BEST
(Beta-Blocker Evaluation Survival Trial) oraz COPERNICUS (Carvedilol
Prospective Randomized Cumulative Survival).
W badaniu BEST stosowano bucindolol, niekardioselektywny
β-adrenoli-
tyk III generacji, z zaznaczonym efektem wazodilatacyjnym, dzięki słabemu
blokowaniu receptorów adrenergicznych
α
1
. Głównym celem badania była
ocena śmiertelności z wszystkich przyczyn w grupie leczonej. Wzięło w nim
udział 2708 pacjentów, 92% z nich było w III klasie czynnościowej NYHA,
pozostałe 8% w IV. Istotny odsetek stanowiły osoby rasy czarnej. Średni
okres obserwacji wynosił 2 lata. Wyniki badania nie były jednoznaczne.
Stwierdzono tendencję do spadku śmiertelności w grupie bucindololu, ale
różnica nie była znamienna statystycznie. Nie było różnicy w ilości nagłych
zgonów oraz zgonów z powodu postępującej niewydolności serca. Znamien-
ność statystyczną osiągnęła jedynie różnica w ilości zgonów z przyczyn serco-
wo-naczyniowych. Była mniejsza o 12,5% w grupie leczonej bucindololem
(p=0,04). Analiza podgrup badanych chorych ujawniła różnicę w odpowie-
dzi na leczenie między rasami. Większe korzyści odnotowano wśród pacjen-
tów rasy białej.
Badanie COPERNICUS objęło 2289 pacjentów z ciężką niewydolnością
serca, randomizowanych do dwóch grup: 1156 chorych do grupy aktywnego
leczenia oraz 1133 do grupy placebo. Badanie przerwano przedwcześnie
zgodnie z zaleceniem Komisji do Spraw Monitorowania i Bezpieczeństwa,
ponieważ stwierdzono znamienny wpływ karwedilolu na przeżywalność. Kar-
wedilol znacząco ograniczył śmiertelność w grupie z najcięższą niewydolno-
ścią serca o blisko 35%, w porównaniu do grupy placebo (p < 0,00013) Ta-
kiego wyniku nie uzyskano w żadnym badaniu z użyciem
β-adrenolityków
u pacjentów w IV grupie czynnościowej NYHA. Jednocześnie odnotowano
redukcję śmiertelności we wszystkich podgrupach badanych, niezależnie od
płci, wieku, rasy, etiologii NS, a także niezależnie od stopnia upośledzenia
funkcji lewej komory, mierzonej wielkością frakcji wyrzutowej. Korzyści te
odnotowano również w grupie z największym ryzykiem zgonu, z frakcją wy-
rzutową lewej komory <15%. Niezwykle obiecujące okazały się również do-
datkowe punkty końcowe badania. Ryzyko śmiertelności i hospitalizacji
z różnych przyczyn uległo redukcji o 24% w stosunku do placebo
(p < 0,0001), ryzyko śmiertelności i hospitalizacji z przyczyn sercowo-naczy-
64

niowych zmniejszyło się o 27% (p < 0,0001), a ryzyko zgonu i hospitalizacji
z powodu postępującej NS o 31% (p < 0,0001). Klinicznym wnioskiem pły-
nącym z przedstawionych danych jest obserwacja, że stosowanie karwedilo-
lu przez rok, w grupie 1000 chorych z ciężką niewydolnością serca, ratuje ży-
cie 70 osobom.
Mimo dużej ilości przeprowadzonych badań klinicznych, oceniających ko-
rzyści płynące z zastosowania różnych
β-adrenolityków w terapii niewydol-
ności serca, pozostają pytania, na które nie ma jednoznacznej odpowiedzi.
Być może toczące się nadal próby z karwedilolem (COMET) czy nebiwolo-
lem (SENIORS) pozwolą na rozstrzygnięcie wątpliwości.
Próbą odpowiedzi na pytanie – czy wszystkie badane
β-adrenolityki mogą
być zamiennie stosowane w leczeniu chorych ze skurczową niewydolnością
serca – były badania porównujące metoprolol z karwedilolem w grupie pa-
cjentów z niewydolnością skurczową serca. Oba leki powodowały poprawę
jakości życia chorych. Karwedilol korzystniej wpływał na parametry hemody-
namiczne, natomiast metoprolol zwiększał tolerancję wysiłku. Nie obserwo-
wano istotnych różnic w efektach działania obu preparatów. Obecnie trwają-
ce, duże studia (COMET), które objęły populację 3000 chorych w II-IV
klasie czynnościowej NYHA, są pierwszymi badaniami porównującymi nie-
selektywny
β-adrenolityk z selektywnym i ich wpływ na śmiertelność
z wszystkich przyczyn.
ZALECENIA DOTYCZĄCE STOSOWANIA LEKÓW
BETA-ADRENOLITYCZNYCH W NIEWYDOLNOŚCI SERCA
Stosowanie leków
β-adrenolitycznych jest zalecane u wszystkich chorych
– bez przeciwwskazań – ze stabilną, łagodną, umiarkowaną i ciężką NS, nie-
zależnie od etiologii. Należy podkreślić, że
β-adrenolityki są dodawane do
standardowej terapii NS, obejmującej diuretyki i ACE-inhibitory.
Obecnie dysponujemy badaniami, które potwierdziły skuteczność trzech
preparatów z grupy
β-adrenolityków: karwedilolu (USCS, COPERNICUS,
CAPRICORN), metoprololu (MERIT-HF) i bisoprololu (CIBIS II) w le-
czeniu NS. Zgodnie z protokołami, do badań włączano chorych spełniają-
cych określone kryteria.
65
UWAGI PRAKTYCZNE
1. Zalecenia dotyczące rozpoczynania terapii lekiem
b-adrenolitycznym:
• pacjent powinien otrzymywać ACE-inhibitor, jeżeli nie ma przeciwwska-
zań;
• pacjent powinien być w stabilnym stanie klinicznym, nie wymagającym
stosowania dożylnych leków o działaniu inotropowym, jak również nie
powinien demonstrować nasilonych objawów retencji płynów;
• leczenie należy zaczynać od dawki minimalnej leku, stopniowo ją zwięk-
szając do dawki podtrzymującej;
• w przypadku nasilenia objawów NS najpierw należy zwiększyć dawkę
diuretyków lub ACE-inhibitorów, a jeżeli to konieczne – zmniejszyć
dawkę
β-adrenolityku;
• w przypadku hipotonii, najpierw należy zmniejszyć dawkę leków rozsze-
rzających naczynia, a następnie
β-adrenolityku;
• zawsze należy rozważyć ponowne włączenie leku, jeżeli stan pacjenta
ulegnie stabilizacji.
2. Dawki leków beta-adrenolitycznych stosowanych w niewydolności serca
(tab. 1):
66
Tabela 1: Dawkowanie beta-adrenolityków w niewydolności serca
DAWKA
DAWKI
POCZĄTKOWA
DAWKA
ZALECANE WG
NAZWA LEKU
W BADANIACH
OPTYMALNA DOŚWIADCZEŃ
KLINICZNYCH
ZESPOŁU
5 mg
metoprolol
(zwiększanie
100-150 mg
50-100 mg
co około 6 tyg.)
metoprolol
o kontrolowanym
12,5 mg
200 mg
100-150 mg
uwalnianiu
1,25 mg
bisoprolol
(zwiększanie
10 mg
2,5-5 mg
co ok. 12 tyg.)
3,125 mg
karwedilol
(zwiększanie
50 mg
25-50 mg
co ok. 6 tyg.)

3. Do leczenia specjalistycznego należy kierować chorych w następujących
przypadkach:
• ciężka niewydolność serca III-IV klasa czynnościowa NYHA;
• nieznana etiologia NS;
• względne przeciwwskazania (hipotonia, bradykardia);
• nietolerancja małych dawek leków.
4. Przeciwwskazania do stosowania leków beta-adrenolitycznych:
• astma oskrzelowa;
• ciężka choroba oskrzelowo-płucna;
• objawowa bradykardia lub hipotonia.
Badania ankietowe oceniające stosowanie
β-adrenolityków w terapii cho-
rych z NS przeprowadzone w Europie potwierdziły, że leki te wykorzystywa-
ne są w praktyce klinicznej stosunkowo rzadko w 9-52% w zależności od kra-
ju. W świetle przedstawionych opinii należy stwierdzić, że zbyt rzadko.
Zapamiętaj!
1. Badania kliniczne potwierdziły, że leki
β-adrenolityczne (bisoprolol, meto-
prolol, karwedilol) zmniejszają śmiertelność w grupie chorych ze skurczową
NS, niezależnie od etiologii.
2. Każdy chory z rozpoznaną NS, bądź dysfunkcją lewej komory powinien
mieć podjętą próbę leczenia
β-adrenolitykiem, przy braku przeciwwskazań
do takiego leczenia.
3. Leki
β-adrenolityczne powinny być dodawane do leczenia standardowego
NS (diuretyk, ACE-I).
4. Leczenie należy rozpoczynać od najmniejszej możliwej dawki, zwiększając
ją w ciągu kilku tygodni do dawki optymalnej.
5. Efekty leczenia
β-adrenolitykami są długoterminowe.
Polecane lektury:
J. Korewicki: Zastosowanie leków beta-adrenolitycznych w leczeniu skurczo-
wej niewydolności serca; Kardiologia Polska, 2000, 53, III, 119-126.
MERIT-HF Study Group: Effect of metoprolol CR/XL in chronic heart fa-
ilure: metoprolol CR/XL Randomised Intervention Trial in Congestive Heart
failure (MERIT-HF); Lancet, 1999; 353: 2001-2006.
67

J. Korewicki, P. Leszek, T. Zieliński: Niewydolność serca – zarys patofizjolo-
gii i zasady leczenia; Med. Science Rev., 1999, 2: 70-84.
W. S. Colucci, E. Braunwald: Atlas niewydolności serca; wydanie I, Gdańsk,
2001.
Polskie Towarzystwo Kardiologiczne: Standardy postępowania w chorobach
układu krążenia; Kardiologia Polska, 1997, 46, Suplement.
68
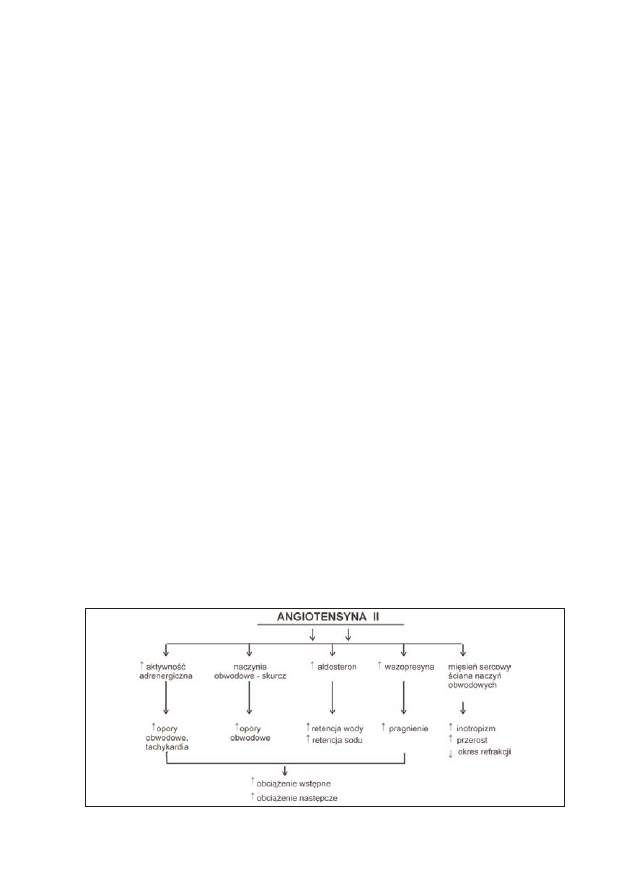
VI.
INHIBITORY KONWERTAZY ANGIOTENSYNY
– PANACEUM NOWEGO TYSIĄCLECIA
Iwonna Grzywanowska-Łaniewska, Monika Tomaszewska-Kiecana,
Joanna Syska-Sumińska
Pojawienie się inhibitorów enzymu konwertującego angiotensynę (ACE-I)
można uznać za największe wydarzenie w farmakoterapii chorób układu
krążenia w ciągu ostatnich dwudziestu lat. Wynika to z różnorodności ich
korzystnych oddziaływań na układ krążenia i metabolizm oraz udowodnio-
nego wydłużenia czasu przeżycia w niewydolności serca.
ROLA UKŁADU RENINA-ANGIOTENSYNA-ALDOSTERON
Lokalizacja składowych układu enzymatycznego R-A-A (reniny, angioten-
synogenu, konwertazy – enzymu przekształcającego angiotensynę I do an-
giotensyny II – angiotensyny I, angiotensyny II) pozwoliła na wyodrębnie-
nie dwóch jego części: osoczowej (krążącej) i tkankowej (miejscowej). Około
90% układu R-A-A jest umiejscowione tkankowo, głównie w śródbłonku na-
czyń, ale także w sercu, płucach, nerkach, jelitach, jądrach, układzie nerwo-
wym, nadnerczach, makrofagach i wielu innych tkankach i narządach. Po-
zostałe 10% znajduje się w osoczu. Uważa się, że krążący układ R-A-A
działa w stanach ostrych (krwotok, odwodnienie), zaś miejscowy w stanach
przewlekłych. Osoczowy układ R-A-A reguluje ciśnienie krwi oraz gospodar-
kę wodno-elektrolitową, a tkankowy wpływa na funkcje właściwe dla danego
narządu. W układzie krążenia pełni ważną rolę w modulowaniu czynności
zdrowego serca i naczyń oraz bierze udział w patogenezie niewydolności krą-
żenia. Układ R-A-A jest ściśle związany z układem kalikreina-bradykinina.
ACE powoduje rozkład bradykininy do jej nieaktywnych związków.
69
Rycina 1: Schemat działania i wpływ na układ krążenia angiotensyny II

Angiotensyna II jest bardzo aktywną biologicznie substancją. Mechanizmy
i skutki działania angiotensyny II przedstawiono w tabeli 2.
ROLA BRADYKININY
Bradykinina stymuluje produkcję i wydzielanie prostacykliny (PGI
2
), tlen-
ku azotu (NO), czynnika hiperpolaryzującego (EDHF) i fibrynolitycznego
aktywatora plazminogenu (t-PA). Ponadto wykazuje działanie (bezpośred-
nio i pośrednio):
• naczyniorozszerzające;
• przeciwpłytkowe;
• przeciwzakrzepowe;
• trombolityczne;
• przeciwzapalne;
• antyproliferacyjne.
70
Tabela 1: Historia odkryć związanych z układem renina-angiotensyna-aldosteron i powstaniem ACE-I
ROK
ODKRYCIE
AUTOR
1898
presyjne działanie wyciągu
Tigerstadt,
z nerek królika
Bergman
1934
wykrycie reniny
Goldblatt
1950-56
wykrycie angiotensyny I, angiotensyny II
Skeggs
i enzymu przekształcającego
angiotensynę (ACE)
1966
wykrycie leków hamujących ACE
Fereira
(Brazylia)
Vane (Anglia)
1970
wyizolowanie z jadu brazylijskiej żmii
teprotydu, pierwszego inhibitora ACE
1975
synteza kaptoprilu
Ondetti,
Cushman, Rubin
1977
pierwsze doniesienia o skuteczności
Ferguson i wsp.
klinicznej kaptoprilu
1978
kaptopril w niewydolności serca
Curtis i wsp.
Gavras i wsp.
1980-1993 wprowadzenie wielu leków ACE-I

MECHANIZM DZIAŁANIA ACE-I
Zasadniczym mechanizmem działania ACE-I jest blokowanie aktywnego
centrum enzymu konwertującego, co prowadzi do spadku syntezy angioten-
syny II oraz zahamowania rozpadu bradykininy (ryc. 2).
71
Tabela 2: Mechanizmy i skutki działania angiotensyny II
MECHANIZMY DZIAŁANIA
SKUTKI DZIAŁANIA
ANGIOTENSYNY II
ANGIOTENSYNY II
W ORGANIZMIE
skurcz naczyń
wzrost ciśnienia tętniczego;
(bezpośrednio i poprzez inne
oporu obwodowego;
substancje naczyniokurczące)
obciążenia wstępnego
i następczego;
spadek diurezy;
spadek miejscowego przepływu
krwi;
zmiany hormonalne:
• wzrost aldosteronu,
retencja sodu i wody;
• wzrost wazopresyny,
wzrost pragnienia;
• wzrost ADH
aktywacja układu adrenergicznego;
tachykardia + j.w.;
hamowanie odruchu
obniżona stabilność
z barorecptorów; elektryczna
serca;
osłabione odruchy
sercowo-naczyniowe;
zwiększenie siły skurczu serca;
wzrost zapotrzebowania na tlen;
przerost mięśnia sercowego;
przerost kardiomiocytów,
przebudowa i odkształcanie
komórek mięśni gładkich naczyń,
serca i naczyń,
fibroblastów; zwłóknienie
serca
modulacja odczynu zapalnego;
działanie prozapalne;
działanie promiażdżycowe;
destabilizacja blaszki
miażdżycowej;
hamowanie aktywności
wzrost gotowości zakrzepowej;
fibrynolitycznej osocza;
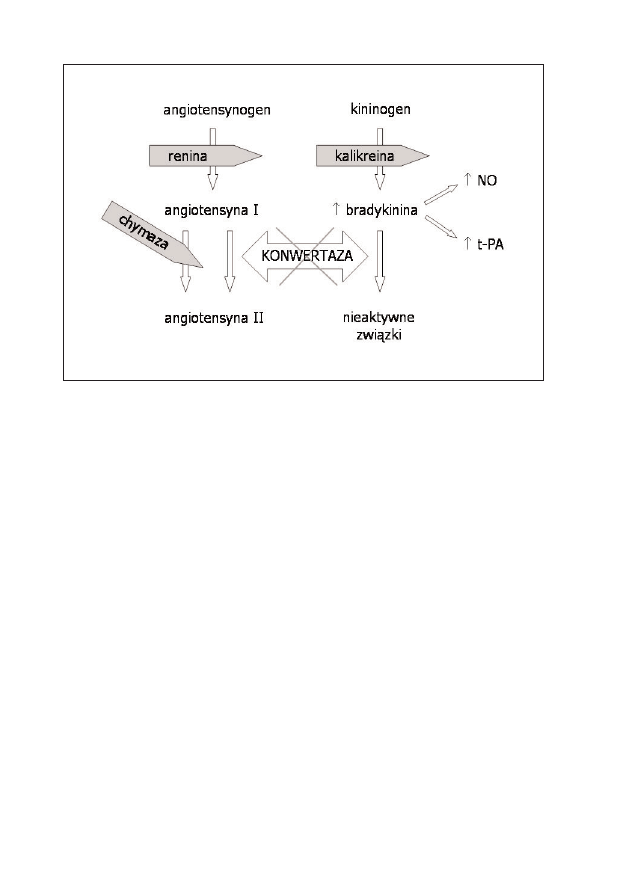
Istnieją alternatywne szlaki powstawania angiotensyny II (najbardziej
znany jest chymazowy), które nie są blokowane przez ACE-I. Leki blokujące
konwertazę obniżają stężenie angiotensyny II i podnoszą stężenie
bradykininy, zarówno w układzie tkankowym, jak i osoczowym. A zatem
zastosowanie ACE-I w istotny sposób niweluje skutki działania angiotensyny
II, a nasila działanie endogennej bradykininy.
GŁÓWNE EFEKTY BIOLOGICZNE ACE-I
• rozkurcz naczyń krwionośnych (zniesienie bezpośredniego działania an-
giotensyny II, spadek aktywności endoteliny śródbłonkowej, obecność
bradykininy);
• spadek produkcji katecholamin (szczególnie noradrenaliny) przez ko-
rę nadnerczy, zwoje współczulne, OUN oraz zmniejszenie wrażliwości
receptorów postsynaptycznych na noradrenalinę;
• utrata sodu i wody, a zatrzymywanie potasu poprzez zahamowanie pro-
dukcji aldosteronu, wazopresyny i angiotensyny, zahamowanie aktyw-
ności ośrodka pragnienia;
• poprawa diurezy oraz ochrona kłębuszka nerkowego przed skokami ci-
śnienia tętniczego, poprzez rozszerzenie w większym stopniu tętniczki
odprowadzającej od doprowadzającej;
72
Rycina 2: Schemat działania inhibitorów konwertazy

• hamowanie rozrostu fibroblastów, mięśni gładkich naczyń, przerostu
mięśnia sercowego, zapobieganie jego przebudowie i odkształcaniu.
KLINICZNE SKUTKI DZIAŁANIA ACE-I W ORGANIZMIE
1. Wpływ na układ krążenia:
• zmniejszenie oporu naczyniowego i ciśnienia tętniczego bez zmian
częstości tętna;
• zmniejszenie obciążenia wstępnego i następczego serca, wzrost objętości
wyrzutowej serca;
• zmiana struktury serca i naczyń (zmniejszenie masy, regresja przerostu
lewej komory);
• regresja zwłóknienia okołonaczyniowego, działanie antyproliferacyjne;
• poprawa przepływu tkankowego krwi;
• przywrócenie odruchu z baroreceptorów;
• poprawa stabilności elektrycznej serca (redukcja zaburzeń rytmu serca).
2. Wpływ na gospodarkę wodno-elektrolitową:
• zwiększenie diurezy;
• zwiększenie stężenia potasu.
3. Wpływ na metabolizm:
• wzrost wrażliwości na insulinę;
• poprawa tolerancji glukozy;
• niewielki wzrost cholesterolu frakcji HDL, bez wpływu na poziom
cholesterolu frakcji LDL i trójglicerydów.
4. Wpływ na układ krzepnięcia:
• zmniejszenie aktywności i agregacji płytek;
• wzrost aktywności fibrynolitycznej osocza.
5. Działanie przeciwmiażdżycowe:
• stabilizacja blaszki miażdżycowej;
73

74
Tabela 3: Kliniczne wskazania do stosowania ACE-I
pierwotne;
wtórne, w tym:
• naczyniowo-nerkowe (także diagnostyka);
• z przerostem lewej komory;
NADCIŚNIENIE
• przełom nadciśnieniowy;
TĘTNICZE
• z zaburzeniami metabolicznymi:
– z cukrzycą,
– hiperlipidemią,
– hiperurykemią, dną moczanową;
• u chorych z chorobami naczyń obwodowych;
• u chorych z chorobami układu oddechowego;
NIEWYDOLNOŚĆ
• skurczowa;
SERCA
• rozkurczowa;
• ściany przedniej;
• rozległy;
• kolejny zawał serca;
ZAWAŁ
• z niewydolnością serca;
SERCA
• z dysfunkcją lewej komory bez cech
niewydolności serca;
• z nadciśnieniem tętniczym;
• z niewydolnością serca;
CHOROBA
• z nadciśnieniem tętniczym;
WIEŃCOWA
• u chorych wysokiego ryzyka powikłań
naczyniowo-sercowych (?);
ZAPOBIEGANIE
POWIKŁANIOM
• po przebytym zawale serca;
SERCOWO-
• z cukrzycą;
NACZYNIOWYM
• z innymi czynnikami ryzyka (?);
W GRUPIE CHORYCH • u osób starszych;
WYSOKIEGO RYZYKA
CUKRZYCA
• typ I z mikroalbuminurią;
• typ II z mikroalbuminurią;
NEFROPATIE
• cukrzycowa;
• nadciśnieniowa;
• z białkomoczem;
STAN PO
• z nadciśnieniem tętniczym;
UDARZE MÓZGU
• bez nadciśnienia tętniczego (?);

• działanie przeciwzapalne;
• działanie antyoksydacyjne.
6. Hamujący wpływ na układ adrenergiczny.
WSKAZANIA DO STOSOWANIA ACE-I
Początkowo leki te stosowano w leczeniu nadciśnienia tętniczego. Naj-
pierw za wskazanie uważano nadciśnienie z dużą aktywnością reninową oso-
cza, ale później potwierdzono również ich skuteczność u chorych z prawi-
dłowym poziomem reniny. Ogromne znaczenie miało zastosowanie ACE-I
w leczeniu niewydolności serca; okazały się skuteczne nawet w niewydolno-
ści opornej na dotychczasową terapię. Ostatnio, dzięki wprowadzeniu no-
wych preparatów i przeprowadzeniu szeregu badań klinicznych pojawiły się
nowe wskazania do ich stosowania.
Nadciśnienie tętnicze
Leki tej grupy są skuteczne w leczeniu nadciśnienia wszystkich stopni wg
WHO. Działanie hipotensyjne ACE-I obserwuje się zarówno wśród cho-
rych z wysoką, jak i niską aktywnością reninową osocza, bowiem nie zależy
ono jedynie od hamowania układu R-A-A. Dobra odpowiedź hipotensyj-
na na leki tej grupy zależy od genotypu, np. ich skuteczność wśród chorych
rasy czarnej jest znacznie mniejsza. Inhibitory konwertazy zastosowane
u chorych z przerostem lewej komory powodują jego regresję. Leki te wy-
korzystywane są w czasie diagnostyki nadciśnienia naczyniowo-nerkowe-
go. W przypadku zwężenia tętnicy nerkowej podanie kaptoprilu zmniejsza
przepływ przez nerkę zaopatrywaną przez zwężoną tętnicę. W czasie scyn-
tygrafii nerek uwidacznia się wówczas asymetria w perfuzji obu nerek.
W przypadku podejrzenia zwężenia obu tętnic nerkowych lub tętnicy je-
dynej nerki test ten nie powinien być wykorzystywany, bowiem może wy-
wołać ostrą niewydolność nerek. W czasie przełomu nadciśnieniowego,
kaptopril można stosować doraźnie (podjęzykowo lub doustnie), bowiem
jest on substancją aktywną, a nie prolekiem, jak większość preparatów
ACE-I. Zalecana dawka to 12,5-25 mg, efekt hipotensyjny występuje po
ok. 15-30 min. ACE-I w leczeniu nadciśnienia tętniczego są wskazane
w przypadku współistnienia zaburzeń metabolicznych: w cukrzycy hamują
rozwój nefropatii cukrzycowej i zmniejszają insulinooporność, w hiperury-
kemii czy dnie moczanowej, zwiększają wydalanie moczanów przez nerki,
w hiperlipidemii pozostają obojętne lub wręcz poprawiają profil lipidowy.
75

Leki te mogą bezpiecznie być stosowane w leczeniu nadciśnienia u cho-
rych z chorobami naczyń obwodowych (w miażdżycy zarostowej tętnic koń-
czyn dolnych obserwowano nawet wydłużenie dystansu chromania) oraz
u chorych ze stanami skurczowymi oskrzeli.
Niewydolność serca
Obecnie u chorych z niewydolnością serca spowodowaną upośledzeniem
funkcji skurczowej, ACE-I są lekami pierwszego wyboru. Ich działanie obej-
muje wszystkie ogniwa patofizjologiczne rozwoju zastoinowej niewydolno-
ści serca. Szereg badań klinicznych, począwszy od przełomowego SAVE
(1992 rok) po opublikowaną w numerze 355 Lancetu w 2000 roku metaana-
lizę 12 763 pacjentów, udowodniło, że zastosowanie ACE-I zmniejsza śmier-
telność ogólną i częstość hospitalizacji z powodu niewydolności serca. Leki
te łagodzą objawy i zapobiegają progresji niewydolności serca, poprawiają
tolerancję wysiłku, klasę czynnościową NYHA. Poprawiają rokowanie
u chorych z cechami niewydolności serca w ostrej fazie zawału. Leczenie
ACE-I należy rozpoczynać od małych dawek, dążąc do maksymalnej, dobrze
tolerowanej, starając się osiągnąć dawki stosowane w dużych próbach kli-
nicznych. Leki te mogą być stosowane w monoterapii, jak i w skojarzeniu
z diuretykami, naparstnicą, nitratami czy innymi wazodylatatorami. Szcze-
gólnie korzystne, choć wymagające uwagi, jest połączenie ACE-I z diurety-
kami. Diuretyki aktywują układ R-A-A, dając tym samym substrat do działa-
nia ACE-I. Jednak w
przypadku wcześniejszej terapii lekami
odwadniającymi, podanie inhibitorów konwertazy może spowodować znacz-
ną, groźną hipotonię. Właściwym jest rozpoczynanie leczenia od ACE-I
i w razie potrzeby dołączenie leków odwadniających. Jeżeli chory już otrzy-
muje diuretyk, należy dawkę tego leku zmniejszyć lub, o ile jest to możliwe,
lek odstawić. W czasie zwiększania dawki należy kontrolować ciśnienie tętni-
cze, funkcję nerek, poziom elektrolitów. Ryzyko hiperkaliemii przy stoso-
waniu diuretyków oszczędzających potas zależy od dawki tych ostatnich.
Zwykle przy podawaniu 25 mg spironolaktonu ryzyko to jest bardzo niewiel-
kie. ACE-I powinny być stosowane u chorych z dysfunkcją skurczową lewej
komory, nawet bez objawów niewydolności serca. Pojawia się coraz więcej
danych potwierdzających korzystny wpływ ACE-I na rozkurczową niewydol-
ność serca.
Cukrzyca
Często przebiega z nadciśnieniem tętniczym. Wykazano, że stosowane
wówczas ACE-I opóźniają rozwój nefropatii cukrzycowej oraz makroangio-
76

patii, nie wywierając niekorzystnego wpływu na profil lipidowy, a nawet
zwiększając wrażliwość na insulinę. Powinny też być stosowane w cukrzycy
bez nadciśnienia tętniczego, bowiem wówczas również zmniejszają mikroal-
buminurię, hamują rozwój nefropatii cukrzycowej bez obniżenia ciśnienia
systemowego.
Nefropatie
Nefropatie cukrzycowa i nadciśnieniowa zostały omówione wyżej. Nadto
udowodniono, że inhibitory ACE spowalniają rozwój niewydolności nerek
u chorych z patologią nerek, przebiegającą z białkomoczem lub bez niego.
Zawał serca i choroba wieńcowa
ACE-I mają hamujący wpływ na rozwój niekorzystnej przebudowy serca
i naczyń u chorych po zawale serca (ISIS-4, SAVE). Szczególne wskazanie
stanowi rozległy zawał ściany przedniej lub z obniżoną frakcją wyrzucania,
nawet bez cech jawnej niewydolności serca. Zaobserwowano bowiem, że
u chorych z opisanymi wyżej uszkodzeniami, szybko dochodzi do przebudo-
wy i rozstrzeni lewej komory, a następnie rozwoju niewydolności serca. Ko-
lejny zawał serca czy niewydolność serca wikłająca ostrą fazę zawału, rów-
nież stanowią wskazanie do stosowania ACE-I. Nie ustalono jednoznacznie
czasu rozpoczęcia terapii u chorych z zawałem serca. Przy wysokim ciśnieniu
tętniczym terapia może być rozpoczęta od razu, choć od małych dawek.
W przypadku normotensji, właściwszym jest rozpoczęcie leczenia od 3-ciej
doby, wówczas bowiem dochodzi do największej aktywacji układu R-A-A.
Podstawowym mechanizmem skuteczności ACE-I w chorobie wieńcowej,
jest poprawa funkcji śródbłonka tętnic nasierdziowych i korzystna modulacja
neurohormonalna. Wydaje się, że właściwości te mają szczególnie mocno
wyrażone ACE-I blokujące tkankową konwertazę. Przesłanki do stosowania
ACE-I w chorobie wieńcowej to:
• poprawa hemodynamiki (przez zmniejszenie obciążenia serca), bez
przyśpieszania czynności serca, poprawia to bilans tlenowy,
• poszerzenie tętnic wieńcowych,
• redukcja zaburzeń rytmu (spadek aktywności adrenergicznej, poprawa
hemodynamiki, spadek ilości wolnych rodników),
• zmniejszenie aktywacji i agregacji płytek,
• nasilenie fibrynolizy,
• zapobieganie niekorzystnej przebudowie serca i naczyń,
77
• działanie przeciwmiażdżycowe; dowodów dostarczyło badanie SECU-
RE, w którym zaobserwowano zmniejszenie progresji zmian miażdżyco-
wych w tętnicy szyjnej u chorych leczonych wysoką dawką ramiprilu (by-
ło ono wykonywane w ramach programu HOPE, w którym leczono
ramiprilem vs placebo chorych z grup wysokiego ryzyka powikłań serco-
wo-naczyniowych – w grupie leczonej aktywnie po 5 latach zaobserwo-
wano spadek o 20% występowania zawałów serca, o 32% udarów mó-
zgu, o 15% zabiegów rewaskularyzacji mięśnia sercowego).
Stan po udarze mózgu
Udar mózgu jest najgroźniejszą chorobą układu naczyniowego. Badanie
HOPE i PROGRESS dowiodły, że stosowanie ACE-I zmniejsza ryzyko uda-
ru mózgu, zarówno pierwszego, jak i ponownego. W badaniu PROGRESS
w grupie chorych z nadciśnieniem tętniczym leczenie perindoprilem zmniej-
szało ryzyko względne udarów o 33%, a w grupie chorych z normotensją
o 22%. Korzystne wyniki uzyskano w przypadku udarów niedokrwiennych
i krwotocznych. Stosowanie ACE-I po udarze mózgu wymaga rozwagi
i ostrożności, ale zawsze powinno być brane pod uwagę.
PRZECIWWSKAZANIA DO STOSOWANIA ACE-I
78
Tabela 4: Przeciwwskazania do stosowania ACE-I
• ciąża i laktacja;
BEZWZGLĘDNE
• zwężenie tętnicy nerkowej (obustronne
lub jedynej czynnej nerki);
• reakcje nadwrażliwości (obrzęk
naczynioruchowy);
• stenoza zastawki aorty;
• koarktacja aorty;
WZGLĘDNE
• kardiomiopatia przerostowa
z zawężeniem drogi odpływu;
• niewydolność nerek;
• hipowolemia, hiponatremia;

Ciąża
ACE-I nie mogą być stosowane w ciąży. Podawane w II i III trymestrze
działają embriopatycznie i powodują groźne powikłania: niewydolność ne-
rek, anurię, deformację twarzy i czaszki, niedorozwój płuc, obumieranie pło-
du, małowodzie. Nie powinny być stosowane również w I trymestrze ciąży,
a jeżeli już są, to szybko odstawione zwykle nie stanowią zagrożenia dla pło-
du i ciąży. Nie wolno tych leków stosować także u kobiet karmiących, bo-
wiem przenikają do mleka w dużym stężeniu.
Zwężenie tętnicy nerkowej obustronne lub jedynej nerki
Filtracja kłębuszkowa w niedokrwionej nerce utrzymywana jest dzięki
skurczowi – pod wpływem angiotensyny II – tętniczki odprowadzającej, co
zapewnia odpowiednie ciśnienie filtracyjne. Zniesienie tego mechanizmu po
podaniu ACE-I prowadzi do nagłego spadku filtracji i szybko narastającej
niewydolności nerek. Za chorych z możliwością tej patologii należy uznać
osoby starsze, z uogólnionymi zmianami miażdżycowymi.
Obrzęk naczynioruchowy
Po przebytym epizodzie obrzęku naczynioruchowego po ACE-I, nie nale-
ży podejmować kolejnych prób stosowania leku.
Stenoza aortalna oraz inne patologie utrudniające odpływ krwi z lewej
komory (koarkatacja aorty, kardiomiopatia przerostowa z zawężeniem drogi
odpływu)
W wyniku spadku oporu obwodowego dochodzi do nasilenia gradientu
w drodze odpływu lewej komory, powoduje to spadek rzutu serca i nasile-
nie objawów chorobowych. Wyjątek stanowi leczenie zaawansowanej niewy-
dolności serca w przypadku nieoperacyjnej stenozy aortalnej (podawać
ostrożnie!).
Niewydolność nerek
U chorych z niewydolnością serca lub hipowolemią, ACE-I mogą pogor-
szyć czynność nerek, bowiem zależy ona w dużym stopniu od obkurczenia
tętniczki odprowadzającej. Podawanie leku zależy od stopnia niewydolności
nerek (graniczna wartość kreatyniny 2,5 mg%, wymaga redukcji dawki –
zwykle o połowę – i monitorowania azotemii). W nefropatii cukrzycowej
i nadciśnieniowej hamują progresję choroby.
79

Hipowolemia, hiponatremia
W stanach tych dochodzi do znacznej aktywacji układu R-A-A jako me-
chanizmu kompensacyjnego. Zniesienie tej reakcji może objawiać się gwał-
towną hipotonią.
OBJAWY NIEPOŻĄDANE PRZY STOSOWANIU ACE-I
W praktyce występują dwa główne działania niepożądane: hipotonia
i kaszel.
Hipotonia
Szczególnie u chorych z niewydolnością serca, leczonych diuretykami oraz
w innych stanach przebiegających z wysoką aktywnością układu R-A-A. Ry-
zyko wystąpienia hipotonii zmniejsza: odstawienie diuretyku na 2-3 dni
przed włączeniem ACE-I, redukcja jego dawki lub rozpoczynanie terapii
ACE-I od małych dawek.
80
Tabela 5: Objawy niepożądane przy stosowaniu ACE-inhibitorów
OBJAW
CZĘSTOŚĆ WYSTĘPOWANIA
hipotonia
2-7%
kaszel
1,6-25%
zaczerwienienie skóry
2-10%
zaburzenia smaku
1-4%
bóle głowy
1-5%
pogorszenie funkcji nerek
0,5-3%
hiperkaliemia
0,4-4%
białkomocz
0,5-3%
obrzęk naczynioruchowy
0,2-0,4%
neutropenia
0,01-0,2%
bóle mięśniowe
( - )
hepatopatia
( - )
neuropatia
( - )

Kaszel
Suchy, męczący; może wystąpić zarówno na początku terapii, jak i po 24
miesiącach! Postulowany mechanizm jego wystąpienia to wzrost poziomu
bradykininy i/lub substancji P w tkankach. Kaszel może ustąpić samoistnie
(u połowy chorych). W celu jego złagodzenia, można dołączyć do stosowa-
nego leczenia kromoglikan sodu lub nifedypinę (mała dawka). Skuteczne
w leczeniu kaszlu bywają też preparaty NLPZ, choć zmniejszają efekt hipo-
tensyjny.
LECZENIE INHIBITORAMI KONWERTAZY – UWAGI PRAKTYCZNE
Przed rozpoczęciem terapii:
• ocena stopnia nawodnienia chorego;
• pomiar ciśnienia tętniczego w pozycji siedzącej i stojącej;
• ocena stanu zastawek serca;
• oznaczenie poziomu kreatyniny i jonogramu;
• odstawienie leków moczopędnych (o ile jest to możliwe);
• indywidualny dobór preparatu.
Początek terapii:
• rozpoczęcie od małych dawek leku;
• ocena ciśnienia tętniczego i tętna po 2-3 godzinach po podaniu pierwszej
dawki leku;
• stopniowe zwiększanie dawki leku co 7-14 dni;
• kontrola jonogramu i parametrów wydolności nerek po ok. 10-14 dniach
leczenia.
Dawkę leku zwiększa się co kilka dni, pod kontrolą parametrów hemody-
namicznych (ciśnienie tętnicze, tętno, diureza), dążąc do dawki optymalnej
dla każdego pacjenta – rozumianej głównie jako utrzymanie pożądanej war-
tości ciśnienia tętniczego.
Jednocześnie trzeba podkreślić, że pełne korzyści terapii mogą pojawić się
tylko przy zalecaniu określonych, stosowanych w dużych badaniach klinicz-
nych dawek ACE-inhibitorów.
Wybór preparatu ACE-I winien zależeć od indywidualizacji leczenia u da-
nego chorego i doświadczenia lekarza.
81

INTERAKCJE INHIBITORÓW KONWERTAZY
Interakcje preparatów ACE-I z innymi lekami dotyczą głównie wzmożo-
nego lub osłabionego efektu hipotensyjnego, hiperkaliemii, zaburzeń wchła-
niania (tab. 6).
82
Tabela 6: Interakcje ACE-I z innymi lekami
• oszczędzające potas - ryzyko hiperkaliemii;
przy stosowaniu spironolaktonu w dawce
25 mg/d, niebezpieczeństwo to jest bardzo
małe;
DIURETYKI
• pętlowe, tiazydy – addycyjne działanie
hipotensyjne, zwiększone ryzyko efektu
pierwszej dawki (znaczna hipotonia),
zmniejszenie utraty K
+
, zapobieganie
wzrostowi poziomu kwasu moczowego;
• niewielkie zwiększenie efektu
BETA-
hipotensyjnego w NT;
ADRENOLITYKI
• właściwe skojarzenie w NS;
GLIKOZYDY
• korzystne skojarzenie w NS;
NAPARSTNICY
• ostrożnie u chorych z zaawansowaną NS
(możliwość pogorszenia funkcji nerek
i kumulacji naparstnicy);
• osłabienie efektu hipotensyjnego
NIESTERYDOWE
ACE-I (blokowanie syntezy
LEKI
naczyniorozszerzających prostaglandyn);
PRZECIWZAPALNE
• możliwość upośledzenia funkcji nerek,
zwłaszcza u chorych z upośledzoną
perfuzją nerek (niewydolność serca,
marskość wątroby);
• większe ryzyko hiperkaliemii
z indometacyną;
KWAS
nie zaobserwowano niekorzystnych
ACETYLO-
interakcji z ACE-I przy stosowaniu
SALICYLOWY
małych dawek kwasu acetylosalicylowego;
INSULINA,
ACE-I zwiększają wrażliwość na insulinę,
DOUSTNE LEKI
co może nasilać ryzyko hipoglikemii,
HIPOGLIKEMI-
zarówno w czasie leczenia insuliną,
ZUJĄCE
jak i doustnymi preparatami
hipoglikemizującymi;

83
Tabela 6: Interakcje ACE-I z innymi lekami c.d.
ANTAGONIŚCI
addycyjne działanie hipotensyjne
KANAŁÓW
oraz zmniejszające mikroalbuminurię
WAPNIOWYCH
w nefropatii cukrzycowej;
PROCAINAMID,
HYDRALAZYNA,
większe ryzyko uszkodzenia
LEKI
IMMUNO-
szpiku i neutropenii;
SUPRESYJNE
TIKLOPIDYNA, nie
zaobserwowano
KLOPIDOGREL
niekorzystnych interakcji;
LEKI
nie zaobserwowano
PRZECIW-
niekorzystnych interakcji;
KRZEPLIWE
ALFA-
zwiększone ryzyko hipotonii;
-ADRENOLITYKI
NT - nadciśnienie tętnicze, NS - niewydolność serca
Tabela 7: Preparaty ACE-I zarejestrowane w Polsce i ich charakterystyka
PREPARATY DAWKI:
CECHY
zarejestrowane początkowa-maks.
/d;
CHARAKTERYSTYCZNE
w Polsce
częstość podawania/d
BENAZEPRIL
tabletki:
NT: 10-40 mg
rejestracja: NT, prolek,
5 mg
NS: 5-40 mg
wydalany przez nerki,
10 mg
1-2
×/d
biologiczny okres półtrwa-
20 mg
nia 10-11 h, niska lipofil-
ność, duże powinowactwo
tkankowe, bezpieczny
w podeszłym wieku;
W AIPRI wydłużał czas do
rozwoju schyłkowej NN;
WYKAZ PREPARATÓW DOSTĘPNYCH W POLSCE
W Polsce zarejestrowanych jest szereg preparatów ACE-I różniących się
między sobą budową chemiczną, farmakokinetyką, wskazaniami rejestracyj-
nymi i cechami szczególnymi. Dawkowanie opiera się na zaleceniach pod-
ręcznikowych i doświadczeniu klinicznym, ale powinno ono ulegać modyfi-
kacji w poszczególnych sytuacjach klinicznych.

84
Tabela 7: Preparaty ACE-I zarejestrowane w Polsce i ich charakterystyka c.d.
PREPARATY DAWKI:
CECHY
zarejestrowane początkowa-maks.
/d;
CHARAKTERYSTYCZNE
w Polsce
częstość podawania/d
CHINAPRIL
tabletki:
NT: 10-20 mg, 1-2
×/d rejestracja: NT, NS
5 mg
NS: 2,5-40mg, 2
×/d
prolek, pokarm bez
10 mg
>65 r. ż. maks.
wpływu na wchłanianie,
20 mg
do 20 mg/d
metabolizowany głównie
w wątrobie; pełny efekt he-
modynamiczny po 1-2 tyg.
stosowania, efekt hipotensyj-
ny utrzymuje się ponad 24 h,
można podawać na noc, wy-
soka lipofilność; „tkankowy”,
stymuluje angiogenezę, udo-
wodniony wpływ na śródbło-
nek (TREND);
CILAZAPRIL
tabletki:
NT: 1-5 mg, 1
×/d
rejestracja: NT, NS
0,5 mg
NS: 0,5-2.5 mg, 1
×/d
prolek, wchłanianie bez
1 mg
związku z posiłkiem, nie
2,5 mg
wiąże się z białkami,
5 mg
wydalany przez nerki w po-
staci niezmienionej, niska li-
pofilność;
ENALAPRIL
tabletki:
NT: 5-20 mg, 2
×/d
rejestracja: NT, NS
2,5 mg
NS: 2,5-10 mg/d,
prolek, okres półtrwania
5 mg
1-2
×/d
ok. 11 h, wydalany
10 mg
z moczem i kałem, niska
20 mg
lipofilność, „osoczowy”, ko-
nieczny indywidualny dobór
dawki w NS, NN i w wieku
podeszłym; redukcja śmier-
telności w grupie chorych
z NS (CONSENSUS,
SOLVD); spadek ryzyka ZS
u chorych z cukrzycą i NT
(ABCD);

85
Tabela 7: Preparaty ACE-I zarejestrowane w Polsce i ich charakterystyka c.d.
PREPARATY DAWKI:
CECHY
zarejestrowane początkowa-maks.
/d;
CHARAKTERYSTYCZNE
w Polsce
częstość podawania/d
FOSINOPRIL
tabletki:
NT: 10-40 mg, 1
×/d
rejestracja: NT, NS
10 mg
NS: 5-40mg, 1
×/d
prolek, z grupą fosforylową,
20 mg
metabolizowany w wątrobie
i w ścianie jelita, silnie wiążący
się z białkami, długi okres pół-
trwania 12-14 h, wysoka lipofil-
ność i penetracja tkankowa
(OUN), wydalany przez nerki
i wątrobę (proporcjonalnie do
wydolności narządowej), lek
z wyboru przy uszkodzonej
czynności nerek; poprawa klasy
NYHA w badaniu FEST, spa-
dek ryzyka incydentów serco-
wo-naczyniowych u chorych
z NT i cukrzycą (FACET);
KAPTOPRIL
tabletki:
NT: 25-150 mg, 2-3
×/d rejestracja: NT, NS
12,5 mg
NS: 6,25-150 mg, 3
×/d zawiera grupę sulfhydrylową,
25 mg
niska lipofilność, stosowany
50 mg
w postaci aktywnej, metaboli-
zowany, wydalany z moczem,
wpływ posiłków na wchłania-
nie, duża biodostępność po
podaniu podjęzykowym, redu-
kcja dawki w NN, duże stęże-
nie w OUN, poprawia nastrój;
redukcja śmiertelności w po-
zawałowej NS (SAVE, ISIS-4);
w nefropatii w przebiegu cu-
krzycy i chorób autoimmuno-
logicznych, w diagnostyce NT
naczyniowo-nerkowego, spa-
dek ryzyka powikłań naczynio-
wych w NT i cukrzycy (CAPPP)

86
Tabela 7: Preparaty ACE-I zarejestrowane w Polsce i ich charakterystyka c.d.
PREPARATY DAWKI:
CECHY
zarejestrowane początkowa-maks.
/d;
CHARAKTERYSTYCZNE
w Polsce
częstość podawania/d
LISINOPRIL
tabletki:
NT: 10-80 mg, 1
×/d
rejestracja: NT
5 mg
NS: 2,5-20 mg, 1
×/d
podawany i wydalany (przez
10 mg
nerki) w postaci aktywnej,
20 mg
hydrofilny, „osoczowy”, łatwo
przenika do tkanek, okres
półtrwania ok. 12 h, możli-
wość kumulacji, konieczna
redukcja dawki w przewlekłej
terapii; spadek śmiertelności
po ZS (GISSI-3);
MOEXIPRIL
tabletki:
NT: 7,5-30 mg,
rejestracja: NT
7,5 mg
1-2
×/d
prolek, podawać 1 h przed
15 mg
posiłkiem, pełny efekt hemo-
dynamiczny po 2-4 tyg. tera-
pii, wydalany z moczem i ka-
łem; redukcja dawki
u chorych z NN i wątroby
oraz w wieku podeszłym; bez-
pieczny u kobiet z NT
w okresie menopauzy (MA-
DAM);
PERINDOPRIL
tabletki:
NT: 4-8 mg, 1
×/d
rejestracja: NT, NS
2 mg
NS: 2-4 mg, 1
×/d
prolek, wysoka lipofilność,
4 mg
wydalany głównie z moczem;
podawać rano, redukcja daw-
ki w NS i w wieku podeszłym;
wpływ na śródbłonek, reduk-
cja częstości kolejnych uda-
rów mózgu (PROGRESS);

87
Tabela 7: Preparaty ACE-I zarejestrowane w Polsce i ich charakterystyka c.d.
PREPARATY DAWKI:
CECHY
zarejestrowane początkowa-maks.
/d;
CHARAKTERYSTYCZNE
w Polsce
częstość podawania/d
RAMIPRIL
tabletki:
NT: 2,5-5 mg, 1
×/d
rejestracja: NT, NS,
1,25 mg
NS: 1,25-10 mg, 1
×/d stan po ZS, prolek, wysoka
2,5 mg
lipofilność, „tkankowy”;
5 mg
wydalany z moczem i kałem;
maks. efekt hemodynamiczny
3-6 h po podaniu; redukcja
dawki w NN, NS i w wieku
podeszłym; redukcja śmier-
telności po ZS (AIRE,
AIREX) oraz w grupach cho-
rych wysokiego ryzyka powi-
kłań sercowo-naczyniowych
(HOPE); spadek powikłań
cukrzycowych (HOPE)
TRANDOLAPRIL
kapsułki:
NT: 1-4 mg, 1
×/d
rejestracja: NT,
0,5mg
Dysfunkcja LK po ZS: dysfunkcja skurczowa LK po
2 mg
już w 1-szej dobie
ZS; prolek, wysoka
0,5 mg 1
×, rano
lipofilność maks. efekt hemo-
dynamiczny 8-12 h, utrzymu-
je się 24h; wydalany głównie
z kałem, także z moczem; re-
dukcja dawki w niewydolno-
ści wątroby i ciężkiej NN;
spadek śmiertelności po ZS
(TRACE);
NT- nadciśnienie tętnicze, NS – niewydolność serca, NN – niewydolność nerek, ZS – zawał serca,
LK – lewa komora

88
Tabela 7: Najważniejsze badania naukowe dotyczące ACE-I
BADANIE
LEK
GRUPA BADANA I WYNIKI
AIRE
The Acute Infarction
Ramipril Efficacy Study;
Lancet 1993,342,821
ramipryl/
placebo
n=1968, lek 3-10 dni po ZS,
w grupie chorych
z pozawałową NS
otrzymujących ramipryl;
redukcja śmiertelności
o 27%;
SAVE
Survival And Ventricular
Enlargment Study;
J Am Coll Cardiol
1997,27,229
kaptopril/
placebo
n=2231, lek 3-16 dzień po
ZS, ocena wpływu leku na
przeżywalność i funkcję lewej
komory; 19% redukcja
śmiertelności oraz redukcja
incydentów kardiologicznych
w grupie otrzymującej
kaptopril;
ISIS-4
Fourth International
Study of Infarct Survival;
Am J Cardiol
1991,68,87D
Lancet 1995,345,669
kaptopril/
placebo
n=58050, w grupie
otrzymującej kaptopril po ZS
7% redukcja śmiertelności po
5 tyg obserwacji;
TRACE
Trandolapril Cardiac
Evaluation; N Engl J Med
1995,333,1670
trandolapril/
placebo
n=6676, po ZS, spadek
śmiertelności o 22%, zgonu
z przyczyn sercowych o 25%,
rozwoju ciężkiej NS o 29%,
w 3-letniej obserwacji
w grupie leczonej
trandolaprilem;
GISSI-3
Gruppo Italiano per lo
Studio della Sopravvivenza
nell'Infarto Miocardico-3;
J Am Coll Cardiol
1996,27,337
lisinopril i/lub
azotany vs
placebo
n=19394, 6 tyg. po ZS
w grupie leczonej
lisinoprilem redukcja
śmiertelności o 11%, po
6 miesiącach także spadek
śmiertelności i częstości
rozwoju NS; szczególne
korzyści u chorych
z cukrzycą;

89
Tabela 7: Najważniejsze badania naukowe dotyczące ACE-I
BADANIE
LEK
GRUPA BADANA I WYNIKI
HOPE
Heart Outcomes
Prevention Evaluation
study; N Engl J Med
2000,342,145
ramipril/
placebo
n=9541, w grupie chorych
wysokiego ryzyka powikłań
sercowo-naczyniowych
leczonych ramiprilem w 5-
letniej obserwacji stwierdzono
22% redukcję wszystkich
powikłań naczyniowych (ZS,
UM, zgon); 20% zmniejszenie
ryzyka ZS, 26% redukcję
ryzyka nagłego zgonu
sercowego, 32% redukcję
ryzyka UM; szczególne
korzyści u chorych z cukrzycą
CONSENSUS
Cooperative North
Scandinavian Enalapril
Survival Study; N Engl J
Med 1992,327,678
enalapril/
placebo
n=253, w 6-miesięcznej
obserwacji w grupie chorych
z NS leczonych enalaprilem
stwierdzono 40% spadek
śmiertelności, po roku - 31%
redukcję śmiertelności;
AIPRI
ACE Inhibition in
Progressive Renal
Insufficiency;
J Cardiovasc Pharmacol
1999, 33,16
benazepril/
placebo
n=583, w 3-letniej obserwacji
benazepril istotnie przedłużał
czas do rozwoju schyłkowej
NN u chorych z umiarkowaną
NN;
TREND
Trial on Reversing
Endothelial Dysfunction;
Circulation 1996,94,258
chinapril/
placebo
n=129, po 6 miesiącach
w grupie leczonej chinaprilem
obserwowano poprawę
funkcji śródbłonka ocenianą
reakcją naczyń wieńcowych
na acetylocholinę;

PODSUMOWANIE
Układ R-A-A to jeden z najważniejszych mechanizmów odpowiedzialnych
za homeostazę organizmu. Sprzężony jest czynnościowo z układem kalikre-
inowo-prostaglandynowym. Reguluje ciśnienie tętnicze krwi i gospodarkę
wodno-elektrolitową. Układ R-A-A zlokalizowany w licznych tkankach i na-
rządach, reguluje napięcie ścian naczyń i wpływa na funkcje danego narządu.
Leki blokujące konwertazę angiotensyny powodują zmiany hormonalne
(głównie zmniejszenie stężenia angiotensyny II, wazopresyny, aldosteronu
i zwiększenie poziomu kinin), hemodynamiczne (spadek oporu obwodowe-
go, ciśnienia tętniczego, zwiększenie przepływu krwi w narządach), obniżają
napięcie układu adrenergicznego, działają antyproliferacyjnie i przeciwmiaż-
dżycowo, korzystnie, choć w niewielkim stopniu, wpływają na profil meta-
boliczny.
Poszczególne preparaty ACE-I różnią się między sobą pod względem far-
makokinetycznym. Wiedza o różnicach i cechach charakterystycznych dane-
go preparatu, pozwala na indywidualizację wyboru leku, w zależności od
konkretnej sytuacji klinicznej.
90
Tabela 7: Najważniejsze badania naukowe dotyczące ACE-I
BADANIE
LEK
GRUPA BADANA I WYNIKI
PROGRESS
Perindopril Protection
against Recurrent Stroke
Study; Lancet, 2001,
358,1033-41
perindopril/
placebo
n=6105, z niedokrwiennym
lub krwotocznym UM;
w grupie leczonej aktywnie
obniżenie ryzyka ponownego
UM: niedokrwiennego o
24%, krwotocznego o 50%;
ZS - zawał serca, NS - niewydolność serca, UM - udar mózgu, NN - niewydolność nerek

Zapamiętaj!
1. ACE-I są obecnie podstawową grupą leków w leczeniu chorób układu krą-
żenia.
2. ACE-I są stosowane w nadciśnieniu tętniczym, w niewydolności serca, za-
pobieganiu powikłaniom po zawale serca i powikłaniom nerkowym u cho-
rych z cukrzycą.
3. Udowodniono, że ACE-I zmniejszają śmiertelność w grupie chorych z nie-
wydolnością serca i pozawałową dysfunkcją lewej komory.
4. Udowodniono skuteczność ACE-I w chorobach na podłożu miażdżyco-
wym (zawały serca, udary mózgu, incydenty wieńcowe).
5. Nie stosuj ACE-I u kobiet w ciąży lub mogących być w ciąży.
6. ZAWSZE rozważ zastosowanie ACE-I u chorych:
• z niewydolnością serca,
• po przebytym zawale serca,
• z nadciśnieniem tętniczym i cukrzycą,
• z chorobą wieńcową i cukrzycą,
• nadciśnieniem tętniczym i białkomoczem,
• z nefropatią cukrzycową,
• z nadciśnieniem tętniczym i po udarze mózgu.
TYLKO w obecności przeciwwskazań nie stosuj tych leków.
Polecane lektury:
H. Adamska-Dyniewska (red.): Leki hamujące enzym przekształcający an-
giotensynę – działanie i zastosowanie kliniczne; Towarzystwo Terapii Moni-
torowanej, Łódź, 1992.
L. H. Opie: Inhibitory konwertazy angiotensyny. Postęp trwa; wydanie III,
Via Medica, Gdańsk, 2000.
G. Opolski, K. J. Filipiak: Leki hamujące układ renina-angiotensyna-aldo-
steron; Urban & Partner, Wrocław, 2000.
L. Giec, Z. S. Herman (red.): Farmakoterapia chorób układu sercowo-naczy-
niowego; PZWL, Warszawa, wydanie IV, 1998.
Standardy PTK; Kardiologia Polska, 1997.
91

VII. ANTAGONIŚCI RECEPTORA AT
1
WE WSPÓŁCZESNEJ KARDIOLOGII
Maciej Janiszewski, Agnieszka Cudnoch-Jędrzejewska, Artur Mamcarz
WSTĘP
Minęło już ponad 100 lat od odkrycia przez Tigertstedta i Bergmana reni-
ny, związku spełniającego kluczową rolę w regulacji ciśnienia tętniczego
krwi. Od 30 lat znane są związki chemiczne, które blokują układ renina-angio-
tensyna-aldosteron (R-A-A) i tym samym umożliwiają skuteczne leczenia
nadciśnienia tętniczego. Pomimo to każdy kolejny rok przynosi nowe odkry-
cia, prowadzące do pełniejszego zrozumienia skomplikowanych zależności
rządzących układem R-A-A. Obecnie wiadomo już, że nadmierna jego ak-
tywacja prowadzi nie tylko do nadciśnienia tętniczego, ale powoduje rów-
nież niekorzystny przerost mięśnia sercowego i naczyń, uszkadza śródbło-
nek, wpływa na układ krzepnięcia i sprzyja rozwojowi miażdżycy. Wraz
z rozwojem wiedzy o układzie R-A-A poszerzają się możliwości precyzyjne-
go, farmakologicznego wpływania na poszczególne jego elementy. W ostat-
nich latach do dobrze znanych leków hamujących enzym przekształcający
angiotensynę I do angiotensyny II (inhibitory konwertazy angiotensyny,
ACE-I), dołączyły leki blokujące wybiórczo receptor, przez który angioten-
syna II wywiera swoje niekorzystne działania biologiczne (antagoniści recep-
tora AT1).
UKŁAD RENINA-ANGIOTENSYNA-ALDOSTERON
Podstawowym substratem wchodzącym w cykl przemian układu R-A-A jest
angiotensynogen. Jest to substancja białkowa syntetyzowana w wątrobie.
Pod wpływem działania reniny jest on przekształcany do angiotensyny I. Pod
wpływem kolejnego enzymu, konwertazy angiotensyny (ACE), angiotensyna
I ulega przemianie do angiotensyny II. O ile zarówno angiotensynogen, jak
i angiotensyna I nie wykazują istotnej aktywności biologicznej, o tyle angio-
tensyna II jest związkiem wywierającym bardzo silny wpływ na wiele tkanek
i układów biochemiczno-humoralnych. Podstawowe efekty działania angio-
tensyny II przedstawiono w tabeli 1.
92

Angiotensyna II nie jest jednak jedynym czynnym biologiczne związkiem
powstającym w wyniku przemian angiotensynogenu. Angiotensyna I może
pod wpływem swoistej endopeptydazy, enzymu działającego niezależnie od
konwertazy angiotensyny, zostać przekształcona do angiotensyny 1-7. Z ko-
lei angiotensyna II nie jest związkiem ostatecznym, lecz ulega dalszym prze-
mianom do aktywnej biologicznie angiotensyny 3-8 (angiotensyna IV) oraz
do nieaktywnych peptydów. Przemiany w układzie R-A-A przedstawiono na
schemacie (ryc. 1).
Pogłębione badania nad układem R-A-A doprowadziły do odkrycia, że
kluczowa przemiana w całym cyklu, a więc przekształcenie angiotensyny I do
angiotensyny II jest katalizowana nie tylko przez enzym konwertujący, ale
może również przebiegać alternatywnymi drogami przy wykorzystaniu in-
nych enzymów, takich jak chymaza, elastaza czy katepsyna G. Odkrycie to
ma istotne implikacje praktyczne, pozwala wyjaśnić, dlaczego pomimo cał-
kowitego zablokowania ACE, nie udaje się całkowicie zahamować powsta-
wania angiotensyny II.
Obecnie wiadomo również, że enzym konwertujący angiotensynę, bierze
udział w szlaku przemian bradykininy, katalizując jej rozkład do związków
nieaktywnych biologicznie.
93
Tabela 1: Najważniejsze działania angiotensyny II (wg Adamskiej-Dyniewskiej)
HEMODYNAMIKA
• wzrost ciśnienia tętniczego;
• skurcz tętnic obwodowych i żył;
• redystrybucja przepływu nerkowego
(skurcz tętniczek odprowadzających);
UKŁAD NERWOWY,
KORA NADNERCZY
• pobudzenie układu
adrenergicznego centralnego
i obwodowego;
• uwalnianie wazopresyny;
• pobudzenie pragnienia;
• uwalnianie aldosteronu;
WZROST KOMÓREK,
SYNTEZA PROTEIN,
MITOZA, MIGRACJA
• przerost mięśnia serca i mięśni
gładkich naczyń;
• synteza białek w miocytach
i fibroblastach;
• wzmożona synteza kolagenu i białek
macierzy;
• hiperplazja (mitoza);
• migracja mięśni gładkich (remodeling).
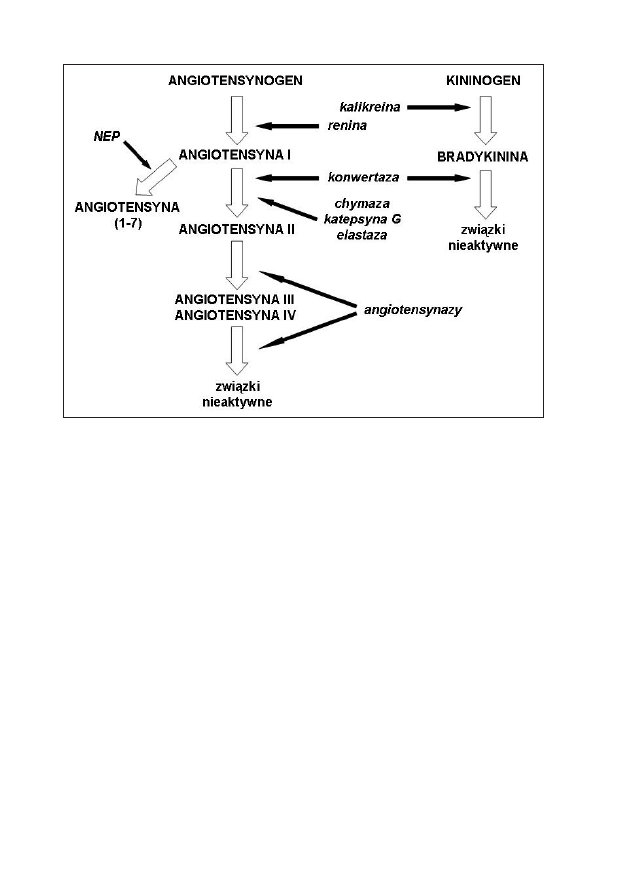
Angiotensyna II wywiera swoje działanie za pośrednictwem swoistych re-
ceptorów. W warunkach podstawowych, angiotensyna II aktywuje przede
wszystkim receptor AT
1
, którego pobudzenie prowadzi do ekspresji jej pod-
stawowych funkcji biologicznych. Badania ostatnich lat dowiodły, że obok
receptora AT
1
, istnieją również inne receptory angiotensynowe – receptor
AT
2
, receptor AT
1-7
, receptor AT
4
, postuluje się również istnienie receptora
AT
3
i dalszych. Co ważne, aktywacja nowo odkrytych receptorów, powoduje
wystąpienie działań biologicznych w znacznej mierze przeciwstawnych do
efektów wywołanych aktywacją receptora AT
1
.
Wydaje się, że najważniejsze znaczenie mają obok receptora AT
1
, recep-
tory AT
2
i AT
1-7
. Receptor AT
2
występuje przede wszystkim w ośrodkowym
układzie nerwowym, sercu i nerkach. Ten typ receptora jest szczególnie
rozpowszechniony w tkankach płodowych, po urodzeniu jego ekspresja się
zmniejsza. Angiotensyna II aktywując receptor AT
2
powoduje zahamowa-
nie wzrostu i syntezy kolagenu, zapobiega proliferacji komórek, a zatem
zmniejsza przerost i włóknienie tkanek. Z kolei receptor AT
1-7
, aktywowa-
ny przez angiotensynę 1-7, powoduje wzmożone uwalnianie prostaglandyn
i tlenku azotu, co prowadzi w efekcie do rozszerzenia łożyska naczyniowe-
go i obniżenia ciśnienia tętniczego krwi. Dane z badań podstawowych
94
Rycina 1: Schemat przemian w układzie renina-angiotensyna-aldosteron
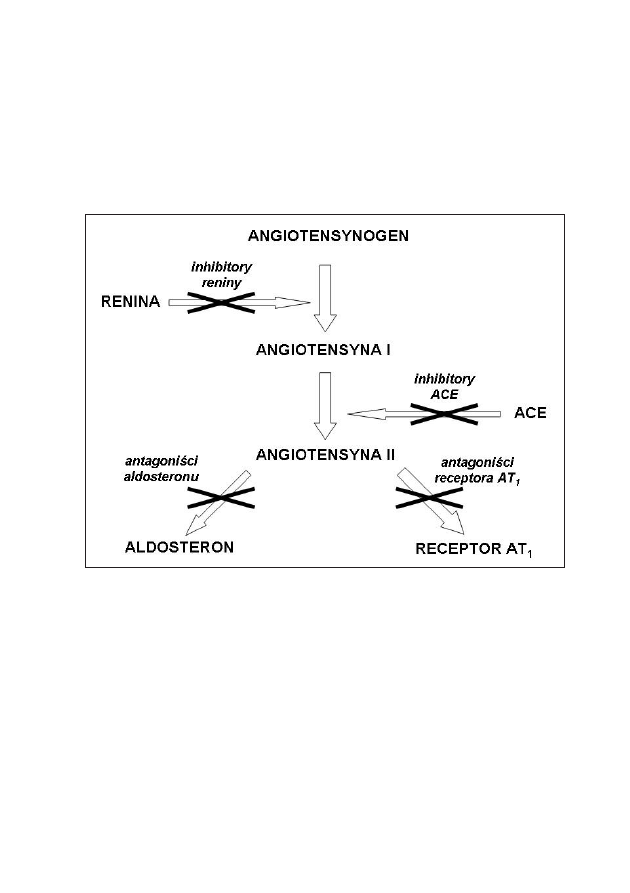
wskazują, że aktywacja receptora AT
4
powoduje wzmożoną syntezę inhi-
bitora aktywatora plazminogenu typu 1 (PAI-1), dając ostatecznie efekt
prozakrzepowy.
Wraz z poznawaniem szczegółów przemian w szlaku R-A-A, rosną rów-
nież możliwości farmakologicznego wpływania na jego poszczególne ele-
menty, a tym samym możliwości ograniczenia niekorzystnych efektów, do
których prowadzi jego nadmierna aktywacja (ryc. 2).
Do leków modyfikujących przemiany szlaku R-A-A należą:
• Inhibitory reniny: substancje hamujące powstawanie angiotensyny
I z angiotensynogenu, a więc wpływające na pierwszy etap przemian
w układzie R-A-A. Ich przydatność lecznicza nie jest jeszcze w pełni zna-
na i dotychczas znajdują się one w fazie badań.
• Inhibitory konwertazy angiotensyny: substancje blokujące enzym prze-
kształcający angiotensynę I do angiotensyny II. Jest to jedna z podsta-
wowych grup lekowych stosowanych we współczesnej farmakoterapii.
Pomimo wielu lat doświadczeń, w dalszym ciągu trwa dynamiczny roz-
wój tej grupy leków, znajdują one zastosowanie już nie tylko w leczeniu
nadciśnienia tętniczego, ale również w terapii niewydolności serca, cho-
95
Rycina 2: Miejsca blokowania układu renina-angiotensyna-aldosteron

roby niedokrwiennej serca oraz w takich dziedzinach, jak diabetologia
czy nefrologia. Szczegółową charakterystykę tych leków omówiono
w rozdziale VI.
• Antagoniści receptora AT
1
: leki z tej grupy, działając na poziomie re-
ceptorowym, wpływają na ostatni etap przemian cyklu R-A-A, wybiór-
czo przeciwdziałając niekorzystnym efektom biologicznym wywoływa-
nym przez angiotensynę II.
• Antagoniści aldosteronu: leki hamujące działanie aldosteronu, jednego
z ostatecznych produktów przemian układu R-A-A, poprzez konkuren-
cyjne wiązanie się z jego receptorem. Jest to grupa leków, znajdująca za-
stosowanie w skojarzonym leczeniu nadciśnienia tętniczego oraz w sta-
nach przebiegających z hiperaldosteronizmem (zespół nerczycowy,
niewydolność krążenia, niewydolność wątroby).
EFEKTY ZABLOKOWANIA RECEPTORA AT
1
Jak wspomniano wcześniej, w warunkach podstawowych angiotensyna II
wywołuje swoje niekorzystne działania poprzez aktywację receptora AT
1
. Ta
sama angiotensyna, aktywując receptor AT
2
, wywołuje działanie częściowo
przeciwstawne (hamowanie przebudowy i włóknienia narządów). Z kolei po-
budzenie receptora AT
1-7
, aktywowanego przez powstającą na drodze alter-
natywnej angiotensynę 1-7, również powoduje efekt przeciwstawny do akty-
wacji receptora AT
1
(rozkurcz naczyń i spadek ciśnienia tętniczego).
Zablokowanie, przy użyciu inhibitorów enzymu konwertującego, powsta-
wania angiotensyny II, znosi jej niekorzystne działanie wywierane za pośred-
nictwem receptora AT
1
, ale równocześnie znosi działania korzystne, wywie-
rane za pośrednictwem receptora AT
2
. Ponadto wiadomo, że angiotensyna
II może powstawać drogą alternatywną, niezależną od ACE, a zatem nawet
skuteczne zablokowanie ACE, nie przyniesie całkowitego zahamowania
układu R-A-A.
Rozwiązaniem tego problemu wydaje się wybiórcza blokada receptora
AT
1
. W takiej sytuacji, powstająca bez przeszkód angiotensyna II, działa po-
przez receptor AT
2
. Z kolei angiotensyna I, przy znacznym nadmiarze nie-
związanej angiotensyny II, w większym stopniu przekształcana jest do an-
giotensyny 1-7 (ryc. 3).
96
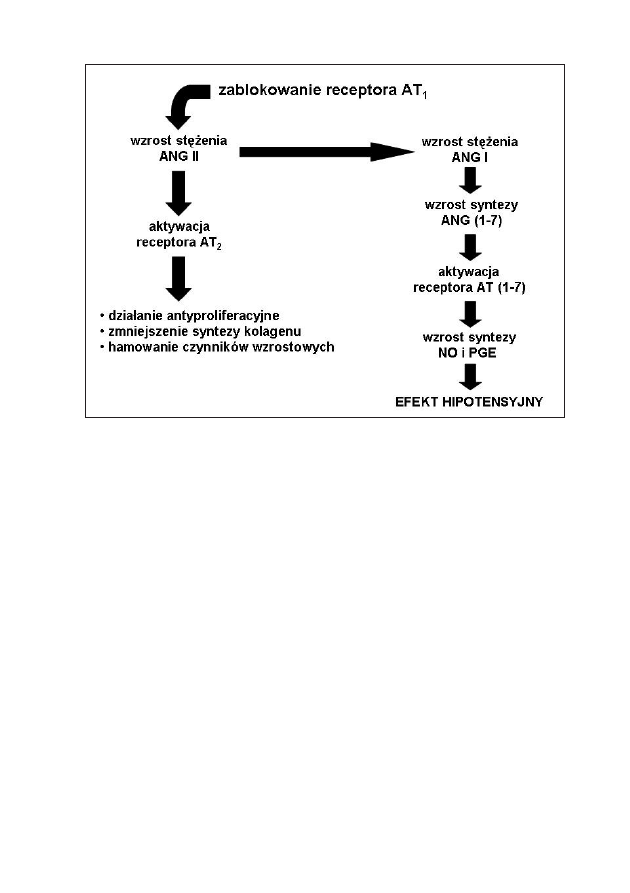
ZASTOSOWANIE KLINICZNE ANTAGONISTÓW RECEPTORA AT
1
Przedstawione wyżej przesłanki teoretyczne, skłaniały do prac nad syntezą
związków wybiórczo blokujących receptor AT
1
. Pierwszym zarejestrowanym
lekiem z tej grupy był losartan (rok 1992, w Polsce od 1996 roku). Kolejne
lata przyniosły szybki rozwój tej grupy leków. W chwili obecnej na rynku
dostępnych jest już kilka preparatów z grupy antagonistów AT
1
, kolejne
substancje znajdują się w fazie badań. Podobnie jak w przypadku
antagonistów enzymu konwertującego, również antagonistów receptora AT
1
stosowano początkowo w leczeniu nadciśnienia tętniczego. Obecnie
prowadzone są badania, mające na celu wykazanie ich przydatności również
w innych stanach klinicznych (niewydolność serca, choroba niedokrwienna
serca i inne).
ANTAGONIŚCI RECEPTORA AT
1
W LECZENIU NADCIŚNIENIA
TĘTNICZEGO
Prowadzone w latach 90-tych badania porównawcze skuteczności hipoten-
syjnej antagonistów receptora AT
1
z innymi uznanymi lekami, stosowanymi
w terapii nadciśnienia tętniczego wykazały, że u 50-70% pacjentów, monote-
97
Rycina 3: Efekty zablokowania receptora AT
1

rapia przy użyciu antagonisty AT
1
umożliwia uzyskanie dobrej kontroli ci-
śnienia. Są to wyniki zbliżone do uzyskiwanych przy stosowaniu wiodących
leków hipotensyjnych, jakimi są antagoniści kanałów wapniowych i inhibi-
tory enzymu konwertującego.
Aktualna strategia leczenia nadciśnienia tętniczego opiera się nie tylko na
skutecznym obniżeniu ciśnienia tętniczego. Zakłada ona, że lek hipotensyj-
ny powinien również korzystnie wpływać na schorzenia współistniejące
z nadciśnieniem, powinien mieć korzystny profil metaboliczny, wykazywać
mało działań niepożądanych i być dobrze tolerowany przez pacjenta.
Antagoniści receptora AT
1
spełniają większość z tych wymagań. Charakte-
ryzują się wysokim profilem bezpieczeństwa, ilość działań niepożądanych po
ich zastosowaniu jest znikoma, wyraźnie mniejsza niż w przypadku innych
leków hipotensyjnych. Jednym z bardziej uciążliwych objawów ubocznych
występujących podczas leczenia inhibitorami konwertazy angiotensyny,
a więc lekami o zbliżonym mechanizmie działania do antagonistów recep-
tora AT
1
, jest suchy, męczący kaszel. Jest on wynikiem zwiększonego stęże-
nia bradykininy, której rozkład jest zahamowany z powodu zablokowania
enzymu konwertującego. Tego działania niepożądanego pozbawione są leki
z grupy antagonistów receptora AT
1
.
Istotną zaletą antagonistów receptora AT
1
jest łatwość dawkowania. Ze
względu na długi okres półtrwania, równomierne obniżanie ciśnienia tętni-
czego w ciągu całej doby, leki te mogą być dawkowane jeden raz na dobę,
co w istotny sposób poprawia współpracę z pacjentem.
Mała ilość działań niepożądanych i łatwe dawkowanie powodują, że anta-
goniści receptora AT
1
, należą do najlepiej tolerowanych leków hipotensyj-
nych. W badaniach Blooma z 1998 roku wykazano, że chorzy leczeni tą gru-
pą leków istotnie rzadziej przerywają leczenie, w porównaniu do chorych
leczonych diuretykiem lub
β-adrenolitykiem.
Antagoniści receptora AT
1
charakteryzują się korzystnym profilem meta-
bolicznym, porównywalnym z inhibitorami enzymu konwertującego. Jest to
o tyle istotne, że u wielu pacjentów z nadciśnieniem tętniczym stwierdza się
współistniejące zaburzenia gospodarki węglowodanowej i lipidowej. Anta-
goniści AT
1
nie wpływają w istotny sposób na stężenia cholesterolu i trójgli-
cerydów, a dla części z nich (kandesartan) wykazano zmniejszanie insulino-
oporności u chorych z hiperinsulinemią i zwiększenie wydalania kwasu
moczowego (losartan).
Zagadnieniem nie w pełni dotychczas poznanym jest wpływ antagonistów
receptora AT
1
na powikłania nadciśnienia i schorzenia współistniejące. Wy-
98

niki zakończonego w ostatnich miesiącach badania LIFE, w którym porów-
nywano wyniki leczenia antagonistą receptora AT
1
(losartan) z lekiem
β-adrenolitycznym (atenolol) są bardzo zachęcające. Przy zbliżonej skutecz-
ności hipotensyjnej obu leków, w grupie leczonej antagonistą AT
1
obserwo-
wano mniejszą ilość zgonów z przyczyn sercowo-naczyniowych oraz mniejszą
ilość udarów mózgu. Wykazano również, że losartan zmniejsza przerost le-
wej komory u pacjentów z nadciśnieniem tętniczym i potwierdzono jego do-
skonałą tolerancję.
Zastosowanie antagonistów receptora AT
1
u chorych z niewydolnością
serca i z chorobą niedokrwienną serca zostanie omówione w dalszej części
rozdziału.
Dotychczasowe badania wskazują, że leki z grupy antagonistów receptora
AT1 mogą być bezpiecznie stosowane u pacjentów z niewydolnością nerek.
Losartan zmniejsza albuminurię u pacjentów z nadciśnieniem tętniczym, jak
również hamuje rozwój nefropatii cukrzycowej u chorych z cukrzycą typu II.
Dane z badań eksperymentalnych wskazują, że antagoniści receptora AT
1
,
są grupą leków, która może być szczególnie korzystna u pacjentów w star-
szym wieku. Przypuszcza się, że blokada receptora AT
1
poprawia funkcje
poznawcze oraz zmniejsza ryzyko udaru mózgu w tej grupie chorych. Po-
twierdzeniem badań eksperymentalnych mają być wyniki trwającego obecnie
badania SCOPE.
Doceniając liczne zalety antagonistów receptora AT
1
, w ostatnim rapor-
cie eksperci Światowej Organizacji Zdrowia (WHO) włączyli leki tej grupy
do leków „pierwszego rzutu” w terapii nadciśnienia tętniczego.
ANTAGONIŚCI RECEPTORA AT
1
W LECZENIU
NIEWYDOLNOŚCI SERCA
Aktywacja układu R-A-A jest odpowiedzialna za przerost mięśnia serco-
wego, jego niekorzystną przebudowę, prowadzącą w efekcie do rozwoju nie-
wydolności serca. Skuteczne zablokowanie szlaku R-A-A, jest zatem jednym
z podstawowych celów w farmakoterapii niewydolności serca. Przydatność
inhibitorów enzymu konwertującego w leczeniu niewydolności serca została
potwierdzona w wielu dużych badaniach klinicznych i w chwili obecnej nale-
żą one do leków „pierwszego rzutu” w terapii niewydolności serca.
Przesłanki teoretyczne wskazywały, że leki z grupy antagonistów recepto-
ra AT
1
, skuteczniej od inhibitorów konwertazy blokując układ R-A-A, po-
winny okazać się skuteczniejsze w leczeniu niewydolności serca. Pierwsze ba-
dania kliniczne (ELITE) wydawały się potwierdzać tę hipotezę, jednak
99

zakończone w 2000 roku badanie ELITE II, nie wykazało istotnych różnic
w skuteczności leczenia niewydolności serca pomiędzy losartanem a kapto-
prilem. Ostateczne rozwiązanie tego problemu powinny przynieść trwające
obecnie duże badania kliniczne. Być może optymalnym rozwiązaniem bę-
dzie łączne podawanie inhibitora enzymu konwertującego i antagonisty re-
ceptora AT
1
– połączenie takie z jednej strony umożliwi precyzyjne zabloko-
wanie układu R-A-A, z drugiej zaś strony, poprzez zablokowanie enzymu
konwertującego, umożliwi zwiększenie aktywności bradykininy (związku
o potencjalnie korzystnym wpływie hamującym rozwój niewydolności serca).
ANTAGONIŚCI RECEPTORA AT
1
W LECZENIU CHOROBY
NIEDOKRWIENNEJ SERCA
Dane z badań eksperymentalnych wskazują, że angiotensyna II bierze
udział w rozwoju zmian miażdżycowych, na każdym z etapów ich rozwoju
(od migracji makrofagów, poprzez niekorzystną oksydację cząsteczek cho-
lesterolu LDL, po przebudowę ściany naczynia i działanie prozakrzepowe).
O ile kolejne badania wskazują na korzystny efekt stosowania inhibitorów
konwertazy u chorych z chorobą niedokrwienną serca, a w szczególności
u chorych po zawale serca, o tyle brak dotąd wiarygodnych danych dotyczą-
cych skuteczności stosowania antagonistów receptora AT
1
. Wydaje się, że
w przypadku choroby niedokrwiennej serca, szczególnie istotny może być
wspomniany wcześniej efekt bradykininowy charakterystyczny dla inhibito-
rów konwertazy. Zwiększone stężenie bradykininy prowadzi do uwolnienia
z komórek śródbłonka naczyniowego tlenku azotu (NO) i prostaglandyn,
a więc substancji o działaniu silnie rozszerzającym naczynia i zwiększającym
stężenie tkankowego aktywatora plazminogenu (t-PA).
DZIAŁANIA NIEPOŻĄDANE ANTAGONISTÓW RECEPTORA AT
1
Antagoniści receptora AT
1
należą do leków o wyjątkowo małej ilości dzia-
łań niepożądanych. W wielu badaniach klinicznych częstość występowania
objawów ubocznych obserwowanych po zastosowaniu tej grupy leków była
zbliżona do ilości występującej po zastosowaniu placebo. Uporczywy, suchy
kaszel, będący jednym z najczęstszych powikłań po stosowaniu inhibitorów
enzymu konwertującego i często zmuszający do przerwania terapii, w gru-
pie chorych leczonych antagonistą receptora AT
1
występuje w znikomym od-
setku (poniżej 1%). Inne działania niepożądane, które były opisywane po
stosowaniu antagonistów receptora AT
1
, to obrzęk naczynioruchowy, uszko-
dzenia wątroby, zmiany skórne, zaburzenia smaku i bóle głowy.
100

W trakcie leczenia skojarzonego z innym lekiem hipotensyjnym opisywano
przejściową hipotonię, a w przypadkach skojarzenia z diuretykami oszczę-
dzającymi potas i/lub preparatami potasu – przypadki hiperkaliemii.
PRZECIWWSKAZANIA DO STOSOWANIA ANTAGONISTÓW
RECEPTORA AT
1
Bezwzględnym przeciwwskazaniem do stosowania antagonistów recepto-
ra AT
1
jest ciąża i okres karmienia piersią. Podobnie jak w przypadku inhibi-
torów enzymu konwertującego, leki z grupy antagonistów receptora AT
1
nie
powinny być stosowane u chorych z obustronnym zwężeniem tętnic nerko-
wych oraz w przypadku zwężenia tętnicy do jedynej czynnej nerki.
ANTAGONIŚCI RECEPTORA AT
1
– RÓŻNICE W OBRĘBIE GRUPY
Antagoniści receptora AT
1
nie są całkowicie jednolitą grupą leków. Po-
szczególne preparaty, przy tym samym podstawowym mechanizmie działania
(blokowanie receptora AT
1
), różnią się istotnie pod względem farmakodyna-
miki i farmakokinetyki, zaś część z nich wykazuje dodatkową specyficzną ak-
tywność biologiczną.
Najkrótszym okresem półtrwania charakteryzuje się losartan (1,5 do 2,5
godz.), okres półtrwania nowszych preparatów (eprosartan, walsartan, irbe-
sartan i inne) jest kilkakrotnie dłuższy.
Z praktycznego punktu widzenia istotną cechą leków jest wpływ pokarmu
na ich wchłanianie z przewodu pokarmowego oraz droga eliminacji z organi-
zmu. W grupie antagonistów receptora AT
1
większość preparatów (poza
walsartanem) może być podawana niezależnie od przyjmowanych posiłków.
W przypadku podawania leków z tej grupy chorym z upośledzoną funkcją
wydalniczą nerek, najbezpieczniej jest wybrać eprosartan, ponieważ charak-
teryzuje się on znikomym wydalaniem przez nerki (w 90% eliminowany jest
przez wątrobę). U chorych z dną moczanową lub tendencją do tworzenia się
złogów w nerkach, należy pamiętać, że stosowanie losartanu zwiększa wy-
dalanie kwasu moczowego, natomiast cechy tej nie wykazują inni przedsta-
wiciele tej grupy.
Eprosartan charakteryzuje się również swoistym dodatkowym wpływem
zmniejszającym napięcie układu adrenergicznego, w związku z tym wydaje
się on szczególnie wskazany w leczeniu chorych z izolowanym nadciśnieniem
skurczowym.
101

ANTAGONIŚCI RECEPTORA AT
1
W POLSCE
Pierwszym zarejestrowanym w Polsce antagonistą receptora AT
1
był losar-
tan (1996 rok). Do chwili obecnej zarejestrowanych zostało kolejnych 5 le-
ków (eprosartan, irbesartan, kandesartan, telmisartan, walsartan). Pomimo
szerokiego wyboru preparatów, antagoniści receptora AT
1
są grupą leków
w dalszym ciągu dość rzadko stosowaną w leczeniu chorych z nadciśnieniem
tętniczym. Z pewnością podstawowym ograniczeniem ich szerszego użycia,
jest stosunkowo wysoka cena, często trudna do zaakceptowania przez pa-
cjenta. Warto jednak pamiętać, że cena leków, jest tylko jedną ze składo-
wych kosztów leczenia, obok kosztów konsultacji lekarskich, badań kontro-
lnych, leczenia powikłań wynikających z działań niepożądanych leków
i w końcu kosztów związanych z przerwami w pracy zawodowej. W tak oce-
nianej analizie farmakoekonomicznej, leki skuteczne i bezpieczne w stoso-
waniu, do których z pewnością należą antagoniści receptora AT
1
, okazują
się interesującą alternatywą dla tzw. tanich leków.
PODSUMOWANIE
Antagoniści receptora AT
1
są nową grupą leków kardiologicznych, wpły-
wających na szlak przemian układu R-A-A. Poprzez selektywną blokadę re-
ceptora AT
1
, przeciwdziałają niekorzystnym efektom biologicznym wywoły-
wanym przez angiotensynę II. Ich wysoka skuteczność hipotensyjna,
spowodowała włączenie ich do grupy leków zalecanych w monoterapii nad-
ciśnienia tętniczego, na równi z uznanymi lekami hipotensyjnymi, takimi jak
diuretyki, leki
β-adrenolityczne, ACE-inhibitory, antagoniści kanałów wap-
niowych i leki
α
1
-adrenolityczne. Przesłanki teoretyczne i wyniki pierwszych
badań klinicznych wskazują, że antagoniści receptora AT
1
znajdą wkrótce
zastosowanie również w leczeniu niewydolności serca. Do zalet tej grupy le-
ków, należy neutralny profil metaboliczny, nieliczne działania niepożądane,
łatwość dawkowania i dobra tolerancja przez chorych. Szczególnie korzystne
wydają się w sytuacjach, gdy chory ma wskazania do blokady układu R-A-A,
a nie toleruje ACE-inhibitorów (kaszel). Szersze zastosowanie tej grupy le-
ków jest ograniczone ich wciąż wysoką ceną.
Zapamiętaj!
1. Antagoniści receptora AT
1
są lekami wpływającymi na szlak renina-angio-
tensyna-aldosteron, poprzez blokadę receptora dla angiotensyny II (AT
1
).
2. Są to skuteczne leki hipotensyjne, polecane przez WHO do stosowania
w monoterapii nadciśnienia tętniczego.
102

3. Ocena skuteczności tej grupy leków w leczeniu niewydolności serca wyma-
ga jeszcze dalszych badań.
4. Antagoniści receptora AT
1
są lekami bezpiecznymi, o małej ilości działań
niepożądanych, dobrze tolerowanymi przez chorych.
Polecane lektury:
G. Opolski, K. J. Filipiak: Leki hamujące układ renina-angiotensyna-aldos-
teron; Urban & Parter, Wrocław, 2000.
H. Adamska-Dyniewska (red.): Leki współczesne, które warto znać; Towa-
rzystwo Terapii Monitorowanej, cykl wydawniczy, Łódź, 1998-2000.
World Health Organization: International Society of Hypertension Guide-
lines for the Management of Hypertension; Journal of Hypertension, 1999,
17: 151-183.
L. H. Opie: Inhibitory Konwertazy Angiotensyny – postęp trwa; Via Medica,
Gdańsk, 2000.
103

VIII. ANTAGONIŚCI KANAŁÓW WAPNIOWYCH
Ewa Burbicka, Monika Tomaszewska-Kiecana, Jacek Sawicki
WSTĘP
Antagoniści kanałów wapniowych (AKW) stanowią niejednorodną grupę
leków, której historia rozpoczęła się w latach 60-tych XX wieku. Pierwszym
przedstawicielem tej grupy był werapamil. Od owego czasu powstały kolejne
preparaty pochodzące z różnych grup chemicznych i charakteryzujące się
odmiennym wpływem na układ krążenia.
PODSTAWY FIZJOLOGICZNE
Kanały wapniowe
Wyróżniamy dwa rodzaje kanałów wapniowych:
• kanały zależne od potencjału błonowego (VOC – voltage operated chan-
nel);
• kanały zależne od receptorów (ROC – receptor operated channel).
Wśród kanałów zależnych od potencjału błonowego rozróżniamy kilka ty-
pów kanałów, jednak w układzie krążenia istotną rolę odgrywają tylko dwa:
typ L (long lasting) i typ T (transient). Kanały typu L zlokalizowane są w ko-
mórkach mięśni przedsionków i komór serca oraz w mięśniówce gładkiej na-
czyń i na te kanały działają preparaty z grupy AKW.
Działanie kanałów typu L
Depolaryzacja błony komórkowej powoduje otwarcie kanałów typu L,
przez które w kierunku dokomórkowym wnikają jony Ca
2+
. Gdy potencjał
wewnątrz komórki przekroczy pewien poziom progowy, następuje wyrzut jo-
nów wapnia z siateczki sarkoplazmatycznej do sarkoplazmy. W wyniku obu
tych procesów dochodzi do wzrostu stężenia jonów wapnia w komórce. Jony
te następnie wychwytywane są przez białka kurczliwe, zaś ATP-aza miozy-
nowa rozkładając ATP dostarcza energii do wykonania skurczu mięśnia. Me-
chanizm prowadzący do skurczu mięśnia poprzez aktywację jonową komór-
ki określa się jako sprzężenie elektromechaniczne.
104
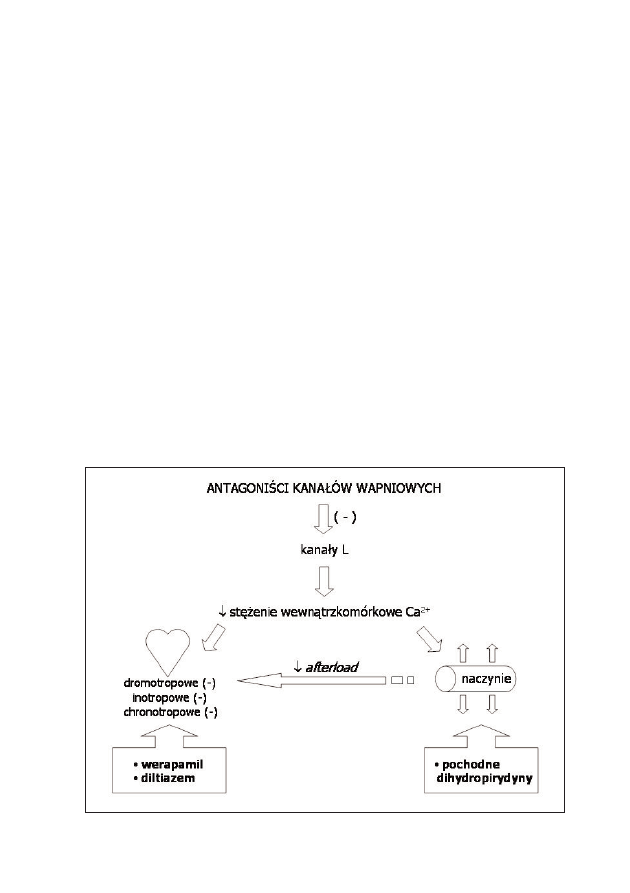
MECHANIZM DZIAŁANIA ANTAGONISTÓW KANAŁÓW
WAPNIOWYCH
Antagoniści kanałów wapniowych, działając poprzez kanały typu L, powo-
dują zahamowanie dokomórkowego prądu wapniowego. Nie wzrasta zatem
stężenie jonów Ca
2+
w komórce mięśniowej i tym samym nie dochodzi do
aktywacji skurczu. Efektem działania AKW jest zmniejszenie kurczliwości
mięśnia sercowego, zwolnienie przewodzenia przedsionkowo-komorowego
oraz zwolnienie pracy serca. Działanie AKW w mięśniach gładkich naczyń
krwionośnych prowadzi do rozszerzenia łożyska naczyniowego i obniżenia
ciśnienia tętniczego krwi.
Antagoniści kanałów wapniowych rozszerzają głównie drobne tętniczki
oporowe, w nerkach są to tętniczki przedkłębuszkowe. Najsilniejszy efekt
rozszerzający uzyskuje się w naczyniach wieńcowych, mózgowych, nerko-
wych, płucnych, skórnych i mięśniowych. Znacznie słabiej AKW wpływają
na duże naczynia żylne i tętnicze. Obniżenie ciśnienia tętniczego krwi nastę-
puje zatem poprzez zmniejszenie oporu obwodowego. Antagoniści kanałów
wapniowych obniżając ciśnienie tętnicze krwi, zmniejszają obciążenie na-
stępcze serca (afterload), nie wpływają jednak na obciążenie wstępne. Me-
chanizm działania AKW przedstawia rycina 1. Efekt działania poszczegól-
nych grup AKW przedstawiono w tabeli 1.
105
Rycina 1: Mechanizm działania antagonistów kanałów wapniowych

Niektórzy przedstawiciele AKW (pochodne dihydropirydyny I generacji)
powodują gwałtowne rozszerzenie naczyń obwodowych i szybkie obniżenie
ciśnienia tętniczego krwi. Wówczas dochodzi do odbarczenia barorecepto-
rów, które aktywują układ współczulny, co objawia się przyspieszeniem ryt-
mu serca i zwiększeniem kurczliwości mięśnia sercowego. Reakcje te pro-
wadzą do wzrostu długu tlenowego komórek mięśniowych. Wtórnie do
aktywacji układu współczulnego uruchomiony zostaje układ renina-angiote-
nsyna-aldosteron (R-A-A).
PODZIAŁ ANTAGONISTÓW KANAŁÓW WAPNIOWYCH
Antagoniści kanałów wapniowych pochodzą z trzech grup chemicznych.
W każdej z nich wyróżnić można kolejne generacje leków. Najliczniejszą
grupę stanowią pochodne dihydropirydyny, a najbardziej znanymi jej przed-
106
Tabela 1: Efekt działania antagonistów kanałów wapniowych
EFEKT
DZIAŁANIA
AKW
Pochodne
dihydropirydyny
Pochodne
fenyloal-
kiloaminy
Pochodne
benzo-
tiazepiny
nifedypina
amlodypina/
felodypina
werapamil
diltiazem
rozszerzenie
tętnic
wieńcowych
+++
+++
++
++
rozszerzenie
tętnic
obwodowych
+++
+++
++
+
kurczliwość
mięśnia
sercowego
0/+
0/+
0/-
0/-
częstość
akcji serca
++
0/+
-
-
przewodzenie
przedsionkowo-
komorowe
0
0
-
-
(+) zwiększenie, ( - ) zmniejszenie, ( 0 ) brak wpływu.

stawicielami są: nifedypina, nitrendypina i amlodypina. Pochodne dihydropi-
rydyny działają głównie na naczynia krwionośne.
Pozostałe dwie grupy chemiczne, tj. pochodne benzotiazepiny i pochodne
fenyloalkiloaminy, również rozszerzają naczynia krwionośne, lecz mniej in-
tensywnie, niż pochodne dihydropirydyny, zaś największą aktywność wykazu-
ją w kardiomiocytach.
Innym podziałem AKW jest podział na generacje, który oparto na różni-
cach w profilu farmakokinetycznym. Preparaty I generacji charakteryzuje
niska biodostępność, wysoki metabolizm I przejścia, a przede wszystkim
gwałtowny początek i krótki czas działania. Ograniczeniem w ich stosowa-
niu są, poza gwałtownym obniżaniem ciśnienia tętniczego krwi, częste obja-
wy niepożądane.
II generacja utworzona została z preparatów ulepszonych początkowo za
pomocą specjalnej preparatoryki (system powolnego uwalniania, tabletki
specjalnie powlekane), mającej zapewnić powolniejsze uwalnianie leku i ła-
godniejszy początek działania (podgrupa A). Dalsze etapy doskonalenia for-
107
Tabela 2: Podział antagonistów kanałów wapniowych
PODZIAŁ
CHEMICZNY
GENERACJA
I
GENERACJA
II A
GENERACJA
II B
GENERACJA
III
pochodne
dihydro-
pirydyny
nifedypina
nifedypina
SR
nifedypina
GITS
nifedypina
CC
felodypina
ER
nicardypina
SR
nikardypina
nitrendypina
nisoldypina
isradypina
felodypina
amlodypina
lacydypina
lerkani-
dypina
pochodne
benzo-
tiazepiny
diltiazem
diltiazem SR
pochodne
fenyloal-
kiloaminy
werapamil
werapamil
SR
SR - slow release; GITS - gastrointestinal therapeutic system; CC - coat core; ER - extended
release

my leku pozwoliły uzyskać preparaty wysoce naczynioselektywne, czyli nie
pobudzające wtórnie układu współczulnego (podgrupa B).
III generację tworzą leki o wysokiej biodostępności, wysoce naczyniose-
lektywne, których działanie jest równomiernie rozłożone w czasie, a możli-
wość powolnego uwalniania leku pozwala dawkować go 1 raz dziennie. Po-
dział antagonistów kanałów wapniowych przedstawiono w tabeli 2.
ZASTOSOWANIE KLINICZNE ANTAGONISTÓW KANAŁÓW
WAPNIOWYCH
Antagonistów kanałów wapniowych stosuje się w leczeniu nadciśnienia tęt-
niczego, choroby niedokrwiennej serca oraz zaburzeń rytmu serca. Są to leki
przydatne również w leczeniu pierwotnego nadciśnienia płucnego, zaburzeń
krążenia mózgowego, a także w zapobieganiu przedwczesnej akcji porodowej.
Nadciśnienie tętnicze
Nadciśnienie tętnicze, to najczęstsze wskazanie do stosowania AKW. An-
tagoniści kanałów wapniowych stanowią jedną z sześciu grup leków zaleca-
nych przez World Health Organization, International Society of Hypertension,
jak również Polskie Towarzystwo Nadciśnienia Tętniczego, w monoterapii
nadciśnienia tętniczego jako tzw. leki pierwszego rzutu. W przypadkach nad-
ciśnienia umiarkowanego i ciężkiego, można je stosować w terapii skojarzo-
nej z innymi preparatami hipotensyjnymi.
Innym ważnym zastosowaniem AKW, w którym stanowią drugą po diure-
tykach zalecaną grupę terapeutyczną, jest leczenie izolowanego nadciśnie-
nia skurczowego. Jeden z patomechanizmów tego typu nadciśnienia, związa-
ny jest z gromadzeniem w komórkach mięśniowych jonów Ca
2+
, stąd
zastosowanie AKW wydaje się uzasadnione. W dużych badaniach klinicz-
nych, dotyczących terapii tego typu nadciśnienia, potwierdzono skuteczność
różnych preparatów z grupy AKW, nie tylko w obniżaniu ciśnienia tętnicze-
go, ale też w zmniejszaniu częstości udarów mózgu i stanów otępiennych.
Antagonistów kanałów wapniowych można stosować również interwencyj-
nie w przełomie nadciśnieniowym. Najczęściej, ze względu na szybkość dzia-
łania, używana jest nifedypina, która podana podjęzykowo w dawce 5-20 mg
powoduje obniżenie ciśnienia tętniczego krwi, już po około 5 minutach od
podania, szczyt działania przypada na 15-30 minutę, a efekt hipotensyjny
utrzymuje się przez 4-6 godzin.
W pewnych stanach chorobowych antagoniści kanałów wapniowych znaj-
dują szczególne zastosowanie. Jako leki nie zaburzające profilu metabolicz-
108

nego, polecane są do stosowania u pacjentów z zaburzeniami gospodarki wę-
glowodanowej, zaburzeniami lipidowymi, czy patologicznymi stanami skur-
czowymi naczyń krwionośnych, np. miażdżycą zarostową tętnic kończyn dol-
nych, czy chorobą Raynaulda. Mogą być także bezpiecznie przyjmowane
przez pacjentów z astmą oskrzelową. W opisanych przypadkach stanowią al-
ternatywne rozwiązanie w stosunku do leków
β-adrenolitycznych.
Antagoniści kanałów wapniowych są grupą leków bezpiecznych, również
u pacjentów z niewydolnością nerek. Ponieważ rozszerzają tętniczki przed-
kłębuszkowe, sprzyjają wzrostowi przesączania kłębuszkowego, poprawiają
filtrację kłębuszkową, obniżają poziom kreatyniny i zwiększają diurezę. Wy-
kazują też działanie natriuretyczne. Dzięki tym działaniom są stosowane
w leczeniu nadciśnienia tętniczego po przeszczepie nerki. Zapobiegają rów-
nież nefrotoksyczności powodowanej przez środki cieniujące. W tych przy-
padkach, można zatem uznać AKW, za leki nefroprotekcyjne.
Konsekwencją wieloletniego, nieleczonego nadciśnienia tętniczego, jest prze-
rost mięśnia lewej komory. Badania kliniczne potwierdziły, że dzięki stosowaniu
AKW, można uzyskać istotną regresję przerostu mięśnia sercowego. W badaniu
z lacydypiną, redukcja ta wyniosła nawet 25% (ocena echokardiograficzna). Po-
dobne efekty uzyskano przy stosowaniu werapamilu i diltiazemu.
Ważnym aspektem leczenia nadciśnieniowego, jest bezpieczeństwo stoso-
wania tych leków u kobiet w ciąży. Uważa się, iż stosowana przed ciążą tera-
pia antagonistą kanałów wapniowych, w czasie ciąży może być kontynuowa-
na. Nie są to jednak leki pierwszego wyboru w terapii nadciśnienia tętniczego
u ciężarnych. Mają jednak zapewnione miejsce w zapobieganiu przedwcze-
snym porodom.
Antagoniści kanałów wapniowych jako grupa leków przeciwnadciśnienio-
wych charakteryzują się pewnymi mechanizmami, które dodatkowo stano-
wią o bezpieczeństwie przewlekłej terapii. Leki te bowiem, nie powodują
niedociśnienia ortostatycznego (problem istotny w terapii osób starszych),
nie obniżają prawidłowego ciśnienia (można je bezpiecznie stosować m.in.
jako leki wieńcowe u chorych bez nadciśnienia tętniczego) i w długotrwałej
terapii nie wykazują rozwoju tolerancji.
Choroba niedokrwienna serca
• Stabilna dusznica bolesna
Choroba niedokrwienna serca to kolejne istotne wskazanie do stosowania
AKW. W stabilnej dusznicy bolesnej zalecane są począwszy od II klasy wg
Canadian Cardiovascular Society (CCS).
109

Korzyści, jakie odnosi się z zastosowania AKW, związane są ze zmniejsze-
niem stężenia jonów Ca
2+
w komórkach, czego efektem jest:
• zmniejszenie siły skurczu mięśnia sercowego;
• zwolnienie częstości rytmu serca;
• wydłużenie czasu relaksacji lewej komory;
• poprawa ukrwienia warstwy podwsierdziowej;
• rozszerzenie naczyń nasierdziowych;
• poprawa rezerwy wieńcowej;
• zmniejszenie obciążenia następczego serca poprzez obniżenie systemo-
wego ciśnienia tętniczego.
Wszystkie wymienione zjawiska powodują, że w niedokrwionym mięśniu
sercowym zmniejsza się zużycie tlenu, co stanowi podstawę przeciwniedo-
krwiennego działania AKW. Badania kliniczne pokazały, iż przeciwniedo-
krwienne działanie wykazują zarówno pochodne dihydropirydyny, benzotia-
zepiny, jak i fenyloalkiloaminy. Antagoniści kanałów wapniowych przy
długotrwałej terapii wpływają na poprawę tolerancji wysiłku.
Podobne korzyści uzyskuje się stosując AKW w terapii niemego niedo-
krwienia. Porównanie niektórych antagonistów kanałów wapniowych z leka-
mi
β-adrenolitycznymi, w zapobieganiu ostrym zespołom wieńcowym i zgo-
nom z przyczyn sercowych, wypadło na tyle korzystnie dla AKW, iż wydaje
się, że mogą stanowić alternatywną terapię w stanach klinicznych, w których
leki
β-adrenolityczne są przeciwwskazane. Warto zwrócić uwagę na badania
TIBET, ACIP, APSIS opisane w tabeli 5.
• Angina Printzmetala
Antagoniści kanałów wapniowych są grupą leków zalecanych przez Pol-
skie Towarzystwo Kardiologiczne, do stosowania w postaci skurczowej cho-
roby niedokrwiennej serca, ponieważ wpływają na jej główny patomecha-
nizm. W leczeniu anginy Printzmetala wskazane są wszystkie preparaty
z grupy AKW, również nifedypina. Należy jednak pamiętać, że do przerywa-
nia kurczu naczyniowego, stosuje się nitroglicerynę.
• Niestabilna dusznica bolesna
Spośród AKW w standardach Polskiego Towarzystwa Kardiologicznego,
dotyczących leczenia niestabilnej dusznicy bolesnej, znalazły się werapamil
i diltiazem. Na ich działanie przeciwniedokrwienne, składa się nie tylko roz-
110

szerzenie naczyń nasierdziowych i podwsierdziowych, ale też poprawa prze-
pływu krwi przez krążenie oboczne. Ważnym mechanizmem jest dodatkowo
działanie zwalniające rytm serca. Badania kliniczne pokazały, iż w działa-
niach doraźnych werapamil i diltiazem, są równie skuteczne w zwalczaniu
epizodów niedokrwiennych, jak leki
β-adrenolityczne, jednak nie ma takich
dowodów w długoterminowej obserwacji. Pochodne dihydropirydyny, ze
względu na możliwość przyspieszania rytmu serca w mechanizmie aktywacji
układu adrenergicznego, nie są wskazane do stosowania w niestabilnej dusz-
nicy bolesnej.
• Ostry zawał serca
Antagoniści kanałów wapniowych nie są grupą leków zalecaną w ostrym
zawale serca. Badania kliniczne HINT i SPRINT II (opisane w tabeli 5)
udowodniły, że zastosowanie nifedypiny w ostrej fazie zawału serca (pierw-
sze 6 dni), może być dla chorego groźne! Nifedypina w stosunku do placebo,
istotnie zwiększa ryzyko wystąpienia zgonu w pierwszych dniach zawału. Ze
względu na brak badań klinicznych, wskazana wydaje się podobna ostroż-
ność w stosunku do innych przedstawicieli pochodnych dihydropirydyny.
W przypadku werapamilu i diltiazemu – leki te wykazały dobrą skutecz-
ność w leczeniu niestabilnej dusznicy bolesnej – zastosowanie ich może być
brane pod uwagę, u pacjentów ze świeżym zawałem serca, zwłaszcza w sytu-
acjach, w których zawałowi towarzyszą nadkomorowe zaburzenia rytmu ser-
ca lub gdy zawał dokonał się u osoby z postacią skurczową choroby niedo-
krwiennej serca.
• Prewencja wtórna
W kilku badaniach klinicznych, obserwacji poddano pacjentów po przeby-
tym zawale serca, przyjmujących werapamil lub diltiazem. Rokowanie u tych
pacjentów było pomyślne pod warunkiem, że w przebiegu zawału serca nie
doszło do istotnego klinicznie uszkodzenia funkcji skurczowej lewej komory.
Zatem, wystąpienie objawów niewydolności mięśnia sercowego, wykluczało
możliwość dalszego stosowania wspomnianych leków ze względu na gorsze ro-
kowanie. Warto zwrócić uwagę na badania DAVIT II i INTERCEPT (tab. 5).
Zaburzenia rytmu serca
Spośród AKW, do leczenia zaburzeń rytmu serca stosuje się werapamil
i diltiazem, które tworzą IV grupę leków antyarytmicznych wg podziału Vau-
ghana-Williamsa.
111

Zastosowanie AKW jako leków antyarytmicznych, opiera się na ich działa-
niu chrono- i dromotropowo ujemnym. Zwolnienie rytmu serca i wydłużenie
czasu przewodzenia związane jest z opóźnianiem ponownego otwarcia ka-
nałów L w węźle zatokowym oraz przedsionkowo-komorowym. W zapisie
elektrokardiograficznym działanie to objawia się zwolnieniem rytmu i wy-
dłużeniem odstępu P-Q.
Główne wskazania do zastosowania IV grupy leków antyarytmicznych sta-
nowią tachyarytmie nadkomorowe, głównie na tle niedokrwiennym (dodat-
kowe pobudzenia nadkomorowe, częstoskurcz nadkomorowy) oraz kontro-
lowanie częstości rytmu serca w migotaniu przedsionków. Leki te wykazują
małą skuteczność w przywracaniu rytmu zatokowego. Przeciwwskazaniem
do stosowania tej grupy jest choroba węzła zatokowego, bloki przedsionko-
wo-komorowe oraz arytmie z dodatkowym szlakiem przewodzenia (tab. 3).
DZIAŁANIA DODATKOWE ANTAGONISTÓW KANAŁÓW
WAPNIOWYCH
W oparciu o badania in vitro, przeprowadzone na modelu zwierzęcym, za-
obserwowano pod wpływem AKW regresję zmian miażdżycowych, objawia-
jącą się zwiększeniem przekroju naczyń wieńcowych nawet o 50%. Badania
kliniczne jednak nie potwierdziły jednoznacznie działania antyaterogennego
AKW. W badaniu INTACT, dotyczącym nifedypiny, wykazano niewielki
wpływ hamujący tego preparatu na proces tworzenia się nowych zmian miaż-
dżycowych w naczyniach wieńcowych. W badaniu PREVENT, dotyczącym
amlodypiny, również nie zaobserwowano istotnego wpływu przeciwmiażdży-
cowego, jednak odnotowano znaczące zmniejszenie częstości nawrotów cho-
112
Tabela 3: Wskazania i przeciwwskazania do stosowania antagonistów kanałów wapniowych
w zaburzeniach rytmu serca
WSKAZANIA
PRZECIWWSKAZANIA
• pobudzenia dodatkowe
nadkomorowe;
• częstoskurcz nadkomorowy;
• częstoskurcz nawrotny węzłowy;
• częstoskurcz nawrotny
przedsionkowo-komorowy;
• migotanie przedsionków;
• bradykardia zatokowa;
• zespół chorej zatoki;
• zespół tachykardia-bradykardia;
• bloki przedsionkowo-komorowe
II i III stopnia;
• zespół WPW, LGL;
• arytmie na tle choroby
organicznej;

roby wieńcowej, konieczności rewaskularyzacji, jak i ponownych hospitali-
zacji. Lacydypina w badaniu ELSA wykazała wprawdzie znaczący wpływ na
zmiany miażdżycowe, ale jedynie w dużych naczyniach, tj. w tętnicach szyj-
nych. Istotny jest fakt, iż uzyskany efekt przeciwmiażdżycowy nie związany
był z działaniem hipotensyjnym badanego leku.
Innym dodatkowym działaniem, jakie AKW wykazują w badaniach do-
świadczalnych, jest działanie przeciwkrzepliwe związane z hamowaniem
agregacji płytek krwi i uwalniania tromboksanu.
AKW prawdopodobnie mogą również oddziaływać na mięśniówkę gład-
ką naczyń za pośrednictwem tlenku azotu.
ANTAGONIŚCI KANAŁÓW WAPNIOWYCH
W NIEWYDOLNOŚCI SERCA
Istotną różnicę obserwuje się porównując wpływ stosowania poszczegól-
nych grup AKW w zależności od etiologii niewydolności serca. W przypad-
ku, gdy do niewydolności serca doszło na tle choroby niedokrwiennej, roko-
wanie jest gorsze, o czym już wspomniano w części dotyczącej prewencji
wtórnej. Obserwacja dotyczyła werapamilu i diltiazemu.
Bezpieczniejsze jest stosowanie AKW w niewydolności mięśnia sercowego
o etiologii innej niż niedokrwienna. W przeprowadzonych badaniach klinicz-
nych PRAISE i PRAISE 2 nie zaobserwowano niekorzystnego wpływu po-
chodnych dihydropirydyny III generacji (amlodypina) na przebieg i rokowa-
nie w kardiomiopatii rozstrzeniowej o innej niż niedokrwienna etiologii. Co
więcej, amlodypina, stosowana u chorych z zaawansowaną niewydolnością
serca w klasie NYHA III/IV, bez względu na przyczynę wystąpienia tej nie-
wydolności, okazała się być lekiem bezpiecznym. Podobne obserwacje po-
czyniono w przypadku felodypiny w badaniu V-HeFT III. Niektóre badania
dotyczące stosowania AKW w niewydolności serca zamieszczono w tabeli 5.
DZIAŁANIA NIEPOŻĄDANE
Objawy niepożądane najczęściej związane są bezpośrednio z silnym roz-
szerzaniem łożyska naczyniowego i dotyczą zwłaszcza pochodnych dihydro-
pirydynowych I generacji. Do najbardziej znanych należą bóle i zawroty gło-
wy, zaczerwienienie skóry, obrzęki wokół kostek.
Nowsze generacje wykazują mniej niekorzystnych objawów hemodyna-
micznych, jednak nie są zupełnie wolne od działań ubocznych, wynikających
z innych mechanizmów. Najczęstsze działania niepożądane przedstawiono
w tabeli 4.
113

INTERAKCJE
Niekorzystne może być kojarzenie werapamilu bądź diltiazemu, z lekami
β-adrenolitycznymi, ze względu na ryzyko wystąpienia bloku przedsionko-
wo-komorowego lub bradykardii. Podobne zagrożenie związane jest z łącze-
niem werapamilu lub diltiazemu z preparatami naparstnicy. Pozytywne efekty
można zaś uzyskać łącząc preparaty z grupy pochodnych dihydropirydyno-
wych z lekami
β-adrenolitycznymi, ze względu na wzajemne zmniejszanie
działań niepożądanych, takich jak przyspieszenie rytmu serca po pochod-
nych dihydropirydyny, czy niekorzystne działania metaboliczne w przypadku
stosowania nieselektywnych
β-adrenolityków. Równie korzystne jest połą-
czenie werapamilu z inhibitorem enzymu konwertującego angiotensynę. Wy-
korzystując działanie synergistyczne obu leków stworzono preparat złożony
z werapamilu SR i trandolaprilu.
Istnieją doniesienia o możliwości niekorzystnej interakcji diltiazemu ze sta-
tynami. Połączenie takie może zwiększać ryzyko wystąpienia rabdomiolizy.
WAŻNIEJSZE BADANIA KLINICZNE
Najistotniejsze, z klinicznego punktu widzenia, badania Evidence Based
Medicine dotyczące stosowania antagonistów kanału wapniowego zawarto
w tabeli 5.
114
Tabela 4: Działania niepożądane niektórych antagonistów kanałów wapniowych
GRUPA
LEK
DZIAŁANIA NIEPOŻĄDANE
pochodne
dihydropirydynowe
I generacji
nifedypina
bóle, zawroty głowy,
zaczerwienienie twarzy, obrzęki
wokół kostek, nudności,
niepokój, depresja;
pochodne
fenyloalkiloaminy
werapamil zaparcia (30% pacjentów);
pochodne
dihydropirydynowe
III generacji
lacydypina
wielomocz, przerost dziąseł,
rumień, świąd skóry;

115
Tabela 5: Najważniejsze badania kliniczne dotyczące stosowania antagonistów kanałów wapniowych
BADANIE
LEK
WNIOSKI
SYST-EURO
nitrendypina
u osób starszych, z izolowanym
nadciśnieniem skurczowym:
zmniejszenie częstość wystąpienia
UM o 42%, ZS o 30%, ilości stanów
otępiennych o 50%;
HOT
felodypina
obniżenie ciśnienia rozkurczowego:
istotne zmniejszenie częstości
incydentów sercowo-naczyniowych;
TIBET
nifedypina SR
vs atenolol
porównywalna skuteczność
w zapobieganiu ostrym epizodom
wieńcowym i zgonom;
APSIS
werapamil SR
vs metoprolol
CR
w stabilnej chorobie wieńcowej: brak
różnic między grupami w całkowitej
śmiertelności i częstości występowania
powikłań sercowo-naczyniowych;
ACIP
diltiazem
vs atenolol
podobna skuteczność w obu grupach
w leczeniu niemego niedokrwienia;
DAVIT II
werapamil
vs placebo
u chorych po ZS bez objawów NS:
zmniejszenie częstości ponownych ZS
i zgonów; u chorych z objawami NS:
nie obserwowano istotnych różnic
między obu grupami w zakresie
śmiertelności;
PROGRAM
DRSG
diltiazem
u pacjentów po ZS non-Q
z nadciśnieniem tętniczym: skuteczny
w prewencji wtórnej;
INTERCEPT
diltiazem SR
u pacjentów po ZS leczonych
fibrynolitycznie: istotne zmniejszenie
częstości ponownych ZS, ryzyka
zgonu i konieczności rewaskularyzacji;
u pacjentów z NS: gorsze rokowanie;
HINT
nifedypina
w niestabilnej dusznicy bolesnej:
wzrost ryzyka zgonu z przyczyn
sercowych;

116
Tabela 5: Najważniejsze badania kliniczne dotyczące stosowania antagonistów kanałów wapniowych c.d.
BADANIE
LEK
WNIOSKI
SPRINT I
SPRINT II
nifedypina
vs placebo
w ostrym ZS: wzrost wczesnej
śmiertelności; brak wpływu na
częstość powtórnych ZS;
INTACT
nifedypina
nieznaczny, hamujący wpływ na
proces tworzenia nowych zmian
miażdżycowych w naczyniach
wieńcowych;
ELSA
lacydypina
vs placebo
znaczące działanie przeciwmiażdżycowe
nie związane z efektem hipotensyjnym
(ocena w tętnicach szyjnych);
PREVENT
amlodypina
vs placebo
brak hamowania tworzenia się
nowych zmian miażdżycowych
w tętnicach wieńcowych oraz brak
wpływu na zwolnienie postępu już
istniejących zmian miażdżycowych
w naczyniach; zmniejszenie częstości
występowania objawów ChNS,
potrzeby rewaskularyzacji oraz
konieczności hospitalizacji z powodu
objawów ChNS;
PRAISE
PRAISE 2
amlodypina
vs placebo
u chorych z kardiomiopatią
rozstrzeniową o etiologii innej niż
niedokrwienna: znamienne
zmniejszenie ryzyka zgonu o 46%;
u chorych z zaawansowaną NS
(NYHA III/IV) bez względu na
etiologię: bez nasilenia objawów NS;
V-HeFT III
felodypina
połączenie felodypiny z ACE-
inhibitorem w leczeniu przewlekłej
NS nie jest skuteczniejsze niż
stosowanie samego ACE-I; nie
wykazano niekorzystnego wpływu
felodypiny na objawy NS;
UM - udar mózgu, ZS - zawał serca, NS - niewydolność serca

117
Zapamiętaj!
1. Antagoniści kanałów wapniowych to zróżnicowana pod względem działa-
nia grupa leków.
2. Najczęstszym wskazaniem do stosowania AKW jest nadciśnienie tętnicze.
3. Nie należy stosować nifedypiny w ostrych zespołach wieńcowych.
4. Antagoniści kanałów wapniowych są podstawową grupą leków zalecaną
w leczeniu postaci skurczowej choroby niedokrwiennej serca tzw. anginie
Printzmetala.
Polecane lektury:
L. Giec, Z. S. Herman: Farmakoterapia chorób układu sercowo-naczynio-
wego; PZWL, Warszawa, 1998.
R. Haiat, G. Leroy: Leczenie chorób sercowo-naczyniowych; Via Medica,
Gdańsk, 2000.
B. Wyrzykowski: Nadciśnienie tętnicze. Terapia i Leki; Via Medica, Gdańsk,
2001.
Standardy PTK. Kardiologia Polska, 1997.

IX.
CZY STATYNY TO NOWA ASPIRYNA W KARDIOLOGII
XXI WIEKU?
Witold Pikto-Pietkiewicz, Mirosław Dłużniewski
WSTĘP
Konieczność leczenia zaburzeń lipidowych stała się oczywista od czasu
pionierskich badań Framingham Heart Study, kiedy to określono, że jednym
z trzech głównych czynników ryzyka choroby niedokrwiennej serca (ChNS)
jest podwyższone stężenie cholesterolu. Rola cholesterolu w powstawaniu
blaszki miażdżycowej była oczywiście znana już wcześniej, Aniczkow w swo-
ich pionierskich badaniach udowodnił w modelu zwierzęcym, że wysokie
spożycie egzogennego cholesterolu, wiąże się z szybszym rozwojem ognisk
ateromatycznych. W latach sześćdziesiątych ubiegłego stulecia, rozpoczęto
szereg programów interwencyjnych w dużych populacjach osób obarczonych
jednym lub wieloma czynnikami ryzyka, wykazując, że korekcja niefarmako-
logiczna lub farmakologiczna, prowadząca do zmniejszenia poziomu czyn-
ników ryzyka, prowadzi w takiej populacji do redukcji zagrożenia chorobami
układu krążenia (ChUK). Jednym z czynników ryzyka, na którym skupiano
szczególną uwagę była, rzecz jasna, hipercholesterolemia (ryc. 1). Dziś nasza
wiedza na temat tzw. lipidowych czynników ryzyka ChNS jest znacznie szer-
sza, wiadomo bowiem, że stężenie cholesterolu całkowitego jest mało precy-
zyjnym wskaźnikiem zagrożenia, a u osób z pozornie „prawidłowymi” stęże-
niami cholesterolu całkowitego, stopień zagrożenia może być nie mniejszy,
niż u osób z hipercholesterolemią. Wiąże się to z niekorzystnym rozkładem
cholesterolu pomiędzy „ochronną” frakcją HDL, a miażdżycorodną frakcją
LDL, obecnością innych lipidowych czynników ryzyka, np. lipoproteiny – Lp
(a). Należy także pamiętać, że hipertriglicerydemia stanowi ważny, niezależ-
ny czynnik ryzyka ChUK – problem ten omówiono w oddzielnym rozdziale
niniejszej publikacji.
O ile działania zapobiegawcze, celowane na zmniejszenie spożycia chole-
sterolu egzogennego i tłuszczów zwierzęcych, stanowiły od początku racjo-
nalną podstawę interwencji w zakresie zaburzeń lipidowych, o tyle farmako-
terapia była przedmiotem kontrowersji. Takie badania jak Coronary Drug
Project z zastosowaniem kwasu nikotynowego, czy Lipid Research Clinic Co-
ronary Primary Prevention Trial z użyciem cholestyraminy pokazały, że za-
równo w prewencji wtórnej, jak i prewencji pierwotnej nawet niewielka re-
dukcja cholesterolu za pomocą farmakoterapii, wiąże się z istotnym,
kilkunastoprocentowym spadkiem ryzyka śmierci z powodu ChNS. Badania
118
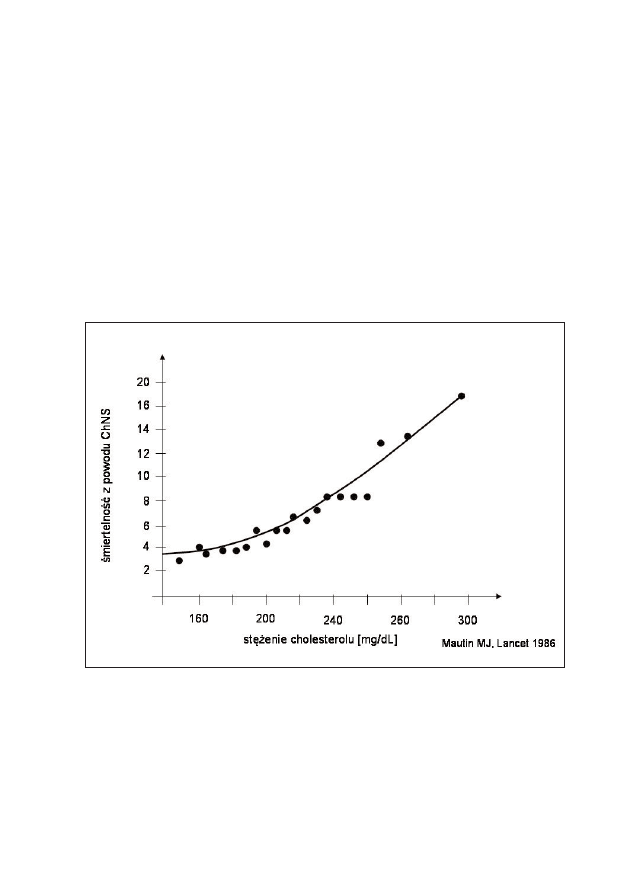
te potwierdziły obserwowaną już wcześniej zależność, że spadek stężenia
cholesterolu o 1% wiąże się z 2% spadkiem ryzyka zgonu z powodu ChNS.
Istotnym ograniczeniem farmakoterapii hiperlipidemii za pomocą żywic czy
kwasu nikotynowego, jest duży odsetek działań ubocznych tych leków, ogra-
niczający liczbę chorych, u których takie leczenie można stosować w sposób
efektywny i przewlekły. Wprowadzenie do leczenia pod koniec lat 60-tych
klofibratu wzbudziło duże nadzieje na bardziej skuteczne leczenie zaburzeń
lipidowych. Jednak wyniki badań z tym lekiem wniosły wiele wątpliwości, co
do zasadności szerokiego stosowania farmakoterapii zaburzeń lipidowych
w celu prewencji powikłań sercowo-naczyniowych. Co prawda w badaniu
WHO stosowanie klofibratu spowodowało istotny 25% spadek ryzyka zgonu
wieńcowego, to jednak z leczeniem związany był znamienny wzrost umieral-
ności pozasercowej, głównie z powodu choroby nowotworowej.
W 1987 roku, w Stanach Zjednoczonych został zarejestrowany nowy lek
hipolipemizujący – lowastatyna. Rozpoczęła się era statyn. Lata 90-te to
triumfalny pochód statyn, gwałtownie zwiększających swój udział w farmako-
terapii zaburzeń lipidowych u chorych z ChUK. Intensywne badania nad no-
wymi, pozalipidowymi mechanizmami działania statyn, wykazanie, że wy-
119
Rycina 1: Śmiertelność z powodu choroby niedokrwiennej serca w zależności od stężenia cholesterolu
całkowitego (6-letni follow-up 361 662 mężczyzn, w wieku 35-57 lat)

wierają działanie zmniejszające ryzyko powikłań sercowo-naczyniowych nie
tylko w związku z działaniem hipolipemizującym, spowodowało wysunięcie
przypuszczenia przez niektórych badaczy, że statyny staną się aspiryną XXI
wieku. Czy tak jest w istocie?
MECHANIZM DZIAŁANIA STATYN
Zanim w 1976 roku japońscy badacze Endo i Kurod wyizolowali z grzybni
Penicillium citrinum mewastatynę, badania nad sposobami farmakologicz-
nego zahamowania szlaku syntezy cholesterolu prowadził już w latach 60-tych
ubiegłego stulecia polski uczony Janusz Supniewski, profesor Uniwersytetu
Jagiellońskiego i Akademii Medycznej w Krakowie. Profesor Supniewski ba-
dał właściwości kwasu metylo-buteno-karboksylowego (MBCA), który ha-
mował syntezę cholesterolu i wykazywał właściwości przeciwmiażdżycowe
w modelu zwierzęcym. Prace wdrożeniowe nad MBCA zatrzymała jednak
śmierć uczonego.
Mewastatyna była pierwszym związkiem hamującym enzym reduktazę
3-hydroksy-3-metyloglutarylo-koenzymu A (HMG-CoA) otwierającym gru-
pę inhibitorów reduktazy HMG-CoA, nazwanych następnie statynami. Ze
względu na toksyczność, nie została wprowadzona do leczenia. Pierwszym
zarejestrowanym lekiem była lowastatyna – naturalny inhibitor reduktazy
HMG-CoA, wyizolowany z grzybni Aspergillus terreus. W rok później zareje-
strowano kolejne statyny – simwastatynę i prawastatynę, a w latach 90-tych
pojawiły się nowe, silne inhibitory reduktazy HMG-CoA, będące w przeci-
wieństwie do wymienionych wcześniej statyn naturalnych, związkami całko-
wicie syntetycznymi (atorwastatyna, ceriwastatyna).
Mechanizm działania hipolipemizującego
Reduktaza HMG-CoA jest ważnym enzymem na wczesnym etapie synte-
zy cholesterolu, jeszcze przed utworzeniem związku policyklicznego. W wy-
niku działania enzymu, związek macierzysty, jakim jest HMG-CoA, zostaje
przekształcony w kwas mewalonowy, który następnie w procesie fosforyla-
cji zostaje przekształcony w pirofosforan izopentenylu (ryc. 2). Statyny są
kompetycyjnymi inhibitorami reduktazy HMG-CoA. W wyniku ich działa-
nia dochodzi do zahamowania wątrobowej syntezy cholesterolu i obniżenia
jego zawartości w cytoplazmie. Efektem obniżenia stężenia cholesterolu
w obrębie komórki wątrobowej, jest aktywacja enzymu powodującego od-
szczepienie od struktur siateczki cytoplazmatycznej białka SREBP (sterol re-
gulatory element – binding protein). Białko SREBP przechodzi do jądra ko-
120
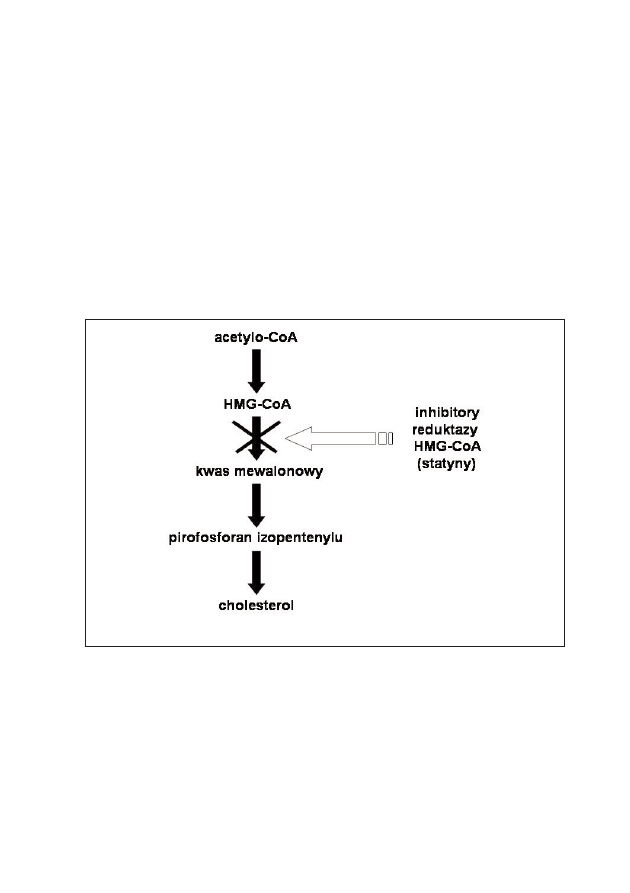
mórkowego, łączy się ze specyficzną częścią DNA – SRE (sterol regulatory
element), stanowiącą fragment promotora wielu genów istotnych dla meta-
bolizmu cholesterolu i triglicerydów. W efekcie dochodzi do zwiększenia
szybkości transkrypcji genu odpowiedzialnego za syntezę receptora LDL
z następowym zwiększeniem ekspresji receptorów dla LDL na powierzchni
hepatocyta. Prowadzi to do przyśpieszenia wychwytu wątrobowego tych li-
poprotein z następowym obniżeniem stężenia LDL i IDL w surowicy krwi.
W wyniku działania SREBP dochodzi także do pobudzenia syntezy redukta-
zy HMG-CoA i innych enzymów, biorących udział w syntezie cholesterolu
oraz metabolizmie triglicerydów. Wtórna aktywacja reduktazy HMG-CoA
w wyniku długotrwałego zahamowania syntezy cholesterolu przez statyny,
może być odpowiedzialna za obserwowany niekiedy powolny wzrost stęże-
nia cholesterolu LDL w surowicy w trakcie leczenia (escape phenomenon).
W wyniku zahamowania reduktazy HMG-CoA pod wpływem statyn do-
chodzi do zmian w stężeniach lipidów w surowicy krwi. Istotnemu obniże-
niu ulega stężenie cholesterolu całkowitego, szczególnie zaś obniża się za-
wartość cholesterolu w aterogennej frakcji lipoprotein niskiej gęstości –
LDL. Obniżeniu pod wpływem statyn ulega także, w zmiennym stopniu, stę-
żenie triglicerydów. Towarzyszy tym zmianom niewielki wzrost stężenia cho-
lesterolu HDL (tab. 1).
121
Rycina 2: Mechanizm hamowania syntezy cholesterolu przez statyny

Pozalipidowe mechanizmy działania statyn
Obserwacje pochodzące z badań ze statynami stosowanymi w populacjach
osób wysokiego ryzyka powikłań sercowo-naczyniowych (chorzy po przeby-
tym incydencie niedokrwiennym serca, z wieloma czynnikami ryzyka, cukrzy-
cą) ujawniły, że efekt ochronny leczenia, jest większy niż w przypadku wcze-
śniej stosowanej terapii hipolipemizującej. Zaobserwowano także, iż
działanie statyn redukujące zagrożenie powikłaniami sercowo-naczyniowymi
jest porównywalne w szerokim zakresie stężeń cholesterolu (porównywalne
efekty leczenia chorych z łagodną, umiarkowaną i ciężką hipercholesterole-
mią). Co więcej, okazało się, że statyny chroniły przed zawałem serca także
osoby nim zagrożone, nawet wtedy, gdy stężenia cholesterolu mieściły się
w zakresie uznawanym dotychczas za „prawidłowy”! Wszystkie te obserwacje
doprowadziły do wniosku, że ochronny wpływ leczenia statynami związany
jest z dodatkowymi efektami działania tych leków, i nie wynika jedynie z ich
działania hipolipemizującego. Te dodatkowe mechanizmy określamy jako
pleotropowe działanie statyn.
Pleotropizm oznacza oddziaływanie pojedynczego leku na wiele celów, mo-
że być związany z podstawowym mechanizmem działania leków, może także
być od niego niezależny. Pleotropowe działania leku mogą być związane z do-
datkowymi, korzystnymi właściwościami danego leku, mogą być obojętne
lub też mogą odpowiadać za działania uboczne danego leku. W przypadku
statyn należy pamiętać, że zablokowanie reduktazy HMG-CoA, prowadzi
do wielokierunkowych zmian. Efektem jej zablokowania jest nie tylko
zmniejszenie stężenia wewnątrzkomórkowego cholesterolu, ale także zaha-
mowanie syntezy innych, niepierścieniowych pochodnych kwasu mewalono-
122
Tabela 1: Wpływ statyn na poszczególne frakcje cholesterolu i trójglicerydy
ChC
redukcja
[%]
LDL
redukcja
[%]
HDL
wzrost [%]
TG
redukcja
[%]
atorwastatyna
17 - 46
35 - 61
(-3) - 12
10 - 45
fluwastatyna
13 - 21
17 - 31
(-3) - 10
1 - 13
lowastatyna
17 - 34
24 - 40
5 - 9
2 - 19
prawastatyna
11 - 28
17 - 35
3 - 10
10 - 24
simwastatyna
20 - 40
28 - 45
5 - 15
10 - 20
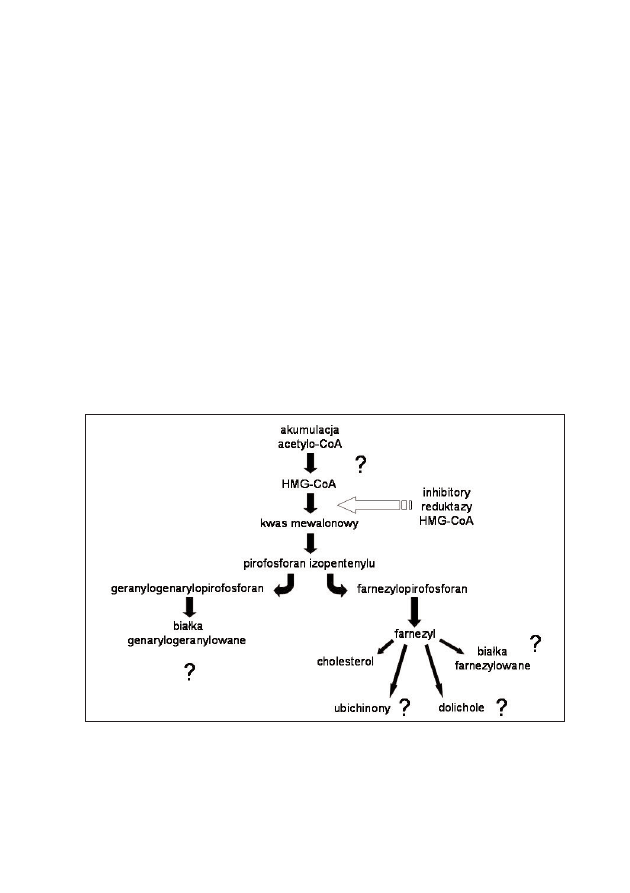
wego, zwanych „izoprenoidami” (ryc. 3). Są to bogato energetyczne związki
– pochodne pirofosforanu izopentenylu, biorące udział w procesach łączenia
się fragmentów lipidowych z białkami wewnątrzkomórkowymi. Proces „pre-
nylacji” białek powoduje nadanie im specjalnych właściwości tzw. białek
przekaźnikowych (białka Ras, Rho, Rap). Białka te biorą udział w proce-
sach sygnałowych, niezbędnych dla proliferacji i różnicowania komórek.
Z tym wiąże się prawdopodobne działanie antyproliferacyjne statyn. Innym
ważnym produktem pochodnym mewalonianu, synteza którego zostaje za-
hamowana pod wpływem statyn, jest ubichinon – kofaktor układu „oddy-
chania wewnątrzkomórkowego” oraz dolichol – związek niezbędny do synte-
zy glikoprotein. Zakłócenie układów oksydacji wewnątrzkomórkowej
w mięśniach poprzecznie prążkowanych, związane z zaburzoną syntezą ubi-
chinonu jest jednym z postulowanych mechanizmów miopatii po statynach.
Trwają intensywne badania nad coraz liczniejszymi pleotropowymi właści-
wościami poszczególnych statyn (tab. 2). Wśród wielu opisywanych efektów,
część może mieć szczególne znaczenie w działaniu zapobiegającym ostrym
incydentom niedokrwiennym serca (lub mózgu), a tym samym ograniczają-
cym śmiertelność związaną z tymi incydentami.
Dysfunkcja śródbłonka jest uważana za jedno z najważniejszych zaburzeń,
leżących u podłoża patologii ściany naczyniowej, towarzyszy jednocześnie
utrwalonym zaburzeniom układu krążenia, takim jak nadciśnienie tętnicze
123
Rycina 3: Efekty blokowania reduktazy HMG-CoA

czy ChNS. Hipercholesterolemia przyczynia się do powstawania i podtrzy-
mywania dysfunkcji śródbłonka, stąd też każde leczenie hipolipemizujące,
normalizuje zaburzoną funkcję endotelium. Poprawa funkcji wyraża się
zwiększeniem syntezy tlenku azotu, a co za tym idzie normalizacją aktywno-
ści wazodylatacyjnej naczynia, w odpowiedzi na różne bodźce (np. acetylo-
cholinę: zwiększenie przepływu – flow mediated vasodilatation). Jednocze-
śnie zmniejszeniu ulega gotowość do kurczu naczyniowego pod wpływem
takich bodźców jak noradrenalina czy angiotensyna. Wydaje się, że wpływ
przynajmniej niektórych statyn na funkcję śródbłonka, zależy nie tylko od
działania hipolipemizującego, ale także od innych mechanizmów związanych
m.in. ze zwiększeniem ekspresji syntazy tlenku azotu (NOS), działaniem an-
tyoksydacyjnym (m.in. zmniejszenie oksydacji LDL) oraz działaniem hamu-
jącym ekspresję cząstek adhezyjnych, a przez to zmniejszeniem adhezji mo-
nocytów do endothelium.
124
Tabela 2: Pleotropowe mechanizmy działania statyn
EFEKT PLEOTROPOWY
PREPARAT
wpływ na dysfunkcję śródbłonka
(np. wzrost produkcji NO)
wszystkie statyny;
działanie antyoksydacyjne
simwastatyna; atorwastatyna;
hamujący wpływ na ryzyko
rozwoju demencji
leki lipofilne - przewaga proleków,
polegająca na lepszym przenikaniu
bariery krew-mózg (?)
działanie przeciwzapalne (
↓CRP)
simwastatyna; prawastatyna;
atorwastatyna;
hamowanie migracji i proliferacji
komórek mięśni gładkich
statyny lipofilne (+);
prawastatyna ( - );
wpływ na właściwości reologiczne
i krzepnięcie krwi
atorwastatyna: wzrost stężenia F
w surowicy;
simwastatyna: spadek stężenia F
w surowicy;
prawastatyna: spadek stężenia
PAI-1, ograniczenie powstawania
skrzeplin;
wpływ na ryzyko osteoporozy,
wzrost tkanki kostnej
wszystkie statyny
F - fibrynogen; PAI-1 - inhibitor aktywatora plazminogenu

Nie mniej istotny zakres działań statyn obejmuje ich wpływy przeciwza-
krzepowe i profibrynolityczne. Znaczenie procesu zapalnego w patogenezie
miażdżycy oraz powstawania ostrych zespołów wieńcowych, związanych
z obecnością tzw. niestabilnych blaszek miażdżycowych (vulnerable plaque)
jest powszechnie akceptowane. Wielokierunkowy wpływ przeciwzapalny sta-
tyn jest dziś uznawany za, być może, najistotniejszą przesłankę zastosowa-
nia tych leków w leczeniu ostrych zespołów wieńcowych. Niektórzy autorzy
podnoszą także znaczenie działania antyproliferacyjnego statyn w hamowa-
niu rozwoju blaszki miażdżycowej.
Podsumowując, statyny w wyniku działania hipolipemizującego, jak rów-
nież w wyniku wielu pozalipidowych efektów, powodują stabilizację blaszki
miażdżycowej, zmniejszają jej gotowość do pękania, tym samym prowadzą
do redukcji częstości ostrych incydentów niedokrwiennych i związanej z nimi
umieralności.
CZY WSZYSTKIE STATYNY SĄ TAKIE SAME?
Grupę statyn stanowi obecnie 5 leków (tab. 3). Wprowadzona na rynek
w 1997 roku ceriwastatyna została wycofana rok temu, ze względu na zwięk-
szoną ilość groźnych powikłań i zgonów po zastosowaniu tego leku. Obec-
nie czeka na wprowadzenie na rynek kolejny lek z tej grupy – rosuwastatyna,
nad którą właśnie zakończono badania przedrejestracyjne.
Statyny chętnie łączone są w tzw. klasę leków, podobnie jak inne ważne
w kardiologii leki, takie jak
β-adrenolityki czy ACE-inhibitory. O ile
125
Tabela 3: Statyny dostępne na polskim rynku - preparaty i dawki
PREPARAT
DAWKA
lowastatyna
20–40 mg
simwastatyna
10–80 mg
prawastatyna
20–40 mg
fluwastatyna
20–40 mg
atorwastatyna
10–80 mg

w przypadku
β-adrenolityków stosunkowo łatwo jest wykazać różnice po-
między poszczególnymi lekami (selektywność w stosunku do receptorów
β, właściwości sympatomimetyczne, działanie wazodylatacyjne i in.), które
wyraźnie różnicują wskazania dla określonych preparatów z tej grupy, o ty-
le sytuacja nie jest już tak oczywista w przypadku zarówno ACE-inhibit-
orów, jak i statyn. Zwolennicy tzw. efektu klasy przyjmują założenie, że je-
śli grupa leków wywiera efekt biologiczny poprzez jeden wspólny dla nich
mechanizm (np. blokowanie receptora
β, hamowanie enzymu konwertu-
jącego czy reduktazy HMG-CoA), to efekty kliniczne działania leków
w obrębie klasy są porównywalne lub identyczne. Jak pokazują wyniki co-
raz liczniejszych badań klinicznych, zgodnych z regułami dobrej praktyki
klinicznej (good clinical practice) teoria „efektu klasy” nie znajduje w nich
dobrego potwierdzenia (ryc. 4). Jedynie badania typu „head to head” mo-
głyby w jednoznaczny sposób udowodnić odmienności lub równoważność
klinicznego efektu porównywanych leków. Niestety badania tego typu pro-
wadzone są zbyt rzadko.
Statyny różnią się między sobą pod wieloma względami, mają odmienną
budowę chemiczną, właściwości farmakokinetyczne i farmakodynamiczne,
różnią się także dodatkowymi właściwościami, określanymi jako działanie
pleotropowe. Mają także zróżnicowany profil bezpieczeństwa.
Już w zakresie podstawowego mechanizmu działania tzn. hamowania re-
duktazy HMG-CoA, statyny dość istotnie się różnią. W badaniach in vitro
reduktazę HMG-CoA najsilniej blokuje ceriwastatyna (tab. 4), do silnych
inhibitorów zaliczana jest także atorwastatyna oraz nieobecna jeszcze na
rynku rosuwastatyna. Słabymi inhibitorami są fluwastatyna i prawastatyna.
Siła działania hipolipemizującego poszczególnych statyn poddana została
126
Rycina 4: Statyny - efekt klasy
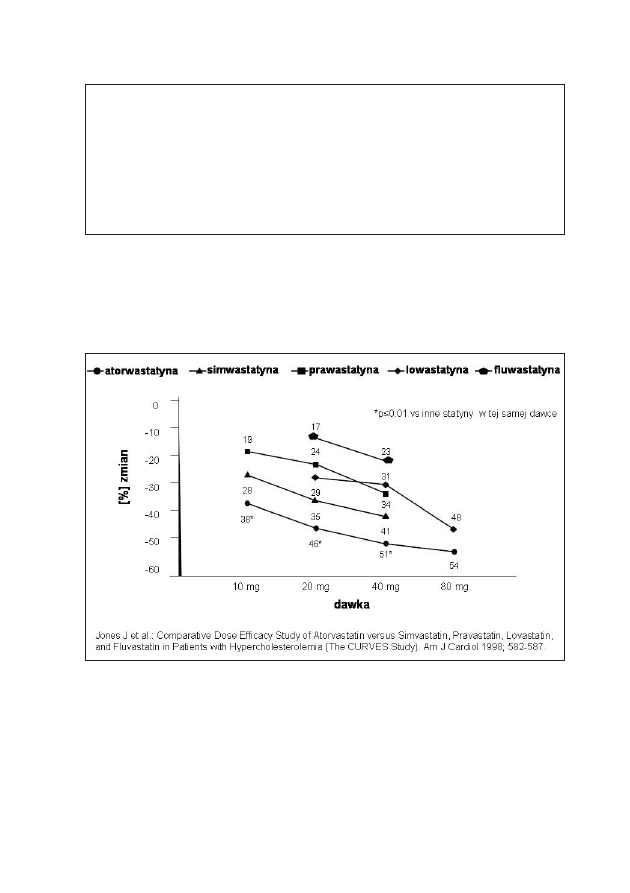
także ocenie w badaniu klinicznym (CURVES). Pomimo istotnych różnic
we wchłanianiu, farmakokinetyce i właściwościach fizykochemicznych, efekt
hipolipemizujący w zakresie obniżania cholesterolu całkowitego i choleste-
rolu LDL korelował dobrze z siłą działania hamującego reduktazę HMG-
-CoA wykazaną dla poszczególnych leków w badaniach in vitro (ryc. 5).
Tradycyjnie statyny dzieli się na „naturalne” i „syntetyczne” (tab. 5). Lo-
wastatyna jest naturalnym związkiem, uzyskanym z grzyba Aspergillus terreus,
prawastatyna jest pochodną fermentacji mewastatyny, a simwastatyna pół-
syntetycznym analogiem lowastatyny. Pozostałe statyny są związkami synte-
tycznymi. Statyny naturalne są w strukturze chemicznej do siebie zbliżone,
różnią się obecnością grup metylowych lub hydroksylowych, co warunkuje
127
Tabela 4: Względna siła hamowania aktywności reduktazy HMG-CoA przez statyny
ceriwastatyna (200)
atorwastatyna (12)
simwastatyna (6)
lowastatyna (3)
prawastatyna (2)
fluwastatyna (1)
Rycina 5: Średnie zmniejszenie stężenia cholesterolu LDL (badanie CURVES)
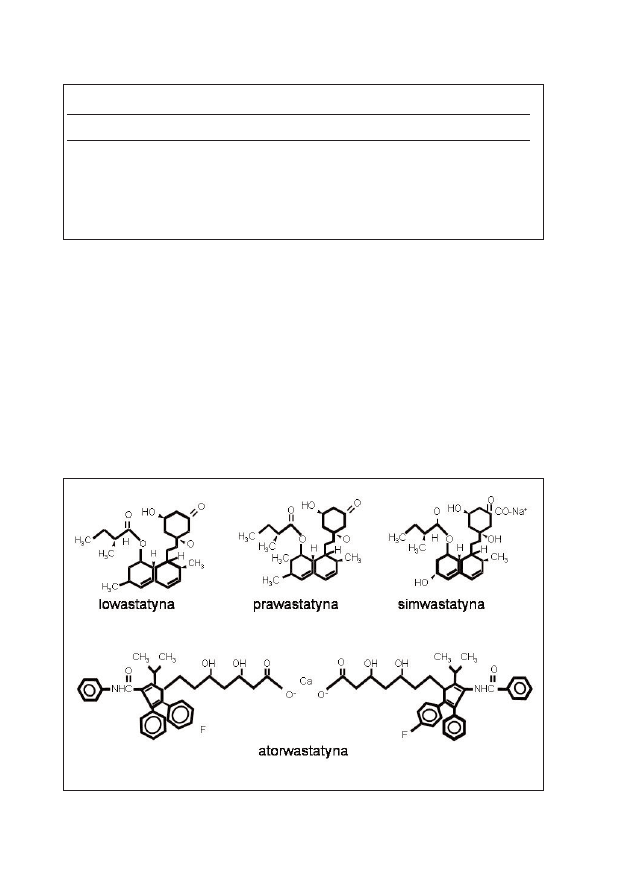
m.in. ich właściwości lipo- lub hydrofilne. Wyraźnie odmienną budowę che-
miczną ma atorwastatyna, będąca przedstawicielem statyn syntetycznych
(ryc. 6). Lipofilność statyn jest uważana za cechę warunkującą pewne spe-
cyficzne właściwości leków, m.in. zdolność do przenikania bariery krew-
-mózg, co z jednej strony odpowiada za niektóre działania niepożądane ze
strony OUN, z drugiej jednak strony może warunkować efekt przeciwotę-
pienny, jaki niektóre statyny wydają się posiadać (tab. 6). Lowastatyna i sim-
wastatyna wchłaniają się z przewodu pokarmowego w postaci nieaktywne-
go laktonu i są przekształcane w wątrobie do aktywnego
b-hydroksykwasu.
Oba leki charakteryzują się silnym efektem pierwszego przejścia i osiągają
niskie stężenia w osoczu (<5% przyjętej dawki). Pozostałe statyny są poda-
128
Rycina 6: Budowa chemiczna statyn „naturalnych” i „syntetycznych”
Tabela 5: Podział statyn na „naturalne” i „syntetyczne”
STATYNY
„NATURALNE”
„SYNTETYCZNE”
• lowastatyna
• prawastatyna
• simwastatyna
• atorwastatyna
• fluwastatyna
• (ceriwastatyna)
• (rosuwastatyna)

wane w postaci aktywnych związków, przy czym fluwastatyna jest mieszaniną
racemiczną, w której jedynie jeden z enancjomerów jest aktywny biologicz-
nie (tab. 7). Stosowanie leku w formie proleku, aktywowanego w wątrobie
może być w opinii niektórych badaczy i klinicystów korzystne. Silnie wyra-
żony efekt pierwszego przejścia w wątrobie powoduje, że gros aktywności
metabolicznej danego leku pozostaje zlokalizowane w tym narządzie, a tkan-
ki obwodowe są w niewielkim stopniu eksponowane na działanie leku. Mo-
że się to wiązać z mniejszym prawdopodobieństwem działań niepożądanych.
Okres półtrwania większości statyn jest krótki, wynosi poniżej 3 godzin.
Jedynie atorwastatyna posiada ponad 14-godzinny okres półtrwania, zaś jej
aktywne metabolity przedłużają półokres całkowitej aktywności inhibitoro-
wej do 20-30 godzin (tab. 8).
129
Tabela 6: Podział statyn na lipo- i hydrofilne
STATYNY
LIPOFILNE
HYDROFILNE
• atorwastatyna
• lowastatyna
• simwastatyna
• fluwastatyna
• prawastatyna
• rosuwastatyna
Tabela 7: Postaci statyn stosowanych na polskim rynku
STATYNY POWSTAŁE W WYNIKU PROCESÓW
FERMENTACJI („NATURALNE”)
• lowastatyna
• simwastatyna
• prawastatyna
• naturalna pochodna
lowastatyny
• pochodna
mewastatyny
• prolek
• prolek
• postać aktywna
STATYNY SYNTETYCZNE
• fluwastatyna
• atorwastatyna
• racemat
• enancjomer
• postać aktywna
• postać aktywna

Działanie pleotropowe
Liczne działania pleotropowe statyn są przez znaczną część badaczy, uzna-
wane za związane z dodatkowym wyraźnym efektem ochronnym, jaki staty-
ny wywierają na układ sercowo-naczyniowy, niezależnym, jak się wydaje, od
działania hipolipemizującego. Wśród korzystnych działań pleotropowych na-
leży wymienić działanie normalizujące funkcję śródbłonka, udowodnione
dla większości statyn. W przypadku innych efektów pleotropowych (działa-
nie przeciwzakrzepowe, profibrynolityczne, antyproliferacyjne, przeciwza-
palne i in.) wpływ poszczególnych statyn jest zróżnicowany (tab. 3, 4).
Interakcje i działania niepożądane statyn
Pamiętając o licznych działaniach niepożądanych leków hipolipemizują-
cych, a także, mając na uwadze silny efekt farmakologiczny, związany z zaha-
mowaniem syntezy cholesterolu, od momentu wprowadzenia statyn do le-
czenia, obawiano się ich potencjalnych działań ubocznych. Z tym też wiązało
się ograniczenie stosowania tych leków do jednoznacznych sytuacji klinicz-
nych związanych z istotną hipercholesterolemią. Lista potencjalnych dzia-
łań ubocznych obejmuje działanie hepatotoksyczne, uszkodzenie mięśni, aż
do rabdomiolizy z następową mioglobinurią i możliwością ostrej niewydol-
ności nerek. Mniej groźne działania niepożądane dotyczą skóry, przewodu
130
Tabela 8: Porównanie właściwości farmakokinetycznych inhibitorów reduktazy HMG-CoA
WYCHWYT
WĄTROBY[%]
wchłoniętej
dawki
AKTYWNE
META-
BOLITY
OKRES
PÓŁTRWANIA
LEKU [h]
atorwastatyna
bardzo nasilony
efekt pierwszego
przejścia
tak
14
(aktywne
metabolity 20-30)
ceriwastatyna
?
tak
2-3
fluwastatyna
>70
nie
1-2
lowastatyna
>70
tak
2-3
prawastatyna
45%
tak
1-3
simwastatyna
>80
tak
2-3

pokarmowego, także OUN (tab. 9). Nie potwierdziły się natomiast obawy
związane z potencjalną możliwością zaburzeń sterydogenezy nadnerczowej
i gonadalnej pod wpływem statyn.
Metabolizm wielu leków zachodzi w wątrobie z udziałem układu cytochro-
mu P450. Większość statyn również jest metabolizowana przy udziale tego
układu, szczególnie zaś istotny dla potencjalnych interakcji jest metabolizm
leków poprzez izoenzym cytochromu P450 o nazwie CYP 3A4. Tą drogą me-
tabolizowane są 3 statyny: atorwastatyna, lowastatyna i simwastatyna, czę-
ściowo ceriwastatyna. Inny izoenzym jest odpowiedzialny za metabolizm flu-
wastatyny, a prawastatyna w ogóle nie jest metabolizowana w systemie
cytochromu P450 (ryc. 7). Poprzez CYP3A4 metabolizowana jest znaczna
grupa innych leków, m.in. leki antyarytmiczne. Wpływ poszczególnych le-
ków na układ enzymatyczny cytochromu może być zróżnicowany, część z le-
ków jest induktorem cytochromu 3A4, przyśpiesza tym samym metabolizm
innych preparatów. Część z nich to leki hamujące cytochrom. Do inhibito-
rów CYP 3A4 należą m.in. tak popularne leki, jak antagoniści receptora hi-
staminowego H
2
(ranitydyna, cymetydyna), czy antybiotyki makrolidowe
(erytromycyna, klarytromycyna) (tab. 10). Zahamowanie aktywności cyto-
chromu wiąże się z nasileniem działania leków przez niego metabolizowa-
nych i łatwo może spowodować działania niepożądane lub toksyczne nawet
przy standardowych dawkach. Należy także pamiętać, że sok grapefruitowy
zawiera silne inhibitory cytochromu CYP3 i nie należy nim popijać leków.
Obserwacje pochodzące z wielu badań klinicznych, a także z prawie 15-let-
niej praktyki stosowania statyn w leczeniu zaburzeń lipidowych wskazują, że
są to nie tylko leki skuteczne, ale co równie ważne, bezpieczne (tab. 11, 12).
Mówiąc jednak o działaniach niepożądanych należy podkreślić, że profil
bezpieczeństwa nie jest taki sam dla wszystkich leków, co częściowo można
131
Tabela 9: Działania niepożądane statyn
• miopatia i rabdomioliza;
• zaburzenia żołądkowo-jelitowe;
• objawy ogólne (zmęczenie, senność, bóle głowy);
• inne:
– skórne, zaburzenia widzenia,
– obrzęk naczynioruchowy,
– małopłytkowość,
– zapalenie skóry i in.;
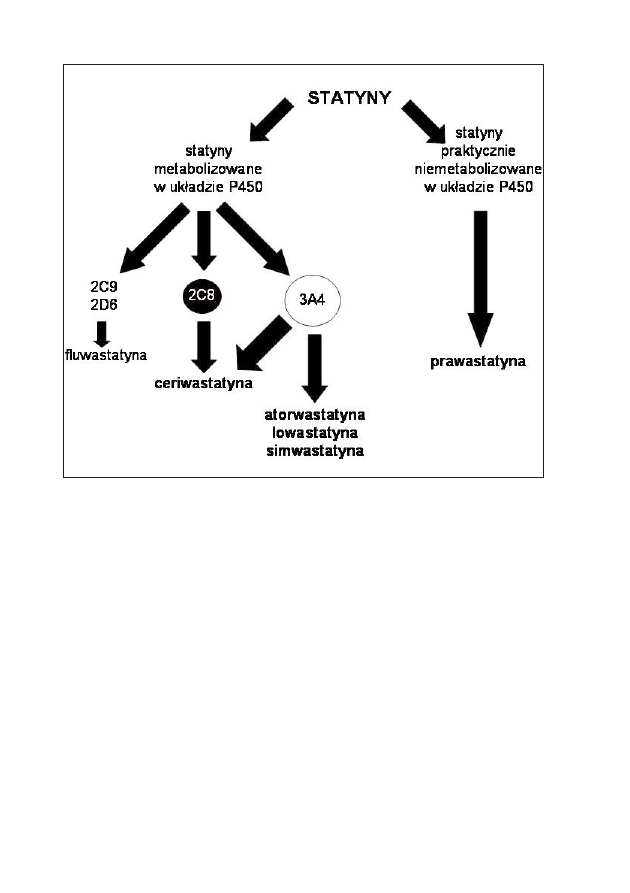
uzasadnić potencjalnym ryzykiem interakcji, o których była mowa powyżej.
W praktyce zwiększone ryzyko poważnych działań ubocznych ujawniło się
w przypadku jednej statyny. W 2001 roku firma Bayer wycofała ceriwastaty-
nę ze sprzedaży z powodu pojawienia się zwiększonej liczby przypadków rab-
domiolizy oraz zgonów, związanych ze stosowaniem leku. Spośród wielu
możliwych przyczyn zwiększonej częstości rabdomiolizy po ceriwastatynie,
część związana może być ze specyficznymi właściwościami leku, głównie du-
żą siłą hamowania reduktazy HMG-CoA oraz małą selektywnością leku
w stosunku do wątroby, a przez to zwiększoną ekspozycją tkanek obwodo-
wych (w tym mięśni poprzecznie prążkowanych) na działanie leku. Inne po-
tencjalne przyczyny to fakt stosowania w USA, gdzie wystąpiło szczególnie
dużo powikłań, dużych dawek leku (0,8 mg), często w połączeniu z gemfi-
brozilem, który hamuje biotransformację ceriwastatyny. Nie bez znaczenia
pozostaje fakt stosowania dużych dawek leku u osób starszych, co przy fizjo-
logicznie zmniejszonej rezerwie funkcjonalnej nerek w tej grupie wiekowej,
zwiększało zagrożenie wystąpieniem ostrej niewydolności nerek.
132
Rycina 7: Klasyfikacja statyn ze względu na rodzaj izoenzymu cytochromu P450 uczestniczącego w ich
metabolizmie

133
Tabela 10: Przykładowe induktory i inhibitory izoenzymu CYP3A4 cytochromu P450 oraz leki metabo-
lizowane przez ten enzym
metabolizm
CYP3A4
induktory
CYP3A4
inhibitory
CYP3A4
• leki antyarytmiczne
- chinidyna
- dyzopiramid
- lidokaina
• antagoniści kanałów
Ca
• cyklosporyna
• steroidy
• statyny
- atorwastatyna
- lowastatyna
- simwastatyna
- ceriwastatyna
• barbiturany
• dexametazon
• karbamazepina
• rifampicyna
• cymetydyna
• ranitydyna
• cyklosporyna
• erytromycyna
• fluoksetyna
• werapamil
• sok grapefruitowy
Tabela 12: Schemat monitorowania transaminaz i CPK podczas terapii statynami
Tabela 11: Monitorowanie bezpieczeństwa stosowania simwastatyny vs placebo w badaniu HPS
w grupie 20 000 chorych
SIMWASTATYNA
n = 10 269
PLACEBO
n = 10 267
WĄTROBA:
AlAT >3x
77 (0,8%)
65 (0,6%)
MIĘŚNIE:
CPK >10x
9 (0,09%)
5 (0,05%)
• przed leczeniem;
• 4-6 tygodni po rozpoczęciu leczenia;
• co 3 miesiące w pierwszym roku;
• co 6 miesięcy w latach następnych (wskaźniki wątrobowe);
Farmakoekonomiczne aspekty leczenia statynami
Statyny ciągle nie są lekami tanimi. Analiza kosztów leczenia statynami
wskazuje jednak na zasadność ekonomiczną takiego postępowania (tab. 13).
Dotyczy to szczególnie chorych wysokiego ryzyka (np. kohorta badania 4S),
u których leczenie hipolipemizujące statynami jest szczególnie opłacalne.
Takie postępowanie pozwala bowiem, istotnie zmniejszyć koszty ewentual-
nych hospitalizacji z powodu zaostrzenia choroby oraz zmniejszyć liczbę nie-
zbędnych procedur rewaskularyzacyjnych.
STATYNY A MEDYCYNA OPARTA NA FAKTACH
Lata 90-te ubiegłego stulecia stanowiły przełom w naszym podejściu do
leczenia zaburzeń lipidowych w prewencji pierwotnej i wtórnej ChNS i in-
nych ChUK. Wraz z ogłoszeniem wyników dużych programów badawczych,
takich jak badanie 4S czy badanie WOSCOPS, stało się jasne, że statyny nie
tylko skutecznie zmniejszają śmiertelność sercowo-naczyniową u chorych po
zawale serca, a także u chorych bez zawału, obarczonych istotnymi zaburze-
niami lipidowymi. Co równie ważne, są lekami dobrze tolerowanymi i bez-
piecznymi. Rozwiały się wątpliwości dotyczące niekorzystnego wpływu le-
czenia hipolipemizującego na umieralność niezwiązaną z ChUK, jak również
nie potwierdziły się sugestie, że niskie stężenie cholesterolu związane jest ze
zwiększonym ryzykiem chorób nowotworowych, samobójstw i udarów krwo-
tocznych mózgu. Przełomowe okazało się badanie 4S, w którym leczenie
simwastatyną w dawce 10-40 mg/dobę lub placebo stosowano przez okres
średnio 5 lat u 4444 pacjentów po zawale serca z umiarkowaną lub ciężką
hipercholesterolemią (średnie stężenie cholesterolu LDL: 188 mg/dL). Le-
czenie simwastatyną związane było z 30% redukcją śmiertelności ogólnej
134
Tabela 13: Farmakoekonomiczne aspekty leczenia statynami (średnie całkowite koszty leczenia
zapewniające osiągnięcie zaleceń NCEP); wg Koren M. J. i wsp. Pharmacoeconomics 1998
LEK
KOSZT [USD]
95% przedział ufności
(%Cl)
atorwastatyna
1064
953 - 1176
simwastatyna
1471
1304 - 1648
lowastatyna
1972
1758 - 2186
fluwastatyna
1542
1384 - 1710

i aż 42% redukcją śmiertelności sercowej. Prewencji pierwotnej poświęco-
ne było badanie West of Scotland Coronary Prevention Study (WOSCOPS).
U 6500 mężczyzn z umiarkowaną lub ciężką hipercholesterolemią (średnie
stężenie cholesterolu LDL: 192 mg/dl) stosowano leczenie prawastatyną
w dawce 40 mg/dobę lub placebo uzyskując w 5-letniej obserwacji odpowied-
nio 22 i 33% znamienną statystycznie redukcję śmiertelności ogólnej i serco-
wej w grupie leczonej prawastatyną. W obu badaniach nastąpiła także istot-
na redukcja nowych zawałów serca oraz potrzeby wykonywania procedur
rewaskularyzacyjnych.
Jak wspominano wcześniej, szczegółowa analiza wyników obu wymienio-
nych badań pokazała, że podobną korzyść z leczenia odnieśli zarówno cho-
rzy z górnego przedziału stężeń cholesterolu, jak i chorzy z niższymi stęże-
niami cholesterolu. Co więcej, okazało się, że ochronny wpływ leczenia jest
widoczny także w grupie chorych, u których stężenie cholesterolu w 5-let-
niej obserwacji nie uległo istotnym zmianom, w stosunku do grupy otrzymu-
jącej placebo. Zaobserwowanie powyższych faktów dało podstawę do przy-
puszczenia, że działanie ochronne statyn jest zależne nie tylko od ich
działania hipolipemizującego, a korzyść z takiego leczenia mogą odnieść tak-
że chorzy z ChNS mający niższe stężenia cholesterolu. Sprawdzeniu tej hipo-
tezy służyły dwa kolejne duże badania CARE i LIPID, w których stosowano
prawastatynę w dawce 40 mg/dobę lub placebo odpowiednio przez okres
5 i 6 lat u pacjentów po przebytym zawale serca, u których średnie stężenie
cholesterolu LDL było na poziomie uznawanym za względnie „prawidłowy”
(średnie stężenie cholesterolu LDL w badaniu CARE: 139 mg/dl, LIPID:
150 mg/dl). Grupę badaną stanowili więc chorzy, którzy według obowiązują-
cych ówcześnie standardów nie mieli wskazań do farmakologicznego lecze-
nia hipolipemizującego. Także i w tych badaniach stwierdzono korzystny
efekt leczenia prawastatyną, zmniejszenie częstości nowych epizodów ser-
cowych oraz związanej z nimi umieralności, a w badaniu LIPID także istot-
ną statystycznie redukcję umieralności ogólnej. W badaniu CARE zaobser-
wowano wystąpienie wartości „progowej” stężenia cholesterolu LDL.
W przypadku tego badania obniżanie stężenia cholesterolu LDL <125
mg/dl za pomocą prawastatyny, nie było związane z dodatkową redukcją ry-
zyka sercowo-naczyniowego. Zaobserwowanie tego faktu stało się podsta-
wą do dyskusji o tym, do jakiego poziomu należy obniżać stężenie choleste-
rolu LDL za pomocą leków. Zagadnieniu temu poświęcono kolejne badania,
cześć z nich nie jest jeszcze zakończona (TNT, SEARCH, IDEAL).
Skuteczność statyn w zapobieganiu powikłaniom sercowo-naczyniowym
nie tylko w grupach wysokiego, ale także niskiego ryzyka udowodniło kolej-
ne badanie w prewencji pierwotnej – badanie AFCAPS/TexCAPS. W bada-
135

niu tym stosowano lowastatynę w grupie 6600 mężczyzn i kobiet, bez obja-
wów miażdżycy tętnic, z prawidłowymi lub nieznacznie podwyższonym stęże-
niami cholesterolu LDL (średnio: 150 mg/dl) oraz niskimi stężeniami chole-
sterolu HDL (<45 mg/dl). W ponad 5-letniej obserwacji stwierdzono
znamienną redukcję nowych incydentów sercowych i zabiegów rewaskula-
ryzacyjnych (redukcja odpowiednio o 40 i 33%). Ze względu na niską liczbę
zgonów w badanej populacji, różnica w częstości nie była istotna. Badanie
to wskazuje, że nawet w populacji niskiego ryzyka ze względu na poziom
cholesterolu LDL, bez objawów choroby naczyniowej, charakteryzującej się
jednak innym lipidowym czynnikiem ryzyka (jakim jest obniżone stężenie
cholesterolu HDL), interwencja za pomocą statyny przynosi korzyść (wybra-
ne wyniki omawianych badań zebrane zostały w tab. 14).
136
Tabela 14: Wpływ leczenia statynami na występowanie zdarzeń wieńcowych w badaniach
„statynowych”; AJC, 87, 14B, 2001
4S
LIPID
CARE
WOSCOPS
AFCAPS/
TexCAPS
Wyjściowy LDL
[mg/dL]
188
150
139
192
150
LDL w trakcie
leczenia [mg/dL]
122
112
98
159
115
redukcja LDL
[%]
35
25
32
26
25
odsetek zdarzeń
w grupie statyny
[%]
19.4
12.3
10.2
5.3
3.5
odsetek zdarzeń
w grupie placebo
[%]
28,0
15,7
13,2
7,5
5,5
względna
redukcja ryzyka
[%]
34
23
24
29
37
bezwzględna
redukcja ryzyka
[%]
8,5
3,4
3,0
2,2
2,0
NNT
*
12
30
34
46
50
*number of patients needed to treat
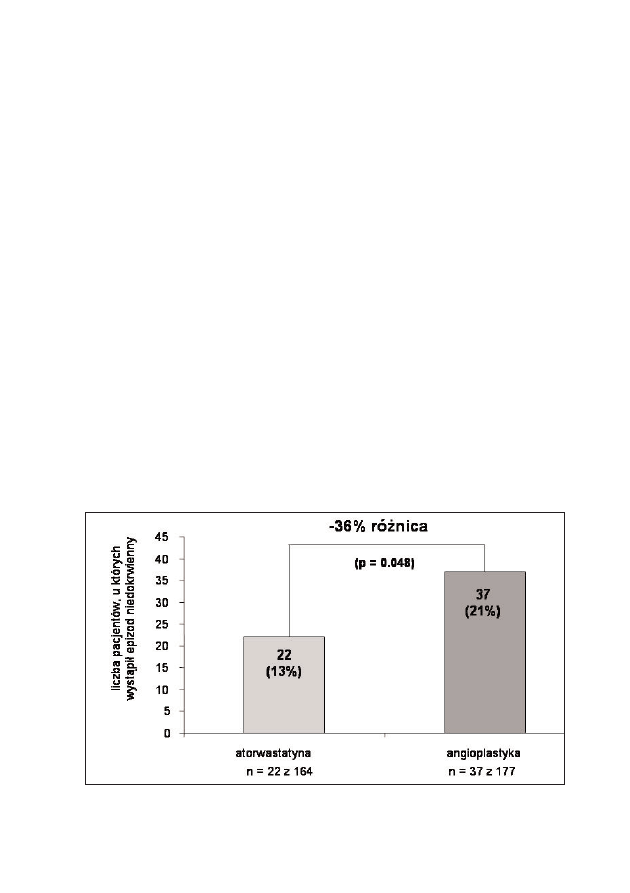
Działania statyn stabilizujące blaszkę miażdżycową znajdują także po-
twierdzenie w tzw. badaniach regresyjnych. Założeniem tego typu badań jest
ocena wpływu terapii statynowej na progresję zmian miażdżycowych w na-
czyniach wieńcowych, uwidacznianych za pomocą angiografii ilościowej. Wy-
niki tych badań wskazują, że interwencja za pomocą statyn, u chorych z an-
giograficznie potwierdzoną chorobą wieńcową, wiąże się z zahamowaniem
progresji zwężeń (możliwa jest nawet niewielka regresja stopnia zwężenia
naczyń w stosunku do badania wyjściowego). Należy jednak podkreślić, że
o ile ocena wpływu statyn na strukturę blaszki miażdżycowej za pomocą ba-
dania angiograficznego wydaje się problematyczna, o tyle we wszystkich te-
go typu badaniach, niewielkim ilościowo zmianom stopnia zwężenia naczyń
w koronarografii, nieodmiennie towarzyszyła radykalna poprawa przebiegu
klinicznego choroby, wyrażająca się zmniejszeniem kolejnych incydentów
niedokrwiennych i redukcją śmiertelności.
Kolejnym etapem, była próba porównania agresywnego leczenia hipolipemi-
zującego z leczeniem inwazyjnym, za pomocą plastyki balonowej u chorych z po-
twierdzoną angiograficznie stabilną chorobą wieńcową. W badaniu AVERT
stwierdzono przewagę leczenia hipolipemizującego za pomocą atorwastatyny
w dawce 80 mg/dobę, w stosunku do leczenia za pomocą PTCA w obserwacji
18-miesięcznej chorych, ze stabilną chorobą wieńcową. Punktem końcowym ba-
dania było wystąpienie pierwszego epizodu wieńcowego (ryc. 8). W innym bada-
niu obserwowano korzystny wpływ leczenia statyną na przebieg choroby, u cho-
rych po wykonaniu zabiegu stentowania tętnic wieńcowych.
137
Rycina 8: Porównanie skuteczności agresywnego leczenia hipolipemizującego za pomocą
atorwastatyny, z angioplastyką wieńcową w prewencji wystąpienia epizodu wieńcowego
(badanie AVERT)
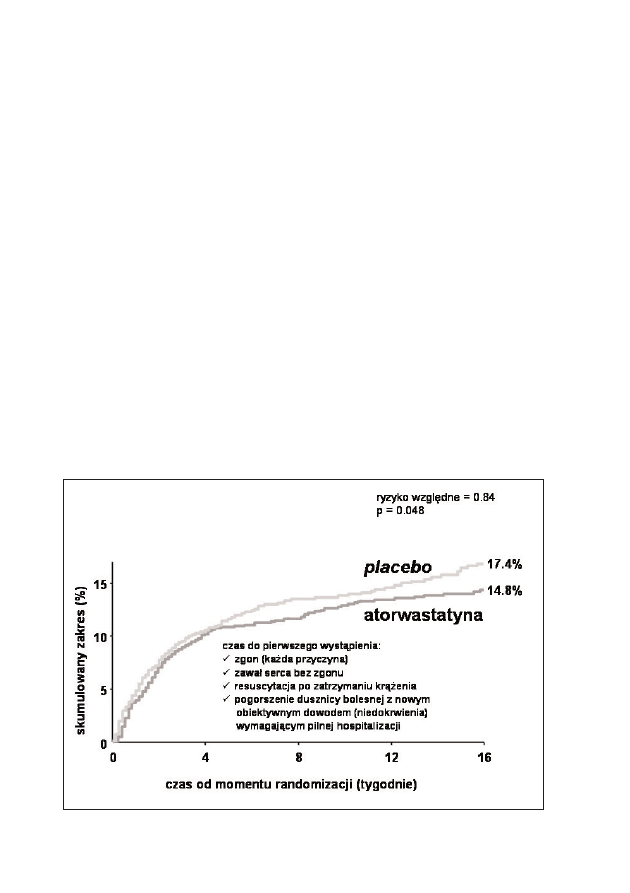
Zrozumienie roli procesu zapalnego w powstawaniu niestabilnej blaszki
miażdżycowej z jednej strony, poznanie wielokierunkowych właściwości
przeciwzapalnych statyn z drugiej strony, stało się przesłanką do zastosowa-
nia statyn „na ostro” w leczeniu ostrych zespołów wieńcowych (ACS). Ana-
liza retrospektywna leczenia statynami chorych z niestabilną chorobą wień-
cową, po zabiegach PCI, wskazywała na jednoznaczne korzyści z takiego
leczenia. Odmienne w tym zakresie są wyniki analizy retrospektywnej bada-
nia SYMPHONY, zaprezentowane w czerwcu 2002 roku. W tym badaniu,
u chorych z ACS, randomizowanych do przedłużonego leczenia doustnym
antagonistą receptora płytkowego IIb/IIIa – sibrafibanem lub aspiryną,
wczesne włączenie statyny do leczenia, nie było związane z dodatkowymi ko-
rzyściami.
Jak dotąd dysponujemy wynikami jednego dużego badania prospektywne-
go, oceniającego skuteczność wczesnego zastosowania statyny w leczeniu
chorych z ACS. W badaniu MIRACL (Myocardial Ischemia Reduction with
Aggressive Cholesterol Lowering) stosowano leczenie atorwastatyną 80 mg/do-
bę lub placebo u 3086 chorych z ACS, bez uniesienia odcinka ST. Leczenie
to w 16-tygodniowej obserwacji, związane było z istotną statystycznie reduk-
cją liczby nawrotów niedokrwienia oraz nieistotną redukcją śmiertelności
(ryc. 9). Trwają inne badania poświęcone temu zagadnieniu (m.in. badanie
„A do Z” z simwastatyną).
138
Rycina 9: Statyny w ostrych zespołach wieńcowych (badanie MIRACL)

Jak widać w świetle przytoczonych powyżej badań, wskazania do stosowa-
nia statyn wyraźnie się rozszerzają. Coraz bardziej rygorystyczne kryteria wy-
równania zaburzeń lipidowych, zmieniają wskazania do ich korekcji farma-
kologicznej, co powoduje, że większość chorych z chorobą niedokrwienną
serca, powinna być leczona statyną. Czy jednak tylko ta grupa chorych?
Opublikowane niedawno wyniki badania HPS (Heart Protection Study),
obejmującego wyjątkowo dużą grupę pacjentów (ponad 20 000) sugerują, że
leczenie statyną, powinno być rozważane nie tylko ze względu na wysokie
stężenie lipidów, czy też fakt przebycia zawału serca lub obecność objawów
CHNS, ale przede wszystkim po uwzględnieniu tzw. globalnego ryzyka powi-
kłań sercowo-naczyniowych, które należy oszacować dla każdego chorego
(tab. 15). W ocenie globalnego ryzyka, należy uwzględnić współistnienie róż-
nych czynników ryzyka, a także występowanie cukrzycy lub miażdżycy o innej
lokalizacji niż naczynia wieńcowe. W badaniu HPS zastosowanie leczenia
simwastatyną w dawce 40 mg/dobę przez okres 5 lat, w grupie pacjentów wy-
sokiego ryzyka (objawy ChNS, miażdżyca, nadciśnienie tętnicze, cukrzyca)
ze stężeniem cholesterolu całkowitego >140 mg/dl (!), związane było z istot-
ną redukcją śmiertelności ogólnej, sercowo-naczyniowej, redukcją liczby in-
cydentów sercowo-naczyniowych, w tym także udarów mózgu. Efekt leczenia
nie zależał od wyjściowego stężenia cholesterolu całkowitego i cholesterolu
LDL, faktu wcześniejszego przebycia zawału serca. Nie zależał od płci (ko-
biety były chronione w podobnym stopniu jak mężczyźni) lub wieku leczo-
nych (chorzy po 75 r. ż zyskali nawet więcej niż młodsi) (ryc. 10, 11). Badanie
HPS wykazało skuteczność prewencyjną leczenia statynami chorych wyso-
kiego ryzyka powikłań naczyniowo-sercowych, praktycznie bez względu na
139
Tabela 15: Docelowe wartości stężeń cholesterolu LDL i wartości progowe upoważniające do rozważe-
nia farmakoterapii w różnych kategoriach ryzyka
KATEGORIA
RYZYKA
DOCELOWE
STĘŻENIA LDL
STĘŻENIA LDL,
PRZY KTÓRYCH
NALEŻY ROZWAŻYĆ
FARMAKOTERAPIĘ
0-1 czynnik ryzyka
<160 mg/dL
>190 mg/dL
≥2 czynniki ryzyka
<130 mg/dL
> 160 mg/dL
choroba wieńcowa lub
stany równoważne pod
względem ryzyka
<100 mg/dL
>130 mg/dL
(100-129 mg/dL
- farmakoterapia
możliwa)
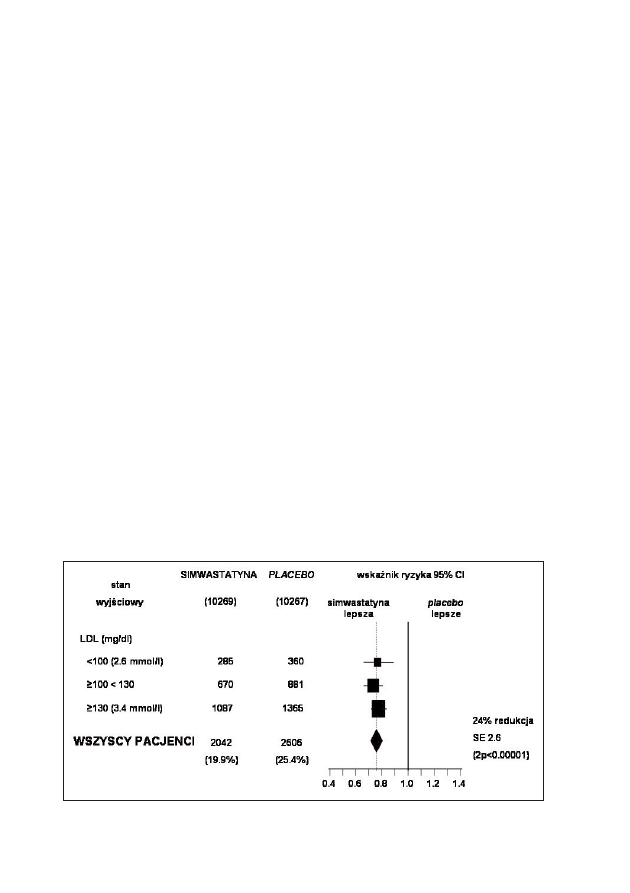
to, w jakim przedziale stężeń cholesterolu oraz w jakim wieku znajdowali się
pacjenci. Tak jak badanie HOPE z ACE-I – ramiprilem, które zmieniło istot-
nie wskazania do stosowania ACE-I w ChNS, badanie HPS z zastosowaniem
simwastatyny, rozszerza zakres stosowania statyn daleko poza wskazanie, ja-
kim jest hipercholesterolemia. Należy jednak przyznać, że brak jest na razie
jasno określonych standardów w tym zakresie.
PODSUMOWANIE
Decyzja o leczeniu hipolipemizującym statynami, jest decyzją na wiele lat, wła-
ściwie na całe życie. Musi zatem uwzględniać przede wszystkim bezpieczeństwo
leczenia z jednej strony, skuteczność kliniczną z drugiej oraz precyzyjnie określo-
ne wskazania (tab 15.). Czym więc należy kierować się przy wyborze konkret-
nego leku u konkretnego chorego? Decyzja powinna uwzględniać szereg aspek-
tów, przede wszystkim potencjalne ryzyko stosowania leku ze względu na
współistniejące schorzenia, szczególnie wątroby lub nerek. Charakter zaburzeń
lipidowych oraz ich natężenie mogą predysponować określony lek do zastosowa-
nia (np. atorwastatyna przy hiperlipidemii skojarzonej lub simwastatyna przy
współistniejącym niskim stężeniu HDL). Bardzo istotnym czynnikiem, determi-
nującym wybór leku hipolipemizującego, są dane pochodzące z dużych badań
klinicznych, które wskazują na celowość stosowania wybranego leku u chorych
z określonej grupy ryzyka. Badania nad wielokierunkowym oddziaływaniem sta-
tyn w chorobach układu krążenia wciąż trwają. Niezmiernie ciekawe są nowe
właściwości statyn, takie jak ich wpływ na remodeling i przerost lewej komory,
ich działanie hipotensyjne, czy wpływ na zdarzenia arytmiczne. Istotne wydaje
się ustalenie ich roli terapeutycznej u chorych z niewydolnością serca. Trwają
140
Rycina 10: Incydenty wieńcowe, a stężenie LDL (badanie HPS: simwastatyna vs placebo)
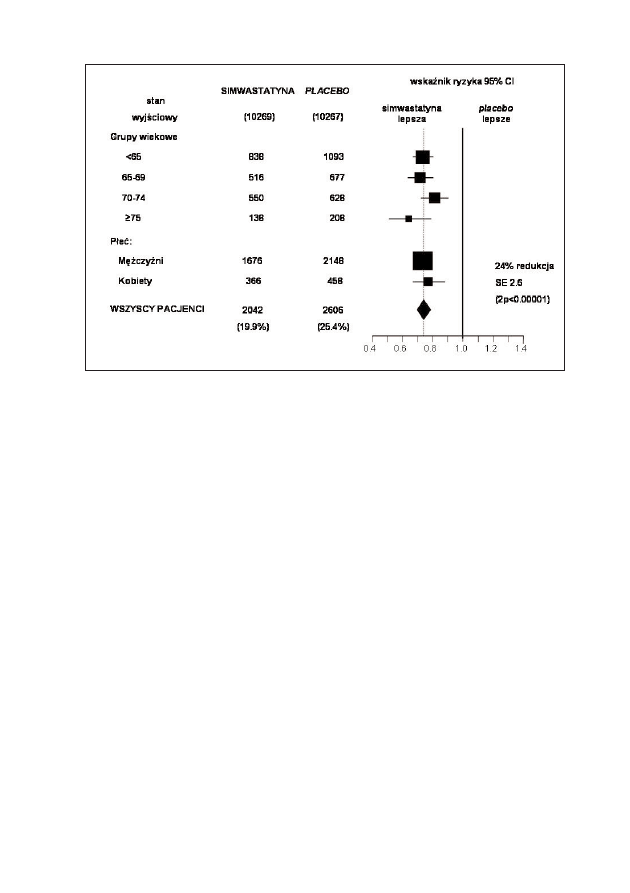
także badania poza kardiologią, nad właściwościami statyn nefroprotekcyjnymi,
antyproliferacyjnymi, przeciwotępiennymi, czy wreszcie zapobiegającymi oste-
oporozie. Pytanie, czy statyna będzie panaceum XXI wieku i czy będziemy ją
stosować podobnie jak aspirynę (bez recepty), pozostaje jednak ciągle otwarte.
Zapamiętaj!
1. Zaburzenia gospodarki lipidowej są jednym z wielu elementów oceny glo-
balnego ryzyka sercowo-naczyniowego. Docelowe parametry lipidowe oraz
agresywność postępowania terapeutycznego, w tym wskazania do farma-
koterapii zaburzeń lipidowych, są uzależnione oceną stopnia globalnego ry-
zyka.
2. Podstawowym celem terapeutycznym w leczeniu zaburzeń lipidowych
u chorego wysokiego ryzyka, także z obecnymi objawami choroby układu
naczyniowego, jest stężenie cholesterolu LDL < 100 mg/dl. Drugorzędo-
wymi celami terapeutycznymi są: niskie stężenie cholesterolu HDL i hiper-
triglicerydemia.
3. Statyny są lekiem pierwszego wyboru w leczeniu hipercholesterolemii.
4. Działanie ochronne statyn, zapobiegające powikłaniom sercowo-naczynio-
wym, tylko w części zależy od ich działania hipolipemizującego, a w części
(być może znacznej) od tzw. pozalipidowych (pleotropowych) mechani-
141
Rycina 11: Incydenty wieńcowe, a wiek i płeć chorych (badanie HPS: simwastatyna vs placebo)

zmów działania statyn. Najistotniejszym efektem sumarycznym pleotropo-
wego działania statyn jest stabilizacja „niestabilnej blaszki miażdżycowej”.
5. Leczenie statynami u chorych ze wskazaniami do takiego postępowania,
powinno być leczeniem stałym („na całe życie”) i nie należy go odstawiać
bez powodu (efekt z odbicia). Jest leczeniem bezpiecznym, należy jednak
systematycznie, okresowo, monitorować badania biochemiczne.
Polecane lektury:
K. J. Filipiak, G. Opolski: Statyny – zarys farmakologii klinicznej; Polfa
Sp. z o. o., Warszawa, 2001.
M. Bednarska-Makaruk, T. Pasierski: Statyny; Medycyna Praktyczna, Kra-
ków, 2000.
A. Gotto (red.): Current Perspectives on Identifying and Managing Hyperli-
pidemia; Am J Cardiol, 2001, 88 (4A).
A. Gotto, A. G. Olsson (red.): In Search of the Ideal Lipid-Lowering Agent;
Am J Cardiol, 2001, 87 (5A).
C. J. Vaughan, A. Gotto, C. T. Basson: The Evolving Role of Statins in the
Mangement of Atherosclerosis; J Am Coll Cardiol, 2000, 35: 1-10.
142

X.
FIBRATY – AKTUALNE MIEJSCE W LECZENIU
HIPERLIPIDEMII
Witold Pikto-Pietkiewicz, Artur Mamcarz
Od czasów pionierskiego badania epidemiologicznego mieszkańców ame-
rykańskiego miasteczka Framingham, przeprowadzonego pod koniec lat 40-
tych XX wieku (Framingham Heart Study), nasza wiedza w zakresie czynni-
ków sprzyjających powstawaniu miażdżycy, a w jej następstwie choroby
niedokrwiennej serca (ChNS), stale się poszerza. Pomimo odkrywania co-
raz to nowych mechanizmów powstawania i pękania blaszki miażdżycowej,
zaburzenia gospodarki lipidowej pozostają kluczowym elementem patoge-
nezy miażdżycy, a przez to stanowią jeden z głównych czynników ryzyka po-
wikłań sercowo-naczyniowych. Powszechnie akceptowana w tym zakresie
jest patogenna rola lipoprotein niskiej gęstości (LDL), szczególnie ich form
zmodyfikowanych (m.in. utlenionych LDL). Większość wypracowanych zale-
ceń i standardów, dotyczących zaburzeń lipidowych i związanego z tym po-
stępowania zapobiegawczego i leczniczego, nakierowana jest na zwalczanie
cholesterolu związanego z frakcją lipoprotein LDL. Słuszność takiego po-
stępowania potwierdzają wyniki dużych prób klinicznych, w których zasto-
sowanie statyn związane było z około 30-35% redukcją ryzyka zgonu z powo-
du ChNS, a także innych chorób naczyniowych. To niewątpliwy sukces
w walce z epidemią chorób układu krążenia (ChUK). Jeśli jednak spojrzymy
na to z drugiej strony, należałoby się zastanowić, dlaczego dwie, spośród każ-
dych trzech leczonych osób dosięga jednak ostry zespół wieńcowy? Odpo-
wiedź na to pytanie jest z całą pewnością złożona. Podstawową przyczyną
jest fakt, że miażdżyca, choć w znacznym stopniu uwarunkowana wysokim
poziomem cholesterolu, rozwija się także pod wpływem bardzo wielu innych
czynników, także lipidowych. Hipertriglicerydemia oraz niskie stężenia cho-
lesterolu HDL, wydają się odgrywać, co najmniej tak samo ważną rolę jako
czynnik ryzyka ChNS, jak podwyższone stężenie cholesterolu LDL.
Aktualny podział zaburzeń lipidowych na 3 kategorie (tab. 1) jest znacznie
bardziej praktyczny od obowiązującego wcześniej podziału Fredricksona
(klasyfikacja WHO – podział na 5 typów hiperlipoproteinemii). Oznaczenie
rutynowego lipidogramu pozwala w większości przypadków zakwalifikować
pacjenta do jednej z 3 kategorii hiperlipidemii, jak również podjąć decyzje
terapeutyczne. Należy także przypomnieć, że zwykle w lipidogramie ozna-
czamy stężenie cholesterolu całkowitego (ChC), cholesterolu HDL oraz stę-
żenie triglicerydów (TG). Stężenie cholesterolu LDL nie jest rutynowo
oznaczane, lecz wyliczane ze wzoru Friedewalda, pod warunkiem, że stęże-
nie TG nie przekracza 400 mg/dL.
143

144
Tabela 1: Podział zaburzeń lipidowych
HIPERCHOLESTERO-
LEMIA IZOLOWANA
(TG <150 mg/dL)
łagodna
ChC: 200-239 mg/dL
LDL: 130-159 mg/dL
umiarkowana
ChC: 240-300 mg/dL
LDL: 160-210 mg/dL
ciężka
ChC >300 mg/dL
LDL >210 mg/dL
HIPERTRIGLI-
CERYDEMIA
IZOLOWANA
(LDL <130 mg/dL)
łagodna
TG: 150-250 mg/dL
umiarkowana
TG: 250-500 mg/dL
ciężka
TG >500 mg/dL
HIPERLIPIDEMIA
MIESZANA
ChC >200 mg/dL
LDL >130 mg/dL
TG >150 mg/dL
ChC - cholesterol całkowity, TG - trójglicerydy
Tabela 2: Kategorie ryzyka epizodu ChNS (w zależności od poziomu cholesterolu) i docelowe poziomy
lipidów
RYZYKO
CZYNNIKI
DOCELOWE
STĘŻENIA LIPIDÓW
łagodne
• ChC: 200-300 mg/dL
• brak nielipidowych cz.
ryzyka
LDL <160 mg/dL
TG <150 mg/dL
umiarkowanie
podwyższone
• ChC: 200-300 mg/dL
oraz jeden nielipidowy
cz. ryzyka
lub
• HDL <39 mg/dL
LDL <130 mg/dL
TG <150 mg/dL
wysokie lub bardzo
wysokie
• objawy: ChNS lub AO
lub cukrzyca
• ChC >300 mg/dL
lub
• ChC: 200-300 mg/dL
• oraz 2 nielipidowe
czynniki ryzyka
LDL <100 mg/dL
TG <150 mg/dL

Docelowe poziomy lipidów oceniane w kategoriach normy lub patologii
podlegają ciągłym modyfikacjom, różniąc się niekiedy dość znacznie w za-
leceniach poszczególnych towarzystw naukowych. Zalecenia amerykańskich
towarzystw określają, jako pożądany poziom cholesterolu całkowitego, stę-
żenie poniżej 190 mg/dL, a cholesterolu LDL poniżej 115 mg/dL. Stężenia li-
pidów uznane za pożądane, zależą także od poziomu zagrożenia ChNS,
oszacowanego dla konkretnego pacjenta. Służą temu specjalne algorytmy
oceny zagrożenia, propagowane także w Standardach Polskiego Towarzy-
stwa Kardiologicznego. Im wyższa kategoria ryzyka „wieńcowego”, tym bar-
dziej rygorystyczne kryteria parametrów lipidowych, a także większe praw-
dopodobieństwo konieczności leczenia farmakologicznego (tab. 2).
HIPERTRIGLICERYDEMIA JAKO CZYNNIK RYZYKA CHORÓB
UKŁADU KRĄŻENIA
Izolowana hipertriglicerydemia (HTG) jeszcze do niedawna nie była po-
strzegana jako niezależny czynnik ryzyka powikłań sercowo-naczyniowych,
a jedynie wtedy, gdy towarzyszył jej podwyższony poziom cholesterolu. Hi-
pertriglicerydemię traktowano jako niegroźną, o ile poziomy TG nie były
znacznie podwyższone.
W 1992 roku, Europejskie Towarzystwo Miażdżycowe (EAS), a w 1994 ro-
ku trzy towarzystwa europejskie (EAS, ESC, ESH) wspólnie uznały HTG
za niezależny czynnik ryzyka choroby niedokrwiennej serca. Standardy Pol-
skiego Towarzystwa Kardiologicznego określają poziom triglicerydów prze-
kraczający 180 mg/dl jako HTG. Należy jednak zaznaczyć, że już od pozio-
mu powyżej 150 mg/dL następuje zwiększenie ryzyka powikłań
sercowo-naczyniowych. Zaostrzenie powyższych kryteriów, zostało podyk-
towane pojawieniem się nowych danych, świadczących o tym, że nawet nie-
znacznie podwyższonym stężeniom TG, towarzyszy szereg procesów patofi-
zjologicznych sprzyjających rozwojowi miażdżycy (tab. 3).
Rola TG w rozwoju blaszki miażdżycowej jest ciągle dyskutowana. Obec-
ność lipoprotein VLDL przenoszących TG, wykryto w ogniskach ateroma-
tycznych, a metaanalizy programów epidemiologicznych dowodzą niezależ-
nego wpływu HTG na zwiększone ryzyko ChNS, co znalazło potwierdzenie
w cytowanych powyżej zaleceniach towarzystw naukowych. Trudność w udo-
wodnieniu roli HTG jako czynnika sprzyjającego powikłaniom sercowo-na-
czyniowym wynika z tego, że zaburzenie to rzadko występuje jako izolowana
nieprawidłowość. Znacznie częściej występuje w zestawieniu z całym zbio-
rem zaburzeń metabolicznych, które wzajemnie wzmacniają swoje indywi-
dualne wpływy aterogenne.
145

Jedną z najczęściej podnoszonych obecnie kwestii, są towarzyszące HTG
zmiany ilościowe i, co ważniejsze, zmiany strukturalne, zarówno cząstek
LDL, jak i samych lipoprotein VLDL oraz obecność zwiększonej ilości czą-
stek resztkowych, tzw. remnantów (lipoprotein pośredniej gęstości – IDL).
Podwyższone stężenie TG wiąże się z nagromadzeniem tzw. małych gęstych
LDL (LDL typ III). Cząstki te, odmiennie od prawidłowych lipoprotein
LDL, charakteryzują się zmniejszonym powinowactwem do receptora LDL.
Dzięki mniejszej średnicy łatwiej wnikają w ścianę naczynia. Podlegają tam
procesom modyfikacji (oksydacji, glikacji), a następnie są wychwytywane
przez makrofagi, za pośrednictwem znajdującego się na ich powierzchni re-
ceptora zmiatającego (scavenger receptor), w sposób nie podlegający zwrot-
nej kontroli. Następnym etapem jest przemiana makrofagów w komórki
piankowate, typowe dla ogniska ateromatycznego.
Małe gęste LDL powodują także ekspresję tzw. cząstek adhezyjnych
(VCAM-1, ICAM-1), co nasila migrację monocytów do ściany naczynia
w miejscu tworzącej się blaszki miażdżycowej. W ostatecznym efekcie, nasi-
leniu ulegają procesy zapalne, znaczenie których w procesie aterogenezy,
jest obecnie mocno podkreślane.
O ile udział dużych cząstek VLDL w procesie aterogenezy nie jest jedno-
znaczny, o tyle udział małych cząstek VLDL oraz ich remnantów, jest dość
146
Tabela 3: Zmiany promiażdżycowe towarzyszące hipertriglicerydemii
• zwiększone stężenie lipoprotein VLDL;
• obecność małych gęstych LDL;
• niskie stężenie lipoprotein HDL;
• tendencja prozakrzepowa:
- wzrost czynnika VII,
- wzrost PAI-1;
• hiperinsulinemia;
• przedłużona lipemia poposiłkowa:
- wydłużenie czasu ekspozycji ściany naczyniowej na aterogenne
działanie lipoprotein z osocza,
- uszkodzenie śródbłonka,
- stymulacja cząstek adhezyjnych;
• wysokie stężenie wolnych kwasów tłuszczowych:
- dysfunkcja śródbłonka (upośledzenie wydzielania NO i prostacykliny),
- nasilenie stresu oksydacyjnego,
- działanie prozakrzepowe.

pewny. Cząstki te, podobnie jak małe gęste LDL, łatwo przenikają do ściany
naczynia, gdzie są wychwytywane przez makrofagi, tym samym przyczyniają
się do powstawania i progresji zmian miażdżycowych. HTG towarzyszy
zwiększona ilość remnantów VLDL, co być może, związane jest z ich upośle-
dzonym katabolizmem.
Obecnie coraz częściej spotykamy się u części chorych, z pozornie niezbyt
nasilonymi zaburzeniami lipidowymi. Stężenia lipidów, na pierwszy rzut oka,
tylko nieznacznie przekraczają górne granice poziomów uznanych za prawi-
dłowe, albo mieszczą się w górnym przedziale normy. Do konstelacji takich
zmian zaliczamy łagodną HTG (150-250 mg/dL), z nieznacznie podwyższo-
nymi stężeniami cholesterolu LDL (tzw. cholesterol LDL granicznie pod-
wyższonego ryzyka: 130-159 mg/dL), niskie stężenie HDL (cholesterol HDL
<40 mg/dL) oraz obecność małych gęstych LDL (tab. 4). Taki charakter lipi-
dogramu, określa się jako aterogenną dyslipidemię.
HTG stanowi też jedno z osiowych zaburzeń metabolicznych w cukrzycy.
Współistnieje tam z innymi zaburzeniami lipidowymi, takimi jak nasilona li-
pemia poposiłkowa, nagromadzenie w osoczu IDL, obecność małych gęstych
LDL oraz obniżenie ochronnej frakcji lipoprotein HDL. Należy także do-
dać, że zaburzeniom tym towarzyszy insulinooporność, hiperinsulinemia,
często także otyłość trzewna.
Opisany powyżej zespół zaburzeń metabolicznych, skojarzony także z do-
datkowymi zmianami metabolicznymi, takimi jak hiperurykemia, podwyższo-
ne stężenie lipoproteiny Lp (a), stan prozakrzepowy, towarzyszące nadciśnie-
nie tętnicze, został opisany w latach 80-tych przez Reavena jako metaboliczny
zespół X. Liczba osób obarczonych tym zespołem stale wzrasta, a badania
nad tym zaburzeniem wskazują na wyjątkowo duże zagrożenie powikłaniami
sercowo-naczyniowymi z nim związane. Leczenie zespołu metabolicznego jest
wielokierunkowe i ma decydujące znaczenie dla redukcji ryzyka. Powinno
obejmować zwiększenie aktywności fizycznej, redukcję masy ciała, odpowied-
nią dietę oraz często farmakoterapię. Kluczową rolę odgrywa farmakoterapia
zaburzeń lipidowych, głównie za pomocą statyn i fibratów.
147
Tabela 4: Aterogenna dyslipidemia
• cholesterol LDL: 130-159 mg/dL;
• łagodne lub umiarkowane podwyższenie stężenia TG (150-250
mg/dL lub 250-500 mg/dL);
• wzrost podfrakcji małych gęstych cząstek LDL;
• obniżenie stężenia cholesterolu HDL <40 mg/dL.

MECHANIZM DZIAŁANIA FIBRATÓW
Pochodne kwasu fibrynowego, zwane popularnie fibratami, nie są lekami
nowymi. Klofibrat – lek prototypowy, został z powodzeniem zastosowany
w klinice już w latach 60-tych. Obniża on efektywnie stężenie TG, w pewnym
zakresie także cholesterolu, poprawia też tolerancję glukozy u osób z jej upo-
śledzeniem. Jak wykazało badanie WHO, przeprowadzone jeszcze w latach
80-tych, zastosowanie tego leku w prewencji pierwotnej, obniżało liczbę za-
wałów o 25%. Stosowanie klofibratu zostało jednak znacznie ograniczone, ze
względu na zwiększoną częstość występowania kamicy dróg żółciowych oraz
nowotworów u osób leczonych tym lekiem. W latach 70-ych pojawiła się II
generacja fibratów (fenofibrat, bezafibrat, etofibrat, gemfibrozil), a w kolej-
nych latach ciprofibrat oraz preparaty fenofibratu mikronizowanego, mają-
ce lepsze właściwości farmakokinetyczne i farmakodynamiczne (tab. 5).
W ostatnim czasie zainteresowanie fibratami rośnie. Jest kilka przesłanek
uzasadniających to wzmożone zainteresowanie. Po pierwsze, jak to opisano
powyżej, HTG odgrywa istotną rolę w patogenezie miażdżycy, tym samym
określono potrzebę jej zwalczania.
Wielki sukces, jaki odniosły statyny, w prewencji pierwotnej i wtórnej cho-
roby wieńcowej, niewątpliwe zwiększył zainteresowanie fibratami, jako le-
kami o potencjalnie podobnej skuteczności w prewencji powikłań sercowo-
-naczyniowych. Kolejną przesłankę stanowi odkrycie nowych mechanizmów
działania fibratów zarówno w zakresie ich działania hipolipemizującego, jak
mechanizmów pozalipidowych.
Zdefiniowanie przez Reavena metabolicznego zespołu X, określenie ze-
społu dyslipidemii, towarzyszącej cukrzycy, wskazało na grupę chorych,
u których zastosowanie fibratów może okazać się szczególnie celowe.
Od dawna wiadomo było, że głównym efektem działania fibratów jest ich
wpływ aktywujący osoczową lipazę lipoproteinową (LPL) oraz hamowanie
syntezy lipoprotein VLDL w wątrobie. Efektem tego działania jest wzrost ka-
148
Tabela 5: Pochodne kwasu fibrynowego – dawkowanie
fenofibrat
3 x 100 mg
fenofibrat mikronizowany
1 x 200 lub 267 mg
ciprofibrat
1 x 100 mg
bezafibrat
3 x 200 mg lub 1 x 400 mg
gemfibrozil
2 x 450 mg lub 2 x 600 mg

tabolizmu bogatych w TG cząstek VLDL i ich przemiana do IDL i LDL,
z następowym przyśpieszeniem usuwania cząstek LDL z krążenia (droga re-
ceptorowa). Leki te w pewnym stopniu wpływają także hamująco na aktyw-
ność reduktazy HMG-CoA (działanie zbliżone do statyn) oraz nasilają do-
środkowy transport steroli z tkanek obwodowych. W wyniku tego dochodzi
do istotnego obniżenia poziomu TG (do 50-60%) oraz nieznacznego lub
umiarkowanego spadku stężenia lipoprotein LDL. Spośród fibratów, szcze-
gólnie wyraźny wpływ na stężenie cholesterolu LDL posiada fenofibrat w po-
staci mikronizowanej. Pod wpływem fibratów następuje także wzrost stęże-
nia cholesterolu HDL związany ze zwiększeniem syntezy białek apo A I i apo
A II. Obniżeniu ulega także poziom aterogennej lipoproteiny Lp (a).
Prowadzone w ostatnich latach badania (głównie z fenofibratem mikroni-
zowanym) pozwoliły ustalić bardziej precyzyjny mechanizm działania fibra-
tów. Kluczem do zrozumienia mechanizmu działania fibratów było odkrycie
klasy receptorów jądrowych dla hormonów steroidowych, określanych jako
receptory aktywowane przez proliferatory peroksysomów (PPARs – peroxi-
some proliferator activated receptors). Postulowany jest udział tych receptorów
w transdukcji wielu sygnałów do jądra komórkowego. Jak wykazano, niektó-
re inne leki również oddziałują poprzez aktywację tych receptorów (np. leki
hipoglikemizujące – pochodne tiazolidinedionów – poprzez PPAR-
γ).
149
Tabela 6: Główne szlaki metabolizmu lipidów oraz inne mechanizmy modyfikowane pod wpływem
aktywacji receptorów PPAR (przez fibraty)
MIEJSCE
DZIAŁANIA
MECHANIZM
DZIAŁANIA
Hepatocyty
aktywacja beta-oksydacji
→ wzrost zużycia TG →
spadek stężenia TG
→ spadek syntezy VLDL;
Adipocyty
wzrost aktywności LPL
→ spadek poziomu TG
Hepatocyty
spadek syntezy apo CIII dla VLDL
→ wzrost
podatności VLDL na działanie LPL;
Inne mechanizmy
mediowane
przez PPAR
a
• wzrost insulinowrażliwości
→ spadek glikemii
i insulinemii;
• spadek TNF
α → spadek insulinooporności;
• działanie przeciwzapalne (PPAR
a
w makrofagach, endothelium, miocytach)
→
obniżenie IL-6, COX-2 (zależnej od IL-2),
CRP i fibrynogenu (synteza zależna od cytokin).

Aktywacja receptorów określanych jako PPAR
a reguluje ekspresję genów
kluczowych dla metabolizmu lipidów. Działanie fibratów polega na aktywa-
cji procesów metabolicznych, mediowanych przez receptory PPAR (tab. 6).
Interesujące wydają się także inne, pozalipidowe (pleotropowe) mechani-
zmy działania fibratów (działanie przeciwzapalne, przeciwzakrzepowe, po-
prawa tolerancji glukozy, działanie obniżające poziom moczanów). Mogą
one stanowić dodatkowe przesłanki dla ich stosowania w prewencji powi-
kłań sercowo-naczyniowych.
Naszkicowane powyżej mechanizmy działania fibratów wskazują, że ich
działanie wykracza daleko poza efekt obniżania stężenia TG. Przeprowa-
dzone dotychczas badania kliniczne z zastosowaniem fibratów wskazują wy-
raźnie, że leki te, podobnie jak statyny, mogą zmniejszać ryzyko incydentów
sercowo-naczyniowych u osób z zaburzeniami lipidowymi. Badania te są
kontynuowane w dużych grupach chorych z cukrzycą, charakteryzujących się
aterogenną dyslipidemią (badanie FIELD). Wydaje się, że to zaburzenie li-
pidowe stanowi szczególnie istotne wskazanie do leczenia fibratami.
Należy jednak pamiętać, że fibraty nie są lekami pozbawionymi działań
ubocznych, czasem prowadzących do groźnych powikłań (rabdomioliza,
ostra niewydolność nerek). Warunkiem bezpiecznego stosowania fibratów
jest znajomość przeciwskazań oraz monitorowanie ich potencjalnych dzia-
łań niepożądanych (tab. 7). Przed rozpoczęciem leczenia należy oznaczyć
poziom transaminaz i kinazy kreatynowej, następnie oznaczenia należy po-
150
Tabela 7: Działania niepożądane fibratów
PRZEWÓD
POKARMOWY
• bóle brzucha;
• wzdęcia;
• biegunki;
• brak łaknienia;
• suchość w jamie ustnej;
• kamica pęcherzyka żółciowego (głównie klofibrat);
MIOPATIA
• bóle mięśniowe;
• zapalenie mięśni;
• rabdomioliza, mioglobinuria z następową ostrą
niewydolnością nerek;
INNE
• bóle głowy;
• uczucie zmęczenia;
• wypadanie włosów;
• zaburzenia potencji.

wtórzyć po 4-6 tygodniach i ponawiać regularnie co 3-6 miesięcy. Należy tak-
że pamiętać o potencjalnym ryzyku terapii skojarzonej ze statynami, kiedy
ryzyko miopatii oraz działania hepatotoksycznego istotnie wzrasta. Praktycz-
nym przykładem takiej niepożądanej interakcji okazało się stosowanie tera-
pii skojarzonej gemfibrozylem i ceriwastatyną. Zwiększona ilość rabdomio-
lizy oraz zgonów w wyniku terapii ceriwastatyną, istotnie wzrastała, jeśli do
leczenia dołączano gemfibrozyl. Znaczna liczba powikłań doprowadziła
w 2001 roku do wycofania ceriwastatyny z rynku farmaceutycznego.
BADANIA KLINICZNE Z ZASTOSOWANIEM FIBRATÓW
Badania nad zastosowaniem fibratów w prewencji pierwotnej i wtórnej to-
czą się już od lat 70., początkowo z klofibratem, następnie w latach 80. i 90.
z fibratami II generacji. Badania te jednak nie są tak liczne, jak również nie
obejmują tak dużych populacji, jak badania z zastosowaniem statyn. Powo-
dem tego była niewątpliwie powszechna akceptacja poglądu o dominującym
znaczeniu podwyższonego stężenia cholesterolu LDL, jako lipidowego czyn-
nika ryzyka rozwoju ChUK. Pojawienie się pod koniec lat 80. statyn na ryn-
ku farmaceutycznym, skierowało uwagę badaczy w stronę tej grupy leków,
zmniejszając przejściowo zainteresowanie fibratami.
Można wyodrębnić 3 kierunki badań w próbach klinicznych z zastosowa-
niem fibratów:
1. badania interwencyjne, z zamiarem obniżenia poziomu cholesterolu, z za-
stosowaniem fibratów w prewencji pierwotnej i wtórnej (Helsinki Heart
Study – HHS),
2. badania interwencyjne nastawione wybiórczo na korektę niskiego poziomu
cholesterolu HDL w przebiegu aterogennej dyslipidemii (VA-HIT, BIP),
3. badania regresyjne – w celu wykazania zahamowania pod wpływem lecze-
nia fibratami progresji miażdżycy naczyń wieńcowych, z oceną angiogra-
ficzną (BECAIT, LOCAT, DAIS).
Ze względu na wielokierunkowe oddziaływanie fibratów na zaburzenia li-
pidowe, leki te stosowano w próbach klinicznych u chorych z różnymi typa-
mi zaburzeń lipidowych. W początkowym okresie badań, poczynając od naj-
wcześniejszego badania z klofibratem, uwaga badaczy skierowana była na
obniżanie cholesterolu całkowitego oraz cholesterolu LDL. W badaniu HHS
wykazano, że gemfibrozil stosowany w prewencji pierwotnej u osób z hiper-
cholesterolemią, powodował znamienną redukcję liczby epizodów sercowo-
-naczyniowych (34%). Warto zwrócić uwagę, że lek ten posiada stosunkowo
mały wpływ na stężenie cholesterolu LDL, głównie obniżając stężenie TG.
151

Jego efekt ochronny prawdopodobnie związany był głównie z wpływem ko-
rygującym stężenie cholesterolu HDL.
W badaniach Bezafibrate Infarction Prevention Study (BIP) oraz VA-HIT
(Veterans Administration HDL Cholesterol Intervention Trial) celem interwen-
cji były nie tyle wysokie poziomy cholesterolu, co skojarzone z podwyższo-
nym stężeniem TG niskie poziomy cholesterolu HDL. Badania objęły sto-
sunkowo duże grupy pacjentów, odpowiednio: BIP: 3090, VA-HIT: 2500
chorych z objawami ChNS. Szczególnie interesujące są wyniki badania
VA-HIT, w którym w grupie leczonej gemfibrozilem uzyskano znamienne
(22%) zmniejszenie liczby zawałów i zgonów sercowych łącznie. Wystąpił
także korzystny trend w zakresie ilości udarów mózgu. Te korzystne zmiany
wskaźników zagrożenia związane były głównie ze wzrostem stężenia chole-
sterolu HDL.
Podjęto także badania nad wpływem terapii fibratami na progresję miaż-
dżycy, ocenianą w badaniu koronarograficznym. W kilku wcześniejszych ba-
daniach wykazano korzystny efekt hamowania progresji miażdżycy naczyń
wieńcowych, jednak najistotniejsze wydają się wyniki opublikowanego
w 2001 roku badania DAIS (Diabetes Atherosclerosis Intervention Study).
W badaniu tym wzięło udział 418 chorych z cukrzycą typu 2, z potwierdzoną
angiograficznie miażdżycą naczyń wieńcowych. Warunkiem włączenia do ba-
dania była dobra kontrola cukrzycy, umiarkowanie podwyższone stężenia
TG (
£500 mg/dL), cholesterolu LDL (£175 mg/dL), oraz stosunek chole-
sterolu całkowitego do cholesterolu HDL powyżej 4. Chorzy otrzymywali fe-
nofibrat mikronizowany 200 mg/dobę lub placebo. W wyniku leczenia uzy-
skano, w grupie fenofibratu, istotne zmiany lipidogramu w stosunku do
grupy placebo. W wykonanym po upływie średnio 39 miesięcy kontrolnym
angiogramie, w grupie leczonej fenofibratem, wykazano znamienne zmniej-
szenie progresji miażdżcy. W wyniku leczenia wystąpiła także – nieznamien-
na statystycznie – redukcja o 23% liczby nowych incydentów sercowych.
Chorzy z cukrzycą typu II stanowią grupę szczególnego ryzyka powikłań
sercowo-naczyniowych, także ze względu na często towarzyszącą cukrzycy
aterogenną dyslipidemię. Charakter tych zaburzeń (HTG, niskie stężenia
cholesterolu HDL, obecność małych gęstych LDL) wskazywałby na fibraty,
jako leki szczególnie przydatne do farmakoterapii zaburzeń lipidowych w cu-
krzycy. Zasadność farmakologicznego leczenia zaburzeń lipidowych u cho-
rych z cukrzycą, potwierdzają dane z badań „statynowych” (badanie CARE,
4S), jak również badania VA-HIT, gdzie chorzy z cukrzycą stanowili istotny
odsetek badanej populacji (25%). W badaniach tych stwierdzono, że podję-
cie leczenia farmakologicznego chorych z cukrzycą, wiąże się z co najmniej
takim samym lub silniejszym wpływem, redukującym ilość powikłań serco-
152

wo-naczyniowych, w porównaniu z grupą nie obciążoną cukrzycą. Potwier-
dzają to także wyniki najnowszego i największego badania „statynowego”
(ponad 20 000 osób) badania HPS (Heart Protection Study), opublikowanego
niedawno. W chwili obecnej, statyny rekomendowane są przez American
Diabetes Association do leczenia podwyższonych stężeń cholesterolu LDL
(powyżej 129 mg/dL). W przypadku stężeń cholesterolu LDL pomiędzy 100-
129 mg/dL, możliwe są do przyjęcia różne strategie postępowania (modyfi-
kacja diety i stylu życia, statyna, fibrat). Należy podkreślić, że docelowe stę-
żenie cholesterolu LDL wynosi u chorych z cukrzycą poniżej 100 mg/dL,
podobnie jak u pacjentów z objawami ChNS. W przypadku niskich stężeń
cholesterolu HDL (<40 mg/dL), bez względu na obecność HTG, sugeruje
się użycie fibratów (np. fenofibratu). Zalecenia American Diabetes Associa-
tion, mówiąc o potrzebie obniżania stężenia cholesterolu LDL, zwracają jed-
nocześnie uwagę, że stężenia cholesterolu HDL oraz TG, mogą być lepszy-
mi wskaźnikami prognostycznymi, niż stężenie cholesterolu LDL u chorych
z cukrzycą typu 2.
Jak wielokrotnie podkreślano, nie podlega dyskusji rola niskiego poziomu
cholesterolu HDL, jako niezależnego silnego czynnika ryzyka powikłań ser-
cowo-naczyniowych. Jak wykazały analizy podgrup z niskimi stężeniami cho-
lesterolu HDL w wielu próbach klinicznych (badania 4S, VA-HIT, CARE
i in.) ryzyko powikłań sercowo-naczyniowych u osób z niskimi wartościami
cholesterolu HDL, jest takie samo lub większe, jak osób z wysokimi stęże-
niami cholesterolu LDL; obniżenie zaś stężenia cholesterolu LDL nie redu-
kuje ryzyka związanego z niskim poziomem HDL. Natomiast uzyskanie
wzrostu stężenia cholesterolu HDL o 1%, jest związane z redukcją ryzyka
powikłań sercowych o 2% u mężczyzn i o 3% u kobiet.
Obserwacja populacji krajów rozwiniętych wskazuje, że wraz ze wzrostem
odsetka osób z nadwagą, rośnie odsetek osób z cukrzycą oraz aterogenną dys-
lipidemią i niskimi stężeniami cholesterolu HDL. Przyjmuje się, że około
35% populacji chorych z ChNS, to osoby z „zespołem niskiego HDL”.
Wskazuje to na potrzebę podejmowania działań prewencyjnych, nakiero-
wanych na podwyższenie poziomu lipoprotein HDL. Obok niezbędnych me-
tod niefarmakologicznych, mamy do dyspozycji fibraty, wykazujące umiar-
kowane, ale wyraźnie korzystne oddziaływanie w tym kierunku. Warto
dodać, że działanie normalizujące poziom HDL jest tym wyraźniejsze, im
niższe są wyjściowo poziomy tych lipoprotein.
W podsumowaniu należy jeszcze raz podkreślić, że leczenie zaburzeń li-
pidowych w celu obniżenia ryzyka powikłań sercowo-naczyniowych, nie po-
winno ograniczać się jedynie do zwalczania wysokich poziomów LDL. Po-
153

winno obejmować także leczenie HTG oraz korekcję niskich poziomów
HDL, co zaczyna znajdować powoli odbicie w modyfikowanych standardach
postępowania. Zastosowanie fibratów może mieć tutaj istotne znaczenie.
Należy mieć nadzieję, że wyniki toczących się dużych badań prospektyw-
nych, potwierdzą wartość fibratów jako leków „kardioprotekcyjnych”.
Zapamiętaj!
1. Hipertriglicerydemia jest niezależnym lipidowym czynnikiem ryzyka choro-
by wieńcowej, także pośrednio wpływającym niekorzystnie na pozostałe
frakcje lipidowe (małe gęste LDL), w związku z czym wymaga działań in-
terwencyjnych.
2. Hipertriglicerydemia obok niskiego stężenia cholesterolu HDL, często się
kojarzy z innymi zaburzeniami metabolicznymi, tworząc tzw. metaboliczny
zespół X, tworzący silne zagrożenie powikłaniami sercowo-naczyniowymi.
3. Fibraty obok działania hipolipemizującego wywierają, podobnie jak staty-
ny, liczne efekty dodatkowe, określane jako pleotropowe, z których przy-
najmniej część może być istotna dla hamowania procesów aterogenezy
(działanie fibrynolityczne, przeciwzapalne). Mechanizm tego działania
związany jest z aktywacją grupy receptorów jądrowych określanych jako
PPAR (peroxisome proliferator activated receptors).
4. Niskie stężenie cholesterolu HDL, często współistniejące z hipertriglicery-
demią, jest silnym, niezależnym od LDL, lipidowym czynnikiem ryzyka
choroby wieńcowej. Fibraty wywierają istotny wpływ, zwiększający stężenie
HDL i są jedną z metod interwencji, rekomendowanych przez standardy
w tym zakresie.
5. Badania kliniczne w prewencji pierwotnej i wtórnej, choć nie tak liczne jak
w przypadku statyn, wskazują na działanie prewencyjne niektórych fibra-
tów (gemfibrozil, fenofibrat mikronizowany) w zapobieganiu progresji
miażdżycy oraz jej powikłań sercowo-naczyniowych.
Polecane lektury:
Profilaktyka choroby niedokrwiennej serca. Rekomendacje Komisji Profi-
laktyki Polskiego Towarzystwa Kardiologicznego; Kardiologia Polska, 2000,
53, suplement I.
Executive summary of the Third Report of the National Cholesterol Educa-
tion Program [NCEP]. Expert Panel on Detection, Evaluation and Treat-
ment of High Blood Cholesterol in Adults [ Adult Treatment Panel III ].
JAMA, 2001, 285: 2486-2497.
154

B. Zaborska, L. Kłosiewicz-Latoszek: 50 głównych leków kardiologicznych:
Fibraty; Kardiologia Polska, 1998, 48: 255.
J. Shepherd: Mechanism of action of fibrates; Postgrad Med, 1993, 69: 43.
J. C. Fruchart: Mechanism of the hypolipidemic action of fibrates; J Lip Res,
1996, 37: 907.
S. M. Grundy, G. L. Vega: Two different views of the relationship of hypertri-
glicerydemia to coronary heart disease. Implications for treatment; Arch In-
tern Med, 1992, 152: 28.
155

XI.
HIPERLIPIDEMIA – WSKAZANIA DO LECZENIA
SKOJARZONEGO
Joanna Syska-Sumińska, Iwonna Grzywanowska-Łaniewska
Profilaktyka miażdżycy polega na równoczesnym zwalczaniu wszystkich
współistniejących czynników ryzyka, w tym zaburzeń gospodarki lipidowej.
Badania obserwacyjne oraz wyniki badań klinicznych potwierdzają, że
zmniejszenie stężenia cholesterolu prowadzi do ograniczenia liczby zgonów
i zawałów u pacjentów z chorobą niedokrwienną serca (ChNS) oraz liczby
zdarzeń sercowych u pacjentów bez uprzednio rozpoznawanej choroby wień-
cowej.
Podstawą leczenia hiperlipidemii jest przede wszystkim zmiana stylu ży-
cia, w tym zmiana przyzwyczajeń żywieniowych. Zasadniczym celem leczenia
jest obniżenie cholesterolu w zakresie frakcji LDL, stanowiącej główną przy-
czynę rozwoju zmian ateromatycznych w ścianie naczynia.
Intensywność leczenia uzależniona jest od globalnego ryzyka, ocenianego
indywidualnie dla danej osoby. Zgodnie z wytycznymi Ekspertów Narodo-
wego Programu Edukacji na Temat Cholesterolu, opublikowanymi w 2001
roku, czynnikami wpływającymi na wielkość ryzyka, są oprócz stężenia cho-
lesterolu LDL: obecność lub brak ChNS, inne postaci miażdżycy naczyń, pa-
lenie tytoniu, nadciśnienie tętnicze, dodatni wywiad rodzinny, wiek oraz
płeć. Na tej podstawie wyodrębniono trzy kategorie ryzyka, modyfikujące
cele leczenia w zakresie stężenia cholesterolu LDL (tab. 1).
Grupę najwyższego ryzyka stanowią pacjenci z chorobą wieńcową bądź
stanami równoważnymi pod względem ryzyka, takimi jak cukrzyca, tętniak
aorty brzusznej (TAB), miażdżyca naczyń obwodowych. Ryzyko poważnych
156
Tabela 1: Kategorie ryzyka wieńcowego
KATEGORIE RYZYKA
DOCELOWE
STĘŻENIE LDL
I
obecność ChNS i stanów klinicznych
równoważnych pod względem ryzyka
z chorobą wieńcową;
<100 mg/dL
II obecność powyżej 2 czynników ryzyka;
<130 mg/dL
III obecność 0 lub 1 czynnika ryzyka.
<160 mg/dL

zdarzeń wieńcowych w tej grupie przekracza 20% w ciągu kolejnych 10 lat,
tzn. u 20 pacjentów na 100 w tej grupie, rozwinie się ostre powikłanie wieńcowe.
W pozostałych dwóch kategoriach ryzyko szacowane jest na poniżej 20%
w grupie II oraz poniżej 10% w grupie III.
Wielkość ryzyka u osób bez objawów klinicznych ChNS, ocenia się wg
dwuetapowej procedury. Początkowo identyfikuje się liczbę czynników ry-
zyka, a następnie dla osób z licznymi czynnikami (>2) dokonuje się oceny
ryzyka 10-letniego. Służy to identyfikacji osób, u których należy ze względu
na stopień zagrożenia, rozważyć konieczność intensyfikacji leczenia.
ZASADY POSTĘPOWANIA W POSZCZEGÓLNYCH GRUPACH
PACJENTÓW
Największe możliwości zmniejszenia zagrożenia rozwojem ChNS i jej po-
wikłań, stwarza niewątpliwie profilaktyka pierwotna. Opiera się ona na
wprowadzeniu zmian stylu życia (TLC – Therapeutic Lifestyle Changes). Do-
tyczy to przede wszystkim:
• zmniejszenia spożycia tłuszczów nasyconych i cholesterolu (tłuszcze na-
sycone <7%, cholesterol <200 mg/dobę), zwiększenie spożycia błonni-
ka 10-25 g/dobę, oraz fitosteroli 2 g/dobę;
• zwiększenia aktywności fizycznej;
• utrzymania właściwej masy ciała;
• zaprzestania palenia tytoniu.
Przestrzeganie tych zasad prowadzi do redukcji stężenia cholesterolu. Nie-
które osoby, obarczone większym ryzykiem z powodu dużego stężenia chole-
sterolu frakcji LDL lub z powodu obecności innych czynników ryzyka, są
kandydatami do zastosowania farmakoterapii.
Celem leczenia hipolipemicznego w profilaktyce wtórnej jest obniżenie
stężenia cholesterolu LDL poniżej 100 mg/dL. Taki sam cel leczniczy dotyczy
pacjentów, u których stwierdzamy stan kliniczny równoważny pod względem
ryzyka z ChNS.
Od pewnego czasu powszechny stał się pogląd o istotnym znaczeniu pro-
gnostycznym niskich stężeń cholesterolu frakcji HDL, zwykle współistnieją-
cym z insulinoopornością, hipertrójglicerydemią (HTG) oraz otyłością
brzuszną, które wpływają na przyspieszenie rozwoju miażdżycy. Stąd też, po-
za oceną ryzyka opartą jedynie na poziomie frakcji LDL, podnosi się ko-
nieczność oceny stężenia frakcji HDL i trójglicerydów (TG) oraz modyfika-
cje ich stężeń przy użyciu metod niefarmakologicznych i farmakologicznych.
157

Badanie Helsinki Heart Study wykazało, że każdy wzrost stężenia HDL
o 1 mg/dL, powodował zmniejszenie ryzyka wieńcowego o 2-3%, niezależnie
od zmian stężenia LDL.
KIEDY POWINNIŚMY ROZWAŻYĆ KONIECZNOŚĆ LECZENIA
FARMAKOLOGICZNEGO?
W przypadku chorych z rozpoznawaną ChNS i stanami równoważnymi
(I kategoria), leczenie jest wskazane przy poziomie LDL >130mg/dL, nato-
miast jest możliwe przy poziomach LDL 100-129 mg/dL, po uwzględnieniu
zmian w stylu życia. Jeżeli poziom LDL jest poniżej 100 mg/dL, wskazana
jest kontynuacja diety celem utrzymania pożądanego stężenia cholesterolu.
Obecnie toczy się kilka badań klinicznych, których celem jest ocena korzyści
ze zmniejszenia poziomu cholesterolu LDL poniżej 100 mg/dL.
Wśród pacjentów drugiej grupy ryzyka, z obecnymi 2 lub więcej czynnika-
mi zagrożenia, pożądany poziom LDL cholesterolu wynosi <130 mg/dL. Ce-
lem terapeutycznym jest obniżenie krótko i długoterminowego ryzyka
ChNS. Jeżeli stężenie LDL wynosi powyżej 130 mg/dL, należy wdrożyć sys-
tem TLC i stosować go przez 3 miesiące. Przy utrzymującym się nadal stęże-
niu LDL >130 mg/dL, należy rozważyć leczenie farmakologiczne. Obecność
ponad 2 czynników ryzyka, przy stężeniu LDL >160 mg/dL, upoważnia do
wkroczenia z leczeniem farmakologicznym.
158
Tabela 2: Model wprowadzania terapeutycznych zmian w stylu życia
WIZYTA 1
rozpocznij wprowadzanie zmian w stylu życia:
• ograniczenie tłuszczów,
• aktywność fizyczna;
WIZYTA 2
oceń reakcję na leczenie w zakresie LDL; jeżeli nie
osiągnięto docelowego stężenia LDL, należy
zintensyfikować leczenie:
• ograniczenie spożycia tłuszczów,
• dołączenie błonnika i fitosteroli;
WIZYTA 3
oceń reakcję na leczenie w zakresie stężenia LDL;
jeżeli nie osiągnięto docelowego stężenia,
należy rozważyć farmakoterapię;
WIZYTA N
monitorowanie pacjenta pod kątem przestrzegania TLC
co 4-6 miesięcy;
początkowo wizyty powinny odbywać się co 6 tygodni

Większość osób bez lub z 1 czynnikiem ryzyka, pozostaje w grupie III
z niższym niż 10% ryzykiem zdarzeń w ciągu następnych 10 lat. U tych pa-
cjentów dążymy do poziomu cholesterolu LDL <160 mg/dL, a podstawo-
wym celem terapii jest ograniczenie ryzyka odległego. Leczeniem pierwsze-
go rzutu jest zmiana stylu życia – system TLC; po 3 miesiącach, przy
poziomie LDL >160mg/dL, dopuszczalne jest wdrożenie farmakoterapii.
Czynnikami przemawiającymi za zastosowaniem farmakoterapii jest obec-
ność jednego z wymienionych czynników: nałogowe palenie tytoniu, źle kon-
trolowane nadciśnienie tętnicze, ChNS w młodym wieku u członków rodzi-
ny, niski poziom cholesterolu frakcji HDL. Celem przewodnim stosowania
leków hipolipemicznych w tej grupie pacjentów jest spowolnienie procesów
miażdżycowych w naczyniach, co wpłynie na obniżenie ryzyka ogólnego. Mu-
simy pamiętać, że w momencie podjęcia decyzji o farmakoterapii zaburzeń
lipidowych, należy zwracać uwagę na rygorystyczne przestrzeganie przez pa-
cjenta zasad strategii TLC.
Najczęściej dla osiągnięcia pożądanego poziomu lipidów wystarczy zastoso-
wanie jednego leku hipolipemizującego, w połączeniu z zaleceniami diete-
tycznymi. Niemniej, w praktyce lekarskiej spotykamy się z sytuacjami kli-
nicznymi, w których istnieje konieczność włączenia kolejnego leku
obniżającego poziom lipidów. Skojarzona terapia hiperlipidemii wydaje się
być korzystna z teoretycznego punktu widzenia. Różne mechanizmy dzia-
łania preparatów (przedstawiono je w innych rozdziałach) pozwalają na
osiągnięcie zamierzonych celów, przy zastosowaniu mniejszych dawek le-
ków. Prowadzenie takiego leczenia wymaga od lekarza dobrej znajomości
farmakokinetycznych właściwości preparatów, ich działań ubocznych, moż-
liwych interakcji oraz zaleceń dotyczących monitorowania takiej terapii.
Tylko taka wiedza pozwala bowiem na uniknięcie groźnych powikłań i uzy-
skanie oczekiwanego rezultatu.
Przystępując do leczenia hiperlipidemii mieszanej, należy ocenić stopień
ryzyka ogólnego i w zależności od tego ustalić docelowe poziomy cholestero-
lu i TG. Cele terapeutyczne dla cholesterolu LDL zostały wymienione w ta-
beli 1, natomiast stężenie TG należy zredukować poniżej 180 mg/dL,
a u chorych z cukrzycą poniżej 150 mg/dL. Zwykle leczenie zaczynamy od
monoterapii, indywidualizując podejście do określonego chorego (płeć,
wiek, ryzyko ogólne, współpraca z lekarzem, umiejętność przestrzegania re-
strykcji dietetycznych). W szczególnie ciężkich przypadkach zaburzeń me-
tabolicznych i bardzo wysokiego ryzyka możemy zastosować terapię skoja-
rzoną. Pozwala to poprawić efektywność leczenia.
W farmakoterapii stosuje się statyny, fibraty, kwas nikotynowy i żywice.
Należy pamiętać, że u dzieci można stosować jedynie żywice, podobnie
159

160
Tabela 3: Aktualnie dostępne leki wpływające na metabolizm lipoprotein
GRUPY
LEKÓW
EFEKT
DZIAŁANIA
DZIAŁANIA
NIEPOŻĄDANE
PRZECIW-
WSKAZANIA
Statyny:
• lowastatyna
• simwastatyna
• prawastatyna
• fluwastatyna
• atorwastatyna
↓ LDL 18-55%
↑ HDL 5-15%
↓ TG 7-30%
• ryzyko
miopatii;
• wzrost
aktywności
enzymów
wątrobowych;
• choroby
wątroby;
• kobiety
w wieku
rozrodczym,
jeżeli nie ma
pewnej
antykoncepcji;
Żywice:
• kolestipol
• cholestyramina
↓ LDL 15-30%
↑ HDL 3-5%
TG b.z. lub
↑
• zaburzenia
żołądkowo-
-jelitowe;
• zmniejszenie
wchłaniania
innych leków
(kw. foliowy,
digoxin,
warfaryna,
diuretyki);
• podwyższone
stężenie TG;
• wrzód
trawienny;
Kwas
nikotynowy
↓ LDL 5-25%
↑ HDL 15-35%
↓ TG 20-50%
• napadowe
zaczerwienienie
skóry;
• hiperurykemia;
• hiperglikemia;
• zaburzenia
żołądkowe;
• hipotensja;
• uszkodzenie
wątroby;
• dna
moczanowa;
• cukrzyca;
• świeży zawał;
• ciąża;
Fibraty:
• fenofibrat
• ciprofibrat
• bezafibrat
• gemfibrozil
↓ LDL 5-20%
↑ HDL 10-20%
↓ TG 20-50%
• objawy
dyspeptyczne;
• kamica
żółciowa;
• nasilenie
efektów
antykoagulan-
tów;
• wzrost
aktywności
transaminaz;
• poważne
uszkodzenie
wątroby
i nerek;
• ciąża;
• kamica
żółciowa;

jak u kobiet będących w okresie rozrodczym, bez zabezpieczenia antykon-
cepcją.
W przypadku chorego z I grupy ryzyka, gdy stężenie cholesterolu LDL
przekracza pożądaną wartość (100 mg/dL), a stężenie TG jest umiarkowanie
podwyższone (<300 mg/dL), udokumentowane korzyści przynosi leczenie
statynami. Natomiast u chorych z wysokimi poziomami TG (>300 mg/dL)
leczenie samą statyną może być niewystarczające i wówczas dołączamy fi-
braty, bądź żywice. Znacznie częściej, z powodu lepszej tolerancji i skutecz-
ności, stosujemy połączenie statyny z fibratem, niż statyny i żywicy.
W przypadku chorego z II grupy ryzyka, jeśli dotychczasowa zmiana stylu ży-
cia nie przyniosła spodziewanych rezultatów, stężenie LDL nie przekracza 130
mg/dL, a TG przekraczają 300 mg/dL, możemy rozważyć leczenie fibratami.
Jeśli LDL przekracza wartość zalecaną, a TG są w granicach 180-300 mg/dL,
wówczas wybór pada na statynę. W sytuacji, gdy stężenie LDL jest umiarko-
wanie podwyższone (około 160 mg/dL), natomiast stężenie TG >500 mg/dL,
stosujemy fibraty. Wysokie stężenia zarówno LDL (160-180 mg/dL), jak i TG
(>500 mg/dL), skłaniają do indywidualnego wyboru leku pierwszego rzutu
bądź leczenia skojarzonego. Jednym z parametrów, którym należy się kiero-
wać przy wyborze leku, jest poziom cholesterolu HDL. Niski poziom HDL
(<40 mg/dL) w obliczu badania BIP sugeruje rozważenie terapii fibratami.
Jednak naczelnym celem leczenia hiperlipidemii mieszanej pozostaje osiągnie-
cie docelowych stężeń LDL.
161
Tabela 4: Grupy leków stosowane w poszczególnych hiperlipidemiach
ZABURZENIA GOSPODARKI
LIPIDOWEJ
GRUPY LEKÓW
Hipercholesterolemia
Wysokie stężenie LDL
• statyny
• żywice
• fibraty
• kwas nikotynowy
Hiperlipidemia mieszana
Wysokie stężenie
VLDL-TG, LDL
• fibraty
• statyny
• kwas nikotynowy
Hipertriglicerydemia
Wysokie stężenie TG
• fibraty
• kwas nikotynowy
Zespół chylomikronemii
Wysoki poziom VLDL-TG
i chylomikrony w osoczu
• fibraty
• kwas nikotynowy
• oleje rybne dodatkowo

Niewątpliwie najlepsze efekty modyfikujące poziom wszystkich frakcji lipi-
dowych przynosi terapia skojarzona statyną łącznie z fibratem. Jest to jednak
połączenie obarczone ryzykiem powikłań, głównie pod postacią zapalenia
mięśni z rabdomiolizą i ostrą niewydolnością nerek, mogącą stanowić przy-
czynę zgonu pacjenta. Dowodzi tego niedawny problem z ceriwastatyną
i gemfibrozilem.
Dlatego w leczeniu należy stosować krótko działającą statynę (lowastaty-
na, simwastatyna, prawastatyna) bez aktywnych metabolitów, z fibratem (wy-
łączywszy gemfibrozil). Możliwy jest również sekwencyjny sposób podawania
leku, zgodny z doświadczeniami własnymi zespołu (np. fibrat codziennie,
statyna co drugi dzień). Do tego typu terapii nie powinni być kwalifikowani
chorzy powyżej 70. roku życia, z upośledzoną czynnością nerek i wątroby,
a także stosujący wiele innych leków (konkurencja między lekami o meta-
bolizujące je enzymy wątrobowe).
Szczególnie wysokie ryzyko działań niepożądanych w stosunku do mięśni,
dotyczy leczenia skojarzonego fibratami i statynami metabolizowanymi
w układzie cytochromu P450 izoenzymu 3A4 (lowastatyna, simwastatyna,
atorwastatyna, ceriwastatyna). Prawastatyna, z uwagi na odmienny szlak me-
taboliczny z pominięciem cytochromu P450, wydaje się być bezpieczna w te-
rapii skojarzonej. Ryzyko miopatii zależy także od dawek stosowanych sta-
tyn, zwiększa je również stosowanie statyn łącznie z antybiotykami
makrolidowymi, antagonistami H
2
(cymetydyna, ranitydyna), lekami immu-
nosupresyjnymi, przeciwdepresyjnymi, antagonistami kanałów wapniowych
(diltiazem), lekami przeciwgrzybiczymi, czy z kwasem nikotynowym. Ryzyko
niepożądanych objawów mięśniowych zwiększają rozległe urazy, alkohol,
środki pobudzające (amfetamina) i ciężkie zakażenia.
Pacjent musi zostać uprzedzony, że jeśli w trakcie terapii pojawią się ja-
kiekolwiek dolegliwości mięśniowe, bóle powysiłkowe mięśni, czy ciemne
zabarwienie moczu, gorączka i ogólne osłabienie, lek powinien zostać od-
stawiony, a chory powinien pilnie skonsultować się z lekarzem. Nie rozpo-
znana miopatia może prowadzić do rabdomiolizy i ostrej niewydolności ne-
rek, natomiast w przypadku szybkiego rozpoznania i odstawienia leku,
objawy mięśniowe cofają się.
W trakcie leczenia powinniśmy kontrolować poziomy transaminaz na po-
czątku terapii, po 6-8 tygodniach, następnie co 3 miesiące przez pierwszy
rok leczenia, potem co 6 miesięcy. Jeżeli stężenie AlAT przekroczy trzykrot-
nie normę – leczenie należy przerwać. W sytuacji pojawienia się bólów mię-
śniowych, czy osłabienia siły mięśniowej, powinniśmy oznaczyć poziom CPK
i w razie ponad 10-krotnego wzrostu – przerwać leczenie. Możliwy jest po-
162

wrót do leczenia jednym z preparatów hipolipemicznych, w przypadkach
uzasadnionych, gdy wartość CPK powróci do normy. Musimy szczególnie
przy upośledzonej funkcji nerek, monitorować stężenie kreatyniny, a w przy-
padku równoczesnego leczenia antykoagulantami wskaźnik INR.
Innym rodzajem skojarzonej terapii hipolipemicznej jest podawanie staty-
ny z lekiem wiążącym kwasy żółciowe. Leczenie to dotyczy hipercholesterole-
mii z bardzo wysokim stężeniem cholesterolu LDL wyższym niż 190 mg/dL
(zwykle jest to genetycznie uwarunkowana postać hipercholesterolemii) lub
przypadków, w których stosowanie diety oraz jednego leku nie powoduje po-
żądanego obniżenia cholesterolu LDL. Żywice mogą być bezpiecznie poda-
wane razem ze statynami, bowiem nie są wchłaniane do krwi i ich działania
niepożądane ograniczają się do przewodu pokarmowego. W czasie leczenia
żywicami, należy pamiętać o suplementacji kwasu foliowego.
Strategia leczenia HTG jest uzależniona od przyczyn oraz stopnia jej nasi-
lenia. Przy stężeniu TG przekraczających 300 mg/dL, należy wdrożyć farma-
koterapię kwasem nikotynowym bądź fibratem, a w razie niepowodzenia –
oboma preparatami równocześnie.
Leczenie izolowanego niskiego stężenia cholesterolu frakcji HDL, w obli-
czu ostatnich doniesień o znaczeniu prognostycznym tej patologii (badania
VA-HIT), zarezerwowana jest dla osób z już rozpoznawaną ChNS oraz sta-
nami równoważnymi. Terapia wówczas polega na włączeniu leków z grupy
fibratów, łącznie z zaleceniem zwiększenia aktywności fizycznej, umiarko-
wanego spożycia alkoholu, zaprzestania palenia tytoniu, wzbogacenia diety
o jednonienasycone kwasy tłuszczowe. Zalecenia na temat spożycia alkoho-
lu w ramach TLC są kontrowersyjne, nadto nie ma danych z randomizowa-
nych badań prospektywnych, potwierdzających związek między redukcją in-
cydentów o etiologii miażdżycowej i spożyciem alkoholu.
Dyslipidemia cukrzycowa jest miażdżycorodną patologią lipidową, wystę-
pującą u osób z cukrzycą typu 2. Mimo, iż podwyższone stężenie TG oraz
niskie stężenie cholesterolu frakcji HDL są typowe dla tego zespołu, to jed-
nak wyniki badań klinicznych potwierdzają uznanie stężenia cholesterolu
LDL za pierwotny cel leczenia. Pożądane stężenie LDL u chorych na cu-
krzycę powinno wynosić poniżej 100 mg/dL. Farmakoterapię podejmuje się
przy wartościach LDL >130 mg/dL, łącznie z zaleceniami o zmianie stylu
życia. W przypadkach, gdy stężenie LDL oscyluje (mimo leczenia statyna-
mi) między 100-129 mg/dL, należy dołączyć lek z grupy fibratów. Szczegól-
nie, że wyniki badania DAIS potwierdzają skuteczność terapii fenofibratem
u pacjentów z cukrzycą, w hamowaniu progresji blaszek miażdżycowych,
w tętnicach wieńcowych o 40%.
163

Zespół chylomikronemii charakteryzuje się bardzo wysokimi poziomami
TG, zwykle >1000 mg/dL, podwyższonymi stężeniami cholesterolu całkowi-
tego (>200 mg/dL), przy prawidłowych wartościach cholesterolu frakcji
LDL. W leczeniu niezwykle ważna jest dieta, obok leczenia fibratami oraz
olejem rybnym z zawartością kwasu omega 3.
Mimo opisanych działań niepożądanych i zagrożenia, jakie niesie ze sobą
skojarzona terapia hipolipemiczna, stosowanie się ściśle do określonych za-
leceń pozwala na uniknięcie ewentualnych powikłań, a efekty leczenia przy-
noszą niewątpliwą i wymierną korzyść leczonemu pacjentowi (redukcja krót-
ko- i długoterminowego ryzyka powikłań sercowo-naczyniowych).
Zapamiętaj!
1. Zaburzenia lipidowe należy leczyć, aby ograniczyć postęp miażdżycy oraz
zmniejszyć częstość klinicznych postaci chorób naczyniowych.
2. Leczenie zaburzeń gospodarki lipidowej rozpoczynamy od zmiany stylu życia:
• dieta,
• utrzymanie pożądanej masy ciała,
• zaprzestanie palenia tytoniu,
• zwiększenie aktywności fizycznej.
3. Obniżenie stężenia cholesterolu o 1% wiąże się ze zmniejszeniem częstości
ChNS o 2%.
4. Wzrost stężenia cholesterolu HDL o 1% wiąże się ze zmniejszeniem czę-
stości ChNS o 2-4%.
5. Leczenie skojarzone jest potrzebne rzadko, wiąże się ze zwiększeniem ryzy-
ka działań niepożądanych i musi być każdorazowo poprzedzone indywidu-
alną oceną wskazań.
Polecane lektury:
Polskie Towarzystwo Kardiologiczne: Standardy postępowania w chorobach
układu krążenia; Kardiologia Polska, XLVI, suplement I, 1997.
Wytyczne AHA/ACC dotyczące zapobiegania atakowi serca i śmierci u osób
z chorobą układu sercowo-naczyniowego na tle miażdżycowym – aktualizacja
2001; Circulation, 1/2001, 104: 1577-1579.
M. D. Feher, W. Richmond: Lipidy i zaburzenia lipidowe; wydanie I, Via
Medica, Gdańsk, 2002.
L. Giec, M. Trusz-Gluza (red.): Choroba niedokrwienna serca: Hiperlipide-
mie towarzyszące chorobie niedokrwiennej serca i ich leczenie; Warszawa,
wydanie II, PZWL, 1999.
164
XII. KWAS ACETYLOSALICYLOWY – UGRUNTOWANA
POZYCJA W NOWOCZESNEJ KARDIOLOGII
Włodzimierz Gierlak, Agnieszka Domagała, Katarzyna Sadkowska,
Marek Kuch
WSTĘP
Podstawowym doustnym lekiem antyagregacyjnym jest kwas acetylosali-
cylowy. Substancja lecznicza zawarta pierwotnie w korze wierzby, stosowana
w postaci soku jeszcze przez Hipokratesa, wyekstrahowana została jako kwas
salicylowy w 1838 roku, zaś wprowadzona do produkcji przemysłowej po od-
kryciu acetylacji kwasu salicylowego po 1897 roku (ryc. 1). Przez 100 lat sto-
sowana jako lek przeciwbólowy, przeciwgorączkowy i przeciwzapalny, do-
piero od dwudziestolecia znajduje zastosowanie w kardiologii, wykorzystując
blokowanie funkcji płytek.
Rycina 1: Wzór kwasu acetylosalicylowego
MECHANIZM DZIAŁANIA
Kwas acetylosalicylowy nieodwracalnie blokuje cyklooksygenazę, jeden
z enzymów przemian kaskady kwasu arachidonowego. Cyklooksygenaza ka-
talizuje proces utleniania wielonienasyconych kwasów tłuszczowych, w wyni-
ku czego ostatecznie powstają prostaglandyny i tromboksan, mediatory sta-
nu zapalnego. Prostaglandyny powstające w ognisku zapalnym powodują
rozszerzanie naczyń i drażnienie zakończeń nerwowych, co daje obraz kli-
niczny zapalenia (ból, obrzęk, podwyższenie temperatury, zaczerwienienie).
Z drugiej strony, prostaglandyny odpowiedzialne są za szereg korzystnych
efektów biologicznych, takich jak działanie ochronne w błonie śluzowej żo-
łądka czy regulacja przepływu nerkowego. Dotychczas odkryto cyklooksy-
genazę 1 (COX-1) i cyklooksygenazę 2 (COX-2). COX-1 w warunkach fizjo-
logicznych odpowiada za produkcję prostaglandyn o działaniu ochronnym.
COX-2 syntetyzowana pod wpływem reakcji zapalnej, przyczynia się do po-
165

wstawania nadmiaru prostaglandyn i podtrzymywania procesu zapalnego.
Aspiryna jest względnie selektywnym blokerem COX-1.
W płytkach krwi blokowanie COX-1 prowadzi do hamowania powstawa-
nia tromboksanu A2 – silnej substancji naczyniokurczącej, proagregacyjnej
i inicjującej tworzenie skrzepliny na blaszce miażdżycowej. Blokowanie na
poziomie płytek ma charakter nieodwracalny, aż do momentu rozpadu
trombocyta, czyli przez okres 7-10 dni.
Blokowanie cyklooksygenazy na poziomie śródbłonkowym zmniejsza syn-
tezę prostacykliny, enzym jednak jest odtwarzany przez komórki śródbłonka
w miejsce nieodwracalnie zablokowanego. Kwas acetylosalicylowy nie wpły-
wa na inne szlaki aktywacji płytek krwi, zależne od serotoniny, adrenaliny,
ADP czy trombiny.
Farmakokinetyka kwasu acetylosalicylowego przedstawia się następująco.
Wchłanianie po podaniu doustnym jest szybkie i całkowite, zachodzi w żo-
łądku i jelicie cienkim na drodze biernej dyfuzji. Ssanie tabletki powoduje
rozpoczęcie wchłania już w jamie ustnej. Tabletki powlekane są przystoso-
wane do wchłaniania w jelicie cienkim.
Kwas acetylosalicylowy charakteryzuje się dużą zdolnością penetracji do
tkanek i płynów ustrojowych, w tym także do płynu mózgowo-rdzeniowego,
stawowego, mleka i przez łożysko. Wiąże się z białkami w 70-90%, w stopniu
zależnym od stężenia w surowicy.
Kwas acetylosalicylowy metabolizowany jest w mechanizmie hydrolizy
katalizowanej przez esterazy do kwasu salicylowego, w 50-80% w mechani-
zmie pierwszego przejścia. Proces dalszej hydroksylacji w wątrobie, ner-
kach oraz w aktywowanych granulocytach obojętnochłonnych prowadzi do
powstania nieaktywnych metabolitów. Główną drogą eliminacji metaboli-
tów jest wydalanie przez nerki. Farmakokinetyka leku nie jest istotnie za-
leżna od wieku.
ZASTOSOWANIA KLINICZNE
Pęknięcie blaszki miażdżycowej i tworzenie bogato płytkowej skrzepliny,
odgrywa podstawową rolę w zamknięciu tętnicy wieńcowej i powstaniu obra-
zu niestabilnej dusznicy bolesnej lub świeżego zawału serca. Badania ISIS-2
były pierwszymi badaniami wieloośrodkowymi, które potwierdziły, że wcze-
sne podawanie aspiryny w świeżym zawale serca zmniejsza śmiertelność
o 23%, zaś w połączeniu ze streptokinazą o 42%. Jak dotąd nie wyjaśniono,
czy główne działanie kwasu acetylosalicylowego polega na nasileniu działa-
nia leków fibrynolitycznych, zapobieganiu reokluzji, czy ogranicza się do
166

działania antyagregacyjnego. Wyniki odległej obserwacji chorych po zawale
serca, wykazały zmniejszenie częstości występowania powtórnego zawału
serca u chorych leczonych kwasem acetylosalicylowym. Efekt ten obserwo-
wano bez względu na stosowany lek fibrynolityczny. Na tej podstawie zaleca-
ne jest jak najwcześniejsze stosowanie aspiryny w świeżym zawale serca, jak
również w prewencji wtórnej.
Jako że niestabilnej dusznicy bolesnej towarzyszy udokumentowana nad-
krzepliwość i zwiększona agregacja płytek, stanowi to patofizjologiczne pod-
stawy stosowania aspiryny. Potwierdzają to wyniki badania RISC, gdzie oce-
niano wpływ dziennej dawki 75 mg kwasu acetylosalicylowego u 796
mężczyzn z niestabilną dusznicą bolesną (NDB) lub ostrym zespołem wień-
cowym bez uniesienia odcinka ST (NSTEMI), w porównaniu z grupą place-
bo w okresie 5 dni. Ryzyko ponownego zawału serca i zgonu w grupie leczo-
nej zmniejszyło się o 57-69% i było istotnie mniejsze zarówno u chorych
z niemym niedokrwieniem, jak i dodatnią, bólową próbą wysiłkową.
W NDB rozpoczęcie leczenia kwasem acetylosalicylowym, jeśli wcześniej
nie był stosowany, powinno nastąpić jak najwcześniej i być kontynuowane.
Duże badania kliniczne przemawiają za stosowaniem małych dawek leku
u pacjentów ze stabilną dusznicą bolesną. Porównując pacjentów z przewle-
kłą chorobą niedokrwienną serca stosujących aspirynę w dawce 125 mg/do-
bę lub placebo, wykazano redukcję występowania zawału serca o 67%.
W badaniu SAPAT w okresie leczenia trwającym 50 miesięcy stwierdzono
również zmniejszenie ryzyka zawału serca, nagłego zgonu sercowego, udaru
mózgu oraz całkowitej śmiertelności. W stabilnej dusznicy bolesnej aspiryna
powinna być stosowana w sposób podobny, jak w prewencji wtórnej po za-
wale – okres leczenia nie jest określony.
Jak dotąd, nie ma dowodów na skuteczność profilaktycznego leczenia an-
tyagregacyjnego u pacjentów bez czynników ryzyka choroby niedokrwiennej
serca (ChNS). Natomiast w badaniu HOT uzyskano znamienną statystycznie
redukcję występowania zawału serca oraz nawrotów niedokrwienia, jak rów-
nież zgonów w grupie pacjentów z nadciśnieniem tętniczym, leczonych tera-
pią hipotensyjną i aspiryną. Nie stwierdzono przy tym wzrostu częstości wy-
stępowania powikłań. Na tej podstawie kwas acetylosalicylowy w dawce 75 mg
dziennie zalecany jest dla osób z grupy wysokiego ryzyka.
Dla pacjentów po angioplastyce tętnic wieńcowych zalecane jest stosowa-
nie intensywnego leczenia antyagregacyjnego kwasem acetylosalicylowym
w połączeniu z tiklopidyną lub klopidogrelem. Zalecenie to jest szczególnie
istotne w przypadku towarzyszącego angioplastyce stentowania tętnic wień-
cowych. Stosowanie aspiryny zmniejsza ryzyko zamknięcia żylnego pomostu
167

aortalno-wieńcowego, zwłaszcza w pierwszym miesiącu po zabiegu pomo-
stowania.
W migotaniu przedsionków aspiryna może być stosowana jedynie u pa-
cjentów z grupy niskiego ryzyka zatorowości, co wykazano w prewencji pier-
wotnej w badaniu SPAF II, jak i wtórnej w badaniu EAFT.
Poza tym, kwas acetylosalicylowy jest stosowany w leczeniu reumatoidal-
nego zapalenia stawów, w dawce dobowej 2-4 g. Nie należy zapominać rów-
nież o działaniu przeciwgorączkowym i przeciwbólowym aspiryny.
Dawkowanie kwasu acetylosalicylowego w kardiologii było przez wiele lat
przedmiotem dyskusji klinicystów. Polecane są dawki od 75 do 325 mg
dziennie. Pierwsza dawka leku powinna być większa (325 mg) oraz ulegać
szybkiemu wchłanianiu. Eliminuje to przy rozpoczęciu leczenia formy leku
o uwalnianiu dojelitowym (przydatne w leczeniu podtrzymującym). W pre-
wencji udaru mózgu oraz chorobach tętnic obwodowych konieczne jest sto-
sowanie wyższych dawek (300-900 mg dziennie).
PRAKTYCZNE UWAGI KLINICZNE
• przeciwzapalne działanie aspiryny może mieć znaczenie w stabilizowa-
niu blaszki miażdżycowej w okresie niestabilnej dusznicy bolesnej, poza
udowodnionym działaniem antyagregacyjnym;
• w świeżym zawale serca aspirynę pacjent musi otrzymać jako lek pierw-
szego rzutu, bowiem od skutecznego zablokowania agregacji płytek mo-
że zależeć zarówno skuteczność leczenia fibrynolitycznego, jak i pier-
wotnej angioplastyki tętnic wieńcowych;
• pierwsza dawka powinna być dawką nasycającą (300-500 mg), to jest 1-2
tabletki preparatu kwasu acetylosalicylowego w postaci niepowlekanej,
aby osiągnąć szybki i skuteczny efekt antyagregacyjny, mimo zastrzeżeń
ze strony gastrologów ze względu na dwukrotnie większe ryzyko wystą-
pienia owrzodzenia żołądka oraz krwawienia z górnego odcinka prze-
wodu pokarmowego;
• jeśli pacjent jest leczony podtrzymującymi dawkami aspiryny, nie ma
bezwzględnej konieczności odstawiania leku przed zabiegiem chirurgicz-
nym; aby przywrócić agregację płytek po leczeniu aspiryną, konieczny
jest okres do 2 tygodni – jest to czas potrzebny do wytworzenia nowych
płytek krwi z megakariocytów, ze względu na nieodwracalność procesu
blokowania cyklooksygenazy przez aspirynę;
168

• w prewencji powikłań zakrzepowo-zatorowych towarzyszących migota-
niu przedsionków aspiryna wykazuje słabe działanie, jednak dla osób
o podwyższonym ryzyku powikłań krwotocznych, może być alternatywą
doustnych antykoagulantów;
• kwasem acetylosalicylowym powinni być leczeni wszyscy pacjenci, bez
przeciwskazań do tego leku, z rozpoznaną chorobą niedokrwienną serca
zarówno w prewencji pierwotnej, jak i wtórnej (po zawale serca); takie
leczenie jest konieczne również u osób bez choroby niedokrwiennej ser-
ca, lecz z obecnymi czynnikami ryzyka ChNS.
OBJAWY NIEPOŻĄDANE I PRZECIWSKAZANIA
Objawy niepożądane leczenia kwasem acetylosalicylowym są zależne od
dawki, dotyczą najczęściej przewodu pokarmowego, na skutek uszkodzenia
bariery ochronnej błony śluzowej żołądka, co skutkuje wzmożonym wydzie-
laniem histaminy, a następnie kwasu solnego. Zostaje zahamowane również
ochronne działanie cytoprotekcyjnych prostaglandyn PGE
2
i PGI
2
. Zjawi-
ska te skutkują prawie dwukrotnym zwiększeniem ryzyka owrzodzenia żo-
łądka oraz krwawienia z górnego odcinka przewodu pokarmowego. Spora-
dycznie może występować nadwrażliwość na aspirynę pod postacią astmy
aspirynowej, skojarzonej najczęściej z współistniejącymi polipami nosa.
Ze względu na swoją budowę chemiczną, kwas acetylosalicylowy może da-
wać rozliczne interakcje lekowe. Do najgroźniejszych należą interakcje z po-
chodnymi kumaryny i sterydami ze względu na ryzyko krwawienia z przewo-
du pokarmowego. Należy pamiętać, że kwas acetylosalicylowy nasila
działanie hipoglikemizujące pochodnych sulfonylomocznika, zagrażając hi-
poglikemią.
Bezwzględnymi przeciwwskazaniami do leczenia aspiryną jest – poza nad-
wrażliwością – czynna choroba wrzodowa, skaza krwotoczna oraz trzeci try-
mestr ciąży.
Zapamiętaj!
Wskazania do stosowania kwasu acetylosalicylowego to:
1. świeży zawał serca oraz prewencja wtórna zawału,
2. stabilna oraz niestabilna dusznica bolesna,
3. prewencja pierwotna w grupie wysokiego ryzyka choroby niedokrwiennej
serca,
4. przed i po angioplastyce tętnic wieńcowych, szczególnie ze stentowaniem,
169

5. po zabiegu pomostowania tętnic wieńcowych,
6. migotanie przedsionków w grupie niskiego ryzyka zatorowości,
7. choroby naczyń,
8. reumatoidalne zapalenie stawów,
9. przeciwbólowo, przeciwgorączkowo.
Polecane lektury:
R. Haiat, G. Leroy: Leczenie chorób sercowo-naczyniowych; VIA MEDICA,
Gdańsk, 2000.
C. Baigent, R. Collins, I. Appleby i wsp.: ISIS-2: 10-year survival among
patients with suspected acute myocardial infarction in randomised compari-
son of intravenous streptokinase, oral aspirin, both, or neither; Br Med J,
1998, 316, 1337.
Polskie Towarzystwo Kardiologiczne: Standardy postępowania w chorobach
układu krążenia. Kardiologia Polska, 1997, 46, suplement I.
170

XIII. PRZEWLEKŁE LECZENIE PRZECIWZAKRZEPOWE
– POCHODNE KUMARYNY ORAZ INHIBITORY
TROMBINY
Włodzimierz Gierlak, Agnieszka Domagała, Katarzyna Sadkowska,
Marek Kuch
Leczenie przeciwzakrzepowe ma już 50-letnią historię. Pochodne hydrok-
sykumaryny nie wykazują bezpośredniego wpływu na krzepnięcie krwi. Efekt
przeciwzakrzepowy zostaje osiągnięty poprzez wpływ na metabolizm wita-
miny K. Antagoniści witaminy K, hamują karboksylację reszt glutaminowych
syntetyzowanych w wątrobie – osoczowych czynników układu krzepnięcia:
II, VII, IX i X, co warunkuje brak ich aktywności w procesie hemostazy.
Leki te hamują również syntezę białek C i S. Działanie przeciwzakrzepowe
pochodnych hydroksykumaryny rozwija się w 3-5 dniu leczenia, zaś przywró-
cenie sprawności układu krzepnięcia trwa do 72 godzin. Wskazania do stoso-
wania doustnych leków przeciwkrzepliwych przedstawiono w tabeli 1.
Przeciwwskazania do stosowania doustnych leków przeciwzakrzepowych
przedstawiono w tabeli 2.
Dawka leku ustalana jest indywidualnie. Lek przeciwzakrzepowy podaje
się raz dziennie, o stałej porze, co zapewnia względnie stałą redystrybucję
w organizmie. Leczenie rozpoczyna się w pierwszych dwóch dniach od
zwiększonych dawek leków, pod kontrolą INR lub wskaźnika protrombino-
wego. Okres wysycenia lekiem, zanim osiągnięty zostanie pożądany efekt
171
Tabela 1: Wskazania do stosowania pochodnych kumaryny
• leczenie zakrzepicy żylnej i zapobieganie nawrotom;
• leczenie przeciwzakrzepowe po przebytym zawale serca;
• leczenie zatorowości płucnej oraz zapobieganie nawrotom;
• leczenie przeciwzakrzepowe w przypadku skrzeplin
wewnątrzsercowych;
• zatory tętnicze;
• po wszczepieniu zastawek mechanicznych serca;
• leczenie przeciwzakrzepowe w wadach zastawkowych;
• zapobieganie udarom niedokrwiennym w grupie pacjentów
z migotaniem przedsionków.

przeciwzakrzepowy, wynosi 72 godziny. Dawka podtrzymująca wynosi zależ-
nie od zapotrzebowania od 1 do 4 mg/dobę.
Pożądany przedział wartości INR dla dobrze kontrolowanego leczenia
przeciwzakrzepowego, wynosi w zależności od wskazań terapeutycznych od
2,5 do 3,5 (wskaźnik protrombinowy: 30-50%). Powszechne wprowadzenie
w ostatnich latach wskaźnika INR zamiast wskaźnika protrombinowego
umożliwiło porównywanie oznaczeń pomiędzy różnymi laboratoriami, bez
względu na czułość stosowanej tromboplastyny (tzw. standaryzacja ozna-
czeń). Sposób obliczenia INR przedstawiono na rycinie 1, natomiast zaleca-
ne wartości INR w zależności od wskazań zamieszczono w tabeli 3.
Rycina 1: Metoda obliczania INR
172
Tabela 2: Przeciwwskazania do stosowania doustnych leków przeciwzakrzepowych
• ciąża;
• niewydolność wątroby;
• alkoholizm;
• niekontrolowane nadciśnienie tętnicze;
• skaza krwotoczna;
• czynna choroba wrzodowa żołądka lub dwunastnicy;
• aktywne krwawienie;
• planowane leczenie zabiegowe;
• nawrót żylnej choroby zakrzepowo-zatorowej pomimo
odpowiedniego leczenia przeciwzakrzepowego;
• wrodzona lub nabyta oporność na doustne antykoagulanty;
• brak współpracy ze strony chorego.

Najpoważniejszym działaniem ubocznym leczenia przeciwzakrzepowego
są powikłania krwotoczne. Częstość krwawień wzrasta wraz z wzrostem
INR/obniżeniem wskaźnika protrombinowego. Powikłania krwotoczne doty-
czą 7-10% pacjentów, przy okresie leczenia dłuższym niż 4 miesiące, i ob-
ciążone są śmiertelnością 1%. Wylewy śródczaszkowe stanowią 1-2% wszyst-
kich powikłań krwotocznych, zwykle w grupie pacjentów powyżej 60. roku
życia. Retrospektywna analiza wyników badania EAFT wykazała, że powi-
kłania krwotoczne nasilają się, gdy wskaźnik INR jest większy od 4.
Działanie pochodnych kumaryny, a przez to efekt leczenia przeciwzakrze-
powego, modyfikowane jest zarówno przez rodzaj pożywienia, temperaturę
otoczenia, jak również liczne interakcje lekowe. Spośród leków nasilających
działanie pochodnych kumaryny należy wymienić salicylany, niesterydowe
leki przeciwzapalne, alkohol, antybiotyki, anticol, chinidynę, fibraty, mety-
lotiouracyl, sulfonamidy (tab. 4). Z kolei do leków, które powodują słabsze
działanie pochodnych kumaryny należą: barbiturany, benzodiazepiny, ste-
rydy, leki przeciwhistaminowe, alkalizujące, przeciwgruźlicze (rifampicyna)
oraz leki antykoncepcyjne (tab. 4).
Dla utrzymania bezpieczeństwa leczenia konieczna jest kontrola parame-
trów układu krzepnięcia, w początkowym okresie co 2 tygodnie. Przy stabil-
nych wartościach INR utrzymujących się w pożądanym przedziale terapeu-
tycznym, kontrolne oznaczenia można wykonywać co 4-6 tygodni. Należy
173
Tabela 3: Zalecane wartości INR w zależności od wskazań do stosowania leczenia przeciwzakrzepowego
INR
(norma: 0,8-1,2)
WSKAZANIA
1,5 - 2,5
• zapobieganie nawracającej zakrzepicy żylnej;
• zapobieganie powtórnemu zawałowi serca;
2,5 - 3,0
• leczenie zakrzepicy żylnej;
• leczenie zatorowości płucnej;
• leczenie skrzeplin wewnątrzsercowych;
• po wszczepieniu zastawek biologicznych serca,
do 3 miesięcy;
• wady zastawkowe; migotanie przedsionków;
2,5 - 3,5
• nawracające zatory tętnicze;
• po wszczepieniu zastawek mechanicznych serca.
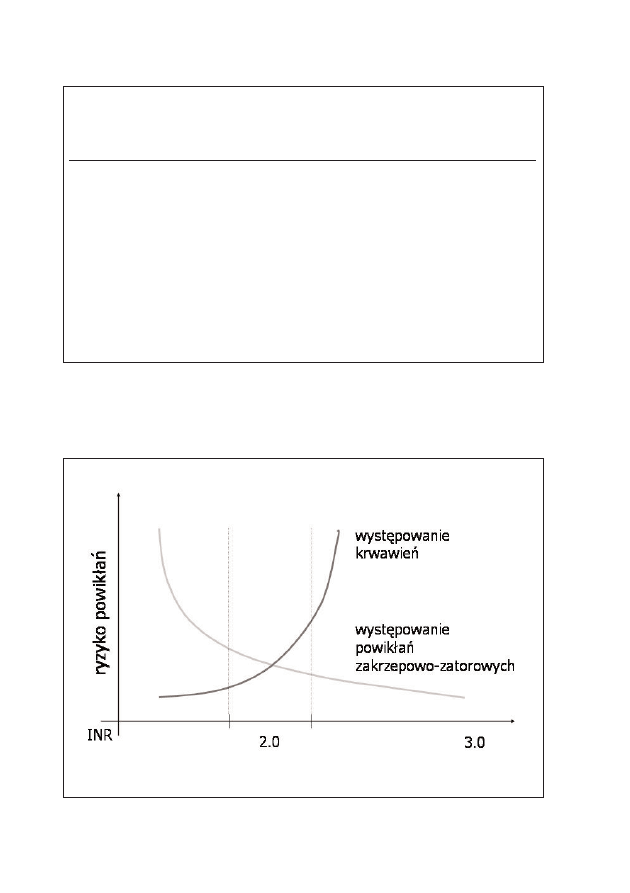
zwrócić uwagę na odwrotnie proporcjonalną zależność pomiędzy obniżają-
cym się ryzykiem wystąpienia powikłań zakrzepowo-zatorowych, a rosnącym
jednocześnie zagrożeniem wystąpienia powikłań krwotocznych w zależności
od dawki przyjmowanego leku przeciwkrzepliwego (ryc. 2).
Rycina 2: Ryzyko powikłań przy stosowaniu antykoagulantów doustnych
174
Tabela 4: Interakcje doustnych leków przeciwzakrzepowych
NASILAJĄ
DZIAŁANIE
PRZECIWKRZEPLIWE
HAMUJĄ
DZIAŁANIE
PRZECIWKRZEPLIWE
• salicylany
• NLPZ
• alkohol
• fibraty
• antybiotyki
• chinidyna
• metylthiouracyl
• sulfonamidy
• barbiturany
• benzodiazepiny
• sterydy
• leki przeciwhistaminowe
• leki alkalizujące
• leki przeciwgruźlicze
• leki antykoncepcyjne

Wobec tak różnorodnych zależności wpływających na stosowane leczenie
konieczne jest prowadzenie metodycznej prewencji powikłań krwotocznych.
Do działań zapobiegawczych należy zapoznanie pacjenta z celem oraz moż-
liwymi powikłaniami prowadzonego leczenia, systematyczny nadzór nad
przyjmowanym leczeniem – zarówno w systemie samokontroli, jak i właści-
wej kontroli lekarskiej (tab. 5).
Postępowanie w przypadku przedawkowania doustnych antykoagulatów
przedstawiono w tabeli 6.
175
Tabela 5: Prewencja powikłań krwotocznych w trakcie leczenia przeciwzakrzepowego
• edukacja pacjenta;
• prowadzenie dzienniczka dawek leku;
• kontrola wskaźnika protrombinowego, nie rzadziej niż
co 2-3 tygodnie;
• wykonywanie badań w wiarygodnych laboratoriach;
• stosowanie preparatów o standaryzowanej dawce;
• jeden lekarz koordynujący leczenie przeciwzakrzepowe chorego.
Tabela 6: Postępowanie w przypadku przedawkowania doustnych antykoagulantów
BEZ KRWAWIENIA
• przerwa w leku na jeden dzień;
• modyfikacja dawki leku;
PRZY WYSTĄPIENIU
KRWAWIENIA
• witamina K: 10 mg i.v.;
• osocze świeżo mrożone: 20 ml/kg;
• koncentrat czynnika protrombiny: cz. IX
20 j./kg m. c.;
• obniżenie hematokrytu o 20-25% z
wystąpieniem wstrząsu pokrwotocznego,
jest wskazaniem do przetoczenia krwi.

ZASTOSOWANIE ANTYKOAGULANTÓW DOUSTNYCH
Poniżej zostaną omówione wiodące wskazania do prowadzenia leczenia
przeciwzakrzepowego w oparciu o Evidence Based Medicine (EBM).
Zawał serca
Na podstawie badań ASPECT z 1994 roku, dotyczących leczenia doustny-
mi antykoagulantami w grupie pacjentów po zawale serca, wykazano zmniej-
szenie śmiertelności o 10%, zmniejszenie ponownych zawałów o 53%,
zmniejszenie częstości występowania udarów mózgu o 40%, jednocześnie
odnotowując wzrost krwawień o 3,9 %.
Dzięki kolejnym przeprowadzonym badaniom można wnioskować, że do-
ustne leki przeciwzakrzepowe stosowane wraz z kwasem acetylosalicylowym
poprawiają rokowanie wśród pacjentów po zawale serca (ATACS, OASIS
1 i 2, CARS). Stosowanie warfaryny obniżało nieznamiennie częstość zgo-
nów, ponownych zawałów serca, niestabilnej dusznicy bolesnej oraz powtór-
nej hospitalizacji. Z analizy podgrup wynika, że korzyści z leczenia osiągnę-
ły pułap znamienności statystycznej w przypadku, jeśli prowadzone leczenie
przeciwzakrzepowe osiągało pożądany zakres (INR 2-2,5).
Opublikowane właśnie zostały wyniki badania APRICOT-2, którego celem
była ocena skuteczności zapobiegania reokluzji tętnic wieńcowych u pacjen-
tów po przebytym zawale serca leczonym fibrynolitycznie. W trzymiesięcznej
obserwacji leczenie pochodnymi kumaryny i kwasem acetylosalicylowym
istotnie zmniejszyło częstość reokluzji tętnic wieńcowych i nawrotów ostrych
zespołów wieńcowych, w porównaniu z grupą leczoną jedynie aspiryną. Jest
to niewątpliwie skuteczny model leczenia, jednak obciążony dużo wyższym
ryzykiem powikłań krwotocznych i do tej pory zarezerwowany dla grupy pa-
cjentów z chorobą niedokrwienną serca o podwyższonym ryzyku powikłań
zakrzepowo-zatorowych. Za modelem łączenia pochodnych kumaryny z nie-
wielkimi dawkami aspiryny przemawia również niski koszt prowadzonego
leczenia.
Leczenie przeciwzakrzepowe skrzeplin wewnątrzsercowych jest prowadzo-
ne zwykle do 6 miesięcy, pod kontrolą echokardiograficzną, po wstępnym
2-tygodniowym przygotowaniu przez heparyny drobnocząsteczkowe.
Migotanie przedsionków
W migotaniu przedsionków, nie związanym z zastawkową wadą serca, wy-
stępuje podwyższone ryzyko powikłań zakrzepowo-zatorowych. Ryzyko uda-
176

ru niedokrwiennego mózgu rośnie pięciokrotnie oraz wzrasta o kolejne 5%
z każdym rokiem trwania migotania przedsionków. Na podstawie powyż-
szych przesłanek zaleca się stosowanie przewlekłego leczenia przeciwzakrze-
powego w grupach pacjentów z przemijającym niedokrwieniem mózgu, czy
po przebytym udarze niedokrwiennym mózgu, jak również po incydentach
zatorowości tętnic obwodowych. Konieczne wydaje się prowadzenie lecze-
nia przeciwzakrzepowego wśród pacjentów z migotaniem przedsionków oraz
umiarkowaną lub ciężką dysfunkcją lewej komory, potwierdzoną w badaniu
echokardiograficznym, a także przy współistniejącym nadciśnieniu tętniczym
oraz wśród osób powyżej 75. roku życia.
Szczególnie uzasadnione jest stosowanie przewlekłego leczenia przeciw-
krzepliwego przy migotaniu przedsionków, które towarzyszy wadzie mitral-
nej po przebytej gorączce reumatycznej. Powyższe wnioski pokrywają się
z wynikami metaanalizy 7 dużych programów klinicznych (AFASAK, BA-
ATAF, SPINAF, SPAF 1 i 2, CAFA, EAFT).
W przypadku napadowego migotania przedsionków o nie ustalonym
okresie występowania, leczeniem z wyboru pozostaje kardiowersja elek-
tryczna. Przed kardiowersją konieczne jest przygotowanie leczeniem prze-
ciwkrzepliwym. Okres przygotowania powinien trwać 3 tygodnie, przy za-
chowaniu przedziału terapeutycznego INR pomiędzy 2,0-3,0. Po
kardiowersji pacjent powinien mieć prowadzone leczenie przeciwkrzepliwe
jeszcze przez 4 tygodnie (zapobiegawczo do czasu powrotu czynności me-
chanicznej przedsionka), o ile nie istnieją wskazania do przewlekłego le-
czenia przeciwkrzepliwego.
Pacjent ze sztuczną zastawką
Zagrożenie wykrzepianiem krwi na sztucznych zastawkach serca utrzymu-
je się pomimo prowadzonego leczenia przeciwkrzepliwego. Sztuczne zastaw-
ki w pozycji mitralnej stanowią dwukrotnie większe zagrożenie wystąpieniem
powikłań zakrzepowo-zatorowych, niż w przypadku sztucznych zastawek
wszczepionych w pozycji aortalnej. Ponadto zastawki kulkowe obciążone są
wyższym ryzykiem powikłań niż zastawki dyskowe.
Ze względu na wysokie ryzyko powikłań zakrzepowo-zatorowych wskaza-
ne jest leczenie przeciwzakrzepowe z utrzymaniem INR w przedziale 2,.5-
3,5. W odróżnieniu, zastawki biologiczne nie wymagają przewlekłego lecze-
nia przeciwzakrzepowego, poza 3-miesięcznym okresem pooperacyjnym.
177

Żylna choroba zakrzepowo-zatorowa
Leczenie przeciwzakrzepowe należy do kanonu zapobiegania żylnej cho-
robie zakrzepowo-zatorowej. Prewencja żylnej choroby zakrzepowo-zatoro-
wej jest zagadnieniem interdyscyplinarnym, bowiem dotyczy zarówno pa-
cjentów oddziałów internistycznych, jak i oddziałów zabiegowych. Nie ma
pełnej zgodności na temat okresu stosowania profilaktycznego doustnych le-
ków przeciwzakrzepowych. W badaniu DURAC prowadzono dwuletnią ob-
serwację pacjentów od pierwszego incydentu żylnej choroby zakrzepowo-za-
torowej (zakrzepica żył głębokich lub zatorowość płucna), leczonych
antykoagulantem doustnym przez okres 6 tygodni lub przez 6 miesięcy. Na-
wroty choroby występowały istotnie częściej w grupie sześciotygodniowej
profilaktyki przeciwzakrzepowej. Wydłużenie czasu prowadzenia profilak-
tyki przeciwzakrzepowej do 6 miesięcy, nie spowodowało zwiększenia po-
ważnych powikłań krwotocznych. Zaproponowane przez Francuskie Towa-
rzystwo Kardiologiczne zalecenia sugerują:
• krótkotrwałe leczenie przeciwzakrzepowe (od 6 tygodni do 3 miesięcy),
jeśli zdarzenie zakrzepowo-zatorowe wystąpiło po zabiegu operacyjnym
czy pourazowo;
• przedłużone leczenie przeciwzakrzepowe (od 3 do 6 miesięcy), gdy zda-
rzenie zakrzepowo-zatorowe ma charakter samoistny;
• przewlekłe leczenie przeciwzakrzepowe w przypadku nawracającej za-
krzepicy żył głębokich lub zatorowości płucnej – jak potwierdzono
w randomizowanej próbie klinicznej, przewlekłe stosowanie antykoagu-
lantów doustnych skuteczniej zapobiega nawrotom żylnej choroby za-
krzepowo-zatorowej, niż przedłużone leczenie przeciwzakrzepowe do
6 miesięcy.
Poza tym, w leczeniu przeciwzakrzepowym znajdują zastosowanie pentasa-
charydy krótko działające, których mechanizm działania polega na bloko-
waniu czynnika Xa oraz bezpośrednie inhibitory trombiny (IIa), takie jak
argatroban i bivaluridina – leki znajdujące się jeszcze w okresie badań kli-
nicznych. Obecnie wg AHA, hirudyna jest zalecana u pacjentów z trombocy-
topenią indukowaną przez heparynę (HIT) oraz w profilaktyce zakrzepicy
żył głębokich, zwiększając jednak ryzyko wystąpienia krwawienia. Bivaluru-
din to syntetyczny analog hirudyny, który odwracalnie wiąże trombinę.
W niewielkich badaniach klinicznych dotyczących niestabilnej dusznicy bole-
snej oraz ostrych zespołów wieńcowych bez uniesienia odcinka ST, jak rów-
nież dotyczących pierwotnej angioplastyki tętnic wieńcowych wykazano, że
redukuje zgony i powtórne zawały serca oraz wykazuje mniejsze ryzyko po-
wikłań krwotocznych niż heparyna niefrakcjonowana. Rezultaty leczenia
178

ostrych zespołów wieńcowych hirudyną i heparyną porównywane były
w czterech dużych badaniach klinicznych: OASIS-1, OASIS-2, TIMI 9B,
GUSTO IIB. Łączna analiza wyników wykazała, że względne ryzyko wstą-
pienia ponownego ostrego incydentu wieńcowego w ciągu 30-35 dni wynio-
sło 0,9 (p=0,016). Mimo iż przedstawione dane przemawiają na korzyść in-
hibitorów trombiny, to nie są one rutynowo stosowane w praktyce klinicznej.
Duże nadzieje wiąże się z nowym inhibitorem trombiny – ximelagatranem.
Jest to lek szybko przekształcający się do formy aktywnej – melagatranu. Xi-
melagatran jest stosowany 2 x dziennie, nie wymaga monitorowania para-
metrów układu krzepnięcia. Wydaje się, że lek ten zbliża się w swojej farma-
kokinetyce do idealnego leku przeciwkrzepliwego. Obecnie znajduje się na
etapie badań klinicznych.
Zapamiętaj!
Wskazania do stosowania pochodnych kumaryny to:
1. leczenie zakrzepicy żylnej i zapobieganie nawrotom,
2. leczenie przeciwzakrzepowe po przebytym zawale serca (wybrane przypadki),
3. leczenie zatorowości płucnej oraz zapobieganie nawrotom,
4. leczenie przeciwzakrzepowe w przypadku skrzeplin wewnątrzsercowych,
5. zatory tętnicze,
6. po wszczepieniu zastawek mechanicznych serca,
7. leczenie przeciwzakrzepowe w wadach zastawkowych,
8. zapobieganie udarom niedokrwiennym w grupie pacjentów z migotaniem
przedsionków.
Polecane lektury:
Fifth ACCP Consensus Conference on Antithrombotic Therapy; Chest, 1998,
114: 439S-769S.
G. Opolski, A. Torbicki: Migotanie przedsionków; Fundacja Rozwoju Me-
dycyny „Człowiek Człowiekowi”, Warszawa, 2000.
W. Z. Tomkowski i wsp.: Podstawy flebologii; Via Medica, Gdańsk, 2002.
179

XIV. TIENOPIRYDYNY – NADZIEJA W LECZENIU
OSTRYCH ZESPOŁÓW WIEŃCOWYCH?
Włodzimierz Gierlak, Agnieszka Domagała, Katarzyna Sadkowska,
Marek Kuch
Badania nad nowymi lekami antyagregacyjnymi wyniknęły z potrzeby le-
czenia pacjentów, dla których aspiryna jest przeciwwskazana (nadwrażli-
wość, astma aspirynowa, czynna choroba wrzodowa, skaza krwotoczna, trze-
ci trymestr ciąży), jak również dla tych osób, które wykazują oporność na
kwas acetylosalicylowy.
RECEPTOROWY MECHANIZM DZIAŁANIA
Tienopirydyny – to grupa leków, do której należą stosowana już od dzie-
sięciolecia tiklopidyna oraz jej nowsza pochodna – klopidogrel. Błyskotliwa
kariera tiklopidyny – wiodącego obecnie leku antyagregacyjnego – rozpo-
częła się od bardzo ciekawej hipotezy sugerującej blokowanie kluczowego
mechanizmu agregacyjnego płytek poprzez receptor glikoproteinowy
IIb/IIIa. Zapowiadało to wtedy przełom w leczeniu antyagregacyjnym, bo-
wiem dotąd jeszcze nie zsyntetyzowano skutecznej doustnej formy antagoni-
sty receptora GP IIb/IIIa. Jednak dopiero kolejne badania przyniosły jed-
noznaczną odpowiedź, w jakim mechanizmie tienopirydyny wywierają efekt
przeciwpłytkowy.
Działanie antyagregacyjne tej grupy leków polega na blokowaniu ADP-za-
leżnego szlaku aktywacji płytek krwi. Adenozynodwufosforan (ADP) uwol-
niony z erytrocytów, płytek krwi oraz uszkodzonych komórek śródbłonka,
powoduje aktywację płytek krwi wywołując procesy adhezji i agregacji pły-
tek. Bezpośredni mechanizm działania tienopirydyn polega na blokowaniu
zależnej od ADP cyklazy adenylowej. Leki stają się aktywne dopiero po
zmetabolizowaniu przez wątrobowy szlak enzymatyczny cytochromu P450.
Wykazano, że efektem leczenia jest wydłużenie czasu krwawienia, hamowa-
nie agregacji płytek oraz opóźnienie retrakcji skrzepu. Blokując działanie
ADP uwalnianego z płytkowych ziarnistości gęstych, dochodzi także po czę-
ści do hamowania agregacji płytek powodowanej przez tromboksan, czyn-
nik aktywujący płytki (PAF), kolagen czy trombinę. Ponadto podkreśla się
korzystne śródbłonkowe działanie pochodnych tienopirydyny, na drodze sty-
mulacji syntezy śródbłonkowego czynnika naczyniorozszerzającego (EDRF),
tlenku azotu (NO), prostacykliny oraz aktywacji własnej aktywności fibry-
nolitycznej.
180

FARMAKOLOGIA ORAZ BEZPIECZEŃSTWO LECZENIA
Zanim zostaną przedstawione wskazania do stosowania tienopirydyn, nie-
zbędne wydaje się omówienie farmakokinetyki antagonistów adenozyno-
dwufosforanu. Standardowa dawka tiklopidyny wynosi 2
× 250 mg/dobę.
Efekt terapeutyczny pierwszej dawki tiklopidyny występuje po 48-72 godzi-
nach. Po odstawieniu tiklopidyny, czynność płytek i czas krwawienia wraca
do normy po 4-10 dniach. Nie ma zależności pomiędzy poziomem terapeu-
tycznym leku w surowicy, a efektem przeciwpłytkowym. Lek metabolizuje
się przez wątrobę. Wobec powyższego należy pamiętać o zapewnieniu cią-
głości leczenia przeciwpłytkowego w ciągu pierwszych 2-3 dni leczenia tiklo-
pidyną, nim rozwinie skuteczną aktywność.
Standardowa dawka klopidogrelu wynosi 75 mg/dobę. Klopidogrel cha-
rakteryzuje się szybszym początkiem działania po przyjęciu pierwszej dawki
leku. Działanie antyagregacyjne występuje już po 2 godzinach. Optymalny
efekt leczniczy osiągany jest po 3-5 dniach terapii. W przypadku rozpoczęcia
szybkiego nasycania klopidogrelem stosując pierwszą dawkę nasycającą
(300 mg), działanie przeciwpłytkowe występuje już po godzinie.
Tiklopidyna jest bezpiecznym lekiem, pod warunkiem znajomości możli-
wych powikłań. Klopidogrel wykazuje działania uboczne dużo rzadziej niż
tiklopidyna. Ze spotykanych objawów ubocznych podczas stosowania tiklo-
pidyny może wystąpić biegunka, nudności i wymioty. Obserwuje się także
osutkę skórną. Potencjalnie najpoważniejszym objawem ubocznym działa-
nia leku jest neutropenia – występująca u 2,1% leczonych tiklopidyną. Neu-
tropenia może rozwinąć się w ciągu pierwszych 3 miesięcy stosowania leku
i może być asymptomatyczna. Opisywano także pojedyncze przypadki apla-
zji szpiku kostnego i zakrzepowej plamicy małopłytkowej. Może wystąpić
także żółtaczka cholestatyczna. W początkowym okresie stosowania tieno-
pirydyn (pierwsze 3 miesiące), bezpieczeństwo leczenia wymaga kontrolo-
wania morfologii wraz z poziomem płytek co dwa tygodnie.
WSKAZANIA DO STOSOWANIA W OPARCIU NA WYNIKACH BADAŃ
WIELOOŚRODKOWYCH
Wskazania do stosowania pochodnych tienopirydyny w miarę prowadzo-
nych badań ulegają rozszerzeniu. Dotychczas zalecanym leczeniem anty-
agregacyjnym w prewencji wtórnej zawału serca było stosowanie aspiryny.
Wskazania do stosowania tiklopidyny dotyczyły jedynie pacjentów nie toleru-
jących aspiryny. Kolejne wyniki wieloośrodkowych badań ugruntowują co-
raz szersze wskazania do stosowania tienopirydyn. Wykazano skuteczność
181

leczenia przeciwpłytkowego tiklopidyną w niestabilnej dusznicy bolesnej, po
przebytym zawale serca, po angioplastyce tętnic wieńcowych wraz ze sten-
towaniem, miażdżycy zarostowej tętnic kończyn dolnych, prewencji wtórnej
udaru niedokrwiennego mózgu oraz w leczeniu antyagregacyjnym w grupie
pacjentów z cukrzycą. Wyniki badania STAMI dotyczące porównania tiklo-
pidyny z kwasem acetylosalicylowym w prewencji wtórnej zawału serca, jak
i badania CAPRIE dotyczące z kolei porównania klopidogrelu z kwasem
acetylosalicylowym, przyniosły zbieżne wyniki. Powyższe badania wykazały
porównywalną do kwasu acetylosalicylowego wartość obu leków, zarówno
w prewencji wtórnej zawału serca, jak i częstości występowania objawów
ubocznych w obserwacji 6-miesięcznej. Ostatnio rozszerzono wskazania do
stosowania tienopirydyn o pacjentów leczonych angioplastyką tętnic wień-
cowych zwłaszcza z założeniem stentu. Na podstawie badań nad leczeniem
antyagregacyjnym pacjentów po angioplastyce tętnic wieńcowych ze stento-
waniem wykazano, że najskuteczniejsze jest skojarzone leczenie kwasem
acetylosalicylowym i tiklopidyną w porównaniu z monoterapią kwasem ace-
tylosalicylowym oraz do połączenia w leczeniu kwasu acetylosalicylowego
i warfaryny. Wnioski takie można było przedstawić po analizie badań doty-
czących tego zagadnienia, takich jak STARS, FANTASTIC, MATTIS, ISAR.
Wyniki tych badań znalazły odbicie w aktualnych zaleceniach American Col-
lege of Chest Physicians i American College of Cardiology. Obecnie prowadzo-
ne są badania CLASSICS dotyczące oceny skuteczności leczenia przeciw-
płytkowego kwasem acetylosalicylowym i klopidogrelem po stentowaniu
tętnic wieńcowych. Prowadzone próby, mające na celu porównanie skutecz-
ności leczenia tiklopidyną lub klopidogrelem w grupie po implantacji stentu,
nie wykazały znamienności statystycznej na korzyść którejś z grup. Obecnie
u pacjentów leczonych pierwotną angioplastyką wieńcową zalecane jest sto-
sowanie klopidogrelu przez 14-30 dni po zawale serca. Powyższe wyniki ba-
dań znajdują uzasadnienie w badaniach podstawowych, bowiem zarówno
kwas acetylosalicylowy, jak i tienopirydyny blokują tylko jeden z mechani-
zmów agregacji płytek i to warunkuje ich ograniczoną skuteczność. Dopiero
połączenie obu leków skutkuje synergistycznym działaniem antyagregacyj-
nym. Wychodząc z tych założeń przeprowadzono badania CURE, które mia-
ło ocenić ryzyko wystąpienia ostrych zespołów wieńcowych i neurologicz-
nych wśród pacjentów z niestabilną dusznicą bolesną bez uniesienia odcinka
ST, leczonych antyagregacyjnie kwasem acetylosalicylowym i/lub klopidogre-
lem. Wyniki badania CURE opublikowane zostały w marcu 2001 roku pod-
czas zjazdu American Heart Association. Wykazano zmniejszenie ryzyka wy-
stąpienia zgonu z przyczyn sercowo-naczyniowych, zawału serca lub udaru
mózgu o prawie 20% w grupie leczonej klopidogrelem i kwasem acetylosali-
182

cylowym, w stosunku do grupy leczonej wyłącznie kwasem acetylosalicylo-
wym, przy znamiennym poziomie istotności statystycznej. Badanie było ran-
domizowane, prowadzone metodą podwójnie ślepej próby i objęło 12 562
pacjentów. Dawka nasycająca leku wynosiła 300 mg, a podtrzymująca 75 mg
dziennie. Obie grupy otrzymały kwas acetylosalicylowy w dawce 75-325 mg
dziennie. Sposób leczenia niestabilnej dusznicy bolesnej u pacjentów włą-
czonych do programu pozostawał do decyzji zespołu leczącego. Zgodnie
z intencją, w badaniu brały udział ośrodki nie ukierunkowane na interwen-
cyjne leczenie niestabilnej dusznicy bolesnej, ponieważ procedury inwazyjne
powodowały przerwanie programu badawczego. Również pacjenci po angio-
plastyce tętnic wieńcowych, pomostowaniu aortalno-wieńcowym oraz lecze-
ni antagonistami receptora GP IIb/IIIa nie byli kwalifikowani do programu
badawczego. Analiza pierwotnych punktów końcowych badania wykazała
częstość ich występowania rzędu 11,5%, w porównaniu z grupą leczoną kwa-
sem acetylosalicylowym i klopidogrelem, w której osiągnięto redukcję czę-
stości występowania rzędu 9,3%.
Skuteczność klopidogrelu daje się obserwować już po 2 godzinach od po-
dania leku i ugruntowuje się w 12-miesięcznej obserwacji. Korzyści z prowa-
dzonego leczenia przedstawiały się następująco: po 9. miesiącach leczenia
klopidogrelem i kwasem acetylosalicylowym uratowano przed zgonem, za-
wałem czy udarem 28 na 1000 leczonych pacjentów. Odsetek przypadków
poważnych krwawień wzrósł z 2,7% w grupie leczonej kwasem acetylosalicy-
lowym, do 3,6 % w grupie leczonej kwasem acetylosalicylowym i klopido-
grelem. Klopidogrel zwiększa ryzyko krwawień zarówno dużych, jak i ma-
łych. Nie obserwowano jednak wystąpienia krwawień do ośrodkowego
układu nerwowego, zaś powikłania krwotoczne nie wymagały interwencji
chirurgicznej czy też stosowania leków inotropowych.
Tak więc wykazano, że klopidogrel zmniejsza ryzyko wystąpienia ostrych
incydentów wieńcowych. W grupie stosującej klopidogrel, obserwowano ten-
dencję do zmniejszenia częstości udarów niedokrwiennych i nie obserwowa-
no zwiększenia częstości udarów krwotocznych. Pozytywne wyniki leczenia
nie były zależne od stopnia ryzyka wystąpienia powikłań sercowo-naczyni-
owych ani od modelu leczenia farmakologicznego. W analizie statystycznej
wykazano korzyści z leczenia klopidogrelem już po upływie pierwszej doby,
co wskazuje na skuteczność zwielokrotnionej pierwszej dawki w szybkim na-
sycaniu podczas rozpoczęcia leczenia. Zastosowany model leczenia anty-
agregacyjnego nie wiązał się z wystąpieniem działań ubocznych, wymagają-
cych przerwania prowadzonego leczenia. Na tej podstawie można sądzić, że
terapia łączona jest tak samo dobrze tolerowana, jak leczenie kwasem acety-
losalicylowym. Przy wszystkich przedstawionych zaletach, istotne ogranicze-
183

nie zastosowania klopidogrelu może stanowić koszt leczenia, który szacuje
się obecnie na równowartość około 3 dolarów za dobę. Decyzja o czasie
trwania leczenia powinna zależeć od analizy indywidualnego zaawansowa-
nia choroby i możliwości finansowych chorego. Coraz powszechniejsze jest
stanowisko, że tylko względy ekonomiczne uniemożliwiają przyjęcie lecze-
nia klopidogrelem w połączeniu z kwasem acetylosalicylowym, jako standar-
du leczenia ostrej niewydolności wieńcowej.
Tak więc, wysoki koszt klopidogrelu może stanowić ograniczenie w dostęp-
ności leku nie tylko w polskich warunkach ekonomicznych. Czy wobec tego
klopidogrel jest rzeczywiście niezastąpionym lekiem antyagregacyjnym? Je-
śli tak, to w jakich sytuacjach klinicznych?
Z pewnością zastosowanie klopidogrelu będzie wskazane, gdy u pacjenta
wymagającego leczenia antyagregacyjnego tiklopidyną wystąpią objawy
uczuleniowe, bądź objawy jej nietolerancji. Jeśli jednak pacjent dobrze to-
leruje leczenie tiklopidyną, to w świetle przeprowadzonych badań, działanie
przeciwpłytkowe tiklopidyny i klopidogrelu jest porównywalne. Analizując
zalety klopidogrelu, zdecydowanie największym jego atutem pozostaje szyb-
kość przemian metabolicznych w organizmie, co skutkuje pełnym efektem
antyagregacyjnym już po godzinie od przyjęcia pierwszej dawki nasycającej
(300 mg). Stwarza to możliwość szybkiego przygotowania pacjenta do an-
gioplastyki tętnic wieńcowych, szczególnie z towarzyszącym stentowaniem.
Jednak leczenie podtrzymujące może być już prowadzone przy zastosowa-
niu tiklopidyny. Postępowanie takie zapewnia zarówno skuteczność, jak
i prawie 10-krotne obniżenie kosztów leczenia.
Czy zatem prowadzenie dwulekowego, intensywnego leczenia antyagrega-
cyjnego jest uzasadnione? Koncepcja ta pomimo przekonujących przesła-
nek patofizjologicznych, nadal nie znajduje pełnej akceptacji wśród klinicy-
stów. Wyniki ostatnio ogłoszonego badania CURE będą stanowić ważny
argument, przemawiający za intensywnym leczeniem antyagregacyjnym pa-
cjentów z niestabilną dusznicą bolesną. Stanowisko takie znalazło odzwier-
ciedlenie w ogłoszonych w marcu 2002 roku zaleceniach AHA odnośnie sto-
sowania klopidogrelu w leczeniu ostrych zespołów wieńcowych. Klopidogrel
jest zalecany, ponieważ ma szybszy początek działania, zwłaszcza po zastoso-
waniu dawki nasycającej oraz ze względu na lepszy profil bezpieczeństwa niż
tiklopidyna.
Kompromisem pomiędzy kosztami a efektywnością prowadzonego lecze-
nia przeciwpłytkowego, będzie jednak zapewne wybór połączenia tiklopidy-
ny z aspiryną.
184

Zapamiętaj!
1. Intensywne leczenie antyagregacyjne poprzez jednoczesne blokowanie AD-
P-zależnej drogi aktywacji płytek oraz poprzez blokowanie cyklooksygenazy
należy do prewencji wtórnej choroby niedokrwiennej serca.
2. Tienopirydyny w połączeniu z kwasem salicylowym to standard leczenia
antyagregacyjnego przed, jak i po zabiegu angioplastyki tętnic wieńcowych,
jak również po angioplastyce ze stentowaniem.
3. Tiklopidyna, aby osiągnąć pełne działanie antyagregacyjne, musi być przyj-
mowana przez 3 do 5 dni, stąd potrzeba wczesnego jej włączenia do lecze-
nia ostrych zespołów wieńcowych równolegle z heparynami drobnoczą-
steczkowymi i kwasem acetylosalicylowym.
4. Klopidogrel rozwija działanie antyagregacyjne już w godzinę od podania,
w przypadku zastosowania dawki nasycającej leku (300 mg = 4 tabl.)
5. Najgroźniejszym działaniem ubocznym stosowania tienopirydyn jest neu-
tropenia i z tego powodu należy monitorować morfologię i poziom płytek
krwi.
Polecane lektury:
ACC/AHA Practice Guidelines Update: Unstable Angina and Non-ST-S-
egment Elevation Myocardial Infarction; http: //www. acc. org/clinical/sta-
tements. htm
S. Yusuf i wsp.: Clopidogrel in Unstable Angina To Prevent Reccurent Events
(CURE); NEJM, 2001, 345: 494-502.
Fifth American College of Chest Phisicians Consensus Conference on Antith-
rombotic Therapy; Chest, 1998, 114: 4395-769S.
185

XV.
LEKI FIBRYNOLITYCZNE – CZY WSZYSTKO
JUŻ WIEMY?
Włodzimierz Gierlak, Agnieszka Domagała, Katarzyna Sadkowska,
Marek Kuch
Najstarszym znanym fibrynolitykiem jest urokinaza, wyizolowana z mo-
czu, odkryta już w 1861 roku. W latach trzydziestych ubiegłego wieku ustalo-
no, że paciorkowce
β-hemolizujące z grupy C produkują substancję fibryno-
lityczną. Badania te prowadzone przez Williama Tilleta doprowadziły do
odkrycia streptokinazy. W 1958 roku Fletcher i wsp. jako pierwsi opisali za-
stosowanie streptokinazy w świeżym zawale serca. Prace nad odkryciem
tkankowego aktywatora plazminogenu pochodzą jeszcze z lat czterdziestych,
zaś czysta substancja została zsyntetyzowana drogą rekombinacji genetycznej
w 1983 roku. Za pionierów leczenia fibrynolitycznego uznani są Chazow
i Rentrop, którzy na początku lat 70-tych udowodnili reperfuzję w ostrym
okresie zawału serca, po podaniu streptokinazy. W Polsce pierwsze przypad-
ki leczenia fibrynolitycznego opisane zostały przez Łopaciuka w 1966 roku.
Podstawy teoretyczne leczenia fibrynolitycznego zostały potwierdzone
i ugruntowane przez De Wooda i wsp., który na podstawie wykonanych ko-
ronarografii wykazał, że w ponad 85% przypadków za wystąpienie zawału
serca odpowiada zakrzep tętnicy wieńcowej. W połowie przypadków zakrzep
zbudowany jest z fibryny i erytrocytów, około 1/3 zakrzepów to zakrzepy
mieszane zbudowane również z agregujących płytek krwi, zaś 1/5 zakrzepów
prowadzących do zawału serca, to zakrzepy płytkowe. Pierwszymi badaniami
wieloośrodkowymi nad skutecznością leczenia fibrynolitycznego w świeżym
zawale serca były badania GISSI oraz ISIS-2, w których wykazano 25% re-
dukcję śmiertelności w grupie leczonej streptokinazą w porównaniu do gru-
py leczonej placebo.
Do grupy leków o działaniu fibrynolitycznym, możemy zaliczyć streptoki-
nazę, APSAC, urokinazę, prourokinazę (saruplazę), tkankowy aktywator
plazminogenu oraz jego pochodne (reteplaza, tenekteplaza, lanoteplaza).
Spośród wymienionych omówione zostaną streptokinaza, APSAC i grupa
tkankowego aktywatora plazminogenu.
STREPTOKINAZA
Streptokinaza jest białkiem produkowanym przez paciorkowce
β-hemolizu-
jące grupy C. Streptokinaza jest zewnątrzpochodnym aktywatorem plazmi-
nogenu. Działanie streptokinazy polega na tworzeniu kompleksu z plazmi-
nogenem, co powoduje odsłonięcie jego aktywnej struktury. Kompleks ten
186
powoduje aktywację pozostałych cząsteczek plazminogenu, przekształcając
je w plazminę. Streptokinaza aktywuje plazminogen związany z fibryną, jak
i plazminogen osoczowy. W konsekwencji dochodzi do lizy włóknika w za-
krzepie, jak również do działania plazminy na niezwiązany fibrynogen oraz
na czynniki V i VIII. Okres półtrwania leku wynosi około 23-30 minut.
Streptokinaza może wywoływać hipotonię w wyniku aktywacji kalikreiny
i wyzwalania bradykininy. Częstość występowania hipotonii może dochodzić
do 5%. Streptokinaza jako białko paciorkowcowe stanowi antygen i może
wyzwalać reakcje alergiczne. W pierwszych dużych badaniach nad streptoki-
nazą (ISIS-2) łagodne reakcje alergiczne występowały u 4,4% leczonych,
w porównaniu do 0,9% w grupie placebo. Przypadki wstrząsu anafilaktycz-
nego występują z częstością poniżej 0,5%. Po podaniu streptokinazy nara-
sta odpowiedź immunologiczna, ze szczytem produkcji przeciwciał już od
7. dnia po podaniu leku. Przeciwciała utrzymują się przez 6-9 miesięcy. Stąd
konieczność stosowania innych niż streptokinaza fibrynolityków, w przypad-
ku wczesnego dorzutu zawału serca.
187
Rycina 1: Schemat aktywacji układu fibrynolizy

ANISTREPLAZA (APSAC)
Lek ten stanowi połączenie streptokinazy z jedną z form plazminogenu
(Lys-plasminogen). Kompleks o tego typu budowie jest bezpośrednim akty-
watorem plazminogenu. APSAC wywołuje stan uogólnionej fibrynolizy, ze
spadkiem poziomu fibrynogenu do 20-40% wartości wyjściowej. Jako sub-
stancja pochodzenia białkowego, również posiada właściwości antygenu
i może dawać reakcje alergiczne. Poprzez wytworzenie kompleksu streptoki-
nazy i plazminogenu uzyskano wydłużenie okresu półtrwania we krwi do 70-
100 minut, co pozwala na stosowanie leku w postaci bolusu dożylnego.
TKANKOWY AKTYWATOR PLAZMINOGENU
Tkankowy aktywator plazminogenu (t-PA) jest obecnie najlepszym do-
stępnym środkiem fibrynolitycznym, ponieważ przywraca przepływ w tętni-
cach wieńcowych szybciej i częściej niż inne leki z tej grupy, co zostało wyka-
zane w badaniach GUSTO I. Naturalny t-PA jest enzymem proteolitycznym
o strukturze jednołańcuchowego polipeptydu. Tkankowy aktywator plazmi-
nogenu, w przeciwieństwie do streptokinazy, nie wykazuje powinowactwa
do krążącego plazminogenu, posiada natomiast duże powinowactwo do fi-
bryny wchodzącej w skład zakrzepu. Do reakcji pomiędzy t-PA i plazminoge-
nem dochodzi w obecności włóknika, wobec czego przekształcenie plazmi-
nogenu w plazminę odbywa się głównie na powstałych zakrzepach.
W konsekwencji po podaniu t-PA nie dochodzi do uogólnionej fibrynolizy.
Okres półtrwania leku w surowicy wynosi 5-7 minut. Nie ma on właściwości
antygenu i nie wywołuje reakcji alergicznych. Spośród stosowanych leków
fibrynolitycznych tkankowy aktywator plazminogenu charakteryzuje się naj-
wyższym odsetkiem udrożnień dozawałowych tętnic wieńcowych (85%). Wy-
niki badań GUSTO dowodzą, że stosowanie tkankowego aktywatora pla-
zminogenu powoduje największą redukcję śmiertelności.
REKOMBINOWANY AKTYWATOR PLAZMINOGENU
Rekombinowany aktywator plazminogenu (r-PA) jest pochodną t-PA uzy-
skiwaną metodami inżynierii genetycznej z komórek Escherichia Coli, po-
wstałą poprzez usunięcie 3 specyficznych domen tego białka. Głównymi za-
letami r-PA jest bezpośrednia aktywacja plazminogenu, w obszarach
w których doszło do związania z włóknikiem, jak również brak reakcji aler-
gicznych.
Wydaje się, że po kilkunastu latach badań nad kolejnymi lekami fibrynoli-
tycznymi można ocenić, że leki te umożliwiają całkowitą reperfuzję (TIMI 3)
188

u około 50% chorych, przy 10% odsetku ponownych reokluzji udrożnionych
naczyń, ostatecznie obniżając śmiertelność szpitalną wśród chorych ze świe-
żym zawałem serca o 25-33%. Obecnie celem leczenia pozostaje zwiększenie
skuteczności reperfuzji przy zmniejszeniu ryzyka powikłań krwotocznych.
Badane w ostatnich latach połączenie streptokinazy oraz antagonisty recep-
tora płytkowego GP IIb/IIIa, było szczególnie obciążone ryzykiem powikłań
krwotocznych. Stąd powstały przesłanki do badań nad leczeniem przy sto-
sowaniu zmniejszonej dawki fibrynolityków nowej generacji z pełną dawką
inhibitora GP IIb/IIIa. Najpierw przeprowadzono badania pilotażowe
SPEED, a następnie badania GUSTO V.
W badaniu GUSTO V brało udział 16 588 osób ze świeżym zawałem ser-
ca do 6 godzin od początku objawów, których randomizowano do leczenia
pełną dawką reteplazy lub połączeniem połowy dawki reteplazy i abcixima-
bu. Nie wykazano zmniejszenia śmiertelności 30-dniowej po zastosowaniu
terapii łączonej (reteplaza: 5,9% vs reteplaza + abciximab: 5,6 %). Uzyska-
no natomiast znamienną statystycznie redukcję złożonego punktu końcowe-
go (zgon, dorzut zawału serca, pilne PTCA: 20,6% vs 16,2%, p<0,0001), co
świadczy o rzadszym występowaniu wczesnych restenoz. Jednocześnie wy-
kazano, że ryzyko wystąpienia powikłań krwotocznych rośnie po 75-roku ży-
cia i dotyczy głównie krwawień do przewodu pokarmowego. Jedno z ostat-
nich opublikowanych badań wieloośrodkowych nad fibrynolitykami dotyczy
skuteczności stosowania tenekteplazy, badanie to znane jest pod akronimem
ASSENT-3. Do badania włączono 6095 pacjentów, leczonych w jednym
z trzech ramion programu: (1) pełną dawką fibrynolityku z hepryną niefrak-
cjonowaną, (2) pełną dawką fibrynolityku w połączeniu z heparyną drobno-
cząsteczkową oraz (3) połową dawki fibrynolityku z pełną dawką inhibitora
IIb/IIIa i zredukowaną dawką heparyny. Wykazano korzyść w grupach z le-
czeniem łączonym, w odniesieniu do klasycznej terapii fibrynolitycznej, od-
powiednio 11,4% vs 11,1% vs 15,4%, przy istotnej redukcji wczesnych incy-
dentów niedokrwiennych.
LECZENIE ŚWIEŻEGO ZAWAŁU SERCA
Obecnie według aktualnych zaleceń AHA/ESC zalecaną metodą leczenia
świeżego zawału serca jest pierwotna angioplastyka tętnic wieńcowych
(PCI). Największą zaletą PCI w zawale serca jest jej wysoka skuteczność
w przywracaniu drożności tętnicy dozawałowej sięgająca 80-97%. Gdy nie
możemy jednak zapewnić choremu szybkiego transportu do pracowni he-
modynamicznej, postępowaniem z wyboru nadal pozostaje leczenie fibryno-
lityczne. Badania prowadzone nad skutecznością leczenia świeżego zawału
189
serca dowodzą, że decydującą rolę odgrywa czas od momentu zamknięcia
tętnicy wieńcowej do uzyskania reperfuzji, bez względu na to, jaka metoda
udrożnienia tętnicy zostanie zastosowana. Analiza statystyczna właśnie opu-
blikowanych wyników badania PRAGUE-2 (CAPTIM, DANAMI-II, AIR
PAMI) wskazuje, że lepsze rezultaty leczenia można uzyskać rozpoczynając
leczenie fibrynolityczne w okresie przedszpitalnym, niż angioplastyką po
okresie odroczonego transportu. Kontynuacją tego toru myślenia jest obec-
nie dyskutowane zagadnienie angioplastyki torowanej, tj. leczenie małymi
dawkami fibrynolizy mające na celu wczesną reperfuzję, poprzedzające wy-
konanie pierwotnej angioplastyki tętnic wieńcowych (tab. 1).
Obecnie kryteria czasowe rozpoczęcia leczenia fibrynolitycznego przed-
stawiają się następująco: zalecane jest jak najwcześniejsze rozpoczęcie fibry-
nolizy, nawet w 30 minut od wystąpienia objawów zawału mięśnia sercowe-
go. Standardowo leczenie fibrynolityczne zalecane jest do 6 godzin od
rozpoczęcia bólu zawałowego. W przedziale pomiędzy 7. a 12. godziną zawa-
łu tromboliza zalecana jest dla pacjentów z utrzymującym się bólem zawało-
wym oraz obecnym uniesieniem odcinka ST. Powyżej 12. godziny od rozpo-
częcia zawału leczenie fibrynolityczne nie jest zalecane, ze względu na
obserwowany w badaniach klinicznych wzrost śmiertelności w grupie późnej
trombolizy (GISSI 1, ISIS 2), jak się wydaje na skutek pęknięcia mięśnia ser-
cowego w miejscu uszkodzenia spowodowanego przez reperfuzję (tab. 2).
190
Tabela 1: Kwalifikacja do leczenia fibrynolitycznego
• potwierdzenie świeżego zawału;
• czas od wystąpienia zawału;
• ocena ryzyka zgonu;
• rozważenie przeciwwskazań do fibrynolizy.
Tabela 2: Potwierdzenie zawału serca
• ból wieńcowy trwający
≥ 30 minut;
• w zapisie EKG:
- uniesienie odcinka ST co najmniej o 0,1 mV,
- lokalizacja zmian w dwóch (lub więcej) sąsiednich
odprowadzeniach,
LUB
- świeży blok lewej odnogi pęczka Hisa.
Nie zaleca się wdrażania leczenia fibrynolitycznego u pacjentów bez zmian
w zapisie EKG oraz przy obecności w EKG jedynie obniżeń odcinka ST.
Z kolei w przypadku wstrząsu kardiogennego w przebiegu świeżego zawału
serca, jakkolwiek leczenie fibrynolityczne ma uzasadnienie patofizjologicz-
ne, to postępowaniem z wyboru jest PCI. Prowadzone obecnie badania
TACTICS oraz SHOCK posłużą porównaniu wyników leczenia fibrynoli-
tycznego, plastyki naczyń wieńcowych lub pomostowania naczyń wieńcowych
ze wskazań nagłych.
W przypadku przeciwwskazań względnych do fibrynolizy każdorazowo wy-
magana jest ocena ryzyka oraz możliwych korzyści leczenia (tab. 3, 4).
191
Tabela 3: Przeciwwskazania bezwzględne do leczenia trombolitycznego
• rozwarstwienie aorty;
• ostre zapalenie osierdzia;
• czynne krwawienie;
• przebyty krwotok śródczaszkowy;
• nowotwór mózgu.
Tabela 4: Przeciwwskazania względne do leczenia trombolitycznego
• okres do 6 miesięcy od krwawienia z przewodu pokarmowego, dróg
moczowych, narządu rodnego, po udarze niedokrwiennym mózgu;
• okres 2-4 tygodni po dużym zabiegu operacyjnym;
• po reanimacji;
• po nakłuciu naczynia nie poddającego się uciskowi;
• nie kontrolowane nadciśnienie tętnicze >180/100 mm Hg;
• skaza krwotoczna, niewydolność wątroby, nowotwór złośliwy;
• w okresie ciąży.

DAWKOWANIE FIBRYNOLITYKÓW W OSTRYM ZAWALE SERCA
PORÓWNANIE WYBRANYCH LEKÓW FIBRYNOLITYCZNYCH
Na podstawie wyników badań wieloośrodkowych dotyczących stosowania
leków fibrynolitycznych ustalono, że rt-PA ma przewagę nad streptokinazą
w następujących sytuacjach klinicznych: zaleca się stosowanie rt-PA u cho-
rych poniżej 75. roku życia, z bólem zawałowym trwającym krócej niż 4 go-
dziny, z zawałem ściany przedniej lub ściany dolnej z zaburzeniami hemo-
dynamicznymi, niewydolnością prawej komory, po przebytej infekcji
paciorkowcowej, wymagających ponownego podania fibrynolizy (pomiędzy
4. dobą a 6. miesiącem od leczenia streptokinazą) oraz uczulonych na strep-
tokinazę (tab. 6).
Natomiast korzystniejsze wyniki leczenia streptokinazą uzyskano wśród
pacjentów: powyżej 75. roku życia, z bólem zawałowym trwającym powyżej
6 godzin, ze zwiększonym ryzykiem udaru mózgu, małym obszarem uszko-
dzenia oraz we wstrząsie kardiogennym (tab. 6).
Osobnym zagadnieniem pozostaje utrzymanie drożności naczynia wień-
cowego po uzyskaniu reperfuzji w wyniku leczenia fibrynolitycznego. Sądząc
z przesłanek patofizjologicznych wskazane jest stosowanie heparyny, ze
wskazaniem na heparyny drobnocząsteczkowe. Aktualne zalecenia ustalo-
ne na podstawie dużych badań klinicznych, takich jak GISSI 2, ISIS 3 oraz
GUSTO I przedstawiają się następująco: heparyna w połączeniu ze strepto-
kinazą może być podawana drogą podskórną lub dożylną, natomiast nie
wpływa to na częstość wczesnej reperfuzji tętnic wieńcowych oraz reokluzji
po stosowaniu streptokinazy. Na podstawie danych z badania DUCCS wyka-
192
Tabela 5: Dawkowanie wybranych leków fibrynolitycznych
LEK
DAWKA I SPOSÓB STOSOWANIA
STREPTOKINAZA
1,5 mln. j. we wlewie dożylnym w ciągu godziny;
rt-PA
wlew dożylny przez 90 minut:
- dawka nasycająca 15 mg,
- następnie 0,75 mg/kg m.c. przez 30 minut,
- oraz 0,5 mg/kg m.c. przez 60 minut;
APSAC
30 j. dożylnie w ciągu 5 minut;
r-PA (reteplaza)
10 j. dożylnie dwie dawki co 30 minut;

zano, że nie stosuje się leczenia heparyną po leczeniu trombolitycznym AP-
SAC ze względu na podwyższoną częstość powikłań krwotocznych. Nato-
miast wyniki badania klinicznego HART przekonują, że leczeniu tromboli-
tycznemu przy użyciu t-PA, powinna towarzyszyć skuteczna terapia heparyną
przez okres 48 godzin.
DAWKOWANIE FIBRYNOLITYKÓW W ZATOROWOŚCI PŁUCNEJ
Kolejne wskazanie do fibrynolizy to masywna zatorowość płucna. Leki fi-
brynolityczne powinny być stosowane w leczeniu zatoru tętnicy płucnej, gdy
incydent zatorowy przebiega z towarzyszącym wstrząsem lub ze znaczną hi-
potensją. Leki te szybciej niż heparyny prowadzą do udrożnienia łożyska na-
czyń płucnych i obniżenia oporu w tętnicy płucnej. U osób z zatorem tętnicy
płucnej powikłanym nagłym zatrzymaniem krążenia i oddechu, hospitalizo-
wanych w warunkach intensywnego nadzoru, możliwe jest prowadzenie lecze-
nia fibrynolitycznego równolegle z resuscytacją. Zwykle leczenie rozpoczyna
się podając 100 mg rt-PA w ciągu 2 godzin. Równoważnym postępowaniem
jest podanie streptokinazy w dawce 1,5 mln jednostek w ciągu 2 godzin. Po
zakończeniu fibrynolizy należy rozpocząć wlew heparyny w dawce 1000 jed-
nostek/godzinę. W przypadku masywnego zatoru tętnicy płucnej wymagają-
cego resuscytacji, należy prowadzić leczenie trombolityczne podając bolus
rt-PA (50 mg w ciągu 10 minut). Leczenie bolusem rt-PA jest teoretycznie
korzystniejsze niż wlewem streptokinazy, bowiem stwarza możliwość szyb-
szego obniżenia oporu płucnego. Jak dotąd nie wykazano redukcji śmiertel-
193
Tabela 6: Porównanie wskazań do stosowania aktywatorów plazminogenu i streptokinazy
t-PA/r-PA
STREPTOKINAZA
chory poniżej 75. r.ż.;
chory powyżej 75 r.ż.;
ból zawałowy krótszy niż 4 godziny; ból zawałowy dłuższy niż 6 godz.;
zawał ściany przedniej lub ściany
dolnej z zaburzeniami
hemodynamicznymi;
przy małym obszarze uszkodzenia;
przebyta infekcja paciorkowcowa;
zwiększone ryzyko udaru mózgu;
ponowna fibrynoliza;
wstrząs kardiogenny;
uczulenie na streptokinazę;

ności w masywnej zatorowości płucnej pod wpływem leczenia fibrynolitycz-
nego. Natomiast na podstawie wyników badania PAIMS 2 wykazano, że sto-
sowanie trombolizy w mniej nasilonych postaciach zatorowości płucnej jest
niewskazane, ze względu na istotnie wyższą częstość występowania powikłań
krwotocznych (10%), przy wynikach leczenia porównywalnych z grupą otrzy-
mującą heparynę.
DAWKOWANIE FIBRYNOLITYKÓW W ZAKRZEPICY
ŻYŁ GŁĘBOKICH
Ostatnim wskazaniem do wdrożenia leczenia fibrynolitycznego jest zakrze-
pica żył głębokich kończyn dolnych u osób ze świeżą, zlokalizowaną proksy-
malnie zakrzepicą, zwłaszcza gdy istnieje ryzyko martwicy kończyny (phleg-
masia cerulea dolens) i występują przeciwwskazania do trombektomii żylnej.
Leczenie fibrynolityczne można wdrożyć do 14 dni od wystąpienia pierw-
szych objawów zakrzepicy żył głębokich.
Streptokinaza we wlewie ciągłym, wlew kontynuowany do kilku dni. Daw-
ka wstępna 250 tys. jednostek w 100 ml 5% glukozy w czasie 30-60 minut,
następnie 100 tys. jednostek/godzinę.
rt-PA można podawać w dawce 0,5 mg/kg m. c. przez 8 godzin. Dawkę
można powtórzyć po 24 godzinach.
Konieczne jest prowadzenie kontroli skuteczności leczenia fibrynolitycz-
nego. Wystarczające jest jednorazowe wydłużenie APTT o 10 sekund powy-
żej górnej granicy normy. Po zakończeniu leczenia fibrynolitycznego należy
rozpocząć leczenie heparynami.
Podejmując decyzję o rozpoczęciu leczenia fibrynolitycznego, należy roz-
ważyć stopień ryzyka wystąpienia powikłań krwotocznych. U chorych we
wstrząsie lub z nagłym zatrzymaniem krążenia i oddychania, uzasadnione
jest podanie fibrynolizy, nawet w przypadku występowania względnych prze-
ciwwskazań do takiego leczenia.
POSTĘPOWANIE W PRZYPADKU POWIKŁAŃ FIBRYNOLIZY
Najczęstsze powikłania fibrynolizy to powikłania krwotoczne, występują
bowiem w 7-10 % przypadków stosowania streptokinazy. Często dochodzi
do krwawień z miejsc wkłucia i miejsc po iniekcjach domięśniowych. Takie
drobne krwawienia zaopatruje się miejscowym uciskiem. Poważniejsze powi-
kłania stanowią krwawienia z przewodu pokarmowego oraz do ośrodkowe-
go układu nerwowego. W takiej sytuacji mogą być konieczne przetoczenia
masy erytrocytarnej, osocza świeżo mrożonego (FFP) lub krioprecypitatu.
194

Odwrócenie działania fibrynolityków można osiągnąć podając wlew dożyl-
ny kwasu traneksamowego w dawce 10 mg/kg m. c., należy jednak pamiętać
o rosnącym zagrożeniu powikłaniami zakrzepowymi.
Zapamiętaj!
1. Leczenie trombolityczne świeżego zawału serca: zastosowanie ewoluuje
w kierunku stosowania zmniejszonych dawek fibrynolityków w połączeniu
z inhibitorami receptora GP IIb/IIIa oraz fibrynolizy przedszpitalnej, jako
przygotowania do pierwotnej angioplastyki tętnic wieńcowych – tzw. angio-
plastyki torowanej.
2. Leczenie trombolityczne masywnej zatorowości płucnej.
3. Leczenie proksymalnej zakrzepicy żył głębokich w przypadkach nieopera-
cyjnych.
4. Wszystko to za cenę kilkunastogodzinnego okresu uogólnionej lizy i w kon-
sekwencji podwyższonego ryzyka powikłań krwotocznych (krwotoki do cen-
tralnego układu nerwowego oraz krwawienia z przewodu pokarmowego –
analiza przeciwwskazań).
5. Streptokinaza i pochodne są substancjami białkowymi, z czego wynikają
działania antygenowe – w odróżnieniu od pochodnych tkankowego akty-
watora plazminogenu.
6. 10 razy wyższy koszt leczenia tkankowym aktywatorem plazminogenu niż
streptokinazą.
Polecane lektury:
A. Łopaciuk: Zakrzepy i zatory; PZWL, 2000.
G. Opolski: Leczenie trombolityczne w świeżym zawale serca; Alfa-Medica
Press, Bielsko-Biała, 1994.
The GUSTO Angiographic Investigators: The effects of tissue plasminogen
activator, streptokinase, or both on coronary artery patency, ventricular func-
tion, and survival after acute myocardial infarction; N Engl J Med, 1993,
329: 1615-22.
The GUSTO IIb Angioplasty Substudy Investigators: A clinical trial com-
paring primary coronary angioplasty with tissue plasminogen activator for
acute myocardial infarction; N Engl J Med, 1997, 336: 1621-8.
195

The ASSENT 3 Investigators: Efficacy and safety of tenecteplase in combina-
tion with enoxaparin, abciximab, or unfractionated heparin: the ASSENT-3
randomised trial in acute myocardial infarction; Lancet, 2001, 358: 605-13.
The GUSTO V Investigators: Reperfusion therapy for acute myocardial in-
farction with fibrinolytic therapy or combination reduced fibrinolytic therapy
and platelet glycoprotein IIb/IIIa inhibition: the GUSTO V randomised trial;
Lancet, 2001, 357: 1905-14.
196

XVI. HEPARYNA NIEFRAKCJONOWANA I HEPARYNY
DROBNOCZĄSTECZKOWE
Włodzimierz Gierlak, Agnieszka Domagała, Katarzyna Sadkowska,
Marek Kuch
Publikowane dane epidemiologiczne wskazują na stały wzrost występowa-
nia chorób naczyniowych, przebiegających z wytworzeniem skrzepliny, za-
równo w naczyniach tętniczych, jak i żylnych. Od lat lekiem z wyboru pozo-
staje heparyna niefrakcjonowana, ostatnio wypierana przez dogodniejsze
w użyciu i bezpieczniejsze heparyny drobnocząsteczkowe. Wyniki badań kli-
nicznych potwierdziły skuteczność heparyn w leczeniu:
• choroby wieńcowej w jej zaawansowanych postaciach oraz przy proce-
durach kardiologii interwencyjnej;
• zatorowości płucnej;
• zakrzepicy żył głębokich;
• profilaktyce pierwotnej i wtórnej żylnej choroby zakrzepowo-zatorowej.
197
Tabela 1: Lecznicze i zapobiegawcze wskazania do stosowania heparyny
WSKAZANIA DO STOSOWANIA HEPARYNY
LECZNICZO
• zakrzepy i zatory tętnicze;
• zatorowość płucna;
• żylna choroba zakrzepowo-zatorowa;
• trombofilia;
ZAPOBIEGAWCZO
• okres okołooperacyjny;
• długotrwałe unieruchomienie;
• po dużych zabiegach chirurgicznych;
• po zabiegach naczyniowych;
• w urazach wielonarządowych;
• po masywnych przetoczeniach krwi;
• w wykrzepianiu wewnątrznaczyniowym;
• zapobieganie zakrzepom w cewnikach;
• podczas angioplastyki tętnic wieńcowych;

HEPARYNA NIEFRAKCJONOWANA (UFH)
Heparyna niefrakcjonowana to mieszanina łańcuchów glikozaminoglika-
nowych o średniej masie cząsteczkowej od 12 do 15 tysięcy daltonów. Głów-
ny mechanizm działania heparyny opiera się na łączeniu z antytrombiną III
– co prowadzi do zmiany jej konformacji; antytrombina III w zmienionej
konformacji bardzo aktywnie łączy się z trombiną, prowadząc do jej unie-
czynnienia. Heparyna hamuje również działanie innych osoczowych czynni-
ków krzepnięcia. Cząsteczki heparyny standardowej są długie (składają się
z ponad 18 jednostek cukrowych) i poprzez łączenie z antytrombiną inakty-
wują w równym stopniu trombinę, jak i czynnik X (stosunek aktywności an-
ty IIa do anty Xa wynosi jak 1: 1). Należy jednak zaznaczyć, że heparyna nie
wpływa na czynnik X związany z płytkami już tworzącymi skrzeplinę; aktyw-
ny czynnik X może nasilać aktywację trombiny, a w konsekwencji powsta-
wanie fibryny i zwiększanie skrzepliny. Poprzez inaktywację trombiny hepa-
ryna standardowa hamuje zależną od trombiny agregację płytek oraz
powstawanie fibryny, zapobiegając w ten sposób dalszemu rozwojowi istnie-
jącej skrzepliny.
Warto również prześledzić, jakie ograniczenia mogą być związane ze stoso-
waniem heparyny standardowej? Heparyna wiąże się silnie z białkami oso-
cza (fibrynogenem itd.) i komórkami śródbłonka – co oznacza, że najpierw
musi wysycić białka osocza, aby dopiero później połączyć się z antytrombiną
i rozpocząć swe działanie. Biodostępność ocenia się na około 30%. Uważa
się, że nawet po podaniu dawki wstępnej w postaci bolusu, stężenie hepary-
ny w osoczu ustala się dopiero po 4-6 godzinach od rozpoczęcia ciągłego
wlewu dożylnego. Heparyna jest metabolizowana w wątrobie, eliminacja za-
chodzi drogą nerkową. Okres półtrwania wydłuża się ze wzrostem dawki
i wynosi 0,5-2 godziny. Właściwości farmakokinetyczne powodują, że trudno
jest przewidzieć siłę działania heparyny (dodatkowo są one osobniczo
zmienne) i dlatego konieczne jest systematyczne monitorowanie czasu ka-
olinowo-kefalinowego (APTT) dla ustalenia optymalnego dawkowania le-
ku. Ponadto efekt przeciwzakrzepowy heparyn polega na wiązaniu się ze
śródbłonkiem naczyń i uwalnianiu inhibitora czynnika tkankowego (TFPI,
tissue factor plasma inhibitor). Heparyny zapobiegają dalszemu tworzeniu
włóknika, umożliwiając jednocześnie endogennemu układowi fibrynolitycz-
nemu hydrolizę skrzepu. Działania niepożądane obejmują m.in. krwawie-
nia, małopłytkowość poheparynową, która może prowadzić do niebezpiecz-
nej zakrzepicy, ponowną aktywację procesu zakrzepowego w kilka godzin
po przerwaniu leczenia. Ponadto, u niektórych osób występuje oporność na
heparynę, która może wynikać z niskiego stężenia ATIII lub wysokiego stę-
198

żenia substancji wiążących heparynę w osoczu. Przy długotrwałym stosowa-
niu heparyna zwiększa ryzyko osteoporozy.
HEPARYNA – DZIAŁANIA UBOCZNE
• powikłania krwotoczne;
• małopłytkowość poheparynowa;
• paradoksalna zakrzepica;
• krwotoczna martwica nadnerczy;
• wpływ heparyny na obniżenie masy kostnej;
• martwica skóry w miejscu wstrzyknięcia;
• hipoaldosteronizm;
• reakcja nadwrażliwości.
Heparynę podaje się zwykle najpierw w dawce nasycającej w szybkim wle-
wie dożylnym, a następnie w ciągłym wlewie lub kolejnych wstrzyknięciach
pod kontrolą APTT (do wydłużenia APTT 1,5-2,5 razy). APTT powinno się
oznaczyć po upływie 6 godzin od podania bolusu. W razie masywnego krwa-
wienia heparynę należy odstawić i podać odpowiednią dawkę siarczanu pro-
taminy; z uwagi na krótki czas półtrwania heparyny standardowej należy
199
Tabela 2: Przeciwwskazania do stosowania heparyny
• aktualne krwawienie;
• czynna choroba wrzodowa żołądka i dwunastnicy;
• żylaki przełyku;
• wrzodziejące zapalenie jelita grubego;
• czynna gruźlica płuc;
• nowotwory:
- przewodu pokarmowego,
- układu oddechowego,
- układu moczowo-płciowego,
- ośrodkowego układu nerwowego (OUN);
• skazy krwotoczne (poza DIC);
• krwotoki do OUN;
• stan po udarze mózgu;
• nadwrażliwość na lek.

neutralizować dawkę podaną w ciągu ostatnich kilku godzin (1 mg siarczanu
protaminy neutralizuje 100 j. m. heparyny). Pacjent wymaga również przeto-
czenia masy erytrocytarnej oraz wyrównania niedoborów wodno-elektrolito-
wych. Małe krwawienia (z miejsca wkłucia) wymagają zwykle jedynie korek-
ty dawkowania heparyny.
Z powyższych względów rozpoczęto poszukiwanie nowych leków, które
zapewniając profil działania heparyny standardowej, byłyby wygodniejsze
w użyciu.
HEPARYNY DROBNOCZĄSTECZKOWE
Heparyny drobnocząsteczkowe (low molecular weight heparin – LMWH)
to sole heterogennych siarczanów glikozaminoglikanów o średniej masie
cząsteczkowej mniejszej niż 8000 daltonów. Uzyskiwane są w procesie de-
polimeryzacji heparyny standardowej. Działanie heparyny drobnocząstecz-
kowej polega również na łączeniu się z antytrombiną III (poprzez specjalną
jednostkę pentasacharydową) i dalszym przyłączaniu się tego kompleksu do
białek kaskady krzepnięcia (IIa, IXa, Xa, XIIa), co doprowadza do ich unie-
czynnienia. Cząsteczki o długości mniejszej niż 18 jednostek cukrowych (a
zatem takie, jakie w dużej ilości znajdują się w preparatach heparyn drob-
nocząsteczkowych) nie unieczynniają trombiny tak sprawnie, jak długie czą-
steczki heparyny standardowej. Możliwa jest jednak inaktywacja czynnika X
dzięki krótkim łańcuchom i dlatego działanie heparyny standardowej (UFH)
i LMWH na czynnik X jest porównywalne. W związku z kaskadowym działa-
niem układu krzepnięcia zahamowanie niewielkiej ilości czynnika Xa zapo-
biega wytwarzaniu znacznie większej ilości trombiny. Stosunek aktywności
anty-Xa do aktywności anty-IIa wynosi dla heparyn drobnocząsteczkowych
od 2 do 4:1 – jest to cecha różnicująca poszczególne heparyny drobnoczą-
steczkowe. Co niezwykle istotne, heparyny drobnocząsteczkowe (w odróż-
nieniu do heparyny standardowej) działają na czynnik Xa związany z płyt-
200
Tabela 3: Ograniczenia w stosowaniu heparyny standardowej
• powolny początek działania;
• niemożność przewidzenia siły działania u danego chorego;
• konieczność częstego monitorowania APTT;
• konieczność hospitalizacji przy podawaniu dożylnym;
• działania niepożądane.

kami krwi i doprowadzają do jego inaktywacji – działają zatem silniej prze-
ciwzakrzepowo od heparyny standardowej. Inny mechanizm działania hepa-
ryn (tak standardowej, jak i drobnocząsteczkowych) polega na uwalnianiu
inhibitora czynników szlaku tkankowego (TPFI). TPFI uwalniany ze śród-
błonka pod wpływem heparyn hamuje kompleks czynnika tkankowego
i czynnika VIIa oraz czynnik Xa. Co ciekawe Bendz i współpracownicy wy-
kazali, że podawanie heparyny standardowej zmniejsza stężenie wolnego
TPFI o wiele bardziej, niż stosowanie LMWH. Okres półtrwania LMWH
jest 2-4 razy dłuższy niż UFH, co powoduje, że można je podawać rzadziej
(wynosi 4-6 godzin, jest nieco krótszy po podaniu dożylnym). Biodostępność
LMWH podawanych podskórnie jest wysoka i wynosi około 90%. Uważa
się, że wynika to ze słabego wiązania z białkami osocza. Eliminacja heparyn
drobnocząsteczkowych zachodzi drogą nerkową – stąd też należy modyfiko-
wać ich dawkowanie u osób z niewydolnością nerek. Przy stosowaniu
LMWH nie stosuje się zwykle żadnego monitorowania, choć u pacjentów
z grupy wysokiego ryzyka powikłań krwotocznych wskazane jest oznaczenie
aktywności anty-Xa. Okazuje się również, że LMWH w mniejszym stopniu
hamują płytki, jak również rzadziej wywołują małopłytkowość poheparyno-
wą (HIT).
Na polskim rynku obecne są cztery preparaty heparyn drobnocząsteczko-
wych:
• dalteparyna;
• enoksaparyna;
• nadroparyna;
• rewiparyna.
201
Tabela 4: Zalety heparyn drobnocząsteczkowych w porównaniu z heparyną standardową
• dłuższy okres półtrwania pozwalający na ich podawanie
1-2 razy na dobę;
• większa dostępność biologiczna;
• większa łatwość w dobieraniu dawki (w zależności
od masy chorego);
• brak konieczności monitorowania leczenia;
• mniejsza częstość poważnych powikłań krwotocznych.

ZASTOSOWANIE HEPARYN W OSTRYCH
ZESPOŁACH WIEŃCOWYCH
W patogenezie ostrych incydentów wieńcowych kluczową rolę odgrywa
pęknięcie blaszki miażdżycowej z naruszeniem ciągłości błony wewnętrznej,
prowokujące adhezję i agregację płytek krwi oraz aktywację układu krzep-
nięcia. Powstawanie skrzepliny to proces zamykania naczynia, który prze-
biega w kilku etapach. Najpierw powstaje czop płytkowy, z kolei na nim od-
kłada się zbity zakrzep fibrynowy. Następnie dochodzi do odkładania się
płytek, erytrocytów i fibryny na powierzchni pierwotnej skrzepliny i jej dal-
szego powiększania. Przeciwdziałanie fizjologicznym zjawiskom procesu he-
mostazy, zapoczątkowanym uszkodzeniem ściany naczyniowej, stanowi pod-
stawowe założenie leczenia ostrych incydentów wieńcowych i obejmuje –
zależnie od postawionego rozpoznania – stosowanie leczenia przeciwpłyt-
kowego (hamującego agregację płytek), leczenia przeciwzakrzepowego (ha-
mującego dalsze narastanie skrzepliny), czy leczenia fibrynolitycznego (pro-
wadzącego do rozpuszczania skrzepliny) oraz leczenia stabilizującego
blaszkę miażdżycową. Aktualne wskazania do stosowania heparyn w lecze-
niu ostrych zespołów wieńcowych zostały przedstawione w tabeli 6.
202
Tabela 5: Porównanie farmakokinetyki heparyny standardowej i heparyn drobnocząsteczkowych
PARAMETR
UFH
LMWH
średnia masa
cząsteczki
12 000-15 000
8 000
okres półtrwania
1-2 godziny
4-6 godzin
biodostępność
ok. 30%
90%
wpływ na APTT
(+)
( - )
monitorowanie
potrzebne/APTT
niepotrzebne/anty-Xa
aktywność anty-IIa
do anty-Xa
1:1
1:2-4
eliminacja
nerki
nerki
droga podania
zwykle dożylnie
zwykle podskórnie

W dalszej części rozdziału zostały przedstawione badania, w których po-
równywano skuteczność działania heparyny standardowej i heparyn drob-
nocząsteczkowych w ostrych incydentach wieńcowych. Badania te stanowią
obecnie podstawę dla prowadzenia współczesnego leczenia opartego na fak-
tach (Evidence Based Medicine – EBM) ostrych incydentów wieńcowych.
BADANIA KLINICZNE HEPARYN DROBNOCZĄSTECZKOWYCH
W LECZENIU OSTRYCH ZESPOŁÓW WIEŃCOWYCH
FRISC II (Fast Revascularization During Instability in Coronary Artery Dise-
ase) to wieloośrodkowe prospektywne randomizowane badanie, w którym
porównywano długotrwałe leczenie dalteparyną w porównaniu do placebo
u 2267 pacjentów z niestabilną dusznicą bolesną lub zawałem bez uniesie-
nia odcinka ST. Uczestnicy próby początkowo otrzymywali podskórnie dalte-
parynę w dawce 120 UI/kg dwa razy dziennie przez 5 dni, a potem byli lo-
sowo dzieleni na 2 grupy: otrzymujących dalteparynę lub placebo przez
okres 3 tygodni. Ponadto uczestnicy otrzymywali kwas acetylosalicylowy i
β-
adrenolityki (jeśli nie było przeciwwskazań). Po 30 dniach stwierdzono istot-
nie mniejszą częstość występowania zgonów, zawałów i konieczności rewa-
skularyzacji w grupie dalteparyny, jednak różnic tych nie stwierdzano po
6 miesiącach. Leczenie dalteparyną wiązało się z większym ryzykiem poważ-
nych krwawień oraz wystąpienia udaru krwotocznego.
W badaniu FRIC (Fragmin in Unstable Coronary Artery Disease) porówny-
wano dalteparynę i standardową heparynę. Punktami końcowymi badania
był zgon, zawał mięśnia sercowego oraz konieczność pilnej rewaskularyza-
cji, tak w ostrej fazie (6 dni), jak i w przewlekłej (40 dni). W tym badaniu
nie wykazano większych korzyści ze stosowania heparyny drobnocząstecz-
203
Tabela 6: Wskazania do stosowania heparyny w ostrych zespołach wieńcowych
• chorzy leczeni t-PA;
• nawracające niedokrwienie mięśnia serca;
• profilaktyka zatorowości po zawale:
- rozległy zawał serca ściany przedniej,
- skrzeplina w lewej komorze,
- migotanie przedsionków,
- zakrzepica żylna,
- długotrwałe unieruchomienie;
• chorzy do przezskórnej lub operacyjnej rewaskularyzacji.

kowej w porównaniu z standardową po 6 dniach, podobnie częstość powi-
kłań krwotocznych była porównywalna.
W badaniu FRAXIS (Fraxiparine in Ischaemic Syndrome) podawano nad-
roparynę przez 6 dni lub 14 dni i porównywano skuteczność leczenia oraz
częstość występowania działań niepożądanych z grupą otrzymującą hepary-
nę standardową dożylnie przez 6 dni u pacjentów hospitalizowanych z po-
wodu niestabilnej dusznicy bolesnej lub zawału mięśnia sercowego bez za-
łamka Q. W badaniu wzięło udział 3468 osób. Analizowano częstość
wystąpienia następujących punktów końcowych: zgon, zawał serca, nawrót
niestabilności wieńcowej w okresie 6, 14 i 90 dni obserwacji. Wykazano po-
równywalną skuteczność i bezpieczeństwo stosowania nadroparyny i hepary-
ny standardowej przez 6 dni; natomiast wydłużenie podawania nadropary-
ny do 14 dni nie dawało żadnych dodatkowych korzyści klinicznych,
a wiązało się ze zwiększonym ryzykiem poważnych krwawień w porównaniu
z heparyną standardową (3,5% vs 1,6%).
Badanie ESSENCE (The Efficacy and Safety of Subcutaneous Enoxaparin
in Non-Q-Wave Coronary Events Study Group) to prospektywne badanie wy-
konywane metodą podwójnie ślepej próby, w którym oceniano skuteczność
stosowania enoksaparyny w niestabilnej dusznicy bolesnej oraz zawale mię-
śnia sercowego bez uniesienia odcinka ST. W badaniu wzięło udział 3171 pa-
cjentów, którzy byli losowo przydzielani do grupy otrzymującej enoksapary-
nę w dawce 1 mg na kilogram masy ciała podskórnie dwa razy dziennie lub
do grupy przyjmującej heparynę standardową (początkowo bolus 5000 jed-
nostek dożylnie i następnie wlew pod kontrolą APTT). Leki podawano
przez co najmniej 2 doby i maksimum do 8 dni. Do badania kwalifikowano
pacjentów przyjętych do szpitala w ciągu 24 godzin od początku bólu.
W analizie uwzględniano częstość występowania zgonu, kolejnego zawału
mięśnia sercowego, nawroty niestabilności wieńcowej w ciągu 14 dni. W gru-
pie leczonej enoksaparyną zaobserwowano o 16% mniejszą częstość wystę-
powania tych incydentów po 14 dniach obserwacji: różnica ta wynikała
w największym stopniu z większej częstości nawrotów niestabilności wieńco-
wej w grupie heparyny standardowej. Po 30 dniach obserwacji, cały czas
stwierdzano korzyści w postaci zmniejszenia częstości złożonego punktu
końcowego w grupie leczonej enoksaparyną, w tej grupie rzadziej też wystę-
powała konieczność pilnej rewaskularyzacji. Nie stwierdzono różnicy, co do
częstości poważnych powikłań krwotocznych pomiędzy grupami, natomiast
mniej poważne krwawienia występowały częściej u osób otrzymujących
enoksaparynę.
204

W prospektywnym randomizowanym badaniu TIMI IIB (The Thromboly-
sis in Myocardial Infarction) wykonywanym metodą podwójnie ślepej próby
porównywano skuteczność enoksaparyny (najpierw 30 mg i. v., następnie
w dawce 1 mg/kg m. c. dwa razy dziennie, podskórnie) i standardowej hepa-
ryny (dawkowanie według masy ciała) u pacjentów hospitalizowanych z po-
wodu ostrego incydentu wieńcowego (niestabilna dusznica bolesna lub za-
wał serca bez uniesienia odcinka ST), w ciągu 24 godzin od początku bólu.
W badaniu wzięło udział 3910 chorych. Badanie miało 2 fazy: w fazie ostrej
pacjenci otrzymywali losowo heparynę standardową lub drobnocząsteczko-
wą; po ostrej fazie pacjenci z ramienia heparyny standardowej otrzymywali
dalej placebo, a osoby otrzymujące heparynę drobnocząsteczkową dalej
enoksaparynę w dawce 40-60 mg podskórnie, dwa razy dziennie. Oceniano
następujące punkty końcowe: zgon, zawał, niestabilność w ostrej fazie (14
dni). Częstość tych zdarzeń była znamiennie niższa w grupie chorych otrzy-
mujących enoksaparynę, w porównaniu do uczestników otrzymujących he-
parynę standardową, w 30. dniu ryzyko wystąpienia tych zdarzeń, jak rów-
nież konieczność pilnej rewaskularyzacji pozostawały istotnie niższe
w grupie otrzymującej enoksaparynę. W 30. dniu częstość poważnych powi-
kłań krwotocznych wynosiła 6,5% w grupie enoksaparyny i 7,0% w grupie
heparyny, natomiast częstość występowania wszystkich powikłań krwotocz-
nych (poważnych i łagodnych) była istotnie wyższa w grupie enoksaparyny,
co wynikało głównie z większej częstości występowania krwiaków w miejscu
wkłucia. Badanie TIMI IIB potwierdziło zatem wyniki badania ESSENCE
wykazując skuteczność i bezpieczeństwo stosowania heparyn drobnoczą-
steczkowych w ostrych incydentach wieńcowych. Wydłużenie czasu leczenia
wydaje się nie przynosić dodatkowych korzyści, a jedynie zwiększa ryzyko
powikłań krwotocznych.
Analiza danych zebranych w ramach wspomnianych badań wskazuje, że
stosowanie heparyn drobnocząsteczkowych jest równie korzystne, jak he-
paryny standardowej. Enoksaparyna jest jedyną heparyną drobnocząstecz-
kową, której wyższość nad heparyną standardową udowodniono na pod-
stawie badań ESSENCE i TIMI IIB (oraz łącznej analizy danych z tychże
badań). Nie wykazano celowości przedłużonego podawania heparyn drob-
nocząsteczkowych – przewlekłe leczenie nie przynosi dodatkowych korzy-
ści, a wiąże się ze zwiększonym ryzykiem powikłań krwotocznych. Warto
podkreślić, że poszczególne preparaty LMWH różnią się, co do swoich
właściwości, ale różne wyniki w przeprowadzonych badaniach klinicznych
(z użyciem różnych preparatów) mogą wynikać z odmienności w protoko-
łach tych badań (np. czas od pojawienia się bólu do rozpoczęcia leczenia,
długość podawania preparatu itd.) oraz różnic w badanych populacjach.
205

Z tego powodu potrzebne są badania bezpośrednio porównujące określo-
ne preparaty LMWH.
Tak więc, w warunkach szpitalnych LMHW znalazły zastosowanie w lecze-
niu ostrych incydentów wieńcowych i dzięki przedstawionym powyżej bada-
niom klinicznym mają już ugruntowaną pozycję, wypierając dotychczasowy
preparat heparyny niefrakcjonowanej.
W naszej klinice pacjentom hospitalizowanych z powodu niestabilnej dusz-
nicy bolesnej lub zawału serca bez uniesienia odcinka ST, podaje się hepary-
nę drobnocząsteczkowa podskórnie obok kwasu acetylosalicylowego, przez
co najmniej 3 dni lub dłużej, po rozpatrzeniu indywidualnych wskazań u da-
nego pacjenta. Posiadanie w arsenale leków przeciwzakrzepowych LMWH
pozwala poszerzać zastosowania lub tworzyć nowe. Pojawienie się LMWH
pozwala rozważać rozpoczęcie leczenia przeciwkrzepliwego u osób z podej-
rzeniem ostrego zespołu wieńcowego jeszcze w okresie przedszpitalnym. Je-
śli do przychodni zgłasza się pacjent z bólem zamostkowym, a w wykonanym
zapisie EKG potwierdzamy obecność zmian niedokrwiennych, należy roz-
ważyć podanie (oprócz kwasu acetylosalicylowego, azotanu podjęzykowego)
także heparyny drobnocząsteczkowej i jak najszybciej przewieźć pacjenta do
szpitala.
Obecnie w dobie ekonomizacji medycyny nie możemy poprzestać na wy-
kazaniu korzyści ze stosowania leków. Stąd często podnoszony zarzut o zbyt
wysokich kosztach leczenia haparynami drobnocząsteczkowymi. Badania
nad kosztami leczenia LMWH przeprowadzono podczas badań ESSENCE
(Mark 1998, Mark 1999). Bezpośredni koszt leczenia jest rzeczywiście wyż-
szy, jednak analizując skrócenie okresu hospitalizacji w OIOK, rzadziej wy-
konywane koronarografie i angioplastyki, to bilans kosztów wypada na ko-
rzyść LMWH. Całość przedstawionych danych dowodzi, że w wyniku
defragmentacji długich łańcuchów heparyny otrzymaliśmy do dyspozycji
równie skuteczną, a jednocześnie bezpieczną grupę leków – heparyny drob-
nocząsteczkowe.
HEPARYNY W LECZENIU ZAKRZEPICY ŻYŁ GŁĘBOKICH
Do niedawna stosowanie heparyny niefrakcjonowanej (UFH) było meto-
dą z wyboru w leczeniu zakrzepicy żył głębokich kończyn dolnych, jednak
obecnie zalecane są heparyny drobnocząsteczkowe. Ostatnimi aktualnymi
wskazaniami do stosowania UFH pozostaje podwyższone ryzyko powikłań
krwotocznych oraz ciężki przebieg żylnej choroby zakrzepowo-zatorowej
z niestabilnością hemodynamiczną. Zaletą UFH jest krótki okres półtrwa-
nia (2-4 godziny od zaprzestania leczenia). Dzięki temu, w przypadku wy-
206

stąpienia powikłań krwotocznych szybciej ustępuje działanie przeciwkrze-
pliwe, zaś w przypadku niestabilności hemodynamicznej można podjąć pró-
bę leczenia fibrynolitycznego bądź operacyjnego. Heparyny drobnocząstecz-
kowe (LMWH) w zakrzepicy żył głębokich stosowane są w dawkach
leczniczych, przez okres 5 dni. Większość pacjentów z tym schorzeniem moż-
na leczyć w warunkach domowych.
Leczenie ambulatoryjne jest przeciwwskazane w przypadku pacjentów
z rozległą zakrzepicą żył głębokich, zagrażającą martwicą kończyny (phleg-
masia cerulea dolens), współistniejącą zatorowością płucną, czy też w przy-
padku pacjenta z podwyższonym ryzykiem powikłań krwotocznych. Każdy
pacjent z wywiadem żylnej choroby zakrzepowo-zatorowej powinien być na-
stępnie leczony w ramach profilaktyki wtórnej. W profilaktyce wtórnej mo-
gą być stosowane również LMWH, jeśli istnieją przeciwwskazania do lecze-
nia antykoagulantami doustnymi.
Jeżeli okres leczenia LMWH przekracza 3-6 miesięcy, należy rozpocząć
profilaktykę osteoporozy.
Należy pamiętać, że zakończenie leczenia LMWH wymaga stopniowej re-
dukcji dawki leku, ze względu na pobudzenie układu krzepnięcia („efekt
z odbicia”).
HEPARYNY W LECZENIU ZATOROWOŚCI PŁUCNEJ
Leczenie zatorowości płucnej ma na celu udrożnienie łożyska naczyń płuc-
nych oraz zmniejszenie ryzyka nawrotów choroby. Zdecydowana większość
przypadków zatorowości płucnej przebiega bez niestabilności hemodyna-
micznej, a leczeniem z wyboru pozostaje heparyna niefrakcjonowana (UFH)
bądź drobnocząsteczkowa (LMWH). Ze względu na możliwość wystąpienia
małopłytkowości poheparynowej (HIT – Heparin-Induced Thrombocytope-
nia) podczas leczenia heparyną niefrakcjonowaną, należy wykonywać ozna-
czenia płytek krwi (odpowiedź immunologiczna przeciw trombocytom roz-
wija się od 5 doby). Leczenie powinno być prowadzone 5-7 dni, w zależności
od przebiegu klinicznego do 10 dni. Wskazane jest dołączenie antykogulan-
tów doustnych. Leczenie łączone powinno być kontynuowane 4 dni przed
odstawieniem heparyny, po osiągnięciu INR w przedziale 2,0-3,0.
207

PROFILAKTYKA PRZECIWZAKRZEPOWA ŻYLNEJ CHOROBY
ZAKRZEPOWO-ZATOROWEJ
Żylna choroba zakrzepowo-zatorowa stanowi powikłanie 20-30% zabie-
gów operacyjnych w chirurgii ogólnej i około 50% poważniejszych zabiegów
ortopedycznych u pacjentów w wieku powyżej 40 lat. W przypadku niepro-
wadzonej profilaktyki przeciwzakrzepowej, odsetek powikłań zakrzepowo-
-zatorowych osiąga 40-60% przypadków po zabiegu wszczepienia endopro-
tezy stawu biodrowego oraz 60-70% po zabiegu wymiany stawu kolanowego.
Żylna choroba zakrzepowo-zatorowa stanowi powikłanie wśród chorych po-
urazowych aż w 58%. Natomiast prawie u 25% chorych po operacjach chi-
rurgicznych rozpoznano zakrzepicę żył głębokich, pomimo braku objawów
zakrzepicy. W przypadku proksymalnej zakrzepicy żył głębokich, jeśli nie zo-
stanie podjęte leczenie heparyną, o 50% wzrasta ryzyko nawracających po-
wikłań zakrzepowo-zatorowych.
PROFILAKTYKA PRZECIWZAKRZEPOWA
W ODDZIALE ZACHOWAWCZYM
• wiek powyżej 70 lat i aktywny proces chorobowy;
• wstrząs;
• trombofilia;
• unieruchomienie pacjenta z aktywną chorobą;
• przewlekła niewydolność serca;
• ostra niewydolność oddechowa;
• ostra infekcja bez sepsy;
• ostre schorzenia reumatyczne;
• wrzodziejące zapalenie jelit;
• zespół korzeniowy oraz kompresyjne złamanie kręgu.
Dzięki dużym badaniom klinicznym wykazano skuteczność zarówno UFH,
jak i LMWH w profilaktyce i leczeniu żylnej choroby zakrzepowo-zatorowej.
Dzięki badaniom MEDENOX i PRINCE ustalono skuteczną dawkę pre-
wencyjną LMWH dla pacjentów leczonych zachowawczo, która dla enoxa-
paryny wynosi 40 mg podskórnie raz dziennie. Przedstawiona statystyka
przekonuje o konieczności stosowania pierwotnej profilaktyki przeciwza-
krzepowej w okresie okołooperacyjnym w specjalnościach zabiegowych.
208

Zapamiętaj!
Wskazania do stosowania heparyny to:
1. chorzy ze świeżym zawałem serca leczeni t-PA;
2. nawracające niedokrwienie mięśnia sercowego;
3. profilaktyka zatorowości po zawale:
a. rozległy zawał serca ściany przedniej,
b. skrzeplina w lewej komorze,
c. migotanie przedsionków,
d. zakrzepica żylna,
e. długotrwałe unieruchomienie;
4. chorzy do przezskórnej lub operacyjnej rewaskularyzacji;
5. leczenie zatorowości płucnej;
6. leczenie zakrzepicy żył głębokich;
7. profilaktyka przeciwzakrzepowa żylnej choroby zakrzepowo-zatorowej.
Polecane lektury:
Fifth ACCP Consensus Conference on Antithrombotic Therapy; CHEST,
1998, 114: 439S-769S.
W. Z. Tomkowski (red.): Kliniczne zastosowania heparyn drobnocząstecz-
kowych; Via Medica, Gdańsk, 2000.
209
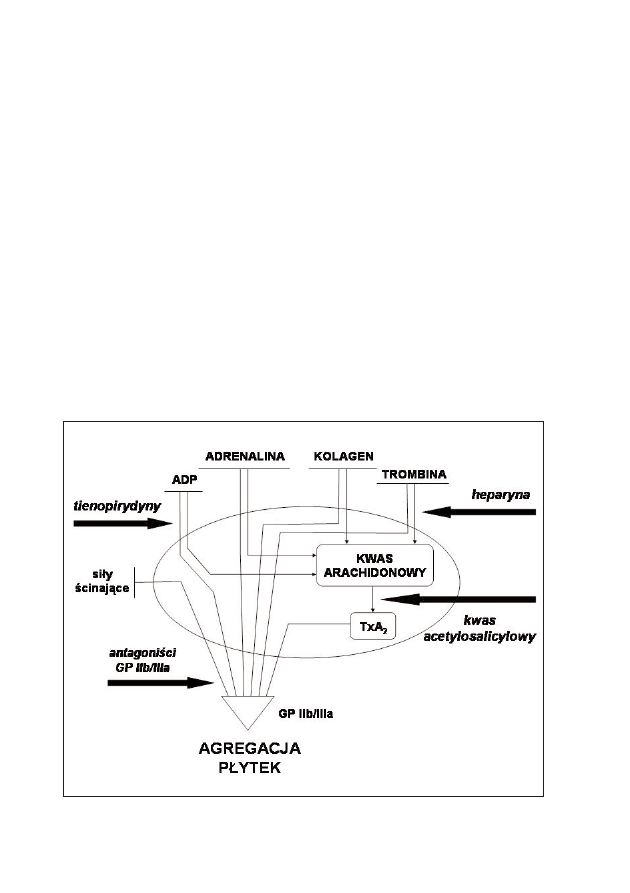
XVII.INHIBITORY RECEPTORA GLIKOPROTEINOWEGO
IIb/IIIa – NADZIEJA NOWOCZESNEJ KARDIOLOGII?
Włodzimierz Gierlak, Agnieszka Domagała, Katarzyna Sadkowska,
Marek Kuch
Jeśli przeanalizujemy mechanizm aktywacji płytek – zjawisko wieloczyn-
nikowe – zauważymy, że wszystkie drogi aktywacji prowadzą do receptora
glikoproteinowego (GP) IIb/IIIa. Receptor GP IIb/IIIa jest receptorem
czynnościowym dla fibrynogenu, fibronektyny, witronektyny i czynnika von
Willebranda. Ostatecznie kaskada agregacji zostaje aktywowana poprzez
wiązanie umieszczonych na płytkach krwi receptorów IIb/IIIa z fibrynoge-
nem. Zablokowanie 80% receptorów GP IIb/IIIa prowadzi praktycznie do
całkowitego zahamowania agregacji płytek. Wychodząc więc z założeń pa-
tofizjologicznych, oczekiwano rozwiązania problemów leczenia antyagrega-
cyjnego wraz z zablokowaniem tej drogi receptorowej. Jednocześnie – jak
wiadomo – białe, bogatopłytkowe zakrzepy w tętnicach wieńcowych stano-
wią najczęstszą przyczynę ich niedrożności, będąc jednocześnie oporne na
leczenie fibrynolityczne, stąd znaczenie blokowania aktywacji trombocytów.
Rycina 1: Mechanizmy aktywacji płytek krwi
210

Zsyntetyzowane inhibitory receptora płytkowego GP IIb/IIIa to grupa nie-
jednorodna. Należą tu przeciwciała monoklonalne (abciximab), cykliczne
peptydy (eptifibatid) oraz substancje niepeptydowe (lamifiban, tirofiban).
ABCIXIMAB
Abciximab jest rekombinowanym przeciwciałem monoklonalnym z dużą
siłą powinowactwa do receptora glikoproteinowego IIb/IIIa. Lek ten nie jest
inhibitorem swoistym, ponieważ blokuje receptor GP IIb/IIIa wielkością
cząsteczki. Zablokowaniu ulega nie tylko łańcuch b3 receptora GP IIb/IIIa,
ale również receptor avb3 (dla witronektyny) i receptor leukocytarny MAC-1.
Receptor witronektyny zlokalizowany jest nie tylko na płytkach krwi, lecz
także w komórkach mięśni gładkich błony wewnętrznej naczyń, zaś bloko-
wanie tego receptora zapobiega przerostowi błony wewnętrznej w badaniach
doświadczalnych, stąd hipoteza o stymulowaniu restenozy w tym mechani-
zmie. Możliwy wydaje się również udział receptorów witronektynowych
w adhezji do osteopontyny zawartej w blaszkach miażdżycowych, jak rów-
nież udział receptora witronektynowego w wytwarzaniu trombiny. Potwier-
dzono znacznie wyższą skuteczność w hamowaniu wytwarzania trombiny po
zablokowaniu zarówno receptora GP IIb/IIIa, jak i receptora witronektyno-
wego. Abciximab blokuje również receptor leukocytarny MAC-1. Konse-
kwencją aktywacji jest nasilenie reakcji zapalnej w wyniku uszkodzenia na-
czynia, poprzez wiązanie leukocytów z płytkami. Tak więc abciximab
zmniejsza adhezję leukocytów po wprowadzeniu stentu, jak również akumu-
lację leukocytów w miejscu uszkodzenia ściany naczynia po angioplastyce.
Jak przedstawiono powyżej, działanie abciximabu wspierające procedury
kardiologii interwencyjnej, nie ogranicza się jedynie do blokowania recep-
tora GP IIb/IIIa.
TIROFIBAN I EPTIFIBATYD
Zarówno tirofiban, jak i eptifibatyd wyizolowane zostały z jadu węży. Oba
leki należą do swoistych blokerów receptora IIb/IIIa, z tym że tirofiban jest
substancją niepeptydową, a eptifibatyd należy do peptydów. Poprzez kompe-
tycyjne blokowanie nie wpływają one na inne receptory. Charakteryzują się
także mniejszym powinowactwem do receptora GP IIb/IIIa w porównaniu
do abciximabu, dlatego ich działanie przeciwpłytkowe jest łatwo odwracalne.
Zablokowanie receptorów następuje po 15 minutach od podania eptifibaty-
du i po 5 minutach w przypadku tirofibanu. Zdolność płytek do agregacji
powraca od 30 minut do 4 godzin po zakończenia wlewu substancji czynnej.
Z ustroju eliminowane są przez nerki.
211

ZASTOSOWANIE INHIBITORÓW GP IIb/IIIa
Inhibitory GP IIb/IIIa stosowano początkowo jako wstępne leczenie nie-
stabilnej dusznicy bolesnej, w postaci 48-godzinnego wlewu dożylnego, w po-
łączeniu z kwasem acetylosalicylowym lub heparyną. Najczęściej stosowano
abciximab, lecz także eptifibatyd w badaniu PURSUIT, tirofiban w badaniu
PRISM, PRISM-PLUS oraz lamifiban w badaniach PARAGON. Metaana-
liza czterech wymienionych badań obejmująca 18 000 pacjentów wykazała
korzystny wpływ inhibitora receptora GP IIb/IIIa na redukcję śmiertelności
oraz ryzyko wystąpienia zawału serca w obserwacji 30-dniowej. Korzyścią
prowadzonego leczenia było uniknięcie 5 zgonów na 1000 leczonych pacjen-
tów oraz łącznie 16 zgonów i zawałów serca na 1000 leczonych pacjentów.
Przy nieznacznie zwiększonym ryzyku krwawień, nie obserwowano większej
częstości krwawień do ośrodkowego układu nerwowego. Na podstawie po-
wyższych przesłanek rozpoczęto badanie GUSTO IV ACS, gdzie oceniano
skuteczność leczenia abciximabem u chorych bez uniesienia odcinka ST,
u których nie planowano wczesnej rewaskularyzacji. Przeprowadzone bada-
nie nie potwierdziło skuteczności leczenia zachowawczego abciximabem
u pacjentów z ostrymi zespołami wieńcowymi. Tak więc obecnie wydaje się,
że możliwe korzyści z zachowawczego leczenia GP IIb/IIIa mogą odnieść
pacjenci najbardziej zagrożeni w grupie niestabilnej dusznicy bolesnej –
z dodatnim wynikiem oznaczenia troponiny (tab. 1).
W wielu randomizowanych badaniach klinicznych wykazano, że chorzy le-
czeni z powodu ostrych zespołów wieńcowych metodami kardiologii inter-
wencyjnej osiągają lepsze wyniki leczenia przy jednoczesnym stosowaniu in-
212
Tabela 1: Skuteczność leczenia zachowawczego inhibitorami GP IIb/IIIa w niestabilnej dusznicy
bolesnej w badaniach klinicznych
LEK
BADANIE
EFEKT KLINICZNY
eptifibatyd
PURSUIT
+++
lamifiban
PARAGON
0
tirofiban
PRISM
+++
PRISM PLUS
+++
abciximab
GUSTO IV ACS
0

hibitorów receptora GP IIb/IIIa. Korzyści w tej grupie pacjentów mogą wy-
nikać z ograniczenia zjawiska mikrozatorowości tętnic wieńcowych w kon-
sekwencji PTCA, czy też ograniczenia zjawiska „no reflow”. Badania EPIC
i CAPTURE oceniały działanie abciximabu, a badanie RESTORE – tirofi-
banu, stosowanych podczas angioplastyki u pacjentów z niestabilną dusznicą
bolesną. Dla abciximabu wykazano zmniejszenie łącznej liczby zgonów, za-
wałów serca oraz zabiegów rewaskularyzacji w 30 dni po zabiegu PTCA.
Równie korzystne wyniki uzyskano w trzymiesięcznej obserwacji w badaniu
EPIC, natomiast istotnej statystycznie korzyści z leczenia abciximabem nie
wykazano w sześciomiesięcznej obserwacji w badaniu CAPTURE. Różnica
w wynikach badań nad abciximabem może wynikać z odmiennego protoko-
łu badania. W badaniu CAPTURE dożylny wlew abciximabu poprzedzał an-
gioplastykę o 18-24 godziny i nie był kontynuowany po PTCA, natomiast
w badaniu EPIC wlew dożylny leku był rozpoczynany bezpośrednio przed
PTCA i kontynuowany jeszcze przez 12 godzin po zabiegu. Badanie RE-
STORE przeprowadzone z tirofibanem podczas PTCA, wykazało co prawda
zmniejszenie łącznego ryzyka występowania zgonów, zawałów serca i rewa-
skularyzacji, lecz jedynie do 7 dni po zabiegu. Ocenie zastosowania bloke-
rów GP IIb/IIIa podczas planowych zabiegów PTCA poświęcone były nato-
miast badania EPILOG i IMPACT II. Badanie EPILOG potwierdziło
korzystny efekt leczenia abciximabem w ocenie trzydziestodniowej, przy za-
stosowaniu małych dawek heparyny. Badanie IMPACT II nad eptifibatydem
wykazało jedynie korzyści z prowadzonego leczenia w obserwacji 1-dobowej,
czego już nie potwierdzono w obserwacji 30-dniowej (tab. 2).
213
Tabela 2: Skuteczność leczenia inhibitorami GP IIb/IIIa towarzyszącego angioplastyce
wieńcowej w badaniach klinicznych
LEK
BADANIE
EFEKT KLINICZNY
abciximab
EPILOG, EPIC
+++
CAPTURE
+
eptifibatyd
IMPACT II
+
tirofiban
RESTORE
+

Nadal w trakcie badań III fazy pozostają doustne formy inhibitora GP
IIb/IIIa, takie jak ksemilofiban, orbofiban i sybrafiban, jednak jak dotąd nie
potwierdzono ich skuteczności. Dlatego pozycja doustnych leków antyagre-
gacyjnych hamujących pośrednie szlaki aktywacji płytek krwi w leczeniu
przewlekłym choroby niedokrwiennej serca, takich jak kwas acetylosalicylo-
wy, tiklopidyna i klopidogrel, nadal pozostaje niezachwiana.
POWIKŁANIA
Do najważniejszych powikłań leczenia należą krwawienia, małopłytkowość
oraz reakcje na ponowne podanie leku. Stosowanie inhibitorów GP IIb/IIIa
wiąże się z większą częstością występowania drobnych krwawień. W bada-
niach EPIC i CAPTURE częstość występowania poważnych krwawień ule-
gła podwojeniu, wynikało to jednak z niewłaściwego zaopatrzenia miejsc
wkłucia oraz niedostosowania dawki heparyny do masy ciała pacjenta.
Ciężka małopłytkowość przy podawaniu eptifibatydu i tirofibanu może wy-
stępować sporadycznie; przy podawaniu abciximabu wynosi 0,7%. Abcixi-
mab może częściej wywoływać małopłytkowość ze względu na występowa-
nie interakcji z heparyną.
Budowa abciximabu, zawierającego fragmenty przeciwciał wywołuje efekt
immunogenny. Ponowne podanie abciximabu nie wiąże się ze wzrostem ry-
zyka reakcji anafilaktycznej, natomiast u 2,4 % pacjentów po ponownym po-
daniu leku wystąpiła ciężka małopłytkowość.
FARMAKOEKONOMIKA
Koszt standardowego wlewu abciximabu wynosi około 1400 dolarów dla
pacjenta. Koszt 24–72-godzinnego wlewu to wydatek do 2160 dolarów. Czas
wlewu eptifibatidu i tirofibanu jest zmienny, jednak w wielu badaniach kli-
nicznych stosowano 48–96-godzinny wlew, a koszt leczenia przekraczał 1000
dolarów. Przeprowadzone analizy farmakoekonomiczne dotyczyły zastoso-
wania inhibitorów GP IIb/IIIa zarówno w leczeniu ostrych zespołów wień-
cowych, jak i metodą pierwotnej angioplastyki tętnic wieńcowych. Wskaźni-
ki skuteczności do kosztów można akceptować tylko u pacjentów wysokiego
ryzyka wystąpienia zawału serca (tj. ze wzrostem aktywności markerów ser-
cowych, czy też utrzymującą się niestabilnością wieńcową).
214

Zapamiętaj!
1. Inhibitory receptora GP IIb/IIIa to leki antyagregacyjne o udowodnionej
skuteczności we wspomaganiu leczenia metodą angioplastyki tętnic wień-
cowych, bez udowodnionego działania w leczeniu zachowawczym niesta-
bilnej dusznicy bolesnej.
2. Jest to grupa leków stosowana również w leczeniu ostrego zawału serca
w połączeniu ze zredukowanymi dawkami leku fibrynolitycznego, bez wpły-
wu na wczesną śmiertelność, jednak istotnie zmniejszająca częstość reoklu-
zji tętnic wieńcowych.
3. Hipoteza o skuteczności leczenia zachowawczego inhibitorami receptora
GP IIb/IIIa w grupie pacjentów z ostrymi zespołami wieńcowymi bez unie-
sienia załamka T z dodatnim oznaczeniem troponiny wymaga potwierdze-
nia w dużych badaniach klinicznych.
Polecane lektury:
A. Beręsewicz, M. Kurzelewski: Niestabilna blaszka miażdżycowa. Kardio-
logia Polska, 2001, 54, 431-438.
A. M. Licoff, R. M. Califf, E. J. Topol: Platelet glycoprotein IIb/IIIa receptor
blockade in coronary artery disease; J Am Coll Cardiol, 2000, 35: 1103-1115.
ACC/AHA Practice Guidelines Update: Unstable Angina and Non-ST -
Segment Elevation Myocardial Infarction; http: //www. acc. org/clinical/sta-
tements. htm
E. J. Topol i wsp.: Comparision of two platelet glycoprotein IIb/IIIa inhibi-
tors, tirofiban and abciximab, for the prevention of ischemic events with per-
cutaneous coronary revascularization; N Engl J Med, 2001, 344: 1888-1894.
215
XVIII. LEKI METABOLICZNE
Jerzy Kuch, Edmund Szczepańczyk
Na podstawie patofizjologii niedokrwienia wiadomo, że do ochrony mię-
śnia sercowego przed nieodwracalnym uszkodzeniem niezbędne są:
• przywrócenie przepływu przez tkanki tak szybko, jak tylko to
jest możliwe;
• utrzymanie drożności naczynia po przywróceniu przepływu;
• działania interwencyjne zwalniające, czy też odwracające
uszkodzenie komórek do czasu uzyskania reperfuzji;
• dalsza ochrona miokardium w okresie poreperfuzyjnym.
Dwa ostatnie z powyższych zadań można osiągnąć przez zwolnienie pato-
logicznych procesów metabolicznych, towarzyszących niedokrwieniu i uru-
chomienie mechanizmów naprawczych. Jest to główne zadanie dla leków
metabolicznych.
NATURALNE MECHANIZMY OCHRONNE
W ostatnim okresie opisano tzw. nowe zespoły niedokrwienne, które są
naturalnymi reakcjami adaptacyjnymi do niedokrwienia, chroniącymi tkan-
ki serca przed martwicą:
• preconditioning (hartowanie przez niedokrwienie);
• ogłuszenie mięśnia sercowego;
• zamrożenie mięśnia sercowego.
Preconditioning
Próba naszego oddziaływania na metabolizm miocytów, którego istotę
często nie w pełni słusznie ograniczamy do określenia kardioprotekcji, doty-
czyć powinna najistotniejszych żywotnych procesów komórkowych, takich
jak:
216

• pobudzenie beztlenowej glikolizy;
• zahamowanie produkcji rodników tlenowych;
• zwiększenie rezerwy ATP w tkankach.
Powyższe procesy mają za zadanie chronić mikrokrążenie przed uszkodze-
niem i zmniejszać zaburzenia w przepływie tkankowym, do którego dochodzi
w czasie i po ustąpieniu niedokrwienia. Ten mechanizm adaptacyjny na nie-
dokrwienie określany jest mianem preconditioning (hartowanie). Działanie
ochronne tego zjawiska tłumaczone jest uruchomieniem pewnych ciągów
enzymatycznych i reakcji receptorowych w tkance mięśniowej. Adenozyna
powstała z ATP w czasie niedokrwienia za pośrednictwem receptora A
2
,
przy współudziale białka G i fosfolipazy uwalnia pewne substancje ochron-
ne, pobudza syntezę tlenku azotu (NO) przez śródbłonek i powoduje prze-
mieszczenie kinazy proteinowej C z cytosolu do sarkolemmy. Następuje
otwarcie kanałów potasowych (K
+
) zależnych od ATP. W wyniku tego skra-
ca się potencjał czynnościowy, a także zmniejsza się napływ jonów Ca
2+
do
komórek. Zmniejsza to siłę skurczu i zużycie energii przez komórki mię-
śniowe. Tego rodzaju mechanizm ochronny, występuje zwykle w nawracają-
cej dusznicy bolesnej, może stanowić ochronę przed zagrażającym zawałem
serca.
Ogłuszenie
Ciężkie niedokrwienie, nie trwające na tyle długo, aby doprowadzić do
nieodwracalnego uszkodzenia, po przywróceniu przepływu zwykle w wyni-
ku reperfuzji, prowadzi do ogłuszenia mięśnia sercowego. Ogłuszenie nastę-
puje na skutek pewnego przemieszczenia ciągów enzymatycznych i zmiany
wrażliwości na jony Ca
2+
. Na skutek reperfuzji i ponownego dostarczania
tlenu do uprzednio niedokrwionych tkanek, powstaje duża ilość wysoce tok-
sycznych rodników tlenowych. Pod ich wpływem sarkolemma zmienia swoją
przepuszczalność, co umożliwia większy napływ wapnia do komórek. Jedno-
cześnie zaobserwowano zmniejszoną wrażliwość na Ca
2+
, co wyraża się istot-
nie osłabioną reakcją białek kurczliwych. To przemijające przeładowanie
wapniem komórek prowadzi do aktywacji i przemieszczeń układów enzyma-
tycznych, które uszkadzają miofilamenty. Pod wpływem czasu i zadziałania
czynników zewnętrznych (leków działających bezpośrednio na metabolizm)
możliwe jest opanowanie nadmiernej ekspresji białek wiążących wapń i na-
prawa uszkodzonych białek.
217

Zamrożenie
Zamrożenie (hibernacja) oznacza brak czynności skurczowej w obszarze
żywej tkanki mięśnia sercowego o małej perfuzji wieńcowej. Brak czynności
skurczowej umożliwia miocytom przetrwanie w warunkach niedostateczne-
go przepływu i związanego z nim deficytu tlenowo-energetycznego. Za moż-
liwe mechanizmy tej dysfunkcji uważa się:
• spadek stężenia ATP;
• nagromadzenie fosforanów nieorganicznych;
• nagromadzenie jonów wodorowych i mleczanów;
• zaburzenia gromadzenia i transportu jonów Ca w siateczce
sarkoplazmatycznej.
Zespół ten obejmuje szerokie spektrum zjawisk – od obserwowanego czę-
sto przez kardiochirurgów już na stole operacyjnym szybkiego powrotu funk-
cji kurczliwej mięśnia sercowego po zabiegu rewaskularyzacji, aż po wielo-
miesięczny okres ciężkiego upośledzenia kurczliwości, nawet po względnie
szybkim przywróceniu przepływu wieńcowego.
Liczne prace wskazują, że np. w okresie pozawałowym stopniową poprawę
funkcji mechanicznej serca (w obszarze okołozawałowym) obserwuje się
w dużym przedziale czasowym, zazwyczaj od 5 tygodni aż do 7 miesięcy od
dokonania się zawału.
Są sugestie, że przedłużający się stan zamrożenia mięśnia sercowego pro-
wadzi do „zaniku z bezczynności” – do niekorzystnej przebudowy i zaniku
elementów kurczliwych, co stwarza podstawy dla powstania miokardiopatii
niedokrwiennej.
Wiele też wskazuje na to, że częste powtarzające się epizody ogłuszenia
mięśnia sercowego mogą doprowadzić do fazy jego zamrożenia. Istotnym
z punktu widzenia klinicznego jest wykazanie obszarów mięśnia sercowego
o zachowanym, choć ograniczonym metabolizmie, przy „niedopasowanym”
przepływie wieńcowym – stwarza to szansę na istotne korzyści po zabiegu
rewaskularyzacji u tych chorych.
218

MODYFIKATORY METABOLICZNE
Leczenie farmakologiczne ingerujące w metabolizm komórkowy jest mniej
lub bardziej udanym naśladownictwem naturalnych procesów ochronnych.
Może wspomagać ochronę endogenną tkanek przez działanie na opisane
ciągi enzymatyczne.
Leczenie metaboliczne w niedokrwieniu mięśnia sercowego sprowadza się
do:
• przywrócenia efektywnych przemian energetycznych (przestawienia
pozyskiwania energii z oksydacji wolnych kwasów tłuszczowych na
znacznie bardziej korzystne utlenianie glukozy);
• zmniejszenia kwasicy wewnątrzkomórkowej;
• zmniejszenia lub odwrócenia dysfunkcji błonowych pomp jonowych
– m. in. redukcji utraty potasu, magnezu i innych pierwiastków
– katalizatorów reakcji biochemicznych;
• ograniczenia reakcji zapalnych towarzyszących niedokrwieniu
(m. in. zmniejszeniu aktywacji neutrofili);
• zmniejszenia „przeładowania” wnętrza komórki jonami wapnia
(przeciwdziałanie apoptozie);
• przeciwdziałania stresowi oksydacyjnemu towarzyszącemu
niedokrwieniu – ograniczeniu wytwarzania i uwalniania wolnych
rodników tlenowych.
Szczególną rolę w ingerencji w uszkodzony metabolizm komórkowy od-
grywają tzw. leki cyto-kardio-protekcyjne. Jest to względnie nowa grupa
związków chemicznych, których działanie jest oparte na ich wpływie na
ochronę i naprawę mechanizmów metabolicznych niedokrwionych komó-
rek. Dlatego noszą one nazwę modyfikatorów metabolicznych. Najbardziej
znane leki tej grupy to: trimetazydyna, ranolazyna, karnityna, a także fosfo-
kreatyna, arginina, magnez, adenozyna.
Mieszanka polaryzująca GIK
Zapewne do tej grupy można zaliczyć od dawna znaną metodę terapeu-
tyczną, znacznie wyprzedzającą wprowadzenie leków metabolicznych, opar-
tą na podawaniu mieszanki polaryzującej GIK (glukoza, insulina, potas) we
wlewach dożylnych.
219

Wydaje się, że spośród wymienionych środków najbardziej poznaną, o naj-
większym doświadczeniu klinicznym jest właśnie mieszanka polaryzująca
GIK. Mieszanka GIK wydaje się działać bezpośrednio na metabolizm ko-
mórkowy w stanach niedokrwienia i uszkodzenia mięśnia sercowego. Pierw-
szy na ten temat pisał już w 1962 roku D. Sodi-Pallares. Stosował on mie-
szankę polaryzującą GIK w roztworze, podawanym dożylnie o następującym
składzie: 40 mmol K
+
+ 20 j. insuliny + 5-10% glukozy 500-1000 ml.
Autor opierał swoją terapię na następujących przesłankach. Polaryzacja
włókien mięśniowych w obszarze ostrego niedokrwienia ulega redukcji. Sto-
pień rozkurczowej polaryzacji różni się w różnych strefach obszaru zawało-
wego, w zależności od tego, czy jest to strefa całkowicie niepobudliwa (mar-
twica), czy z opóźnioną aktywacją (strefa uszkodzenia) lub też obszar
o zmienionej repolaryzacji (strefa niedokrwienia). Koncentracja jonów pota-
su wewnątrz włókien mięśniowych (K
+
) do koncentracji tego jonu na ze-
wnątrz włókien (Ko
+
) jest 30 razy większa. Ten stosunek dotyczy spoczyn-
kowej polaryzacji włókien. Mogłoby to dowodzić, że polaryzacja włókien
mięśniowych w ludzkim sercu głównie powodowana jest przez stosunek
K
+
/Ko
+
i przenikliwość K
+
przez błonę komórkową, która jest istotnie więk-
sza niż dla innych jonów. Tak więc, każdy spadek polaryzacji jest następ-
stwem zmniejszenia się wspomnianego gradientu potasu. Ta kombinacja po-
dawania potasu łącznie z insuliną i glukozą stwarza możliwość wzrostu
polaryzacji spoczynkowej i działanie gradientu potasu w mięśniu sercowym.
To badanie, jak i późniejszych 7 dużych raportów na temat leczenia mieszan-
ką polaryzującą, pomimo pewnych różnic metodycznych, wydają się potwier-
dzać w znacznej części opisane oczekiwania. Wykazano w nich – po zasto-
sowaniu terapii mieszanką GIK – poprawę zapisu elektrokardiograficznego,
ustąpienie lub zmniejszenie towarzyszących niemiarowości oraz poprawę sa-
mopoczucia pacjentów.
Pomimo ciągle niepełnej wiedzy na ten temat wydaje się, że mieszanka po-
laryzująca przynosi korzystne efekty u pacjentów z ostrymi zespołami wień-
cowymi ze współistniejącą cukrzycą lub zaburzoną tolerancją glukozy. Przy-
noszą potwierdzenie tych oczekiwań wyniki badań GIGAMI oraz ECLA,
które wykazały korzystne rezultaty stosowania mieszanki GIK u pacjentów
leczonych w Oddziałach Intensywnej Opieki Kardiologicznej z powodu
ostrych zespołów wieńcowych.
Mieszankę polaryzującą GIK podaje się dzisiaj w infuzji dożylnej, podobnie
jak to stosował Sodi-Pallares: 40 mmol K
+
w roztworze 5-10% glukozy (500-
1000 ml) + 20 j. insuliny. Zaskakująco pozytywne wyniki uzyskali Rackley
i wsp., którzy podawali chorym glukozę i insulinę w większych stężeniach.
220

Trimetazydyna
Spośród tzw. modyfikatorów metabolicznych najlepiej poznanym lekiem
jest trimetazydyna. Przemawiają za tym duże badania doświadczalne i kli-
niczne. Trimetazydyna działa na ważne procesy oksydacyjne niedokrwionej
komórki; hamuje oksydację wolnych kwasów tłuszczowych i sprzyja utlenia-
niu pirogronianu, co jest szczególnie korzystne w warunkach niedokrwienia
mięśnia sercowego. Dopiero niedawno (Kantor i wsp., 2000 rok) poznano
dokładny mechanizm działania trimetazydyny – hamowanie tiolazy 3-keto-
acylokoenzymu A. Trimetazydyna zmienia zatem kierunek metabolizmu
z wolnych kwasów tłuszczowych na szlak przemian glukozy i poprawia sprzę-
żenie pomiędzy glikolizą i utlenianiem węglowodanów. Prowadzi to do
zmniejszenia zużycia tlenu i zmniejsza wytwarzanie kwasu mlekowego, co
obniża kwasicę wewnątrzkomórkową i zmniejsza kumulację jonów wapnio-
wych we wnętrzu komórki. Wykazano też zmniejszenie zawartości wolnych
rodników tlenowych i ograniczenie reakcji zapalnych (m.in. zmniejszenie ak-
tywacji granulocytów obojętnochłonnych) w niedokrwionej tkance, po za-
stosowaniu trimetazydyny.
Przedstawione efekty metaboliczne udowodniono w badaniach doświad-
czalnych i w próbach klinicznych u chorych ze stabilną dusznicą bolesną.
W badaniach klinicznych wykazano, że trimetazydyna jest skutecznym le-
kiem w stabilnej dusznicy bolesnej. Wyniki oceniano za pomocą próby wysił-
kowej – mierząc czas do wystąpienia bólu i obniżenia odcinka ST w elektro-
kardiogramie, stwierdzono znamienną poprawę tolerancji wysiłku. Za-
obserwowano także poprawę wydolności serca w incydentach niedokrwien-
nych.
Dotychczasowe wyniki badań dowodzą, że trimetazydyna w istotny sposób
poprawia przemiany metaboliczne w miocytach w stanach niedokrwienia,
zarówno w ostrych incydentach wieńcowych, jak i stabilnej dusznicy bole-
snej.
Skuteczne dawki trimetazydyny to 3 x 20 mg lub 2 x 35 mg (tabletki o zmo-
dyfikowanym uwalnianiu).
Ranolazyna
Innym lekiem z grupy modyfikatorów metabolicznych, o podobnym dzia-
łaniu do trimetadyzyny, jest ranolazyna. W badaniach doświadczalnych
stwierdzono, że działa ona w sercu niedokrwionym oraz w niedokrwionym
i następnie reperfundowanym. Wykazano, że poprawia przemiany energe-
tyczne; hamuje utlenianie kwasów tłuszczowych i zwiększa tlenowe spalanie
221

glukozy. Ranolazyna jest typowym inhibitorem
β-oksydacji, który dodatko-
wo pobudza aktywność dehydrogenazy pirogronianowej.
We wstępnych próbach klinicznych zostały potwierdzone obserwacje do-
świadczalne. W testach wysiłkowych wydłużył się czas do wystąpienia bólu
i znamiennego obniżania odcinka ST.
W badaniach klinicznych u 100 pacjentów ze stabilną dusznicą bolesną,
którzy otrzymywali ranolazynę IR w dawce 400 mg 3 razy dziennie, uzyska-
no istotną poprawę kliniczną; zmniejszyła się częstość napadów bólów dławi-
cowych i uległo ograniczeniu użycie nitrogliceryny. W dużym międzynaro-
dowym badaniu MARISA, w którym pacjenci otrzymywali w monoterapii
ranolazynę SR w dawce 500 mg, 1000 mg i 1500 mg 2 razy dziennie, uzyska-
no poprawę tolerancji wysiłkowej, przy dobrej tolerancji leku przy wysokim
dawkowaniu. Wykazano jednak niewielki wzrost skorygowanego odcinka
QT (QTc). Wzrost był niewielki (5-13 ms), zależny od wielkości dawki. Nie
stanowi to szczególnego zagrożenia dla pacjentów z prawidłowym czasem
trwania odcinka QTc w zapisie EKG. Okresowej kontroli wymagają pacjen-
ci z nieco wydłużonym odcinkiem QTc.
Aktualnie prowadzone badania CARISA – biorą w nich także udział
ośrodki polskie – poświęcone są ocenie ranolazyny w połączeniu z innymi
lekami wieńcowymi (leki
β-adrenolityczne, azotany, antagoniści kanałów
wapniowych) w przewlekłej dusznicy bolesnej. Oceniana w nich jest po-
prawa w zakresie niewydolności wieńcowej w zależności od poziomu rano-
lazyny w surowicy oraz ewentualnej interakcji pomiędzy podawanymi le-
kami. Zakres dawek mieści się w limicie 500-1000 mg 2 razy dziennie.
Wcześniejsze próby z tym lekiem stwarzają nadzieję na korzystne efekty
kliniczne.
Karnityna
Wreszcie trzeci lek wymieniony w tej grupie – karnityna i jej pochodna
propionylo-L-karnityna – jest związkiem naturalnym, występującym w przy-
rodzie. Jak się wydaje, jest ona wewnątrzkomórkowym mediatorem utlenia-
nia glukozy w komórkach mięśnia sercowego – reguluje transport kwasów
tłuszczowych do wnętrza mitochondriów, obniża w nich stosunek acetylo-
-CoA do CoA. Ponadto stymuluje aktywność dehydrogenazy pirogroniano-
wej. Choć doświadczenia kliniczne z karnityną są niewielkie, to jednak do-
tychczasowe publikacje dowodzą korzystnego wpływu tego leku u chorych
z ostrym zawałem serca. Wczesne rozpoczęcie leczenia w ostrym zawale ser-
ca i kontynuowanie przez 12 miesięcy poprawia wydolność lewej komory
i ogranicza jej rozstrzeń w porównaniu z grupą kontrolną. Istota działania
222

tego leku, to zwiększanie aktywności dehydrogenazy pirogronianowej, co na-
sila spalanie tlenowe glukozy w mięśniu sercowym.
W nowych badaniach klinicznych wykazano, że doustne podawanie karni-
tyny w dawce 3 g dziennie przez 28 dni po wystąpieniu zawału serca zmniej-
sza częstość ostrych incydentów wieńcowych, w tym ponownych zawałów
i zgonów sercowych. Ponadto stwierdzono efekt kardioprotekcyjny podając
L-karnitynę chorym po pomostowaniu wieńcowym.
Fosfokreatyna
Jest podstawowym związkiem energetycznym skurczu mięśniowego. Wy-
kazano w wielu badaniach klinicznych jej pozytywny efekt kardioprotek-
cyjny w warunkach niedokrwienia mięśnia sercowego. Ocenia się, że głów-
ny mechanizm protekcyjny fosfokreatyny to ochrona błony komórkowej
przed utlenianiem jej lipidów i białek przez wolne rodniki tlenowe i to za-
równo w ostrym niedokrwieniu, jak też w okresie reperfuzji. Stąd coraz po-
wszechniejsze stosowanie fosfokreatyny w ostrej fazie zawału serca, jak też
w osłonie zabiegów kardiochirurgicznych, czy inwazyjnych działań na na-
czyniach wieńcowych. Udowodniono korzystny efekt stosowania egzogen-
nej fosfokreatyny na zmniejszanie i odwracanie dysfunkcji skurczowej le-
wej komory po zawale i w stanach po epizodach dłuższego niedokrwienia.
Obserwowano też wyraźne ograniczenie strefy martwicy, znamiennie
mniejszą ilość groźnych komorowych zaburzeń rytmu po stosowaniu fos-
fokreatyny. Przeciętne, dożylne dawki fosfokreatyny to kilka gramów pre-
paratu na dobę.
Arginina
L-arginina jest prekursorem tlenku azotu. Jest endogennym regulato-
rem tonusu naczyniowego. Ma efekt protekcyjny – udowodniono jej ha-
mujący wpływ na rozwój miażdżycy, odwracanie dysfunkcji śródbłonka na-
czyniowego.
Podawanie L-argininy przez okres 6 tygodni w dawce 5-12 g/dobę wyraź-
nie poprawia tolerancję wysiłku i znamiennie zwiększa przepływ przez przed-
ramię.
Magnez
W szerszych badaniach doświadczalnych na zwierzętach oraz klinicznych
na ludziach wykazano korzystny efekt podawania magnezu m.in. na:
223

• ograniczenie strefy martwicy w zawale mięśnia sercowego;
• znamienne zmniejszenie dysfunkcji (skurczowej) pozawałowej lewej
komory.
Powyższe korzyści osiągano tylko wtedy, kiedy stosowano wlew magnezu
wcześnie, już łącznie z leczeniem fibrynolitycznym, czy inwazyjnym w ostrym
zawale serca.
Adenozyna
Jest naturalnym nukleozydem odgrywającym ważną rolę w regulacji krąże-
nia wieńcowego i rytmu serca. Poza dowiedzionym działaniem wazodilata-
cyjnym w krążeniu wieńcowym, wykazuje szereg dodatkowych właściwości
w warunkach niedokrwienia – zmniejsza „wyczerpanie energetyczne”, ha-
muje produkcję nadtlenków, stymuluje glikolizę, przeciwdziała nadmiernej
β-adrenergicznej stymulacji serca.
To wszystko pozwala zaliczyć ją do „modulatorów metabolicznych”, dają-
cych silny efekt kardioprotekcyjny, zwłaszcza w stanach przedłużonego nie-
dokrwienia. Ostatnio wykazano istotną rolę adenozyny w mechanizmie kar-
dioprotekcji endogennej – preconditioningu – oraz jako potencjalnego
czynnika hamującego agregację płytek w zmienionych miażdżycowo naczy-
niach. Uważa się, że adenozyna, obok prostacykliny, jest częścią śródbłonko-
wego systemu przeciwzakrzepowego.
Obecne zastosowanie adenozyny to perfuzja wieńcowa i leczenie nadko-
morowych zaburzeń rytmu, a w niedalekiej przyszłości kardioprotekcja,
zwłaszcza w stanach przedłużającego się niedokrwienia. Średnia dawka to
6-18 mg preparatu dożylnie – pod ścisłą kontrolą rytmu serca.
Inne leki o działaniu metabolicznym
Poza lekami działającymi przede wszystkim na metabolizm komórkowy,
zwanymi regulatorami metabolizmu, istnieje szereg podstawowych leków
kardiologicznych, stosowanych w chorobie niedokrwiennej serca, niewydol-
ności serca i nadciśnieniu tętniczym, które mają ważne działanie metabo-
liczne, określane często jako działanie pleotropowe. Do nich należą przede
wszystkim inhibitory reduktazy HMG-CoA (statyny), leki
β-adrenolityczne,
inhibitory konwertazy angiotensyny (ACE-I).
Chociaż nie są to ściśle leki metaboliczne, to jednak zasługują, aby o ko-
rzystnych efektach ich działania metabolicznego wspomnieć.
224

• Statyny
Statyny hamują szlak biosyntezy cholesterolu, który odbywa się na pozio-
mie enzymu reduktazy 3-hydroksy-3metyloglutarylu-koenzymu A (HMG-
-CoA), a który bierze udział w syntezie izoprenu. Pochodne izoprenu uczest-
niczą w licznych procesach metabolicznych. Szlak ten prowadzi do powstania
dużej liczby produktów końcowych, mających znaczenie dla różnych proce-
sów komórkowych, takich jak: glikozylacja, izoprenylacja białek, kontrola
wzrostu.
Wśród znanych działań pleotropowych, jak poprawa dysfunkcji śródbłon-
ka i zwiększanie biodostępności NO, należy wymienić efekt tkankowego
działania metabolicznego. Są to: działanie antyoksydacyjne, hamujące
wstrząs oksydacyjny w niedokrwionych komórkach i hamowanie wychwytu
lipoprotein, co przyczynia się do „wyciszenia” aktywnych procesów w blasz-
ce miażdżycowej.
W badaniach doświadczalnych udowodniono, że efekty te zjawiają się czę-
sto wcześniej, niż można zaobserwować istotne obniżenie poziomu choleste-
rolu w surowicy. Spostrzeżenia te wydają się potwierdzać ostatnie doświad-
czenia kliniczne w ostrych zespołach wieńcowych.
Aby efekty te osiągnąć, niezbędne są jednak skuteczne dawki statyn, mie-
rzone jednak efektywnym obniżeniem poziomu cholesterolu. Dla bardziej
znanych statyn byłyby to następujące dawki: atorwastatyna – 10-40 mg/d,
simwastatyna – 20-40 mg/d, prawastatyna – 20-40 mg/d, lowastatyna – 20-40
mg/d, fluwastatyna – 20-40 mg/d.
• Leki beta-adrenolityczne
Większość leków
β-adrenolitycznych wykazuje działanie ochronne przed
toksycznym wpływem katecholamin na niedokrwiony mięsień sercowy. Mię-
dzy innymi konsekwencją tego działania jest przesunięcie spalań tkankowych
z kwasów tłuszczowych w kierunku glukozy; mierzone to jest lepszym wyko-
rzystaniem glukozy i zwiększoną estryfikacją mleczanów oraz spadkiem stę-
żenia w surowicy wolnych kwasów tłuszczowych. W konsekwencji tego na-
stępuje wzrost rezerw energetycznych; rośnie stężenie ATP i fosfokreatyny.
Niektóre
β-adrenolityki, np. carvedidol, mają właściwości antyoksydacyjne,
co zmniejsza zagrożenie stresem oksydacyjnym.
Mówiąc o metabolicznym działaniu leków
β-adrenolitycznych, należy nad-
mienić, że mogą one powodować objawy niepożądane; niekorzystne zmia-
ny w profilu lipidów
LDL, TG, ¯HDL) oraz ukrytą hipoglikemię. Dotyczy
to szczególnie leków
β-adrenolitycznych nieselektywnych. Należy jednak
225

podkreślić, że korzystne efekty działania metabolicznego
β-adrenolityków
wielokrotnie przewyższają możliwości wystąpienia opisanych objawów nie-
pożądanych. Działanie kardioprotekcyjne leków
β-adrenolitycznych jest
mierzone zmniejszeniem zgonów i ostrych incydentów wieńcowych u pacjen-
tów po przebytym zawale serca (redukcja zgonów o 32-36%).
• Inhibitory konwertazy angiotensyny (ACE-I)
Wśród licznych efektów działania pleotropowego ACE-inhibitorów należy
podkreślić ich wpływ na metabolizm glukozy. Inhibitory ACE szczególnie
skuteczne okazały się w leczeniu nadciśnienia tętniczego i niewydolności ser-
ca u pacjentów z cukrzycą; znacząco zmniejszały częstość powikłań w cho-
robach układu sercowo-naczyniowego. Mechanizm działania ACE-inhibito-
rów polega na zmniejszaniu insulinooporności niedokrwionych tkanek
z zaburzoną tolerancją glukozy. A właśnie oporność na insulinę w okresie
„przedcukrzycowym” wydaje się być mechanizmem leżącym u podstaw
zwiększonego ryzyka miażdżycy.
Jak wynika z tego krótkiego przeglądu „modyfikatorów metabolicznych”,
posiadamy obecnie kilka leków, które m.in. przesuwają metabolizm komór-
kowy na korzystny szlak: hamują spalanie kwasów tłuszczowych i zwiększają
oksydację glukozy, co podnosi wydajność przemian energetycznych w ko-
mórce mięśnia sercowego i zapobiega dalszej jej destrukcji.
Również w niewydolności serca o podłożu niedokrwiennym, istnieją prze-
słanki dla stosowania leków metabolicznych.
Doświadczenia płynące z dotychczasowych badań tej grupy leków stwarza-
ją perspektywy nowego podejścia do leczenia choroby niedokrwiennej i nie-
wydolności serca.
Zapamiętaj!
1. Leki metaboliczne są coraz częściej stosowane we wszystkich stadiach cho-
roby niedokrwiennej serca.
2. Uzasadnione jest też ich stosowanie w stanach niewydolności serca, zwłasz-
cza niedokrwiennej.
3. Leki metaboliczne znajdują zastosowanie w ochronie miokardium w trak-
cie zabiegów inwazyjnych czy kardiochirurgicznych.
4. Leki metaboliczne nie wykazują niekorzystnego działania na hemodyna-
mikę, pomimo tego, że są grupą leków wysoce niejednorodnych.
226

5. Korzystne działanie metaboliczne mają też leki innych grup, szeroko stoso-
wane w leczeniu choroby niedokrwiennej serca: dysfunkcji śródbłonka na-
czyniowego (ACE-inhibitory,
β-adrenolityki, antagoniści kanałów wapnio-
wych, statyny).
6. Lepsze poznanie mediatorów endogennych reakcji adaptacyjnych (precon-
ditioning, ogłuszenie, zamrożenie mięśnia sercowego) pozwoli na jeszcze
lepsze „wsparcie metaboliczne” schorzeń układu sercowo-naczyniowego
w przyszłości.
Polecane lektury:
D. J. Hearse: Metaboliczne aspekty choroby niedokrwiennej serca; Via Me-
dica, Gdańsk, 1998.
G. D. Johnston: Fundamentals of Cardiovascular Pharmacology; New York,
1999.
J. Kuch, L. Ceremużyński: Wpływ mieszanki polaryzującej KIG na utrzyma-
nie efektów defibrylacji elektrycznej serca; Pol. Arch. Med. Wewn., 1967, 39,
511.
K. Przyklenk i wsp.: Ischemic preconditioning: endogenous cardioprotection;
Boston, Mass Kluwer, 1994.
D. M. Yellon, S. H. Rahimtoola, L. H. Opie: Nowe zespoły niedokrwienne;
Via Medica, Gdańsk, 2001.
227

XIX. LEKI ANTYARYTMICZNE – KIEDY I JAK (NIE)
STOSOWAĆ?
Jarosław Król, Monika Tomaszewska-Kiecana, Edyta Kostarska-Srokosz,
Mirosław Dłużniewski
PRZYCZYNY ZABURZEŃ RYTMU
Zaburzenia rytmu serca mogą być objawem wielu chorób układu serco-
wo-naczyniowego, ale mogą być także spowodowane stanami patologiczny-
mi w innych narządach i układach (tab. 1). Gdy pacjent zgłasza: kołatanie
serca, uczucie zamierania serca, silne lub szybkie bicie serca, pokasływanie
przy wysiłku, a także – co bywa coraz częściej obserwowane – trudności przy
pomiarze ciśnienia tętniczego za pomocą elektronicznego aparatu, należy
myśleć o zaburzeniach rytmu.
Jak zawsze, dokładny wywiad wsparty wynikami badań dodatkowych, po-
zwala na postawienie trafnej diagnozy. Diagnoza jest szczególnie ważna w tej
grupie chorych, bo zaburzenia rytmu serca mogą być banalną dolegliwością,
ale mogą też stanowić zagrożenie życia. Podobnie jak w innych sytuacjach
klinicznych, gdy tylko jest to możliwe, należy dążyć do usunięcia przyczyny,
228
Tabela 1: Sercowe i pozasercowe przyczyny zaburzeń rytmu serca
PRZYCZYNY
SERCOWO-NACZYNIOWE
PRZYCZYNY
POZASERCOWE
• choroba niedokrwienna serca;
• wady zastawkowe;
• kardiomiopatie;
• nadciśnienie tętnicze;
• zapalenie mięśnia sercowego;
• zawał serca;
• zespół WPW, zespół
wydłużonego QT;
• arytmogenna dysplazja prawej
komory;
• nadczynność tarczycy;
• zaburzenia jonowe;
• choroby układu oddechowego
(POChP);
• niedokrwistość;
• ostre infekcje wirusowe;
• gorączka;
• choroby w jamie brzusznej
(kamica, przepuklina rozworu
przełykowego);
• skutek stosowania leków;

a nie zadowalać się leczeniem objawów. Uwzględniając pozasercowe przy-
czyny zaburzeń rytmu można uzyskać pełne wyleczenie nie tylko objawów,
ale także choroby podstawowej.
LEKI ANTYARYTMICZNE
W 1640 roku sprowadzono do Europy korę chinową, z której wytwarzano
lek przeciwgorączkowy, później przeciwmalaryczny – chininę. W XX wieku
pochodna chininy – chinidyna, dała początek całej rodzinie leków stosowa-
nych z różnym powodzeniem u chorych z zaburzeniami rytmu serca. Było to
typowe leczenie objawów oparte na obserwacji, że podczas stosowania chini-
ny, jako leku przeciwmalarycznego, chorzy z migotaniem przedsionków czu-
li się lepiej. Wieloletnie obserwacje wykazały podobne działania uboczne
u chorych leczonych zarówno chininą, jak i chinidyną, zwane zatruciem chi-
ninowym. W latach pięćdziesiątych i sześćdziesiątych opisano wśród pacjen-
tów przewlekle leczonych chinidyną nagłe zgony. W tym czasie znane były
już inne leki antyarytmiczne, niektóre z nich stosowane bywają do dziś, inne
wykazały działania niepożądane lub brak skuteczności i wyszły z użycia. Pró-
bą usystematyzowania leków antyarytmicznych był podział zaproponowany
w 1970 roku przez Vaughana-Williamsa, wielokrotnie modyfikowany.
Do grupy I zalicza się leki o działaniu blokującym kanały sodowe, których
podstawowym działaniem elektrofizjologicznym jest zmniejszenie szybkości
powstawania potencjału czynnościowego. W tej grupie wyróżniamy 3 pod-
grupy leków, różniące się między sobą kinetyką interakcji z kanałem sodo-
wym.
Do grupy Ia należą leki wydłużające czas trwania potencjału czynnościo-
wego (chinidyna, prokainamid, ajmalina, dizopiramid). Wydłużają one okres
refrakcji i repolaryzacji. Grupę tę cechuje pośrednia kinetyka wiązania z ka-
nałem sodowym.
Grupę Ib tworzą leki zmniejszające czas trwania potencjału czynnościo-
wego (lidokaina, fenytoina, meksyletyna, tokainid, apryndyna). Skracają
okres repolaryzacji oraz charakteryzują się szybką kinetyką wiązania z ka-
nałem sodowym.
Do grupy Ic zaliczane są leki, nie wpływające istotnie na czas trwania po-
tencjału czynnościowego (enkainid, flekainid, lorkainid, morycyzyna, propa-
fenon). Słabo wpływają na repolaryzację i okres refrakcji. Cechą charaktery-
styczną tej grupy jest wolna kinetyka wiązania z kanałem sodowym.
Opierając się na obserwacjach klinicznych, 3 podklasy grupy I można opi-
sać następująco:
229

• Leki z grupy Ia: poszerzają QRS, przedłużają odstęp H-V, przedłużają
okres refrakcji i opóźniają wystąpienie repolaryzacji. Chinidyna i proka-
inamid posiadają dodatkowo właściwości cholinolityczne.
• Leki z grupy Ib: nieznacznie wpływają na czas trwania QRS lub odstęp
H-V, nie przedłużają okresu refrakcji.
• Leki z grupy Ic: poszerzają zespół QRS, przedłużają odstęp H-V, nie-
znacznie wydłużają okres refrakcji.
Do grupy II zaliczono leki
β-adrenolityczne, które zmniejszają szybkość
depolaryzacji oraz przedłużają czas trwania potencjału czynnościowego. Sta-
nowią ważną grupę leków antyarytmicznych, zmniejszających lub wyłączają-
cych adrenergiczną stymulację receptorów w mięśniu sercowym oraz w ukła-
dzie bodźcoprzewodzącym, co prowadzi do hamowania automatyzmu węzła
zatokowo-przedsionkowego i ośrodków ektopowych.
Do grupy III należą leki, których główne działanie antyarytmiczne zależy
od przedłużenia czasu trwania potencjału czynnościowego, a w konsekwen-
cji wydłużania czasu refrakcji mięśnia sercowego (amiodaron, bretylium, so-
talol) oraz ostatnio wprowadzane leki blokujące kanały potasowe (dofety-
lid, azymilid, sematylid, ambazylid, almokalant).
Grupę IV stanowią leki hamujące powolny napływ jonów wapniowych do
wnętrza komórek sercowych, a więc drugą fazę potencjału czynnościowego.
Do tej grupy zaliczamy leki blokujące kanały wapniowe (verapamil, diltia-
zem).
PROARYTMICZNE DZIAŁANIE LEKÓW ANTYARYTMICZNYCH
Występowanie nagłych zgonów obserwowano początkowo u chorych le-
czonych chinidyną. Okazało się jednak, że zjawisko to występuje także
u chorych leczonych innymi lekami, głównie z grupy I, ale także (choć rza-
dziej), amiodaronem czy sotalolem. Przyczyna tych zgonów nie była znana.
Analiza zapisów EKG u niektórych pacjentów leczonych antyarytmicznie
wykazuje znamienne (>0,6 s) wydłużenie QT, podobnie jak pod wpływem
trójcyklicznych leków przeciwdepresyjnych, czy w rodzinnym zespole wydłu-
żonego QT. Wydłużenie QT związane jest z ryzykiem nagłego zgonu. Moni-
torowanie dobowe EKG metodą Holtera chorych leczonych lekami anty-
arytmicznymi, pozwoliło na wykazanie złożonych komorowych zaburzeń
rytmu, a wśród nich – wielokształtnego częstoskurczu komorowego typu tor-
sades de pointe, których nie rejestrowano przed rozpoczęciem leczenia. Prak-
230

tyczną wskazówką wynikającą z tych obserwacji, jest pomiar odstępu QT,
zwłaszcza w pierwszym okresie stosowania leków antyarytmicznych. Znacz-
ne wydłużenie QT może być sygnałem zagrożenia nasileniem zaburzeń ryt-
mu.
W latach osiemdziesiątych, na podstawie obserwacji klinicznych wykazano,
że w grupie chorych po przebytym zawale serca największą śmiertelnością
zagrożeni są chorzy z komorowymi zaburzeniami rytmu serca (KZR). Uzna-
no, że leczenie antyarytmiczne zastosowane u wszystkich chorych z zaburze-
niami rytmu po zawale pozwoli na zmniejszenie śmiertelności. Badania
CAST (Cardiac Arrhythmia Suppression Trial) miały to udowodnić. U cho-
rych po przebytym zawale serca z komorowymi zaburzeniami rytmu, zasto-
sowano leki z grupy I – encainid, flecainid i morycyzynę w porównaniu z pla-
cebo. Badanie przerwano z powodu istotnie większej śmiertelności
w grupach aktywnie leczonych w porównaniu z placebo. W ten sposób bole-
śnie przekonano się, że proarytmicznego działania leków antyarytmicznych
nie można lekceważyć. Zjawisko to jest groźne, może być potencjalną przy-
czyną nagłego zgonu.
Powszechne zastosowanie monitorowania dobowego EKG pozwoliło nie
tylko na poznanie zaburzeń rytmu, ich klasyfikację, opisanie ich spontanicz-
nej zmienności dobowej, ale także ustalenie wskazań do leczenia. Podział
kliniczny komorowych zaburzeń rytmu na łagodne, potencjalnie złośliwe
i złośliwe zaproponowany przez Biggera łączy wyniki badań dodatkowych
z pełnym obrazem klinicznym i stanowi najlepszą wskazówkę do leczenia.
KOGO LECZYĆ, JAK LECZYĆ?
Jeżeli wyniki badań przeprowadzonych u pacjenta zgłaszającego dolegli-
wości spowodowane zaburzeniami rytmu nie wykazują żadnej organicznej
choroby serca, można przyjąć, że zaburzenia rytmu są łagodne i wtedy roz-
począć leczenie. W tej grupie chorych nie ma wskazań do stosowania leków
grupy I lub III. Łagodne zaburzenia rytmu poddają się leczeniu solami pota-
su i magnezu. Dobrze reagują na tonizujące leki ziołowe. Spośród leków
o działaniu antyarytmicznym jedynie
β-adrenolityki mogą być zastosowane.
Ważne jest wytłumaczenie choremu, że pomimo dokuczliwości zaburzeń ryt-
mu, nie występuje zagrożenie życia. Czasem zadanie to jest bardzo trudne.
Najliczniejsza grupa chorych, z potencjalnie złośliwymi komorowymi za-
burzeniami rytmu, jest niejednorodna. Ze szczególną uwagą należy oceniać
zagrożenie u chorych po przebytym zawale serca, przed wypisaniem ze szpi-
tala. Pozawałowe uszkodzenie serca ocenione w badaniu ECHO jako zabu-
231

rzenia kurczliwości, niska frakcja wyrzutowa, dodatni wczesny test wysiłko-
wy, ujawniający niedokrwienie w obszarze nie objętym zawałem, a także za-
burzenia rytmu rejestrowane podczas testu wysiłkowego lub w 24-godzinnej
rejestracji EKG metodą Holtera, stanowią wskazanie do pilnej koronaro-
grafii. Przywrócenie przepływu w zamkniętej tętnicy „dozawałowej” lub in-
terwencja w innej krytycznie zwężonej tętnicy wieńcowej może być skutecz-
nym sposobem na uniknięcie groźnych zaburzeń rytmu, będących powodem
nagłego zgonu. Podobny efekt dać może chirurgiczne leczenie skutków za-
wału serca (np. wycięcie tętniaka będącego źródłem pobudzeń dodatko-
wych). Udowodniona skuteczność leków
β-adrenolitycznych w prewencji
wtórnej po przebytym zawale serca polega także na ograniczeniu incyden-
tów KZR i zmniejszeniu zagrożenia nagłym zgonem.
Inna grupa chorych z potencjalnie złośliwymi KZR, to chorzy z nadciśnie-
niem tętniczym, z przerostem lewej komory. Zaburzenia rytmu mogą być
wtórne do przerostu komory lub zaburzeń jonowych powstających przy stoso-
waniu leków moczopędnych. Stosowane w dawkach skutecznie kontrolujących
ciśnienie, ACE-inhibitory oraz antagoniści kanałów wapniowych powodują re-
gresję przerostu mięśnia lewej komory, a więc pośrednio przeciwdziałają zabu-
rzeniom rytmu. Istnieją dowody, że regresja przerostu lewej komory zmniejsza
częstość występowania zaburzeń rytmu i poprawia rokowanie.
Zaburzenia rytmu w omówionych grupach chorych stanowią potencjalne
zagrożenie zgonem w stanach zaostrzenia choroby podstawowej – w niesta-
bilnej dusznicy bolesnej, w przełomie nadciśnieniowym lub gdy chory pod-
dany ma być zabiegowi operacyjnemu. Leczenie zaburzeń rytmu nabiera
wtedy nowego znaczenia, pojawiają się wskazania do stosowania profilak-
tycznego leków antyarytmicznych. Nadal jednak nie są to leki klasy I. Chory
leczony jest w tych stanach w warunkach szpitalnych. Pozwala to na poda-
nie dożylne nasycającej dawki amiodaronu – leku o wypróbowanej skutecz-
ności w leczeniu KZR, ale potencjalnie toksycznie działającego na tarczycę
przy dłuższym stosowaniu. Wskazania do dalszego przewlekłego podawania
amiodaronu ustalane są podczas hospitalizacji. Ze względu na dość częste
występowanie zaburzeń czynności tarczycy (nadczynność lub niedoczynność)
w trakcie stosowania amiodaronu, konieczna jest jej ocena biochemiczna
i morfologiczna przed podaniem leku.
Najmniej liczną, ale o najcięższym rokowaniu grupę, stanowią chorzy
z groźnymi, złośliwymi zaburzeniami rytmu. Do grupy tej zalicza się chorych
z objawami niewydolności serca, w przebiegu wad serca, kardiomiopatii,
z przerostem lewej komory będącym skutkiem nadciśnienia, z pozawałowym
zwłóknieniem serca. U chorych tych rejestruje się najgroźniejsze złożone
232

arytmie komorowe, takie jak nieutrwalony częstoskurcz komorowy, często-
skurcz komorowy typu torsades de pointe, rzadziej utrwalony częstoskurcz
komorowy. Do grupy tej zalicza się także chorych po przebytym incydencie
zatrzymania krążenia spowodowanego migotaniem komór. Wśród chorych
nieleczonych nagły zgon występuje aż u 61% pacjentów podczas rocznej ob-
serwacji, dotyczy to chorych z niewydolnością serca klasy III wg NYHA, gdy
uszkodzenie mięśnia lewej komory jest większe (NYHA IV), nagłe zgony
występują w 21%. Leczenie zaburzeń rytmu w tej grupie chorych jest szcze-
gólnie trudne, gdyż tradycyjne leki antyarytmiczne działają kardiodepresyj-
nie, zwykle pogarszają i tak już upośledzoną kurczliwość mięśnia sercowe-
go. Kluczem do leczenia tych pacjentów jest właściwe leczenie niewydolności
serca. Leczenie to uwzględnia zmiany humoralno-biochemiczne powodują-
ce zaburzenia rytmu. Leczenie ACE-inhibitorami i
β-adrenolitykami, cza-
sem inhibitorami receptora AT1 i antagonistami aldosteronu jest zatem po-
stępowaniem antyarytmicznym w niewydolności serca. Leki
β-adreno-
lityczne, podobnie jak w prewencji wtórnej zawału serca, należą dziś do stan-
dardowych leków stosowanych w niewydolności krążenia. Ich działanie opie-
ra się nie tylko na poprawie metabolizmu i bilansu tlenowego, ale także na
zmniejszeniu gotowości arytmicznej, co niewątpliwie wpływa na poprawę ro-
kowania u tych chorych. Dowodem na skuteczność takiego postępowania są
wyniki badań CIBIS II i MERIT, a także ostatnio ogłoszone wyniki badania
CARMEN. Niestety, ciągle jeszcze istnieje wiele ograniczeń do stosowania
β-adrenolityków u chorych z niewydolnością serca, którzy są często w wie-
ku podeszłym i mają inne schorzenia, takie jak cukrzyca, niewydolność nerek
czy wątroby, a także zaawansowane zmiany w tętnicach obwodowych.
U chorych ze złośliwymi zaburzeniami rytmu alternatywą może być lecze-
nie za pomocą wszczepianego kardiowertera-defibrylatora. W nielicznych
na razie badaniach (MADIT I i MADIT II) wykazano wyższą skuteczność
leczenia elektrofizjologicznego. Ta nowa metoda leczenia jest na razie bar-
dzo droga, ale można oczekiwać, że w przyszłości będzie tak powszechnie
stosowana, jak stymulatory serca.
Zapamiętaj!
1. Nie zawsze zaburzenia rytmu serca świadczą o chorobie układu sercowo-na-
czyniowego.
2. Leczenie przyczynowe zaburzeń rytmu serca, z uwzględnieniem metod nie-
farmakologicznych daje szansę na uniknięcie powikłań związanych ze sto-
sowaniem leków antyarytmicznych.
233

Polecane lektury:
The Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Prelimina-
ry report: Effect of encainide and flecainide on mortality in randomized trial
of arrhythmia suppression after myocardial infarction; N. Engl. J. Med. 1989,
321, 406.
J. T. Bigger: Definition of benign versus malignant ventricular arrhythmias.
Target for treatment; Am. J. Cardiol. 1983, 52, 47C.
A. J. Moss, J. Hall, D. S. Cannom i wsp.: For the Multicenter Automatic De-
fibrillator Implantation Trial Investigators. (MADIT) Improved survival with
an implanted defibrillator in patients with coronary disease at high risk for
the ventricular arrhythmias; N. Engl. J. Med. 1996, 335: 1933-40.
234

XX. HORMONALNA TERAPIA ZASTĘPCZA – NADZIEJA
CZY ROZCZAROWANIE?
Katarzyna Cybulska, Joanna Syska-Sumińska,
Iwonna Grzywanowska-Łaniewska
Choroby układu krążenia stanowią najważniejszą przyczynę zgonów ko-
biet po menopauzie. Kobieta po 50. roku życia ma 46% ryzyko zachorowania
na chorobę niedokrwienną serca (ChNS), natomiast prawdopodobieństwo
rozwinięcia się u niej raka sutka lub raka endometrium wynosi odpowied-
nio: 10% i 2,6%. Według danych amerykańskich, co druga kobieta umiera
z powodu choroby serca lub udaru mózgu, natomiast jedna na 25 z powodu
raka sutka. Choroby układu sercowo-naczyniowego stanowią więc jeden
z najpoważniejszych problemów opieki zdrowotnej nad kobietami w star-
szym wieku. Wyraźny wzrost zapadalności na ChNS u kobiet po menopauzie
sugeruje ochronny wpływ żeńskich hormonów płciowych na rozwój miażdży-
cy. Uważa się, że mechanizm tego działania polega na ich korzystnym wpły-
wie na profil lipidowy i inne czynniki metaboliczne oraz na naczynia i hemo-
dynamikę. Obserwacje te stały się bodźcem do rozpoczęcia badań
klinicznych oceniających wpływ leczenia hormonalnego na czynniki ryzyka
miażdżycy, a także podjęcia prób tego leczenia u kobiet z chorobą wieńcową.
Niestety, pomimo niezwykle zachęcających wyników wielu badań obserwa-
cyjnych, nie dysponujemy obecnie wynikami randomizowanych, kontrolo-
wanych placebo, badań prospektywnych potwierdzających korzyści ze stoso-
wania hormonalnej terapii zastępczej (HTZ) u kobiet z chorobą wieńcową.
Przeciwnie, ogłoszone w sierpniu 1998 roku wyniki badania HERS, a na-
stępnie HERS II oraz wyniki innych badań dotyczących prewencji wtórnej
(ERA, CARS, WEST) i pierwotnej (WHI) stanowią przestrogę przed wy-
ciąganiem zbyt daleko idących wniosków z badań obserwacyjnych.
METODY HORMONALNEJ TERAPII ZASTĘPCZEJ
Podstawowym składnikiem hormonalnej terapii zastępczej są estrogeny
naturalne. Należy odróżnić je od estrogenów syntetycznych stosowanych
w dużych dawkach, koniecznych dla zahamowania owulacji, w antykoncepcji
doustnej. Estrogeny naturalne posiadają znacznie słabszy wpływ na wątro-
bową produkcję białek i pozbawione są większości niekorzystnych efektów
metabolicznych typowych dla preparatów syntetycznych. Najczęściej stoso-
wanymi estrogenami naturalnymi są 17-beta-estradiol (17
β-E2), lub sprzężo-
ne estrogeny końskie (CEE). Preferowane są małe dawki tych preparatów
(17
β-E2: 1-2 mg/dobę, CEE: 0,625 mg/dobę), które w większości przypad-
235

ków zapewniają stężenie terapeutyczne estradiolu (E2) w surowicy (40-100
pg/ml). U kobiet z zachowaną macicą leczenie estrogenami należy równo-
ważyć odpowiednią dawką progestagenów dla ochrony przed atypowym
przerostem i rakiem endometrium. Aby ochrona ta była skuteczna, proge-
stageny powinny być podawane przynajmniej przez 10 dni w miesiącu).
Obecnie dostępne są trzy grupy progestagenów:
• pochodne 19-nortestosteronu (norethisteron, lewonorgestrel, linestre-
nol);
• naturalny progesteron;
• pochodne progesteronu naturalnego (octan medroxyprogesteronu-
MPA, dydrogesteron).
Pochodne 19-nortestosteronu charakteryzują się silnym działaniem andro-
gennym i anabolicznym na metabolizm kości, natomiast ze względu na nie-
korzystny wpływ na lipidy surowicy, nie są polecane w HTZ u pacjentek
z chorobami układu krążenia (ChUK). W tych przypadkach zaleca się po-
dawanie progesteronu naturalnego i jego pochodnych, które charakteryzują
się znikomym działaniem androgennym i podobnym do estrogenów wpły-
wem na gospodarkę lipidową. Najczęściej stosowanym progestagenem jest
MPA, podawany w dawkach od 2,5 do 10 mg/dobę w zależności od schema-
tu leczenia. Czynnikiem ograniczającym stosowanie naturalnego progeste-
ronu jest jego krótki okres półtrwania i związane z tym trudności w uzyska-
niu stężenia terapeutycznego w surowicy, dlatego też przy leczeniu doustnym
konieczne jest zastosowanie preparatów mikronizowanych o kontrolowanym
uwalnianiu.
Istnieją trzy podstawowe schematy podawania leków w hormonalnej tera-
pii zastępczej, są to:
• Estrogenowo-progestagenowa terapia cykliczna (ryc. 1) – polegająca na
podawaniu estrogenów przez 21 dni z 10-12-dniową „wstawką” proge-
stagenową w drugiej połowie cyklu. Ten schemat terapii naśladuje natu-
ralną grę hormonalną, typową dla cyklu miesiączkowego z okresowym
złuszczaniem błony śluzowej macicy w okresie tygodniowej przerwy
w podawaniu leków. Terapia cykliczna jest metodą z wyboru u kobiet
z niedoborami estrogenów w okresie premenopauzalnym i wczesnym
okresie pomenopauzalnym.
236
Rycina 1: Estrogenowo-progestagenowa terapia cykliczna
• Estrogenowa terapia ciągła z cyklicznym podawaniem progestagenów
(ryc. 2) – polegająca na podawaniu estrogenów przez 28 dni oraz gesta-
genów od połowy drugiego do końca trzeciego tygodnia cyklu. W czasie
leczenia prowadzonego według tego schematu krwawienia miesięczne
występują tylko w początkowym okresie leczenia, po kilku miesiącach
stają się skąpe, a u starszych kobiet mogą w ogóle zanikać. Przerwa
w podawaniu gestagenów zapobiega atrofii endometrium nie wywołując
jednak krwawienia z odstawienia. Leczenie według tego schematu pro-
wadzi się u kobiet zgłaszających podczas terapii cyklicznej objawy wypa-
dowe w okresie tygodniowej przerwy w podawaniu leków.
Rycina 2: Estrogenowa terapia ciągła z cyklicznym podawaniem progestagenów
• Ciągła terapia estrogenowo-gestagenna (ryc. 3) – ten sposób leczenia
prowadzi do zmian zanikowych w błonie śluzowej macicy, będących kon-
sekwencją przewlekłego podawania gestagenów. Po okresie początko-
237
wych nieregularnych krwawień dochodzi do ustania miesiączkowania.
Terapia ta jest preferowana u kobiet starszych i tych, w których odczuciu
fakt występowania krwawień miesięcznych jest czynnikiem niepożąda-
nym.
Rycina 3: Ciągła terapia estrogenowo-gestagenna
U kobiet, które przebyły histerektomię, nie ma wskazań do podawania ge-
stagenów. W tych przypadkach prowadzi się jedynie ciągłą terapię estroge-
nową (ryc. 4).
Rycina 4: Ciągła terapia estrogenowa
Należy wspomnieć również o suplementacji gestagennej (ryc. 5), prowa-
dzonej w celu uzupełnienia niedoboru progestagenów, stwierdzanego u wie-
lu kobiet w okresie premenopauzalnym. U pacjentek tych stwierdza się czę-
sto nieprawidłowe krwawienia miesiączkowe oraz występowanie
estrogenozależnych rozrostów, takich jak: mięśniaki macicy, przerost endo-
metrium oraz choroba włóknisto-torbielowata sutków. Suplementacja ge-
238

stagenna odgrywa rolę w łagodzeniu dolegliwości subiektywnych i zapobie-
ganiu zmianom w układzie rozrodczym u kobiet w okresie premenopauzal-
nym, nie przynosi natomiast istotnych korzyści z punktu widzenia profilakty-
ki i leczenia chorób układu krążenia.
Rycina 5: Suplemenacja gestagenna
Zarówno estrogeny, jak i progestageny mogą być podawane doustnie lub
w postaci plastrów naklejanych na skórę. Uważa się, że estrogeny podawane
przezskórnie mają słabsze działanie na metabolizm lipidów i wątrobową
produkcję białek. Efekt ten tłumaczy się ominięciem przy podaniu prze-
zskórnym pierwszego przejścia przez wątrobę i mniejszym śródwątrobowym
stężeniem leku. Ta droga podawania może być preferowana u chorych
z uszkodzeniem wątroby, kamicą żółciową, hipertrójglicerydemią (HTG)
oraz nietolerancją preparatów doustnych.
Warto także wspomnieć o grupie związków będących wybiórczymi modu-
latorami receptora estrogenowego (selective estrogen receptor modulators –
SERMs), do których należą między innymi tamoksyfen i raloksyfen. Związ-
ki te łączą się z receptorami estrogenowymi w tkankach i mają podobny do
estrogenów wpływ na metabolizm kości i lipidów. SERMs są natomiast po-
zbawione niekorzystnego wpływu na endometrium i sutek, wykazując w tych
tkankach działanie antagonistyczne do estrogenów. Obecnie prowadzone
jest badanie RUTH (The Raloxifene Use for The Heart) mające na celu oce-
nę znaczenia stosowania raloksyfenu na występowanie incydentów sercowo-
-naczyniowych u kobiet.
239

WPŁYW HORMONALNEJ TERAPII ZASTĘPCZEJ NA CZYNNIKI
RYZYKA CHORÓB UKŁADU SERCOWO-NACZYNIOWEGO
Jak wspomniano na wstępie, dostępnych jest wiele badań obserwacyjnych,
których wyniki wskazują na korzystny wpływ HTZ na czynniki ryzyka ChUK.
W oparciu o te właśnie dane podejmowano próby stosowania HTZ, nie tyl-
ko u kobiet z klasycznymi wskazaniami do tego leczenia (objawy okołome-
nopauzalne, osteoporoza), ale także u pacjentek z czynnikami ryzyka lub już
istniejącą ChNS. Do najważniejszych efektów biologicznych działania HTZ
należą:
Wpływ na metabolizm lipidów
Działania estrogenów na przemiany lipoprotein uważane są za podstawo-
we z punktu widzenia kardioprotekcji i stanowiły przedmiot intensywnych
badań w ciągu ostatnich lat. Wiadomo, że estrogeny nasilają katabolizm
LDL obniżając ich stężenie w surowicy. Efekt ten związany jest z powodowa-
nym przez estrogeny wzrostem aktywności wątrobowych receptorów LDL.
Estrogeny zwiększają stężenie cholesterolu HDL przede wszystkim przez
zwiększenie jego syntezy, a także przez obniżenie aktywności lipazy wątrobo-
wej – enzymu ułatwiającego katabolizm HDL. Nie wszystkie efekty działania
estrogenów są korzystne z punktu widzenia prewencji miażdżycy; pod ich
wpływem dochodzi do nasilenia syntezy trójglicerydów (TG). Znaczenie kli-
niczne HTG, wywołanej stosowaniem estrogenów, w rozwoju choroby wień-
cowej jest niejasne; wiadomo, że do podwyższenia stężenia TG dochodzi
przede wszystkim w wyniku zwiększenia wytwarzania dużych, bogatych
w TG, cząsteczek VLDL. Cząsteczki te są następnie bezpośrednio usuwane
przez wątrobę, bez przekształcania w małe, bardziej aterogenne, VLDL
i LDL. Pacjenci z HTG, u których ryzyko ChNS jest duże, mają zazwyczaj
także obniżony poziom cholesterolu HDL, czego nie obserwuje się u pacjen-
tek z HTG poestrogenową.
Znacznie mniej wiadomo na temat wpływu progestagenów na metabolizm
lipoprotein. Wynika to między innymi z faktu, że jest to niejednorodna gru-
pa związków posiadających różnie nasilone działania androgenne i estrogen-
ne. Podawane doustnie progestageny mają przeciwstawne do estrogenów
działanie na lipidy. Efekt ten jest zależny od wpływu na metabolizm wątro-
bowy i wprost proporcjonalny do właściwości androgennych preparatu. Jest
więc najsilniej wyrażony w przypadku pochodnych 19-nortestosteronu, słab-
szy w przypadku medroksyprogesteronu i praktycznie nieobecny dla natu-
ralnego progesteronu. Nowe progestageny o dominującym działaniu estro-
gennym wpływają na metabolizm lipidów, tak jak estrogeny. Zarówno
240

estrogeny, jak i progestageny obniżają stężenie lipoproteiny A – Lp (a),
uznawanej za niezależny od cholesterolu czynnik ryzyka ChNS. Na stężenie
Lp (a) nie wpływa dieta, wysiłek fizyczny, ani większość preparatów hipoli-
pemizujących (z wyjątkiem kwasu nikotynowego). Istnieją doniesienia, że
terapia skojarzona estrogenami i progestagenami, a zwłaszcza progestage-
nami o dużej androgenności, powoduje sumowanie się korzystnego wpływu
na metabolizm Lp (a).
Długo wiele kontrowersji budził wpływ łącznej terapii estrogenowo-proge-
stagenowej na stężenia lipoprotein osocza. Istniały obawy, że dodatek proge-
stagenu może eliminować korzyści wynikające z podawania estrogenów.
Obaw tych nie potwierdziły ogłoszone w 1995 roku wyniki badania PEPI
(Postmenopausal Estrogen/Progestin Interventions). Trwało ono trzy lata i ob-
jęło 875 zdrowych kobiet po menopauzie, którym w oparciu o dobór loso-
wy, na zasadzie podwójnie ślepej próby, kontrolowanej placebo, podawano
koniugowane estrogeny końskie w monoterapii lub skojarzeniu z progesta-
genami (MPA lub mikronizowanym progesteronem). W porównaniu z pla-
cebo we wszystkich grupach znamiennie wzrosło stężenie cholesterolu HDL
i TG, a obniżyło się stężenie cholesterolu całkowitego i LDL (tab. 1).
Należy pamiętać, że chociaż HTZ ma korzystny wpływ na profil lipidowy,
jej skuteczność w leczeniu hipercholesterolemii, oceniana na podstawie re-
dukcji stężenia cholesterolu całkowitego i LDL, jest istotnie mniejsza niż
tradycyjnego leczenia hipolipemizującego. Z tego powodu nie można roz-
patrywać HTZ jako alternatywy dla leczenia z zastosowaniem statyn, zwłasz-
cza jeśli weźmie się pod uwagę dobrze udokumentowany, korzystny wpływ
ich stosowania na występowanie incydentów sercowo-naczyniowych i śmier-
telność.
241
Tabela 1: Wpływ hormonów stosowanych w HTZ na metabolizm lipidów
ChC
LDL
HDL
TG
Lp(a)
Estrogeny
↓↓
↓↓
↑↑
↑↑
↓
Progestageny*
↑
↑
↓
↑
↓
Estrogeny +
progestageny*
↓↓
↓↓
↑
↑
↓↓
ChC - cholesterol całkowity; TG - trójglicerydy
*dotyczy MPA i mikronizowanego progesteronu, stosowanych w badaniu PEPI

Estrogeny podane parenteralnie omijają wątrobę, unikając efektu pierw-
szego przejścia, pomimo tego indukują w wątrobie podobne zmiany, jak es-
trogeny podane doustnie, nie wpływają jednak niekorzystnie na stężenie TG.
Efekt leczenia parenteralnego na lipidy staje się wyraźny dopiero po dłuż-
szym okresie podawania estrogenów. Dołączenie progestagenu do estroge-
nowej terapii przezskórnej wydaje się nie modyfikować jej wpływu na lipi-
dy. W przypadku estrogenowo-progestagenowej terapii przezskórnej można
zauważyć trend w kierunku obniżania poziomu HDL, jednak dostępne wyni-
ki badań nie pozwalają na wyciągnięcie jednoznacznych wniosków.
Wpływ na ciśnienie tętnicze
Znacząca część kardioprotekcyjnego działania estrogenów wynika z ich
bezpośredniego i pośredniego oddziaływania na naczynia i hemodynamikę.
Główną rolę odgrywa tutaj ich wpływ na śródbłonek naczyniowy i pobudza-
nie wydzielania produkowanych w nim mediatorów rozkurczu, takich jak
EDRF i prostacyklina, a także hamowanie odpowiedzi mięśniówki naczyń
na silny bodziec naczynio-kurczący, jakim jest wydzielanie endoteliny. Es-
trogeny hamują także płytkową produkcję kurczącego naczynia tromboksa-
nu A2. Udowodniono również istnienie niezależnego od śródbłonka efektu
naczynio-rozkurczowego estrogenów, związanego z ich działaniem blokują-
cym kanał wapniowy. Naczyniowe działania estrogenowej terapii zastępczej
(ETZ) wydają się przeważać nad potencjalnie hipertensyjnym efektem zwią-
zanym z nasileniem przez estrogeny produkcji angiotensynogenu (tab. 2).
Działanie to jest istotne w przypadku stosowania dużych dawek estrogenów
242
Tabela 2: Wpływ estrogenów na mechanizmy modulujące ciśnienie tętnicze
MECHANIZM
WPŁYW ESTROGENÓW
EFEKT
EDRF
↑ wydzielania
↓ ciśnienia tętniczego
PGI
2
↑ wydzielania
↓ ciśnienia tętniczego
ET-1
↓ odpowiedzi naczyniowej ↓ ciśnienia tętniczego
TXA2
↓ wydzielania
↓ ciśnienia tętniczego
kanał wapniowy
blokowanie
↓ ciśnienia tętniczego
angiotensynogen
↑ produkcji
↑ ciśnienia tętniczego

syntetycznych w antykoncepcji, znacznie mniejsze przy doustnym podawa-
niu estrogenów naturalnych w dawkach stosowanych w HTZ, a praktycznie
nieobecne przy terapii przezskórnej.
Wpływ progestagenów na naczynia jest przeciwstawny do estrogenów.
Działają one poprzez swoiste receptory obecne w ścianie naczynia, a także
wywołują efekt typu „downregulation” w stosunku do receptorów estrogeno-
wych. Powstaje pytanie, czy dodatek silnych substancji naczynio-kurczących,
jakimi są progestageny, do ETZ nie będzie eliminował kardioprotekcyjnego
efektu tej terapii? Nie potwierdzają tego duże badania kliniczne (PEPI,
ARIC), w których oceniano wpływ estrogenowo-progestagenowej terapii za-
stępczej na ciśnienie tętnicze, które może być przyjęte jako wykładnik na-
czyniowego działania prowadzonego leczenia. W badaniu WHI obserwowa-
no jedynie niewielki wzrost ciśnienia skurczowego (1,5 mm Hg) u kobiet
stosujących HTZ, w porównaniu z grupą otrzymującą placebo.
Wpływ na masę ciała
U około 60% kobiet w okresie przekwitania dochodzi do nagłego wzrostu
masy ciała o 2,5-5 kg. Przyczyna tej otyłości wciąż nie jest dokładnie pozna-
na, wiadomo natomiast, że jej występowanie zwiększa stopień ryzyka choro-
by wieńcowej. Ujawnienie się otyłości okresu okołomenopeuzalnego tylko
u części kobiet stawia pod znakiem zapytania rolę deficytu hormonów płcio-
wych jako jedynego czynnika etiologicznego. Uważa się, że występowanie
otyłości w okresie okołomenopauzalnym jest uwarunkowane wieloma czyn-
nikami, takimi jak: predyspozycja genetyczna, wydzielanie neuropeptydów
i hormonów, aktywność autonomicznego układu nerwowego.
Lęk przed otyłością jest jedną z częstszych przyczyn odrzucania HTZ
przez kobiety. Biorąc pod uwagę wyniki badań, dotyczących terapii estroge-
nowo-progestagenowej i ich wpływu na masę ciała i wskaźnik talia/biodro,
obawy te nie mają żadnego uzasadnienia klinicznego. W badaniu PEPI
stwierdzono przyrost masy ciała we wszystkich grupach kobiet. Był on naj-
większy w grupie placebo (średnio o 2,1 kg w ciągu 36 miesięcy), a najmniej-
szy w grupie leczonej samymi estrogenami (średnio 0,7 kg w ciągu 36 miesię-
cy; p=0,03). W grupach kobiet otrzymujących estrogeny z progestagenami
przyrost masy ciała był mniejszy niż w grupie placebo, lecz większy niż w gru-
pie leczonej samymi estrogenami. Powyższe wyniki sugerują, że przyrost cię-
żaru ciała po menopauzie jest związany z wiekiem, a nie ze stosowaniem
HTZ.
243

Wpływ na tolerancję glukozy
Okres pomenopauzalny charakteryzuje się postępującym pogarszaniem
metabolizmu węglowodanów. Efekt ten jest prawdopodobnie związany ze
zmniejszeniem się liczby obwodowych receptorów insulinowych i zmniejsze-
niem trzustkowej sekrecji insuliny. Insulinooporność i hiperinsulinizm są
składnikami zespołu X stanowiącego sumę niekorzystnych zmian metabo-
licznych, istotnie zwiększających ryzyko chorób układu krążenia.
W świetle dostępnych badań, podawane po menopauzie estrogeny w mo-
noterapii zmniejszają insulinooporność, jest ona natomiast nasilana w wyni-
ku podawania samych progestagenów. W wielu badaniach, w których pro-
wadzono łączną terapię estrogenowo-progestagenową, stwierdzono poprawę
lub brak wpływu tego leczenia na tolerancję glukozy. W badaniu PEPI obser-
wowano obniżenie poziomu glukozy i insuliny na czczo w grupach leczonych
aktywnie, przy czym nie stwierdzono istotnych statystycznie różnic pomię-
dzy leczeniem estrogenami w monoterapii i w połączeniu z progesteronem.
Poziomy insulinemii 2 godziny po posiłku nie wykazywały istotnych różnic
w stosunku do placebo w żadnej z aktywnie leczonych grup. Natomiast ob-
serwowane w 2 godziny po posiłku stężenia glukozy były istotnie wyższe
w grupach leczonych hormonalnie.
Ze względu na niejednoznaczny wpływ HTZ na metabolizm węglowoda-
nów, pacjentki z cukrzycą, u których rozpoczynane jest leczenie hormonalne,
wymagają częstej kontroli, zwłaszcza w pierwszym okresie terapii. Nie zale-
ca się tego leczenia u pacjentek z niewyrównaną cukrzycą.
Wpływ na parametry krzepnięcia
Wpływ HTZ na parametry krzepnięcia jest zróżnicowany (tab. 3); obej-
muje on zarówno mechanizmy przeciwzakrzepowe, jak i prozakrzepowe.
Działanie przeciwzakrzepowe HTZ jest zależne od zmniejszania stężenia fi-
brynogenu, inhibitora aktywatora plazminogenu (PAI-1), hamowania agre-
gacji płytek oraz zwiększenia stężenia białka C, będącego inhibitorem krzep-
nięcia. Obserwowane podczas stosowania HTZ zwiększenie stężenia
czynnika VII i X oraz zmniejszenie stężenia antytrombiny III, mogą odpo-
wiadać za osłabienie efektu przeciwzakrzepowego tej terapii.
Ponieważ efekty HTZ na układ krzepnięcia są przede wszystkim konse-
kwencją wpływu tego leczenia na metabolizm wątrobowy, tak więc należy
oczekiwać, że będą one zmniejszone przy przezskórnym podawaniu tych le-
ków. Wniosek ten potwierdzają wyniki badań ostatnich lat, dotyczące prze-
zskórnej terapii, w których nie stwierdzono istotnego wpływu tego leczenia
244

na różnorodne czynniki hemostazy zarówno w przypadku krótkiego, jak
i długiego stosowania.
HORMONALNA TERAPIA ZASTĘPCZA W PREWENCJI PIERWOTNEJ
I WTÓRNEJ CHOROBY WIEŃCOWEJ
Dane dokumentujące korzystny wpływ HTZ na czynniki ryzyka choroby
wieńcowej, stanowiły podstawę teoretyczną do zastosowania jej jako jednej
z metod zapobiegania i leczenia choroby niedokrwiennej serca u kobiet
w okresie menopauzy.
Prewencja pierwotna
Z metaanaliz dotyczących wcześniej przeprowadzonych badań obserwa-
cyjnych wynika, że monoterapia estrogenowa zmniejsza ryzyko choroby
wieńcowej o 35-50%. Najwartościowsze wydają się być badania, w których
rozpoznanie choroby wieńcowej było potwierdzone angiograficznie; wyka-
zują one mniejsze zaawansowanie zmian w naczyniach wieńcowych u kobiet,
które w przeszłości przyjmowały estrogeny. Znacznie mniej badań dotyczy
substytucji estrogenowo-progestagenowej w prewencji pierwotnej choroby
niedokrwiennej serca, jednak wyniki przeprowadzonych badań retrospek-
tywnych wskazują na podobne zmniejszenie ryzyka incydentów wieńcowych,
jak w przypadku stosowania samych estrogenów. Badanie Women’s Health
Initiative (WHI), którego wyniki ogłoszono w lipcu 2002 roku, jest pierw-
245
Tabela 2: Wpływ doustnej HTZ na krzepnięcie
PARAMETR
WPŁYW HTZ
ZNACZENIE HTZ
fibrynogen
↓
przeciwzakrzepowe
białko C
↑
przeciwzakrzepowe
PAI-1
↓
przeciwzakrzepowe
agregacja płytek
↓
przeciwzakrzepowe
czynnik VII
↑
prozakrzepowe
czynnik X
↑
prozakrzepowe
antytrombina III
↓
prozakrzepowe

szym randomizowanym, kontrolowanym placebo badaniem prospektywnym,
dotyczącym stosowania HTZ w ramach prewencji pierwotnej choroby wień-
cowej. W badaniu tym uczestniczyło 16 608 kobiet, a stosowanymi lekami
były koniugowane estrogeny końskie i octan medroksyprogesteronu (CEE
0,625 mg/d + MPA 2,5 mg/d), podawane w sposób ciągły. Niestety, nadzieje
pokładane w stosowanej terapii nie spełniły się. Przeciwnie, komitet nadzo-
rujący badanie zdecydował o jego wcześniejszym zakończeniu, po stwierdze-
niu, że ryzyko wynikające z prowadzonej terapii przewyższa uzyskiwane ko-
rzyści. W grupie leczonej hormonalnie stwierdzono częstsze występowanie
incydentów wieńcowych (29%), udarów mózgu, powikłań zakrzepowo-zatoro-
wych oraz przypadków inwazyjnego raka sutka. Obserwowane korzyści ze
stosowanej HTZ dotyczyły zmniejszenia ryzyka przypadków raka jelita gru-
bego oraz złamań szyjki kości udowej. Wyniki badania WHI wskazują, że
skojarzone leczenie CEE + MPA nie powinno być rozpoczynane i kontynu-
owane w ramach prewencji pierwotnej choroby wieńcowej. W przypadkach
zalecania tego leczenia jako prewencji osteoporozy należy dokładnie prze-
analizować czynniki ryzyka choroby sercowo-naczyniowej i raka sutka istnie-
jące u danej kobiety oraz rozważyć potencjalne korzyści i ryzyko wynikające
z tego postępowania. Autorzy pracy podkreślają, że opublikowane obserwa-
cje nie dotyczą krótkotrwałego stosowania HTZ w leczeniu objawów wypa-
dowych. W ramach badania WHI kontynuowana jest obserwacja grupy
10 739 kobiet po histerektomii, u których stosowane są same estrogeny; jej
zakończenie planowane jest na rok 2005. Aktualne zalecenia Amerykańskie-
go Towarzystwa Kardiologicznego dotyczące stosowania estrogenowo-proge-
stagenowej terapii zastępczej w prewencji pierwotnej choroby wieńcowej są
następujące:
• nie należy zalecać HTZ w prewencji pierwotnej choroby wieńcowej;
• należy przerwać HTZ u osób, u których doszło do wystąpienia ostrego
incydentu wieńcowego.
Prewencja wtórna
Zachęcające wyniki badań prospektywnych dotyczących stosowania mo-
noterapii estrogenowej u kobiet z chorobami układu krążenia (Lipid Rese-
arch Clinics Program, Leisure World Study) stały się podstawą do zaplanowa-
nia badania HERS (Heart and Oestrogen/Progestin Replacement Study) –
pierwszej randomizowanej próby klinicznej dotyczącej stosowania terapii es-
trogenowo-progestagenowej w prewencji wtórnej choroby wieńcowej. W ba-
daniu tym 4-letnią obserwacją objęto 2763 kobiety po menopauzie, u któ-
rych prowadzono ciągłą HTZ lub podawano placebo. Ogłoszone wyniki
246

badania HERS były zaskakujące; nie tylko nie obserwowano korzyści ze sto-
sowania HTZ w chorobie wieńcowej, ale w ciągu pierwszego pół roku trwa-
nia badania, liczba zdarzeń wieńcowych u kobiet stosujących HTZ zwiększy-
ła się o 50% w porównaniu do grupy otrzymującej placebo. Liczba
incydentów sercowo-naczyniowych zaczęła się zmniejszać dopiero po dłuż-
szym okresie leczenia, co w rezultacie spowodowało uzyskanie nieznamien-
nych statystycznie różnic w ogólnej analizie. W grupie leczonej hormonal-
nie było również więcej przypadków powikłań zakrzepowo-zatorowych,
liczba tych powikłań także zmniejszała się w kolejnych latach. Ze względu
na hipotezę, że korzyści z HTZ mogą ujawnić się dopiero po dłuższym okre-
sie terapii (early risk, later benefit), leczenie rozpoczęte w ramach badania
HERS kontynuowano, na zasadzie otwartej próby, jako badanie HERS II.
Niestety i tym razem wyniki okazały się rozczarowujące: zmniejszenie liczby
zdarzeń wieńcowych, stwierdzane w ostatnich latach trwania badania HERS,
nie było obserwowane w kolejnych latach leczenia w ramach badania HERS
II. Wyniki badania HERS II stanowią dodatkowe potwierdzenie wcześniej-
szych obserwacji, wskazujących na brak korzyści ze stosowania HTZ w pre-
wencji wtórnej choroby wieńcowej. Podobne wnioski wynikają z obserwacji
prowadzonych w ramach badania ERA (Effects of Estrogen Replacement on
the Progression of Coronary-artery Atherosclerosis), w którym badano wpływ
ETZ/HTZ na ocenianą angiograficznie progresję miażdżycy oraz badania
CARS (The Coumadin Aspirin Reinfarction Study), gdzie ETZ/HTZ rozpo-
czynano po niedawno przebytym zawale serca. Zgodnie z aktualnym stano-
wiskiem Amerykańskiego Towarzystwa Kardiologicznego, nie zaleca się sto-
sowania estrogenowo-progestagenowej terapii zastępczej w prewencji
wtórnej choroby wieńcowej.
BEZPIECZEŃSTWO STOSOWANIA HORMONALNEJ TERAPII
ZASTĘPCZEJ
Pomimo niespełnionych nadziei związanych ze stosowaniem HTZ w pre-
wencji pierwotnej i wtórnej chorób układu krążenia, należy pamiętać, że
nadal istnieją klasyczne wskazania do tej terapii, takie jak łagodzenie obja-
wów okołomenopauzalnych i leczenie osteoporozy. Opublikowanie ostat-
nich doniesień dotyczących HTZ (HERS, WHI) przyczyniło się do zwięk-
szenia obaw kobiet związanych z tą terapią, z których jako najważniejsze
należy wymienić strach przed nowotworem złośliwym, powikłaniami zakrze-
powo-zatorowymi oraz ze strony układu krążenia. Biorąc pod uwagę dzia-
łania biologiczne estrogenów, dotyczące przede wszystkim endometrium
i sutka, nie są to obawy bezpodstawne.
247

Wpływ na endometrium
Działanie estrogenów polega na pobudzaniu proliferacji nabłonka gruczo-
łowego błony śluzowej macicy. Długotrwała stymulacja powoduje jego roz-
rost, mogący w konsekwencji prowadzić do rozwoju raka endometrium. Pro-
liferacyjny wpływ estrogenów jest równoważony przez progestageny,
wydzielane fizjologicznie w czasie cyklu miesiączkowego przez ciałko żółte.
Ryzyko raka endometrium istotnie zwiększa się w okresie okołomenopauzal-
nym, co jest wynikiem niedomogi wydzielniczej ciałka żółtego i niedoboru
progesteronu. Konsekwencją przerostu endometrium są nieregularne krwa-
wienia pojawiające się na początku cyklu miesiączkowego. W świetle obec-
nej wiedzy, dodanie progestagenów do ETZ, przez co najmniej 10 dni cy-
klu, istotnie zmniejsza, choć nie zapobiega całkowicie atypowemu
przerostowi endometrium. Prowadzenie HTZ uważa się obecnie za postępo-
wanie bezpieczne, pod warunkiem przestrzegania zasad kwalifikacji do te-
go leczenia, jak również systematycznego wykonywania badań kontrolnych.
Wpływ na gruczoł sutkowy
Wzrost ryzyka zachorowania na raka sutka wiąże się z przedłużoną eks-
pozycją na estrogeny endogenne. Ryzyko to wzrasta w związku z wczesną
menarche i późnym ustaniem miesiączkowania, a także jest wprost propor-
cjonalne do liczby porodów. Nie wykazano ochronnej roli dodatku proge-
stagenów na gruczoły sutkowe; w przeciwieństwie do wpływu na endome-
trium, mają one działanie stymulujące proliferację komórek gruczołów
sutkowych.
W badaniu WHI stwierdzono 26% zwiększenie ryzyka rozwoju inwazyj-
nego raka sutka w grupie stosującej HTZ w porównaniu z placebo, nie ob-
serwowano istotnej różnicy w zakresie występowania przypadków raka in
situ.
Hormonalna terapia zastępcza, a incydenty zakrzepowo-zatorowe
Wyniki analiz dotyczących związku HTZ i występowania incydentów za-
krzepowo-zatorowch, takich jak zatorowość płucna i zakrzepowe zapalenie
żył, wskazują na 2-krotny, w porównaniu z placebo, wzrost ryzyka tych powi-
kłań u kobiet aktualnie stosujących leczenie hormonalne. Obserwowane ry-
zyko wydaje się być największe podczas pierwszego roku od rozpoczęcia le-
czenia hormonalnego i dotyczy ono zarówno kobiet z chorobami układu
krążenia (HERS), jak i kobiet zdrowych (WHI). Jak wynika z dostępnych
obserwacji, pomimo braku ewidentnego wpływu prokoagulacyjnego ocenia-
248

nego na podstawie analizy zachowania się poszczególnych parametrów
krzepnięcia, HTZ zwiększa ryzyko powikłań zakrzepowo-zatorowych (za-
równo zatorowości płucnej, jak i zakrzepowego zapalenia żył). Zwiększenie
ryzyka jest niewielkie, ale istotne statystycznie. Podkreśla się, że u zdrowych
kobiet bezwzględne ryzyko tych powikłań jest bardzo małe i istotnie mniej-
sze, niż w przypadku antykoncepcji doustnej. Decyzja o rozpoczęciu HTZ,
powinna być zatem oparta na wnikliwej analizie potencjalnych korzyści i za-
grożeń wynikających z tego leczenia. Bardzo istotne jest także ustalenie
obecności czynników ryzyka powikłań zakrzepowo-zatorowych, takich jak:
przebyty incydent zakrzepowo-zatorowy w przeszłości, choroba nowotworo-
wa, trombofilia oraz konieczność długotrwałego unieruchomienia – w tych
przypadkach rozpoczynanie HTZ nie jest zalecane. Zaleca się również cza-
sowe przerwanie HTZ w czasie szczególnego narażenia na powikłania za-
krzepowo-zatorowe, a więc po zabiegach operacyjnych i w razie konieczno-
ści dłuższego unieruchomienia.
Hormonalna terapia zastępcza, a udar mózgu
Dane na temat wpływu ETZ i HTZ na ryzyko występowania udarów mó-
zgu są sprzeczne. Istnieją doniesienia wskazujące na istotne działanie ko-
rzystne (National Health and Nutricional Examination Survey), dane wska-
zujące na brak wpływu (Pedersen, Angeja) lub nieistotne statystycznie
zwiększenie ryzyka (HERS), aż do doniesień wskazujących na istotne zwięk-
szenie ryzyka udaru (Womens Estrogen for Stroke Trial – badanie WEST
i WHI). Aktualne zalecenia Amerykańskiego Towarzystwa Kardiologicznego
są następujące:
• nie należy zalecać HTZ w prewencji pierwotnej udaru mózgu;
• należy przerwać HTZ u osób, u których doszło do wystąpienia udaru.
Wpływ hormonalnej terapii zastępczej na śmiertelność
Chociaż wyniki wielu badań obserwacyjnych wskazują, że przewlekłe sto-
sowanie estrogenów może prowadzić do zmniejszenia śmiertelności, fakt ten
nigdy nie został potwierdzony w prospektywnym, randomizowanym badaniu
klinicznym. Zarówno w badaniu HERS, jak i WHI, nie stwierdzono wpływu
prowadzonej HTZ na śmiertelność. Przypuszcza się, że korzyści obserwowa-
ne we wcześniejszych badaniach mogły wynikać z faktu, że kobiety stosujące
HTZ częściej niż inne przestrzegają zaleceń dotyczących „zdrowego stylu
życia”.
249

Hormonalna terapia zastępcza, a zagrożenie kamicą żółciową
Zarówno estrogeny, jak i progestageny podawane doustnie zwiększają wą-
trobową pulę wolnego cholesterolu. Estrogeny nasilają łączenie się chole-
sterolu z receptorami LDL hepatocytów i jego wychwyt z surowicy. Progesta-
geny zmniejszają natomiast estryfikację wolnego cholesterolu wątrobowego.
W konsekwencji dochodzi do wzrostu wysycenia żółci cholesterolem, co jest
wstępnym warunkiem tworzenia kamieni cholesterolowych. Co więcej, do-
ustne podawanie estrogenów obniża zawartość kwasu chenodezoksycholo-
wego w żółci. Kwas ten ma zdolność rozpuszczania żółciowego cholesterolu
i był używany do rozpuszczania kamieni żółciowych. Potwierdzeniem powyż-
szych obserwacji są wyniki badania HERS, w którym stwierdzono istotnie
większą liczbę przypadków kamicy żółciowej u kobiet stosujących doustną
HTZ w porównaniu do grupy placebo. Jak wynika z doniesień, stosowanie
przezskórnej HTZ nie wpływa niekorzystnie na stopień wysycenia żółci cho-
lesterolem i zawartość kwasów żółciowych. Wydaje się więc, że u kobiet,
u których ryzyko kamicy żółciowej jest duże, a także po jej nieoperacyjnym
leczeniu, powinna być preferowana hormonoterapia przezskórna.
PRZECIWWSKAZANIA DO HORMONALNEJ TERAPII ZASTĘPCZEJ
1. Nie związane z układem sercowo-naczyniowym:
• Bezwzględne przeciwwskazanie do HTZ stanowią:
- nowotwór złośliwy endometrium lub sutka,
- jakikolwiek czynny proces nowotworowy o innej lokalizacji,
- ciężkie uszkodzenie wątroby,
- endometrioza,
- krwawienia z dróg rodnych o nie ustalonej przyczynie.
• Za przeciwwskazania względne uważa się:
- mastopatię,
- wywiad rodzinny nowotworu sutka,
- hiperplazję endometrium,
- mięśniaki macicy,
- kamicę żółciową.
2. Związane z układem sercowo-naczyniowym:
- rozpoznana choroba niedokrwienna serca,
250

- przebyty udar mózgu,
- czynny proces zakrzepowo-zatorowy,
- przebyty epizod zakrzepowo-zatorowy.
MONITOROWANIE TERAPII
Przed rozpoczęciem HTZ zalecane jest przeprowadzenie oceny stanu
zdrowia pacjentki, z uwzględnieniem istniejących przeciwwskazań do tego
leczenia. Badania diagnostyczne powinny obejmować: kontrolę podstawo-
wych parametrów biochemicznych, badanie internistyczne i ginekologiczne,
mammografię oraz USG narządu rodnego z oceną grubości endometrium
(za najdokładniejsze w tych przypadkach uważa się USG przezpochwowe).
Powyższe badania powinny być wykonywane raz w roku podczas prowadze-
nia leczenia hormonalnego.
Zagadnieniem dotychczas jednoznacznie nierozwiązanym jest problem
wykonywania biopsji i histologicznej oceny endometrium w celu wykluczenia
atypowego jego przerostu i zmian nowotworowych. Nie ulega wątpliwości,
że powinna być ona wykonywana w każdym przypadku wystąpienia nieregu-
larnego krwawienia z dróg rodnych oraz w przypadkach krwawień bardzo
obfitych lub przedłużających się. Biopsję endometrialną należy również wy-
konać, jeżeli grubość endometrium stwierdzona w badaniu USG przekracza
4-5 mm. Istnieją natomiast kontrowersje na temat rutynowego wykonywa-
nia tego badania u wszystkich kobiet przed rozpoczęciem HTZ.
OBJAWY NIEPOŻĄDANE HORMONALNEJ TERAPII ZASTĘPCZEJ
Estrogeny mogą powodować objawy niepożądane, przypominające dole-
gliwości zgłaszane podczas pierwszych tygodni ciąży, a więc okresu, kiedy
poziom estrogenów istotnie wzrasta. Objawy te to: wzdęcia, bolesność pier-
si, nudności, bóle głowy, występują one u 5-10% kobiet przyjmujących stan-
dardową dawkę estrogenu, są zazwyczaj łagodne i nie powodują konieczno-
ści przerwania leczenia.
Objawy niepożądane związane z leczeniem progestagenami są identycz-
ne, jak dolegliwości związane z zespołem napięcia przedmiesiączkowego
i stanowią jedną z częstszych przyczyn przerywania przez kobiety leczenia
hormonalnego. Do najbardziej typowych objawów należą: bolesność piersi,
nudności i wzdęcia, a także obrzęki i zaburzenia nastroju, takie jak: stany lę-
kowe, rozdrażnienie i depresja. Występowanie objawów niepożądanych za-
leżne jest od rodzaju zastosowanego preparatu, jednak nie jest możliwe
251

przewidzenie indywidualnej reakcji pacjentki na lek. Często można uzyskać
poprawę samopoczucia po zmianie preparatu. Najlepiej tolerowane są małe
dawki progestagenów, a zwłaszcza progesteron naturalny.
PODSUMOWANIE
W świetle ostatnio opublikowanych wyników dużych kontrolowanych pla-
cebo, prospektywnych badań klinicznych (HERS, WHI), HTZ wydaje się
być jednym z większych rozczarowań współczesnej kardiologii. Niewątpliwie
opublikowane wyniki i metodyka badań jeszcze długo będą przedmiotem
dyskusji i krytyki. Najwięcej wątpliwości budzą rodzaj i dawki zastosowanych
hormonów oraz schemat i droga ich podawania – być może, gdyby zastoso-
wano mniejsze dawki nowszych preparatów lub gdyby podawano je prze-
zskórnie, uzyskane wyniki byłyby inne. Zwraca się także uwagę na zaawanso-
wany wiek badanych kobiet (średnio 63 i 67 lat, odpowiednio w badaniach
WHI i HERS), znacznie przekraczający przeciętny wiek pacjentek, u któ-
rych zazwyczaj rozpoczyna się HTZ. Znaczenie stosowania monoterapii es-
trogenowej u kobiet po histerektomii w prewencji chorób układu krążenia
pozostaje nadal zagadnieniem otwartym, więcej informacji na ten temat
oczekuje się po ogłoszeniu wyników badania WHI, dotyczących podgrupy
kobiet stosujących ten schemat terapii, w 2005 roku.
Nie należy zapominać, że stosowanie HTZ istotnie poprawia komfort ży-
cia u kobiet w okresie klimakterium oraz nadal ma swoje miejsce w lecze-
niu osteoporozy pomenopauzalnej, choć nie jest już uznawane za postępo-
wanie z wyboru. U kobiet stosujących HTZ z tych wskazań, najważniejszym
zagadnieniem pozostaje zapewnienie bezpieczeństwa prowadzonej terapii,
polegające na przestrzeganiu przeciwwskazań i zaleceń dotyczących jej mo-
nitorowania. Z punktu widzenia prewencji i leczenia osteoporozy, leczenie
hormonalne powinno być prowadzone przez okres 10-20 lat. Należy jednak
mieć świadomość, że ryzyko rozwoju zmian nowotworowych sutka i endo-
metrium rośnie z wydłużeniem czasu leczenia. Czas terapii podejmowanej
w celu łagodzenia objawów okołomenopauzalnych jest zazwyczaj krótszy
i nie przekracza 5 lat. W świetle przedstawionych danych wydaje się, że decy-
zja o rozpoczęciu HTZ powinna być podjęta wspólnie przez pacjentkę i jej
lekarza w oparciu o analizę indywidualnych korzyści i ryzyko wynikające z te-
go leczenia.
252

Zapamiętaj!
1. Hormonalna terapia zastępcza polega na podawaniu estrogenów i proge-
stagenów u kobiet po menopauzie, kobiety po histerektomii mogą otrzymy-
wać same estrogeny.
2. Za wskazania do stosowania HTZ uznaje się obecnie: łagodzenie objawów
okołomenopauzalnych i leczenie osteoporozy u kobiet.
3. Wyniki ostatnio opublikowanych randomizowanych badań klinicznych nie
potwierdzają korzyści ze stosowania estrogenowo-progestagenowej terapii
zastępczej w prewencji pierwotnej i wtórnej choroby wieńcowej. Znaczenie
stosowania monoterapii estrogenowej u kobiet po histerektomii jest nadal
przedmiotem badań klinicznych.
Polecane lektury:
Writing Group for the Womens Health Initiative Investigators: Risks and
Benefits of Estrogen Plus Progestin in Healthy Postmenopausal Women. Prin-
cipal Results From the Womens Health Initiative Randomized Controlled
Trial; JAMA, 2002, 288: 321-333.
S. Hulley, D. Grady, T. Bush i wsp.: Randomized Trial of Estrogen Plus Pro-
gestin for Secondary Prevention of Coronary Heart Disease in Postmenopau-
sal Women; JAMA, 1998, 280: 605-612.
D. Grady, D. Herrington, V. Bittner i wsp.: Cardiovascular Disease Outco-
mes During 6.8 Years of Hormone Therapy. Heart and Estrogen/Progestin Re-
placement Study Follow-up (HERS II); JAMA, 2002, 288: 49-57.
The WritingGroup for PEPI Trial: Effects of Estrogen or Estrogen/Proge-
stin Regimens on Heart Disease Risk Factors in Postmenopausal Women; JA-
MA, 1995, 273: 199-208.
253



Wyszukiwarka
Podobne podstrony:
Farmakologia kliniczna lekow kardiotropowych
Lekarski farmakologia kliniczna,definicja1
Kardiologia praktyczna 5 Niewydolność serca (1)
Kardiologia praktyczna 5 Niewydolność serca (2)
Kardiologia praktyczna 1 Diagnostyka kardiologiczna (2)
farma kliniczna- pytania, Medycyna, Pobr materiały, V rok UMB-2015-09-30, V rok UMB, Farmakologia Kl
Seminarium 1 - Farmakoterapia bolu, 5 ROK, FARMAKOLOGIA KLINICZNA
farma.test 1, 6 rok, Farmakologia kliniczna, giełda
wyniki gr. C, 5 ROK, FARMAKOLOGIA KLINICZNA
farmakologia kliniczna 2010, MEDYCYNA - ŚUM Katowice, V ROK, Farmakologia kliniczna
Farmakologia kliniczna
farma wstrzas, Medycyna, Pobr materiały, V rok UMB-2015-09-30, V rok UMB, Farmakologia Kliniczna
Farmakologia kliniczna koenzymu Q10 J Drzewoski
więcej podobnych podstron