
Elementy fizyki statystycznej
Termodynamika
Część 9
Janusz Brzychczyk, Instytut Fizyki UJ

Mikrostany i makrostany
Mikrostan określony stan kwantowy układu. Mikrostan specyfikowany jest przez zbiór wszystkich
liczb kwantowych układu.
W klasycznym opisie gazu, składającego się z N cząstek punktowych, mikroskopowy stan gazu
scharakteryzowany jest przez 6N liczb: 3N współrzędnych (x
i
, y
i
, z
i
) oraz 3N składowych prędkości
(v
xi
, v
yi
, v
zi
). Taki stan mikroskopowy można przedstawić jako punkt w 6N
wymiarowej przestrzeni
fazowej (3N współrzędnych i 3N składowych pędów).
Makrostan opisywany przez parametry charakterystyczne dla całego układu czyli parametry
makroskopowe (E, V, N ...). Realizowany jest przez pewną liczbę mikrostanów.
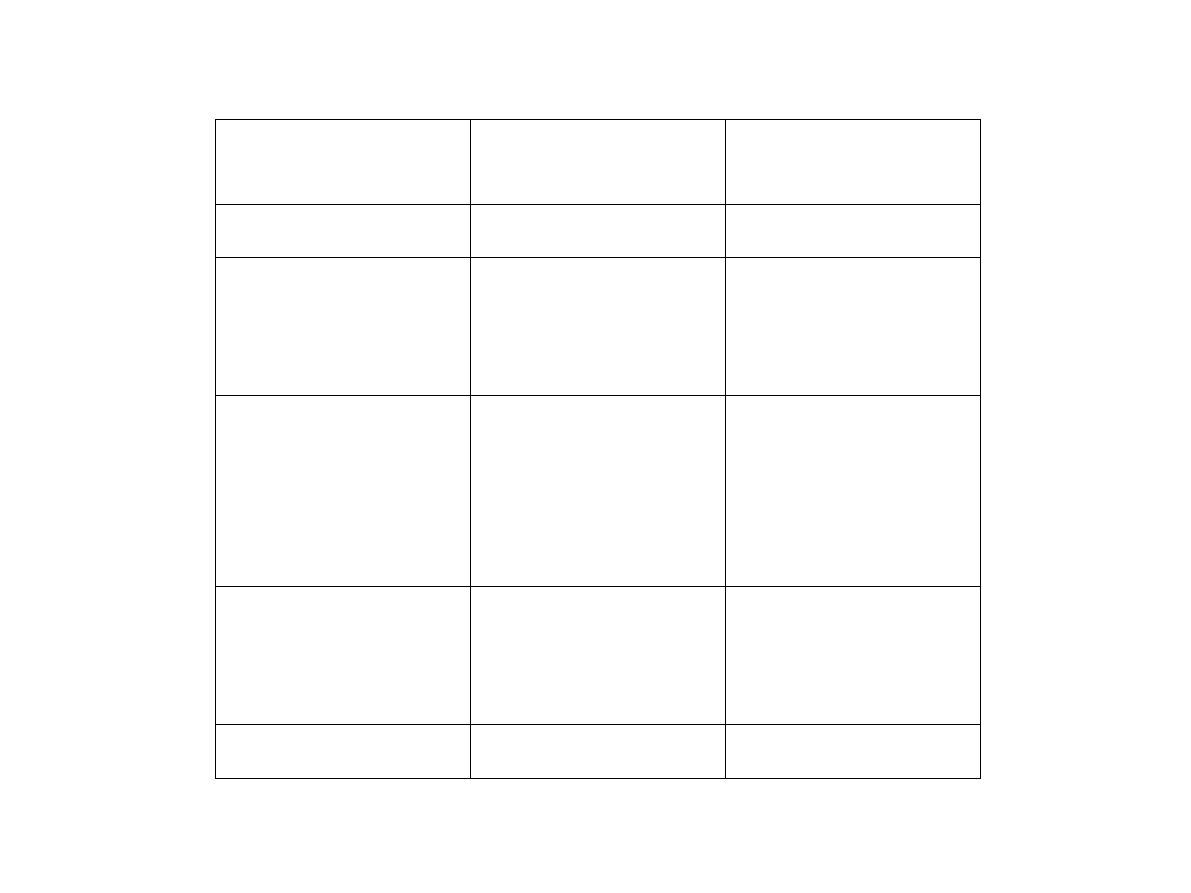
Przykład: Rozważamy układ złożony z czterech rozróżnialnych cząstek A, B, C, D. Każda z tych
cząstek może znajdować się w dwóch stanach: stanie o energii E = 0 lub stanie o energii E =
Makrostany
Mikrostany
A
B
C
D
Liczba mikrostanów
E = 0
0 0 0 0
1
0 0 0
0
0 0
0 0
0
0 0 0
E =
4
0 0
0 0
0 0
0
0
0
0
0 0
6
E = 2
0
0
0
0
E = 3
4
E = 4
1
Liczbę mikrostanów odpowiadających danemu makrostanowi nazywamy
prawdopodobieństwem
termodynamicznym danego makrostanu.
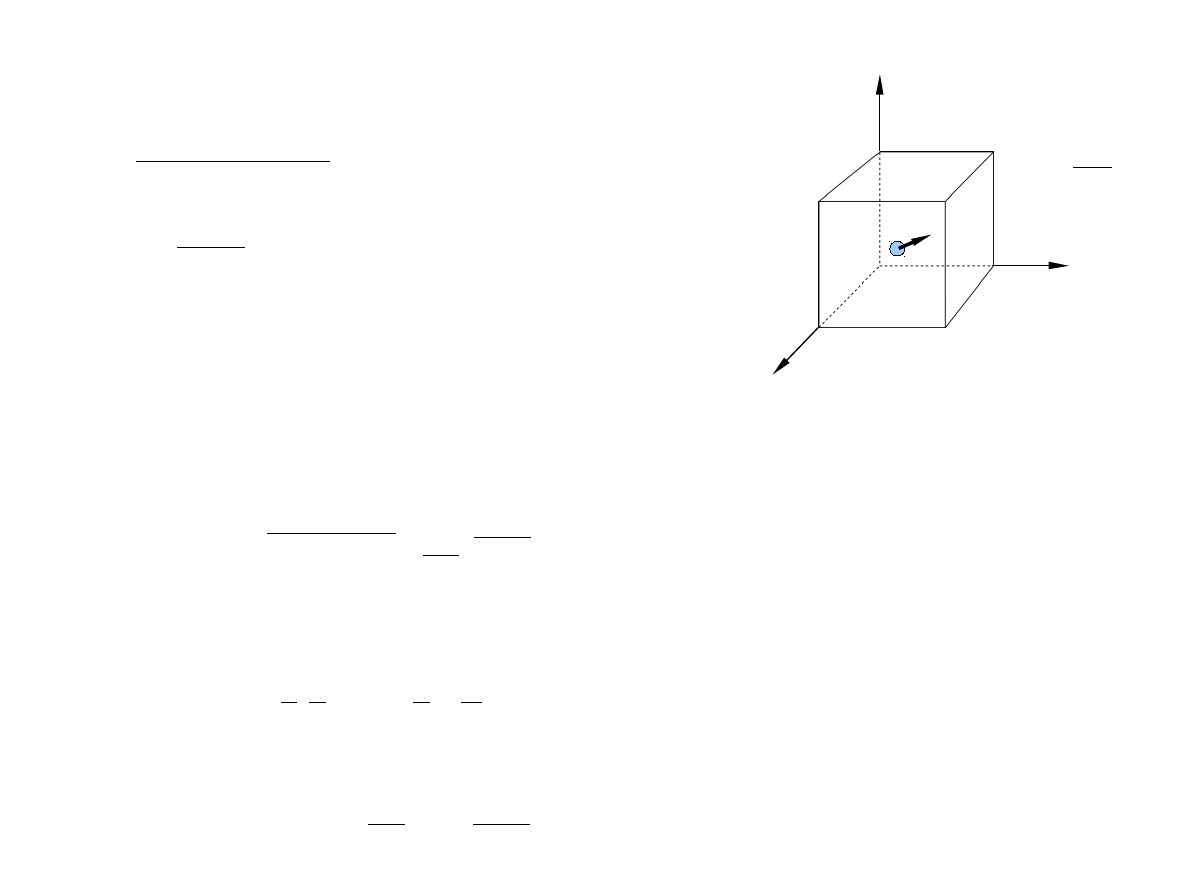
Przykład: Pojedyncza cząstka o masie m porusza się swobodnie w trójwymiarowym pudle.
Pudło ma kształt sześcianu o krawędzi L.
Opis kwantowy
Możliwe wartości poziomów energetycznych
E =
h
2
8
mL
2
n
x
2
n
y
2
n
z
2
x
y
z
p
E = p
2
2
m
gdzie h jest stałą Plancka, a liczby kwantowe
n
x
, n
y
, n
z
=
1, 2, 3,
Dla zadanej wartości E, wartości liczb kwantowych spełniające to równanie, znajdują się na
powierzchni kuli o promieniu R
R=
n
x
2
n
y
2
n
z
2
=
2
L
h
2
mE
Wartości tych liczb kwantowych określają mikrostan układu. Jednej wartości energii może
odpowiadać wiele mikrostanów (degeneracja poziomów energetycznych).
Liczba stanów
(E ) o energiach mniejszych od E jest równa liczbie jednostkowych sześcianów
leżących wewnątrz tej kuli, dla których wartości n
x
, n
y
, n
z
są dodatnie
E
=
1
8
4
3
R
3
=
4
3
L
h
3
2
mE
3/ 2
V = L
3
Liczba stanów o energiach pomiędzy E i E
+
E
E , E E
=
d
dE
E =
2
V
h
3
2
m
3/2
E
1/2
E
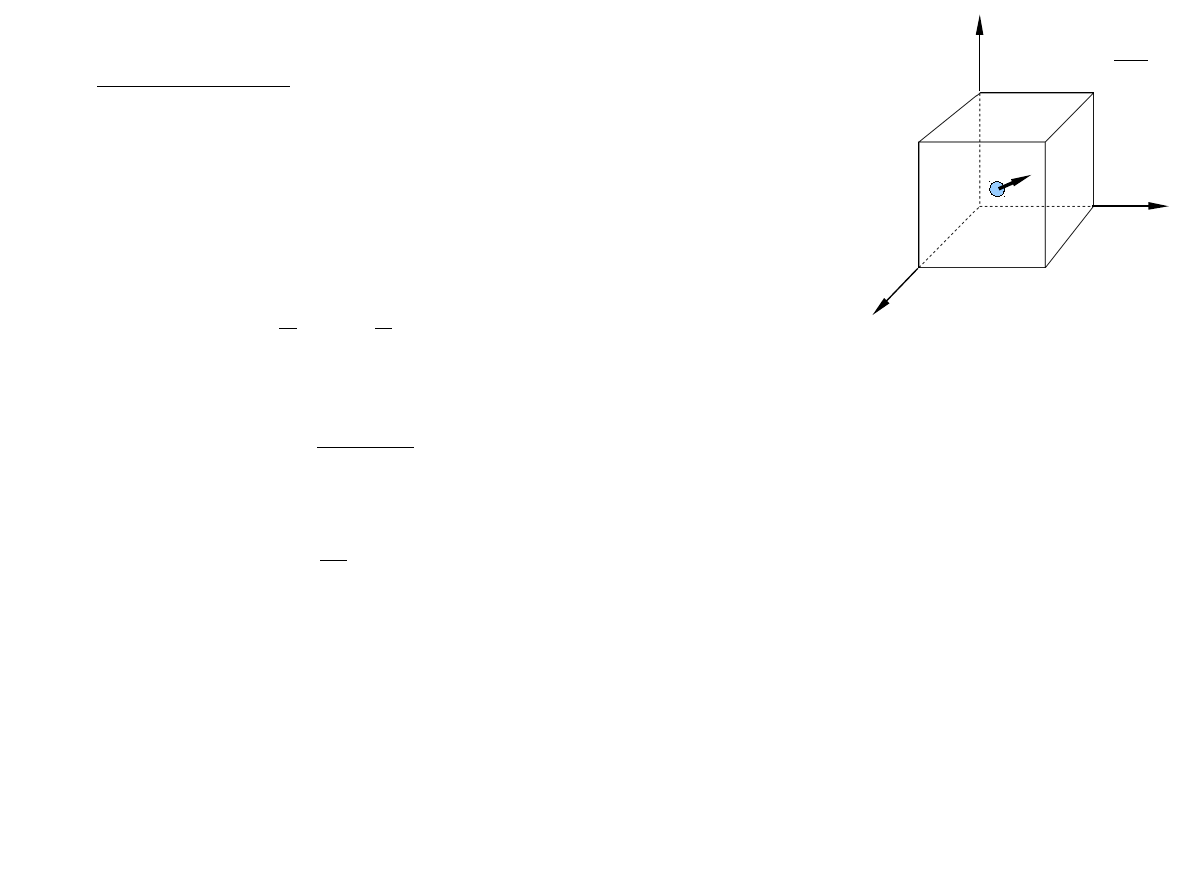
Opis klasyczny
x
y
z
p
E = p
2
2
m
V = L
3
Energia E może sie zmieniać w sposób ciągły. Mikrostan jest
określony przez wartości współrzędnych x, y, z oraz składowych pędu p
x
, p
y
, p
z
cząstki, czyli współrzędne punktu w 6
wymiarowej przestrzeni fazowej.
Element objętości przestrzeni fazowej:
d = dx dy dz dp
x
dp
y
dp
z
.
Objętość dostępnej przestrzeni fazowej dla stanów o energiach pomiędzy E i E
+
E
Objętość dostępnej przestrzeni fazowej dla stanów o energiach mniejszych od E
0,
E
=
V
4
3
p
3
=
4
3
V
2
mE
3/2
E , E E
=
d
0,
E
dE
E = 2V
2
m
3/2
E
1/2
E
Porównując to z wyrażeniem na liczbę stanów w opisie kwantowym
E , E E
=
1
h
3
E , E E
Tak więc, uwzględniając wnioski z mechaniki kwantowej, jednemu mikrostanowi należy przypisać
komórkę w przestrzeni fazowej o objętości
=
h
3
Wartość stałej Plancka: h = 6.626∙10
34
Js.

Układ izolowany – rozkład mikrokanoniczny
Układ izolowany ma stałą wartość energii E.
Możliwe są tylko takie mikrostany układu, których energia jest równa E.
Podstawowy postulat fizyki statystycznej:
Jeżeli układ izolowany znajduje się w równowadze, to każdy z możliwych
mikrostanów jest jednakowo prawdopodobny.
gdzie
oznacza liczbę dozwolonych mikrostanów.
P
=
1
Prawdopodobieństwo, że układ jest w danym dozwolonym mikrostanie
jest równe

Obliczanie prawdopodobieństw
W pierwszym przykładzie, jeżeli układ jest izolowany i jego energia jest równa E = 3
to możliwe są cztery mikrostany:
0
0
0
0
= 4
A
B
C
D
W stanie równowagi prawdopodobieństwo każdego z tych mikrostanów jest takie samo,
równe 1/4.
Na tej podstawie możemy obliczać różne interesujące nas wielkości.
Przykład:
Prawdopodobieństwo, że cząstka A jest w stanie o energii
wynosi 3/4.
Średnia energia cząstki A jest równa 3/4
.

Statystyczna definicja entropii
Entropia zdefiniowana jest wzorem Boltzmanna:
S = k ln
gdzie
jest liczbą możliwych mikrostanów, a k jest stałą, nazywaną stałą Boltzmanna.
Wzór ten stosuje się do układów izolowanych w równowadze.
Entropia układu złożonego z podukładów, których wzajemne oddziaływanie można zaniedbać,
jest sumą entropii podukładów. Entropia jest wielkością ekstensywną.
=
1
2
S = S
1
S
2
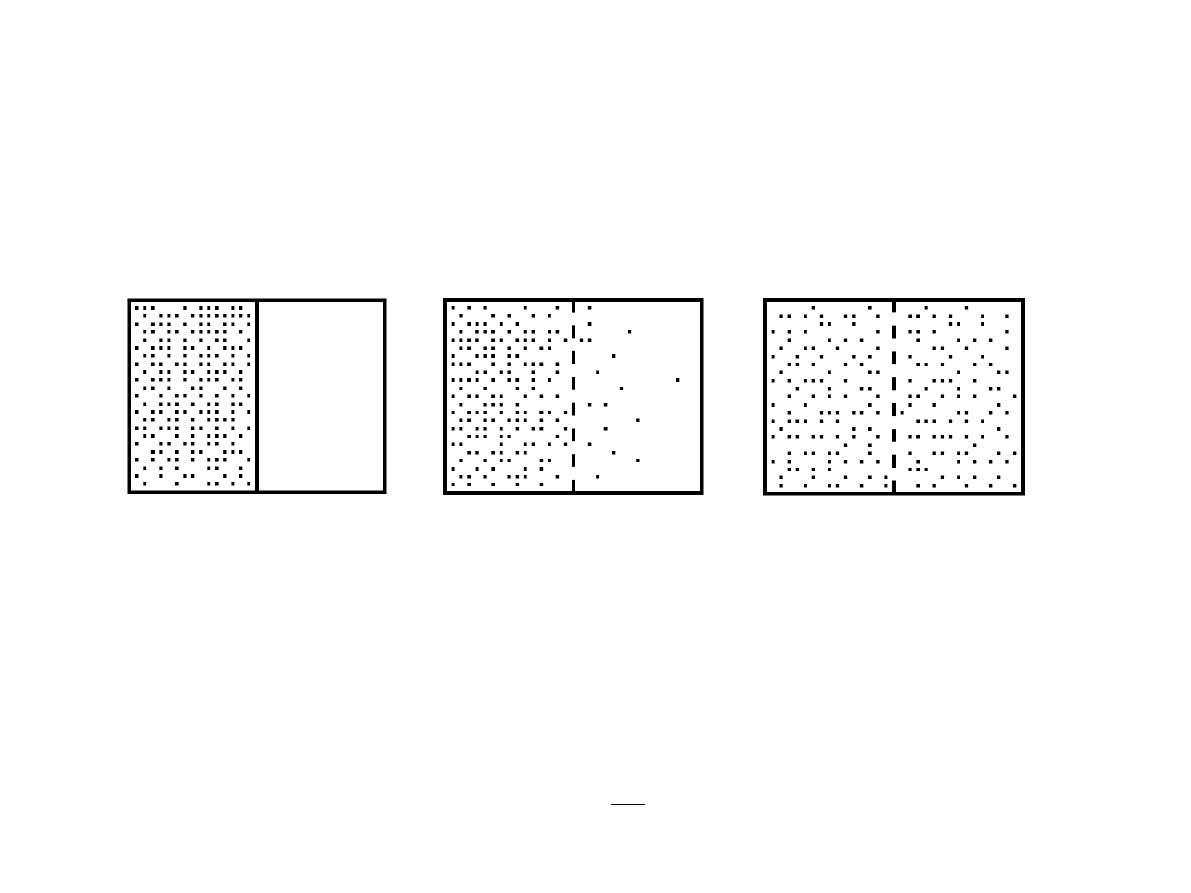
Prawo wzrostu entropii w układach izolowanych
Przykład: Adiabatyczno
izotermiczne rozprężanie gazu doskonałego (doświadczenie Joule'a).
E = const, N = const.
Stan początkowy V = V
1
Stan końcowy V = V
2
= 2V
1
Stan początkowy V = V
1
Stan początkowy V = V
1
Stan początkowy V = V
1
Liczba dostępnych mikrostanów dla jednej cząstki jest proporcjonalna do objętości V.
Liczba mikrostanów całego układu
=
f
E
V
N
stąd entropia
S
E ,V , N
=
k ln = k N lnV ln f
E
.
Przyrost entropii
S= S
2
−
S
1
=
kN ln
V
2
V
1
=
k N ln2 0
W procesach nieodwracalnych, zachodzących w układzie izolowanym, entropia rośnie.
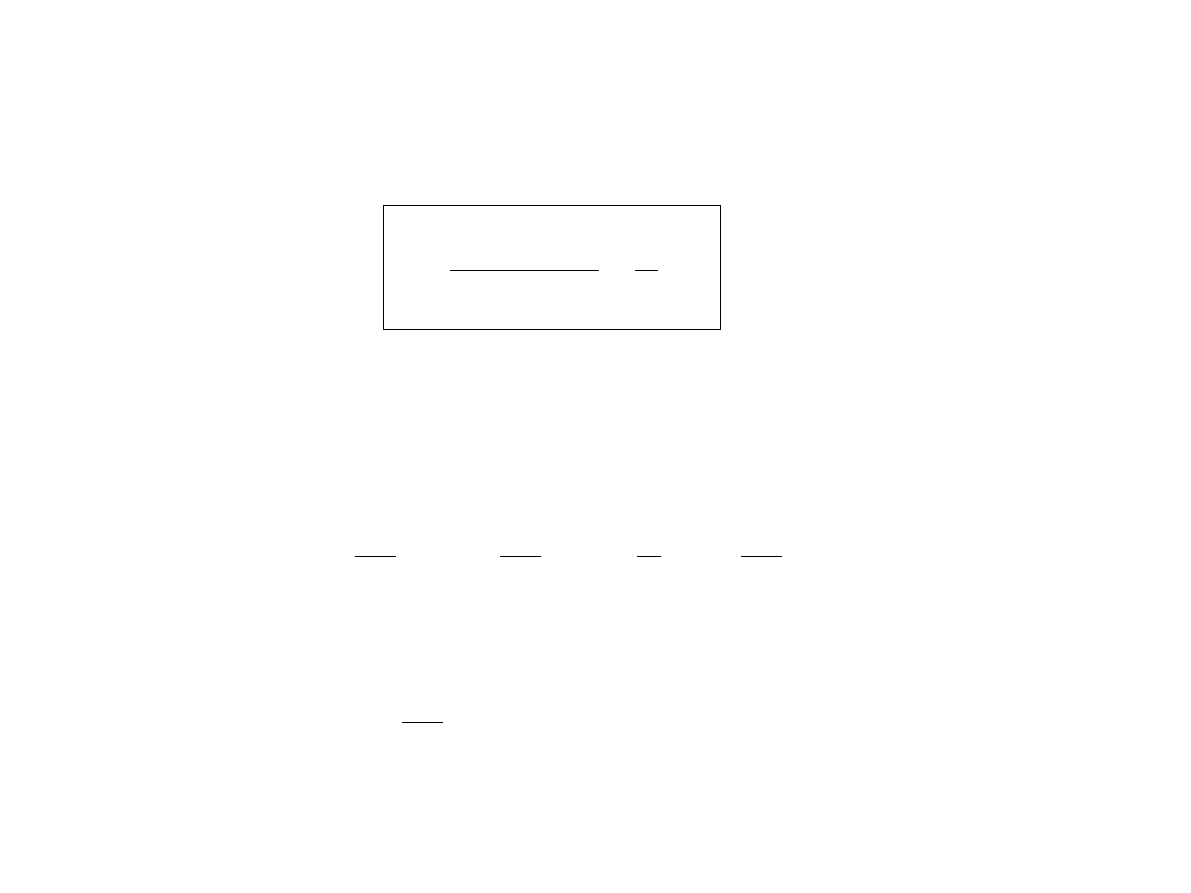
Termodynamiczna definicja temperatury
Temperatura termodynamiczna T zdefiniowana jest wzorem
∂
S
E ,V , N
∂
E
=
1
T
Pokażemy, że temperatura termodynamiczna T jest identyczna z temperaturą wskazywaną
przez termometr gazowy, czyli temperaturą występującą w równaniu stanu gazu doskonałego.
Dla układu zamkniętego N = const, różniczka zupełna entropii S(E, V, N) wyraża się jako
dS =
∂
S
∂
E
V
dE
∂
S
∂
V
E
dV = 1
T
dE
∂
S
∂
V
E
dV
Stosując tę tożsamość dla kwazistatycznego procesu adiabatycznego (dS = 0) otrzymujemy
dE =− T
∂
S
∂
V
E
dV

dE =− T
∂
S
∂
V
E
dV =−pdV
Zgodnie z pierwszą zasadą termodynamiki, przyrost energii układu w procesie adiabatycznym
jest równy pracy wykonanej na układzie
stąd
p = T
∂
S
∂
V
E
Uwzględniając, że entropia gazu doskonałego
S = kN lnV f
E
otrzymujemy
p =
kNT
V
Równanie to przechodzi w równanie stanu gazu doskonałego jeżeli przyjmiemy
k =
R
N
A
gdzie R jest uniwersalną stałą gazową, a N
A
liczbą Avogadra.
Wartość stałej Boltzmanna wynosi k = 1.38
∙
10
23
J/K.
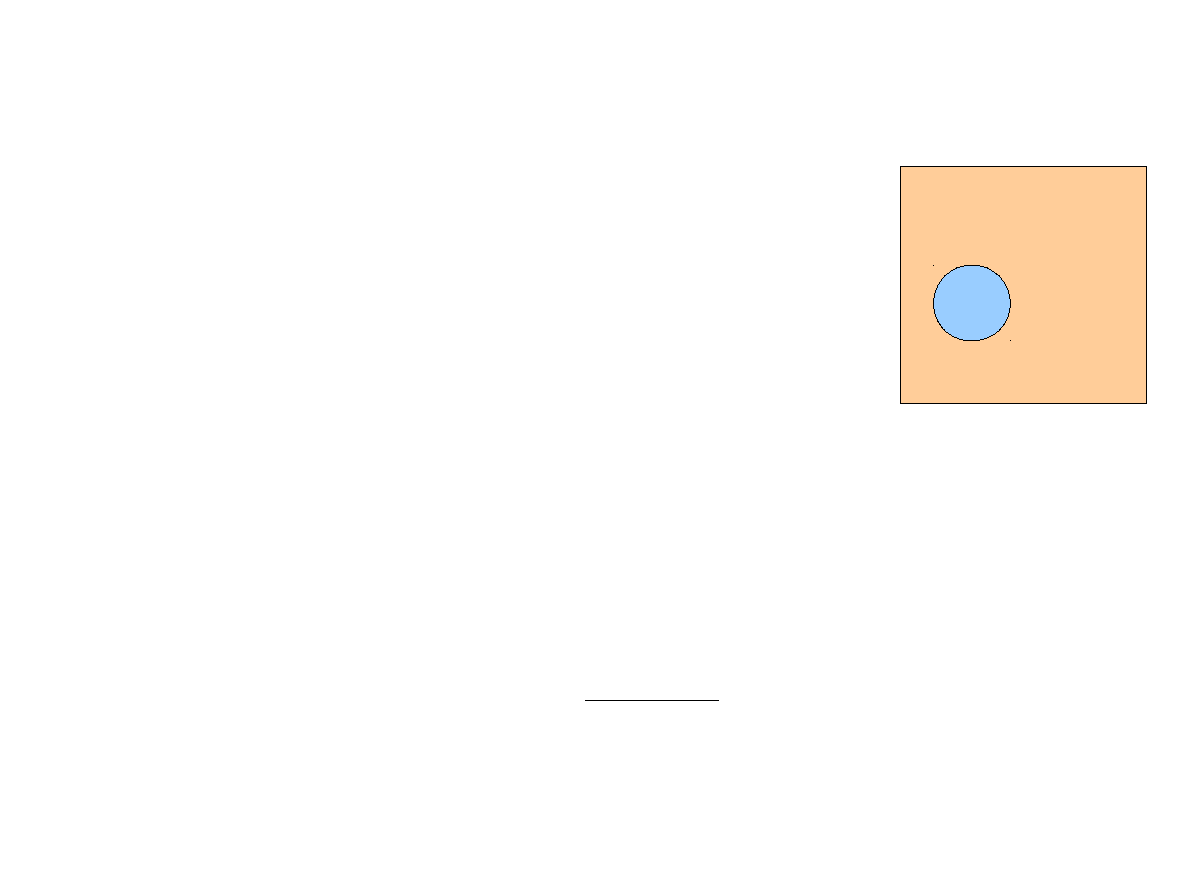
Rozkład kanoniczny
Rozważamy układ zamknięty w równowadze termicznej z dużym
zbiornikiem ciepła o stałej temperaturze T (otoczenie). Temperatura
układu jest równa temperaturze otoczenia. Energia układu może
ulegać zmianom (fluktuacje).
T = const
Całość (układ + otoczenie) jest układem izolowanym o stałej energii E
C
.
Załóżmy, że układ jest w mikrostanie
o energii E
. Energia otoczenia
jest wówczas równa E
C
E
, Przy ustalonym mikrostanie układu liczba
mikrostanów całości jest równa liczbie mikrostanów otoczenia
E
C
E
).
Prawdopodobieństwo, że układ jest w mikrostanie
P
~
o
E
C
−
E
Przy założeniu E
<< E
C
można skorzystać z rozwinięcia
ln
o
E
C
−
E
=
ln
o
E
C
−
∂
ln
o
E
C
∂
E
C
E
Dalsze człony w tym rozwinięciu są zaniedbywalne ponieważ są odwrotnie proporcjonalne do
coraz wyższych potęg liczby cząstek w otoczeniu, które z założenia jest bardzo dużym układem.
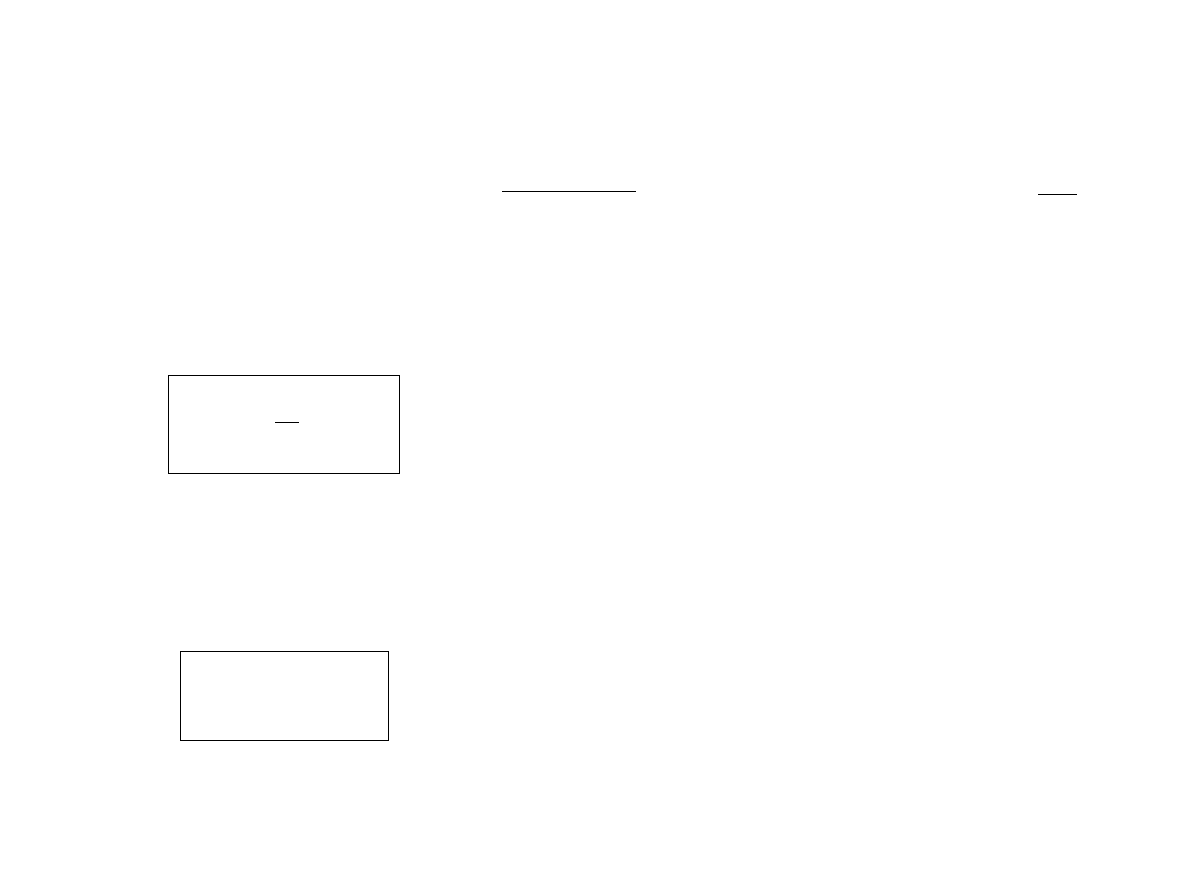
Rozkład kanoniczny
Uwzględniając definicje entropii i temperatury otrzymujemy
ln
o
E
C
−
E
≃
ln
o
E
C
−
∂
ln
o
E
C
∂
E
C
E
=
ln
o
E
C
−
E
Zatem
P
~
o
E
C
−
E
=
e
ln
o
E
C
−
E
=
o
E
C
e
−
E
P
~
e
−
E
P
=
1
Z
e
−
E
W powyższym wyrażeniu stała normalizacyjna Z jest niezależna od stanu układu i można
ją wyznaczyć z warunku normalizacji prawdopodobieństwa
∑
P
=
1
Stąd
Z =
∑
e
−
E
gdzie suma przebiega po wszystkich mikrostanach układu. Stała Z nazywana jest
funkcją rozdziału lub sumą stanów.
e
−
E
nosi nazwę czynnika Boltzmanna
)
(
=
1
kT

Rozkład kanoniczny
Prawdopodobieństwo, że układ ma energię E
P
E
=
g
E
1
Z
e
−
E
gdzie g(E) jest liczbą mikrostanów o energii E.
W przypadku gdy mikrostan opisują zmienne ciągłe np. {q, p}, wówczas zamiast prawdopodo
bieństwem operujemy gęstością prawdopodobieństwa, a sumowanie zastępujemy całkowaniem.
Z =
∬
e
−
E
q, p
dqdp
Funkcja rozdziału:
Gęstość prawdopodobieństwa, że układ jest w stanie {q, p}
f
q , p
=
1
Z
e
−
E
q , p
Gęstość prawdopodobieństwa, że układ ma energię E
f
E
=
E
1
Z
e
−
E
(E) oznacza gęstość stanów – iloczyn
(E)
dE jest równy liczbie stanów w przedziale (E, E+
dE).
Prawdopodobieństwo, że układ ma energię w przedziale (E, E+
dE)
P
E , EdE
=
f
E
dE
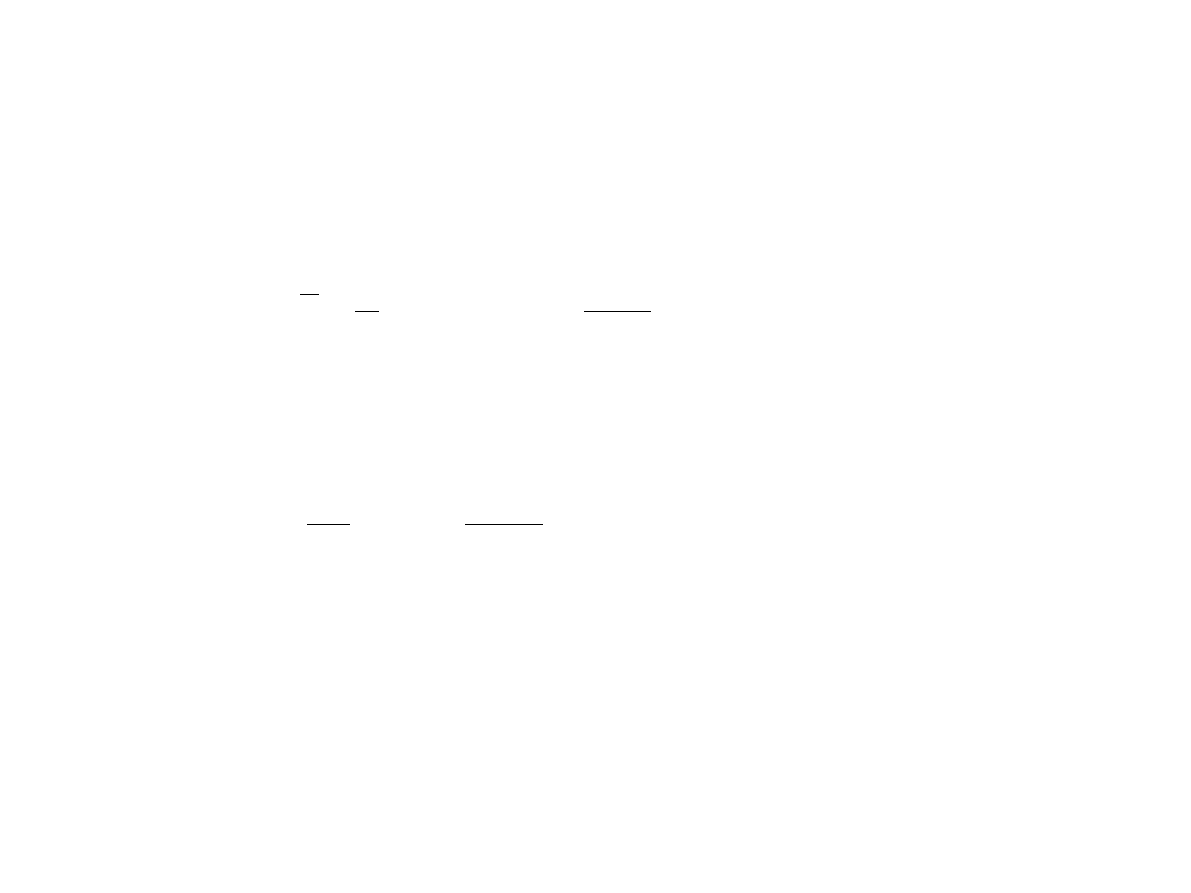
Wielkości termodynamiczne
Na podstawie rozkładu kanonicznego średnia energia układu (energia wewnętrzna U )
jest równa
U ≡ E = 1
Z
∑
E
e
−
E
= −
∂
ln
Z
∂
V
Pojemność cieplna przy stałej objętości
C
V
=
∂
U
∂
T
V
=
k
2
∂
2
ln
Z
∂
2
V
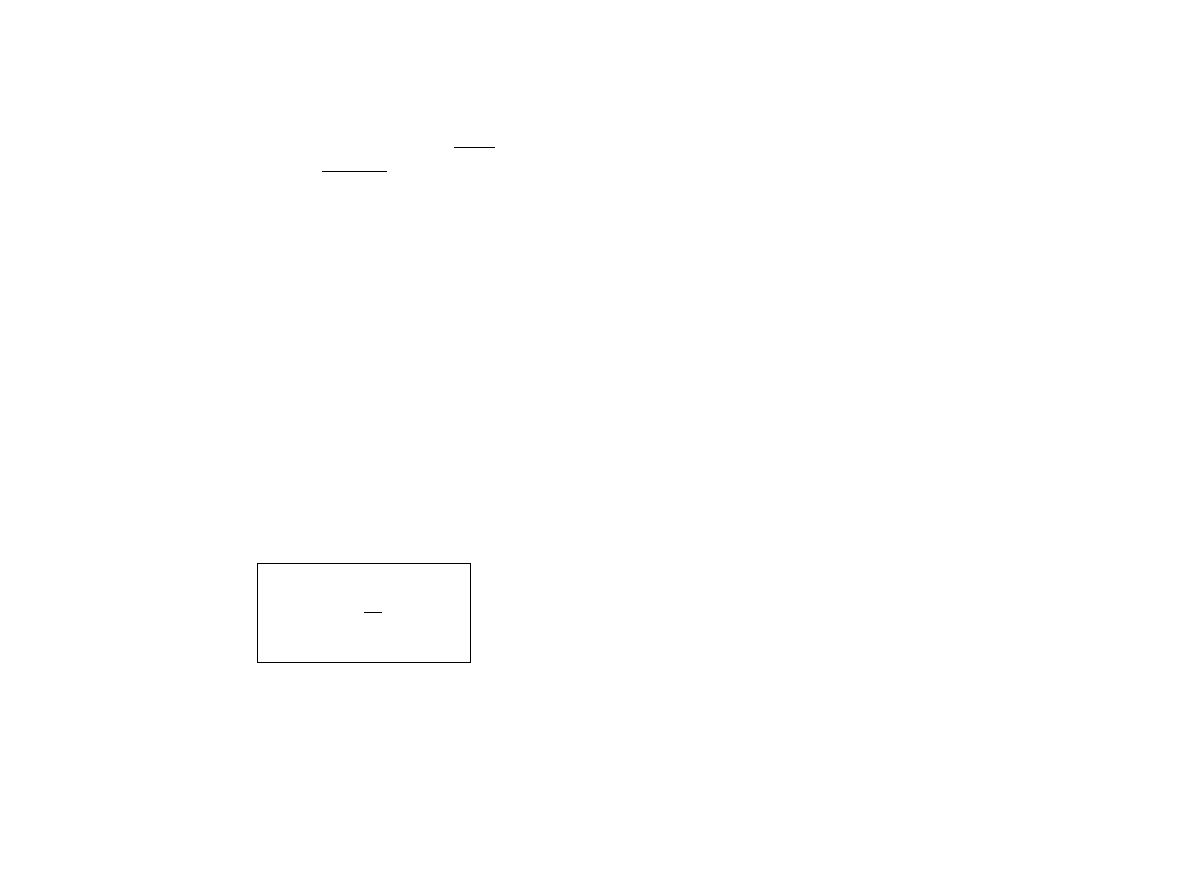
W układzie o energii E, prawdopodobieństwo mikrostanu
jest równe
P
=
1
E
=
e
−
S
E
k
(rozkład mikrokanoniczny)
P
=
Z
−
1
e
−
E
(rozkład kanoniczny)
Dla układów o bardzo dużej liczbie stopni swobody, rozkłady mikrokanoniczny i kanoniczny
stają się równoważne. Dzieląc stronami powyższe równości otrzymujemy
Ze
U−TS
=
Ze
F
=
1
Uwzględniliśmy tu, że średnia energia jest identyczna z energią wewnętrzną U oraz
energia swobodna F = U
–
T
S. Otrzymujemy związek
F = − 1
ln Z
Wzór ten jest szczególnie użyteczny – za jego pomocą możemy obliczyć wszystkie parametry
i potencjały termodynamiczne układu.
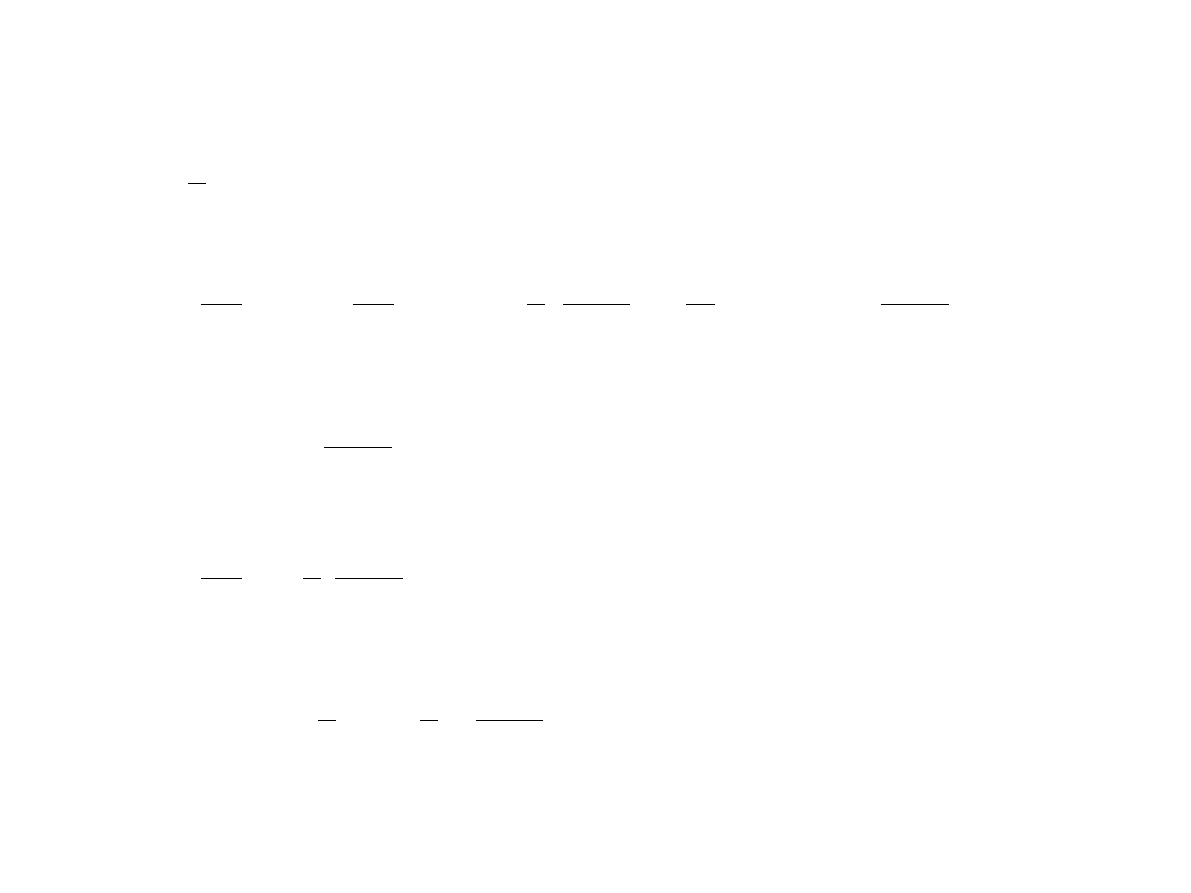
F = − 1
ln Z
S = −
∂
F
∂
T
V
=
k
2
∂
F
∂
V
=
k
2
[
−
1
∂
ln
Z
∂
V
1
2
ln
Z
]
= −
k
∂
ln
Z
∂
V
k ln Z
p = −
∂
F
∂
V
T
=
1
∂
ln
Z
∂
V
U = F TS = −
∂
ln
Z
∂
V
G = F pV = − 1
ln Z
1
V
∂
ln
Z
∂
V
Wielkości termodynamiczne
Wyszukiwarka
Podobne podstrony:
63 MT 09 Przybornik narzedziowy
59 MT 09 Warsztatowa lamiglowka
MT 09 1999 Samochody najbliższej przyszłości
58 MT 09 Stolik i polka
62 MT 09 Dla wynalazcow(1)
62 MT 09 ABC rakietnictwa
63 MT 09 Pilniki zastepcze
58 MT 09 Drobne usprawnienia
56 MT 09 Co zrobic z kapsli
58 MT 09 Praktyczne porady
58 MT 09 Prostownik lampowy
63 MT 09 Podstawka do czytania
59 MT 09 Lódka zabawka
62 MT 09 Podzespoly radiotechniczne
59 MT 09 Obrobka tworzyw sztucznych
63 MT 09 Otwieranie Wecka
59 MT 09 Termoregulator
58 MT 09 Odbiornik trzyzakresowy
63 MT 09 Przybornik narzedziowy
więcej podobnych podstron