
Copyright by Studium Oświatowe „Tutor”
dr inż. Zdzisław Głowacki, Toruń 2013
ODPOWIEDZI I MODEL OCENIANIA
I ogólnopolska próbna matura „CHEMIA Z TUTOREM”
dla uczniów klas przedmaturalnych
POZIOM ROZSZERZONY
TUTOR
CH-RP 201306
Ogólne zasady oceniania są takie same jak dla wszystkich prac maturalnych z chemii.
1. Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające
poleceniom zawartym w zadaniach.
[Nie mniej, ponieważ jest to próbna matura w klasie przedmaturalnej – za drobne uchybienia tj.
złe przybliżenie (błędne zaokrąglenie wartości końcowej), mniej istotne pomyłki we wzorach
półstrukturalnych, itp. nie należy pozbawiać uczniów punktów – tylko zaznaczyć te błędy
w ocenianym arkuszu.]
2. Rozwiązania zadań, uwzględniające inny tok rozumowania niż podany w kryteriach,
oceniane są zgodnie z zasadami punktacji. Uczeń może udzielić inaczej sformułowanych
odpowiedzi lub uzasadnień o innej treści niż podane w modelu – osoba oceniająca powinna
zawsze starannie przeanalizować takie zapisy. Jeżeli są one merytorycznie poprawne
i odpowiadają na zadane pytanie, to należy przyznać punkty za taką odpowiedź.
3. Istnieje kilka systemów ustalania nazw związków chemicznych, jeżeli uczeń podaje poprawną
nazwę, która nie jest wyszczególniona w tym modelu oceniania, to otrzymuje punkty zgodnie
z zasadami punktacji. (Jeżeli w poleceniu jest wymagane podanie nazwy systematycznej, to
podanie nazwy zwyczajowej jest odpowiedzią nieprawidłową.)
4. Gdy do jednego polecenia zdający podaje kilka odpowiedzi (z których jedna jest prawidłowa, inne
nieprawidłowe), to nie otrzymuje punktów za żadną z nich.
5. Jeżeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający powinien napisać
równanie reakcji chemicznej, a nie jej schemat.
6. Dobór współczynników w równaniach reakcji chemicznych może różnić się od przedstawionego
w modelu (np. mogą być zwielokrotnione), ale bilans musi być prawidłowy. Niewłaściwy dobór
lub brak współczynników powoduje utratę 1 punktu za zapis tego równania.
7. W rozwiązaniach zadań rachunkowych oceniane są: metoda, wykonanie obliczeń i podanie
wyniku z jednostką. W obliczeniach cząstkowych zapis jednostek nie jest wymagany, ale jeśli
jednostki są, to muszą być poprawne. Błędny zapis jednostki lub jej brak przy ostatecznym
wyniku liczbowym powoduje utratę 1 punktu. (W obliczeniach wymagane jest poprawne
zaokrąglanie wyników liczbowych.)
8. Za poprawne obliczenia będące konsekwencją zastosowania niepoprawnej metody zdający nie
otrzymuje punktów.
9. Za poprawne spostrzeżenia i wnioski będące konsekwencją niewłaściwie zaprojektowanego
doświadczenia zdający nie otrzymuje punktów.
10. Za napisanie wzorów strukturalnych zamiast wzorów półstrukturalnych (grupowych) nie odejmuje
się punktów.
11. Zapis „↑”, „↓” w równaniach reakcji nie jest wymagany.
12. Należy uznać „Δ” i „T” jako oznaczenie podwyższonej temperatury.
13. W równaniach reakcji, w których ustala się stan równowagi, brak „
⇄” nie powoduje utraty
punktów.

2
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
ODPOWIEDZI I MODEL OCENIANIA
www.tutor.edu.pl
Studium Oświatowe
„Tutor”
Zadanie 1. (1 pkt)
Należało podkreślić: Strzałka A Strzałka C
Zadanie 2. (1 pkt)
1. P, 2. P, 3. F
Zadanie 3. (1 pkt)
Należało zamalować pozycję chromu, pierwszy pierwiastek w grupie szóstej (Z = 24).
Zadanie 4. (1 pkt)
Strzałki oznaczone literami A i D.
Zadanie 5. (2 pkt)
1. Promieniowanie α, wiązka jąder helu, ładunek +2, najmniej przenikliwe promieniowanie.
2. Promieniowanie β
, wiązka elektronów, ładunek
1.
3. Promieniowanie β
+
, wiązka pozytonów, ładunek +1, cząstki antymaterii.
4. Promieniowanie neutronowe, wiązka neutronów
cząstek elektrycznie obojętnych, masa bliska
masie protonu.
5. Promieniowanie γ – fale elektromagnetyczne o częstotliwości wyższej od promieniowania
rentgenowskiego.
Uwaga! Jeżeli w miejscu 4. lub 5. uczeń wpisał neutrina (promieniowanie neutrinowe, wiązka neutrin), to taką odpowiedź
należy traktować jako poprawną.
[2 pkt w przypadku wymienienia co najmniej czterech rodzajów promieniowania z krótkim komentarzem,
1 pkt w przypadku podania trzech rodzajów z komentarzem]
Zadanie 6. (1 pkt)
W 2036 roku.
Zadanie 7. (1 pkt)
Nie można.
Metodę izotopową
14
C wykorzystuje się w przypadku obiektów pochodzących od organizmów
żywych. Dopóki organizmy żyły, miały stałą zawartość tego izotopu w wyniku wymiany atomów
węgla z otoczeniem. Zakładamy, że zawartość izotopu
14
C w otoczeniu (atmosferze) jest stała.
Z chwilą śmierci organizmu wymiana ustaje i zawartość izotopu
14
C obniża się proporcjonalnie do
okresu półtrwania. Można na przykład określać wiek przedmiotów wykonanych z drewna – od chwili
ścięcia drzewa zawartość izotopu
14
C w drewnie obniża się.
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
3
www.szkolna.pl
Zadanie 8. (4 pkt)
a)
substraty
produkt gazowy
1. węglan wapnia, kwas solny
CO
2
, tlenek węgla(IV)
2. aluminium, stężony wodorotlenek sodu
H
2
, wodór
3. tlenek magnezu, kwas bromowodorowy
nie wydziela się
4. miedź, stężony kwas azotowy(V)
NO
2
, tlenek azotu(IV)
5. siarczek potasu, kwas chlorowodorowy
H
2
S, siarkowodór
b) CaCO
3
+ 2 HCl
CaCl
2
+ H
2
O + CO
2
c) 2 H
+
+ S
2
H
2
S
[a) 2 pkt w przypadku wymienienia poprawnie co najmniej czterech produktów gazowych, 1 pkt w przypadku podania
trzech poprawnych odpowiedzi; b) i c) po 1 pkt za dobrą odpowiedź]
Zadanie 9. (2 pkt)
Równanie reakcji: Cu
2+
+ Cd + SO
4
2
Cu + Cd
2+
+ SO
4
2
Obliczenia:
112 g/mol
64 g/mol
m
mol
=
48 g
m
Cu
= ?
m =
3,2 g
Odpowiedź: Masa miedzi osadzonej wynosi 4,3 g.
[2 pkt w przypadku pełnej odpowiedzi, 1 pkt w przypadku poprawnego zapisania równania, uczeń może podać równanie
jonowe lub jonowe skrócone]
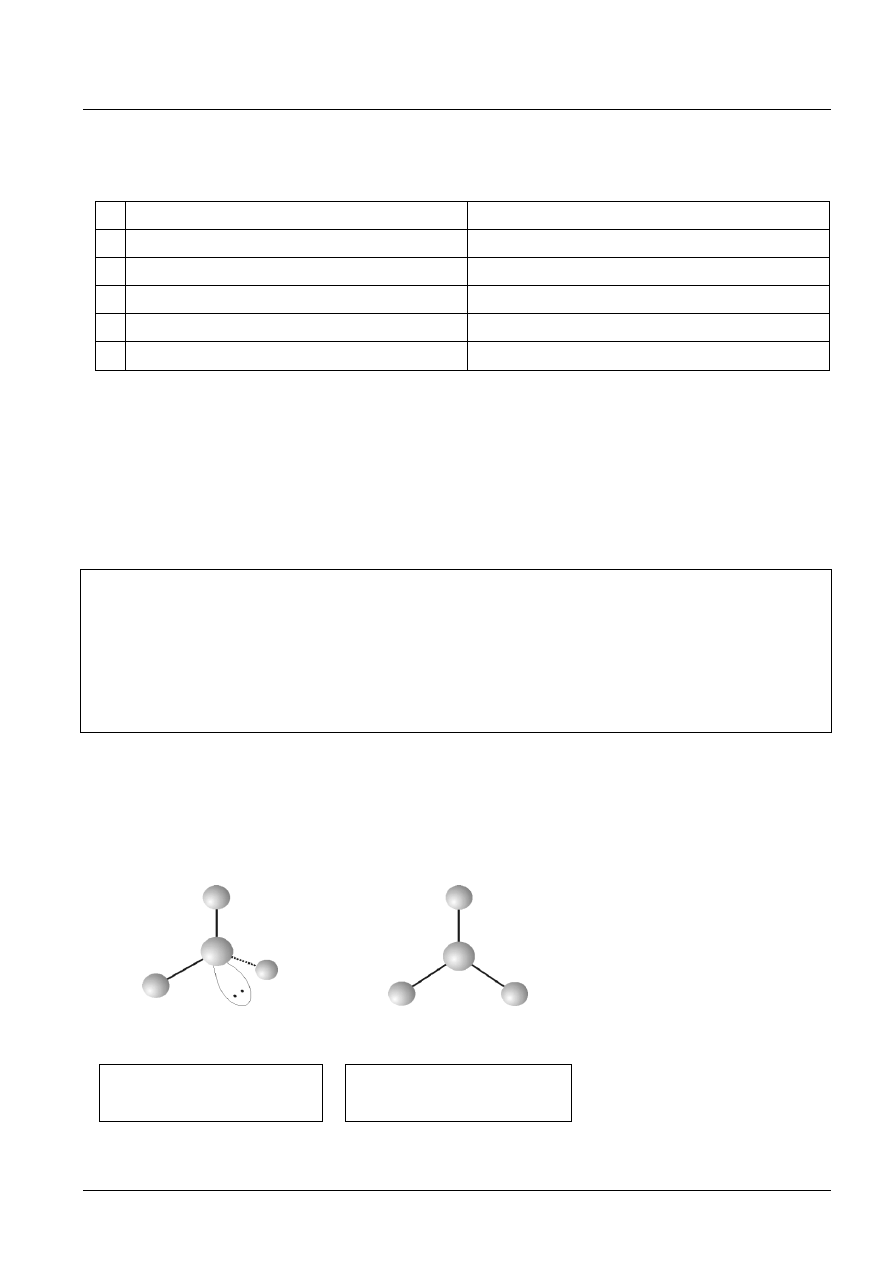
Zadanie 10. (2 pkt)
a)
b)
Przykładowo:
NH
3
, CH
3
, NCl
3
, SO
3
2
SO
3
, HCHO, CO
3
2
[2 pkt w przypadku wymienienia czterech indywiduów, 1 pkt w przypadku podania co najmniej dwóch, uczeń może podać
także inne cząsteczki i jony – osoba sprawdzająca powinna ocenić poprawność innych odpowiedzi]
4
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
ODPOWIEDZI I MODEL OCENIANIA
www.tutor.edu.pl
Studium Oświatowe
„Tutor”
Zadanie 11. (5 pkt)
a) 2 Cl
2 e
+ Cl
2
/
5
b) 8 H
+
+ MnO
4
+ 5 e
Mn
2+
+ 4 H
2
O /
2
c) 10 Cl
+ 16 H
+
+ 2 MnO
4
5 Cl
2
+ 2 Mn
2+
+ 8 H
2
O
d)
Obliczamy liczbę moli chloru:
n =
pV
R
T
1
Pa
1
m
, 1 J
mol
1
1
2
,4 4 mola
Liczba moli zużytego HCl wynosi: 0,808 mola
m
HCl
= 29,49 g
Obliczamy potrzebną objętość % roztworu HCl:
36 g
100 g roztw.
84,75 cm
3
29,49 g ----------------- V
x
V
x
= 69,42 cm
3
Odpowiedź: 69 cm
3
[Po 1 pkt za a), b) i c); 2 pkt za poprawne rozwiązanie zadania d), 1 pkt za obliczenie tylko liczby moli chloru lub
przedstawienie niepełnego rozwiązania w części d).]
Zadanie 12. (2 pkt)
a) Należało otoczyć kółkiem: NO
3
. Jon ten może być tylko utleniaczem – atom azotu jest na
najwyższym swoim stopniu utlenienia.
b)
zasady
NO
3
S
2
O
3
2
SO
3
2
IO
3
sprzężone kwasy
HNO
3
HS
2
O
3
HSO
3
HIO
3
[Po 1 pkt za a) i b)]
Zadanie 13. (1 pkt)
Zasady sprzężone z kwasami w kolejności od najsłabszej do najmocniejszej:
Br
, Cl
, ClO
, BrO

© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
5
www.szkolna.pl
Zadanie 14. (2 pkt)
a)
Sprawdzamy warunek:
c
4 ,
1
2
1
1
4
Wykonujemy obliczenia przybliżone:
K =
2
c,
=
c
1
1
2
10
2
,
% = 1%
Odpowiedź:
% = 1%
b)
Sprawdzamy warunek:
c
4 ,
1
1
1
4
Wykonujemy obliczenia przybliżone:
HX
H
+
+ X
K =
[H
]
2
c
, [H
+
] =
c = 10
5
mol/dm
3
, pH = 5
Odpowiedź: pH 5.
[Po 1 pkt za a) i b) – jeżeli uczeń przedstawił dobre wyniki, a nie dokonał sprawdzenia możliwości korzystania z obliczeń
uproszczonych – 1 pkt za oba podpunkty.]
Zadanie 15. (3 pkt)
a) Glin otrzymuje się przemysłowo na drodze elektrolizy stopionego tlenku glinu. Inną metodą może
być elektroliza stopionych soli otrzymanych z tego tlenku. Można także podać metodę redukcji
tlenku glinu aktywniejszym metalem – silniejszym reduktorem, np. magnezem.
b) Al
2
O
3
+ 6 HCl
2 AlCl
3
+ 3 H
2
O
AlCl
3
+ 3 NaOH
Al(OH)
3
+ 3 NaCl
c) Przykładowo:
Al(OH)
3
+ 3 H
+
Al
3+
+ 3 H
2
O
Al(OH)
3
+ 3 OH
[Al(OH)
6
]
3
lub
Al(OH)
3
+ 3 OH
AlO
3
3
+ 3 H
2
O
[Po 1 pkt za a), b) i c)]
6
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
ODPOWIEDZI I MODEL OCENIANIA
www.tutor.edu.pl
Studium Oświatowe
„Tutor”
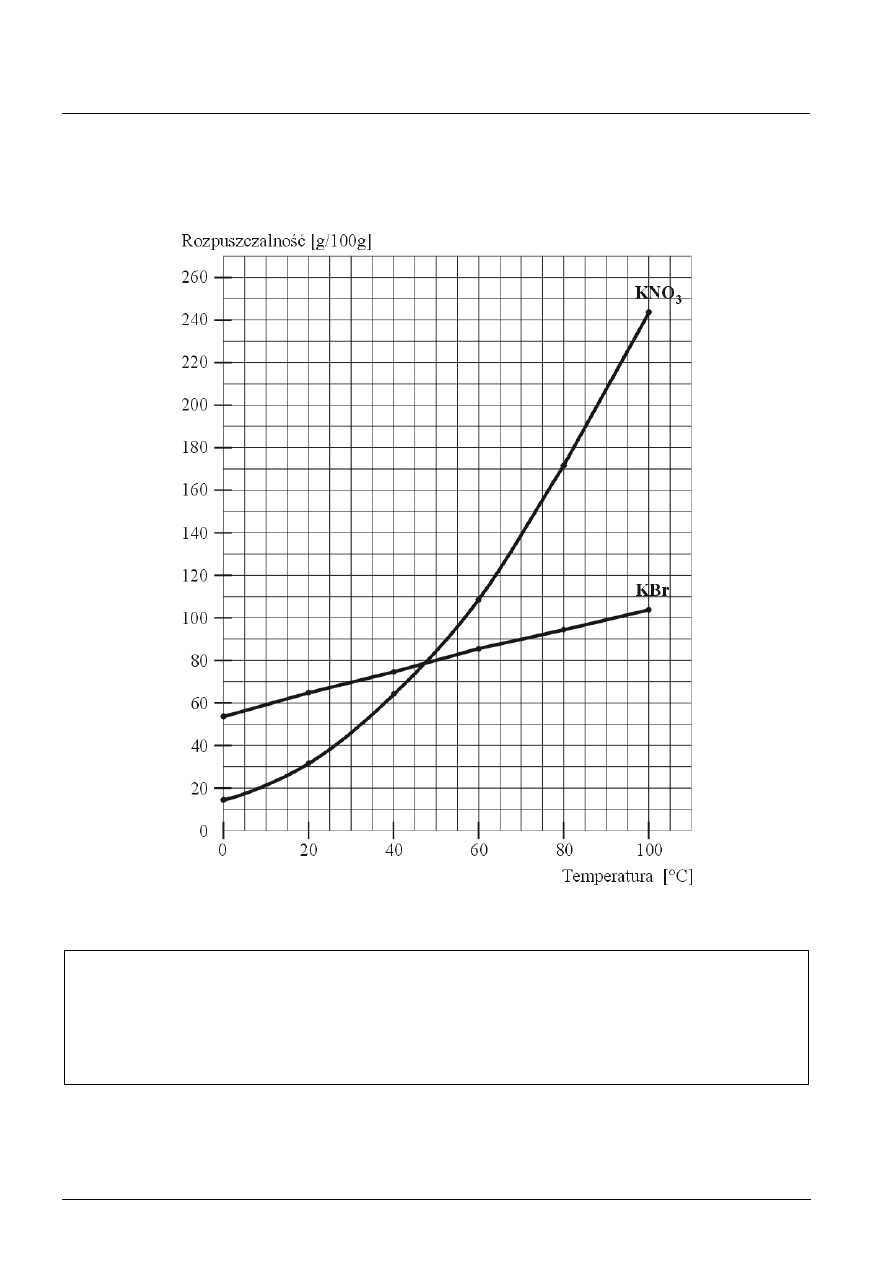
Zadanie 16. (5 pkt)
a) 1 pkt za prawidłowo narysowany i opisany wykres
b) W temperaturze ok. 48
C rozpuszczalności obu soli są równe.
c)
Obliczenia:
KBr
90 g
100 g H
2
O
m
x
= 18 g
20 g H
2
O
Odpowiedź: 1 g Br

© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
7
www.szkolna.pl
d)
Obliczenia:
80 g H
2
O
100 g KNO
3
100 g H
2
O
125 g KNO
3
t
1
= 65
C
100 g KNO
3
45 g = 55 g KNO
3
80 g H
2
O
m
x
100 g H
2
O
m
x
= 68,75 g/100 g H
2
O
odczytujemy z wykresu t
2
= 44
C
t = t
1
t
2
= 21
C
Odpowiedź: Należy oziębić roztwór o ok. 21
C, do temperatury 44
C.
[Po 1 pkt za a), b) i c); 2 pkt za poprawne rozwiązanie zadania d). 1 pkt za przedstawienie niepełnego rozwiązania lub
częściowo błędne np. nie uwzględnienie właściwej masy wody w obliczeniach, tylko wykonanie obliczeń w odniesieniu do
100 g.]
Zadanie 17. (4 pkt)
a) Ag
+
+ Cl
AgCl
b) Ag
+
NO
3
Cl
Na
+
c)
Obliczenia:
AgNO
3
+
NaCl
AgCl
+
NaNO
3
0,5 mola
1 mol
0,5 mola
m
AgCl
= 71,75 g osadu
V
K
= 1 dm
3
I
R
= [Ag
+
] [Cl
] = 10
10
[Ag
+
] = 2
10
10
mol/dm
3
[Cl
] = 0,5 mol/dm
3
n
Ag+
= 2
10
10
6,02
10
23
= 12,04
10
13
Odpowiedź: Masa osadu to 2 g, liczba jonów Ag
+
= 12,04
10
13
[Po 1 pkt za a) i b), 2 pkt za poprawne rozwiązanie zadania c). 1 pkt za obliczenie tylko jednej części zadania np. masy
osadu AgCl.]
8
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
ODPOWIEDZI I MODEL OCENIANIA
www.tutor.edu.pl
Studium Oświatowe
„Tutor”
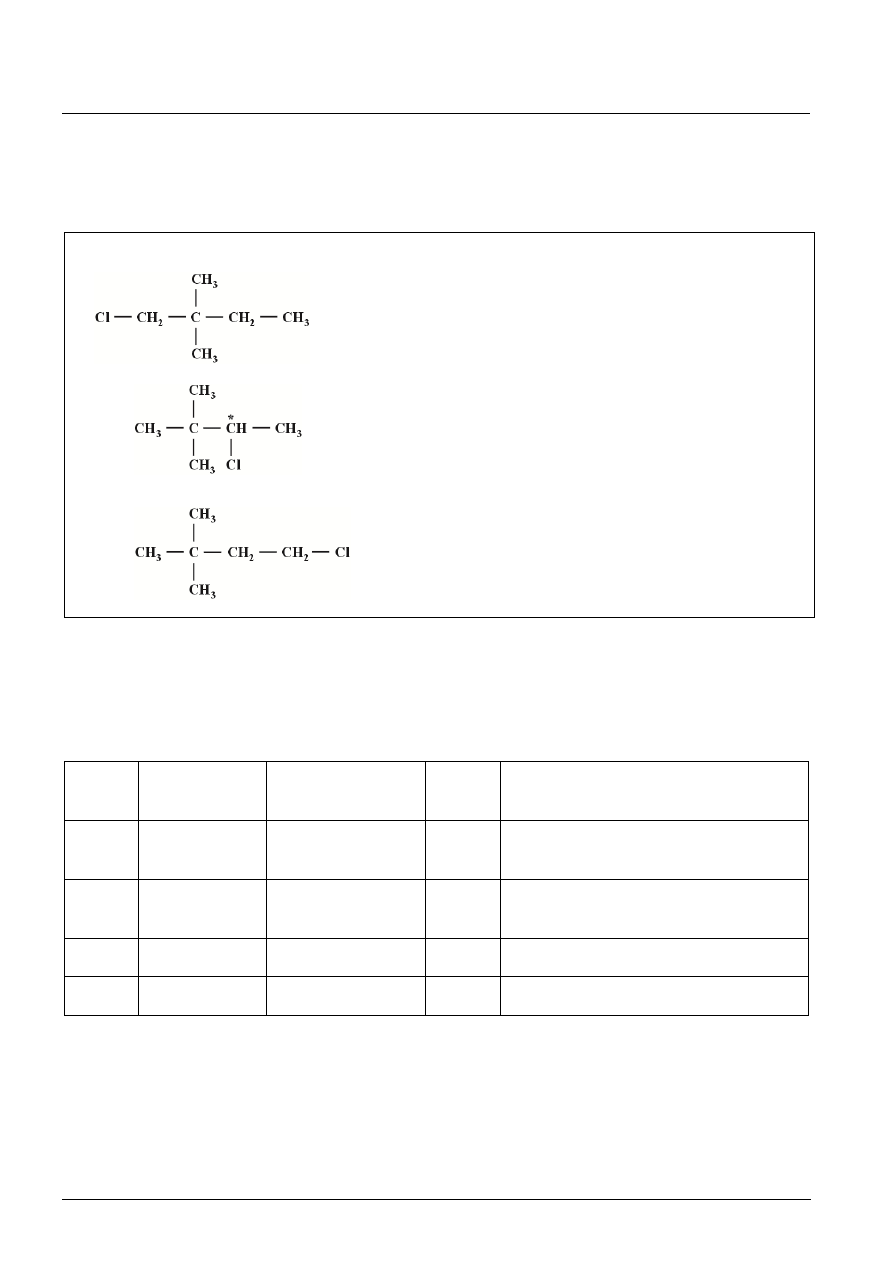
Zadanie 18. (2 pkt)
a) Cztery monochloropochodne, w tym para enancjomerów.
b)
wzory półstrukturalne
nazwy systematyczne
1-chloro-2,2-dimetylobutan
3-chloro-2,2-dimetylobutan
dwa izomery optyczne (+) i (
)
1-chloro-3,3-dimetylobutan
[Po 1 pkt za a) i b) – jeżeli uczeń w odpowiedzi nie uwzględni występowania pary enancjomerów, a wszystkie inne dane
poda poprawnie otrzymuje 1 pkt.]
Zadanie 19. (3 pkt)
nr pary
związek I
związek II
izomery
tak/nie
rodzaj izomerii
I
etanol
eter dimetylowy
tak
Izomeria strukturalna (metameria) lub
izomeria konstytucyjna
II
kwas etanowy
metanian metylu
tak
Izomeria strukturalna (metameria) lub
izomeria konstytucyjna
III
2-metylopentan 2,3-dimetylopentan
nie
IV
glukoza
sacharoza
nie
Związkami optycznie aktywnymi są: 2, -dimetylopentan, glukoza, sacharoza.
[2 pkt za poprawne uzupełnienie tabeli, 1 pkt w przypadku dobrego opisania trzech związków, 1 pkt za wymienienie
wszystkich związków optycznie aktywnych.]
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
9
www.szkolna.pl
Zadanie 20. (1 pkt)
Odpowiedź: Do szeregu L należy związek A, a do szeregu D należą związki B, C i D.
Zadanie 21. (2 pkt)
Obliczenia:
C
:
H
:
O
40
:
6,7
:
53,3 mg
/12
/1
/16
3,33
6,7
3,33 moli
2
4
2
najprostszy ester musi mieć dwa atomy tlenu: C
2
H
4
O
2
Odpowiedź:
metanian metylu (mrówczan metylu)
[1 pkt za ustalenie składu związku oraz 1 pkt za podanie wzoru półstrukturalnego i nazwy.]
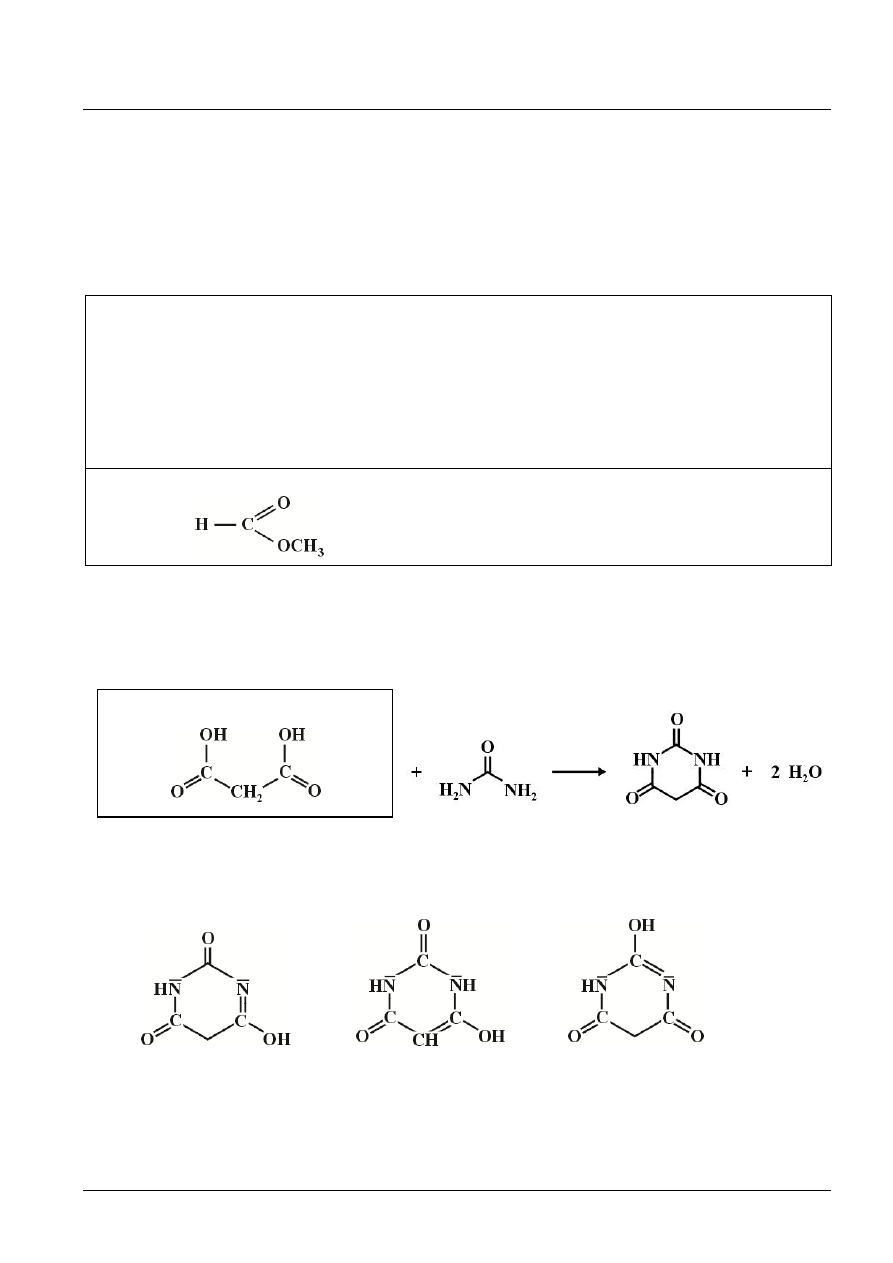
Zadanie 22. (3 pkt)
nazwa: kwas propanodiowy
kwas barbiturowy
Przykładowe odmiany tautomeryczne tego kwasu.
[1 pkt za podanie wzoru związku półstrukturalnego, 1 pkt za podanie nazwy i 1 pkt za narysowanie wzoru dowolnej
odmiany tautomerycznej.]
10
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
ODPOWIEDZI I MODEL OCENIANIA
www.tutor.edu.pl
Studium Oświatowe
„Tutor”
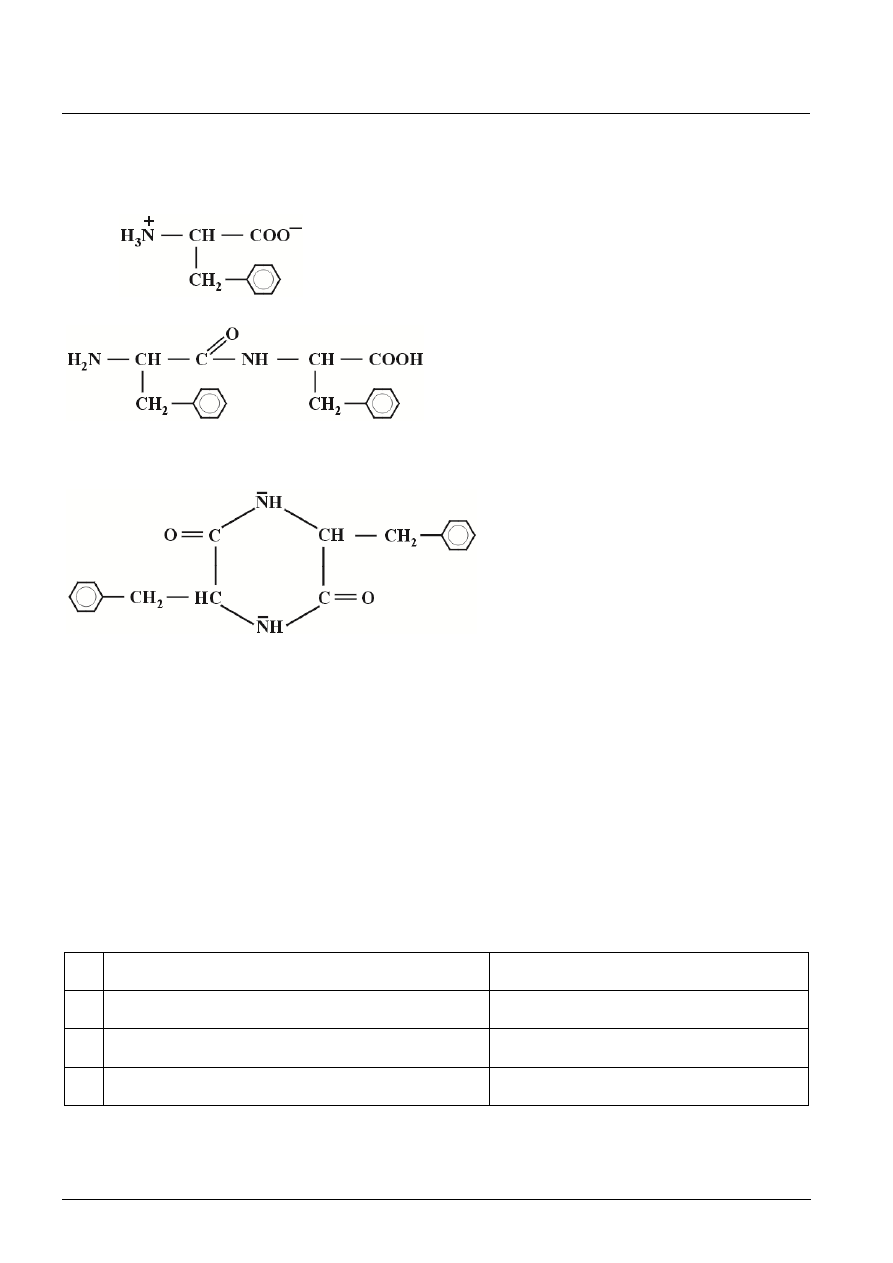
Zadanie 23. (5 pkt)
a) Wzór półstrukturalny fenyloalaniny w postaci soli wewnętrznej.
b)
dipeptyd liniowy
dipeptyd cykliczny
c) Dipeptydy cykliczne nie mogą występować w postaci soli wewnętrznych ponieważ ich grupy
aminowe (zasadowe) i karboksylowe (kwasowe) są zaangażowane w wytworzenie wiązań
amidowych.
d) Oba dipeptydy będą cząsteczkami optycznie aktywnymi – każdy z nich posiada dwa asymetryczne
atomy węgla.
[Po 1 pkt za a), c) i d) 2 pkt łącznie za b) – po 1 pkt za dobrze narysowany wzór dipeptydu.]
Zadanie 24. (2 pkt)
aminokwas lub pochodna aminokwasu
odczyn
1.
alanina (punkt izoelektryczny = 6,02)
lekko kwasowy
2.
kwas glutaminowy (punkt izoelektryczny = 3,22)
kwasowy
3.
sól sodowa fenyloalaniny
zasadowy
[2 pkt za pełną dobrą odpowiedź (w 1. jako dobrą odpowiedź można potraktować określenie – kwasowy (kwaśny), 1 pkt za
poprawne podanie odczynów w dwóch przypadkach).]
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
11
www.szkolna.pl
Zadanie 25. (2 pkt)
Obliczenia:
roztwór początkowy cm
3
, c = 15%, d = 1,2 g/cm
3
m
glu
= 360 g
15% = 54 g
0,3 mola
glukoza z sacharozy 342 g
1 mol glukozy
40 g
n
x
= 0,117 moli
V
k
= 1 dm
3
, c
m
= 0,417 mol/dm
3
Odpowiedź: Stężenie molowe ,41 mol/dm
3
.
[2 pkt za pełną dobrą odpowiedź, 1 pkt w przypadku popełnienia mniej istotnego błędu tj.: brak jednostki, dokonanie złych
przybliżeń).]
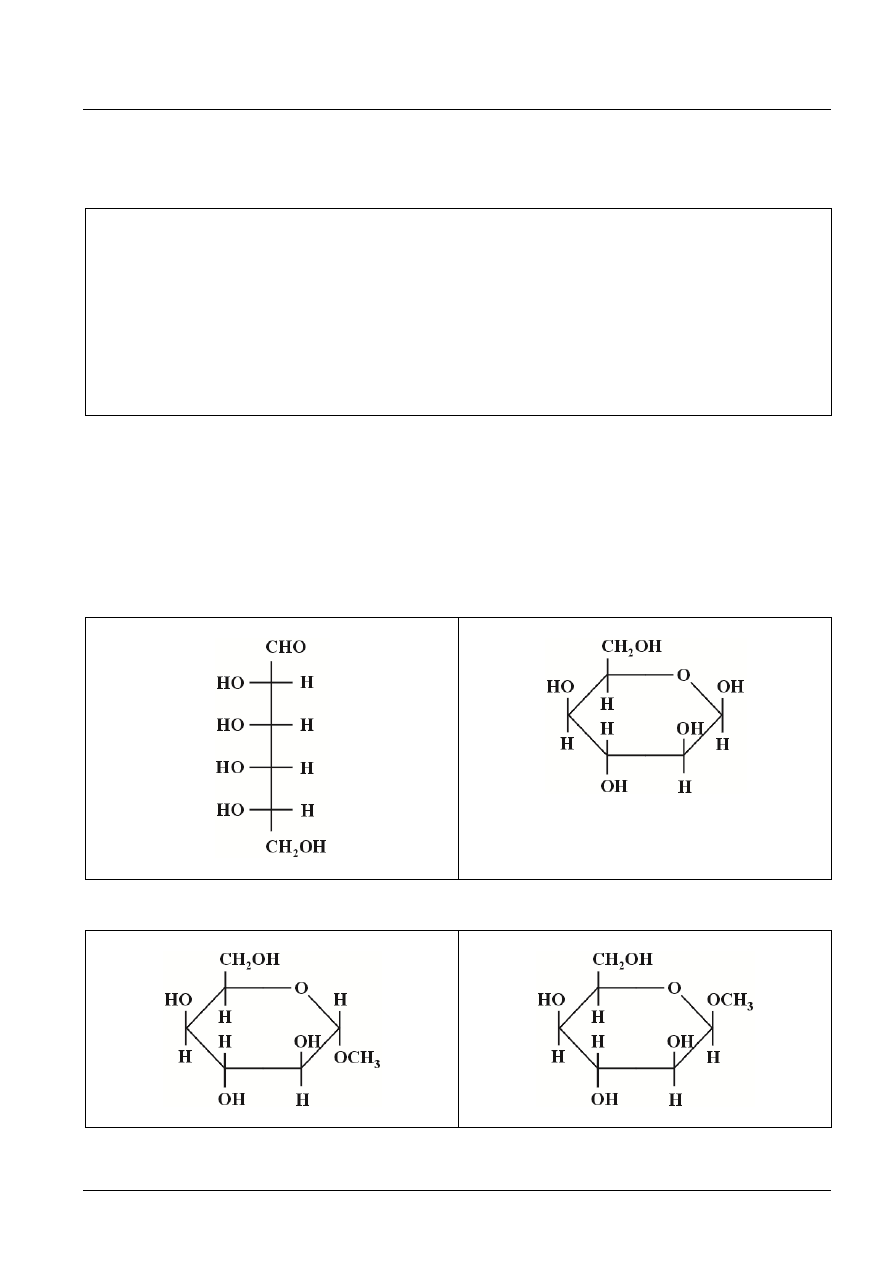
Zadanie 26. (2 pkt)
a) L-(
)-alloza w projekcji Fischera
b) anomer β-D-(
)-idozopiranozy
c)
[2 pkt za pełną dobrą odpowiedź, 1 pkt za poprawne wzory a) i b) oraz 1 pkt za poprawne wzory c).]
Wyszukiwarka
Podobne podstrony:
Chemia nieorganiczna zadania 12 Nieznany
chemia z tutorem arkusz 12 06 2013
chemia z tutorem arkusz 12 06 2013
arkusz 2 opm chemia z tutorem 12 06 2014 klasy przedmaturalne
chemia z tutorem 3 04 14 model i odpowiedzi
arkusz 2 opm chemia z tutorem 12 06 2014 klasy przedmaturalne
Chemia Egzamin Odpowiedzi
chemia zadania 2 id 113035 Nieznany
Pomiary Automatyka Robotyka 12 Nieznany
Pytania i Odpowiedzi 12
Chemia ogolna wyklady 5 6 2012 Nieznany
chemia opracowanie id 112613 Nieznany
chemia klucz (2) id 112361 Nieznany
odpowiedzi 2002 Nieznany
chemia tablice id 112030 Nieznany
Chemia 03 id 557778 Nieznany
więcej podobnych podstron