Medycyna Wet. 2008, 64 (2)
223
Praca oryginalna
Original paper
Plazma nasienia jest kompleksem bia³ek, których
synteza zwi¹zana jest z j¹drami, naj¹drzami i dodat-
kowymi gruczo³ami p³ciowymi (14). W sk³adzie bio-
chemicznym bia³ek plazmowych zidentyfikowano en-
zymy, hormony (12), inhibitory proteinaz, glikoprote-
iny (15). Op³aszczaj¹c siê po ejakulacji na powierzch-
ni plazmolemy w obrêbie struktur biochemicznych
plemników, bia³ka staj¹ siê systemami polifunkcyjny-
mi warunkuj¹cymi zdolnoæ zap³adniaj¹c¹ plemników,
decyduj¹cymi czêsto o p³odnoci samca (17). W ostat-
nim okresie uzyskano interesuj¹ce rezultaty badañ
wskazuj¹ce, ¿e niektóre bia³ka plazmowe determino-
waæ mog¹ p³odnoæ buhajów (7), ogierów (1) i knu-
rów (4). Podkrelono ich wp³yw na przydatnoæ na-
sienia do kriokonserwacji (5). Niemniej za niezbêdne
nale¿y uznaæ dalsze poszukiwania nowych rozwi¹zañ
metodycznych pozwalaj¹cych na charakterystykê
strukturaln¹ bia³ek plazmy nasienia zwi¹zanych z p³od-
noci¹.
Obok rutynowo stosowanych w laboratoriach bio-
chemicznych metod chromatografii powinowactwa,
chromatografii odwróconej fazy HPLC, sekwencjono-
wania bia³ek, szczególne zainteresowanie dotyczy
wysokorozdzielczych metod elektroforezy. Dwukie-
runkowa elektroforeza w ¿elu poliakryloamidowym
(2-D PAGE), obok spektrometrii masowej (MS), na-
le¿y do bloku analitycznego stosowanego w proteo-
mice, umo¿liwiaj¹c, miêdzy innymi, mapowanie bia-
³ek (11). Termin mapowanie bia³ek (protein mapping)
dotyczy identyfikacji pojedynczych polipeptydów
w z³o¿onych mieszaninach bia³ek przy wykorzystaniu
metody 2-D. Omawiana metoda stanowi po³¹czenie
izoelektroogniskowania (IEF) i elektroforezy w ¿elu
poliakryloamidowym w obecnoci soli sodowej siar-
czanu dodecylosodowego (SDS-PAGE) (10). W ten
sposób metoda 2-D pozwala na jednoczesn¹ identyfi-
kacjê bia³ek na podstawie ich ³adunku elektrostatycz-
nego oraz masy cz¹steczkowej. Dwukierunkowa elek-
troforeza w ¿elu poliakryloamidowym zosta³a wyko-
rzystana do charakterystyki plazmy nasienia ró¿nych
gatunków ssaków (1-3, 7, 9).
Celem badañ by³a ocena zmiennoci liczby polipep-
tydów w plazmie nasienia, identyfikowanych metod¹
elektroforezy dwukierunkowej, w zale¿noci od wie-
ku knurów i sezonu, w którym pozyskiwano nasienie.
Mapowanie bia³ek plazmy nasienia knura
przy wykorzystaniu metody elektroforezy
dwukierunkowej w ¿elu poliakryloamidowym*
)
W£ADYS£AW KORDAN, JERZY STRZE¯EK, DANIEL SOLIWODA,
MAREK LECEWICZ, MARZENA MOGIELNICKA
Katedra Biochemii i Biotechnologii Zwierz¹t Wydzia³u Bioin¿ynierii Zwierz¹t UWM, ul. Oczapowskiego 5, 10-718 Olsztyn
Kordan W., Strze¿ek J., Soliwoda D., Lecewicz M., Mogielnicka M.
Mapping of boar seminal plasma proteins by two-dimensional polyacrylamide gel electrophoresis
Summary
An attempt was made to use a modified 2-D PAGE technique to analyze seminal plasma proteins and their
polymorphisms in relation to boar age and season. The 2-D PAGE analysis of seminal plasma proteins
was performed using a buffer pH gradient of 3 to 10. Modifications to the 2-D PAGE procedure included
substituting mercaptoethanol (ME) with dithiothreitol (DTT) and the use of a specific reagent assay (Plus One
2-D Clean-Up Kit, Amersham Biosciences), which markedly improved the resolution of the electrophoregrams.
Polymorphisms by polypeptide mapping of boar seminal plasma were dependent on the animal age and
season. Furthermore, the amount of polypeptides detected in the seminal plasma was significantly lower in 12
month-old boars compared with 3 year-olds. Additionally, the seminal plasma polypeptides were markedly
lower in the summer than in the autumn. The results of the study showed that mapping seminal plasma
proteins may be used as a marker for the secretor activity of boar accessory sex glands, and as a selection
criterion for male reproduction.
Keywords: boar, seminal plasma, polyacrylamide gel electrophoresis
*
)
Badania wykonane w ramach tematu badañ statutowych UWM w Olszty-
nie nr 0103.0803.

Medycyna Wet. 2008, 64 (2)
224
Materia³ i metody
Materia³ dowiadczalny. Ejakulaty pobierano metod¹
manualn¹ od trzech knurów rasy wbp i pbz stacjonuj¹cych
w Laboratorium Biologii Rozrodu Katedry Biochemii
i Biotechnologii Zwierz¹t UWM w Olsztynie. Analizie
poddano 24 ejakulaty. Uzyskano zgodê Lokalnej Komisji
Etycznej w Olsztynie na pobieranie nasienia.
Przygotowanie próbek plazmy nasienia do rozdzia-
³ów elektroforetycznych metod¹ 2-D PAGE. Do badañ
stosowano plazmê nasienia uzyskan¹ po dwukrotnym wi-
rowaniu nasienia przez 20 minut, odpowiednio, przy 900 × g
i 10 000 × g, w temperaturze pokojowej. Przed wykona-
niem rozdzia³u elektroforetycznego w próbach oznaczano
zawartoæ bia³ka (18). Zastosowano oryginaln¹, zmodyfi-
kowan¹, procedurê przygotowania prób plazmy nasienia
do rozdzia³ów elektroforetycznych. Próby rozcieñczano do
koñcowej koncentracji 0,1 mg bia³ka/ml i preinkubowano
w obecnoci specyficznego zestawu odczynnikowego (Plus
One 2-D Clean-Up Kit, Amersham Biosciences) zgodnie
z procedur¹ podan¹ przez producenta. Po preinkubacji próby
zawieszano w 100 µl zmodyfikowanego buforu lizuj¹cego
(9,5 M mocznik Amersham Biosciences, 2% Triton
X-100 Sigma, 65 mM (0,65 × 10
1
M) DTT Serva, 2%
roztwór amfolitów w zakresie pH 3-10 Amersham Bio-
sciences) i poddawano elektroforezie dwukierunkowej.
Elektroforeza dwukierunkowa (2-D PAGE) bia³ek
plazmy nasienia. Przeprowadzono j¹ zgodnie z metod¹ po-
dan¹ przez OFarrel i wsp. (10), w gradiencie pH 3-10.
Izoelektroogniskowanie (IEF). ¯ele do izoelektroognis-
kowania (9,2 M mocznik, 4% poliakryloamid Sigma, 20%
Triton X-100, 2% roztwór amfolitów w zakresie pH 3-10)
poddawano wstêpnej preelektroforezie z zastosowaniem
zmiennych wartoci napiêcia (200 V 10 min., 300 V
15 min., 400 V 15 min.). Zasadniczy rozdzia³ elektrofo-
retyczny, poprzedzony elektoforez¹ wstêpn¹ (500 V
10 min.) prowadzono w temperaturze pokojowej (850 V
4,5 godziny).
Elektroforeza denaturuj¹ca (SDS-PAGE). Po izoelek-
troogniskowaniu, ¿ele poddawano inkubacji w buforze
ekwilibruj¹cym (0,0625 M Tris-HCl, pH 6,8; 2,3% SDS,
5,0% 2-merkaptoetanol Serva, 10% glicerol POCH,
Gliwice, 0,05% b³êkit bromofenolowy, metanol POCH,
Gliwice) przez 10 minut. Rozdzia³y elektroforetyczne pro-
wadzono w 15% ¿elu poliakryloamidowym w obecnoci
(SDS) oraz przy zastosowaniu buforu Tris-glicyna-SDS (pH
8,3) (8), wykorzystuj¹c aparat Mini Protean II (Bio-Rad).
Detekcja próbek po elektroforezie 2-D PAGE. ¯ele
poliakryloamidowe barwiono metod¹ srebrow¹ z wykorzy-
staniem zestawu odczynników Silver staining kit (Amer-
sham Biosciences) (6). Analizê elektroforegramów prze-
prowadzono z zastosowaniem programu komputerowego
PD Quest
TM
(Bio-Rad). Program ten pozwala na jednoczes-
ne i precyzyjne wyznaczenie masy cz¹steczkowej oraz ³a-
dunków elektrostatycznych analizowanych bia³ek.
Wp³yw wieku i pory roku na profil elektroforetycz-
ny polipeptydów plazmy nasienia knura. Próbki plazmy
nasienia stosowane w badaniach elektroforetycznych
uzyskiwano z ejakulatów 3 knurów spe³niaj¹cych kryteria
normospermii, w odniesieniu do wybranych wskaników
makroskopowych, mikroskopowych, morfologicznych oraz
zawartoci bia³ka ca³kowitego (tab. 1). Po pobraniu ejaku-
laty s¹czono przez steryln¹ gazê w celu usuniêcia frakcji
galaretowatej, a nastêpnie poddawano wirowaniu przy
10 000 × g w ci¹gu 15 minut, w temperaturze pokojowej.
Uzyskan¹ w ten sposób plazmê nasienia przechowywano
w temperaturze 80°C (193,2 K) do czasu dalszych analiz.
Uwzglêdniono 12-miesiêczne przedzia³y wiekowe knurów.
Badaniami profili elektroforetycznych objêto plazmy na-
sienia uzyskane od knurów w wieku: 12 miesiêcy, 24 mie-
siêcy, 36 miesiêcy i dodatkowo 42 miesiêcy. Uwzglêdnia-
j¹c zmiany d³ugoci dnia wietlnego oraz wp³yw tego zja-
wiska na w³aciwoci biologiczne nasienia wyodrêbniono
cztery okresy, w których wykonano badania profili elek-
troforetycznych, tj. wiosenny (obejmuj¹cy miesi¹ce: kwie-
cieñ, maj, czerwiec), letni (obejmuj¹cy miesi¹ce: lipiec,
sierpieñ, wrzesieñ), jesienny (obejmuj¹cy miesi¹ce: pa-
dziernik., listopad, grudzieñ) oraz zimowy (obejmuj¹cy
miesi¹ce: styczeñ, luty, marzec).
Analizê statystyczn¹ przeprowadzono przy pomocy pro-
gramu komputerowego Statistica 6.0 (statsoft). Stosowano
test Dunnetta.
Wyniki i omówienie
Bia³ka plazmy nasienia knura wykazuj¹ tendencjê
do agregacji powodowanej, miêdzy innymi, ich gliko-
proteinowym charakterem (15), co w znacznym stop-
niu utrudnia ich analizê elektroforetyczn¹. Stosowa-
nie klasycznej metody elektroforezy dwukierunkowej
(2-D) do analizy omawianych substancji nie daje za-
dowalaj¹cych rezultatów, co przejawia siê nisk¹ roz-
dzielczoci¹ otrzymanych ektroforegramów i w koñ-
cowym efekcie nie pozwala na ich obiektywn¹ analizê.
W niniejszych badaniach podjêto próbê adaptacji me-
tody (2-D) do analizy bia³ek plazmy nasienia knura.
W wyniku modyfikacji metody 2-D PAGE, polega-
j¹cej na zastosowaniu specyficznego zestawu odczyn-
nikowego (Plus One 2-D Clean-Up) do preinkubacji
prób, otrzymano wzrost rozdzielczoci elektroforegra-
mów. Zastosowanie preinkubacji w znacznym stop-
niu redukowa³o ingerencjê substancji niepo¿¹danych,
takich jak: kwasy nukleinowe, detergenty, sole, lipidy,
fenole. Dodatkowo zast¹pienie w buforze lizuj¹cym
2-merkaptoetanolu DTT (ditiotreitolem), posiadaj¹cym
wiêksz¹ zdolnoæ redukcji mostków disiarczkowych
ze wzglêdu na obecnoæ w sk³adzie dwóch grup tiolo-
wych (-SH), wp³ywa³o pozytywnie na rozdzielczoæ
elektroforetyczn¹ bia³ek plazmy nasienia knura. Ob-
a
k
s
W
k
i
n
x
a
i
m
r
e
p
s
o
m
r
o
N
)
6
1
(
g
w
m
c
(
u
t
a
l
u
k
a
j
e
æ
o
t
e
j
b
O
3
)
8
7
,
8
4
2
0
0
4
-
0
0
1
0
1
(
w
ó
k
i
n
m
e
l
p
a
j
c
a
rt
n
e
c
n
o
K
6
m
c
/
3
)
4
4
,
0
8
5
0
0
6
-
0
5
1
)
%
(
w
ó
k
i
n
m
e
l
p
æ
o
w
il
h
c
u
R
7
1
,
8
6
0
5
>
h
c
y
n
o
i
n
e
i
m
z
w
ó
k
i
n
m
e
l
p
k
e
t
e
s
d
O
)
%
(
e
i
n
z
c
i
g
o
l
o
fr
o
m
0
8
,
7
0
2
<
m
c
/
g
m
(
e
ti
w
o
k
³
a
c
o
k
³
a
i
B
3
)
3
3
,
6
3
0
0
,
8
3
o
³
o
k
o
Tab. 1. Wybrane wskaniki ejakulatów (n = 24)
Medycyna Wet. 2008, 64 (2)
225
serwowane zjawisko pozwoli³o na zastosowanie me-
tody 2-D do analizy map polipeptydowych plazmy
nasienia z uwzglêdnieniem wieku knurów i pory roku.
W obrêbie analizowanych elektroforegramów wyod-
rêbniono trzy grupy polipeptydów, przyjmuj¹c za kry-
terium podzia³u ich masê cz¹steczkow¹, tj.: £ 20,1
kDa grupa I; 20,1-40 kDa grupa II; 40-90 kDa
grupa III.
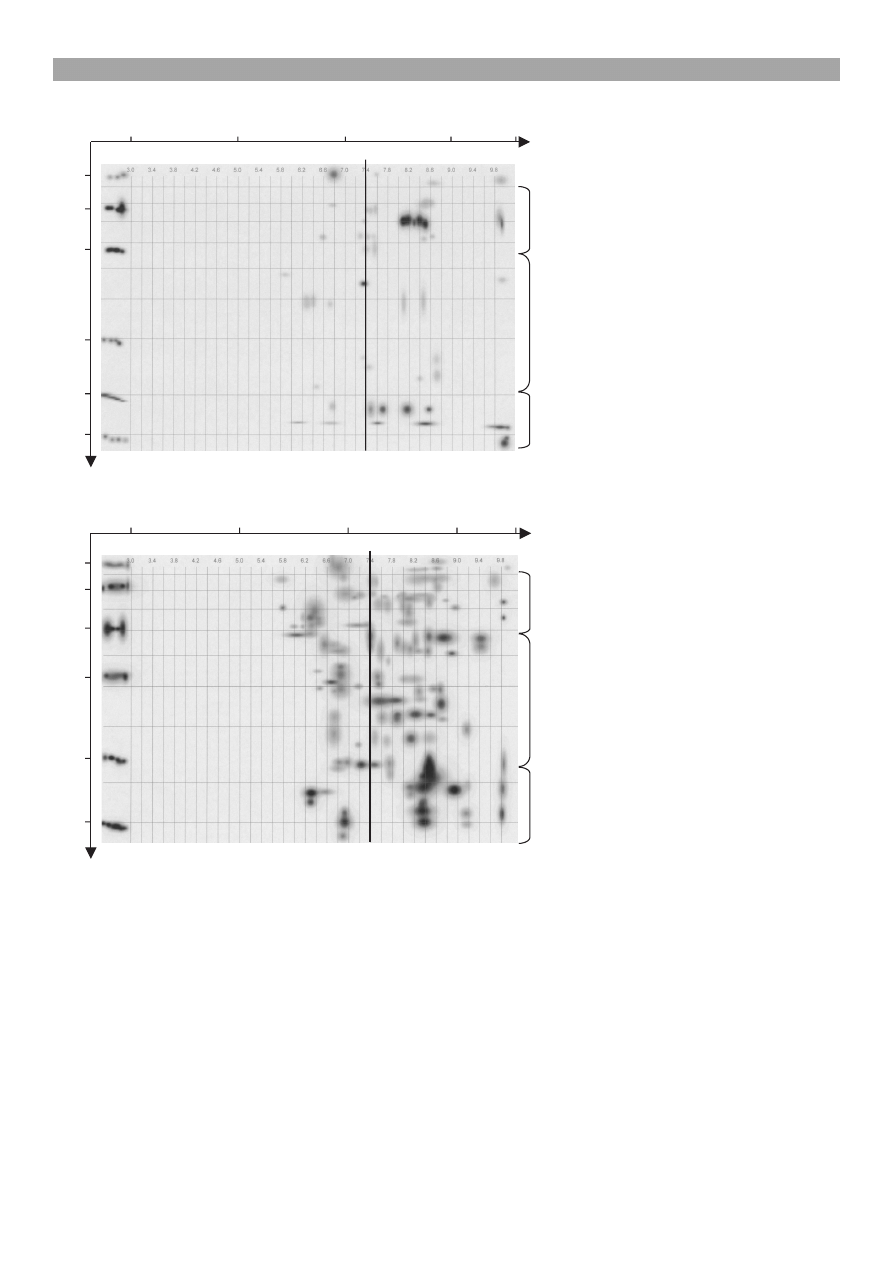
Jak wynika z danych przedstawionych na ryc. 1, wraz
z up³ywem wieku knura obserwowano zmiany ilocio-
we i jakociowe w sk³adzie map polipeptydowych.
Zjawisko to przejawia³o siê szczególnie wzrostem
ogólnej liczby polipeptydów u analizowanego osob-
nika, odpowiednio, od 52 w wieku 12
miesiêcy do 131 w wieku 36 miesiê-
cy. Dynamiczny wzrost liczby poli-
peptydów obserwowano szczególnie
w przedziale 20-40 kDa, od 16 u knu-
ra w wieku 1 roku do 53 u osobnika
w wieku 3 lat oraz w grupie polipep-
tydów o masie cz¹steczkowej 40-90
kDa, od 24 w wieku 12 miesiêcy do
49 w wieku 36 miesiêcy. Zmianom
ilociowym frakcji polipeptydowych
towarzyszy³o pojawienie siê bia³ek
o nowych w³aciwociach bioche-
micznych, których przejawem by³y
wartoci pI bia³ek w zakresie pH obo-
jêtnego, a szczególnie zasadowego.
Dotyczy³o to zw³aszcza polipeptydów
w przedziale mas cz¹steczkowych od
20 do 40 kDa i od 40 do 90 kDa.
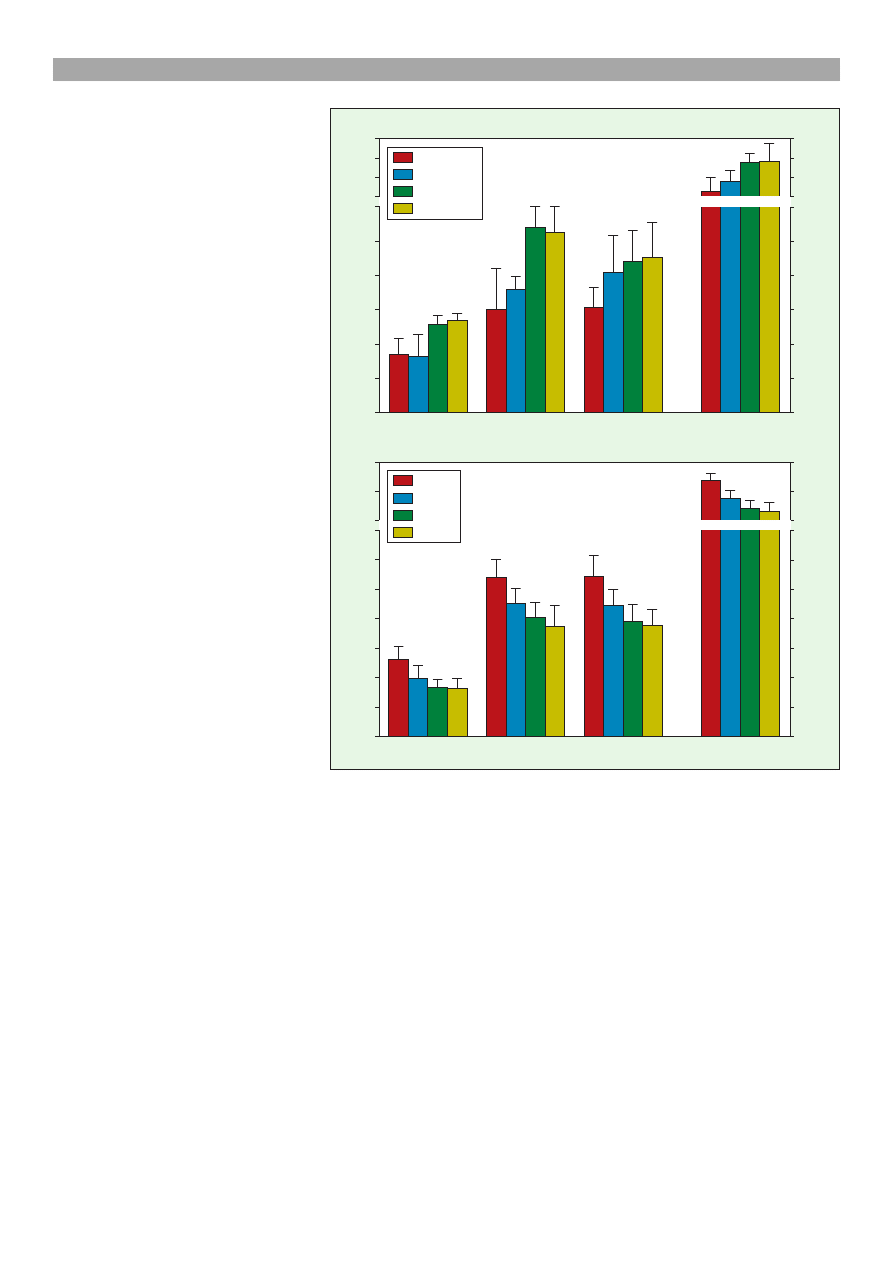
Rezultaty analiz ilociowych pro-
fili polipeptydowych plazmy nasienia
z uwzglêdnieniem wieku knurów
przedstawia ryc. 2A. W analizowa-
nych próbkach plazmy nasienia ob-
serwowano, potwierdzony statystycz-
nie, wzrost ogólnej liczby polipepty-
dów wraz z up³ywem wieku knurów,
odpowiednio, od 72 w wieku 1 roku
do 125 w wieku 3 lat. U osobników
w wieku 3,5 roku stwierdzono tylko
nieznaczny wzrost liczby polipepty-
dów. Na podkrelenie zas³uguje fakt
istotnego wzrostu liczby polipepty-
dów u osobników 3-letnich, szczegól-
nie w przedziale mas cz¹steczkowych
od 20 do 40 kDa. Równie¿ w pozo-
sta³ych grupach (> 20 kDa, 40-90
kDa) najwy¿sz¹ liczbê polipeptydów
obserwowano u osobników w wieku
3-3,5 roku.
Wyniki badañ wskazywaæ mog¹ na
osi¹gniêcie pe³nej zdolnoci sekrecyj-
nej dodatkowych gruczo³ów p³cio-
wych knura w wieku oko³o 3 lat. Zja-
wisko to zapewne dotyczy szczegól-
nie gruczo³ów pêcherzykowych, które u knura s¹ g³ów-
nym ród³em bia³ek plazmy nasienia (15).
Jak wynika z danych przedstawionych na ryc. 2B,
najwy¿sz¹, potwierdzon¹ statystycznie, liczbê polipep-
tydów obserwowano w okresie jesiennym 122, naj-
ni¿sz¹ w letnim 84. W okresie zimowym i wiosen-
nym zanotowano wartoci porednie. Wyniki takie
dotyczy³y wszystkich grup analizowanych polipepty-
dów, niezale¿nie od ich masy cz¹steczkowej. Tym nie-
mniej istotny wzrost liczby polipeptydów w okresie
jesiennym stwierdzono w grupach w przedziale mas
cz¹steczkowych 20-40 kDa i 40-90 kDa, odpowied-
nio: 55 i 56. Natomiast dla okresu letniego wartoci te
7,4
7,4
3
5
7
9
10
40-90
kDa
(24*)
40-90
kDa
(49*)
20-40
kDa
(16*)
20-40
kDa
(53*)
£
20
kDa
(12*)
£
20
kDa
(29*)
3
5
7
9
10
94,0
67,0
45,0
30,0
20,1
14,4
14,4
94,0
67,0
45,0
30,0
20,1
Mr
(kDa)
Mr
(kDa)
pH
pH
A.
B.
Ryc. 1. Elektroforeza dwukierunkowa (2-D) bia³ek plazmy nasienia knura w wie-
ku 12 miesiêcy (A) i 36 miesiêcy (B)
Objanienia: * liczba polipeptydów
Medycyna Wet. 2008, 64 (2)
226
wynosi³y, odpowiednio, 36 i 37 poli-
peptydów. Obserwowane zjawisko
wskazywaæ mo¿e na sezonow¹
zmiennoæ w zakresie aktywnoci
translacyjnej dodatkowych gruczo³ów
p³ciowych knura. Nale¿y nadmieniæ,
i¿ ejakulaty kolekcjonowane w mie-
si¹cach letnich charakteryzuj¹ siê ob-
ni¿on¹ jakoci¹, natomiast jesieni¹
wykazuj¹ najwy¿sz¹ wartoæ biolo-
giczn¹ (16).
W posumowaniu nale¿y stwierdziæ,
¿e zmodyfikowana metoda elektrofo-
rezy dwukierunkowej (2-D) mo¿e byæ
z powodzeniem stosowana w anali-
zie bia³ek plazmy nasienia knura.
Z kolei uwarunkowany wiekiem knu-
rów i por¹ roku polimorfizm map po-
lipeptydowych plazmy nasienia knu-
ra mo¿e byæ wykorzystany jako mar-
ker molekularnych zmian aktywnoci
sekrecyjnej dodatkowych gruczo³ów
p³ciowych. Stanowiæ mo¿e zarazem
istotny wyznacznik kwalifikacji sam-
ców do rozrodu.
Pimiennictwo
1.Brandon C. I., Heusner G. L., Caudle A. B., Fayrer-
-Hosken R. A.: Two-dimensional polyacrylamide gel
electrophoresis of equine seminal plasma proteins
and their correlation with fertility. Theriogenology
1999, 52, 863-873.
2.Desnoyers L., TherienI., Manjunath P.: Characteri-
zation of the major proteins of bovine fluid to two-
-dimensional polyacrylamide gel electrophoresis.
Mol. Reprod. Dev. 1994, 37, 425-435.
3.Cardozo J. A., Fernandez-Juan M., Forcada F.,
Abecia A., Muini-Blanco T., Cebrian-Perez J. A.:
Monthly variations in ovine seminal plasma pro-
teins analyzed by two-dimensional polyacrylamide
gel electrophoresis. Theriogenology 2006, 66, 841-
-850.
4.Flowers W. L.: Relationships between seminal
plasma proteins and boar fertility. Ann. Swine Rep.
2001, 1-4.
5.Fraser L., Dziekoñska A., Strze¿ek J., Strze¿ek R.: Dialysis of boar semen
prior to freezing-thawing: Its effect on post-thaw sperm characteristics.
Theriogenology 2007 (w druku).
6.Heukeshoven J., Dernick R.: Simplified method for silver staining of pro-
teins in polyacrylamide gels and the mechanism of silver staining. Electro-
phoresis 1985, 6, 103-112.
7.Killian G. J., Chapman D. A., Rogowski L. A.: Fertility-associated proteins
in Holstein bull seminal plasma. Biol. Reprod. 1993, 49, 1202-1207.
8.Laemmli U. K.: Cleavage of structural proteins during the assembly of the
head bacteriophage T4. Nature 1970, 277, 680-685.
9.Mc Dowell K. J., Little T. V., Timoney P. J., Adams M. H.: Characterization of
proteins in the seminal plasma of stallions, geldings and geldings supple-
mented with testosterone. Res. Vet. Sci. 61, 33-37.
10.OFarrel P. Z., Goodman H. M., OFarrel P. H.: High resolution of two-
-dimensional electrophoresis of basic as wall as acidic proteins. Cell 1977,
12, 113-142.
11.Panisko E. A., Conrads T. P., Goshe M. B., Veenstra T. D.: The postgenomic
age: Characterization of proteomes. Exp. Hemat. 2002, 30, 97-107.
12.Shivaji S., Scheit K. H., Bhargava P. M.: Proteins of Seminal Plasma.
A Willey-Interscience Publications, New York 1990.
13.Strze¿ek J.: Nasienie i u¿ytkowanie rozp³odowe knura, [w:] Wierzbowski S.
(red.): Andrologia. Platan-Kryspinów 1996, 201-217.
14.Strze¿ek J.: Plazma nasienia a niektóre funkcje biologiczne plemników. Post.
Biol. Kom. 1999, 26, 59-68.
15.Strze¿ek J.: Secretory activity of boar seminal vesicle glands. Biol. Reprod.
2002, 2, 243-266.
16.Strze¿ek J., Demianowicz W., Luberda Z., Torska J.: The effect of season on
acrosin activity and plasmolemma susceptibility of boar spermatozoa. Proc.
12
th
Int. Congess Anim. Reprod. The Hague, Netherlands 1992, 4, 532-534.
17.Strze¿ek J., Wysocki P., Kordan W., Kukliñska M., Mogielnicka M., Soli-
woda D., Fraser L.: Proteomics of boar seminal plasma current studies and
possibility of their application in biotechnology of animal reproduction.
Reprod. Biol. 2005, 5, 279-290.
18.Weichselbaum T. E.: An accurate and rapid method for the determination of
proteins in small amounts of blood serum and plasma. Am. J. Clin. Path.
Techn. Sekt. 1946, 10, 40.
Adres autora: dr hab. W³adys³aw Kordan, prof. nadzw. UWM, ul. Ocza-
powskiego 5, 10-718 Olsztyn; e-mail: w³adys³aw.kordan@uwm.edu.pl
Ryc. 2. Wp³yw wieku knurów (A), (n = 12) oraz pory roku (B), (n = 12) na liczbê
polipeptydów plazmy nasienia knura po elektroforezie 2D
Objanienia: a, b, A, B, C rednie oznaczone ró¿nymi literami ró¿ni¹ siê istotnie:
ma³ymi przy p £ 0,05; du¿ymi przy p £ 0,01
A.
0
10
20
30
40
50
60
70
100
130
160
Liczba
polipeptydów
Liczba
polipeptydów
Liczba
polipeptydów
Liczba
polipeptydów
0
10
20
30
40
50
60
70
100
130
160
>20 kDa
20-40 kDa
40-90 kDa
a
b
a
a
b b
b
b
a
S
B.
0
10
20
30
40
50
60
70
80
120
160
0
10
20
30
40
50
60
70
80
120
160
>20 kDa
20-40 kDa
40-90 kDa
A
B
A
A
A
C
C
B
B
B
B
B
B
B
B
B
S
jesieñ
zima
wiosna
lato
12 miesiêcy
24 miesi¹ce
36 miesiêcy
42 miesi¹ce
Wyszukiwarka
Podobne podstrony:
Mapowanie Dyskow Sieciowych id Nieznany
17 05 2010 bialek kaleta Bazy D Nieznany (2)
BIOC 2027 rodzina bialek nf kb Nieznany (2)
Sklad chemiczny plazmy nasienia
Cw 5 Andro IV pobieranie nasien Nieznany
Mapowanie genow id 279397 Nieznany
Andro Cw 11 Konserwacja nasien Nieznany
Ilosciowe oznaczanie bialek id Nieznany
2010 artykul MAPOWANIE PROCESOW Nieznany (2)
Przykłady roli biologicznej białek
Właściwości fizykochemiczne białek
1 Przyswajanie białek przez organizmid 8658 ppt
Gor±czka o nieznanej etiologii
właściwości białek mięśniowych
Budowa Chemiczna Białek
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
więcej podobnych podstron