1
KWASY KARBOKSYLOWE
HCOOH
metanowy
(mrówkowy)
CH
3
COOH
etanowy
(octowy)
CH
3
CH
2
COOH
propanowy
(propionowy)
CH
3
CH
2
CH
2
COOH
butanowy …
(masłowy)
CH
3
(CH
2
)
3
COOH
(walerianowy)
OH
COOH
COOH
Br
Cl
kwas 2-hydroksybenzoesowy
kwas 1-bromo-t-2-chloro-1-cyklopentanokarboksylowy
Wa
ż
no
ść
grup funkcyjnych:
RCOOH > RCOOR’ > RCOX > RCONR’
2
. RCN > RCOR’ >
ROH > RNH
2
> RCH=CHR > RC
≡
CR
(COOH)
2
k. etanodiowy
(szczawiowy)
CH
2
(COOH)
2
k. propanodiowy (malonowy)
(CH
2
COOH)
2
k. butanodiowy
(bursztynowy)
HOOCCH=CHCOOH k. but-2-endiowy (cis- maleinowy, trans- fumarowy)
Struktura, wła
ś
ciwo
ś
ci
R
C
O
H
C
O
O
R
H
O
C
O
H
R
O
polarno
ść
, wysokie t.t., t.wrz., zapach, lotno
ść
t.t. [
°°°°
C]
t.wrz. [
°°°°
C]
CH
3
CH
2
OH
-114.7
78.5
CH
3
CHO
-121.0
20.8
CH
3
COOH
16.7
118.2
Wła
ś
ciwo
ś
ci kwasowo-zasadowe
C
O
O
R
H
+ H
2
O
+ H
3
O
K
a
= 10
-4
- 10
-5
RCOO
pK
a
CH
3
COOH
4.8
ClCH
2
COOH
2.9
Cl
3
CHCOOH
0.65
CH
3
CH
2
CHClCOOH
2.8
CH
3
CHClCH
2
COOH
4.06
2
C
CH
3
H
3
C
CH
2
CH
2
COOH
CH
3
NaOH
C
CH
3
H
3
C
CH
2
CH
2
COO Na + H
2
O
CH
3
4,4-dimetylopentanian sodowy
LABORATORYJNE METODY OTRZYMYWANIA
A.
Utlenianie alkoholi 1
°°°°
, aldehydów:
RCH
2
OH
[O]
[O]
RCHO
RCOOH
B.
Reakcja zw. organometalicznych z CO
2
(karboksylowanie zwi
ą
zków Grignarda):
R - MgX + C
O
O
THF
R
C
O
OMgX
R
C
O
OH
H, HOH
+ Mg(OH)X
C.
Hydroliza nitryli:
D.
Rozszczepienie alkenów/alkinów w warunkach utleniaj
ą
cych:
C
C
R
H
R'
R"
R-COOH +
O
C
R"
R'
E.
Utlenianie alkilobenzenów
:
R
[O]
COOH
F.
Synteza malonowa
COOEt
CH
2
COOEt
1. EtO Na
2. R-Cl
COOEt
CH-R
COOEt
1. NaOH
2. H
3
O, T
COOH
CH
2
-R
R-X
CN
R-CN
1. HO
2. H, HOH
RCOOH + NH
3
3
REAKCJE
Substytucja nukleofilowa do grupy karboksylowej (mechanizm addycji + eliminacji):
C
O
O
R
H
+
Nu
C
OH
Nu
R
O
C
O
R
Nu
- trudno odchodz
ą
ca grupa;
- kwasowy H
1.
Otrzymywanie halogenków kwasowych i bezwodników:
RCOOH + PBr
3
R
C
O
O
PBr
2
B
- HBr
Br
R
C
O
Br
+
HOPBr
2
R
C
O
O
H
+
C
O
Cl
R
T
C
R
O
O
C
R
O
+ HCl
zaktywowany przez Cl karbonyl ulega nawet słabemu Nu
Bezwodniki w zw. dikarboksylowych:
H
2
C
H
2
C
C
OH
OH
C
H
2
C
H
2
C
C
O
C
O
O
T
O
O
+ H
2
O
2.
Otrzymywanie estrów
R
C
O
O
H
+
R'OH
H
R
C
O
O
R'
+
H
2
O
4
R
C
O
O
H
H
R
C
OH
O
H
C
R
O
OH
OH
H
3
C
H
CH
3
OH
- H
- H
R
C
O
O
CH
3
C
R
O
OH
OH
H
3
C
H
- H
2
O
Wewn
ą
trzcz
ą
steczkowa estryfikacja:
HOCH
2
CH
2
CH
2
CH
2
C
O
OH
H
2
SO
4
H
2
C
H
2
C
C
H
2
CH
2
O
C
O
laktony
3. Otrzymywanie amidów
Aminy – Nu i B wzgl
ę
dem kwasów
Tworzenie soli – odwracalne,
∆∆∆∆
→
amidy
R
C
O
O
H
+
NH
3
R
C
NH
3
OH
O
R
C
NH
2
OH
2
O
R
C
O
NH
2
CH
3
CH
2
C
O
OH
+
(CH
3
)
2
NH
T
CH
3
CH
2
C
O
N(CH
3
)
2
laktam
Analogicznie jak hydroksykwasy.
4
. Redukcja do alkoholi
(LiAlH
4
)
R
C
O
O
H
1. LiAlH
4,
THF
2. H, H
2
O
R-CH
2
-OH
NH
2
CH
2
CH
2
CH
2
C
O
OH
T
H
2
C
H
2
C
N
H
C
H
2
C
O

5
5
.
αααα
- Bromowanie
(reakcja Hella – Volharda – Zielinskiego)
Br
2,
P (
ś
lad)
PBr
3
(
ś
lad)
PBr
3
R-H
2
C
C
O
OH
R-HC
C
O
OH
Br
NaOH
NH
3
R-HC
C
O
OH
OH
R-HC
C
O
OH
NH
2
BIOLOGICZNA AKTYWNO
ŚĆ
KWASÓW
HCOOH – feromon alarmowy
CH
3
COOH – feromon obronny, najpopularniejszy prekursor biosyntetyczny
→
kwasy tłuszczowe,
jednostka izoprenowa
3 CH
3
COOH
ENZYMY
C
H
3
C
CH
2
COOH
OH
CH
2
CH
2
OH
ENZYMY
C
H
3
C
CH
2
CH
2
CH
2
OP O
O
OH
P
OH
O
OH
Kwasy tłuszczowe
(C
12
– C
22
)
NNKT – niezb
ę
dne nienasycone kwasy tłuszczowe, np kw. oleinowy
> 90% cis C=C
CH
3
(CH
2
)
14
COOH
kwas heksadekanowy (palmitynowy), 16:0
CH
3
(CH
2
)
7
-CH=CH-(CH
2
)
7
COOH
kwas cis-oktadek-9-enowy (oleinowy), 18:1
margaryna twarda
35% KT
12% t-NKT
masło
50% KT
3 – 4% t-NKT
KT / t-NKT ?
margaryna mi
ę
kka
15% KT
5% t-NKT
Ro
ś
liny: k. oleinowy + linolowy (18:2) = 70%
Zwierzeta: k. oleinowy (50%) + k. palmitynowy = 70%
Mydła (sole sodowe kwasów tłuszczowych).Tworz
ą
micelle. Mg
+2
, Ca
+2
→
osady
POCHODNE KWASÓW KARBOKSYLOWYCH
R
C
O
X
R
C
O
OR'
R
C
O
NR'
2
R
C
N
R
C
O
O
C
O
R
halogenek
bezwodnik
ester
amid
nitryl
kwasowy
kwasowy
Niezwykle istotne w przyrodzie: zw. zapachowe, woski, tłuszcze, mocznik, białka …
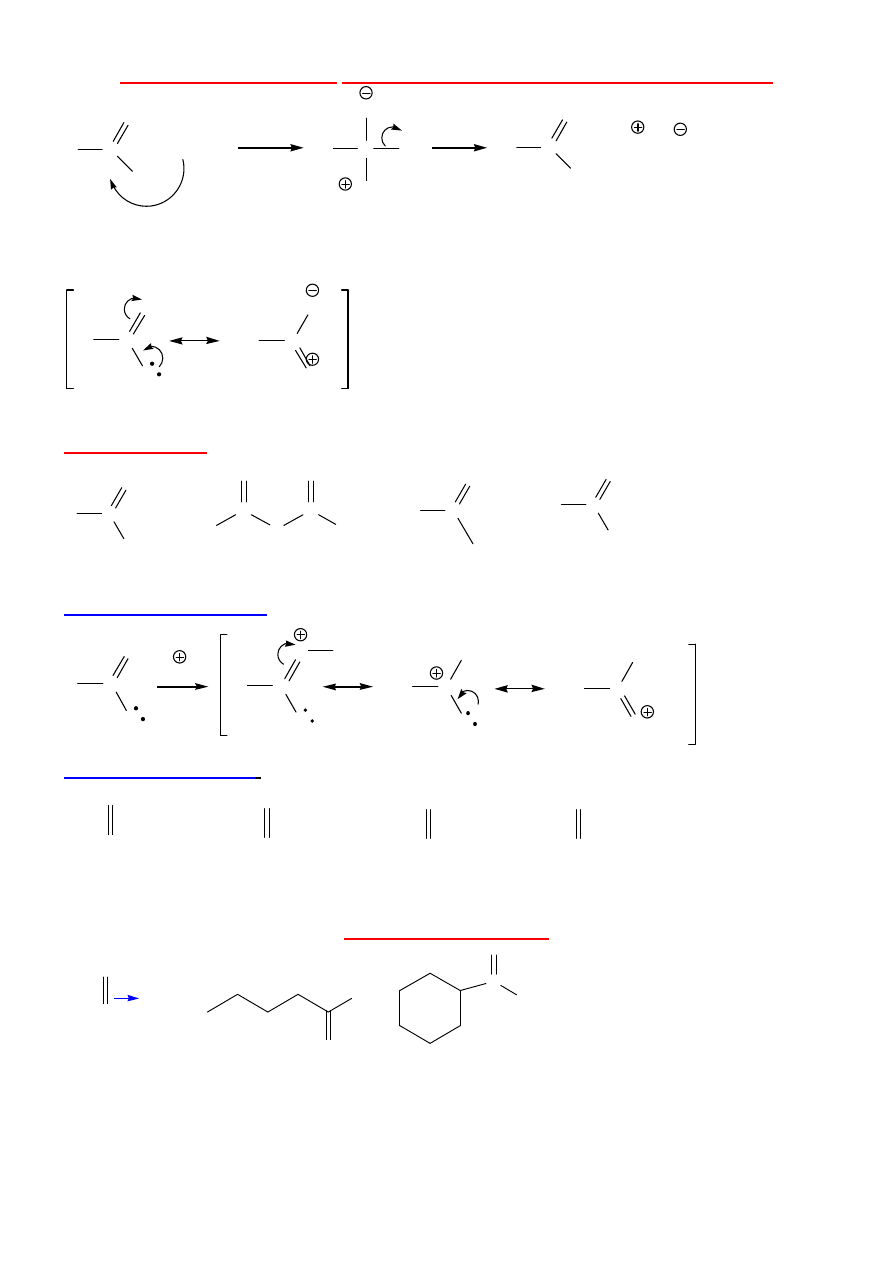
6
REAKCJA SUBSTYTUCJI W POCHODNYCH KWASÓW KARBOKSYLOWYCH
R
C
O
L
+ NuH
C
O
R
L
NuH
R
C
O
Nu
+ H + L
tetraedryczny zw. przej
ś
ciowy
Reaktywno
ść
←
jako
ść
L
R
C
O
L
R
C
O
L
Im wi
ę
kszy udział struktury polarnej, tym krótsze wi
ą
zanie C-L, dłu
ż
sze C-O
REAKTYWNO
ŚĆ
:
R
C
O
X
R
C
O
OR'
R
C
O
NR'
2
R
C
O
O
C
O
R
>
>
>
halogenki acylowe - RCOX – elektroujemno
ść
X, rozmiar orbitala p
Wła
ś
ciwo
ś
ci zasadowe:
R
C
O
L
R
C
OH
L
R
C
O
L
H
H
R
C
OH
L
Wła
ś
ciwo
ś
ci kwasowe
:
O
O
CH
3
-C-OCH
3
O
CH
3
-C-CH
3
O
CH
3
-C-Cl
<
<
<
CH
3
-C-N(CH
3
)
2
pK
a
= ~ 30
pK
a
= ~ 25
pK
a
= ~ 20
pK
a
= ~ 16
HALOGENKI ACYLOWE
O
CH
3
-C-Cl
F
O
C
O
Br
fluorek pentanoilu bromek cykloheksanokarbonylu
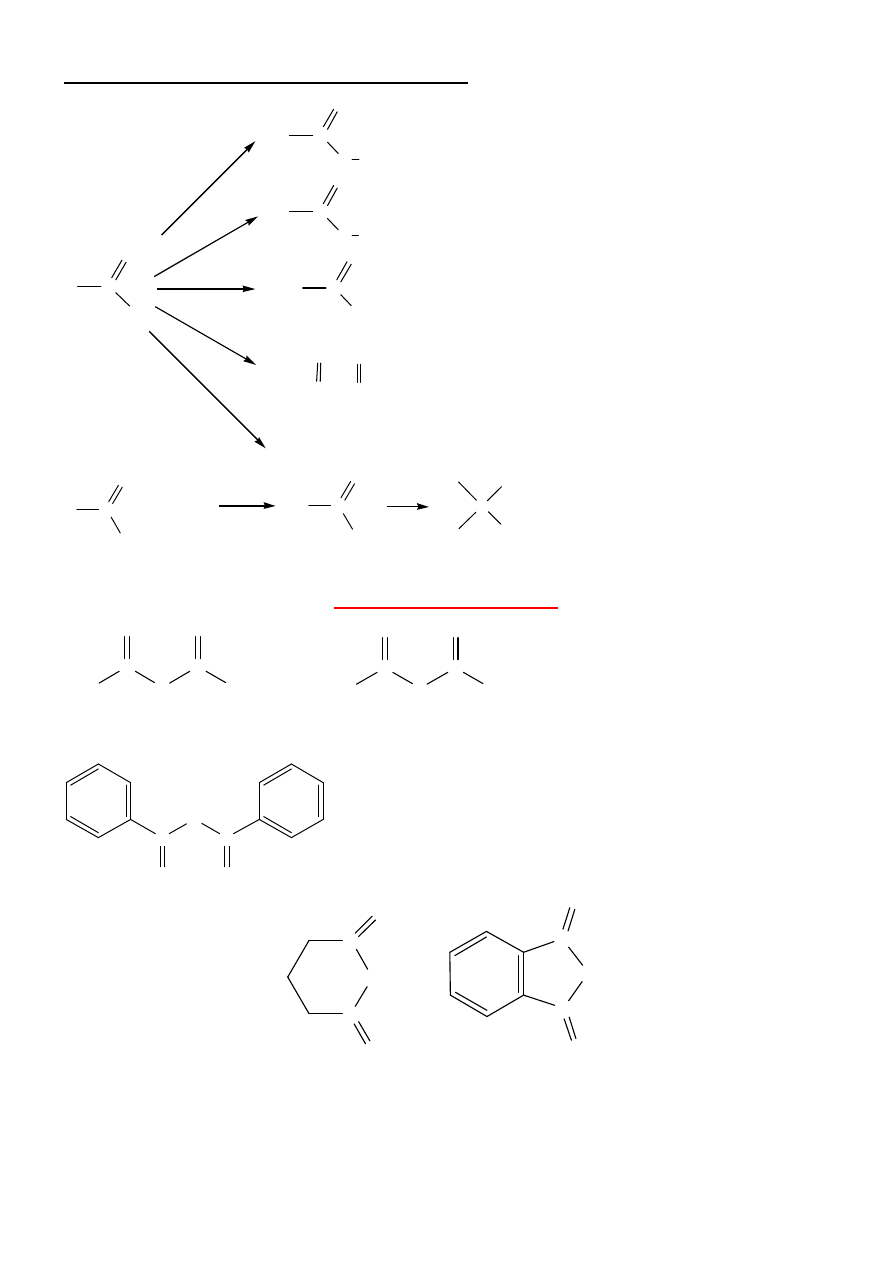
7
Reakcje substytucji w halogenkach acylowych:
R
C
O
X
R
C
O
O H
+ HX hydroliza (czesto gwaltowna)
R
C
O
O R'
+ HX estryfikacja
R
C
O
NHR'
R-C-O-C-R
O
O
+ HX
aminoliza
R-CH
2
-OH
HOH
R'OH
R'NH
2
RCOOH
NaBH
4
(LiAlH
4
)
R
C
O
X
+ R'MgX
R
C
O
R'
R'MgX
C
OH
R'
R'
R
BEZWODNIKI KWASOWE
H
3
C
C
O
O
C
O
CH
3
H
3
C
C
O
O
C
O
CH
2
CH
3
bezwodnik octowy
bezwodnik octowo-propanowy
( b. octowo-propionowy)
bezwodnik benzoesowy
bezwodnik glutarowy
bezw. ftalowy
Reaguj
ą
jak chlorki, L = RCOO
-
C
O
O
C
O
C
O
C
O
O
C
C
O
O
O
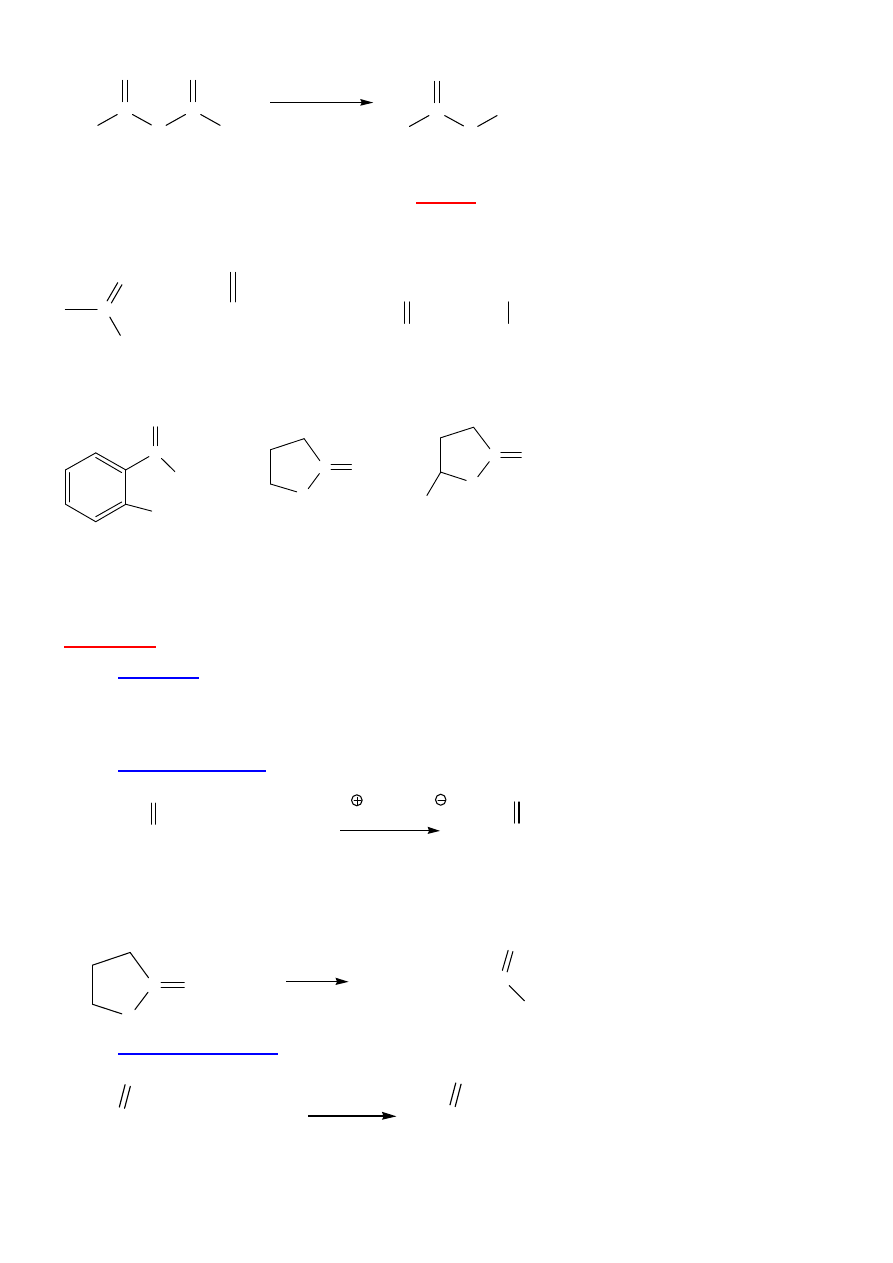
8
H
3
C
C
O
O
C
O
CH
3
C
2
H
5
OH
H
3
C
C
O
O
C
2
H
5
+ CH
3
COOH
ESTRY
Najwa
ż
niejsza klasa pochodnych kwasowych.
O
CH
3
CH
2
-C-OC
2
H
5
C
OR
O
O
CH
3
-C-OCH
2
CH
2
CHCH
3
CH
3
propanian etylu
octan 3-metylobutylu
alkoksykarbonyl
(zapach banana)
O
C
O
C
C
O
OCH
3
NH
2
O
O
H
3
C
oksa-2-cyklopentanon
5-metylooksacyklopentan-2-on
2-aminobenzoesan metylu (
γ
-butyrolakton)
(
γ
-walerolakton)
(antranilan metylu)
REAKCJE:
1.
Hydroliza
– konieczno
ść
katalizy
Katalizowana kwasowo – odwrotno
ść
estryfikacji (odwracalna)
Katalizowana zasadowo – nieodwracalna (A + E)
2. Transestryfikacja
C
17
H
35
COCH
2
CH
3
O
+ CH
3
OH
H lub CH
3
O
C
17
H
35
COCH
3
O
+ CH
3
CH
2
OH
oktadekanian etylu
laktony
→
hydroksyestry
O
C
O + ROH
HOCH
2
CH
2
CH
2
C
O
OR
+ CH
3
CH
2
OH
3. Tworzenie amidów
R-C-OCH
3
O
+ R'NH
2
T
R-C-NHR'
O
+ CH
3
OH
aminy bardziej Nu ni
ż
alkohole; bez katalizatora, skuteczniej z T
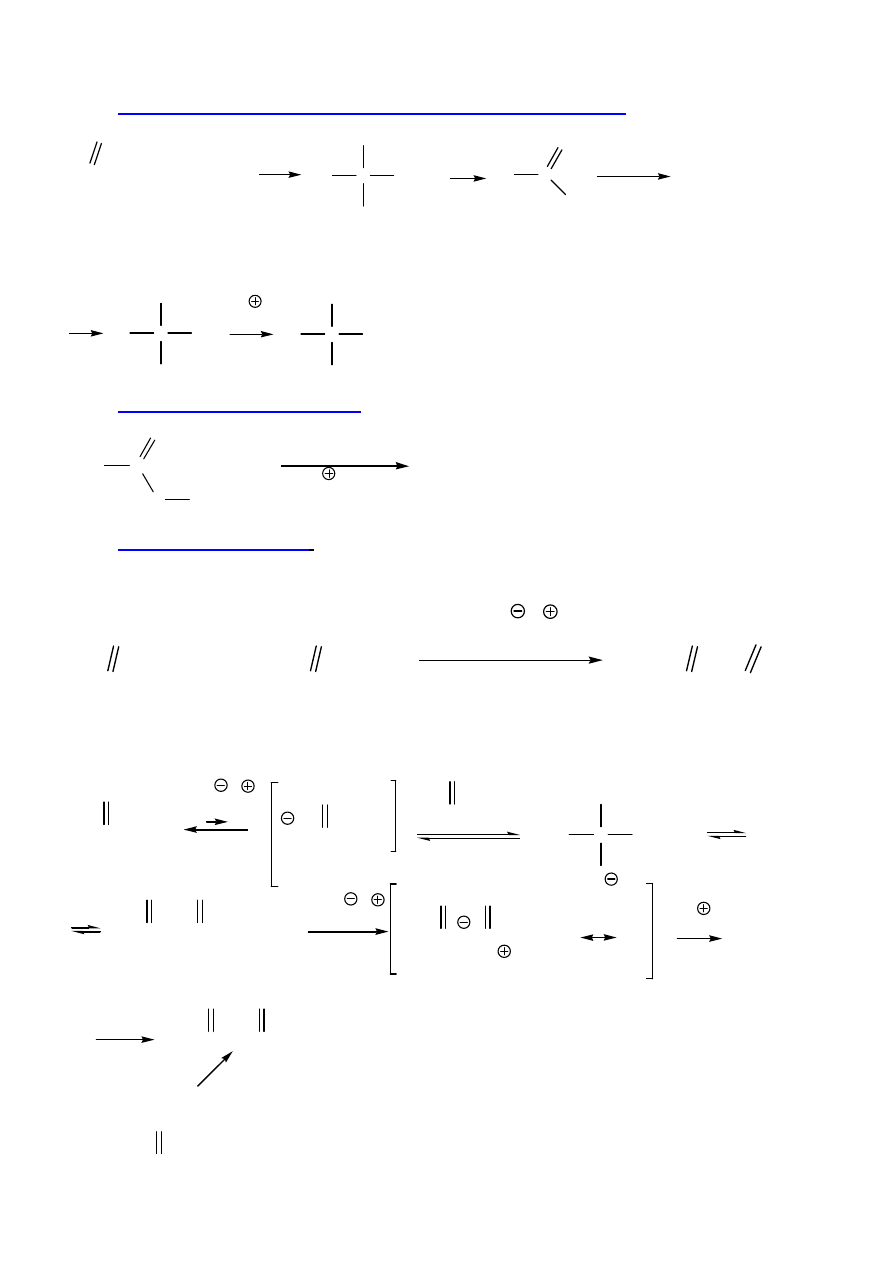
9
4. Tworzenie alkoholi przez działanie odczynnikiem Grignarda
R-C-OCH
3
O
+ R'-MgBr
C
R'
R
OCH
3
OMgBr
R
C
O
R'
R'-MgBr
C
R'
R
R'
OMgBr
H
C
R'
R
R'
OH
magnezowa sól hemiacetalu
3 alkohol
(z mrowczanu - 2 )
°
°
5. Redukcja estrów do alkoholi
R
C
O
O
CH
2
CH
3
1. LiAlH
4,
Et
2
O
2. H , H
2
O
R-CH
2
OH + CH
3
CH
2
OH
6.
Kondensacja Claisena
→
zw.
β
-dikarbonylowe
Enolany estrów ulegaj
ą
r-cji addycji-eliminacji, analogicznej do kondensacji aldolowej:
CH
3
-C-OC
2
H
5
O
CH
3
-C-OC
2
H
5
O
+
C
2
H
5
O Na
C
2
H
5
OH
CH
3
-C-CH
2
-C-
OC
2
H
5
O
O
acetylooctan etylu
CH
3
-C-OC
2
H
5
O
C
2
H
5
O Na
CH
2
-C-OC
2
H
5
O
CH
3
-C-OC
2
H
5
O
H
3
C
C
CH
2
COOC
2
H
5
OC
2
H
5
O
CH
3
-C-CH
2
-C-OC
2
H
5
O
O
C
2
H
5
O Na
CH
2
-C-CH-C-OC
2
H
5
O
O
Na
H
CH
3
-C-CH
2
-C-OC
2
H
5
O
O
pKa = 11
(CH
3
)
2
CH-C-OC
2
H
5
O
brak reakcji Claisena
10
Aniony
β
-dikarbonylowe = nukleofile
- mo
ż
na alkilowa
ć
Synteza malonowa
→
kwasy
karboksylowe
C
2
H
5
O
C
O
C
H
2
C
O
OC
2
H
5
1. C
2
H
5
O Na, C
2
H
5
OH
2. R-Br
C
2
H
5
O
C
O
CH
C
O
OC
2
H
5
R
H
HO
C
O
CH
C
O
OH
R
R-CH
2
-COOH
KWASY
3-Ketokwasy łatwo dekarboksyluj
ą
.
TIOESTRY
Transfer acylu (halogenki, bezwodniki – zbyt
aktywne).
Bardziej aktywne od estrów (RS
-
- słabsza
zasada = lepsza gr. odchodz
ą
ca), ale w
warunkach fizjologicznych nie hydrolizuj
ą
.
ESTRY W NATURZE
Lipidy:
- proste:
tłuszcze, woski;
- zło
ż
one:
fosfolipidy, glikolipidy…
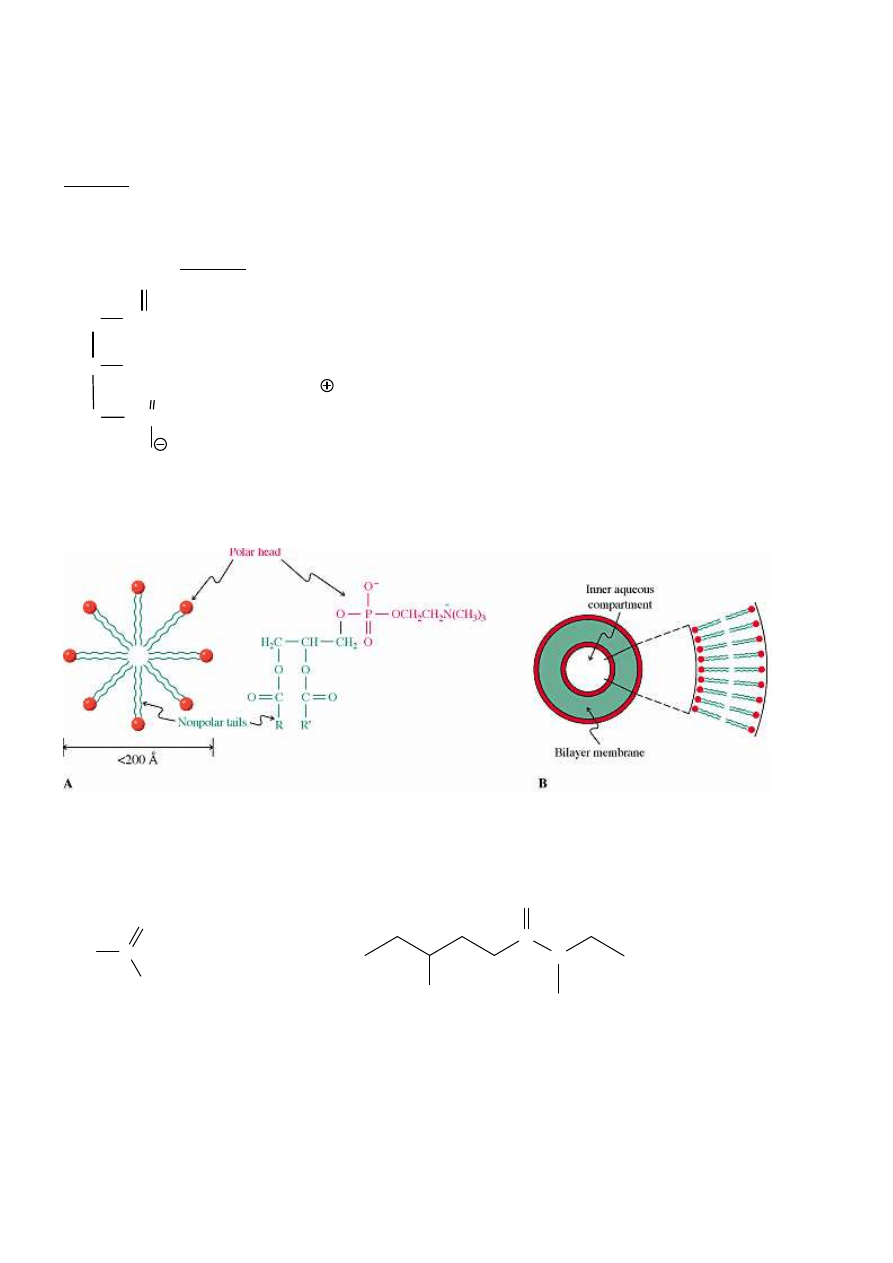
Woski
–
estry długoła
ń
cuchowych kwasów i długoła
ń
cuchowych alkoholi
CH
3
(CH
2
)
n
CO(CH
2
)
m
CH
3
O
wosk pszczeli
n = 24, 26
m = 29, 31
Wosk owczy po oczyszczeniu – lanolina
Woski zło
ż
one: estry cholesterolu, estry witaminy D czy A
Tłuszcze i oleje = triacyloglicerole (TAG) = triglicerydy
Kwasy tłuszczowe – zwykle nierozgał
ę
zione, parzysta il. at. C
Nienasycone – zwykle
cis
Rezerwy energetyczne
→
CO
2
, H
2
O
KT: palmitynowy (16:0), mirystynowy (14:0), laurowy (12:0) )
⇒
LDL, arterioskleroza
Tłuszcze strukturyzowane
– przeestryfikowane w celu wzbogacenia w NKT
czekolada
(masło kakaowe) – trigliceryd z 2 cz
ą
steczkami kwasu stearynowego(18C) i 1 cz
ą
st.
oleinowego (Z) – nie s
ą
odpowiedzialne za LDL! Dodatkowo – fenolowe antyoksydanty.
H
2
C
HC
H
2
C
OCOR
OCOR'
OCOR"
H
3
C
C
O
S
CoA
acetylokoenzym A
11
Fosfolipidy
(składniki
ś
ciany komórkowej)
Fosfoglicerydy
– glicerol zacylowany 2 cz
ą
st. KT i reszt
ą
kw. fosforowego,
który zwi
ą
zany jest z innym niskocz
ą
steczkowym alkoholem np. cholin
ą
.
lecytyny – fosfoglicerydy z cholin
ą
(fosfatydylocholiny – mózg, układ nerwowy).
Inne: fosfatydyloseryny, fosfatydyloetanoloaminy…
Jedna z lecytyn:
H
2
C
HC
H
2
C
OCR
OCOR'
O-P-OR"
R = CH
3
(CH
2
)
14
- k. palmitynowy
R' = CH
3
(CH
2
)
7
CH=CH(CH
2
)
7
- k. oleinowy
O
O
R" = (CH
3
)
3
N(CH
2
)
2
-
O
Fosfolipidy – niezb
ę
dne składniki błon komórkowych. Tworz
ą
micelle (<200Å) lub podwójn
ą
warstw
ę
lipidow
ą
AMIDY
CH
3
CH
2
CH
2
CH
2
CONH
2
pentanoamid
H
3
C
C
O
NH
2
HCONH
2
C
N
Br
O
4-bromo-N-etylo-N-metyloheksanoamid (3 )
formamid (1)
°
acetamid (1 )
°
°
12
N
H
N
S
O
CH
3
CH
3
O
COOH
H
H
RCOHN
H
γγγγ−−−−
butyro
laktam
azacyklopentan-2-on
Pokrewne grupy funkcyjne:
RHN
C
O
NHR
RHN
C
O
OH
RHN
C
O
OR'
kwas karbaminowy
karbaminian (uretan)
Biologicznie istotne – białka…
1.
Hydroliza
(silne kwasy lub silne zasady + grzanie)
NH
2
O
OH
O
+ (NH
4
)
2
SO
4
H
2
SO
4
T
Mechanizm - jak estry
CH
3
CH
2
C
O
NHCH
3
NaOH, T
CH
3
CH
2
C
O
O Na
+ NH
2
CH
3
H
CH
3
CH
2
C
O
OH
+ CH
3
NH
3
2.
Redukcja
Otrzymywanie amin:
CH
3
CH
2
CH
2
C
O
N
CH
3
CH
2
CH
2
CH
2
N
CH
2
CH
3
CH
2
CH
3
CH
3
1. LiAlH
4
2. H , H
2
O
H
3
C
Laktamy
→
aminy cykliczne
3.
Halogenowanie amidów; przegrupowanie Hofmanna
13
RCHCNH
2
O
pK
a
= ok. 30
pK
a
= ok. 22
RCH
2
CNH
2
O
RCH
2
CNH
O
amid jonu enolanowego
anion amidowy
Halogenowanie wobec zasad
→
aminy (n-1 C)
O
X
2,
NaOH
R
-
NH
2
+ CO
2
RCNH
2
O
O
OH
-H
2
O
X-X
- X
O
X
OH
O
X
- H
2
O
O=C=N-R
- X
H
2
O
HO-C-NHR
O
R
-
NH
2
+ CO
2
R
-
-C-N
RCNH
2
RCNH
RCNH
NITRYLE
R
C
N
Ten sam stopie
ń
utlenienia C, przekształcaj
ą
si
ę
w pochodne kwasowe
CH
3
CH
2
C
N
CH
3
C
N
C
N
C
N
propano
nitryl
(propionitryl)
acetonitryl
cykloheksanonitryl
(cyjanocykloheksan)
benzonitryl
REAKCJE NITRYLI:
1. Hydroliza
(kwasowa / zasadowa, T)
R
C
N
H
R
C
N
H
H
2
O
R
C
N
H
OH
2
- H
R
C
N
H
OH
H
R
C
N
H
OH
H
tautomer amidu
R
C
O
NH
2
H
H
2
O
R
C
O
OH
+ NH
4
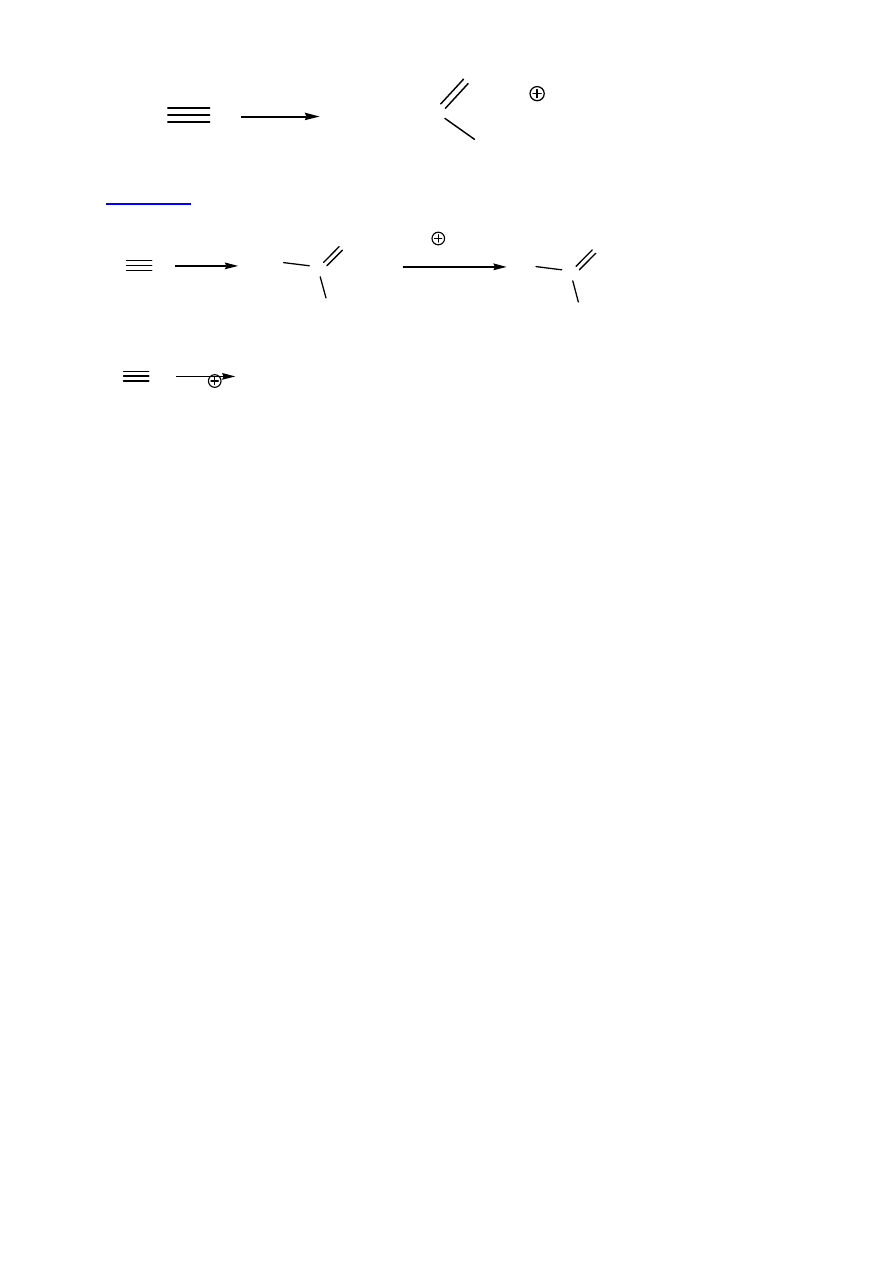
14
CH
3
(CH
2
)
4
C
N
NaOH, T
CH
3
(CH
2
)
4
C
O
ONa
+ NH
4
3. Redukcja
→
aminy (niepełna – ketony)
R-C
N
R-C
N
(iBu)
2
AlH
R
C
H
N-AlR'
2
R' = iBu
H , H
2
O
R
C
H
O
1. LiAlH
4
2. H , H
2
O
R-CH
2
NH
2
Wyszukiwarka
Podobne podstrony:
Kwasy i ich pochodne 09
Kwasy i ich pochodne polecenai, Szkoła, Biologia
Kwasy i ich pochodne polecena i odpowiedzi, Szkoła, Biologia
Kwasy i ich pochodne polecenai, Szkoła, Biologia
Kwasy karboksylowe i ich pochodne
Kwasy Karboksylowe i ich pochodne
przykładowe zadania kwasy organiczne i ich pochodne nazewnictwo
Naturalne źródła węglowodorów i ich pochodne
MAKROEKONIMA, środki gospodarcze i źródła ich pochodzenia. (22 str), Środki gospodarcze i źródła ich
7 kwasy karboksylowe&pochodne 2
Nazwy zwyczajowe grup alkilowych i acylowych oraz ważne węgowodory i ich pochodne
Charakterystyka środków gospodarczych i źródeł ich pochodzenia, Dokumenty- prawo i administracja
kosmetologia-kwasy i ich sole w kosmetyce, Kosmetologia, Chemia Kosmetyczna
7 Modele wysokości i ich pochodne Interpolacja, algebra map
więcej podobnych podstron