
Elementy fizyki statystycznej –
klasyczny gaz doskonały
Termodynamika
Część 10
Janusz Brzychczyk, Instytut Fizyki UJ
Użyteczne całki
∫
0
∞
e
−
ax
2
dx =
1
2
a
∫
−∞
∞
e
−
ax
2
dx=
a
a 0
∫
0
∞
xe
−
ax
2
dx =
1
2
a
∫
0
∞
x
2
e
−
ax
2
dx=
1
4
a
a
∫
0
∞
x
3
e
−
ax
2
dx=
1
2
a
2
∫
0
∞
x
4
e
−
ax
2
dx =
3
8
a
2
a
Klasyczny opis gazu doskonałego
Warunek stosowalności przybliżenia klasycznego:
(termiczna długość fali de Broglie'a) << (średnia odległość pomiędzy cząstkami)
=
h
2
mkT
−
1/2
≪
n
−
1/3
T – temperatura gazu
V – objętość
m – masa cząstki
N – liczba cząstek
n = N/V – średnia liczba cząstek
na jednostkę objętości

Rozkład Maxwella
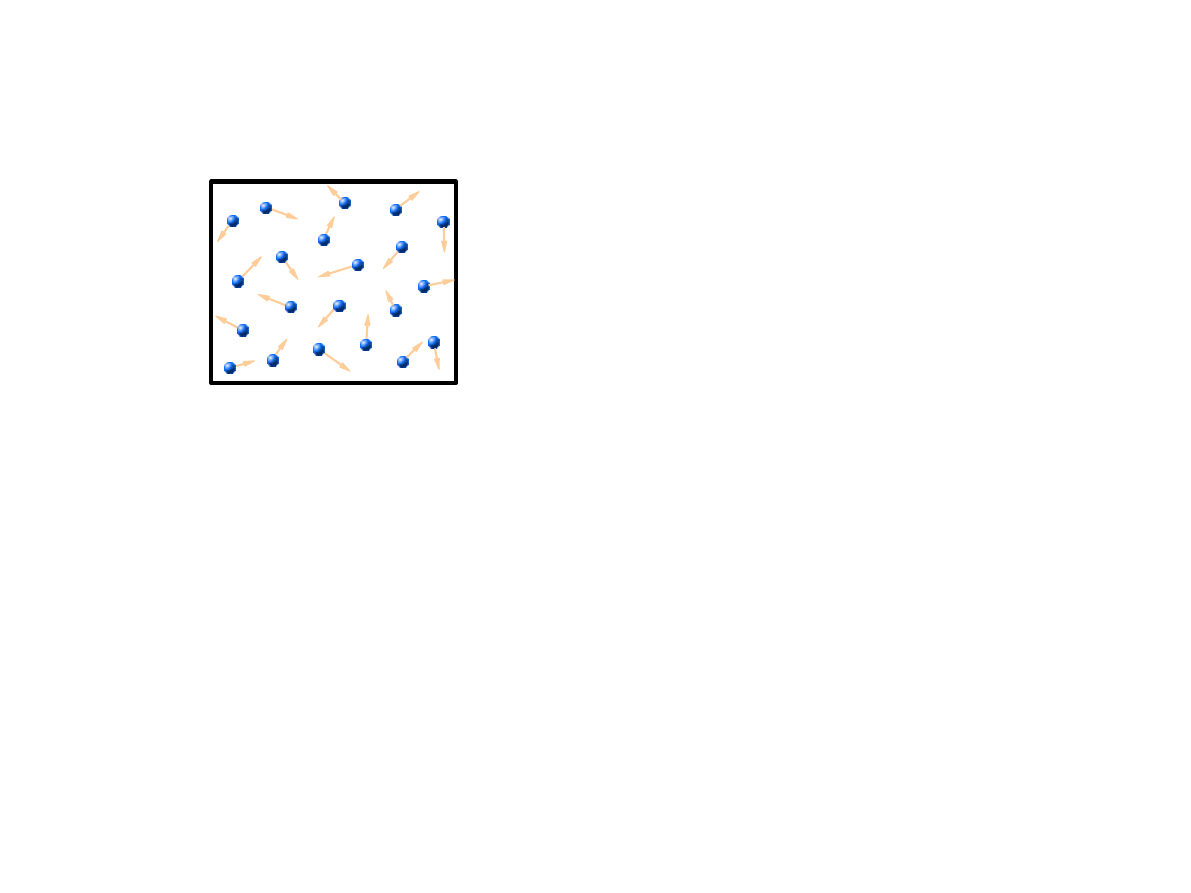
Rozważamy rozkład prędkości cząstek gazu doskonałego w przybliżeniu klasycznym.
Temperatura gazu T, masa cząstki m, średnia liczba cząstek w jednostce objętości n.
Gęstość prawdopodobieństwa, że dana cząstka ma pęd jest określona przez rozkład kanoniczny
f
p
∝
e
−
p
2
2
mkT
p = mv
f
v
=
Ce
−
mv
2
2
kT
Wartość stałej C otrzymujemy z warunku normalizacji. W rezultacie
f
v
=
m
2
kT
3/2
e
−
mv
2
2
kT
Średnia liczba cząstek na jednostkę objętości, które mają prędkość zawartą w przedziale
[
v , vdv
]
n
v
d
3
v = n f
v
d
3
v
Prawdopodobieństwo, że cząstka ma prędkość zawartą w przedziale jest równe
[
v , vdv
]
f
v
d
3
v.
p
Ponieważ
Rozkład Maxwella
Rozkład jednej ze składowych prędkości
Gęstość prawdopodobieństwa, że cząstka ma składową prędkości v
x
g
v
x
=
∫
−∞
∞
∫
−∞
∞
f
v
x
,v
y
,v
z
dv
y
dv
z
=
m
2
kT
3/2
∫
−∞
∞
∫
−∞
∞
e
−
m
2
kT
v
x
2
v
y
2
v
z
2
dv
y
dv
z
g
v
x
=
m
2
kT
1/2
e
−
mv
x
2
2
kT
Jest to rozkład Gaussa o wartości średniej oraz odchyleniu standardowym
v
x
=
0
=
kT
m
.

Rozkład Maxwella
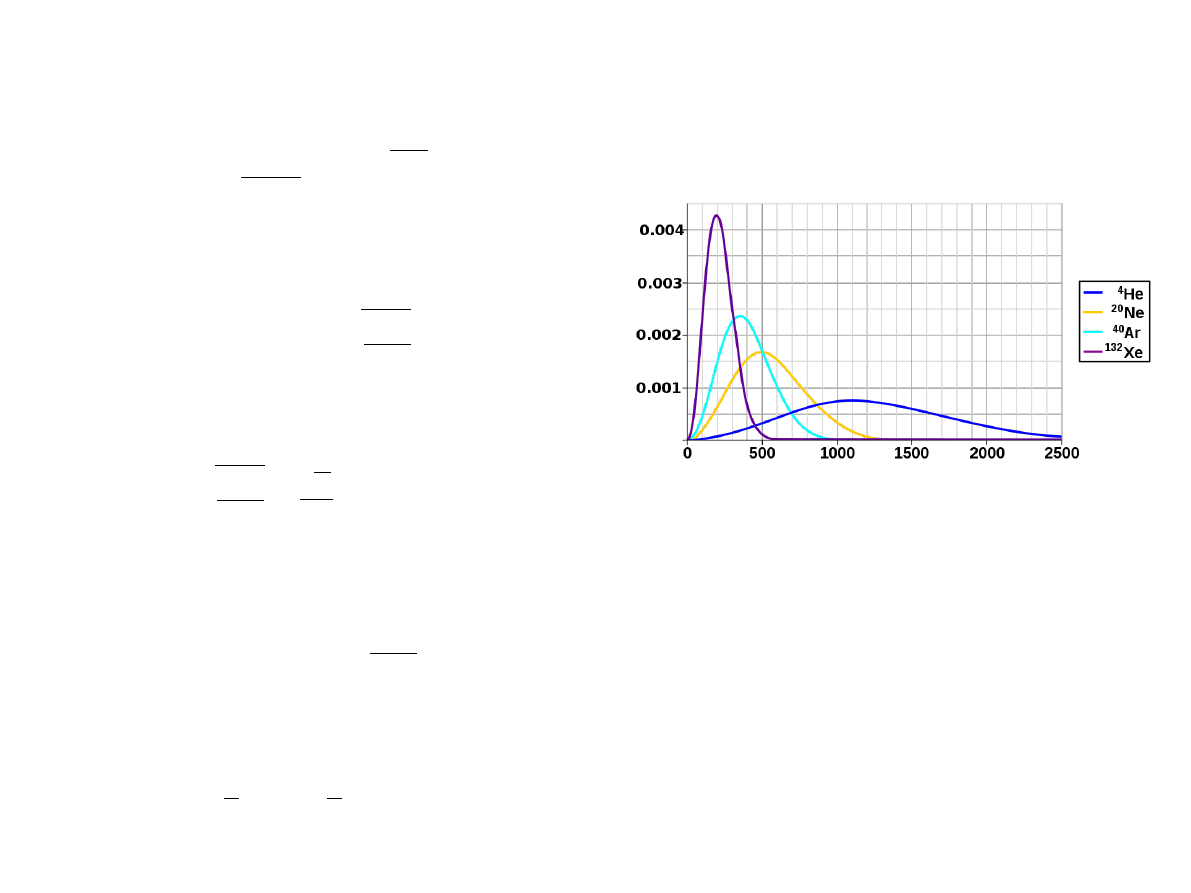
Rozkład szybkości cząstek
f
v
=
4
v
2
f
v
Gęstość prawdopodobieństwa, że cząstka porusza się z szybkością w dowolnym kierunku
otrzymamy całkując po wszystkich kierunkach wektora prędkości. Ponieważ nie zależy
od kierunku, wystarczy pomnożyć przez pole powierzchni sfery o promieniu
f
v
f
v
f
v
v =
∣
v
∣
v
f
v
=
4
m
2
kT
3/2
v
2
e
−
mv
2
2
kT
Prawdopodobieństwo, że cząstka ma szybkość w przedziale
[
v
1
, v
2
]
P
v
1
,v
2
=
∫
v
1
v
2
f
v
dv
Gęstość prawdopodobieństwa, że cząstka ma energię kinetyczną E
f
E
=
f
v
dv
dE
dE =
2
kT
3/2
E e
−
E
kT
f
v
=
4
m
2
kT
3/2
v
2
e
−
mv
2
2
kT
Własności rozkładu szybkości cząstek
f
v
v
[
m/ s
]
Wikipedia
Wartość średnia
v =
∫
0
∞
v f
v
dv =
8
kT
m
Wartość najbardziej prawdopodobna
v =
2
kT
m
=
2
v
Średnia wartość kwadratu prędkości
v
2
=
∫
0
∞
v
2
f
v
dv =
3
kT
m
Średnia energia kinetyczna cząstki
E =
1
2
m
v
2
=
3
2
kT
T =25
o
C
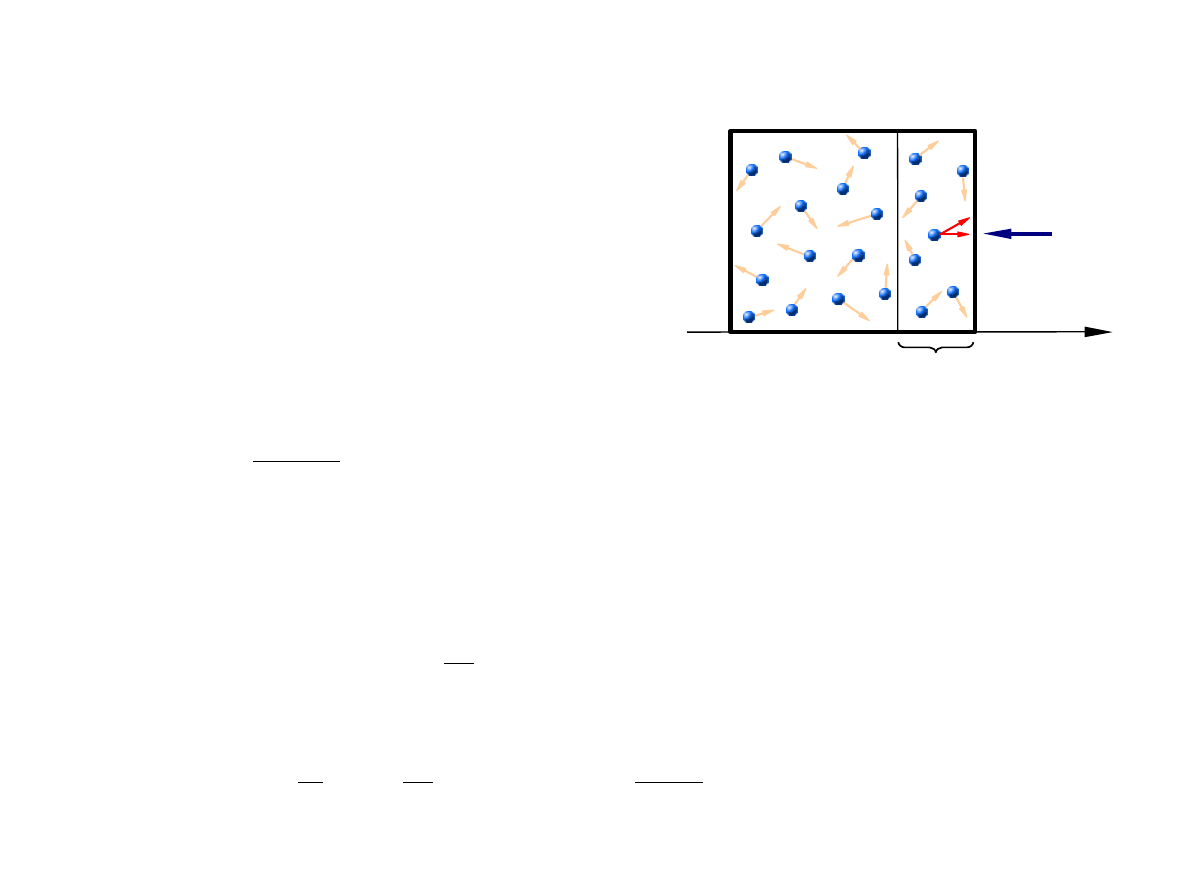
Ciśnienie
x
v
v
x
v
x
t
A –
powierzchnia
ściany
Średnia liczba cząstek, których składowa x prędkości, v
x
,
ma wartość zawartą w przedziale [v
x
, v
x
+
dv
x
]
N
v
x
dv
x
=
N g
v
x
dv
x
Z tej liczby, tylko te cząstki uderzą w ścianę w przeciągu
czasu
t, których odległość od ściany jest mniejsza niż
v
x
t, czyli cząstki znajdujące się w objętości Av
x
t.
Liczba ta wynosi
Av
x
t
V
N g
v
x
dv
x
Po zderzeniu ze ścianą zmiana pędu cząstki wynosi 2
mv
x
, zatem całkowita zmiana pędu wszystkich
cząstek zderzających się ze ścianą w przedziale czasu
t, równa zgodnie z III zasadą dynamiki
Newtona wartości F
t, wynosi
F = p A
p =
F
A
=
2
m
N
V
∫
0
∞
v
x
2
g
v
x
dv
x
=
N kT
V
stąd ciśnienie gazu
F t = 2m A t
N
V
∫
0
∞
v
x
2
g
v
x
dv
x
(
równanie stanu
)

Termodynamika gazu doskonałego
Kanoniczna funkcja rozdziału dla jednej cząstki
Z
1
=
1
h
3
∭
dx
dydz
∭
e
−
p
x
2
p
y
2
p
z
2
2
mkT
dp
x
dp
y
dp
z
Z
1
=
V
h
3
∫
−∞
∞
e
−
p
x
2
2
mkT
dp
x
∫
−∞
∞
e
−
p
y
2
2
mkT
dp
y
∫
−∞
∞
e
−
p
z
2
2
mkT
dp
z
=
V
h
3
2
mkT
3
Z
1
=
V
2
mkT
h
2
3/2
=
V
3
Funkcja rozdziału dla N cząstek rozróżnialnych:
Z
N
=
Z
1
N
.
Dla cząstek nierozróżnialnych
Z
N
=
Z
1
N
N!
=
V
N
N!
2
mkT
h
2
3
N /2

Termodynamika gazu doskonałego
ln
Z
N
=
N lnV
3
N
2
ln
kT
−
ln
N!
3
N
2
ln
2
m
h
2
p = kT
∂
ln
Z
N
∂
V
T ,N
=
N kT
V
równanie stanu
.
Ciśnienie gazu
Używając przybliżenia Stirlinga: otrzymujemy
ln
N! ≃ N ln N − N
F = − kT ln Z
N
= −
NkT
[
ln V
N
3
2
ln
2
m kT
h
2
1
]
S = −
∂
F
∂
T
V , N
=
Nk
[
ln V
N
3
2
ln
2
m kT
h
2
5
2
]
U = kT
2
∂
ln
Z
N
∂
T
V , N
=
3
2
NkT
=
∂
F
∂
N
T ,V
= −
kT
ln
[
V
N
2
mkT
h
2
3
2
]
Gaz doskonały w polu sił zewnętrznych
Całkowita energia cząstki
E
r ,p
=
E
kin
p
E
pot
r
Gęstość prawdopodobieństwa, że cząstka ma dany pęd i położenie
q
r , p
∝
e
−
E
kin
p
kT
e
−
E
pot
r
kT
Rozkłady gęstości prawdopodobieństwa dla pędu i położenia są niezależne.
Dla pędu
f
p
∝
e
−
p
2
2
mkT
– rozkład Maxwella
Dla położeń
f
r
∝
e
−
E
pot
r
kT
Zatem koncentracja cząstek (średnia liczba cząstek na jednostkę objętości) zależy od
położenia według zależności
n
r
∝
e
−
E
pot
r
kT

Gaz doskonały w jednorodnym polu grawitacyjnym
E
pot
x , y, z
=
m g z
Rozważamy gaz w pobliżu powierzchni Ziemi
gdzie z oznacza wysokość na której znajduje się cząstka, a g jest przyspieszeniem ziemskim.
n
z
∝
e
−
mgz
kT
Koncentracja cząstek na wysokości z
Z równania stanu gazu doskonałego
p
z
=
n
z
kT
zatem zależność ciśnienia gazu od wysokości
p
z
=
p
0
e
−
mgz
kT
gdzie p
0
oznacza ciśnienie na wysokości z = 0.
Dla małych wysokości
wzór barometryczny
p
z
=
p
0
e
−
mgz
kT
≃
p
0
1−
mg
kT
z
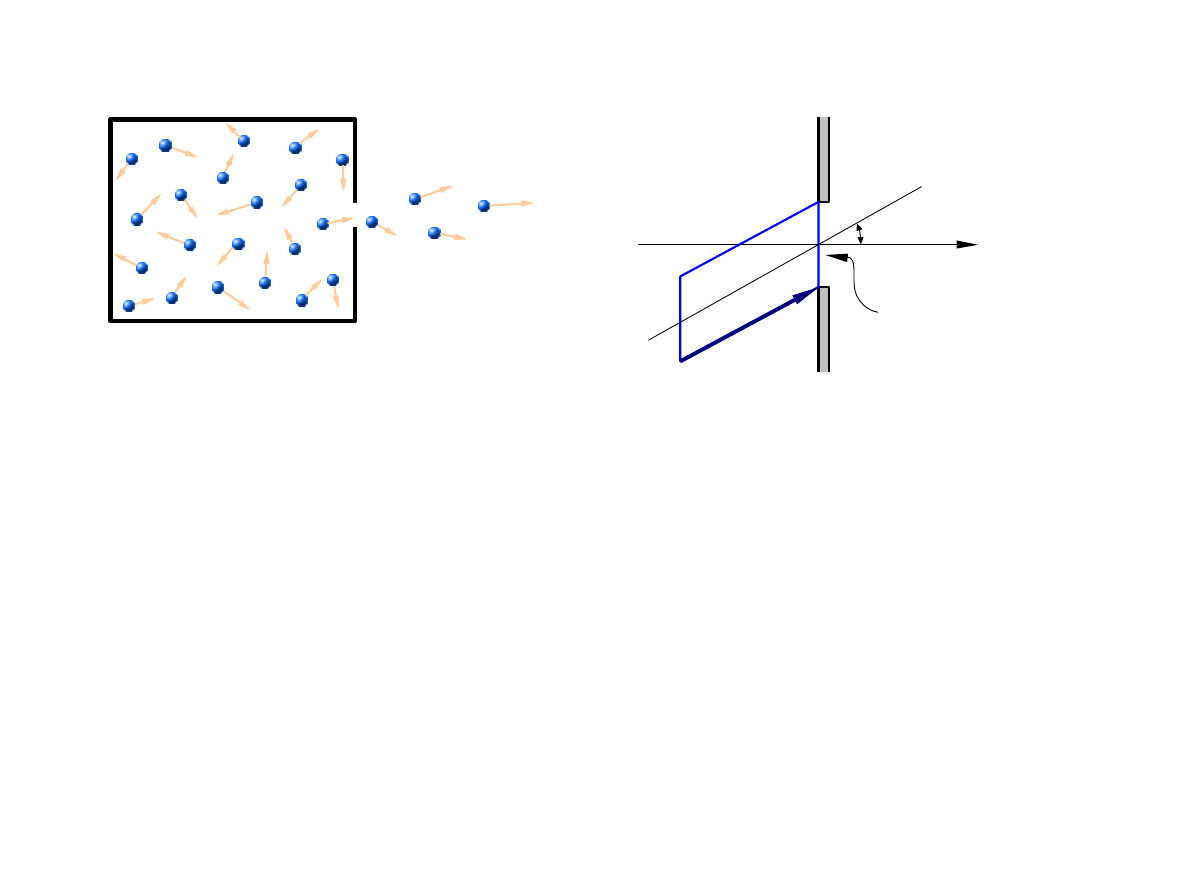
Efuzja
T – temperatura gazu
n – średnia liczba cząstek
na jednostkę objętości
Cząsteczki o prędkościach z przedziału trafią na otwór w ciągu czasu
t jeżeli będą się
znajdować w „pochyłym” walcu o podstawie
A i wysokości
v ,vdv
z
v t
A −
powierzchnia
otworu
v t cos.
Liczba tych cząstek wynosi
J
v
d
3
v = n A v t cos f
v
d
3
v
Dla jednostkowej powierzchni
A i jednostkowego czasu
t
J
v
d
3
v = n f
v
v cos d
3
v
gdzie jest rozkładem prędkości Maxwella.
f
v
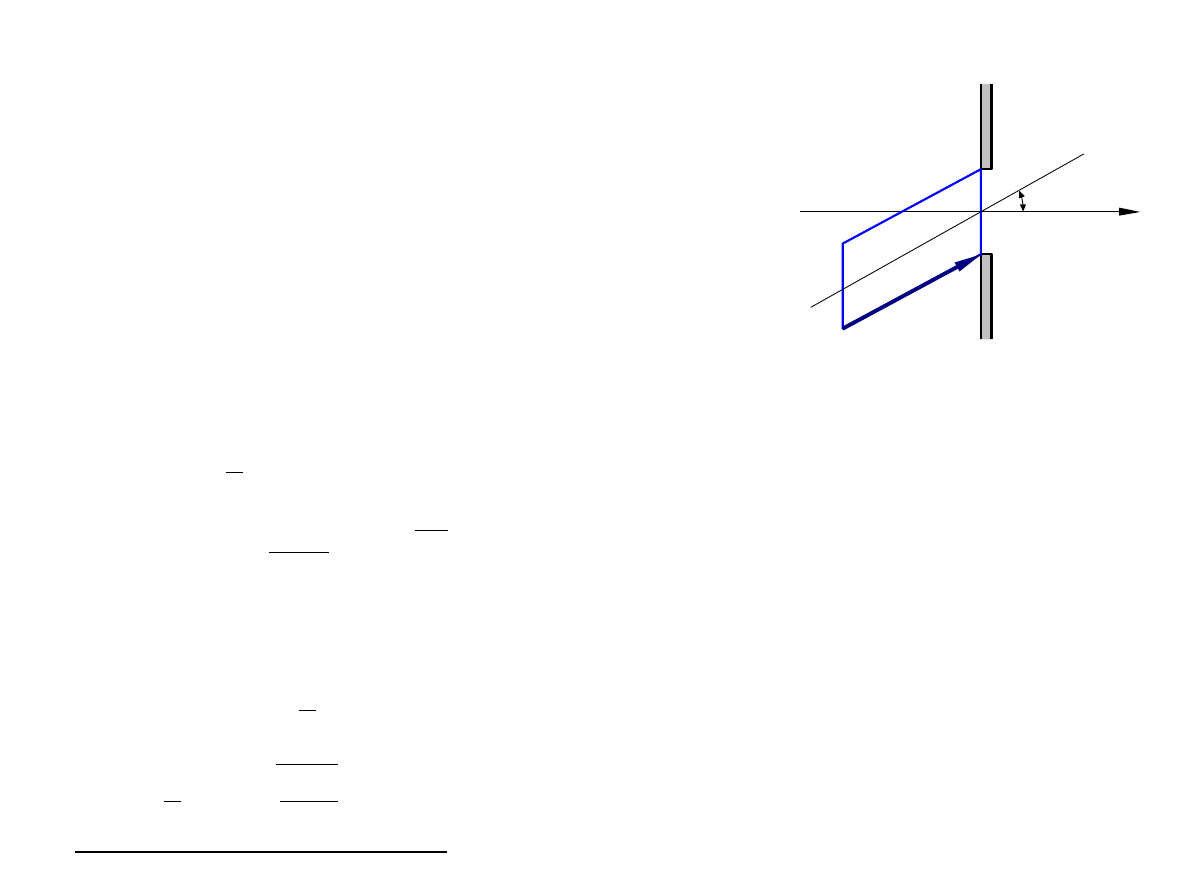
Efuzja
z
v t
J
v
d
3
v = n f
v
v cos d
3
v = n f
v
v cos v
2
sin
dvdd
Przechodzimy ze współrzędnych kartezjańskich do sferycznych
Całkując po wszystkich możliwych kierunkach wektora prędkości
otrzymujemy rozkład szybkości cząstek w wiązce
J
v
dv = 2
∫
0
1
sin
d
sin
nv
3
f
v
dv = nv
3
f
v
dv
J
v
dv =
∫
0
2
d
∫
0
/
2
sincos
d nv
3
f
v
dv
J
v
dv =
1
4
nv f
v
dv
J
v
dv = n
m
2
kT
3/2
v
3
e
−
mv
2
2
kT
dv
Średnia liczba cząstek gazu wydostających się przez otwór o jednostkowej powierzchni w ciągu jednostki
czasu wynosi
J =
∫
0
∞
J
v
dv =
1
4
n
∫
0
∞
v f
v
dv
J =
1
4
nv = n
kT
2
m
Wyszukiwarka
Podobne podstrony:
58 MT 10 Przystawka UKF
03 Czy Mt 10
58 MT 10 Rolkaseta
58 MT 10 Podstawka lutownicy
63 MT 10 Szafka biurko
61 MT 10 Prasa srubowa
64 MT 10 Półka do szczotek
58 MT 10 Wodna waga
56 MT 10 Film rysunkowy
MT 10 2004 Nobel z matematyki
58 MT 10 Pantograf
W-4 MT w, W Y K Ł A D 10
59 MT 10 Warsztatowa lamiglowka
58 MT 10 Przystawka UKF
03 Czy Mt 10
58 MT 10 Rolkaseta
58 MT 10 Podstawka lutownicy
63 MT 10 Szafka biurko
58 MT 10 Gitara elektryczna
więcej podobnych podstron