WYKŁAD TRZECI
Prawo okresowości – Dymitr Mendelejew 1869r. ( Johann
Döbereiner, John Newlands, Lothar Meyer).
W szeregu pierwiastków, uporządkowanych według rosnących
wartości liczb atomowych, właściwości chemiczne i fizyczne
zmieniają się w sposób okresowy (ujęcie makroskopowe).
W szeregu pierwiastków, uporządkowanych według rosnących
wartości liczb atomowych, konfiguracje elektronów walencyjnych
zmieniają się w sposób okresowy (ujęcie mikroskopowe).
Prawo okresowości oraz jego wyrażenie w postaci tablicy układu
okresowego stanowi klucz do wyjaśnienia podstawowej organizacji
materii.
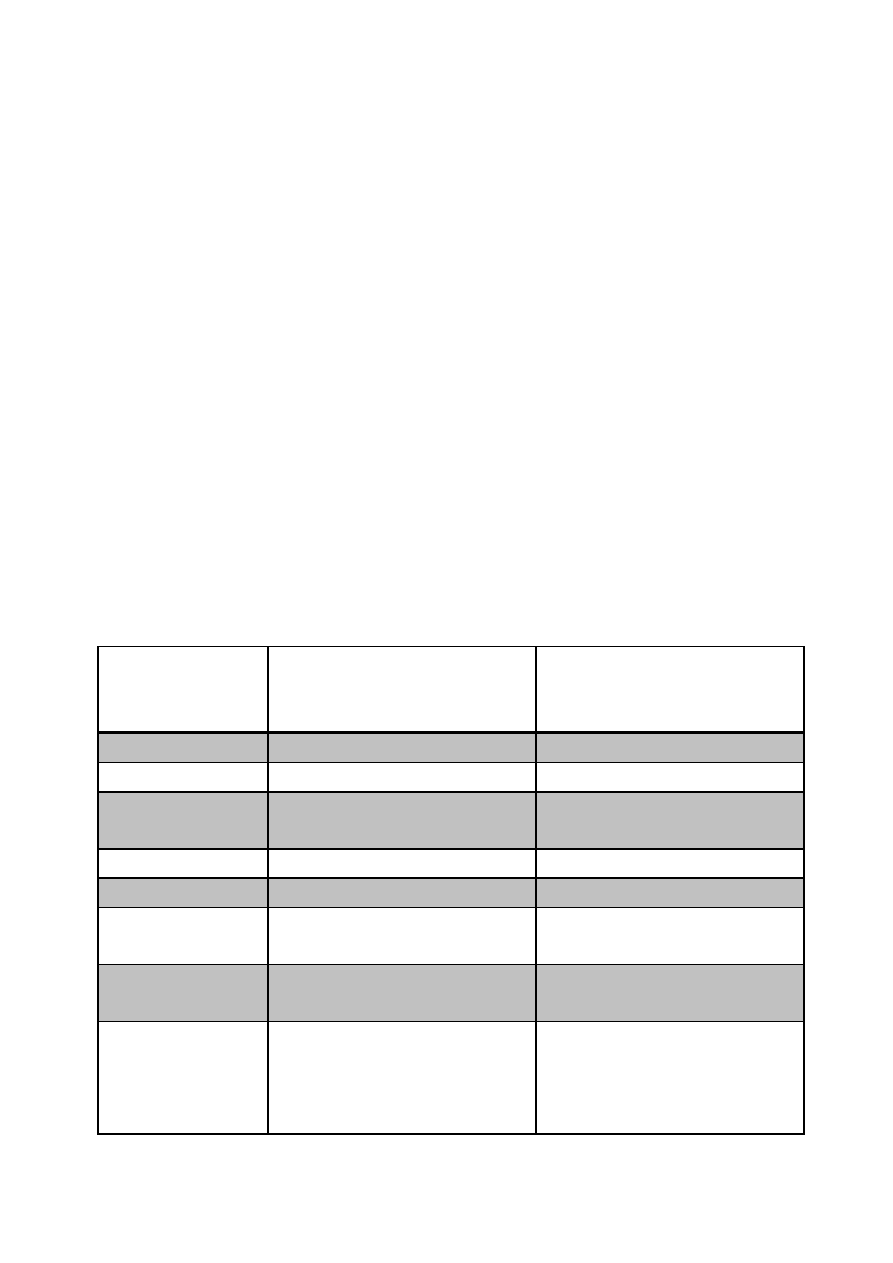
Przewidywane przez Mendelejewa właściwości eka-krzemu
Właściwość
Eka-krzem Es (1871r.)
Dymitr Mendelejew
przewidywanie
German Ge (1886r.)
Clemens Winkler odkrycie
Masa atomowa
ok. 72
72,6
Gęstość [g/cm
3
]
5,5
5,32
Temperatura
topnienia [ºC]
wysoka
937
Barwa
ciemnoszara
Szara
Otrzymywanie
w reakcji K
2
EsF
6
z sodem
w reakcji K
2
GeF
6
z sodem
Tlenek
EsO
2
; biały amfoteryczny,
d=4,7 g/cm
3
GeO
2
; biały amfoteryczny,
d=4,23 g/cm
3
Chlorek
EsCl
4
; wrze poniżej 100 ºC,
d=1,9 g/cm
3
Ge Cl
4
; wrze w 84 ºC, d=1,84
g/cm
3
Reakcje
z
kwasami
i
zasadami
Es będzie słabo
rozpuszczalny w kwasach
(np. HCl) i odporny na
alkalia (np. NaOH)
Ge nie rozpuszcza się w HCl
ani NaOH ale rozpuszcza się
w stężonym HNO
3

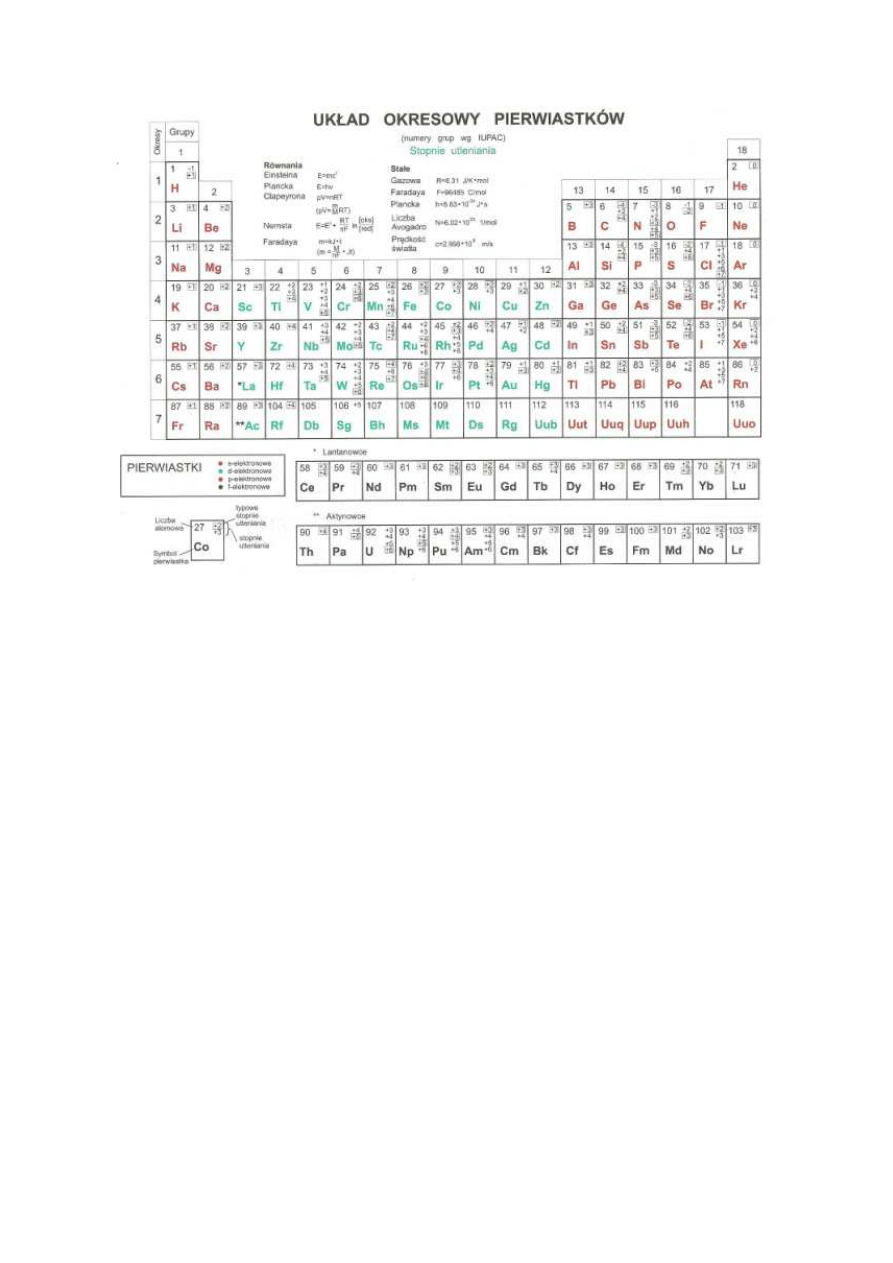
Grupy i bloki w układzie okresowym
Blok s obejmuje pierwiastki grup 1 i 2 (IA i IIA). W grupach tych
zewnętrzne (walencyjne) elektrony są na orbitalach s.
Blok p obejmuje pierwiastki grup 13 - 18 (IIIA – VIIIA). W grupach
tych rozbudowa zewnętrznych powłok następuje przez umieszczanie
nowych elektronów na orbitalach p. Dlatego do bloku p należy sześć
grup pierwiastków.
Blok d obejmuje pierwiastki grup 3 – 12 (IB – VIIIB). Leżą one
między pierwiastkami bloków s i p. Cechą charakterystyczną
pierwiastków z bloku d jest rozbudowa podpowłok d do 10 elektronów.
Blok d obejmuje 10 grup pierwiastków. Pierwiastki bloku d są
nazywane pierwiastkami przejściowymi, ponieważ w układzie
okresowym są jakby pomostem między blokami s i p.
Pierwiastki bloku f odznaczają się rozbudową podpowłok f do 14
elektronów. Pierwiastki te występują w okresach 6 i 7. Ze względów
praktycznych na rysunkach układu okresowego pierwiastki bloku f
umieszcza się osobno a nie w okresach, do których należą.

Atomy wszystkich pierwiastków tego samego okresu wykazują tę
samą liczbę głównych poziomów energetycznych (powłok
elektronowych), częściowo lub całkowicie obsadzonych elektronami.
Atomy wszystkich pierwiastków tej samej grupy mają tę samą liczbę
elektronów walencyjnych, czyli zewnętrznych (są to elektrony na
najwyższym poziomie energetycznym).
Numer okresu jest równy:
•
liczbie powłok elektronowych,
•
numerowi walencyjnej powłoki elektronowej,
•
liczbie głównych poziomów energetycznych,
•
numerowi najwyższego poziomu energetycznego,
•
głównej liczbie kwantowej.
Numer grupy głównej jest równy:
•
liczbie elektronów walencyjnych (zewnętrznych),
•
liczbie
elektronów
na
najwyższym
głównym
poziomie
energetycznym.
Zapełnianie elektronami podpowłok elektronowych w kolejnych okresach:
1 okres
1s
2 pierwiastki w okresie
2 okres
2s
2p
8 pierwiastków w okresie
3 okres
3s
3p
8 pierwiastków w okresie
4 okres
4s
3d
4p
18 pierwiastków w okresie
5 okres
5s
4d
5p
18 pierwiastków w okresie
6 okres
6s
4f
5d
6p
32 pierwiastki w okresie
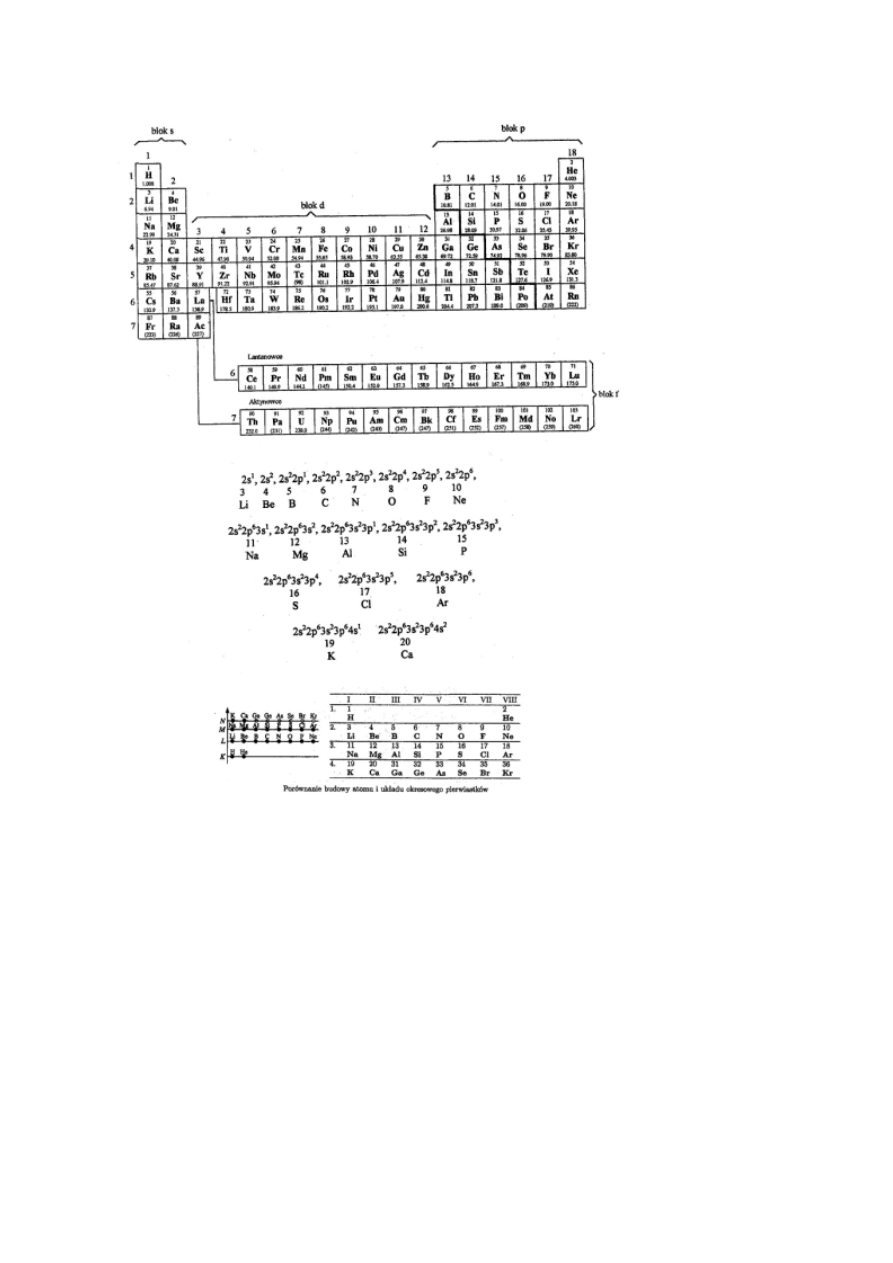
Zmienność własności pierwiastków w układzie okresowym (relacje
poziome, pionowe i diagonalne).
•
Rozmiary atomów maleją w okresach, co wiąże się ze wzrostem
ładunku jądra. Elektrony walencyjne są silniej związane, wzrasta
energia jonizacji, słabnie metaliczny charakter pierwiastków i ich
tlenki stają się mniej zasadowe (Na
2
O – silnie zasadowy; Al
2
O
3
–
amfoteryczny; SO
2
– kwasowy)
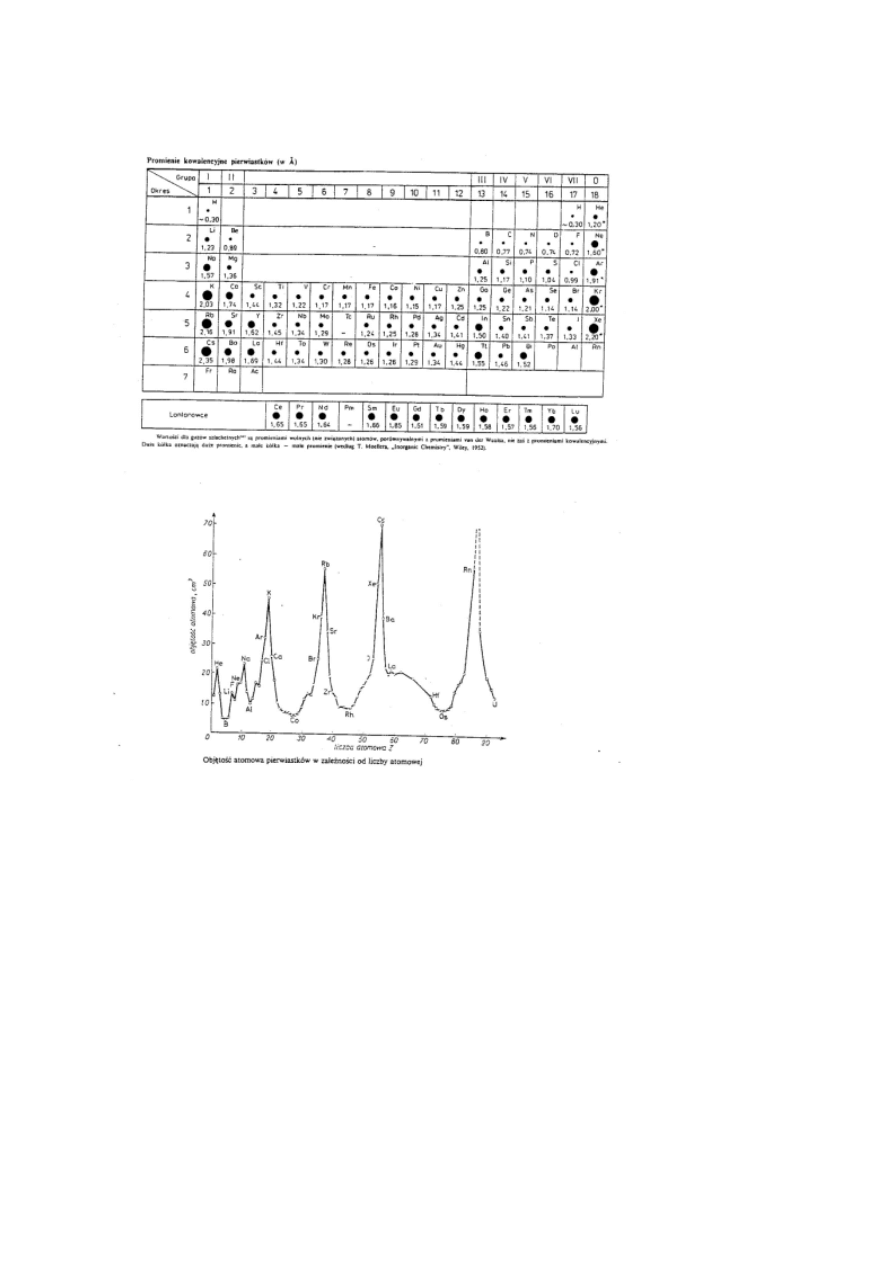
Objętość atomowa to stosunek masy molowej pierwiastka do jego
gęstości. Jest to objętość jaką zajmuje 1 mol pierwiastka.
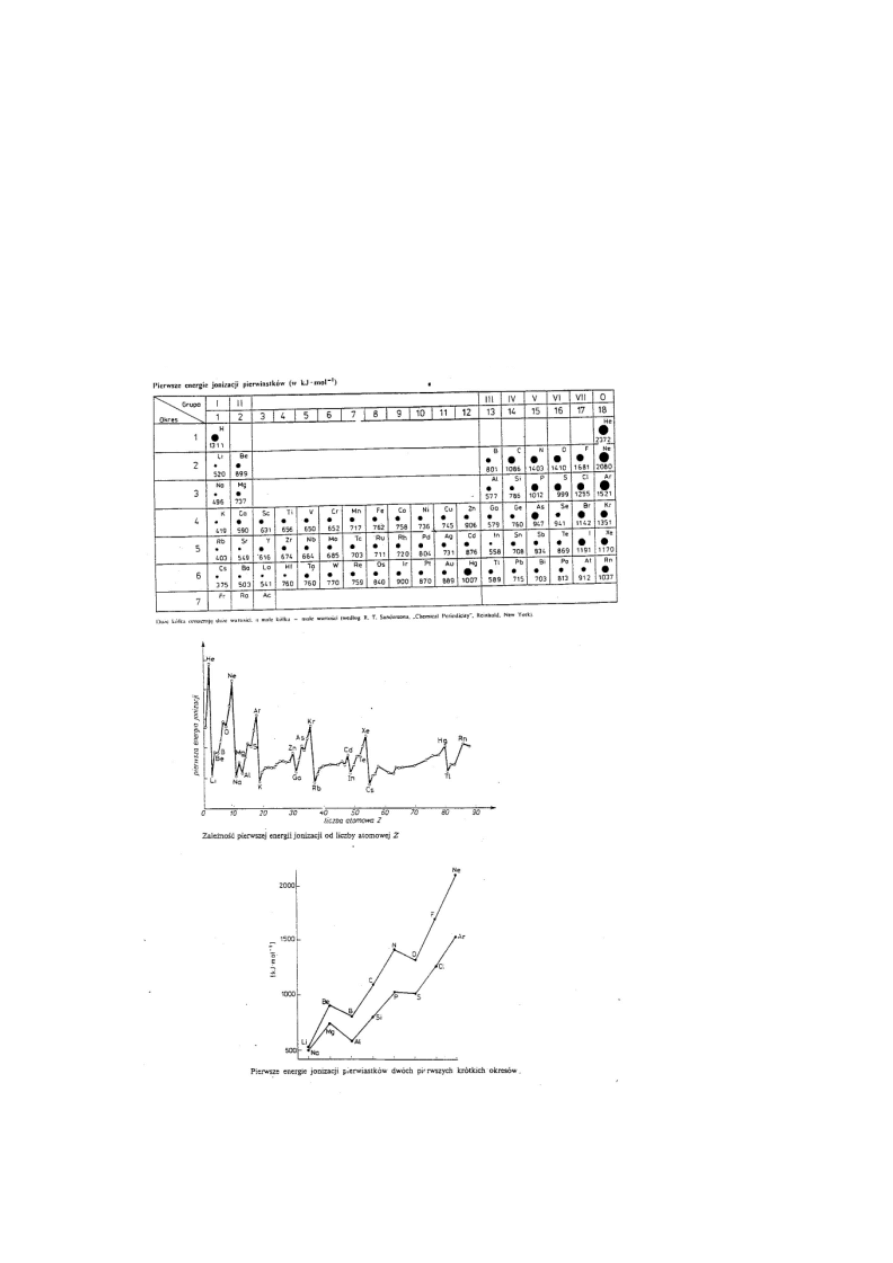
•
Pierwsze energie jonizacji rosną w ramach okresu a maleją w
grupach. Energia jonizacji to energia potrzebna do oderwania
elektronu od atomu, co powoduje powstanie kationu:
np. Li +
E
j
→ Li
+
+ e
-
•
Powinowactwo elektronowe to energia uwalniana w momencie
przyjęcia elektronu przez atom: np. F + e
-
→ F
-
+
E
p
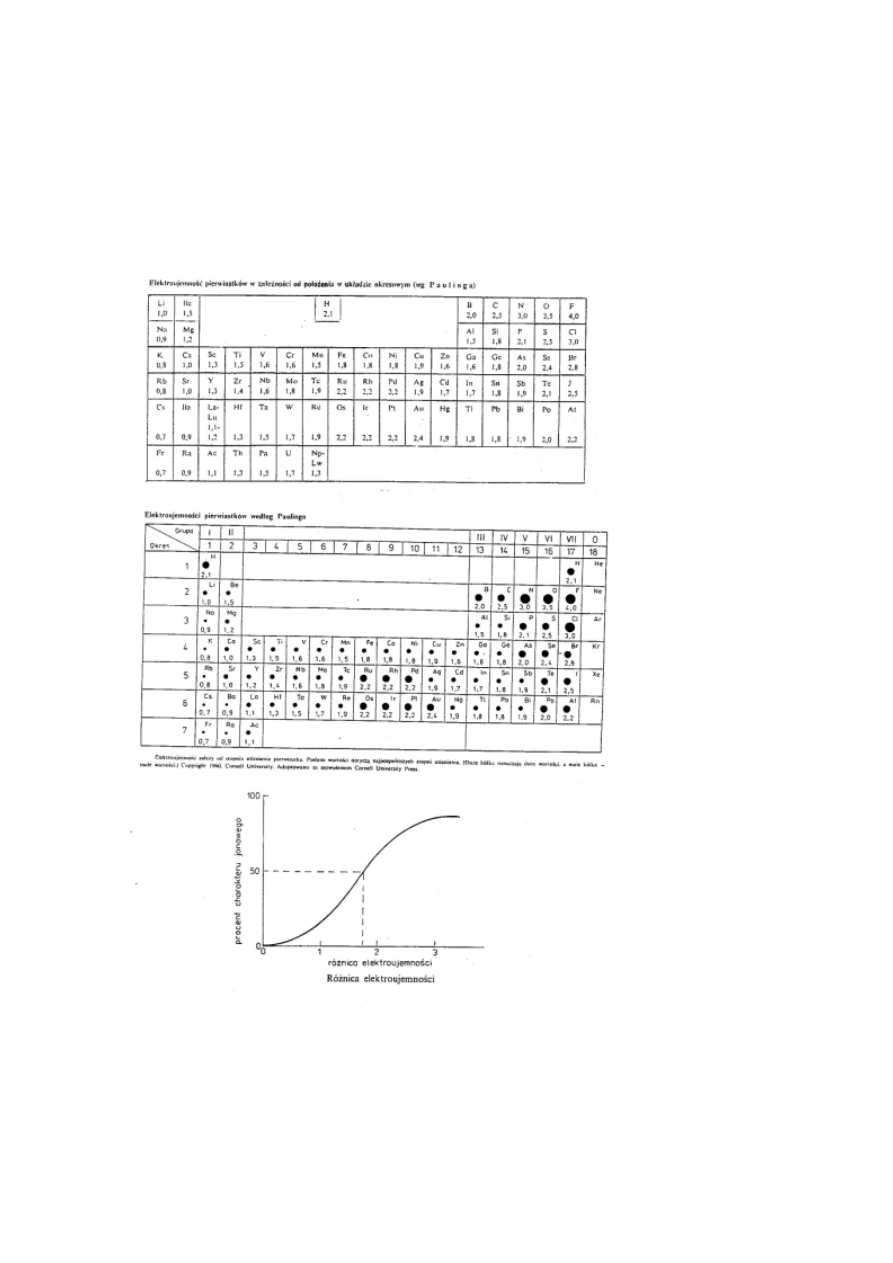
•
Elektroujemność jest miarą siły przyciągania elektronów
tworzących wiązanie w cząsteczce przez atomy danego
pierwiastka.
•
Wartościowość to zdolność atomu do tworzenia wiązań, równa
liczbie utworzonych przez ten atom wiązań. Wartościowość
pierwiastka w każdej z grup głównych jest równa albo numerowi
grupy, albo liczbie otrzymanej przez odjęcie numeru grupy od
ośmiu. Numer grupy głównej wskazuje na największą możliwą
wartościowość pierwiastka.
grupa główna
I
II
III
IV
V
VI
VII
największa wartościowość 1
2
3
4
5
6
7
inne wartościowości
2
3
4
5
2
3
1
Wartościowości pierwiastków grup głównych:
Okres
I
II
III
IV
V
VI
VII
Tlenki
Na
2
O
MgO
Al
2
O
3
SiO
2
P
2
O
5
SO
3
Cl
2
O
7
Wodorki
NaH
MgH
2
AlH
3
SiH
4
PH
3
H
2
S
HCl
•
Metale i niemetale:
w okresach charakter metaliczny pierwiastków grup
głównych maleje z lewa na prawo,
w grupach głównych charakter metaliczny pierwiastków
rośnie z góry w dół.
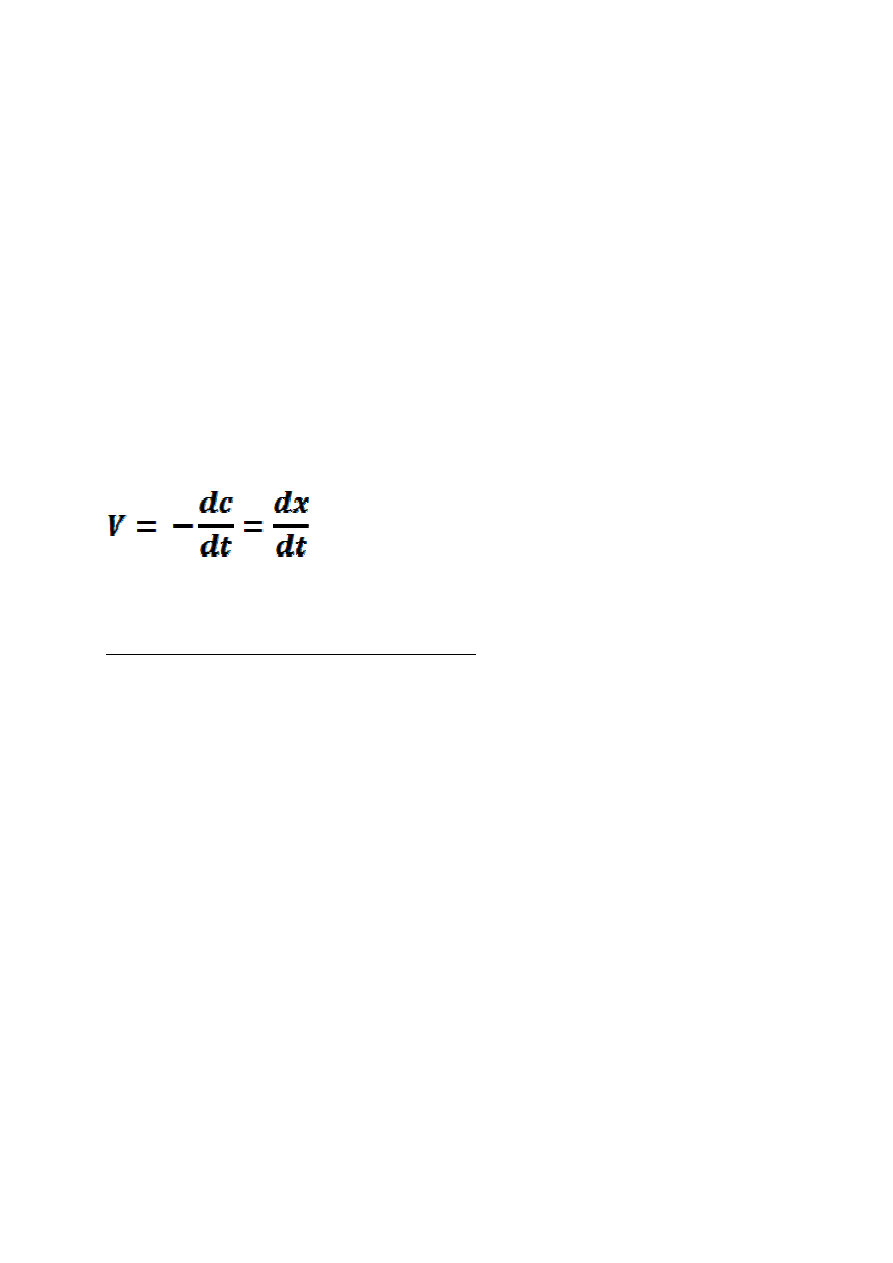
•
Pierwiastki zasado- i kwasotwórcze:
w okresach od lewej do prawej charakter zasadowy maleje a
kwasowy rośnie,
w grupach od góry do dołu charakter zasadowy rośnie a kwasowy
maleje.
KINETYKA REAKCJI CHEMICZNYCH
Szybkość reakcji chemicznych definiuje się jako pochodną ilości
reagenta względem czasu, w którym ta ilość powstała (dla produktu)
lub została przetworzona (dla substratu).
gdzie:
c-stężenie substratu,
x-stężenie produktu
Szybkość reakcji chemicznych zależy:
od rodzaju reagujących substancji (substratów),
od stężenia reagujących substancji (lub ciśnienia w przypadku
gazów),
od temperatury,
od obecności lub braku katalizatorów.
Szybkość reakcji jest proporcjonalna do stężeń substratów, np. :
CO + Cl
2
→ COCl
2
V = k [CO] [Cl
2
]
fosgen
V – szybkość reakcji, k – stała szybkości reakcji,
[ ] - nawiasy kwadratowe oznaczają stężenie molowe.

2 NO + O
2
→ 2 NO
2
V = k [NO]
2
[O
2
]
2 N
2
O → 2N
2
+ O
2
V = k [N
2
O]
Ogólny wzór na szybkość reakcji chemicznej:
V = k [S
1
]
a
[S
2
]
b
[S
3
]
c
....
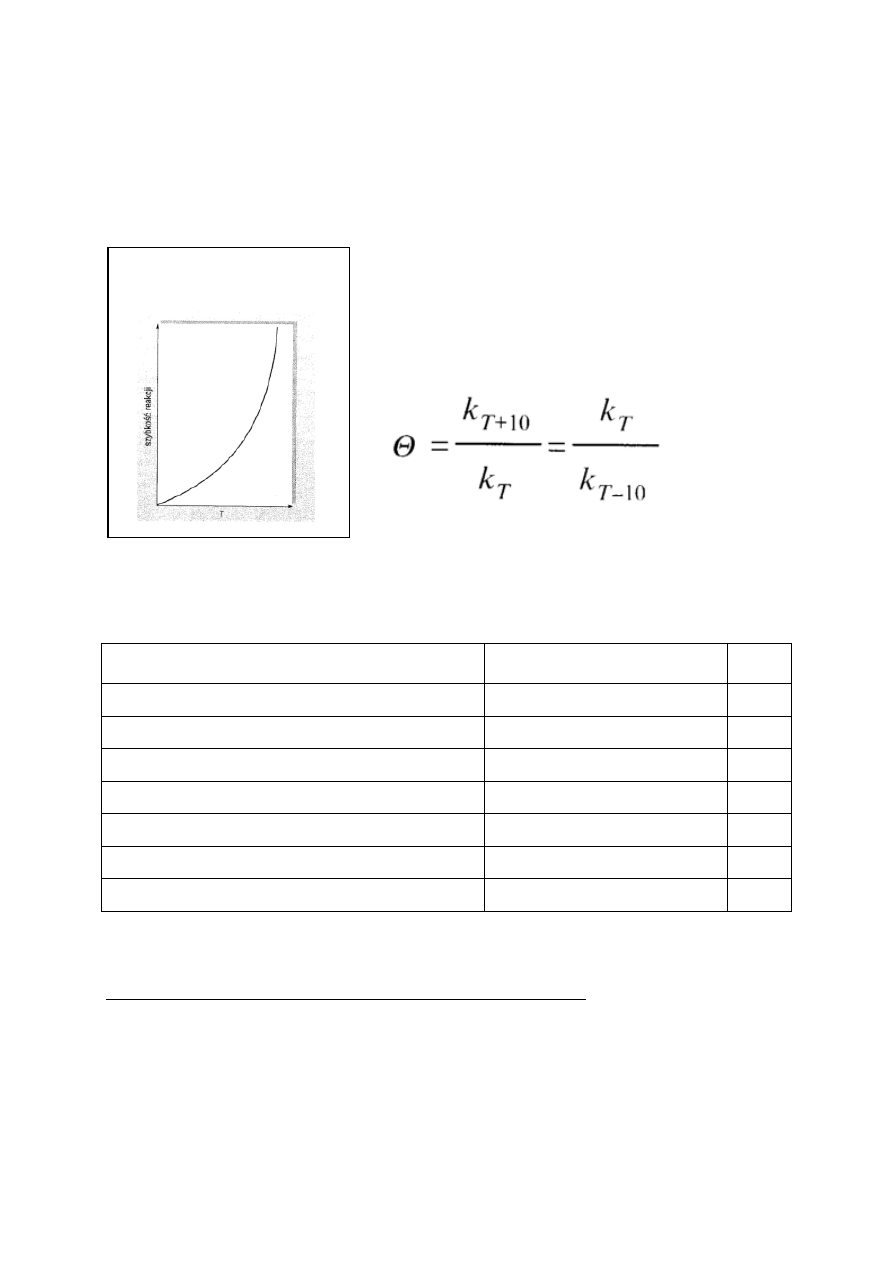
Szybkość reakcji chemicznej zależy od temperatury.
Reguła van’t Hoffa – szybkość reakcji wzrasta od 2 do 4 - krotnie po
podwyższeniu temperatury o 10 stopni ( w skali Kelvina lub
Celsjusza). Ma ona charakter przybliżony.
Współczynnik temperaturowy niektórych reakcji
Reakcja
Granice temperatur [ºC]
Θ
Synteza jodowodoru z pierwiastków
283 - 383
2,5
Hydroliza octanu etylu
10 - 45
1,9
Hydroliza sacharozy
25 - 55
3,6
Oddychanie roślin
0 - 25
2,5
Fermentacja alkoholowa
30 - 70
2,0
Rozwój jajeczka żaby
0 - 25
2,7
Ś
cinanie białka podczas gotowania jajka
50 (!)
Teoria kompleksu aktywnego i energia aktywacji.
Powstający w czasie reakcji stan o maksymalnej energii jest
nazywany stanem przejściowym reakcji albo kompleksem
aktywnym.
Zależność szybkości reakcji od
temperatury
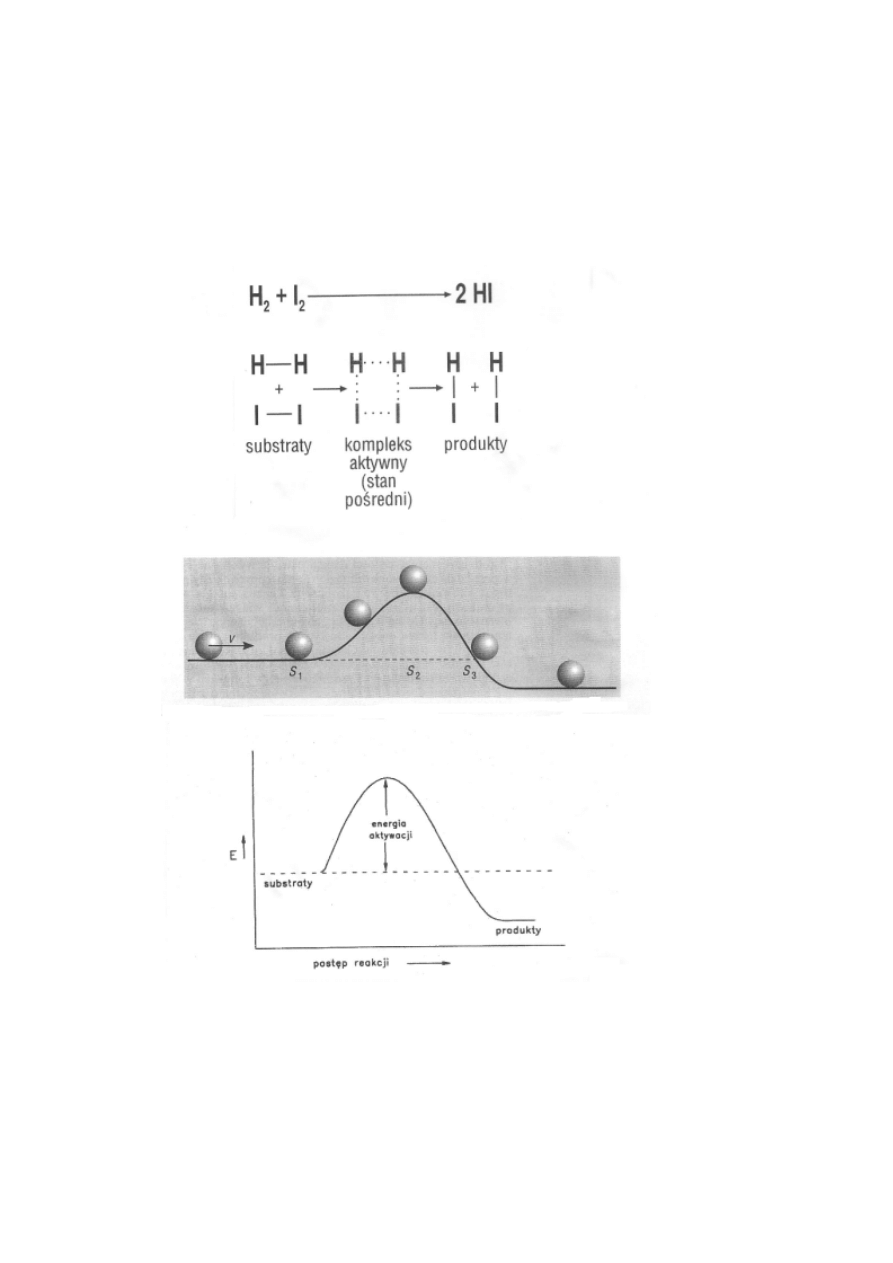
Energia aktywacji jest to minimalna energia jaką muszą mieć
cząsteczki, żeby ich zderzenie doprowadziło do reakcji chemicznej.
Zmiany energii podczas reakcji z jednym stanem przejściowym
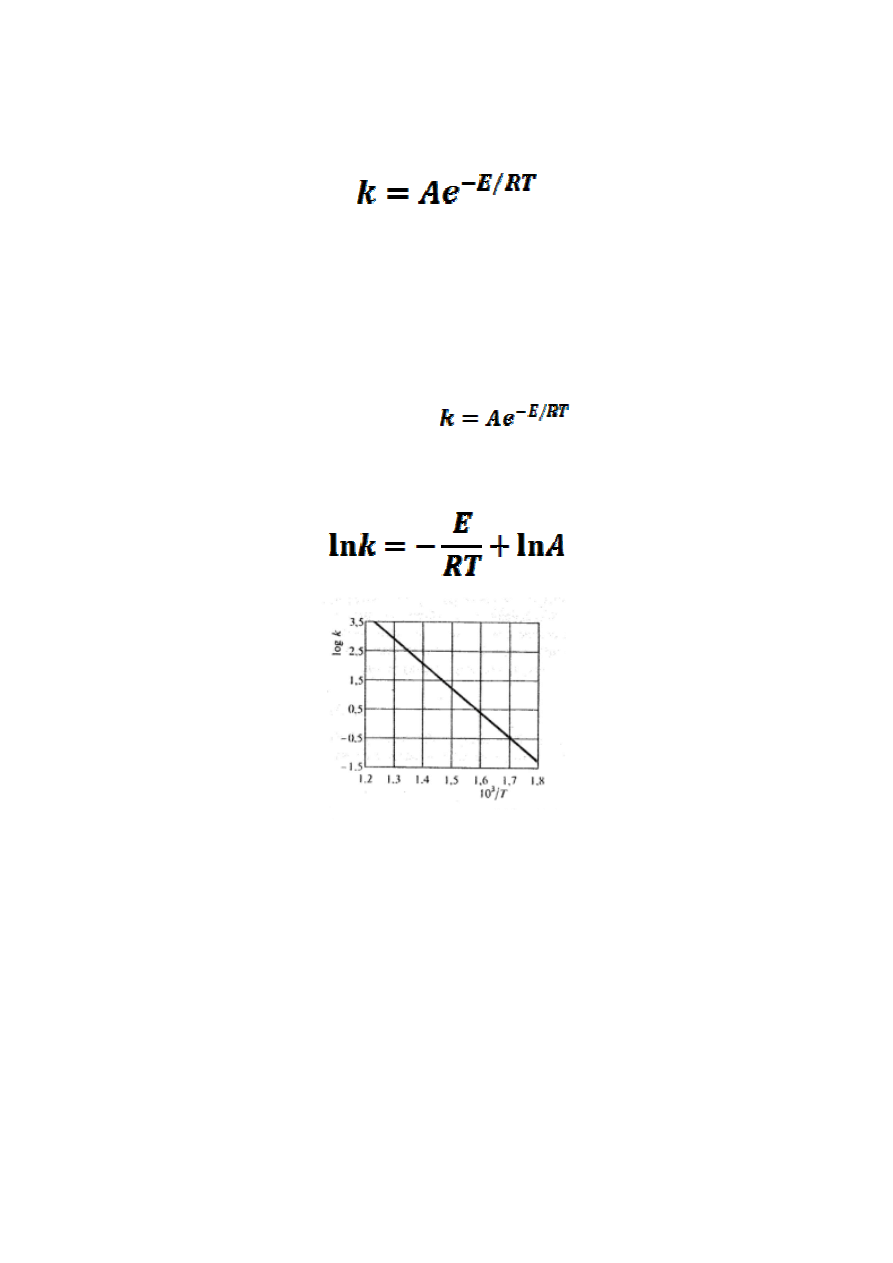
Zależność stałej szybkości reakcji k od energii aktywacji wyraża
równanie Arrheniusa:
Gdzie: k – stała szybkości reakcji, E – energia aktywacji, R – stała gazowa,
T – temperatura, A – współczynnik przedwykładniczy (czynnik częstości).
Podwyższenie temperatury powoduje wzrost stałej szybkości k.
Jedynym parametrem, który ma wpływ na stałą szybkości reakcji jest
temperatura.
Jeżeli zlogarytmuje się równanie
, to otrzymamy
wyrażenie, które stanowi funkcję liniową zmiennej 1/T :
Zależność logarytmu stałej szybkości reakcji od odwrotności temperatury
Tangens kąta nachylenia prostej do osi odciętych daje wartość
współczynnika E/R. Rzędna punktu przecięcia prostej z osią rzędnych
daje wartość lnA.

Katalizatorem nazywamy substancję, która wprowadzona do
mieszaniny reakcyjnej zwiększa szybkość reakcji, sama nie ulegając
trwałym
przemianom
chemicznym.
Substancje
powodujące
spowalnianie reakcji chemicznych nazywa się katalizatorami
ujemnymi lub inhibitorami. Katalizatory nie zużywają się podczas
reakcji.
Katalizatorami są substancje o bardzo różnych właściwościach:
metale, tlenki metali, tlenki niemetali, kwasy, zasady, a także
substancje organiczne.
Uwzględniając rozproszenie katalizatora i substratów, katalizę dzieli
się na:
•
katalizę homogeniczną, jeżeli katalizator i reagenty stanowią
jedną fazę (gazową lub ciekłą),
•
katalizę heterogeniczną, jeżeli katalizator i reagenty znajdują się
w różnych fazach, a katalizowana reakcja zachodzi na granicy
faz.
W organizmach żywych ważną rolę odgrywają biokatalizatory, do
których zaliczamy enzymy, witaminy i hormony.
Katalityczny rozkład nadtlenku wodoru:
H
2
O
2
+ 2H
+
+ 2Fe
2+
→ 2H
2
O + 2Fe
3+
H
2
O
2
+ 2Fe
3+
→ O
2
+ 2H
+
+ 2Fe
2+
Katalizatory nie tylko przyspieszają reakcje ale mogą też kierować
reakcję w stronę powstawania innych produktów, np.:
4NH
3
+3O
2
→ 2N
2
+ 6H
2
O –
bez katalizatora
4NH
3
+5O
2
→ 4NO + 6H
2
O –
w obecności platyny (Pt) jako katalizatora

SIŁY NAPĘDOWE REAKCJI
Kierunek reakcji. Większość reakcji chemicznych może zachodzić w
obu kierunkach, np.:
CaO + CO
2
→ CaCO
3
oraz CaCO
3
→ CaO + CO
2
(ok. 1000ºC)
Reakcje takie nazywane są reakcjami odwracalnymi.
Reakcje biegnące tylko w jednym kierunku są reakcjami
nieodwracalnymi, np.:
NH
4
NO
2
→ N
2
+ H
2
O – reakcja jest łatwa do wykonania,
N
2
+ 2H
2
O → NH
4
NO
2
– reakcja nie zachodzi w żadnych warunkach.
Równowaga
chemiczna
jest
równowagą
dynamiczną.
W
mieszaninach znajdujących się w stanie równowagi bez przerwy
biegną reakcje w obu kierunkach. Stan równowagi ustala się wtedy,
gdy szybkość reakcji w jedną i drugą stronę są jednakowe.
Położenie równowagi:
Prawo działania mas (Guldberg i Waage – 1867r.):
Stan równowagi chemicznej zostaje osiągnięty wtedy, gdy stosunek
iloczynu stężeń produktów do iloczynu stężeń substratów reakcji
przyjmie pewną wartość charakterystyczną dla tej reakcji. Stosunek
ten jest nazywany stałą równowagi chemicznej K.

Równowagowe reakcje odwracalne – stan równowagi a kinetyka
reakcji:
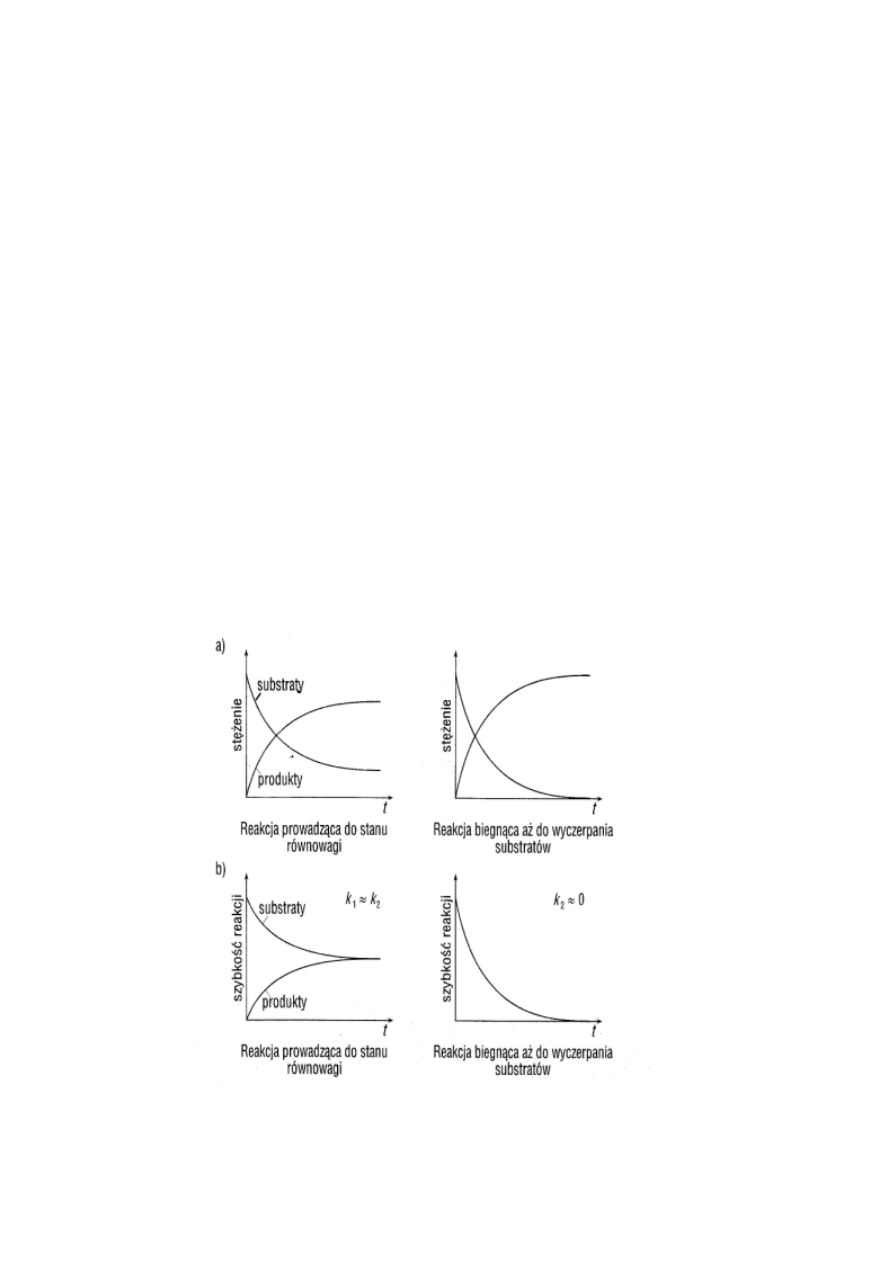
Reakcje nieodwracalne
Nieodwracalny przebieg reakcji ma miejsce, gdy:
•
w reakcji chemicznej powstaje produkt gazowy, np.:
Zn + H
2
SO
4
→ ZnSO
4
+ H
2
(↑)
•
w reakcji tworzy się substancja praktycznie nierozpuszczalna, np.:
AgNO
3
+ HCl → AgCl (↓) + HNO
3
•
w reakcji powstaje słabo zdysocjowany związek lub jon, np.:
Na
+
+ OH
-
+ H
+
+ Cl
-
→ Na
+
+ Cl
-
+ H
2
O
Wykresy zmian stężeń (a) i zmian szybkości reakcji (b) w funkcji
czasu dla typowych przypadków. Symbol k
1
oznacza stałą szybkości
reakcji „w prawo”, k
2
– „w lewo”.
Wyszukiwarka
Podobne podstrony:
(CHEMIA WYKLAD 6)id 1242 Nieznany (2)
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
CHEMIA SA,,DOWA WYKLAD 4 id 11 Nieznany
chemia zywnosci wyklady id 1130 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
chemia zadania 2 id 113035 Nieznany
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
chemia opracowanie id 112613 Nieznany
chemia klucz (2) id 112361 Nieznany
ZP wyklad1 id 592604 Nieznany
Chemia Wyklad 4 id 111675
chemia tablice id 112030 Nieznany
or wyklad 1 id 339025 Nieznany
II Wyklad id 210139 Nieznany
Chemia 03 id 557778 Nieznany
więcej podobnych podstron