
Barbara Siemek
Zespół Fizyki, Akademia Rolnicza
Do u ytku wewn trznego
WICZENIE 13
POMIAR CIEPŁA WŁA CIWEGO CIAŁ STAŁYCH
Kraków, 05.02.2007
SPIS TRE CI
I.
CZ
TEORETYCZNA ................................................................................................................................. 2
1.
T
ERMODYNAMIKA
-
PODSTAWOWE POJ CIA
................................................................................................. 2
2.
P
ARAMETRY STANU
.
R
ÓWNANIE STANU
........................................................................................................ 2
3.
C
IEPLNY PRZEPŁYW ENERGII
......................................................................................................................... 2
4.
P
RACA PROCESU TERMODYNAMICZNEGO
...................................................................................................... 5
5.
I
ZASADA TERMODYNAMIKI
............................................................................................................................ 6
6.
C
IEPŁO WŁA CIWE
......................................................................................................................................... 6
7.
C
IEPŁO MOLOWE
............................................................................................................................................ 6
8.
C
IEPŁO WŁA CIWE GAZÓW
............................................................................................................................ 7
9.
C
IEPŁO WŁA CIWE CIAŁ STAŁYCH
................................................................................................................ 8
10.
Z
ASADA BILANSU CIEPLNEGO
....................................................................................................................... 11
11.
Z
ASADA POMIARU
......................................................................................................................................... 12
II. CEL WICZENIA ........................................................................................................................................... 13
III.
WYKONANIE WICZENIA..................................................................................................................... 13
IV. OPRACOWANIE WYNIKÓW....................................................................................................................... 14
V. LITERATURA UZUPEŁNIAJ CA............................................................................................................... 15
ZAKRES WYMAGANYCH WIADOMO CI:
Poj cia: ciepło wła ciwe, ciepło wła ciwe ciał stałych, cieczy i gazów, ciepło topnienia, ciepło
parowania, temperatura, energia wewn trzna. Zmiany stanu skupienia. Warunki stosowalno ci
bilansu cieplnego. Obowi zuje umiej tno uło enia bilansu cieplnego stosowanego w tym
wiczeniu.

B
I. CZ
TEORETYCZNA
1. Termodynamika - podstawowe poj cia
Termodynamika
to dział fizyki, w którym rozpatruje si procesy zachodz ce w układach
składaj cych si z du ej liczby cz steczek. Układy takie zwane s
układami makroskopowymi
.
Poj cie
układu fizycznego
- wycinka materii, który został wyodr bniony w my lach z
otoczenia - jest jednym z kilku podstawowych poj stosowanych w termodynamice. W
omawianych poni ej zagadnieniach posługiwa si b dziemy poj ciem
układu izolowanego
. Jest
to układ, który nie wymienia z otoczeniem ani energii ani masy.
Układ zamkni ty
nie wymienia z
otoczeniem masy natomiast mo e wymienia energi a
układ otwarty
mo e wymienia z
otoczeniem i energi i mas . Je eli w układzie badamy zachodz ce w nim zjawiska cieplne, to
taki układ nazywamy
termodynamicznym
.
2. Parametry stanu. Równanie stanu
Opis termodynamiczny nie wymaga znajomo ci ogromnej liczby
wielko ci
mikroskopowych
opisuj cych układ takich jak: poło enia i pr dko ci poszczególnych atomów
lub cz steczek. W celu opisu stanu układu makroskopowego posługujemy si jedynie kilkoma
wielko ciami. S nimi: ci nienie (p), temperatura (T) i obj to (V). Wielko ci te zwane s
parametrami stanu
lub
parametrami makroskopowymi
. Parametry stanu s wielko ciami
mierzalnymi bezpo rednio i nie zale od "historii układu" tzn. od tego co z układem działo si
przed pomiarem.
Wyja nienie wielu wła ciwo ci rzeczywistych substancji uzyska mo na na gruncie
prostych modeli. Model mo na zdefiniowa podaj c równanie, które wi e parametry stanu.
Równanie to nazywamy
równaniem stanu
. Dla przykładu model
gazu doskonałego
odnosi si do
gazu o równaniu stanu
pV nRT
=
gdzie: n oznacza liczb moli gazu, R oznacza
stał gazow
, T jest temperatur w skali Kelvina.
3. Cieplny przepływ energii
W literaturze spotyka si dwa sposoby okre lenia "ciepła". W pierwszej z tych definicji
poj cie "ciepła" nie wyst puje, lecz mówi si o "wymianie ciepła" lub o "cieplnym przepływie
energii":

C
W takim uj ciu
wymiana ciepła
jest sposobem przekazywania energii a ciepło
charakteryzuje pewien proces a nie układ termodynamiczny (Szczeniowski, Fizyka
do wiadczalna, T2. s.44).W drugiej definicji poj cie "ciepła" uto samia si z pewn energi :
Ciepło
to energia, która przepływa z jednego ciała do drugiego, np. w wyniku istnienia ró nicy
temperatur (Halliday D., Resnick R., Fizyka Tom 1, s.664). Jednostk tak rozumianego "ciepła"
jest 1 d ul (1J). Podobnie energi przekazan w formie cieplnego przepływu mierzymy w
d ulach.
Temperatura
Powszechnie uwa amy, e miar temperatury jest "ciepłota" ciała. Samo poj cie ciepłoty
jest niezmiernie subiektywne. Wydaje si , e bardziej precyzyjn i obiektywn definicj
temperatury b dzie nast puj ca:
Temperatura
to taka skalarna wielko fizyczna, której równo zapewnia równowag
termiczn ciał b d cych ze sob w kontakcie. Aby t definicj wyja ni pro ciej, we my pod
uwag dwa ciała; ciało A, które wydaje nam si zimne i B, które odczuwamy jako gor ce. Je eli
ciała te zetkniemy ze sob to po pewnym czasie stwierdzamy, e ich "ciepłota" wyrównała si .
Stan, który osi gn te ciała nie ulegnie zmianie i nazywamy go stanem równowagi termicznej.
Inaczej powiemy, e ciała A i B uzyskaj równowag wtedy, gdy ich temperatury wyrównaj si .
Inn definicj temperatury podano w podr czniku (Resnick R., Halliday D., Fizyka Tom 3, s.
525).
"Istnieje wielko skalarna, nazywana
temperatur
, która jest wła ciwo ci wszystkich
układów termodynamicznych (w stanach równowagi), taka e równo temperatur jest
warunkiem koniecznym i wystarczaj cym równowagi termicznej." Jednostk temperatury w
układzie SI jest stopie Kelvina.
Energia wewn trzna. Zasada ekwipartycji energii
Na energi wewn trzn (U) składa si energia kinetyczna ruchu cz steczek lub atomów,
energia potencjalna ich wzajemnego oddziaływania a tak e energia wi zania cz ci składowych
j der atomowych. Do energii wewn trznej nie zaliczamy energii mechanicznej ciała jako cało ci.
Mo na wykaza , e energia wewn trzna zale y (jest funkcj ) temperatury ciała i jest do niej
wprost proporcjonalna. Ponadto energia wewn trzna zale y od sposobu powi zania nawzajem
cz steczek ciała czyli od stanu skupienia.

D
Wszelki ruch ciała (cz steczki) w przestrzeni trójwymiarowej mo emy rozwa y jako
ruch wzdłu (wokół) trzech niezale nych osi, czyli poło enie ciała w przestrzeni trójwymiarowej
okre la sze niezale nych współrz dnych (trzy liniowe x,y,z) i trzy k towe (a, b, g). Ta liczba
niezale nych współrz dnych okre laj ca poło enie ciała w przestrzeni równa jest liczbie
stopni
swobody
(R.I. Grabowski, "Fizyka" s.139).
Zatem dowolne ciało (równie cz steczka wchodz ca w skład dowolnego ciała) ma sze
stopni swobody - trzy zwi zane z ruchem post powym i trzy z ruchem obrotowym. Je eli ruch
ciała podlega pewnemu ograniczeniu, wówczas liczba stopni swobody równie ulega zmianie. I
tak np. dla opisu ruchu cz steczki gazu jednoatomowego wystarczy podanie trzech niezale nych
współrz dnych, czyli taka cz steczka posiada trzy stopnie swobody, cz steczka gazu
dwuatomowego ma ich pi natomiast cz steczka gazu trój - i wieloatomowego ma sze stopni
swobody.
Powstaje pytanie, czy istnieje zwi zek pomi dzy liczb stopni swobody i energi
wewn trzn . W teorii klasycznej według Boltzmanna: Na ka dy stopie swobody cz steczki
(ciała) przypada jednakowa ilo energii. Jest to tre
zasady ekwipartycji energii
, czyli równego
podziału tej energii na wszystkie stopnie swobody.
Jako przykład wykorzystania zasady ekwipartycji energii rozwa ymy gaz doskonały,
którego energia wewn trzna jest sum energii kinetycznej ruchu post powego i obrotowego
cz steczek. (Cz steczki gazu doskonałego nie oddziałuj ze sob , a wi c nie istnieje energia
potencjalna gazu doskonałego). Mo na wykaza , e rednia energia kinetyczna cz steczki gazu
jednoatomowego maj cej trzy stopnie swobody wyra a si wzorem:
E
kT
k
=
3
2
gdzie: k jest to stała Boltzmanna, a T oznacza temperatur gazu. Zatem zgodnie z zasad
ekwipartycji energii na jeden stopie swobody cz steczki gazu doskonałego przypada energia
kinetyczna
E
kT
k
=
1
2
Tak wi c dla n moli gazu doskonałego całkowita energia wewn trzna b d ca redni
energi kinetyczn wyra a si nast puj cym wzorem:
U E
n
i
kNT
k
=
=
2
gdzie: i oznacza liczb stopni swobody cz steczki gazu, R - stała gazowa.
E
Z powy szej zale no ci wynika, e energia wewn trzna gazu doskonałego jest funkcj
temperatury gazu oraz liczby stopni swobody cz steczek wchodz cych w skład gazu (energia
wewn trzna gazu ro nie je eli ro nie jego temperatura).
4. Praca procesu termodynamicznego
W termodynamice prac nazywa si makroskopowy sposób przekazywania energii z układu do
otoczenia lub z otoczenia do układu wi
cy si z ruchem osłon tego układu.
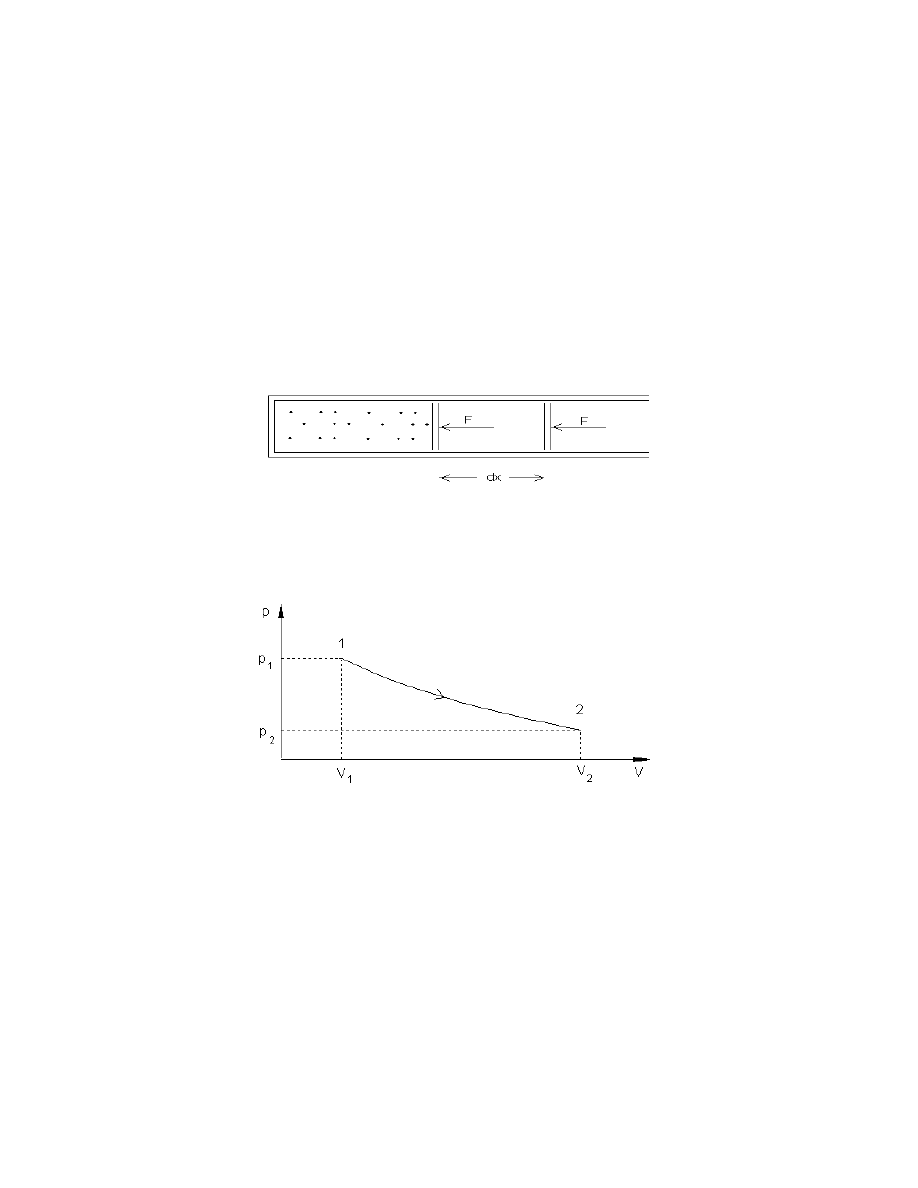
Aby obliczy prac okre lonego procesu termodynamicznego we my pod uwag gaz
znajduj cy si w cylindrze, zamkni ty tłokiem o powierzchni S, scharakteryzowany poprzez
parametry (p,V,T). Tłok poruszaj cy si bez tarcia, zostanie przesuni ty o odcinek dx (Rys.1).
Rys. 1. Praca gazu przeciwko sile nacisku tłoka
Rozwa my proces, w którym gaz przechodzi ze stanu pocz tkowego (1) do ko cowego (2),
osi gaj c stan równowagi scharakteryzowany ci nieniem p
2
i obj to ci V
2
(rys.2).
Rys. 2. Proces przej cia gazu ze stanu pocz tkowego (1) do ko cowego (2)
Gaz wykonuje prac przeciw sile nacisku tłoka. Praca wykonana przez gaz przy bardzo małym
przemieszczeniu tłoka na drodze dx wynosi:
dW Fdx pSdx pdV
=
=
=
gdzie: p jest to ci nienie wywierane na gaz, S- pole powierzchni tłoka, dV oznacza zmian
obj to ci gazu. Aby obliczy całkowit prac przy du ym przesuni ciu tłoka, musimy zna
zale no ci nienia od obj to ci i wówczas praca b dzie równa:
W
pdV
V
V
=
1
2

F
Prac t mo na równie obliczy graficznie, mierz c pole powierzchni pod krzyw wykre lon na
płaszczy nie p-V (Rys. 2).
5. I zasada termodynamiki
Termodynamika opiera si na dwóch podstawowych prawach, nazywanych zasadami
termodynamiki.
Pierwsza zasada termodynamiki okre la zwi zek pomi dzy ciepłem i prac oraz zmian
energii wewn trznej. Zwi zek ten mo na wyrazi wzorem:
∆
∆
∆
U
Q
W
=
+
gdzie:
∆U oznacza zmian energii wewn trznej, ∆Q jest to ilo ciepła pobranego lub oddanego
przez układ,
∆W oznacza prac wykonan przez układ lub nad układem.
6. Ciepło wła ciwe
Ró ne ciała charakteryzujemy pod wzgl dem zdolno ci pobierania czy oddawania energii przez
tzw. ciepło wła ciwe.
Ciepłem wła ciwym
(c
w
) ciała (układu) nazywamy stosunek ilo ci ciepła pobranego przez
jednostk masy ciała do zmiany temperatury powstałej w wyniku pobrania tego ciepła
c
Q
m T
w
=
∆
gdzie: Q jest to ilo ciepła pobranego przez ciało, m-masa ciała,
∆T oznacza zmian
temperatury. Jednostk tak rozumianego ciepła wła ciwego jest J/kg K. Wzór ten jest słuszny
tylko wówczas je eli ciepło wła ciwe nie zale y od temperatury, lub dla bardzo małych
przyrostów temperatur (
∆T). Dla du ych ró nic temperatur mamy do czynienia z pewnym
rednim ciepłem wła ciwym.
7. Ciepło molowe
W termodynamice cz sto wygodniej jest posługiwa si poj ciem ciepła molowego.
Ciepłem
molowym
(C) ciała (układu) nazywamy ilo ciepła pobranego przez jeden mol tego ciała do
zmiany temperatury powstałej w wyniku pobrania tego ciepła.
C
Q
n T
=
∆
gdzie n oznacza liczb moli. Jednostk ciepła molowego jest J/mol·K. Pomi dzy ciepłem
wła ciwym i molowym zachodzi zwi zek:
C
c
w
=
µ

G
gdzie:
µ jest mas cz steczkow ciała.
8. Ciepło wła ciwe gazów
W przypadku gazów wygodniej jest posługiwa si molem gazu zamiast np. kilogramem,
dlatego w odniesieniu do gazów posługujemy si cz ciej poj ciem ciepła molowego ni
wła ciwego.
Ciepło molowe (wła ciwe) gazów zale y w istotny sposób od warunków w jakich zachodzi ich
ogrzewanie. Dlatego te aby scharakteryzowa gaz pod wzgl dem zdolno ci pobierania i
oddawania energii wprowadza si dwa ciepła molowe: przy stałym ci nieniu (C
p
) i przy stałej
obj to ci (C
v
).
Molowym ciepłem wła ciwym przy stałej obj to ci (C
v
) nazywamy ilo ciepła pobranego
przez jeden mol ciała do zmiany temperatury ciała powstałej w wyniku pobrania tego ciepła, w
stałej obj to ci. Zgodnie z pierwsz zasad termodynamiki
∆Q=∆U (V=const, wi c ∆W=0), a
ciepło molowe b dzie równe:
C
n
U
T
V
V const
=
=
1
∆
∆
Poniewa dla jednego mola gazu doskonałego (n=1) energi wewn trzn mo na zapisa :
U
i
RT
=
2
. Tak wi c ciepło molowe przy stałej obj to ci C
v
b dzie równe
C
i
R
V
=
2
co oznacza i w przypadku gazów ciepło molowe przy stałej obj to ci nie zale y od temperatury.
Molowym ciepłem wła ciwym przy stałym ci nieniu (C
p
) nazywamy ilo ciepła
pobranego przez jeden mol ciała do zmiany temperatury ciała powstałej w wyniku pobrania tego
ciepła, przy stałym ci nieniu. Poniewa zgodnie z pierwsz zasad termodynamiki ciepło
dostarczone z zewn trz zu ywa si nie tylko na zwi kszenie energii wewn trznej, ale i na
wykonanie pracy
∆W przeciwko siłom zewn trznym, wi c ciepło molowe przy stałym ci nieniu
C
p
jest wi ksze od ciepła molowego przy stałej obj to ci C
v
o warto pracy
∆W. Mo na
wykaza , e
∆W=R, gdzie R jest to stała gazowa. Zwi zek pomi dzy ciepłem molowym przy
stałym ci nieniu i ciepłem molowym przy stałej obj to ci nosi nazw równania Mayera:
C
C
R
i
R R
p
V
=
+ =
+
2
Z zale no ci powy szych wynika, i ciepło molowe gazów nie zale y od temperatury.
Do wiadczenie wykazuje jednak, e w rzeczywisto ci jedynie ciepło molowe gazów

H
jednoatomowych nie zmienia si z temperatur . Ciepło molowe gazów wieloatomowych jest w
przybli eniu stałe tylko w temperaturach bliskich temperaturze normalnej. W wysokich
temperaturach rzeczywiste ciepło molowe przybiera warto ci wi ksze ni teoretyczne co
tłumaczy si " wzbudzaniem" rotacyjnych stopni swobody. Za w bardzo niskich temperaturach
ciepło molowe gazów wieloatomowych ró ni si niewiele od ciepła molowego gazów
jednoatomowych gdy nast puje "zamra anie" rotacyjnych stopni swobody. Ró nice powy sze,
trudne do wyja nienia w oparciu o klasyczn teori gazów wyja nia mechanika kwantowa. Głosi
ona i energia ruchu obrotowego cz steczek nie zmienia si w sposób ci gły, ale skokowo,
okre lonymi porcjami (kwantami). Zatem w niskich temperaturach cz steczki wieloatomowe nie
mog absorbowa energii na rotacyjne stopnie swobody, przestaj wykonywa ruch obrotowy i
zachowuj si jak jednoatomowe, st d ciepła molowe cz steczek gazów wieloatomowych i
jednoatomowych w niskich temperaturach s jednakowe.
9. Ciepło wła ciwe ciał stałych
Na ogół ciepło wła ciwe ciał stałych jest mniejsze od ciepła wła ciwego danego materiału
w stanie ciekłym lub gazowym. Wyj tkowo du e ciepło wła ciwe ma woda i fakt ten ma du e
znaczenie w przyrodzie gdy zbiorniki wodne odgrywaj rol zbiorników i regulatorów ciepła
(np. woda morska ogrzewa si latem znacznie słabiej ni l d, a zim stygnie znacznie szybciej ni
l d).
Z punktu widzenia mikroskopowej budowy ciała stałego wiemy, e w ciele stałym
cz steczki (atomy) znajduj si w ci le okre lonym uporz dkowaniu przestrzennym tworz c sie
krystaliczn (lub przestrzenn ). Cz steczki ciała stałego wykonuj drgania wokół swoich
poło e równowagi, przy czym przesuni cia cz steczek z miejsca na miejsce w ciele stałym s
mo liwe ale zachodz stosunkowo rzadko. Całkowita energia cz steczki ciała stałego składa si z
energii kinetycznej ruchu cieplnego E
k
(oscylacji) oraz energii potencjalnej oddziaływa
wzajemnych E
p
.
W dostatecznie wysokich temperaturach warto ci energii E
k
i E
p
mo emy uwa a za
jednakowe, zatem rednia energia wewn trzna jednej cz steczki ciała stałego jest równa:
U
E
E
E
k
p
k
=
+
= 2
W modelu klasycznym, z zasady ekwipartycji energii dla pojedynczej cz stki wynika, e
jej rednia energia kinetyczna jest równa:
U
i
kT
=
2

I
gdzie: k - stała Boltzmana, i - oznacza liczb stopni swobody cz steczki, T jest to temperatura,
wi c energia wewn trzna cz steczki ciała stałego b dzie si wyra ała:
U ikT
=
Poniewa cz steczka ciała stałego mo e jedynie oscylowa wokół poło enia równowagi i
ma trzy stopnie swobody (i=3), a zatem jej energia wewn trzna U = 3kT. Je eli we miemy pod
uwag jeden mol chemicznie prostej substancji to energia wewn trzna takiej ilo ci ciała stałego
b dzie si wyra ała wzorem:
U
NkT
RT
=
=
3
3
gdzie R jest stał gazow substancji, N liczba Avogadra. Tak wi c ciepło molowe odniesione do
jednego mola ciała stałego C=3R, za ciepło wła ciwe c
w
=3R/
µ. Zakładaj c R=8.32 J/mol·K,
otrzymamy warto ciepła molowego równ :
[
]
C
J mol K
=
⋅
25 /
Mo na to uj słowami: w dostatecznie wysokich temperaturach ciepło molowe
wszystkich chemicznie prostych ciał stałych jest w przybli eniu jednakowe i wynosi 25
J/mol
⋅K. Twierdzenie to nosi nazw prawa Dulonga-Petita. Natomiast ciepło molowe substancji
chemicznie zło onych równe jest sumie warto ci ciepła atomowego pierwiastków wchodz cych
w skład tych zwi zków i prawo to nazwano prawem Joule'a i Koppa.
Z powy szych zale no ci (w uj ciu klasycznym) wynika, e ciepło molowe ciał stałych
nie zale y ani od temperatury ani od wła ciwo ci ciał stałych. Jednak do wiadczenie wykazuje,
e ciepło wła ciwe ciał stałych zale y od temperatury, przy czym zale no taka szczególnie
silnie przejawia si w niskich temperaturach. Daje si to wyrazi tzw. wzorem P.Debye'a:
c
AT
w
=
3
gdzie: T oznacza temperatur w skali bezwzgl dnej, A jest to pewna stała charakterystyczna dla
danego rodzaju substancji.
Ze wzoru powy szego wynika i w niskich temperaturach ciepło wła ciwe ciał stałych
maleje wraz ze zmniejszaniem si temperatury i d y do zera, je eli temperatura maleje do zera.
Równie ciepło molowe ciał stałych w niskich temperaturach zale y od temperatury, co
wyra a nast puj cy wzór:
(
)
C
f T
=
/
Θ
gdzie:
Θ jest tzw. temperatur charakterystyczn (zale n od badanego pierwiastka), powy ej
której ciepło molowe nie zale y od temperatury. Zale no ciepła molowego (C
v
) ciał stałych od
temperatury mo na przedstawi na wykresie (rys.3):
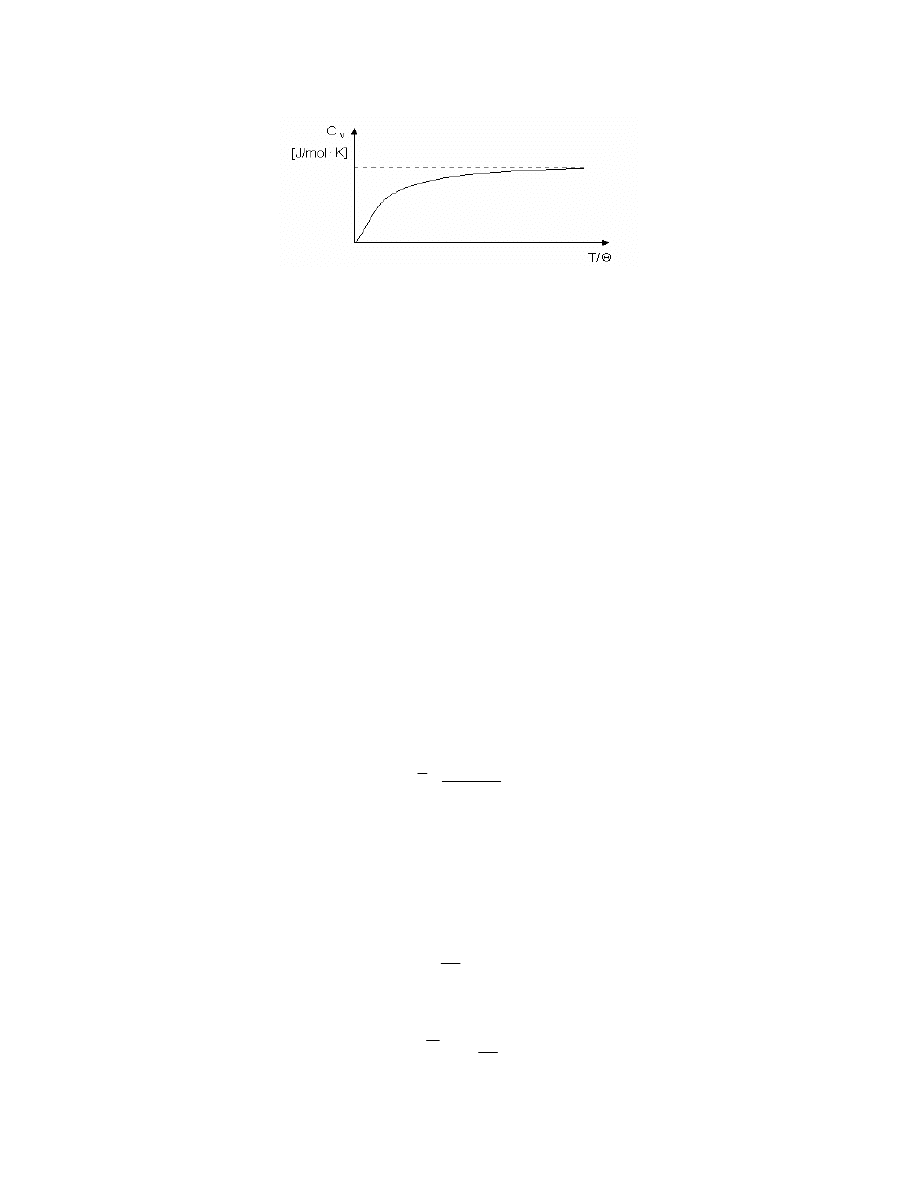
J
Rys. 3. Zale no ciepła molowego ciał stałych (przy stałej obj to ci) od temperatury.
I - reguła Dulonga-Petita, II - prawo Debye’a
Jak wida na rysunku dla temperatur T mniejszych od temperatury charakterystycznej
Θ,
ciepło molowe ciał stałych maleje wraz ze zmniejszaniem si temperatury, a dla temperatury T=
Θ
ciepło molowe przyjmuje warto stał .
Przyczyn niezgodno ci klasycznej teorii ciepła molowego ciał stałych z do wiadczeniem
jest ograniczona stosowalno klasycznej zasady ekwipartycji energii. Trudno ci te zostały
pokonane przez współczesn teori kwantow . Teoria ta została rozwini ta w 1905 roku przez A.
Einsteina i jej podstawowe zało enie jest takie, i ka dy atom drgaj cy w w le sieci
krystalicznej ma trzy stopnie swobody. Przy czym w krysztale zbudowanym z jednakowych
atomów, drgaj one z jednakow cz stotliwo ci
ν. Energia atomu drgaj cego w w le sieci
krystalicznej, nie mo e przyjmowa dowolnych warto ci, a tylko ci le okre lone, b d ce
wielokrotno ciami kwantu energii h
ν. Zagadnienie okre lenia redniej warto ci energii cz stki
drgaj cej harmonicznie wokół pewnego centrum, rozwin ł w 1900 r. M. Planck. Otrzymał on
nast puj ce wyra enie na redni energi cz stki:
E
h
e
h kT
−
−
ν
ν
/
1
gdzie: h-stała Plancka,
ν - cz stotliwo drga atomów, k-stała Bolzmanna, T-temperatura w
skali Kelvina. Z powy szego wzoru wynikaj nast puj ce wnioski:
(1) przy wysokich temperaturach kT >> h
ν
h
kT
ν
1
mo na stosowa nast puj cy przybli ony wzór:
e
h
kT
h
kT
ν
ν
= +
1
wówczas zale no powy sza prowadzi do klasycznego wyra enia na energi atomu:

K
E
h
h
kT
kT
=
+
+
−
≈
ν
ν
1
1
Tak wi c w wysokich temperaturach rednia energia przypadaj ca na jeden stopie
swobody drgaj cego atomu nie zale y od cz stotliwo ci jego drga , a zale y od temperatury. Dla
jednego mola energia ta b dzie równa RT. St d ciepło molowe przyjmie warto C=R. W tych
warunkach ciepło molowe ciała stałego nie zale y od temperatury czyli jest spełnione prawo
Dulonga-Petita.
(2) W niskich temperaturach gdy kT << h
ν, czyli hν/kT >> 1 jest spełniony warunek:
e
h
kT
ν
1
i wówczas rednia energia atomu b dzie równa:
U
E
h e
h
kT
≈
=
−
ν
ν
a ciepło molowe jest odwrotnie proporcjonalne do temperatury C~1/T
2
.
Temperatura T=
Θ, poni ej której ciepło molowe zmniejsza si wraz z malej c
temperatur ciała stałego, jest okre lona wzorem:
k
h
Θ =
ν
max
gdzie:
ν
max
jest to maksymalna cz sto drgania atomów w sieci ciała stałego. Temperatura
Θ
nazywa si charakterystyczn temperatur Debye'a.
Gdy temperatura T>>
Θ słuszne jest prawo Dulonga-Petita
Dla temperatur T<<
Θ obserwuje si odchylenie od tego prawa.
Kwantowa teoria ciepła wła ciwego ciał stałych dobrze wytłumaczyła fakt zmniejszania
si ciepła molowego z obni aniem temperatury, nie tłumaczyła jednak zale no ci ciepła
molowego od temperatury w postaci:
C AT
=
3
Trudno ta została rozwi zana cz ciowo przez Debey'a, a pó niej przez Fermiego i Diraca.
10. Zasada bilansu cieplnego
Ró ne ciała stykaj c si ze sob mog wymienia energi . Jednym z podstawowych i
powszechnych sposobów wymiany energii mi dzy ciałami jest wymiana na sposób ciepła.
Warunkiem koniecznym takiej wymiany jest istnienie ró nicy temperatur i wówczas ciepło
przepływa od ciał o wy szej temperaturze do ciał o ni szej temperaturze. Niekiedy wymiana
ciepła jest jedyn przyczyn zwi kszania lub pomniejszania energii wewn trznej ciała. Taka

L
sytuacja ma miejsce w przypadku układu ciał umieszczonych w
kalorymetrze
, czyli w
urz dzeniu, które uniemo liwia wymian ciepła z otoczeniem realizuj c ide izolacji ciał od
otoczenia. W takich warunkach energia wewn trzna tego całego układu jest stała mimo, e
zachodzi wymiana ciepła pomi dzy tworz cymi go ciałami i energie wewn trzne tych ciał
ulegaj zmianie. Pierwsza zasada termodynamiki pozwala stwierdzi , e suma ilo ci ciepła
pobranego przez jedne ciała układu izolowanego równa jest sumie ilo ci ciepła oddanego przez
inne ciała tego układu, tak e zmiana energii wewn trznej całego układu była zerowa.
Stwierdzenie to nazywane jest
zasad bilansu cieplnego
i zapisywane w formie równania:
Q
1
+ Q
2
+ ... = Q'
1
+ Q'
2
+ ...
gdzie: poszczególne Q oznaczaj ilo ci ciepła pobrane przez poszczególne ciała w układzie a Q'
oznaczaj ciepła oddane przez inne ciała tego układu.
11. Zasada pomiaru
W czasie pomiaru ciało stałe o masie m
c
i temperaturze T
p
zawieszamy w termostacie.
Para wodna przechodz ca przez termostat ogrzewa to ciało do temperatury wrzenia wody (T
w
).
Ogrzane ciało zostaje nast pnie wprowadzone do kalorymetru z wod . Ciało to oddaje ciepło Q
o
:
Q
o
= m
c
c
c
(T
w
- T
k
)
gdzie: c
c
jest to ciepło wła ciwe badanego ciała, T
w
- temperatura wrzenia wody, a T
k
oznacza
temperatur ko cow ciała, wody i kalorymetru. Woda i kalorymetr ogrzewaj si od temperatury
T
p
do T
k
pobieraj c ciepło Q
p:
Q
p
= (m
k
c
k
+ m
w
c
w
) (T
k
- T
p
)
gdzie: m
k
jest to masa kalorymetru, c
k
jego ciepło wła ciwe, m
w
- oznacza mas wody, a c
w
ciepło wła ciwe wody.
Zasada pomiaru ciepła wła ciwego ciała stałego metod kalorymetryczn jest nast puj ca.
Podczas pomiarów wyznaczamy mas ciała, jego temperatur ko cow i temperatur wrzenia
wody. Ciepło wła ciwe tego ciała mo e zosta obliczone je li znana jest warto ciepła oddanego
Q
o
.
Metod okre lenia ciepła Q
o
jest zastosowanie zasady bilansu cieplnego. Zasad t mo na
stosowa do układów izolowanych. W naszym wiczeniu ide izolacji układu od otoczenia
realizuje kalorymetr. Zgodnie z zasad bilansu cieplnego ciepło oddane przez badane ciało równe
jest ciepłu pobranemu przez ciała pozostaj ce z nim w kontakcie cieplnym.
Q
o
= Q
p

M
Posługuj c si zasad bilansu cieplnego otrzymujemy nast puj cy zwi zek pomi dzy
wielko ciami mierzonymi, a wyznaczanym ciepłem wła ciwym ciała:
(
)(
)
(
)
c
m c
m c
T
T
m T
T
c
k k
w w
k
c
w
k
=
+
−
−
0
We wzorach przyj to nast puj ce oznaczenia m
c
- masa ciała, m
w
- masa wody w kalorymetrze,
m
k
- masa kalorymetru, c
w
= 4187 J/kg·K - ciepło wła ciwe wody, c
k
= 377 J/kg·K - ciepło
wła ciwe kalorymetru miedzianego, T
p
- temperatura pocz tkowa wody w kalorymetrze, T
k
-
temperatura ko cowa wody w kalorymetrze (najwy sza po wrzuceniu ciała), T
w
- temperatura
wrzenia wody.
II. CEL WICZENIA
Celem wiczenia jest wyznaczenie redniego ciepła wła ciwego kilku ciał stałych metod
kalorymetryczn .
III. WYKONANIE WICZENIA
1.
Zwa y badane ciało (m
c
).
2.
Wł czy ogrzewanie naczynia z wod .
3.
Zawiesi na druciku badane ciało w termostacie ogrzewaj c nadal wod .
4.
Zwa y osuszone naczynie kalorymetryczne (bez osłony) wraz z mieszadełkiem
(masa m
k
) notuj c dokładno pomiaru masy Dm.
5.
Napełni naczynie kalorymetryczne do połowy wod destylowan , a nast pnie
zwa y je by wyznaczy mas (m
w
) wody zawartej w tym naczyniu.
6.
Doprowadzi wod w ogrzewanym naczyniu do wrzenia, a nast pnie zmniejszaj c
moc grzejn gotowa j przez 15 min. odprowadzaj c równocze nie par wodn
do naczynia z zimn wod .
7.
Wprowadzi zamocowany w statywie czujnik termometru cyfrowego do naczynia
kalorymetrycznego i tu przed wło eniem ciała do kalorymetru zmierzy temperatur T
p
.
8.
Wprowadzi badane ciało do naczynia kalorymetrycznego (trzymaj c za drucik).
9.
Mieszaj c wod w naczyniu kalorymetrycznym obserwowa wskazania
termometru i zanotowa najwy sz warto temperatury (T
k
).

N
10.
Przyjmujemy, e temperatura ko cowa wody jest równa temperaturze wrzenia.
Poniewa ta temperatura zale y od ci nienia powietrza, aktualne ci nienie nale y
odczyta na barometrze i zanotowa wynik pomiaru (p
t0
). Zgodnie ze
wskazówkami podanymi w instrukcji barometru rt ciowego obliczy poprawki
∆p
1
,
∆p
2
i
∆p
3
i zapisa skorygowan warto ci nienia p. W tablicach znale
temperatur wrzenia wody T
w
.
11.
Powtórzy pomiary dla innego ciała.
IV. OPRACOWANIE WYNIKÓW
1.
Obliczy ciepło wła ciwe dla ka dego z ciał u ytych do pomiaru według wzoru
(1). Nale y zwróci uwag na to, e warto ci ró nic temperatur wyra one w
stopniach Kelvina s równe liczbowo warto ciom wyra onym w stopniach
Celsjusza.
2.
Otrzymane wyniki porówna z warto ciami tablicowymi. (Nale y zanotowa na
wiczeniach, jakiego rodzaju ciało stosuje si do pomiarów).
3.
Bł d ciepła wła ciwego obliczy metod ró niczki zupełnej dla jednego z
badanych ciał. Wykona obliczenia bł du bezwzgl dnego i wzgl dnego.
4.
Wynik ko cowy zapisa w postaci: c
c
±
∆c

O
V. LITERATURA UZUPEŁNIAJ CA
Bolton W., Zarys fizyki, Tom 2, PWN, Warszawa 1988, s. 405-409
Chyla K., Fizyka dla ZSZ, Wydanie trzecie, WSziP, Warszawa 1991. s.122-123
Dry ski T. Do wiadczenia pokazowe z fizyki, PWN, Warszawa, 1964
Encyklopedia fizyki, Tom 1, PWN, Warszawa 1974, s.260-261
Halliday D., Resnick R., Fizyka Tom 1, PWN, Warszawa 1994, s.523
Herman M., Kalesty ski A., Widomski L., Podstawy fizyki dla kandydatów na wy sze uczelnie,
PWN, Warszawa 1984, s.470-473, 204-207
Gabrylewski E., Fizyka dla klasy I liceum ogólnokształc cego, technikum i liceum zawodowego.
PZWS, Warszawa 1973, s.217
Jaworski B.M., Pi ski A.A., Elementy fizyki, PWN, Warszawa 1979, s.321-346, 362-368
Je ewski M., Fizyka, PWN, Warszawa 1957, s.203-205
Jenike M., Fizyka. Podr cznik dla liceów ogólnokształc cych, WSZiP, Warszawa 1993, s.252-
270
Kami ski Z. Fizyka dla kandydatów na wy sze uczelnie techniczne, WNT, Warszawa 1984,
s.262-263, 323-330
Szczeniowski S. Fizyka do wiadczalna, Cz
II, PWN, Warszawa 1976, s.28-40
Wróblewski A.K., Zakrzewski J.A., Fizyka, Tom 2, PWN, Warszawa 1984, s.543-545; 552
Wyszukiwarka
Podobne podstrony:
1 5 i 1 8 zasada zach energii, e kinetyczna i potencjalna
16 Zasada równoważności energii kinetycznej i pracy
zasada ekwipartycji energii
Energia i jej rodzaje - zasada zachowania energii, Fizyka
08 Zasada zachowania energii
RACHUNEK CAŁKOWY. CAŁKA OZNACZONA I JEJ ZASTOSOWANIA, SZKOŁA, Matematyka, Matematyka
Sól Epsom i jej zastosowanie w kosmetyce
6 Pochodna i jej zastosowanie
Dioda-wiad ogolne, Szkoła, Politechnika 1- 5 sem, SEM IV, Elektronika i Energoelektronika. Laborator
Analiza korespondecji i jej zastosowania w naukach społecznych
energia kinetyczna zadania, BUDOWNICTWO, Inżynierka, semestr 2, Fizyka
Ściaga długopis, Energia cieplna - energia kinetyczna drobin Energia wewnętrzna - suma energi kine
Mechatronika, Turbina wiatrowa, Turbina wiatrowa - urządzenie zamieniające energię kinetyczną wiatru
REF-MAT., MATEMATYCZNA TEORIA STEROWANIA I JEJ ZASTOSOWANIE.
więcej podobnych podstron