
UNIWERSYTET GDA
Ń
SKI
Katedra Chemii Ogólnej i Nieorganicznej
CHEMIA NIEORGANICZNA
K
IERUNEK
:
OCHRONA
Ś
RODOWISKA –
STUDIA I STOPNIA
(3-
LETNIE
-
LICENCJACKIE
)
(ćwiczenia laboratoryjne)
Ć
wiczenia laboratoryjne odbywają się raz w tygodniu. Program ćwiczeń
laboratoryjnych realizowany jest na podstawie instrukcji i obejmuje zestaw 10 ćwiczeń
laboratoryjnych z zakresu chemii nieorganicznej (nr 2-11) oraz spotkanie dotyczące spraw
organizacyjnych (45 min. na początku semestru). Ćwiczenia 2-10 trwają się z 2 h i 15 minut,
a ćwiczenie 11 trwa 1 h 30 minut. W ramach ćwiczeń laboratoryjnych z chemii
nieorganicznej studenci będą mieli okazję samodzielnie wykonać kilkadziesiąt ciekawych
doświadczeń.
Laboratorium z chemii nieorganicznej obejmuje następujące ćwiczenia:
1. Spotkanie organizacyjne
2. Podstawowe czynności laboratoryjne
3. Metody oczyszczania i rozdzielania substancji. Roztwory właściwe
4. Podstawowe typy związków nieorganicznych
5. Szybkość reakcji chemicznych i równowaga chemiczna
6. Dysocjacja jonowa
7. Stężenie jonów wodorowych. Wskaźniki pH
8. Roztwory buforowe
9. Protolityczne reakcje jonów w roztworze wodnym
10. Iloczyn rozpuszczalności
11. Podstawy elektrochemii
Ć
wiczenia mają na celu wyrobienie umiejętności samodzielnego eksperymentowania
i rozwiązywania problemów.
Gdańsk 2010

Ćwiczenie 1
SPOTKANIE ORGANIZACYJNE. SZKOLENIE BHP

Ćwiczenie 2
PODSTAWOWE CZYNNOŚCI LABORATORYJNE
1. Proste czynności laboratoryjne
a) przygotowanie roztworu w probówce
Do probówki wsypać szczyptę azotanu(V) miedzi(II). Pipetą miarową odmierzyć
7,5 cm
3
wody destylowanej i przenieść do probówki. Probówkę zamknąć korkiem i
wstrząsając rozpuścić jej zawartość. Uzyskany roztwór zachować do doświadczenia 2a.
b) przygotowanie roztworu nasyconego w zlewce szklanej
W zlewce o pojemności 50 cm
3
odważyć około 8 g azotanu(V) potasu. Przy pomocy cylindra
miarowego odmierzyć 25 cm
3
wody destylowanej i przenieść do zlewki. Mieszając bagietką
rozpuścić możliwie najdokładniej KNO
3
w wodzie. Zdekantować roztwór znad
nierozpuszczonej pozostałości do drugiej zlewki i pozostawić do doświadczenia 2b.
2. Ogrzewanie i odparowywanie roztworów wodnych
a) w probówce
Do probówki z roztworem uzyskanym w doświadczeniu 1a wrzucić niewielki kawałek
kaolinu. Probówkę ująć w łapę i ogrzewać w nieświecącym płomieniu palnika poruszając
łagodnie probówką ruchem wirowym.
b) w zlewce szklanej
Do zlewki szklanej, z uzyskanym w doświadczeniu 1b nasyconym roztworem KNO
3
, wrzucić
kilka kawałków kaolinu. Zlewkę umieścić na płytce metalowej na trójnogu i ogrzewać
płomieniem palnika odparowując około połowę ilości wody z roztworu. Zawartość zlewki
pozostawić do ostudzenia.
c) w parownicy porcelanowej
Do parownicy porcelanowej wlać około 15 cm
3
wodnego roztworu siarczanu(VI) kobaltu(II).
Ostrożnie odparować do sucha na małym płomieniu palnika.
3. Ważenie
a) Zapoznanie się z głównymi zasadami ważenia na wagach w pracowni laboratoryjnej.
b) Zważyć na wadze dowolny przedmiot (np. szkiełko zegarkowe).
4. Przygotowanie roztworu o określonym stężeniu
a) sporządzenie roztworu chlorku baru o określonym stężeniu (0,25 M)
Obliczoną ilość odczynnika (BaCl
2
·2H
2
O) odważyć na wadze analitycznej i przenieść do
kolby miarowej o pojemności 50 cm
3
przy pomocy suchego lejka szklanego. Spłukać ścianki
lejka wodą destylowaną z tryskawki. Rozpuścić BaCl
2
·2H
2
O poruszając kolbą ruchem
wirowym. Do kolby wprowadzić wodę destylowaną dopełniając ją „pod kreskę” i ponownie
wymieszać roztwór. Poczekać, aż krople wody spłyną ze ścianek kolby i potem dopełnić „do
kreski” (menisk dolny).
b) sporządzenie roztworu kwasu siarkowego(VI) o określonym stężeniu (0,5 M)
Do kolby miarowej o pojemności 100 cm
3
wprowadzić 5 cm
3
wody destylowanej. Obliczoną
ilość stężonego kwasu siarkowego(VI) odmierzyć pipetą miarową i przenieść do kolby.
Spłukać ścianki lejka wodą z tryskawki i dopełnić wodą „pod kreskę” i wymieszać roztwór.

Poczekać, aż krople wody spłyną ze ścianek kolby i potem dopełnić wodą „do kreski”
(menisk dolny).
5. Strącanie osadu siarczanu(VI) baru
Odmierzyć pipetą miarową 20 cm
3
przygotowanego wcześniej roztworu BaCl
2
i przelać do
zlewki o pojemności 250 cm
3
. Dodać 100 cm
3
wody destylowanej i ogrzewać do wrzenia
roztwór na płytce metalowej nad palnikiem. Do gorącego roztworu wlewać przy
jednoczesnym mieszaniu bagietką roztwór kwasu siarkowego(VI) w takiej ilości, aby jego
nadmiar w stosunku do BaCl
2
wynosił 10%.
6. Mycie szkła laboratoryjnego
a) mycie mechaniczne (szczotki do mycia naczyń laboratoryjnych, tryskawki, pompki wodne)
b) mycie chemiczne (kwasy, ługi, rozpuszczalniki, detergenty)
Pytania i zagadnienia
1.
Omówić źródła ciepła stosowane w laboratorium chemicznym.
2.
Omówić typy palników gazowych.
3.
W jakich przypadkach nie można stosować palnika gazowego do ogrzewania?
4.
W jakich naczyniach przeprowadza się ogrzewanie cieczy?
5.
Dlaczego podczas ogrzewania cieczy stosuje się kaolin?
6.
W jaki sposób zabezpiecza się ogrzewany roztwór przed utratą rozpuszczalnika?
7.
Do czego służy łaźnia wodna i w jakich przypadkach się z niej korzysta?
8.
Co to są roztwory mianowane i w jaki sposób przygotowuje się je?
9.
Ile gramów CaCl
2
·6H
2
O należy odważyć, aby przygotować 50 cm
3
0,25 M roztworu?
10.
Wymienić i omówić przeznaczenie naczyń miarowych.
11.
Omówić metody mycia szkła laboratoryjnego.
12.
Zdefiniować pojęcia: roztwór rzeczywisty, roztwór nasycony, roztwór przesycony,
13.
Zdefiniować stężenia: molowe, molalne, normalne, procentowe, ppm, ppb, ułamek
molowy.

Ćwiczenie 3
METODY OCZYSZCZANIA I ROZDZIELANIA SUBSTANCJI. ROZTWORY
WŁAŚCIWE
1. Strącanie osadu fosforanu(V) wapnia
Do 10 cm
3
roztworu węglanu wapnia otrzymanego przez rozpuszczenie stałego CaCO
3
w
zimnej wodzie destylowanej dodać przy jednoczesnym mieszaniu bagietką, 5 cm
3
roztworu
2 M kwasu fosforowego(V). Zlewkę z wytrąconym osadem fosforanu(V) sodu rozlać do
trzech zlewek.
2.Oddzielanie osadu od roztworu
a) dekantacja
Mieszaninę z pierwszej zlewki zdekantować zlewając możliwie najdokładniej roztwór znad
osadu.
b) sączenie pod zmniejszonym ciśnieniem
Mieszaninę z drugiej zlewki przesączyć pod zmniejszonym ciśnieniem przy użyciu kolby
ssawkowej, pompki wodnej i lejka Büchnera. Sączek przyciąć w taki sposób, aby przykrywał
wszystkie otwory lejka, po czym zwilżyć wodą z tryskawki. Sprawdzić czy przylega
dokładnie i rozpocząć sączenie.
c) wirowanie
Zawartość trzeciej zlewki rozlać do probówek wirówkowych, rozmieścić równomiernie w
wirówce w płaszczach zabezpieczających i odwirować.
3. Oddzielanie osadu od roztworu z użyciem filtracji chemicznej
Karbowany sączek umieścić w szklanym lejku i wsypać do niego pięć łyżeczek węgla
aktywnego. Do 100 cm
3
wody w zlewce dodać jedną kroplę atramentu (lub trzy kryształki
manganianu(VII) potasu). Kolorowy roztwór przesączyć przez węgiel aktywny do probówki
umieszczonej w statywie.
4. Oczyszczanie substancji przez rozpuszczanie i krystalizację
Do roztworu, otrzymanego przez rozpuszczenie 8 g azotanu(V) potasu w 50 cm
3
wody
wsypać ok. 1 g piasku. Po paru minutach energicznego mieszania mieszaninę przesączyć
przez sączek karbowany do zlewki. Klarowny przesącz ogrzewać w zlewce do około
odparowania połowy rozpuszczalnika i pozostawić do krystalizacji.
5. Oczyszczanie jodu przez sublimację (Uwaga! Doświadczenie należy wykonać pod
wyciągiem!)
Do suchej, czystej zlewki o pojemności 200 cm
3
wsypać ok. 1 g jodu zanieczyszczonego
piaskiem. Zlewkę postawić na płytce metalowej umieszczonej na trójnogu. Okrągłodenną
kolbę o pojemności 250 cm
3
napełnić zimną wodą i umieścić na zlewce z jodem. Ogrzewać
słabym płomieniem palnika. Obserwować uważnie zmiany stanów skupienia jodu. Zebrać
ostrożnie oczyszczony jod z powierzchni kolby i przenieść do słoika.
6. Ekstrakcja
Do rozdzielacza o poj. 100 cm
3
wlać 10 cm
3
wodnego roztworu jodu w jodku potasu i
następnie 10 cm
3
chloroformu. Zamknąć rozdzielacz korkiem szlifowym i wytrząsać
zawartość przez około 2 min. W trakcie wytrząsania otworzyć kilkakrotnie kran rozdzielacza

w celu wyrównania ciśnienia. Oddzielić warstwę organiczną. Do warstwy wodnej (w
rozdzielaczu) wlać świeżą porcję chloroformu i powtórzyć wytrząsanie. Ekstrakcję prowadzić
do momentu uzyskania bezbarwnej warstwy wodnej.
7. Destylacja
Zbudować zestaw do destylacji składający się z kolby okrągłodennej, płaszcza elektrycznego,
nasadki destylacyjnej z termometrem 0-100
o
C, chłodnicy i odbieralnika. Do kolby wlać około
500 cm
3
wody morskiej, wrzucić kilka kawałów kaolinu i ogrzewać. Przerwać ogrzewanie,
zanim roztwór całkowicie odparuje! Po zakończeniu destylacji wykonać próbę na obecność
jonów chlorkowych i siarczanowych(VI) w wodzie przed i po destylacji.
8. Chromatografia
Do komory chromatograficznej (lub cylindra miarowego albo wysokiej zlewki) wlać
mieszaninę (1:1) rozcieńczonego kwasu octowego i etanolu. Wyciąć pasek bibuły mieszczący
się w cylindrze, ale nie dotykający ścian. Na jednym końcu paska, w odległości 2 cm od dołu
narysować kropkę kolorowym pisakiem (np. czarnym, brązowym, zielonym). Plamkę
wysuszyć. Drugi koniec paska zagiąć w odległości ok. 2 cm od końca i zamocować na
szklanym pręciku. Bibułę wsunąć do cylindra tak, aby jej koniec na którym jest plamka
zanurzył się w cieczy na głębokość ok. 1 cm. Naczynie przykryć. Gdy front rozpuszczalnika
przesunie się prawie do końca, bibułę wyjąć i wysuszyć. Określić wartości współczynników
R
f
składników analizowanej mieszaniny.
Pytania i zagadnienia
1.
Omówić metody oddzielania osadu od roztworu.
2.
Kiedy przeprowadza się sączenie pod zmniejszonym ciśnieniem? W jaki sposób wytwarza
się podciśnienie?
3.
Dlaczego proces strącania przeprowadza się na gorąco i wobec nadmiaru odczynnika
strącającego?
4.
Wymienić metody rozdzielania mieszanin.
5.
Wytłumaczyć jakie różnice właściwości składników wykorzystuje się w poszczególnych
metodach rozdzielania mieszanin.
6.
Wyjaśnić znaczenie terminów: filtracja, przesącz, pozostałość, destylacja, destylat, pogon,
odparowanie, krystalizacja, rozwarstwienie, ekstrakcja, desaturacja, sedymentacja,
dekantacja, sublimacja, adsorbent, adsorpcja.
7.
W jakim celu stosuje się chromatografię?
8.
Zdefiniować pojęcia: roztwór rzeczywisty, roztwór nasycony, roztwór przesycony,
rozpuszczalność.
9.
Zmiana jakich parametrów prowadzi do przejścia od roztworu nienasyconego do
nasyconego i odwrotnie?
10.
Jak zależy rozpuszczalność ciał stałych od temperatury?
11. Rozpuszczalność chlorku sodu w temperaturze 20
o
C wynosi 36 g/100 g wody. Obliczyć
stężenie procentowe i molalne roztworu.
11.
Zdefiniować pojęcia: rozpuszczalność, roztwór nasycony, roztwór przesycony.
12.
Jak przeprowadzić roztwór w roztwór nasycony i odwrotnie?
13.
Rodzaje oddziaływań międzycząsteczkowych.

Ćwiczenie 4
PODSTAWOWE TYPY ZWIĄZKÓW NIEORGANICZNYCH
1. Otrzymywanie i właściwości tlenków
1.1. Spalanie magnezu w powietrzu i identyfikacja produktu reakcji
Kawałeczek wstążki magnezowej zapalić wprowadzając ją na chwilę do płomienia palnika.
Następnie palący się magnez wprowadzić do zlewki lub cylindra. Do uzyskanego białego
produktu dodać kilka cm
3
wody, wymieszać i sprawdzić odczyn roztworu dodając kilka
kropli fenoloftaleiny.
1.2. Spalanie siarki w powietrzu i identyfikacja właściwości powstałego tlenku (Uwaga!
Doświadczenie należy wykonać pod wyciągiem!)
Niewielką ilość sproszkowanej siarki umieścić na łyżeczce do spalań, zapalić w płomieniu
palnika i szybko wsunąć łyżeczkę do cylindra do zbierania gazów, przykrytego szkiełkiem
zegarkowym. Ostrożnie powąchać powstający gaz, dodać do cylindra trochę wody i
wytrząsnąć zawartość do rozpuszczenia się gazu. Następnie dodać kilka kropli oranżu
metylowego lub błękitu bromotymolowego.
1.3. Otrzymywanie tlenku miedzi(II) przez rozkład wodorotlenku
Do kilku cm
3
2 M roztworu siarczanu(VI) miedzi(II) dodawać 2 M roztworu NaOH do
wytrącenia niebieskiego osadu wodorotlenku miedzi(II). Następnie zawartość probówki
ogrzać lekko w płomieniu palnika zwracając uwagę na zmianę barwy osadu.
1.4. Otrzymywanie tlenków przez rozkład soli (Uwaga! Doświadczenie należy wykonać
pod wyciągiem!)
Niewielką ilość stałego azotanu(V) ołowiu, Pb(NO
3
)
2
, wsypać do probówki i ogrzać w
płomieniu palnika do rozkładu związku. Zwrócić uwagę na barwy powstających tlenków:
NO
2
i PbO. Do probówki wsunąć lekko tlące się łuczywko w celu identyfikacji obecności
tlenu.
2. Kwasy. Niektóre metody otrzymywania
2.1. Reakcja tlenku kwasowego z wodą
Do probówki zawierającej kilka cm
3
wody destylowanej wsypać szczyptę P
4
O
10
(ostrożnie –
reakcja silnie egzotermiczna). Wymieszać bagietką i po całkowitym
rozpuszczeniu osadu
rozlać roztwór do dwóch probówek. Do każdej z nich dodać po 2 krople
następujących
wskaźników: błękitu bromotymolowego i oranżu metylowego. Zanotować
barwę roztworów.
2.2. Otrzymywanie kwasów z ich soli
Do dwóch probówek wsypać niewielką ilość: do pierwszej węglanu sodu, a do drugiej octanu
sodu. Do każdej dodać po około 3 cm
3
2 M roztworu kwasu siarkowego(VI). Zawartość
drugiej probówki ogrzać. Zwrócić uwagę na intensywność wydzielania się gazu w pierwszej
probówce i ostrożnie powąchać substancję wydzielającą się w drugiej probówce.

3. Wodorotlenki. Wybrane metody otrzymywania
3.1. Reakcja metalu z wodą
Do wysokiej zlewki o pojemności 200 cm
3
wlać około 50 cm
3
wody i wrzucić świeżo
odkrojony, wielkości małego ziarna grochu, kawałek sodu. Za pomocą błękitu
bromotymolowego i fenoloftaleiny sprawdzić odczyn roztworu.
3.2. Reakcja tlenku zasadowego z wodą
Do probówki wsypać szczyptę tlenku baru, dodać 5 cm
3
wody i wymieszać. Wybranym
wskaźnikiem sprawdzić odczyn roztworu.
3.3. Otrzymywanie wodorotlenków z soli
Do trzech probówek wlać po około 3 cm
3
roztworu chlorku żelaza(III), chlorku glinu i
azotanu(V) magnezu. Do każdej probówki dodawać kroplami 2 M roztworu NaOH do
wytrącenia osadu. Probówki zawierające osady wodorotlenków glinu i magnezu pozostawić
do doświadczenia 3.4.
3.4. Badanie amfoteryczności wodorotlenków
Otrzymane w poprzednim doświadczeniu osady wodorotlenków glinu i magnezu oddzielić od
roztworów przez odwirowane. Każdy z osadów podzielić na dwie części. Do jednej dodać
2 M roztwór HCl, do drugiej 4 M roztwór NaOH, do rozpuszczenia osadów.
4. Sole. Niektóre metody otrzymywania soli
4.1. Reakcja kwasu z zasadą
Do około 2 cm
3
0,1 M roztworu wodorotlenku baru dodać kilka cm
3
2 M roztworu H
2
SO
4
.
4.2. Reakcja tlenku zasadowego z kwasem
Do dwóch probówek wsypać kolejno niewielkie ilości tlenku miedzi(II) i tlenku kobaltu(II), a
następnie dodać kilka cm
3
2 M roztworu kwasu azotowego(V). Zawartość ogrzać zwracając
uwagę na barwę otrzymanych roztworów.
4.3. Reakcja metalu z kwasem (Uwaga! Doświadczenie należy wykonać pod wyciągiem!)
Do dwóch probówek wsypać nieco sproszkowanej miedzi, a następnie dodać do pierwszej z
nich 2 M roztworu HCl, do drugiej 2 M HNO
3
. Zawartość probówek lekko ogrzać. Zwrócić
uwagę na różnicę w zachowaniu się miedzi wobec obu kwasów.
4.4. Reakcja między dwiema solami
Do probówki zawierającej około 2 cm
3
roztworu Pb(NO
3
)
2
dodać kilka kropli roztworu jodku
potasu.
4.5. Otrzymywanie wodorosoli
Do probówki wlać około 2 cm
3
nasyconego roztworu wodorotlenku wapnia, wrzucić kilka
kryształków „suchego lodu” (stały CO
2
) lub wprowadzić gazowy CO
2
(z butli) do wytrącenia
osadu. Do otrzymanego osadu dodać kolejną porcję CO
2
doprowadzając do rozpuszczenia
osadu. Uzyskany roztwór ogrzać obserwując ponowne tworzenie się osadu.

Pytania i zagadnienia
1.
Opisać równaniami reakcji chemicznych wykonane doświadczenia podając jednocześnie
barwę roztworów, otrzymanych osadów i inne zaobserwowane zjawiska.
2.
Podać co najmniej po pięć przykładów tlenków metali o właściwościach: zasadowych,
amfoterycznych i kwasowych.
3.
Podzielić następujące tlenki według ich charakteru chemicznego podając odpowiednie
reakcje chemiczne: N
2
O
3
, Na
2
O NO
2
, CuO, MgO, Cr
2
O
3
, SnO, I
2
O
5
, CrO
3
, CO, B
2
O
3
,
Mn
2
O
7
, Bi
2
O
3
.
4.
Podać zapis reakcji spalania wapnia, fosforu i żelaza w tlenie. Czy każdy z otrzymanych
tlenków reaguje z wodą? Podać reakcje i określić odczyn wodnych roztworów.
5.
Jak zmienia się charakter chemiczny tlenków pierwiastków V grupy głównej układu
okresowego na: (a) III stopniu utlenienia, (b) V stopniu utlenienia. W uzasadnieniu podać
równania odpowiednich reakcji chemicznych.
6.
Zilustrować przykładami zmianę charakteru chemicznego tlenków tego samego
pierwiastka ze zmianą jego stopnia utlenienia.
7.
Podać równania reakcji chemicznych świadczące o tym, że NO
2
jest tlenkiem kwasowym,
CaO tlenkiem zasadowym, a Al
2
O
3
wykazuje właściwości amfoteryczne.
8.
Zilustrować reakcjami metody otrzymywania kwasów, podając po dwa przykłady dla
każdej z metod.
9.
W jaki sposób otrzymać kwas krzemowy z SiO
2
?
10.
Jakie czynniki wpływają na moc kwasów (przykłady)?
11.
W podanych parach kwasów i zasad zaznaczyć, który(a) jest mocniejszy(a): HClO
2
-
HClO
3
, H
2
SO
3
– HNO
3
, Fe(OH)
2
- Fe(OH)
3
, HCl - HBr, NaOH - Mg(OH)
2
, Ca(OH)
2
-
Ba(OH)
2
, H
3
PO
4
– HNO
3
, KOH – CsOH. Uzasadnić wybór.
12.
Jak zmienia się moc zasadowa wodorotlenków tej samej grupy oraz tego samego okresu
(przykłady)?
13.
Zilustrować równaniami reakcji chemicznych metody otrzymywania wodorotlenków.
14.
Wymienić znane wodorotlenki o charakterze amfoterycznym. Dla dwóch z nich podać
reakcje potwierdzające te właściwości.
15.
Podać wszystkie możliwe reakcje otrzymywania następujących soli: CuSO
4
, Zn(NO
3
)
2
,
MgCl
2
.
16.
Wymienić trudno rozpuszczalne w wodzie: siarczany(VI), węglany, chlorki i siarczki.
17.
Jakie nowe sole można otrzymać mając do dyspozycji: AgNO
3
, CuSO
4
, Na
3
PO
4
, BaCl
2
i
K
2
CO
3
. Podać cząsteczkowe i jonowe zapisy zachodzących reakcji.
18.
Podać po pięć sposobów – równania reakcji chemicznych − otrzymywania chlorków,
azotanów(V), siarczanów(VI) i ortofosforanów(V) różnych pierwiastków.
19.
Dlaczego entalpia zobojętniania dowolnego mocnego kwasu dowolną mocną zasadą jest
jednakowa? Jaka jest jej wartość?
20.
Podać po dwa przykłady reakcji roztwarzania metali w kwasach nieutleniających i
utleniających.
21.
Podać (wraz z komentarzem) zapisy reakcji zachodzących podczas stopniowego
wprowadzania CO
2
do roztworu Ca(OH)
2
na zimno i po ogrzaniu.
22.
Jak można ortofosforan(V) wapnia przeprowadzić w diwodoroortofosforan(V) wapnia?
Podać równania reakcji.
23.
Jak można hydroksoazotan(V) magnezu przeprowadzić w azotan(V) magnezu? Podać
równania reakcji.
24.
Napisać równania reakcji: Pb(NO
3
)
2
, Na[Cr(OH)
4
], K
2
CrO
4
i Al(OH)SO
4
z wodnym
roztworem kwasu siarkowego(VI).

25.
Napisać równania reakcji: Al, ZnSO
4
, NH
4
NO
3
, NO
2
i NaH
2
PO
4
z wodnym roztworem
wodorotlenku potasu (nadmiar !).
26.
Napisać równania reakcji: Zn, ZnO i Zn(OH)
2
z wodnymi roztworami wodorotlenku sodu
i kwasu solnego.
27.
Spośród poniższych reakcji wybrać te, które rzeczywiście zachodzą i podać dla nich pełny
zapis cząsteczkowy i jonowy:
a) CuSO
4
+ NaOH (nadmiar)
f) NH
4
Cl + Ca(OH)
2
b) Na
2
SiO
3
+ CO
2
+ H
2
O
g) Cl
2
+ KOH
c) Ag + HCl (rozc.)
h) FeSO
4
+ Cu
d) Zn + HNO
3
(rozc.)
i) Na
3
PO
4
+ CaCl
2
e) CrO
3
+ SO
3
j) Mn
2
O
7
+ KOH
28.
W pięciu probówkach znajdują się rozcieńczone roztwory: CuSO
4
, AgNO
3
, HCl, NaOH i
ZnCl
2
. Jak je rozróżnić bez użycia wskaźników pH i innych odczynników?
29.
Ułożyć równania reakcji, za pomocą których można dokonać następujących przemian:
Ca → CaO → Ca(OH)
2
→
CaCO
3
→ Ca(HCO
3
)
2
→ CaCO
3
30.
W jaki sposób można otrzymać: (a) wodorotlenek żelaza(III) z żelaza, (b) wodorotlenek
miedzi(II) z metalicznej miedzi ? Podać równania odpowiednich reakcji chemicznych.
31.
Podać wzory i nazwy chemiczne następujących związków: sól kuchenna, soda
oczyszczona, soda żrąca, sól gorzka, lapis, szkło wodne, saletra chilijska, salmiak, wapno
palone, wapno gaszone, siny kamień, sól glauberska, potaż.
32.
Ile gramów MgS powstanie w reakcji 6 g Mg i 6 g S, przy założeniu 100% wydajności
reakcji?
33.
2,3 g metalicznego sodu wrzucono do 50 g wody. Obliczyć stężenie procentowe
otrzymanego roztworu wodorotlenku sodu.
34.
Do 100 cm
3
0,1 M roztworu H
3
PO
4
dodano:(a) 0,8 g NaOH, (b) 0,31g Na
2
O, (c) 30 cm
3
1
M roztworu NaOH, (d) 0,345 g metalicznego Na. Jakie sole otrzymano w poszczególnych
przypadkach? Podać odpowiednie obliczenia i zapisy równań reakcji.
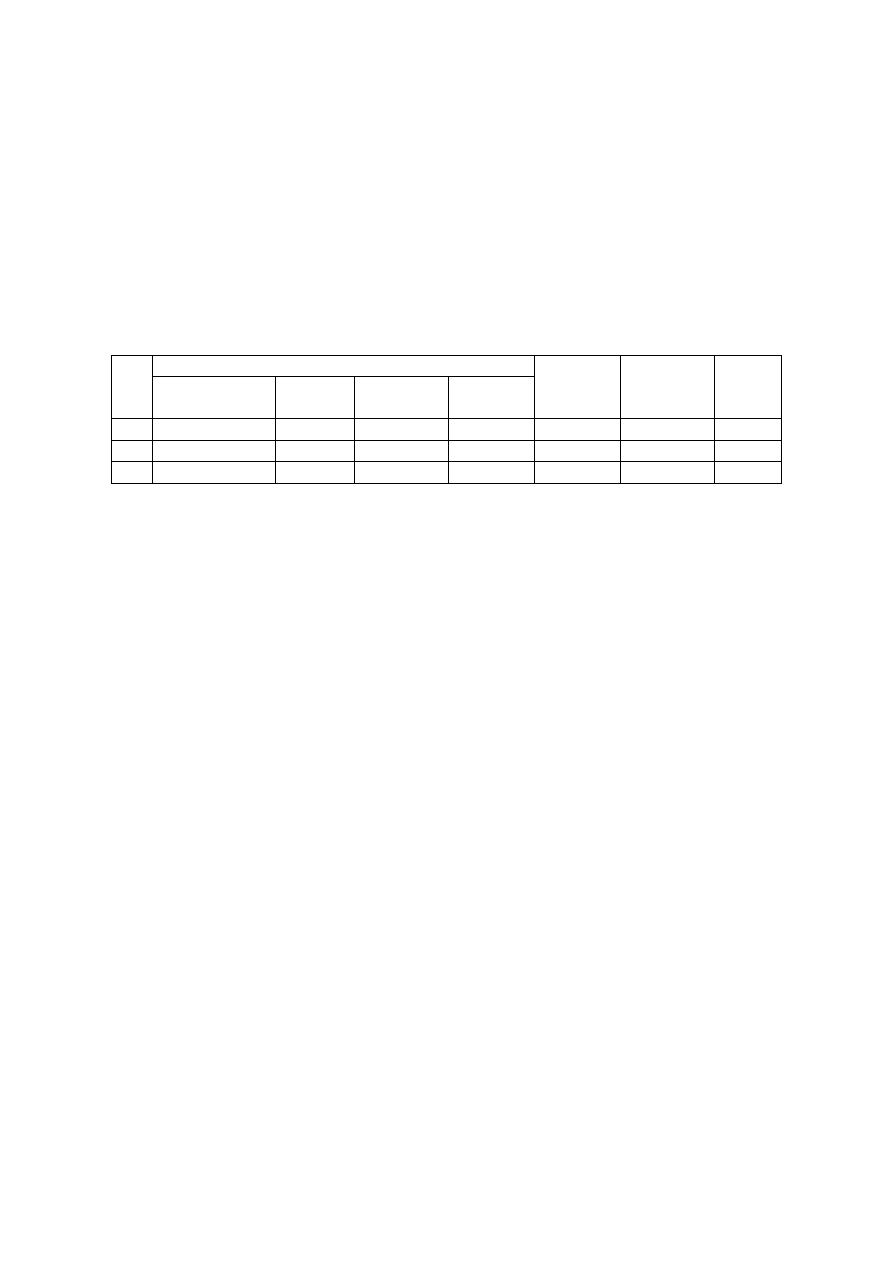
Ćwiczenie 5
SZYBKOŚĆ REAKCJI CHEMICZNYCH I RÓWNOWAGA CHEMICZNA
1. Zależność szybkości reakcji od stężenia substancji reagujących
(badanie kinetyki reakcji Landolta)
W zlewkach o pojemności 50 cm
3
przygotować roztwory zawierające jodan(V) potasu, kwas
siarkowy(VI) i skrobię w ilościach podanych w poniższej tabeli. Cylindrem miarowym
odmierzyć 5 cm
3
siarczanu(IV) sodu, wlać do mieszaniny w zlewce, szybko wymieszać i
odmierzać czas aż do momentu pojawienia się granatowego zabarwienia. Czynności wykonać
dla wszystkich podanych roztworów zawierających różne stężenia jodanu(V) potasu.
Lp
.
Zawartość zlewki
0,01 M
Na
2
SO
3
c
KIO3
[mol/dm
3
]
czas
[s]
0,02 M KIO
3
woda
0,5 M
H
2
SO
4
skrobia
1
5 ml
30 ml
1 ml
0,5 ml
5 ml
2
10 ml
25 ml
1 ml
0,5 ml
5 ml
3
15 ml
20 ml
1 ml
0,5 ml
5 ml
2. Wpływ temperatury na szybkość reakcji chemicznych
a) 3 g NH
4
Cl rozpuścić w ciepłej wodzie, w małej zlewce, używając do tego celu 10 cm
3
wody. Analogicznie przygotować roztwór zawierający 4 g NaNO
2
, rozpuszczając go w 10
cm
3
wody. Odmierzyć po 3 cm
3
każdego z roztworów i wlać je do probówki z korkiem, lekko
wstrząsnąć jego zawartość i pozostawić otwierając korek.
b) Powtórzyć doświadczenie zlewając takie same objętości substratów, ogrzane uprzednio do
temperatury 70
o
C. Zaobserwować zmianę w intensywności wydzielania gazowego produktu
reakcji, wywołaną podwyższeniem temperatury reakcji.
3. Wpływ katalizatora na szybkość reakcji chemicznych
a) kataliza heterogeniczna
Do trzech probówek nalać ostrożnie perhydrolu (30% H
2
O
2
) do 1/3 objętości. Do pierwszej z
probówek wrzucić grudkę braunsztynu, do drugiej nieco węgla aktywnego, w trzeciej
zostawić dla porównania sam perhydrol. Sprawdzić żarzącym się łuczywkiem intensywność
wydzielania się gazu.
4. Wpływ temperatury na równowagę chemiczną reakcji
Do dwóch probówek wlać po 1 cm
3
1 M roztworu CoCl
2
w 3 M roztworze NaCl. Jedną
probówkę pozostawić jako porównawczą, drugą ogrzać w płomieniu palnika – do zmiany
barwy z żółtej na niebieską. Następnie probówkę tę ochłodzić i porównać zabarwienie
ochłodzonego roztworu z barwą roztworu nie ogrzewanego.
5. Wpływ zmiany stężeń substancji na stan równowagi chemicznej - równowaga między
jonami chromianowymi i dichromianowymi
Do probówki wlać około 1 cm
3
0,5 M roztworu K
2
CrO
4
i dodać kilka kropli 1 M roztworu
H
2
SO
4
do zmiany barwy z żółtej na pomarańczową. W drugiej probówce przeprowadzić
reakcję odwrotną, tzn. do roztworu K
2
Cr
2
O
7
o stężeniu 0,5 M dodawać roztworu NaOH do
zmiany barwy.

6. Wpływ wydzielania się produktów trudno rozpuszczalnych, łatwo lotnych oraz słabo
zdysocjowanych na równowagę reakcji chemicznych
a) powstaje produkt trudno rozpuszczalny
Do dwóch probówek wlać po około 5 cm
3
0,1 M roztworu NaCl. Następnie do pierwszej z
nich dodać około 3 cm
3
0,1 M roztworu KNO
3
, a do drugiej 0,1 M roztworu AgNO
3
.
b) powstaje produkt łatwo lotny
Do około 5 cm
3
1 M Na
2
CO
3
dodać około 2 cm
3
1 M HCl.
c) powstaje produkt słabo zdysocjowany
Przygotować w probówce roztwór octanu sodu. Do tak przygotowanego roztworu dodać 2 M
roztworu kwasu siarkowego(VI). Ostrożnie powąchać zawartość probówki.
7. Reakcja oscylacyjna Briggsa-Rauschera
Przygotować następujące roztwory:
a) w 25 cm
3
wody rozpuścić 0,4 g kwasu malonowego i 0,25 g MnSO
4
·5H
2
O;
b) w 25 cm
3
wody rozpuścić 1,1 g KIO
3
i dodać 2 krople H
2
SO
4(stęż.);
c) do 10 cm
3
30% H
2
O
2
dodać 15 cm
3
0,05 % roztworu skrobi.
W krystalizatorze zmieszać po 10 cm
3
wszystkich roztworów. Po 1-minutowym okresie
wstępnym rozpoczyna się reakcja, której przebieg charakteryzują oscylacje zabarwienia
roztworu: żółty – bezbarwny – niebieski.
Pytania i zagadnienia
1.
Zdefiniować szybkość reakcji chemicznej, od czego zależy jej wartość?
2.
Co to jest stała szybkości reakcji i od czego zależy jej wartość?
3.
Zdefiniować rzędowość i cząsteczkowość reakcji, czy zawsze są one sobie równe?
4.
Nadtlenek wodoru w wodnym roztworze ulega rozkładowi z wydzieleniem tlenu. Określić,
czy szybkość tej reakcji wzrośnie, czy zmaleje, jeżeli:
a) zwiększy się stężenie roztworu
b) ogrzeje się roztwór
c) do roztworu doda się MnO
2
, który jest katalizatorem reakcji rozkładu H
2
O
2
.
5.
Na czym polega rola katalizatora w reakcjach chemicznych?
6.
Które z podanych katalizatorów należy zaliczyć do homogenicznych, a które do
heterogenicznych? Uzasadnić odpowiedź.
a) tlenek wanadu(V), katalizujący utlenianie tlenku siatki(IV) do tlenku siarki(VI)
b) mieszanina tlenku azotu(II) i tlenku azotu(IV), katalizująca utlenianie tlenki siarki(IV)
do tlenki siarki(VI)
c) węgiel aktywny, katalizujący reakcję rozkładu nadtlenku wodoru w roztworze wodnym
d) jodek potasu, katalizujący reakcję rozkładu nadtlenku wodoru w roztworze wodnym
e) nikiel, katalizujący reakcję syntezy amoniaku z pierwiastków
f) złoto, katalizujące reakcję rozkładu gazowego jodowodoru
g) stężony roztwór wodny kwasu siarkowego(VI), katalizujący reakcję estryfikacji etanolu
kwasem octowym
h) platyna, katalizująca reakcję przyłączenia wodoru do etenu
7. Jak, zgodnie z regułą van
’
t Hoffa, zmieni się szybkość reakcji po podwyższeniu
temperatury o 20
o
C?
8. Reakcja syntezy A + 2 B = C przebiega według równania kinetycznego v = k ⋅ cA ⋅ cB.
Początkowe stężenie substratu A wynosi 1 mol⋅dm-3, substratu B – 2 mol⋅dm
-3
, stała
szybkości k = 0,2 s
-1
·mol
-2
·dm
6
. Obliczyć szybkość reakcji: a) w momencie jej

rozpoczęcia; b) po upływie pewnego czasu, gdy stężenie substratu A zmniejszyło się do
0,4 mol·dm
-3
.
9. Kiedy układ osiąga stan równowagi?
10. Co to jest stała równowagi chemicznej i od czego zależy jej wartość?
11. Jakie reakcje można uważać za praktycznie nieodwracalne?
12. W jakich warunkach zmiana ciśnienia wpływa na układ znajdujący się w równowadze?
13. Sformułować zasadę Le Chateliera-Brauna i na jej podstawie wyjaśnić, w jakim kierunku
przesunie się równowaga reakcji: N
2
+ 3 H
2
←
→
2 NH
3
∆
H = - 22 kcal
a) po zwiększeniu ciśnienia wywieranego na reagujący układ
b) po zwiększeniu objętości naczynia
c) po podwyższeniu temperatury
d) po wprowadzeniu katalizatora (Fe z dodatkiem Al)
14. Jak wpłynie: a) zwiększenie ciśnienia, b) podwyższenie temperatury, na równowagę
następujących reakcji:
a)
2 H
2
+ O
2
←
→
2 H
2
O
∆
H < 0
b)
CaCO
3
←
→
CaO + CO
2
∆
H > 0
c)
2 C + O
2
←
→
2 CO
∆
H < 0
15. Określić, jak wpłynie na położenie równowagi poniższej reakcji:
CO
2 (g)
+ H
2
(g)
←
→
CO
(g)
+ H
2
O
(g)
a)
dodanie CO
2
do mieszaniny reakcyjnej
b)
dodanie H
2
do mieszaniny reakcyjnej
c)
dodanie CO do mieszaniny reakcyjnej
d)
dodanie H
2
O do mieszaniny reakcyjnej
e)
usunięcie części CO
2
z mieszaniny reakcyjnej
f)
usunięcie części CO z mieszaniny reakcyjnej
16. Określić w jaki sposób na położenie równowagi reakcji syntezy kwasu węglowego z
tlenku węgla (IV) i wody wpłynie:
a) zagotowanie roztworu
b) zwiększenie ciśnienia tlenku węgla(IV).
17. Określić w której reakcji zwiększenie ciśnienia mieszaniny reakcyjnej spowoduje
zwiększenie wydajności:
a)
synteza chlorowodoru
b)
termiczny rozkład węglanu wapnia
c)
synteza amoniaku
d)
termiczny rozkład jodowodoru

Ćwiczenie 6
DYSOCJACJA JONOWA
1. Przewodnictwo elektryczne jako kryterium podziału substancji na elektrolity i
nieelektrolity
Zbadać konduktometrycznie przewodnictwo roztworów następujących substancji: stęż.
roztworu sacharozy (C
12
H
22
O
11
), 0,1 M HCl, 0,1 M CH
3
COOH, 0,1 M NaOH, 0,1 M NH
3 (aq)
,
0.1 M NaCl. W tym celu zanurzyć do cieczy sondę konduktometryczną, skalibrować przyrząd
i zanotować wartość przewodnictwa. Zbadać także przewodnictwo wody wodociągowej i
wody destylowanej.
UWAGA ! Przed wykonaniem każdego pomiaru, należy pamiętać o przemyciu
i osuszeniu sondy konduktometrycznej!
2. Zależność stopnia dysocjacji elektrolitu od jego stężenia
Do zlewki (100 cm
3
) odmierzyć cylindrem miarowym 20 cm
3
lodowatego kwasu octowego.
Zlewkę postawić na płycie mieszadła elektromagnetycznego i zanurzyć w niej elektrody
węglowe. Sprawdzić intensywność światła żarówki. Następnie odpipetować 10 cm
3
kwasu i
za pomocą pipety dodać tyle samo wody destylowanej. Zawartość zlewki dokładnie
wymieszać i wykonać kolejny pomiar.
3. Wpływ dodatku wspólnych jonów na przesunięcie równowagi dysocjacji słabego
elektrolitu w roztworze wodnym
a) wpływ soli słabego kwasu na dysocjację tego kwasu
Do probówki wlać 5 cm
3
0,1 M roztworu CH
3
COOH a następnie dodać 2 krople oranżu
metylowego. Zawartość probówki podzielić na dwie równe części. Jedną probówkę
pozostawić jako kontrolną, do drugiej wsypać niewielką ilość octanu sodu (stałego)
zamieszać roztwór bagietką. Porównać zabarwienie otrzymanego roztworu z zabarwieniem
roztworu w probówce kontrolnej.
b) wpływ soli słabej zasady na dysocjację tej zasady
Do probówki wlać 5 cm
3
0,1 M roztworu amoniaku, a następnie dodać 2 krople
fenoloftaleiny. Jedną probówkę z zasadą pozostawić jako kontrolną, do drugiej wsypać
niewielką ilość chlorku amonu i zamieszać roztwór bagietką. Porównać zabarwienie
otrzymanego roztworu z zabarwieniem roztworu w probówce kontrolnej.
4. Wpływ rodzaju rozpuszczalnika na wartość stopnia dysocjacji
Stosując zestaw z żarówką i sondę sprawdzić, przewodzenie prądu gotowych roztworów
chlorowodoru w wodzie, metanolu i toluenie.
5. Reakcje jonowe z utworzeniem słabych elektrolitów
Do probówki wlać 1 cm
3
1 M NH
4
Cl. Następnie dodawać kroplami 1 cm
3
1,0 M NaOH.
Delikatnie sprawdzić zapach wydzielającego się w probówce gazu (zawartość probówki
można lekko podgrzać umieszczając ją w łaźni wodnej). Do wylotu probówki zbliżyć
zwilżony wodą uniwersalny papierek wskaźnikowy (nie dotykać papierkiem ścianek
probówki). Obserwować barwę papierka.

Pytania i zagadnienia
1.
Podać podstawowe założenia teorii dysocjacji elektrolitycznej Arrheniusa.
2.
Jakie są doświadczalne dowody występowania jonów w roztworach?
3.
Wymienić czynniki wpływające na stopień dysocjacji elektrolitu.
4.
Wyjaśnić zmianę przewodnictwa kwasu octowego w miarę dodawania do niego wody.
5.
Zdefiniować stałą dysocjacji oraz podać od jakich czynników zależy jej wartość.
6.
Do dwóch probówek, zawierających roztwór kwasu octowego dodano: do pierwszej –
wody, do drugiej – roztworu HCl. Jak wpłynie to na stopień i stałą dysocjacji kwasu
octowego?
7.
Podać równania dysocjacji kwasu siarkowodorowego oraz wyrażenia na kolejne stałe
dysocjacji. Uszeregować występujące w roztworze jony według malejącej wartości ich
stężeń.
8.
Wyprowadzić zależność pomiędzy stopniem dysocjacji, stałą dysocjacji i stężeniem
elektrolitu.
9.
Kryterium podziału elektrolitów na mocne i słabe.
10.
Dlaczego w przypadku mocnych elektrolitów wprowadzono pojęcie aktywności?
11.
W wodnym roztworze kwasu HA stężenie jonów H
3
O
+
wynosi 0,3 M, zaś stężenie
cząsteczek niezdysocjowanych kwasu wynosi 1,7 M. Obliczyć stopień i stałą dysocjacji
kwasu.
12.
Obliczyć stężenie jonów wodorotlenowych w 0,01 M roztworze słabej zasady, której stała
dysocjacji wynosi 1,75·10
-5
.
13.
Obliczyć stężenie jonów H
3
O
+
w 0,01 M roztworze kwasu solnego i 0,05 M roztworze
kwasu octowego.
14.
Czym należy tłumaczyć duże przewodnictwo roztworów wodnych HCl i NaOH?
15.
Zapisać jonowo reakcje zachodzące po zmieszaniu wodnych roztworów:
a)
(NH
4
)
2
SO
4
+ NaOH
b)
K
2
CO
3
+ HCl
c)
NH
3
+ CH
3
COOH
16.
Przy jakim stężeniu roztworu stopień dysocjacji kwasu azotowego(III) będzie równy 0,1?
17.
Omówić wpływ wspólnych jonów na dysocjację słabych elektrolitów.
18.
Wskazać, które z wymienionych substancji są elektrolitami i podać równania ich
dysocjacji: Na
3
PO
4
, NaOH, CH
3
COOH, FeCl
3
, Cu(NO
3
)
2
, NH
3
, HNO
3
, H
2
SO
4
, H
3
PO
4
,
C
6
H
6
, C
6
H
12
O
6
, CH
3
COONH
4
, (NH
4
)
2
SO
4
.
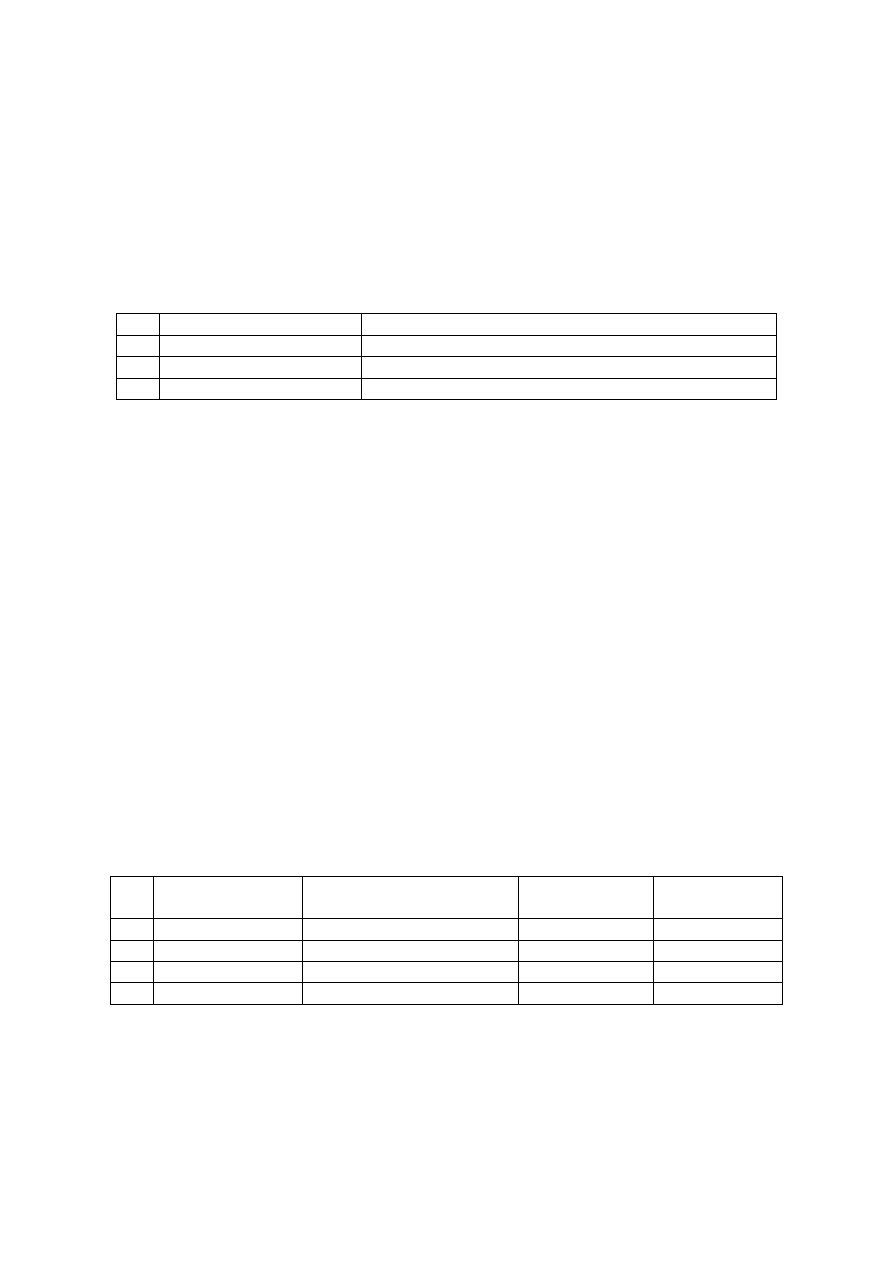
Ćwiczenie 7
STĘśENIE JONÓW WODOROWYCH. WSKAŹNIKI pH
1. Badanie zmiany barwy wskaźników w roztworach o różnych wartościach pH
Do trzech probówek wlać po około 2 cm
3
roztworu wzorcowego o znanym pH. Do każdej z
nich dodać dwie krople następujących wskaźników: oranż metylowy, błękit bromotymolowy,
fenoloftaleina. Zanotować barwę wskaźników. Porównać uzyskane wyniki z wartościami pH
zawartymi w poniższej tabeli:
Lp.
Wskaźnik
Barwa
1.
Oranż metylowy
Czerwona gdy pH < 3,2 śółta gdy pH > 4,5
2.
Błękit bromotymolowy
ś
ółta gdy pH < 6 Niebieska gdy pH > 7,6
3.
Fenoloftaleina
Bezbarwna gdy pH < 8,2 Malinowa gdy pH > 10
2. Sprawdzanie odczynu wybranych roztworów
Do ośmiu ponumerowanych probówek dodać kolejno po 1 cm
3
następujących roztworów: 0,1
M HCl; 0,1 M CH
3
COOH; 0,1 M NaCl; H
2
O (destylowana); 0,1 M NH
3 (aq)
; 0,1 M NaOH; 0,1
M NH
4
Cl; 0,1 M K
2
CO
3
. Przygotować osiem papierków wskaźnikowych. Z każdej probówki
pobrać dobrze opłukaną i osuszoną bagietką kropelkę roztworu i zwilżyć nią jeden papierek
wskaźnikowy. Zanotować zabarwienie papierka.
3. Oznaczanie pH roztworów
Określić wartość pH roztworu otrzymanego od prowadzącego ćwiczenia stosując metodę
opisaną w doświadczeniu 1.
3. Oznaczanie wartości pH roztworów z zastosowaniem pehametru
Należy zmierzyć pH następujących roztworów:
1) 0,1 M roztworu kwasu chlorowodorowego otrzymanego z roztworu stężonego
(36%, d = 1,18 g/cm
3
),
2) 0,1 M roztworu wodorotlenku sodu otrzymanego ze stałego NaOH,
3) 0,1 M roztworu kwasu octowego – użyć gotowego roztworu,
4) 0,1 M roztworu amoniaku – użyć gotowego roztworu.
Orientacyjną wartość pH określić papierkiem uniwersalnym. Następnie zmierzyć pH za
pomocą pehametru wyposażonego w elektrodę kombinowaną. Uzyskane wyniki, łącznie z
wartościami wynikającymi z obliczeń zestawić w tabeli:
Lp.
Odczynnik
pH określone papierkiem
uniwersalnym
pH zmierzone
pehametrem
pH obliczone
1.
0,1 M HCl
2.
0,1 M NaOH
3.
0,1M CH
3
COOH
4.
0,1 M NH
3
4. Badanie zmiany pH podczas miareczkowania mocnej zasady mocnym kwasem
Odmierzyć 25 cm
3
0,1 M roztworu NaOH i przenieść do zlewki o pojemności 100 cm
3
.
Następnie dodać do tego roztworu kilka kropli fenoloftaleiny i umieścić zlewkę na mieszadle
magnetycznym. W roztworze zanurzyć elektrodę kombinowaną połączoną z pehametrem.
Biuretę napełnić 0,1 M roztworem HCl. Miareczkować, aż do zobojętnienia (barwa
wskaźnika zaniknie). Po uzyskaniu zobojętnienia miareczkować dalej, aż do wprowadzenia

20% nadmiaru HCl (w stosunku do stechiometrycznej ilości miareczkowanej zasady).
Zmiany pH podczas miareczkowania przedstawić graficznie jako wykres zależności pH
roztworu od objętości wprowadzonego kwasu (krzywa miareczkowania).
5. Oznaczanie pehametrem pH kilku produktów żywnościowych
Do zlewek o pojemności 100 cm
3
wlać do połowy jej wysokości kilka wybranych, aktualnie
dostępnych w laboratorium, produktów (napój Coca Cola, ocet spożywczy, sok jabłkowy,
kawa, piwo, woda gazowana) i pehametrem zmierzyć ich wartość pH.
6. Oznaczanie pH preparatu kosmetycznego (szamponu do włosów, mydła do rąk lub
żelu pod prysznic)
Otrzymany kosmetyk rozcieńczyć wodą i wlać po około 2 cm
3
do dziesięciu probówek. Do
każdej z nich dodać kilka kropli następujących wskaźników: błękit tymolowy, żółcień
metylowa, błękit bromofenolowy, oranż metylowy, czerwień metylowa, lakmus, błękit
bromotymolowy, czerwień obojętna, fenoloftaleina, tymoloftaleina. Zanotować barwę
otrzymanych roztworów i przybliżoną wartość pH. Wyznaczyć pH otrzymanego preparatu
kosmetycznego.
7. Naturalne wskaźniki
a) liście czerwonej kapusty
Do każdej z sześciu probówek z roztworami 0,1 M HCl; 0,1 M CH
3
COOH; 0,1 M NaCl; H
2
O
(destylowana); 0,1 M NH
3 (aq)
; 0,1 M NaOH dodać po skrawku ugotowanego liścia czerwonej
kapusty. Porównać zmiany zabarwienia liści czerwonej kapusty w kwasach i zasadach.
Ocenić czy liście czerwonej kapusty mogą być wskaźnikami mocy kwasów i zasad.
b) esencja herbaciana
Do trzech probówek wlać po 2 cm
3
esencji herbacianej. Do jednej z nich dodać 4 krople
0,1 M CH
3
COOH, do drugiej dodać 4 krople 0,1 M roztworu NaOH, zawartość trzeciej
probówki pozostawić bez zmian. Wyjaśnić zmiany zabarwienia esencji z herbaty po dodaniu
kwasu i zasady.
Pytania i zagadnienia
1.
Co to jest iloczyn jonowy wody i od czego zależy jego wartość?
2.
Co to jest pH roztworu? Dlaczego zakres pH dla roztworów wodnych wynosi 0 – 14?
3.
Co to są wskaźniki pH? Co rozumie się pod pojęciem zakresu zmiany barwy wskaźnika?
4.
Wymienić najczęściej stosowane wskaźniki pH. Podać mechanizm ich działania.
5.
Obliczyć stężenie jonów wodorowych w roztworze, w którym stężenie jonów
wodorotlenowych wynosi 3,16·10
-4
, a pKw = 14.
6.
Ustalić jakie zabarwienie występuje w roztworze a) kwasu, b) zasady po dodaniu
wskaźnika typu HInd, którego dysocjacja związana jest z następującymi barwami: (barwa
ż
ółta) HInd = H
+
+ Ind
-
(barwa niebieska).
7.
Obliczyć stężenie jonów wodorowych w roztworze dla którego:
a) pH= 3,92, b) pOH = 5,86.
8.
Który roztwór jest bardziej kwasowy, ten w którym stężenie jonów H
3
O
+
wynosi
7·10
-7
M, czy ten w którym stężenie jonów OH
-
jest równe 3·10
-8
M?
9.
Obliczyć pH następujących roztworów: a) 0,01 M kwasu solnego; b) 0,1 M kwasu
cyjanowodorowego zakładając, że stopień dysocjacji tego kwasu wynosi 0,01%;
c) 0,1 M roztworu kwasu octowego.
10.
Na czym polega potencjometryczne miareczkowanie kwasów i zasad?

11.
Próbkę 5 cm
3
roztworu NaOH rozcieńczono do 100 cm
3
. Na zmiareczkowanie 20 cm
3
otrzymanego roztworu zużyto 12,5 cm
3
0,1 M roztworu HCl. Jakie było stężenie molowe
próbki przed jej rozcieńczeniem?
12.
W roztworze I stężenie jonów wodorotlenowych wynosi 1·10
-4
M, a w roztworze II
1·10
-10
M. W którym roztworze stężenie jonów wodorowych jest większe? Odpowiedź
uzasadnić obliczeniami.

Ćwiczenie 8
ROZTWORY BUFOROWE
1. Bufor octanowy jako przykład buforu typu HA/A
-
a) przygotowanie roztworu buforu octanowego o pH = 4,25
Korzystając z 0,5 M roztworów kwasu octowego i octanu sodu w cylindrze o poj. 50 cm
3
przygotować 40 cm
3
buforu octanowego o pH = 4,25 (stosunek objętości obu roztworów
obliczyć należy z zależności obowiązującej dla buforu typu HA/A
-
). Sprawdzić pH roztworu
poprzez dodanie 10 kropli zieleni bromokrezolowej. Przygotowany, zabarwiony wskaźnikiem
roztwór pozostawić do doświadczenia 1c.
b) równowaga w roztworze buforu octanowego
Do probówki wlać 5 cm
3
0,1 M roztworu kwasu octowego i 5 cm
3
wody, a następnie dodać
2 krople oranżu metylowego. Zawartość probówki starannie wymieszać i podzielić na dwie
równe części. Do pierwszej dodać około 2 cm
3
0,5 M octanu sodu i wymieszać. Drugą
probówkę pozostawić jako punkt odniesienia dla porównania barwy roztworów.
c) badanie stałości pH roztworu buforu octanowego
Przygotować około 40 cm
3
roztworu kwasu octowego o pH = 4,25 dodając do wody
destylowanej 10 kropli zieleni bromokrezolowej, a następnie 0,01 M roztworu kwasu
octowego (po 1 kropli) tak, aby barwa roztworu była identyczna (jasnozielona) jak
otrzymanego w doświadczeniu 1a roztworu buforu octanowego. Następnie przygotowany
roztwór kwasu rozdzielić na dwie równe części rozlewając go do cylindrów miarowych o poj.
50 cm
3
. Do dwóch następnych cylindrów wlać przygotowany w doświadczeniu 1a roztwór
buforowy w taki sposób, aby objętość roztworów we wszystkich czterech cylindrach była
jednakowa. Cylindry ponumerować i ustawić na białym tle. Do jednej części roztworu
niezbuforowanego dodawać 0,5 M roztworu kwasu solnego (po jednej kropli) do pojawienia
się żółtej barwy roztworu. Powtórzyć tę samą czynność dla roztworu buforowego i odczytać
objętość dodanego roztworu kwasu solnego. Ponieważ w trakcie dodawania kwasu solnego
do roztworu buforowego znacznie wzrasta objętość roztworu, należy uzupełniać ilość
wskaźnika tak, aby jego stężenie wynosiło 10 kropli/40 cm
3
. Do drugiej części
niezbuforowanego roztworu kwasu octowego dodawać kroplami 0,5 M roztwór wodorotlenku
sodu (po jednej kropli) do uzyskania barwy niebieskiej. Analogicznie postępować z
roztworem buforowym utrzymując stężenie wskaźnika na poziomie 10 kropli/40 cm
3
.
Odczytać zmianę objętości roztworu.
2. Bufor amoniakalny jako przykład buforu typu B/BH
+
a) przygotowanie roztworu buforu amoniakalnego o pH = 8,4
Korzystając z 0,5 M roztworów amoniaku i chlorku amonu w cylindrze o poj. 50 cm
3
przygotować 40 cm
3
buforu amoniakalnego o pH = 8,4 (stosunek objętości obu roztworów
obliczyć należy z zależności obowiązującej dla buforu typu B/BH
+
). Sprawdzić pH roztworu
poprzez dodanie 2 kropli fenoloftaleiny. Przygotowany zabarwiony wskaźnikiem roztwór
pozostawić do doświadczenia 2b.
b) badanie pojemności buforowej roztworu buforu amoniakalnego
Zawartość cylindra z doświadczenia 2a podzielić na dwie równe części i rozlać do cylindrów
o poj. 50 cm
3
(roztwory 1 i 2). Do 40 cm
3
wody destylowanej z dodatkiem 2 kropli
fenoloftaleiny dodawać kroplami 0,01 M roztwór NH
3aq
, aż do uzyskania takiej samej, jak w
roztworze buforowym, barwy jasnoróżowej. Otrzymany roztwór podzielić na dwie równe

części do dwóch cylindrów o poj. 50 cm
3
(roztwory 3 i 4). W kolejnym etapie doświadczenia
ustawić cylindry na białym tle i do jednej części roztworu buforowego oraz
niezbuforowanego (roztwory 1 i 3) dodawać 0,5 M roztwór NaOH, aż do zmiany barwy
roztworu na malinową. Zanotować objętości roztworu NaOH potrzebne do wywołania
zmiany barwy. Do drugiej pary roztworów (roztwory 2 i 4) dodawać 0,5 M roztwór HCl, do
odbarwienia roztworów. Ze względu na to, że fenoloftaleina wykazuje barwę przejściową w
zakresie pH od 8 do 10, zaś wyjściowy roztwór buforowy miał pH równe 8,4, obserwowane
w doświadczeniu zmiany barwy pozwalają na wyznaczenie pojemności buforowej.
c) zastosowanie buforu amoniakalnego
Przygotować w probówkach po około 5 cm
3
roztworów soli: żelaza(III) i magnezu(II).
Roztwory podzielić na dwie równe części. Do pierwszej części każdego roztworu dodać
kroplami 2 M roztwór amoniaku, aż do wytrącenia osadu. Do drugiej części roztworów dodać
bufor amoniakalny, przygotowany przez zmieszanie równych objętości 2 M roztworu
amoniaku oraz 2 M roztworu chlorku amonu.
3. Zależność pH roztworu buforowego od stosunku stężeń jego składników
Przygotować w probówkach trzy roztwory buforowe mieszając ze sobą 0,5 M roztwory
kwasu octowego i octanu sodu w następujących stosunkach objętościowych:
1)
10 cm
3
roztworu CH
3
COOH i 1 cm
3
roztworu CH
3
COONa,
2)
5 cm
3
roztworu CH
3
COOH i 5 cm
3
roztworu CH
3
COONa,
3)
1 cm
3
roztworu CH
3
COOH i 10 cm
3
roztworuCH
3
COONa.
Obliczyć wartości pH otrzymanych roztworów, a następnie obliczone wartości sprawdzić
eksperymentalnie dodając do probówek po kilka kropli zieleni bromokrezolowej.
4. Porównanie wpływu rozcieńczania na pH roztworu buforowego i niezbuforowanego
a) roztwór buforowy
Przygotować w probówce roztwór buforowy mieszając 10 cm
3
1 M roztworu kwasu
octowego i 1 cm
3
1 M roztworu octanu sodu. 1 cm
3
tego roztworu rozcieńczyć 50-krotnie
i pobrać do drugiej probówki 10 cm
3
rozcieńczonego roztworu. Do obu probówek dodać po 2
krople oranżu metylowego i porównać barwy. Pozostawić roztwory do doświadczenia 2b.
b) roztwór niezbuforowany
Do probówki wlać 10 cm
3
1 M roztworu kwasu octowego, do drugiej probówki tę samą
objętość roztworu rozcieńczonego 50-krotnie. Do obu probówek dodać po 2 krople oranżu
metylowego. Porównać barwy wskaźnika w obu parach probówek (2a i 2b).
5. Wyznaczanie pojemności buforowej buforu węglanowego, wody bałtyckiej,
syntetycznej wody atlantyckiej, wody wodociągowej i wody destylowanej
Sporządzić bufor węglanowy rozpuszczając 0,19 mola Na
2
CO
3
oraz 0,41 mola NaHCO
3
w 1
dm
3
wody destylowanej. Do kolb stożkowych o poj. 250 cm
3
pobrać po 50 cm
3
badanych
cieczy (buforu węglanowego, wody bałtyckiej, syntetycznej wody atlantyckiej, wody
wodociągowej i wody destylowanej). Za pomocą uprzednio skalibrowanego pehametru
zmierzyć pH w każdej kolbie. Następnie do każdej próbki dodawać z biurety o poj. 25 cm
3
po
kropli rozwór HCl ciągle mieszając (w przypadku buforu węglanowego użyć 0,5 M, a w
pozostałych przypadkach 0,005 M roztworu HCl). Należy dodać taką ilość roztworu
miareczkującego, aby nastąpiła zmiana pH nie mniejsza niż jedna jednostka.

Pytania i zagadnienia
1.
Zinterpretować różnicę barw roztworów w doświadczeniu 1b.
2.
Porównać i zinterpretować wyniki otrzymane w doświadczeniu 1c dla roztworu
niezbuforowanego i mieszaniny buforowej.
3.
Obliczyć pojemność buforu badanego w doświadczeniu 2b.
4.
Na podstawie wyników z doświadczenia 3 i 4 wyjaśnić, od czego zależy pH roztworu
buforowego.
5.
Wyniki miareczkowań uzyskanych w doświadczeniu 5 zestawić w tabeli zawierającej dla
każdej z 5 badanych cieczy pH wyjściowe, ilość dodanego kwasu (oraz jego stężenie) i pH
po dodaniu kwasu. Na podstawie danych doświadczalnych obliczyć pojemność buforową i
zestawić w tej samej tabeli. Dla buforu węglanowego obliczyć pojemność buforową
(przyjmując w obliczeniach dla kwasu węglowego wartość K
a2
równą 5·10
–11
) i porównać
z wartością wyznaczoną doświadczalnie.
6.
Co to są roztwory buforowe? Podać przykłady trzech typów roztworów buforowych.
7.
Na czym polega buforujące działanie roztworów buforowych?
8.
Wyprowadzić wzory na stężenie jonów wodorowych w roztworze buforu octanowego i
amoniakalnego.
9.
Zmieszano 50 cm
3
1 M roztworu kwasu octowego i 150 cm
3
0,1 M roztworu NaOH.
Obliczyć pH otrzymanego roztworu.
10.
Obliczyć zmiany pH po dodaniu 10 cm
3
0,1 M roztworu NaOH do: a) 100 cm
3
wody, b)
100 cm
3
buforu amoniakalnego, w którym stężenia obu składników są równe 0,1 M.

Ćwiczenie 9
PROTOLITYCZNE REAKCJE JONÓW W ROZTWORZE WODNYM
1. Hydratacja kationów
a) Do trzech probówek wsypać szczyptę bezwodnych soli: do pierwszej siarczanu(VI)
miedzi(II), do drugiej siarczanu(VI) niklu(II), do trzeciej siarczanu(VI) kobaltu(II). Do każdej
z probówek dodać po około 2 cm
3
wody destylowanej i wytrząsać zawartość probówki aż sól
ulegnie rozpuszczeniu. Porównać barwy otrzymanych roztworów z barwami odpowiednich
soli bezwodnych i stałych hydratów.
b) Cienkim pręcikiem szklanym zwilżonym 1 M roztworem chlorku kobaltu(II) napisać
dowolny wyraz na białym papierze. Papier wysuszyć i obejrzeć napis. Zwrócić uwagę na
odbarwienie napisu po ostygnięciu, względnie po skierowaniu nań oddechu lub ciepłego
strumienia powietrza z suszarki. Wyjaśnić zaobserwowane zjawiska.
2. Badanie odczynu wybranych soli
a) reakcje kationów z wodą (protoliza kationowa)
Do trzech probówek wsypać szczyptę odpowiedniej soli: do pierwszej siarczan(VI) glinu, do
drugiej chlorek żelaza(III), do trzeciej chlorek amonu. Do każdej z probówek dodać po około
2 cm
3
wody destylowanej i przez chwilę wytrząsać zawartość probówki. Określić za pomocą
papierków wskaźnikowych pH otrzymanych roztworów.
b) reakcje anionów z wodą (protoliza anionowa)
Przygotować po ok. 2 cm
3
wodnych roztworów: węglanu sodu, ortofosforanu(V) sodu
i siarczku sodu. Do otrzymanych roztworów dodać po kilka kropli błękitu bromotymolowego.
c) sole obojętne
Określić za pomocą papierków wskaźnikowych pH przegotowanej i ochłodzonej wody, która
będzie używana do przygotowywania roztworów w czasie wykonywania ćwiczenia.
Do dwóch probówek wsypać szczyptę odpowiedniej soli: do pierwszej azotanu(V) potasu, do
drugiej siarczanu(VI) sodu. Do każdej z probówek dodać po około 2 cm
3
wody destylowanej i
wytrząsać zawartość probówki aż sól ulegnie rozpuszczeniu. Określić za pomocą papierków
wskaźnikowych pH otrzymanych roztworów.
3. Wyznaczanie stałych i stopnia protolizy
Przygotować po 50 cm
3
gotowych 0,5 M roztworów następujących soli: węglanu sodu,
wodorowęglanu
sodu,
ortofosforanu(V)
sodu,
wodorofosforanu(V)
sodu,
diwodorofosforanu(V) sodu, chlorku amonu, octanu sodu, azotanu(V) glinu, azotanu(V)
chromu(III) i octanu amonu. Oznaczyć wartość pH przygotowanych roztworów za pomocą
pehametru. Wykorzystując zmierzone wartości pH, obliczyć stopień i stałą protolizy
poszczególnych jonów.
Pytania i zagadnienia
1.
Co to jest hydratacja? Od jakich własności jonu zależy jego zdolność do tworzenia
hydratów?
2.
Jakie są następstwa hydratacji jonów?
3.
Dlaczego odwodnienie siarczanu(VI) miedzi(II) i siarczanu(VI) niklu(II) towarzyszy
zmiana barwy soli? Podać inne przykłady takiego zachowania soli.

4.
Solwatacja a hydratacja.
5.
Uszeregować następujące jony według malejącej zdolności do hydratacji: H
+
, K
+
, Li
+
,
Al
3+
, Mg
2+
, Cu
2+
, NO
3
-
, SO
4
2-
, Cl
-
.
6.
Pojęcie kwasu i zasady Broensteda.
7.
Hydroliza jako reakcja protolityczna anionowej zasady lub kationowego kwasu z wodą.
8.
Co to są stopień i stała hydrolizy?
9.
Jakie czynniki i w jaki sposób wpływają na stopień hydrolizy?
10.
Napisać
równania
reakcji
protolitycznych
przebiegających
w
wykonanych
doświadczeniach.

Ćwiczenie 10
ILOCZYN ROZPUSZCZALNOŚCI
1. Reakcje wytrącania osadów jako reakcje jonowe
Do dwóch probówek zawierających roztwór azotanu(V) srebra dodać: do pierwszej kilka
kropli 2 M roztworu kwasu solnego, do drugiej roztworu chlorku sodu.
2. Efekt wspólnego jonu
Do dwóch probówek wlać nasycony roztwór chlorku ołowiu(II). Do jednej probówki dodać
10 kropli nasyconego roztworu octanu ołowiu(II), do drugiej zaś taką samą ilość nasyconego
roztworu chlorku sodu.
3. Różnice w rozpuszczalności soli trudno rozpuszczalnych
Do probówki z roztworem chlorku wapnia dodać roztworu siarczanu(VI) sodu. Zawartość
probówki odstawić na 2-3 minuty, osad odwirować i przemyć. Następnie sporządzić
nasycony roztwór otrzymanego siarczanu(VI) wapnia wytrząsając przez kilka minut osad w
probówce z około 5 cm
3
wody. Osad odwirować, a następnie dodać szczawianu amonu.
4. Przeprowadzenie soli trudno rozpuszczalnych w trudniej rozpuszczalne
Do probówki z roztworem azotanu(V) ołowiu(II) dodać taką samą objętość siarczanu(VI)
sodu. Osad odwirować, oddzielić od roztworu i zadać kilkoma kroplami siarczku amonu.
Dokładnie wymieszać bagietką. Wlać do probówki roztwór azotanu(V) ołowiu(II), a
następnie dodać roztworu chlorku sodu. Osad odwirować i zadać roztworem chromianu(VI)
potasu. Zamieszać bagietką.
5. Wpływ stężenia jonów wodorowych na rozpuszczalność soli słabych kwasów
Strącić osad szczawianu wapnia przez zmieszanie roztworów szczawianu amonu i soli
wapnia. Osad odwirować i po zdekantowaniu roztworu podzielić na dwie części. Do
pierwszej części dodać 2 M roztworu kwasu solnego, a do drugiej 2 M roztworu kwasu
octowego.
6. Frakcjonowane strącanie osadów
Do jednej probówki wprowadzić kilka kropli 0,5 M roztworu chlorku amonu, do drugiej taką
samą objętość 0,1 M roztworu jodku potasu. Do każdej z nich dodać po kilka kropli 0,1 M
roztworu azotanu(V) srebra. Następnie zmieszać równe objętości roztworów chlorku sodu i
jodku potasu, zakwasić kwasem azotowym(V) i dodać kilka kropli azotanu(V) srebra. Po
upływie 5 minut osad odwirować. Za pomocą pipetki pobrać ciecz znad osadu, przenieść do
drugiej probówki i dodać kilka kropli azotanu(V) srebra. Pobieranie cieczy znad osadu i
ponowne wytrącanie osadu należy powtarzać tak długo, aż otrzyma się zupełnie biały osad.
Porównać zabarwienie kolejno otrzymanych osadów z osadami otrzymanymi na początku.
7. Zastosowanie buforu amoniakalnego do selektywnego wytrącania osadów
Przygotować po około 10 cm
3
0,1 M roztworów azotanu(V) żelaza(III) i azotanu(V) magnezu.
Roztwory podzielić na dwie części. Do pierwszej części każdego z roztworów należy dodać
około 10 cm
3
2 M roztworu amoniaku. Do drugiej porcji roztworów azotanów(V) należy
wprowadzić około 10 cm
3
buforu amoniakalnego, przygotowanego przez zmieszanie równych
objętości 2 M roztworów amoniaku i chlorku amonu. Zaobserwować różnice w wytrącaniu
się osadów.

8. Czynniki wpływające na przebieg procesu rozpuszczania - polarność rozpuszczalnika
i substancji rozpuszczonej
8.1. Rozpuszczalność soli nieorganicznych
Do jednej probówki wlać około 2 cm
3
wody destylowanej (demineralizowanej) a do drugiej
taką samą objętość etanolu. Do każdej z nich wsypać po kilka kryształków chlorku sodu i
wymieszać zawartość. Porównać rozpuszczalność soli w obu rozpuszczalnikach.
8.2. Rozpuszczalność stałych substancji niepolarnych
Do probówek wlać po 2 ml wody, wodnego roztworu jodku potasu, etanolu oraz chloroformu.
Do każdego z tych rozpuszczalników wsypać po kilka kryształków jodu, wymieszać
zawartości i porównać rozpuszczalność jodu oraz barwy otrzymanych roztworów.
Pytania i zagadnienia
1.
Podać zależność pomiędzy rozpuszczalnością i iloczynem rozpuszczalności dla trudno
rozpuszczalnych elektrolitów typu AB, AB
2
i A
2
B
3
.
2.
Jak wytłumaczyć stwierdzenie, że żadne wytrącanie nie może być całkowite?
3.
Przedyskutować jakościowo i ilościowo wpływ wspólnego i obcego jonu na
rozpuszczalność osadów.
4.
Jak wpływa stopień dysocjacji odczynnika strącającego na proces strącania osadów?
5.
Jak przebiega proces wytrącania osadów trudno rozpuszczalnych w przypadku, kiedy
odczynnik strącający tworzy osady z kilkoma jonami obecnymi w roztworze?
6.
Zmieszano parami następujące roztwory elektrolitów: Pb(NO
3
)
2
, Na
2
S, CuSO
4 ,
KCl (w 6
możliwych kombinacjach). W których przypadkach przebiega reakcja? Podać równania
reakcji w formie cząsteczkowej i jonowej.
7.
Iloczyn rozpuszczalności Pb
3
(PO
4
)
2
wynosi 1,5·10
-32
. Obliczyć rozpuszczalność tej soli w
gramach na litr oraz znaleźć stężenie jonów Pb
2+
i PO
4
3-
w jej roztworze nasyconym.
8.
W jakim celu wprowadzamy w reakcjach strącania nadmiar odczynnika strącającego?
Dlaczego nie zaleca się używania zbyt wielkiego nadmiaru odczynnika strącającego?
9.
Iloczyn rozpuszczalności chlorku srebra jest równy 1,6·10
-10
,
a chromianu(VI) srebra
9·10
-12
(w temperaturze 25
o
C). Podać, która z tych soli jest łatwiej rozpuszczalna w
roztworze wodnym.
10.
Czynniki wpływające na rozpuszczalność gazów w cieczach.
11.
Dlaczego rozpuszczalność gazów zawsze maleje ze wzrostem temperatury?
12.
Który z gazów – wodór, chlor, chlorowodór – jest najlepiej rozpuszczalny, a który
najgorzej? Wyjaśnić dlaczego.
13.
Od czego zależy, czy rozpuszczanie ciał stałych w cieczach jest procesem egzo- czy
endotermicznym?
14.
Jak zmienia się rozpuszczalność siarczanu(VI) amonu w wodzie ze wzrostem
temperatury? Proces jest endotermiczny.
15.
Dlaczego kwas benzoesowy, w przeciwieństwie do benzenu, rozpuszcza się w wodzie?
16.
Dlaczego rozpuszczalność związków jonowych zwiększa się wraz ze wzrostem
względnej przenikalności elektrycznej rozpuszczalników?
17.
Dlaczego gęstość wodnego roztworu amoniaku jest mniejsza od gęstości wody i maleje
ze wzrostem stężenia?

Ćwiczenie 11
PODSTAWY ELEKTROCHEMII
1. Potencjały standardowe układów redoks
Na podstawie podanych poniżej wartości standardowych potencjałów układów redoks
określić możliwość reakcji w grupie następujących utleniaczy: KMnO
4
, FeCl
3
i reduktorów:
KI, KBr Sprawdzić doświadczalnie trafność doboru, przeprowadzając reakcje między
roztworami utleniaczy i reduktorów zakwaszonymi 4 M roztworem H
2
SO
4
. W reakcjach, w
których powstaje wolny jod lub brom, zidentyfikować je dodatkowo na podstawie
zabarwienia warstwy dodanego chloroformu.
Pt/ MnO
4
-
,H
3
O
+
, Mn
2+
E
0
= +1,52 V
Pt/ Fe
3+
, Fe
2+
E
0
= +0,77 V
Pt/ I
2
, I
-
E
0
= +0,53 V
Pt/ Br
2
, Br
-
E
0
= +1,09 V
2. Zależność przebiegu procesu utleniania i redukcji od środowiska reakcji
Do trzech zlewek o pojemności 50 cm
3
nalać po około 2 cm
3
0,1 M roztworu siarczanu(IV)
sodu. Roztwór w pierwszej zlewce zakwasić 2 M roztworem H
2
SO
4
, do drugiej dodać
stężonego roztworu NaOH, trzecią próbkę pozostawić bez zmian. Następnie do każdej ze
zlewek dodawać kroplami, mieszając, 0,1 M roztwór KMnO
4
.
3. Reakcje, w których substancja spełnia rolę utleniacza bądź reduktora, w zależności
od partnera reakcji
a) 1 cm
3
0,1 M roztworu jodku potasu zakwasić w probówce 2 M roztworem H
2
SO
4
, dodać
roztworu skrobi, a następnie kilka kropli 10 % roztworu nadtlenku wodoru. Zwrócić uwagę
na zmianę zabarwienia w probówce.
b) Do probówki zawierającej kilka cm
3
10% roztworu nadtlenku wodoru zakwaszonego 4 M
roztworem H
2
SO
4
, dodawać kroplami 0,1 M roztwór KMnO
4
. Zwrócić uwagę na zmiany
zachodzące w probówce.
4. Reakcje z udziałem substancji organicznych jako reduktorów
Do probówki z roztworem dichromianu potasu wprowadzić po kilka kropli stężonego kwasu
siarkowego(VI) i alkoholu etylowego. Zwrócić uwagę na zmianę zabarwienia roztworu i
pojawienie specyficznego zapachu, charakterystycznego dla aldehydu octowego (CH
3
CHO).
5. Porównanie aktywności chemicznej metali
Przygotować probówki z roztworami: azotanu(V) ołowiu(II), azotanu(V) miedzi(II),
azotanu(V) srebra. Do każdej z probówek dodać kawałek metalicznego cynku, przemytego
uprzednio 2 M roztworem HCl, a następnie opłukanego wodą destylowaną. Probówki
odstawić na 20 min. Powtórzyć operacje wrzucając do każdej z próbówek po małym kawałku,
oczyszczonego w 2 M HNO
3
i opłukanego wodą destylowaną, drutu miedzianego.
Zaobserwować, w których wypadkach zachodzi wypieranie metali z ich soli.
6. Sporządzanie ogniwa galwanicznego
Zestawić ogniwo Daniella przygotowując dwa półogniwa: miedziane i cynkowe. W tym celu
do dwóch zlewek o pojemności ok. 150 cm
3
wlać do 2/3 wysokości: do pierwszej - 1 M
roztwór siarczanu(VI) miedzi(II), do drugiej – 1 M roztwór siarczanu(VI) cynku. Zlewki
połączyć kluczem elektrolitycznym, wypełnionym nasyconym roztworem KNO
3
,

zmieszanym z agar-agarem. Do zlewki z roztworem ZnSO
4
wprowadzić płytkę cynkową, zaś
do roztworu CuSO
4
– płytkę miedzianą. Zanurzone w roztworach płytki połączyć z zaciskami
woltomierza prądu stałego (potencjometru). Zanotować SEM ogniwa.
7. Elektroliza wodnego roztworu siarczanu(VI) sodu
Napełnić elektrolizer Hoffmana 1 M roztworem siarczanu(VI) sodu z dodatkiem błękitu
bromotymolowego, wypierając całkowicie powietrze z aparatu. Połączyć przyrząd ze źródłem
prądu stałego i ustalić napięcie zasilające na około 10 V. Prowadzić elektrolizę około 10
minut. Zwrócić uwagę na stosunek objętościowy gazów wydzielonych przy katodzie i
anodzie. Gaz z przestrzeni katodowej zebrać do probówki, odwróconej dnem do góry,
następnie otwór probówki zbliżyć do płomienia palnika. Otworzyć kranik od przestrzeni
anodowej, zebrać nieco gazu do probówki, a następnie u wylotu probówki umieścić żarzące
się łuczywko.
8. Miedziowanie elektrolityczne
Napełnić naczynie elektrolizera (np. zlewkę o pojemności 50 cm
3
) do 2/3
objętości 0,05 M
roztworem CuSO
4
. Przygotować elektrody. W tym celu gruby drut żelazny (np. gwóźdź)
oczyścić starannie papierem ściernym, przemyć strumieniem wody wodociągowej, a
następnie wodą destylowaną, po czym poddać go wytrawianiu 2 M roztworem H
2
SO
4
w ciągu
1-2 minut. Wytrawiony drut opłukać wodą destylowaną i osuszyć kawałkiem bibuły. Tak
przygotowany drut żelazny będzie stanowił katodę, anodę zaś - płytka lub gruby drut
miedziany. Umieścić elektrody w roztworze CuSO
4
i włączyć w obwód prądu. Prowadzić
elektrolizę przez 5-10 min., stosując prąd o natężeniu ok. 500 mA.
Uwaga ! W trakcie operacji nie dotykać palcami tej części drutu, która ma być
zanurzona w roztworze elektrolitu.
Pytania i zagadnienia
1.
Zdefiniować pojęcia: stopień utlenienia pierwiastka, utleniacz, reduktor, utlenianie,
redukcja.
2.
Obliczyć stopnie utlenienia podkreślonych pierwiastków w następujących związkach i
jonach: NO
2
-
, Ca(MnO
4
)
2
, (NH
4
)
2
Cr
2
O
7
, SO
3
2-
,C
6
H
6
, NaH, OF
2
, HSO
4
-
, Mg, H
2
O
2
,
HNO
3
, ClO
-
, CH
3
OH, MnO
4
2-
, CH
3
COOH, K
4
[Fe(CN)
6
].
3.
Dobrać współczynniki w następujących równaniach redoks:
a)
Cr
2
O
7
2-
+ S
2-
+ H
3
O
+
→
Cr
3+
+ S + H
2
O
b)
FeS + HNO
3
→
Fe(NO
3
)
3
+ S + NO + H
2
O
c)
Ca(OH)
2
+ Cl
2
→
Ca(ClO)
2
+ CaCl
2
+ H
2
O
d)
KNO
3
+ C + S →
N
2
+ CO
2
+ K
2
S
e)
MnO
4
-
+ C
2
H
4
+ H
2
O →
MnO
2
+ CH
2
OH-CH
2
OH + OH
-
f)
CrCl
3
+ H
2
O
2
+ NaOH →
Na
2
CrO
4
+ NaCl + H
2
O
g)
Zn + NO
3
-
+ H
3
O
+
→
Zn
2+
+ NH
4
+
+ H
2
O
4.
Jak ze wzrostem liczby atomowej zmieniają się redukujące właściwości jonów
halogenkowych oraz utleniające właściwości wolnych fluorowców?
5.
Który pierwiastek w układzie okresowym jest najsilniejszym utleniaczem, a który jest
najsilniejszym reduktorem w roztworze wodnym? Odpowiedź podać na podstawie
standardowych potencjałów redoks układów w roztworze wodnym.
6.
Zdefiniować pojęcia: półogniwo, potencjał standardowy (normalny) elektrody metalicznej.
7.
Jaki jest związek między położeniem metalu w szeregu elektrochemicznym a możliwością
reagowania tego metalu z: a) z wodą, b) z kwasami nie utleniającymi, c) z kwasami
utleniającymi?

8.
Co to jest siła elektromotoryczna ogniwa? Obliczyć SEM dla normalnego ogniwa Daniella.
9.
Omówić mechanizm elektrolizy. Podać szkic typowego zestawu do elektrolizy.
10.
Podać równania reakcji elektrodowych zachodzących na elektrodach platynowych
podczas elektrolizy wodnych roztworów CuSO
4
, NaOH, KNO
3
, NaCl, CH
3
COONa.
Wyszukiwarka
Podobne podstrony:
spis lab I sem 2010
nieorganiczna, chemia nieorganiczna, lab nieorganiczna
Lab Regulamin 2010
Prog lab TMM 2010 id 394677 Nieznany
OS lab 2012 id 340947 Nieznany
Bad. op.lab - wszystko 2010
spis lab I sem 2010
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Błędy w obliczeniach numerycznych - stare, Informatyka WEEIA 2010-2015, Semestr IV, Metody numeryczn
Chemia ogolna i nieorg 13 2010
2010 Lab 10 struktury drzewiaste
Podstawy Automatyki Lab 2010 CW1 Układy przełączając…
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
Podstawy-Automatyki-Lab-2010-CW1-Układy-przełączając…
więcej podobnych podstron