
PRZEGLĄD PODSTAWOWYCH KLAS
ZWIĄZKÓW PIERWIASTKÓW BLOKÓW s i p
Wstęp. Elektroujemność pierwiastków
Elektroujemność, χ , jest to wielkość określająca
zdolność
atomu
pierwiastka
znajdującego
się
w cząsteczce do przyciągania ku sobie elektronów.
Znane są trzy skale elektronegatywności zdefiniowane
przez
Paulinga,
Mullikana
i
Alfreda-Rochowa.
W powszechnym użyciu pozostaje skala Paulinga.
Pierwiastki
o
największym
powinowactwie
elektronowym,
fluor
i
tlen,
mają najwyższe
elektroujemności: χ
F
= 4 i χ
O
= 3,5. Pierwiastki
o
najmniejszym
powinowactwie
elektronowym,
mianowicie litowce, mają elektroujemności χ < 1.
Elektroujemność zmienia się w zależności od położenia
pierwiastka w Układzie Okresowym.
Rys. 1. Zmiany elektroujemności w Układzie Okresowym pierwiastków
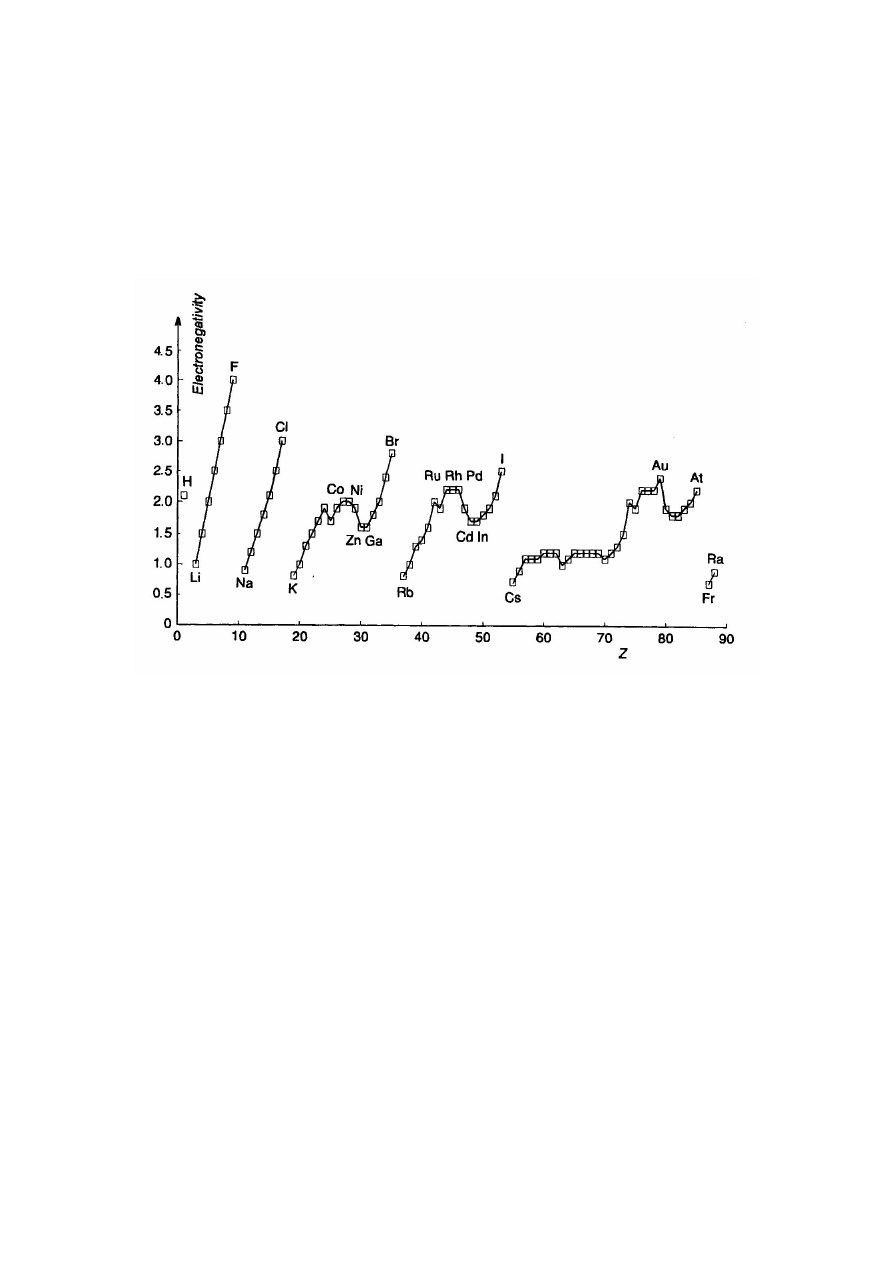
Okresowy
charakter
zmian
elektroujemności
w skali Paulinga w zależności od liczby atomowej Z
pierwiastka przedstawia wykres 2.
Rys. 2. Okresowość zmian elektroujemności w skali Paulinga
Pierwiastki o dużej elektroujemności określamy
mianem elektroujemnych, a pierwiastki o małej
elektroujemności
nazywamy
elektrododatnimi.
Bezwzględna wartość różnicy elektroujemności
│χ
A
–χ
B
│pierwiastków A i B pozwala ocenić stopień
spolaryzowania
wiązań
kowalencyjnych
A-B
w związkach A
m
B
n
na podstawie procentowego udziału
wiązania jonowego:
% = 16│χ
A
–χ
B
│+ 3,5│ χ
A
–χ
B
│
2
(1)
Procentowe udziały wiązania jonowego w zależności
od różnicy elektroujemności podano w tabeli 1.
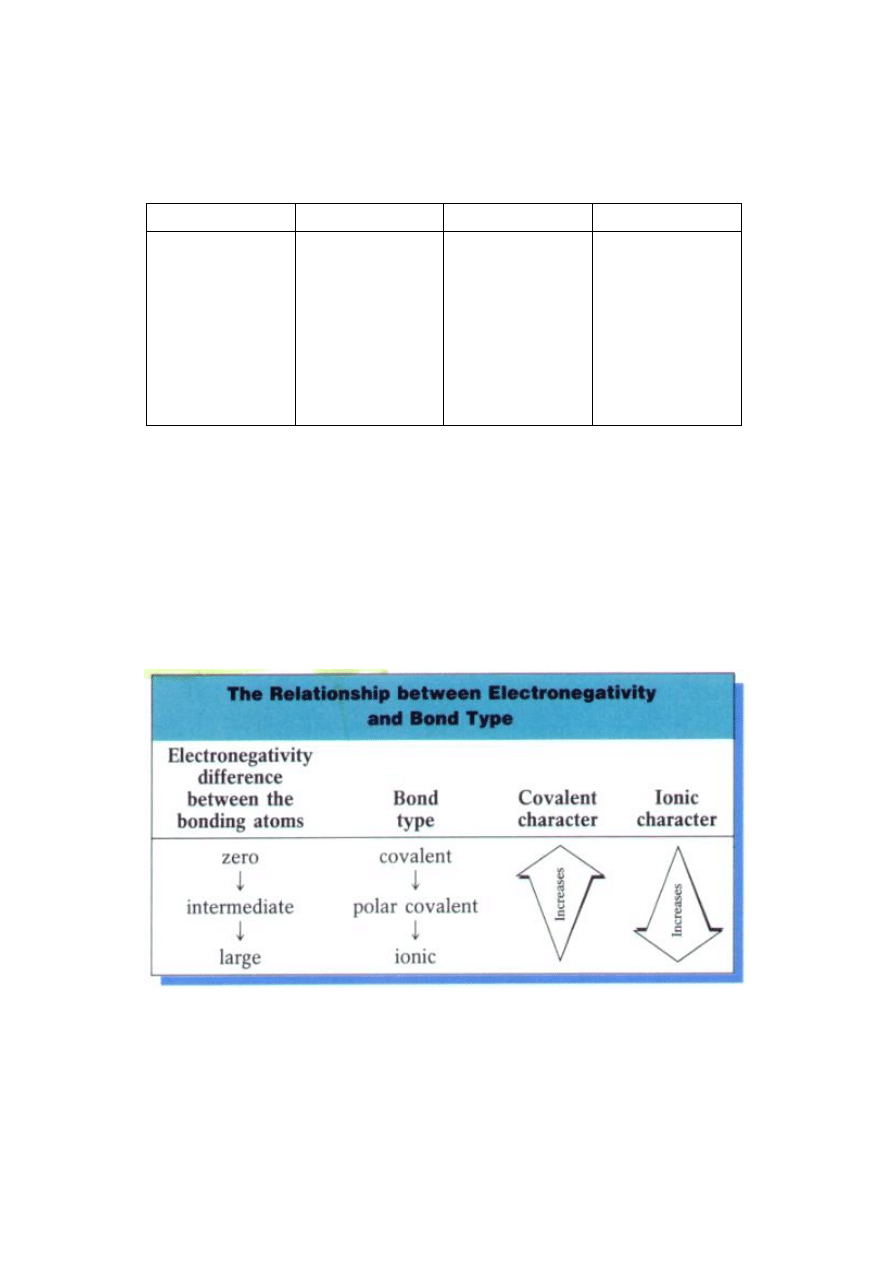
Tabela 1. Udział wiązania jonowego w zależności od różnicy χ
A
–χ
B
χ
A
–χ
B
%
χ
A
–χ
B
%
0,2
0,4
0,6
0,8
1,2
1,4
1,6
3,3
7,0
10,9
15,0
24,2
29,3
34,6
1,8
2,0
2,2
2,4
2,6
2,8
3,2
40,1
46,0
52,1
58,6
65,3
72,2
87,0
Ogólnie można to ująć regułą jakościową, że duża
różnica elektroujemności pierwiastków A i B jest
typowa dla związków z wiązaniami jonowymi,
natomiast mała różnica jest charakterystyczna dla
związków z wiązaniami kowalencyjnymi. Regułę tę
ilustruje tabela 2.
Tabela 2. Jakościowy wpływ różnicy elektroujemności na
charakter wiązań chemicznych w wieloatomowych cząsteczkach
pierwiastków (np. H
2
, N
2
, O
2
, P
4
, S
8
, Cl
2
) i związków chemicznych
Wodorki pierwiastków bloku s i
p
Wodorki są związkami wodoru z innymi
pierwiastkami (X) o wzorze ogólnym H
m
X
n
.
Przykłady:
LiH, NaH – wodorek litu, wodorek sodu
CaH
2
– wodorek wapnia
B
2
H
6
– wodorek boru, diborowodór, diboran
AlH
3
– wodorek glinu
CH
4
– wodorek węgla, metan, najprostszy węglowodór
Inne wodorki węgla – węglowodory: nasycone (akany,
cykloalkany), nienasycone (alkeny i alkiny), aromatyczne.
NH
3
– wodorek azotu, azan, amoniak
PH
3
– wodorek fosforu, fosfan, fosforowodór
H
2
O – wodorek tlenu, woda
H
2
S – wodorek siarki, siarkowodór
HX, gdzie X = F, Cl, Br, I – wodorki fluorowców,
tzw. halogenowodory, np. HCl - chlorowodór
Wodorki pierwiastków bloku s i p dzielimy na:
● o charakterze jonowym z atomem wodoru na -1
stopniu utlenienia, H
-
. Wodorki takie tworzą litowce,
berylowce oraz glin.
● kowalencyjne, tworzone przez węglowce, azotowce,
tlenowce i fluorowce, gdzie atomy wodoru są +1
stopniu utlenienia, H
+
. Szczególnym przypadkiem
jest diborowodór, B
2
H
6
, w którym występuje
specyficzne
wiązanie
kowalencyjne
poprzez
trójcentrowy orbital cząsteczkowy H – B – H.

Różnice elektroujemności dla tlenu i wodoru oraz
azotu i wodoru są równe odpowiednio 1,4 i 0,9. Na
podstawie wzoru (1) można przyjąć, że udziały
charakteru jonowego wiązań O–H w cząsteczce wody
i N–H w cząsteczce amoniaku wynoszą odpowiednio 29
i
18%.
Różnica elektroujemności węgla (2,5)
i wodoru (2,1) przesądza o tym, że cząsteczki
nasyconych węglowodorów alifatycznych mają znikomy
udział charakteru jonowego w wiązaniach C–H, a ich
moment dipolowy jest równy 0. Udział wiązania
jonowego w halogenowodorach HX (X = F, Cl, Br, I)
maleje wraz z elektroujemnością fluorowca (tabela 3).
Tabela 3. Udział wiązania jonowego w halogenowodorach HX
Związek χ
X
–χ
H
Udział wiązania jonowego [%]
HF
HCl
HBr
HI
1,9
0,9
0,7
0.4
45
18
12
5
Wodorki litowców, berylowców, glinu i galu są tu
wyjątkiem, ponieważ całkowicie jonowego charakteru
wiązań w tych związkach nie można uzasadnić w
oparciu o małe różnice elektroujemności, które
zmieniają się w przedziale od 0,5 do 1,4. O wiązaniach
jonowych decyduje tu elektrododatni charakter tych
metali.
W poszczególnych okresach właściwości wodorków
pierwiastków bloku s i p zmieniają w charakterystyczny
sposób, a reprezentatywnym przykładem są wodorki
pierwiastków drugiego okresu w UO.
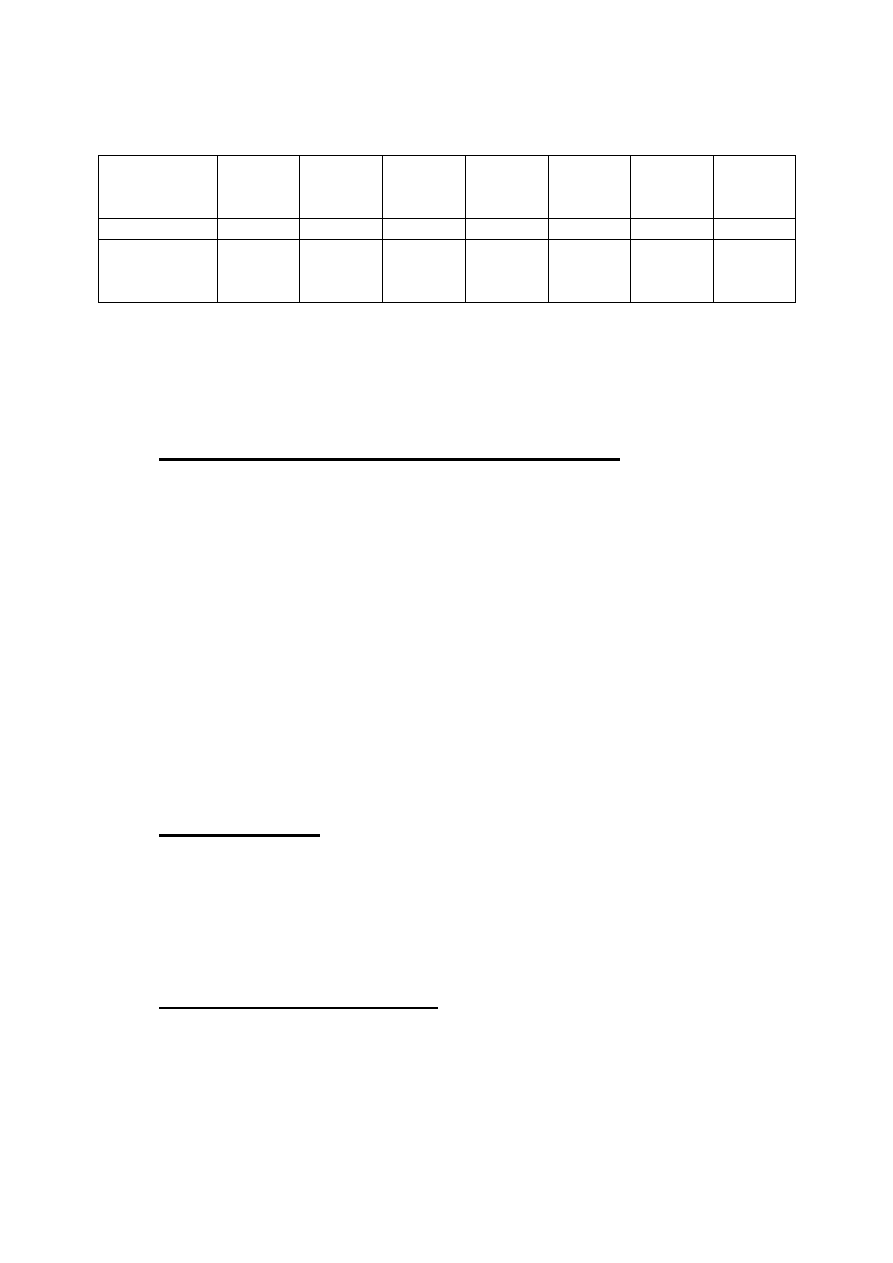
Tabela 4. Wodorki pierwiastków drugiego okresu
Numer
grupy
głównej
I
II
III
IV
V
VI
VII
Wodorki
LiH
BeH
2
B
2
H
6
CH
4
NH
3
H
2
O
HF
Stopnie
utlenienia
pierwiastków
+1
+2
+3
4-8 = −4
5-8 = −3
6-8 = −2
7-8 = −1
wzrost kwasowości――――→
←――――wzrost zasadowości
UWAGA:
stopnie utlenienia wodoru w wodorkach
to:
−1
(LiH, BeH
2
, B
2
H
6
);
+1
(CH
4
, NH
3
, H
2
O, HF)
Wodorki litowców i berylowców są ciałami
stałymi. Po stopieniu przewodzą prąd elektryczny,
a podczas ich elektrolizy wodór wydziela się na
anodzie.
Jon
wodorkowy,
H
-
,
jest
silnym
reduktorem, ponieważ standardowy potencjał
układu H
2
/H
-
jest ujemny, E
o
= -2,3V. Z tego względu
wodorki
tych
metali
reagują z wodą lub
z kwasami z wydzieleniem wodoru:
NaH + H
2
O = NaOH + H
2
CaH
2
+ 2HCl = CaCl
2
+ 2H
2
Borowodory, z których najprostszym jest B
2
H
6
,
mają bardzo duże ciepła spalania, w przeliczeniu na
jednostkę masy niemal dwukrotnie większe od ciepeł
spalania węglowodorów. Z tego powodu borowodory
stosuje się jako paliwa rakietowe.
Wodorki fluorowców są gazami bardzo dobrze
rozpuszczalnymi w wodzie. Uzyskane roztwory
mają
odczyn
silnie
kwaśny,
ponieważ
halogenowodory są mocnymi kwasami.

Wodorki fosforu, siarki, selenu, telluru i arsenu
i antymonu (PH
3
, H
2
S, H
2
Se, H
2
Te, AsH
3,
SbH
3
) są
silnie toksycznymi gazami. W wodnych roztworach
H
2
S, H
2
Se i H
2
Te są słabymi kwasami, od których
wywodzą sole: siarczki, selenki i tellurki.
Gazowy
amoniak
dobrze
rozpuszcza się
w wodzie i jest słabą zasadą. Jego analog,
fosforowodór jest gazem i wykazuje właściwości
bardzo słabej zasady i dlatego halogenki fosfoniowe
PH
4
X, gdzie X = F, Cl, Br, I, są znacznie mniej
trwałe od halogenków amonowych. Kolejne
analogi, AsH
3
, SbH
3
i BiH
3
są nietrwałe.
AsH
3
jest
silnym reduktorem, np. z roztworu AgNO
3
wydziela
srebro:
6Ag
+
+ AsH
3
+ 2H
2
O = 6Ag + HAsO
2
+ 6H
+
Wodorki krzemu tworzą szereg homologiczny
silanów o wzorze ogólnym Si
n
H
2n+2
. Silany są mniej
trwałe i bardziej reaktywne od węglowodorów
nasyconych. Podobne właściwości wykazują wodorki
germanu: GeH
4
, Ge
2
H
6
i Ge
3
H
8
. Reaktywność
silanów i germanowodorów wykorzystuje się
w syntezie innych połączeń krzemu i germanu.
Wodorki cyny i ołowiu, SnH
4
i PbH
4
, są bardzo
nietrwałe i nie mają znaczenia praktycznego.

Tlenki pierwiastków bloku s i
p
Tlenki o wzorze ogólnym X
n
O
m
są związkami tlenu
z innymi pierwiastkami. Tlenki elektrododatnich
litowców i berylowców, np. Na
2
O, K
2
O, MgO, CaO,
BaO,
mają
charakter
zadecydowanie
jonowy.
W tlenkach pierwiastków elektroujemnych, np. NO
2
,
P
2
O
3
, SO
2
, SO
3
, Cl
2
O
7
, występują spolaryzowane
wiązania kowalencyjne. Zwrócić trzeba uwagę na fakt,
że związek tlenu z fluorem(I) jest w rzeczywistości
difluorkiem tlenu OF
2
, bowiem fluor ma większą
elektroujemność niż tlen.
Wśród tlenków pierwiastków bloku s i p można
wyróżnić cztery grupy.
● Tlenki kwasowe, np. B
2
O
3
, CO
2
, SO
2
, SO
3
, Cl
2
O
7
,
P
4
O
10
, As
2
O
3
, SeO
3
, I
2
O
5
, od których wywodzą
się odpowiednie kwasy tlenowe. Wymienione tlenki
reagują z tlenkami zasadowymi lub z zasadami, np.:
K
2
O + B
2
O
3
= 2KBO
2
2NaOH + SO
2
= Na
2
SO
3
+ H
2
O
● Tlenki zasadowe, np. Na
2
O, K
2
O, Cs
2
O, MgO, CaO,
BaO, Bi
2
O
3
, od których pochodzą odpowiednie
zasady lub wodorotlenki. Wymienione tlenki reagują
z tlenkami kwasowymi lub z kwasami, np.:
CaO + SO
3
= CaSO
4
Bi
2
O
3
+ 6HCl = 2BiCl
3
+ 3H
2
O
● Tlenki amfoteryczne, np. BeO, Al
2
O
3
, Ga
2
O
3
, SnO,
SnO
2
, PbO, wykazujące właściwości kwasowe
w reakcjach z mocnymi zasadami lub zasadowe
w reakcjach z mocnymi kwasami, np.:
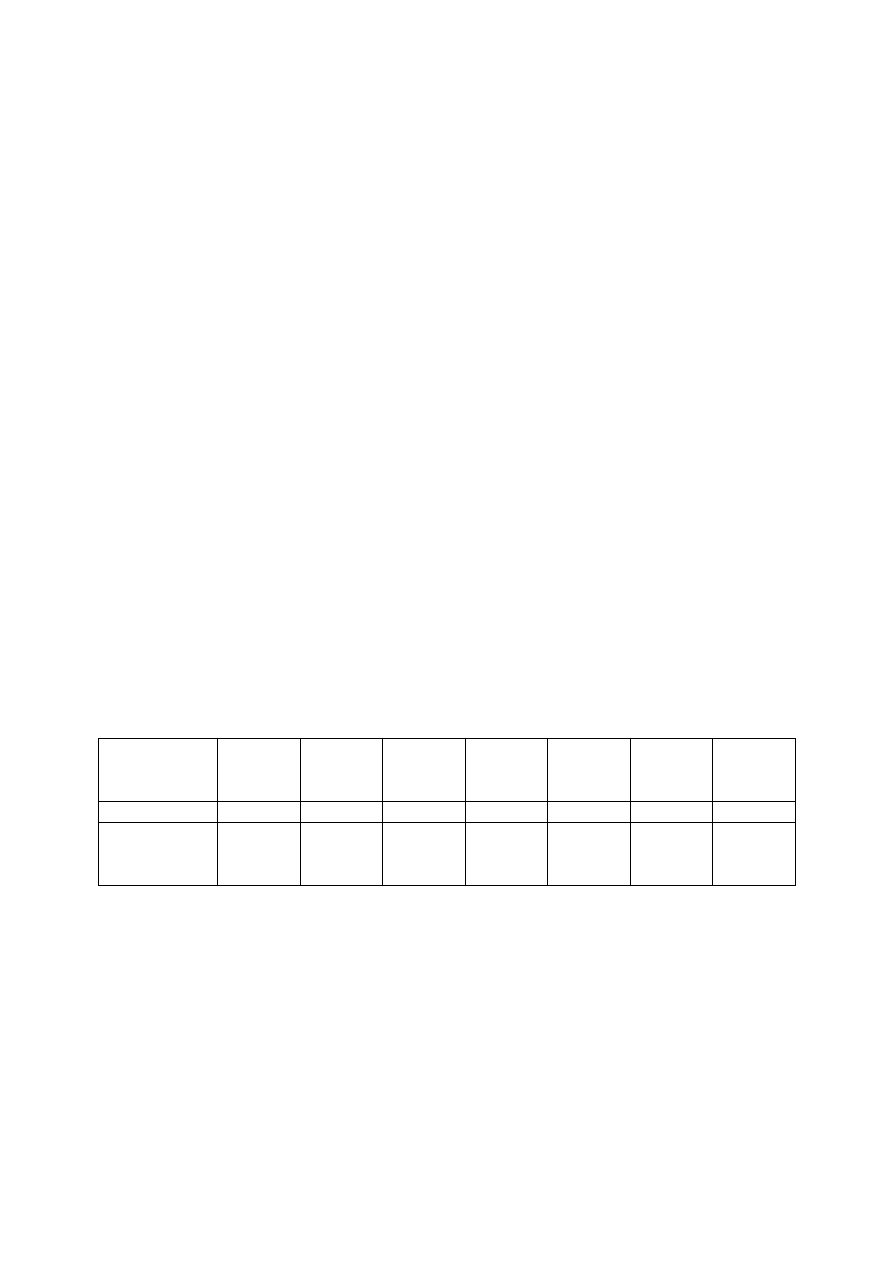
Al
2
O
3
+ 2NaOH + 3H
2
O = 2Na[Al(OH)
4
]
Al
2
O
3
+ 6HCl = 2AlCl
3
+ 3H
2
O
NaOH + SnO + H
2
O = Na[Sn(OH)
3
]
SnO + 2HCl = SnCl
2
+ H
2
O
● Tlenki obojętne, np. CO, N
2
O, które nie wykazują
cech kwasowych lub zasadowych i nie reagują
z zasadami i kwasami.
Zasadowy charakter tlenków w rodzinach litowców,
berylowców i borowców wzrasta wraz z liczbą atomową
pierwiastka. Natomiast charakter kwasowy tlenków
w rodzinach azotowców, siarkowców i chlorowców
maleje ze wzrostem liczby atomowej pierwiastka. Aby
prześledzić w jaki sposób w poszczególnych okresach
zmieniają się właściwości zasadowe i kwasowe tlenków
pierwiastków bloku s i p na ich maksymalnych
stopniach utlenienia wystarczy rozpatrzyć trzeci okres
UO.
Numer
grupy
głównej
I
II
III
IV
V
VI
VII
Tlenki
Na
2
O
MgO
Al
2
O
3
SiO
2
P
4
O
10
SO
3
Cl
2
O
7
Stopnie
utlenienia
pierwiastków
+1
+2
+3
+4
+5
+6
+7
wzrost kwasowości――――→
←――――wzrost zasadowości
Uwaga: w tlenkach tlen występuje na
-2
stopniu utlenienia.
Proste tlenki niektórych pierwiastków spotyka się
w naturze jako minerały, np. SiO
2
– krzemionka,
kwarc, kryształ górski; Al
2
O
3
– korund; SnO
2
–
kasyteryt.

Kwasy
Kwasom poświęciliśmy sporo uwagi na pierwszym
wykładzie. Kwasy pochodzące od elektroujemnych
pierwiastków bloku s i p można podzielić na kwasy
beztlenowe i kwasy tlenowe czyli oksokwasy.
Przykłady:
Kwasy beztlenowe
HCN – kwas cyjanowodorowy
HN
3
– kwas azotowodorowy
H
2
S – kwas siarkowodorowy
HF – kwas fluorowodorowy
HCl – kwas solny (chlorowodorowy)
HBr – kwas bromowodorowy
HI – kwas jodowodorowy
H[BF
4
] – kwas tetrafluoroborowy(III)
H[PF
6
] – kwas heksafluorofosforowy(V)
Kwasy tlenowe
HBO
2
– kwas borowy(III)
H
2
CO
3
– kwas węglowy
HNO
2
– kwas azotowy(III)
HNO
3
– kwas azotowy(V)
H
3
PO
3
– kwas fosforowy(III)
H
3
PO
4
– kwas fosforowy(V)
H
3
AsO
4
– kwas arsenowy(V)
H
2
SO
3
– kwas siarkowy(IV)
H
2
SO
4
– kwas siarkowy(VI)
H
2
SeO
4
– kwas selenowy(VI)
HClO
4
– kwas chlorowy(VII)

Kwasy rozpuszczone w roztworach wodnych mają
różną moc jako elektrolity. Można je podzielić na
kwasy mocne, kwasy średniej mocy i kwasy słabe. Moc
kwasów oceniamy w oparciu o ich stałe dysocjacji K
a
.
W praktyce stosuje się ujemny logarytm stałej
dysocjacji:
pK
a
= - log K
a
(2)
Im mniejsza jest wartość pK
a
, tym większa jest wartość
K
a
i moc danego kwasu. Kwasy jednoprotonowe
(jednozasadowe), np. HF, HBO
2
, HNO
2
, HClO
4
dysocjują w jednym tylko etapie. Natomiast dysocjację
kwasów wieloprotonowych (wielozasadowych), np.
H
2
SO
4
, H
3
PO
4
, traktujemy jako proces etapowy,
dlatego każdy i-ty etap dysocjacji danego kwasu
charakteryzujemy i-tą wartością stałej dysocjacji K
ai
.
Przykłady:
Kwas pK
a
Określenie mocy
HClO 7,54 bardzo słaby
HN
3
4,64 słaby
HNO
2
3,15 średniej mocy
HNO
3
-1,43 mocny
HClO
4
-1,58 mocny
H
3
PO
4
2,15 (pK
a1
) średniej mocy na I etapie
7,18 (pK
a2
) bardzo słaby na II i III
12,38 (pK
a3
) etapie
H
2
SO
4
-3 (pK
a1
) mocny na I etapie
1,99 średniej mocy na II etapie

Wodorotlenki
Wodorotlenki M(OH)
n
zawierają kation metalu
bloku s i p lub kation amonowy, NH
4
+
.
Przykłady
LiOH - wodorotlenek litu
NaOH – wodorotlenek sodu
KOH – wodorotlenek potasu
CsOH – wodorotlenek cezu
TlOH – wodorotlenek talu(I)
Be(OH)
2
– wodorotlenek berylu
Mg(OH)
2
– wodorotlenek magnezu
Ba(OH)
2
– wodorotlenek baru
Al(OH)
3
– wodorotlenek glinu
Ga(OH) – wodorotlenek galu
Sn(OH)
2
– wodorotlenek cyny(II)
Pb(OH)
2
– wodorotlenek ołowiu(II)
NH
4
OH – wodorotlenek amonu
Wodorotlenki dzielimy na zasadowe, które reagują
z kwasami dając sole, natomiast nie reagują
z zasadami, np. NaOH, Ca(OH)
2
, Bi(OH)
3
, NH
4
OH:
NaOH + HBr = NaBr + H
2
O
Ca(OH)
2
+ H
2
SO
4
= CaSO
4
+ 2H
2
O
NH
4
OH + HNO
3
= NH
4
NO
3
+ H
2
O
Bi(OH)
3
+ 3HCl = BiCl
3
+ 3H
2
O
oraz
wodorotlenki
amfoteryczne,
np.
Be(OH)
2
,
Al(OH)
3
, Ga(OH)
3
, Sn(OH)
2
, Pb(OH)
2
, które reagują
z kwasami i mocnymi zasadami i obydwu przypadkach
powstają odpowiednie sole, np.:

Al(OH)
3
+ 3HCl = AlCl
3
+ 3 H
2
O
trichlorek glinu
Al(OH)
3
+ NaOH = Na[Al(OH)
4
]
tetrahydroksoglinian(III) sodu
Niektóre wodorotlenki są słabo, np. Ca(OH)
2
, lub
trudno rozpuszczalne, np. Be(OH)
2
, Mg(OH)
2
, Al(OH)
3
,
Ga(OH)
3
, Sn(OH)
2
, Pb(OH)
2
, w wodzie.
Wodorotlenki NaOH, KOH, CsOH, Ba(OH)
2
, TlOH są
dobrze rozpuszczalne w wodzie i są mocnymi zasadami.
Wodorotlenek amonu, NH
4
OH dobrze rozpuszcza się
w wodzie, ale jest słabą zasadą.
Sole pierwiastków bloku s i p
Sole omawianych pierwiastków w stanie stałym
mają strukturę krystaliczną i z bardzo nielicznymi
wyjątkami (np. SnCl
2
) o charakterze kryształów
jonowych. W węzłach sieci krystalicznej występują
kationy, np. Na
+
, Ba
2+
, NH
4
+
, oraz aniony (reszty
kwasowe), np. Cl
-
, NO
3
-
, CO
3
2-
.
Wiele soli spotykamy w przyrodzie jako
minerały, np. NaCl - sól kamienna, halit. Znaczne
ilości soli zawiera woda morska.
Znamy
szereg
metod
otrzymywania
soli.
Najczęściej stosuje się zobojętnienie kwasów
zasadami, np.:
HI + KOH = NaI + H
2
O
H
+
+ OH
-
= H
2
O
Kolejnym sposobem jest roztwarzanie tlenków
metali w kwasach, np.:
MgO + 2HCl = MgCl
2
+ H
2
O

Sole dzielimy na:
● proste, np. KCl, BaSO
4
● kompleksowe, np. Na[BF
4
]
● podwójne, np. MgCO
3
∙CaCO
3
● mieszane, np. (Na,K)Cl
● sole hydratowane (krystalohydraty),
np. Na
2
SO
4
∙10H
2
O
Zwykle mamy do czynienia z solami o charakterze
obojętnym. Znane są również sole powstałe
w wyniku częściowego zobojętniania kwasów
wieloprotonowych lub zasad wielowodorotlenowych.
Wodorosole (sole kwaśne), np.:
KHSO
4
– wodorosiarczan(VI) potasu,
NaH
2
PO
4
– diwodorofosforan(V) sodu,
MgHPO
4
– wodorofosforan(V) magnezu,
można
otrzymać
w
reakcjach
częściowego
zobojętniania kwasu siarkowego(VI) i kwasu
fosforowego(V) zasadami.
H
2
SO
4
+ KOH = KHSO
4
+ H
2
O
H
3
PO
4
+ NaOH = NaH
2
PO
4
+ H
2
O
H
3
PO
4
+ Mg(OH)
2
= MgHPO
4
+ 2H
2
O
Hydroksosole (sole zasadowe), np.
Mg(OH)Cl – chlorek hydroksomagnezu
Ca(OH)Cl - chlorek hydroksowapnia
są produktami częściowego zobojętnienia kwasem
solnym wodorotlenków magnezu i wapnia.
Mg(OH)
2
+ HCl = Mg(OH)Cl + H
2
O
Hydroksosolą jest występujący w przyrodzie
hydroksoapatyt – Ca
5
(OH)(PO
4
)
3
.
Związki kompleksowe
Znana jest spora liczba związków kompleksowych
boru, glinu, galu, indu, talu, cyny, ołowiu i bizmutu.
Niektóre z nich mają znaczenie praktyczne, np.:
Li[AlH
4
] – tetrahydrydoglinian(III) litu stosowany
do syntezy wodorków wodorków berylu i krzemu;
Na[BH
4
] – tetrahydrydoboran(III) sodu w reakcjach
redukcji i uwodorniania;
Na
3
[AlF
6
] – heksafluoroglinian(III) sodu (kriolit)
stosowany
w
hutach
aluminium
(elektroliza
stopionej soli z dodatkiem Al
2
O
3
);
H[BF
4
] – kwas tetrafluorobowy(III) jest składnikiem
elektrolitu używanego do produkcji ołowiu na
drodze elektrolizy;
H
2
[SiF
6
] – kwas hehsafluorokrzemowy stosowany do
produkcji elektrolitycznego ołowiu;
Na
2
[Sn(OH)
4
] – tetrahydroksocynian(II) sodu jest
silnym reduktorem.
Węgliki i azotki
Na uwagę zasługują dwa połączenia, mianowicie
azotek boru – BN i węglik krzemu – SiC. Są to
związki bierne chemicznie, odporne na działanie
wysokich temperatur, bardzo twarde lecz dające się
obrabiać mechaniczne.
Zastosowania: BN - materiał ścierny i specjalny
materiał ceramiczny; SiC - pręty grzejne, końcówki
wierteł, detale odporne na ścieranie.

Wyszukiwarka
Podobne podstrony:
9 Przegld podstawowych klas zwizkw pierwiastkw blokw d i f
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
matematyka podstawowe wzory i Nieznany
miao wykl 6 projektowanie klas Nieznany
krzysztofik,podstawy telekomuni Nieznany (2)
instrukcja podstawy AutoCad 1 i Nieznany
16 Wytwarzanie podstawowych pol Nieznany (2)
Podstawy automatyki (w 1 i 2) p Nieznany
Noworyta, podstawy inzynierii c Nieznany (4)
PRZEGLOS id 404380 Nieznany
Podstawy przedsiebiorczosci 3 i Nieznany
więcej podobnych podstron