Egzamin maturalny z chemii. Poziom rozszerzony
Copyright by Studium Oświatowe „Tutor”
dr inż. Zdzisław Głowacki, Toruń 2013
MODEL OCENIANIA ZAWIERA INFORMACJE PRAWNIE CHRONIONE
DO MOMENTU ZAKOŃCZENIA EGZAMINU!
TUTOR
CH-R 201303
Ogólne zasady oceniania są takie same jak dla wszystkich prac maturalnych z chemii.
1. Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające
poleceniom zawartym w zadaniach.
2. Rozwiązania zadań, uwzględniające inny tok rozumowania niż podany w kryteriach, oceniane są
zgodnie z zasadami punktacji. Uczeń może udzielić inaczej sformułowanych odpowiedzi lub
uzasadnień o innej treści niż podane w modelu – osoba oceniająca powinna starannie
przeanalizować takie zapisy. Jeżeli są one merytorycznie poprawne i odpowiadają na zadane
pytanie, to należy przyznać punkty za taką odpowiedź.
3. Istnieje kilka systemów ustalania nazw związków chemicznych, jeżeli uczeń podaje poprawną
nazwę, która nie jest wyszczególniona w tym modelu oceniania, to otrzymuje punkty zgodnie
z zasadami punktacji. Jeżeli w poleceniu jest wymagane podanie nazwy systematycznej, to
podanie nazwy zwyczajowej jest odpowiedzią nieprawidłową.
4. Gdy do jednego polecenia zdający podaje kilka odpowiedzi (z których jedna jest prawidłowa,
inne nieprawidłowe), to nie otrzymuje punktów za żadną z nich.
5. Jeżeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający powinien napisać
równanie reakcji chemicznej, a nie jej schemat.
6. Dobór współczynników w równaniach reakcji chemicznych może różnić się od przedstawionego
w modelu (np. mogą być zwielokrotnione), ale bilans musi być prawidłowy. Niewłaściwy dobór
lub brak współczynników powoduje utratę 1 punktu za zapis tego równania.
7. W rozwiązaniach zadań rachunkowych oceniane są: metoda, wykonanie obliczeń i podanie
wyniku z jednostką. W obliczeniach cząstkowych zapis jednostek nie jest wymagany, ale jeśli
jednostki są, to muszą być poprawne. Błędny zapis jednostki lub jej brak przy ostatecznym
wyniku liczbowym powoduje utratę 1 punktu. W obliczeniach wymagane jest poprawne
zaokrąglanie wyników liczbowych.
8. Za poprawne obliczenia będące konsekwencją zastosowania niepoprawnej metody zdający nie
otrzymuje punktów.
9. Za poprawne spostrzeżenia i wnioski będące konsekwencją niewłaściwie zaprojektowanego
doświadczenia zdający nie otrzymuje punktów.
10. Za napisanie wzorów strukturalnych zamiast wzorów półstrukturalnych (grupowych) nie
odejmuje się punktów.
11. Zapis „↑”, „↓” w równaniach reakcji nie jest wymagany.
12. Należy uznać „Δ” i „T” jako oznaczenie podwyższonej temperatury.
13. W równaniach reakcji, w których ustala się stan równowagi, brak „
⇄” nie powoduje utraty
punktów.
14. Elementy odpowiedzi, podane w tym modelu, umieszczone w nawiasach nie są wymagane.
2
Próbny egzamin maturalny z chemii – poziom rozszerzony – TUTOR – marzec 2013
MODEL OCENIANIA
© Oficyna Wydawnicza, Studium Oświatowe „Tutor”
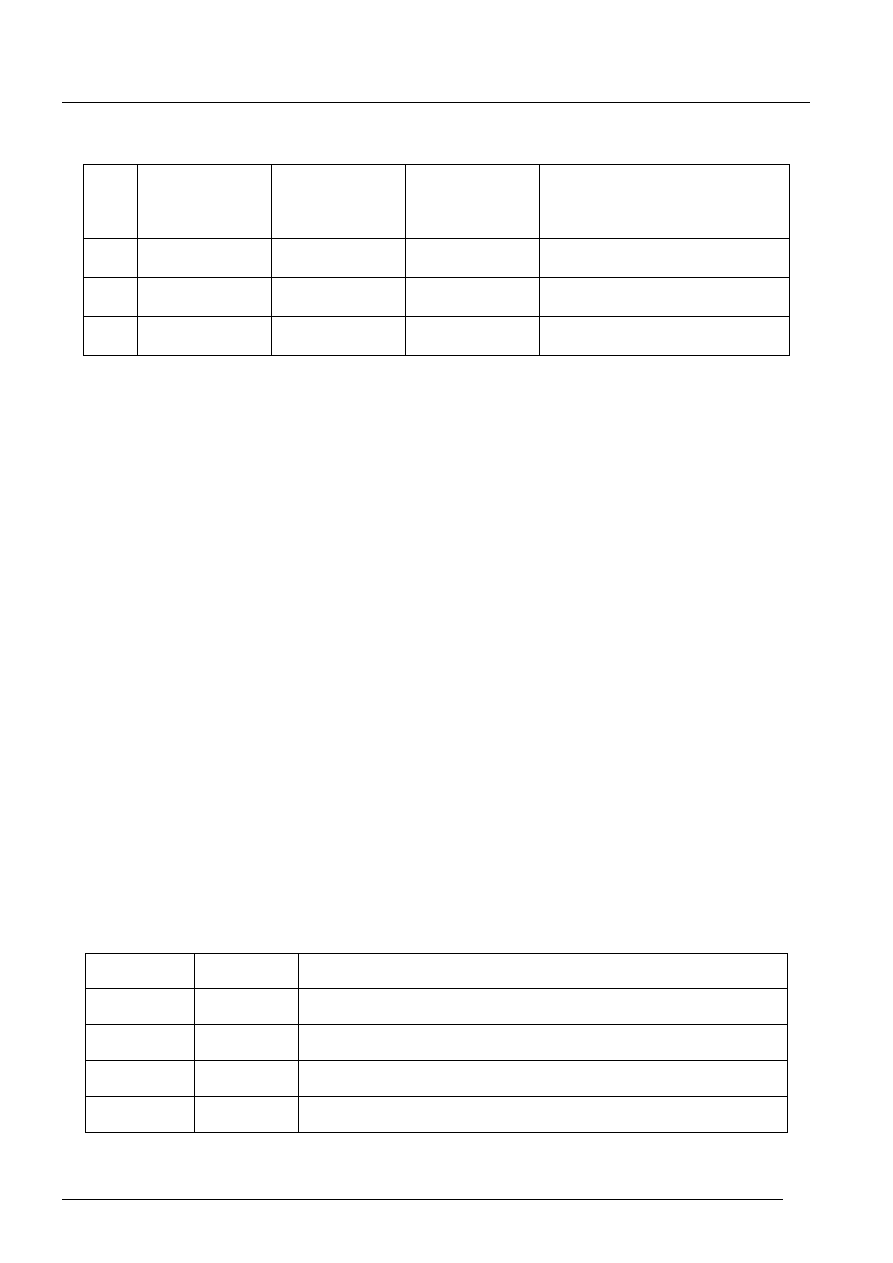
Zadanie 1. (2 pkt)
liczba
elektronów
w atomie
liczba
powłok
elektronowych
liczba
niesparowanych
elektronów
walencyjnych
nazwa grupy, do której należy
pierwiastek
Be
4
2
0
berylowce
N
7
2
3
azotowce
Cu
29
4
1
miedziowce
[2 pkt za wszystkie prawidłowe odpowiedzi; 1 pkt w przypadku popełnienia maksymalnie dwóch błędów]
Zadanie 2. (1 pkt)
1. P, 2. F, 3. F
[1 pkt za wszystkie prawidłowe odpowiedzi]
Zadanie 3. (1 pkt)
Zadanie 4. (1 pkt)
Wiek tej włóczni wynosi 11 520 lat.
Zadanie 5. (2 pkt)
1) Równanie zachodzącej reakcji chemicznej:
a
a
↑
[1 pkt w przypadku poprawnej odpowiedzi]
2) 85,9%
[1 pkt w przypadku poprawnej odpowiedzi]
Zadanie 6. (1 pkt)
wzór
chemiczny
typ wiązania między atomami w molekułach
woda
H
2
O
atomowe spolaryzowane
amoniak
NH
3
atomowe spolaryzowane
chlorek sodu
NaCl
jonowe
azot
N
2
atomowe niespolaryzowane
[1 pkt w przypadku wszystkich poprawnych odpowiedzi]
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
3
www.szkolna.pl
,
www.tutor.edu.pl
Zadanie 7. (2 pkt)
I.
2 KMnO
4
(1) K
2
MnO
4
+ (1) MnO
2
+ (1) O
2
↑
II.
2 HgO
(1) O
2
↑ 2 Hg
[1 pkt za prawidłowe uzupełnienie obu równań]
Objętość tlenu (w warunkach normalnych) wynosi 213 cm
3
.
[1 pkt w przypadku poprawnej odpowiedzi]
Zadanie 8. (1 pkt)
CH
3
CH
2
OH
H
2
O
H
2
CO
3
CH
3
COOH
ClCH
2
COOH
[1 pkt w przypadku pełnej poprawnej odpowiedzi]
Zadanie 9. (1 pkt)
odczyn roztworu kwaśny
odczyn roztworu obojętny
odczyn roztworu zasadowy
II, VI
III
I, IV, V
[1 pkt w przypadku pełnej poprawnej odpowiedzi]
Zadanie 10. (1 pkt)
dpowiedź D.
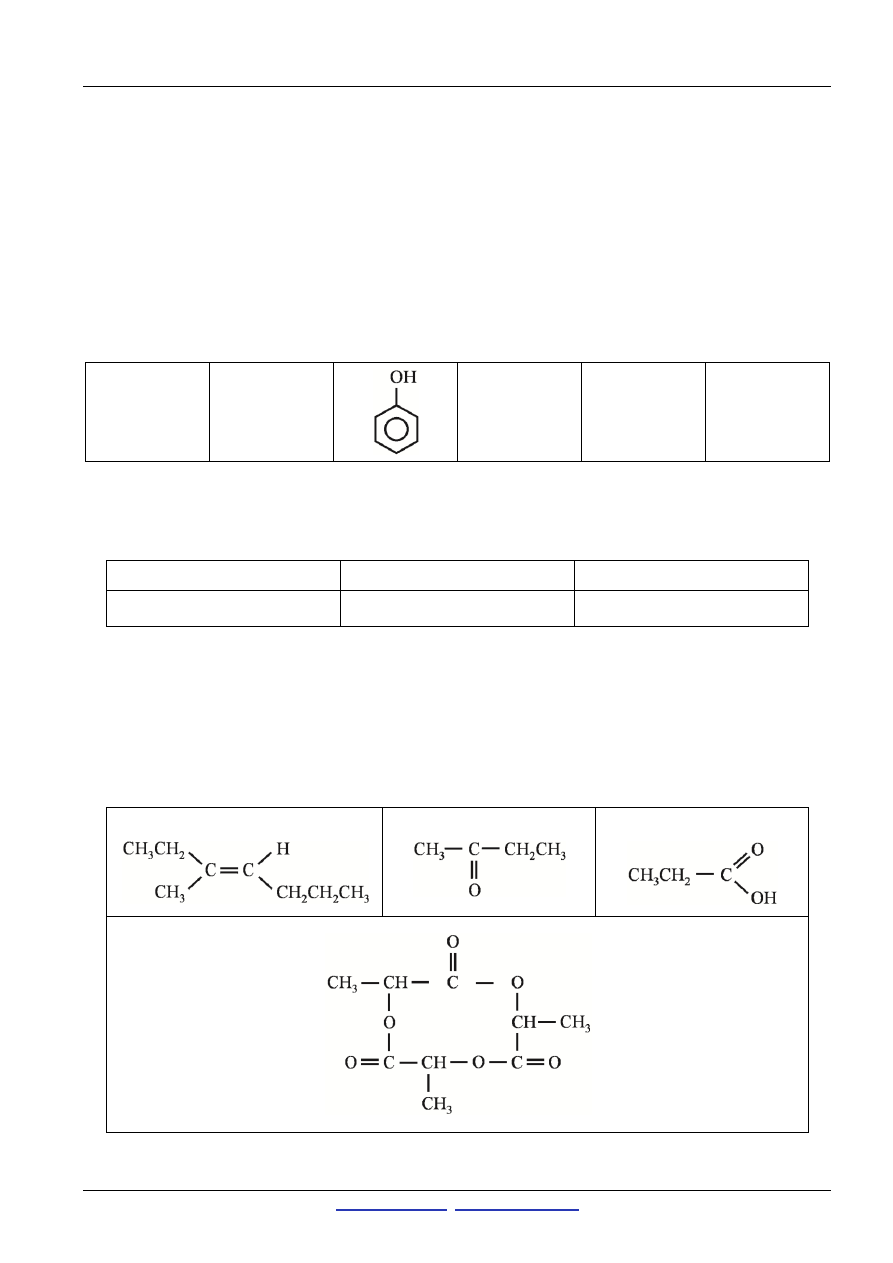
Zadanie 11. (2 pkt)
A
B
C
D
[2 pkt za narysowanie wszystkich cząsteczek poprawnie, 1 pkt za co najmniej dwie poprawnie narysowane cząsteczki]
4
Próbny egzamin maturalny z chemii – poziom rozszerzony – TUTOR – marzec 2013
MODEL OCENIANIA
© Oficyna Wydawnicza, Studium Oświatowe „Tutor”
Zadanie 12. (1 pkt)
10 atomów (można wyliczyć lub odczytać ze wzoru sumarycznego)
Zadanie 13. (2 pkt)
Grupa A. hydroksylowa lub wodorotlenowa
Grupa B. aminowa lub aminowa II-rzędowa
[ pkt za obie prawidłowe odpowiedzi; 1 pkt w przypadku jednej poprawnej odpowiedzi]
Zadanie 14. (2 pkt)
zasada sodowa
reakcja nie zachodzi
kwas solny
[ pkt za obie prawidłowe odpowiedzi; 1 pkt w przypadku jednej poprawnej odpowiedzi]
Zadanie 15. (1 pkt)
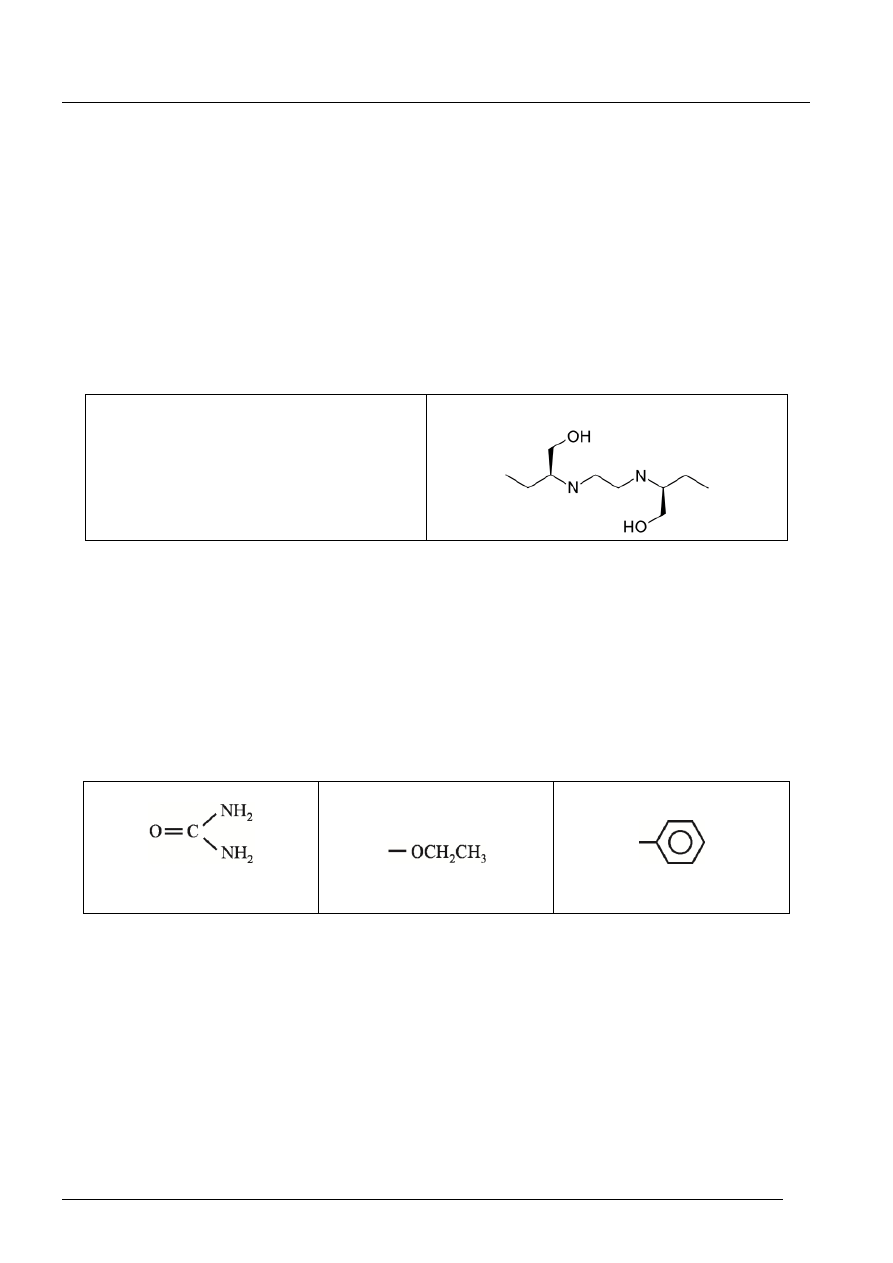
Przykładowa odpowiedź.
Etambutol jest związkiem chiralnym – w cząsteczce znajdują się dwa centra stereogeniczne – dwa
asymetryczne atomy węgla. (Można też zwrócić uwagę na występowanie formy mezo dla tego
związku.)
Zadanie 16. (2 pkt)
mocznik
grupa etoksylowa
grupa fenylowa
[ pkt za trzy prawidłowe odpowiedzi; 1 pkt w przypadku dwóch poprawnych odpowiedzi]
Zadanie 17. (1 pkt)
Wzór sumaryczny: C
9
H
12
N
2
O
2
.
Masa molowa dulcyny: 180 g/mol.
Zadanie 18. (2 pkt)
a) sacharoza
b) obojętny – cząsteczka nie posiada żadnych grup o charakterze kwasowym lub zasadowym
[2 pkt za obie prawidłowe odpowiedzi; 1 pkt w przypadku jednej poprawnej odpowiedzi]
H
2
Cl
H
2
Cl

© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
5
www.szkolna.pl
,
www.tutor.edu.pl
Zadanie 19. (2 pkt)
opis reakcji
1.
2.
3.
4.
5.
mechanizm – rodzaj
reakcji chemicznej
E.
D.
B.
C.
A.
[2 pkt za wszystkie prawidłowe odpowiedzi; 1 pkt w przypadku co najmniej trzech poprawnych odpowiedzi]
Zadanie 20. (3 pkt)
kwas 2-aminopentanodiowy
kwas aminoetanowy lub kwas aminooctowy
kwas 2-aminopropanowy
kwas 2-amino-3-hydroksypropanowy
[2 pkt za wszystkie prawidłowe odpowiedzi; 1 pkt w przypadku co najmniej dwóch poprawnych odpowiedzi]
Odpowiedź: Masa aminokwasów wynosi 252,5 g.
[1 pkt w przypadku poprawnej odpowiedzi]
Zadanie 21. (1 pkt)
Wykorzystując do obliczeń entalpie spalania reagentów otrzymujemy zależność:
H =
802
(
285
3
247) = 224 kJ
Odpowiedź: Standardowa entalpia reakcji wynosi 224 kJ.
[1 pkt w przypadku poprawnej odpowiedzi]
Zadanie 22. (2 pkt)
ester
+
woda
kwas
+
alkohol
początek
4
5
1
0
stan równowagi
4
x
5
x
1 + x
x
K =
kwas alkohol
ester woda
, otrzymujemy x = 1,2 mola
Odpowiedź: W wyniku hydrolizy estru powstało 1, mola alkoholu.
[ pkt za prawidłową odpowiedź wynikającą z poprawnych obliczeń; 1 pkt w przypadku przedstawienia częściowego
rozwiązania – co najmniej zapisania równania reakcji, podania wzoru na wartość stałej K i zestawienia danych
liczbowych do obliczeń]
Zadanie 23. (2 pkt)
kwas
H
3
O
+
HCl
H
2
O
HSO
NH
3
sprzężona zasada
H
2
O
Cl
OH
SO
NH
[ pkt za pięć prawidłowych odpowiedzi; 1 pkt w przypadku czterech poprawnych odpowiedzi]
6
Próbny egzamin maturalny z chemii – poziom rozszerzony – TUTOR – marzec 2013
MODEL OCENIANIA
© Oficyna Wydawnicza, Studium Oświatowe „Tutor”
Zadanie 24. (1 pkt)
Obliczenia:
I
R
= [Ag
+
] [Cl
]
[Cl
] = 0,1 mol/dm
3
, [Ag
+
] = 5,88
10
6
mol/ dm
3
I
S
= 5,88
10
7
> 10
10
Odpowiedź: sad się wytrąci, iloczyn stężeń jonów Ag
+
i Cl
przekroczy iloczyn rozpuszczalności
AgCl.
[ pkt za prawidłową odpowiedź wynikającą z poprawnych obliczeń; 1 pkt w przypadku przedstawienia częściowego
rozwiązania – co najmniej zapisania wzoru na wartość iloczynu rozpuszczalności i zestawienia danych liczbowych do
obliczeń]
Zadanie 25. (2 pkt)
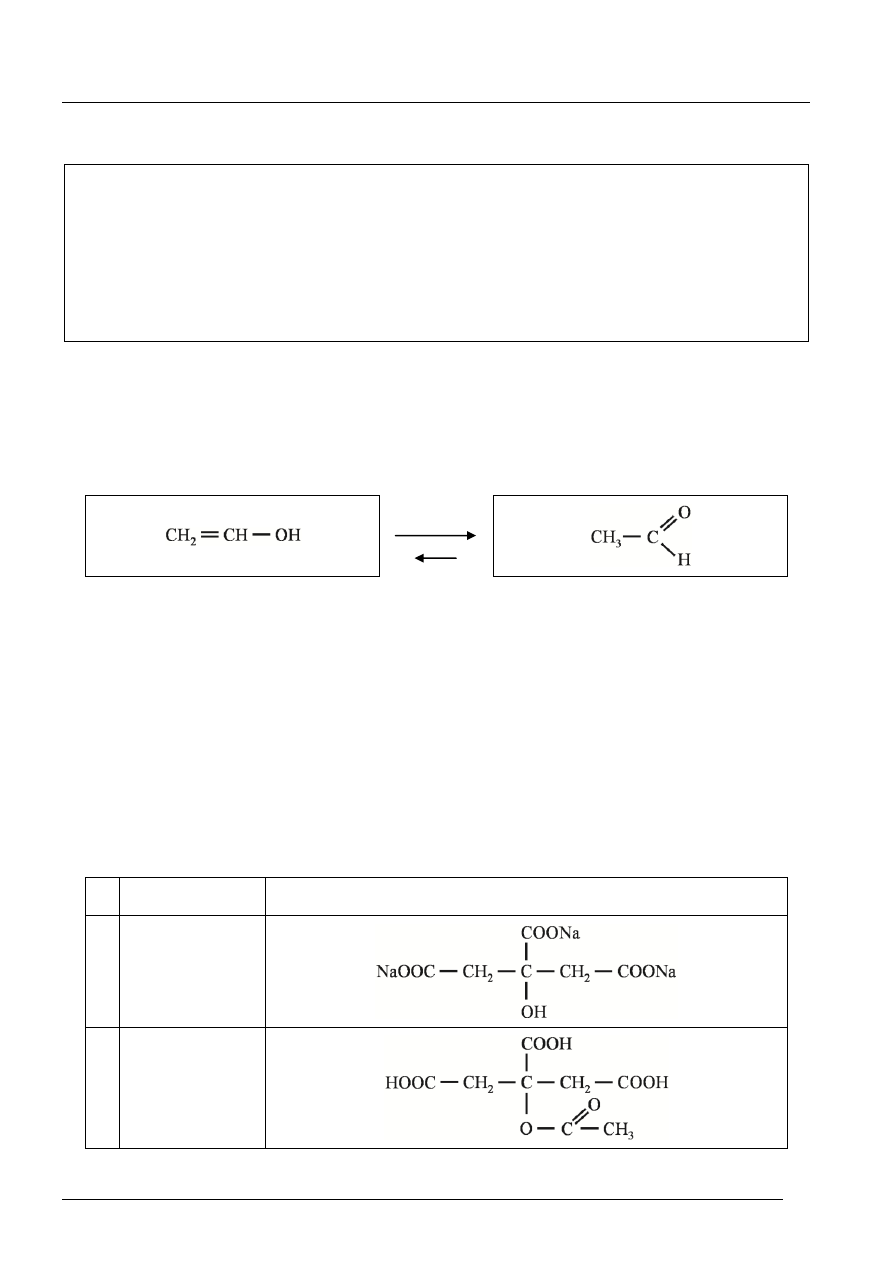
Schemat tautomeryzacji
alkohol winylowy
forma enolowa
aldehyd octowy
forma aldehydowa
Uczeń uzasadnia przegrupowanie powstaniem trwalszej cząsteczki, o niższej energii, w wyniku
przemieszczenia pary elektronowej do elektroujemnego atomu tlenu i utworzenia grupy
karbonylowej. np.:
Przyczyną przegrupowania enoli do aldehydów lub ketonów jest powstanie cząsteczki o niższej
energii lub bardziej trwałej (stabilniejszej) formy z grupą karbonylową.
[1 pkt za poprawnie narysowane wzory; 1 pkt za podanie przyczyny zachodzącego przegrupowania]
Zadanie 26. (2 pkt)
substrat
produkt główny
1.
NaOH
(aq)
2.
(CH
3
CO)
2
O
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
7
www.szkolna.pl
,
www.tutor.edu.pl
substrat
produkt główny
3.
CH
3
OH
4.
HCl
(aq)
reakcja chemiczna nie zajdzie
[2 pkt za cztery prawidłowe odpowiedzi; 1 pkt w przypadku co najmniej dwóch poprawnych odpowiedzi]
Zadanie 27. (3 pkt)
Obliczenia:
kwas: 40 cm
3
10% H
2
SO
4
, masa m
k
= 42,64 g
zasada: 0% roztwór Na H, masa m
z
= 42,64 g, V
z
= 34,98 cm
3
35 cm
3
liczby moli:
n
k
= 0,0435 moli,
n
z
= 0,213 moli
n
H+
= 0,087 moli,
n
OH
= 0,213 moli
nadmiar jonów H
bjętość Na H 34,98 cm
3
35 cm
3
[1 pkt w przypadku poprawnej odpowiedzi]
dczyn końcowego roztworu – zasadowy.
[1 pkt w przypadku podania tylko poprawnej odpowiedzi]
Uzasadnienie – np. liczba moli zasady jest wyższa od liczby moli jonów wodorowych w kwasie –
w wyniku reakcji zobojętnienia otrzymamy nadmiar jonów wodorotlenowych w roztworze.
[1 pkt w przypadku poprawnego uzasadnienia odpowiedzi]
Zadanie 28. (1 pkt)
Obliczenia:
60%
15
10% :
60%
35
:
15
25%
7
:
3
10%
35
Odpowiedź: 7 cz. kwasu 10% do 3 cz. kwasu 60%
8
Próbny egzamin maturalny z chemii – poziom rozszerzony – TUTOR – marzec 2013
MODEL OCENIANIA
© Oficyna Wydawnicza, Studium Oświatowe „Tutor”
Zadanie 29. (2 pkt)
Nr
Nazwa
I
Np.
chlor/chlorek żelaza(III)
lub chlor/chlorek glinu
lub chlor/katalizator
II
kwas benzenosulfonowy
III
3-bromonitrobenzen
IV
aldehyd benzenokarboksylowy
lub aldehyd benzoesowy
[ pkt za cztery prawidłowe odpowiedzi; 1 pkt w przypadku co najmniej dwóch poprawnych odpowiedzi]
Zadanie 30. (1 pkt)
Uczeń podkreśla te cząsteczki, które posiadają moment dipolowy równy zeru.
3
3
CH
CH
Cl
CH
3
4
CH
4
CCl
2
O
2
H
Cl
H
O
H
2
[1 pkt w przypadku wszystkich poprawnych odpowiedzi]
Zadanie 31. (1 pkt)
Z podanego zbioru można wybrać dwie pary enancjomerów: . i 4. lub 4. i 5. – wzory 3. i 5.
przedstawiają tą samą cząsteczkę.
[1 pkt w przypadku wskazania jednej z par enancjomerów]
Zadanie 32. (1 pkt)
Prawidłowe odczynniki to d., e. oraz f.
[1 pkt w przypadku wskazania co najmniej dwóch poprawnych odczynników; 0 pkt jeżeli uczeń wskazał jeden
niewłaściwy odczynnik]
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
9
www.szkolna.pl
,
www.tutor.edu.pl
Zadanie 33. (6 pkt)
A.
CaO + 3 C
CaC
2
+ CO
lub
2 CaO + 5 C
2 CaC
2
+ CO
2
[1 pkt w przypadku poprawnie zapisanego równania reakcji]
B.
1,1-dichloroetan (produkt główny zgodny z regułą Markownikowa)
reakcja 4.
benzen
reakcja 5.
addycja (elektrofilowa)
reakcja 3.
[2 pkt za wszystkie prawidłowe odpowiedzi; 1 pkt w przypadku co najmniej dwóch poprawnych odpowiedzi]
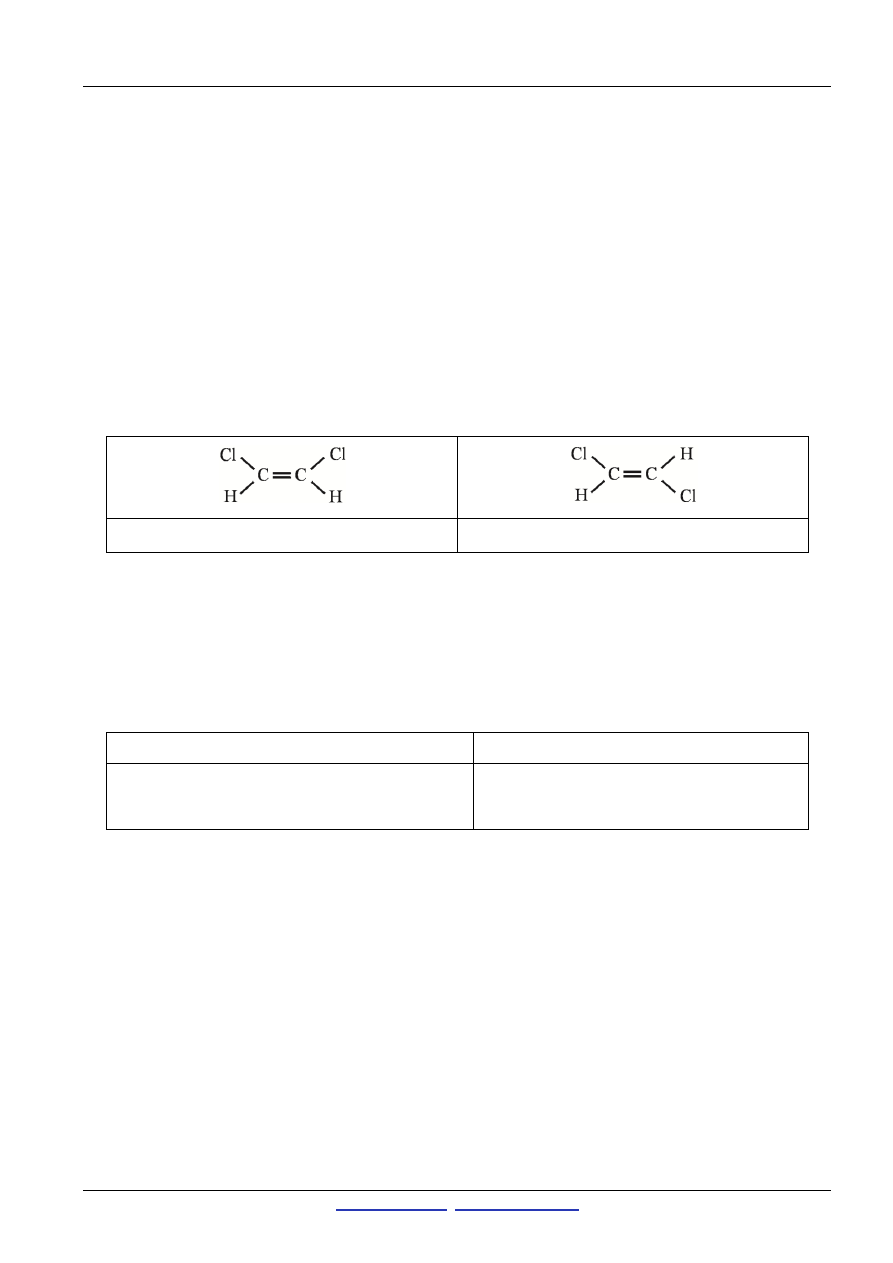
C.
Nazwa: cis-1,2-dichloroeten
Nazwa: trans-1,2-dichloroeten
[2 pkt za pełną prawidłową odpowiedź; 1 pkt w przypadku dwóch poprawnych wzorów bez podania nazw]
D.
Chloroeten lub chlorek winylu – gęstość ,79 g/dm
3
[1 pkt pełną prawidłową odpowiedź]
Zadanie 34. (1 pkt)
największa
najmniejsza
II.
I.
[1 pkt za pełną prawidłową odpowiedź]
10
Próbny egzamin maturalny z chemii – poziom rozszerzony – TUTOR – marzec 2013
MODEL OCENIANIA
© Oficyna Wydawnicza, Studium Oświatowe „Tutor”
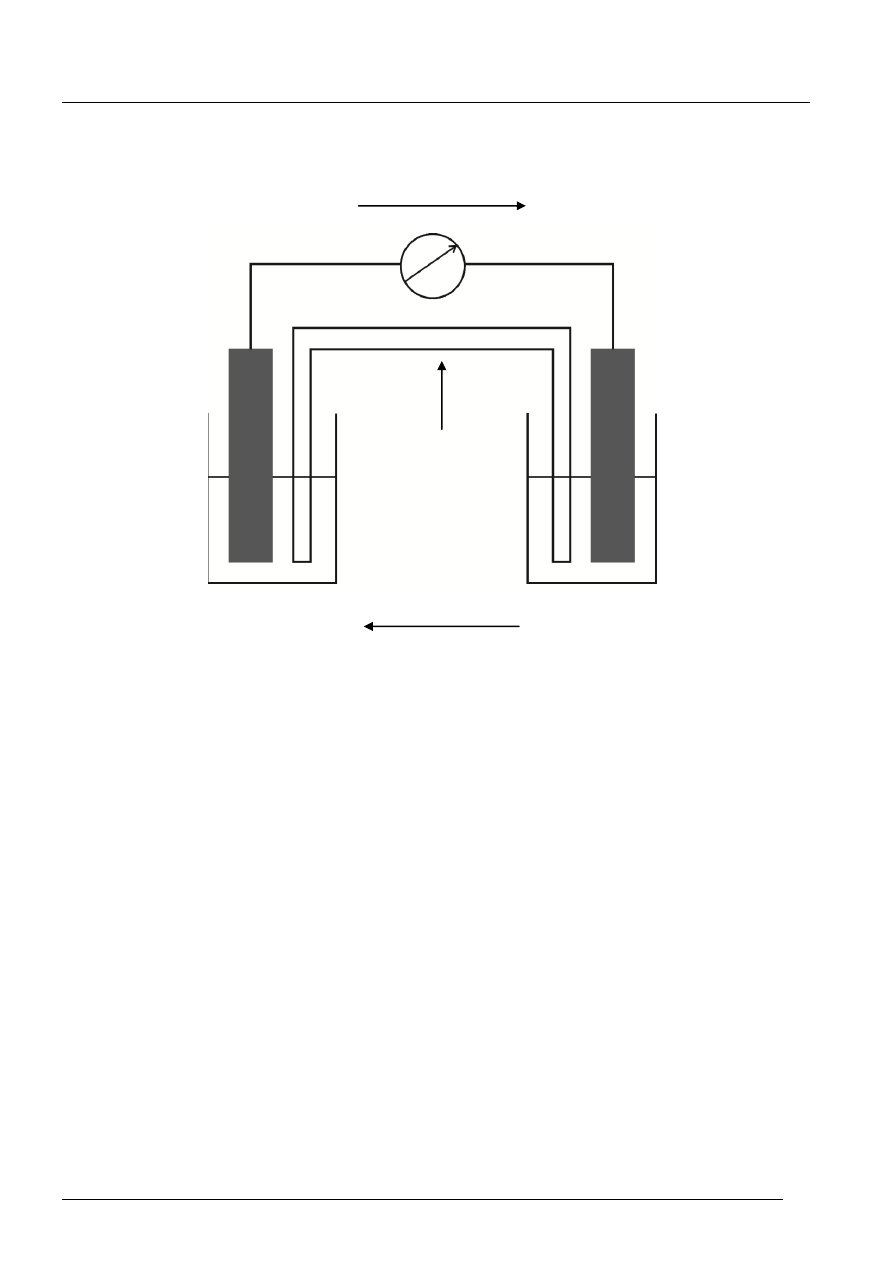
Zadanie 35. (1 pkt)
ruch elektronów
ruch jonów
Siła elektromotoryczna tego ogniwa wynosi: 0, 8 V
[1 pkt za pełną prawidłową odpowiedź]
klucz elektrolityczny
A (
)
anoda
elektroda ujemna
E
0
=
0,14 V
potencjał niższy
utlenienie Sn
K (+)
katoda
elektroda dodatnia
E
0
= 0,34 V
potencjał wyższy
redukcja Cu
2+
Sn
Cu
Wyszukiwarka
Podobne podstrony:
Chemia PR 2013 Tutor
2010 klucz chemia pr
JEZYK POLSKI PR 2013 KLUCZ id 2 Nieznany
2007 operon klucz chemia pr
czerwiec 2013 chemia PR
2010 klucz chemia pr
chemia r 2013 tutor odp
Chemia PR operon listopad 2013
chemia r 2013 tutor arkusz
chemia3 pr p2012
bialoruski pr 2013
Cennik biletów jednorazowych na pociągi PR 2013 IX
chemia ZR U 2013
więcej podobnych podstron