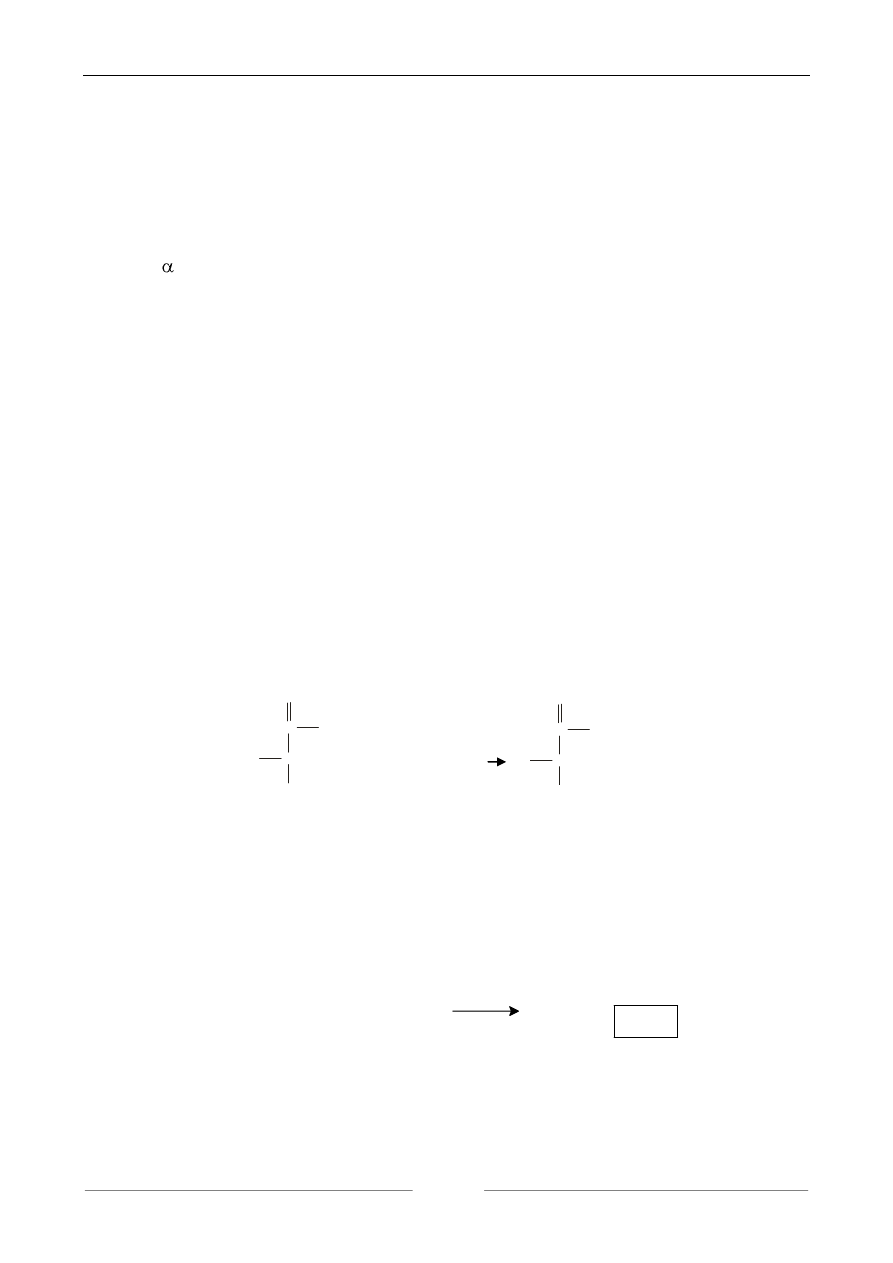
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 1
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
1
Ćwiczenie 1
Temat: WŁAŚCIWOŚCI FIZYKO-CHEMICZNE AMINOKWASÓW.
Część teoretyczna
Aminokwasy są to związki organiczne zawierające grupę karboksylową i aminową (zwykle w
położeniu w stosunku do grupy kwasowej). Obok aminokwasów alifatycznych są i takie które
zawierają pierścień aromatyczny, heterocykliczny lub dodatkowe grupy np. -OH,
-SH itp. Z uwagi na obecność dwóch podstawowych grup zdolnych do dysocjacji elektrolitycznej,
aminokwasy mają charakter jonu obojnaczego, reagując zarówno z kwasami jak i z zasadami (two-
rząc sole). Z uwagi na obecność węgla asymetrycznego związki te (z wyjątkiem glicyny) tworzą
dwa izomery przestrzenne, z których jedynie forma L występuje naturalnie. Szczegóły dotyczące
budowy i właściwości aminokwasów należy przyswoić w oparciu o dostępne podręczniki bioche-
mii.
Klasyfikacja aminokwasów
Aminokwasy dzieli się na grupy systematyczne w zależności od różnych kryteriów. Za naj-
ważniejszy uważa się podział aminokwasów pod względem ich budowy chemicznej. Inne podziały
to występowanie lub brak aminokwasów w białkach (aminokwasy białkowe i niebiałkowe) i wresz-
cie zdolność organizmów zwierzęcych i człowieka do syntezy poszczególnych aminokwasów (ami-
nokwasy endogenne i egzogenne). Szczegóły dotyczące klasyfikacji aminokwasów należy uzupeł-
nić z podręcznika.
Ogólne reakcje aminokwasów
1. ESTRYFIKACJA GRUPY KARBOKSYLOWEJ AMINOKWASU.
Estryfikacja grupy karboksylowej aminokwasu z grupą hydroksylową alkoholu zachodzi
zgodnie z reakcją:
O
C
O
C
H
2
N
R
H
+
HO-CH
2
-CH
3
O
C
O
C
H
2
N
R
H
-CH
2
-CH
3
+
H
2
O
H
aminokwas alkohol ester
Estry te w przeciwieństwie do aminokwasów są lotne a reakcja ich powstawania bywa wyko-
rzystywana w chromatografii gazowej, za pomocą której rozdziela się w sposób zautomatyzowany
substancje lotne.
2. TWORZENIE SIĘ WIĄZANIA PEPTYDOWEGO.
Wiązanie peptydowe tworzy się w reakcji grupy karboksylowej jednego aminokwasu z grupą
aminową drugiego aminokwasu zgodnie z reakcją:
H N-CH-COO + H N-CH-COO
R
R
1
2
+
+
_
_
|
|
3
3
H O
2
H N-CH-
CH-COO
+
_
_
R
R
1
2
3
|
|
CO-NH-
Reakcja ta ma szczególnie ważne znaczenie gdyż w ten sposób tworzą się peptydy i białka.
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 1
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
2
Część praktyczna
A) REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW
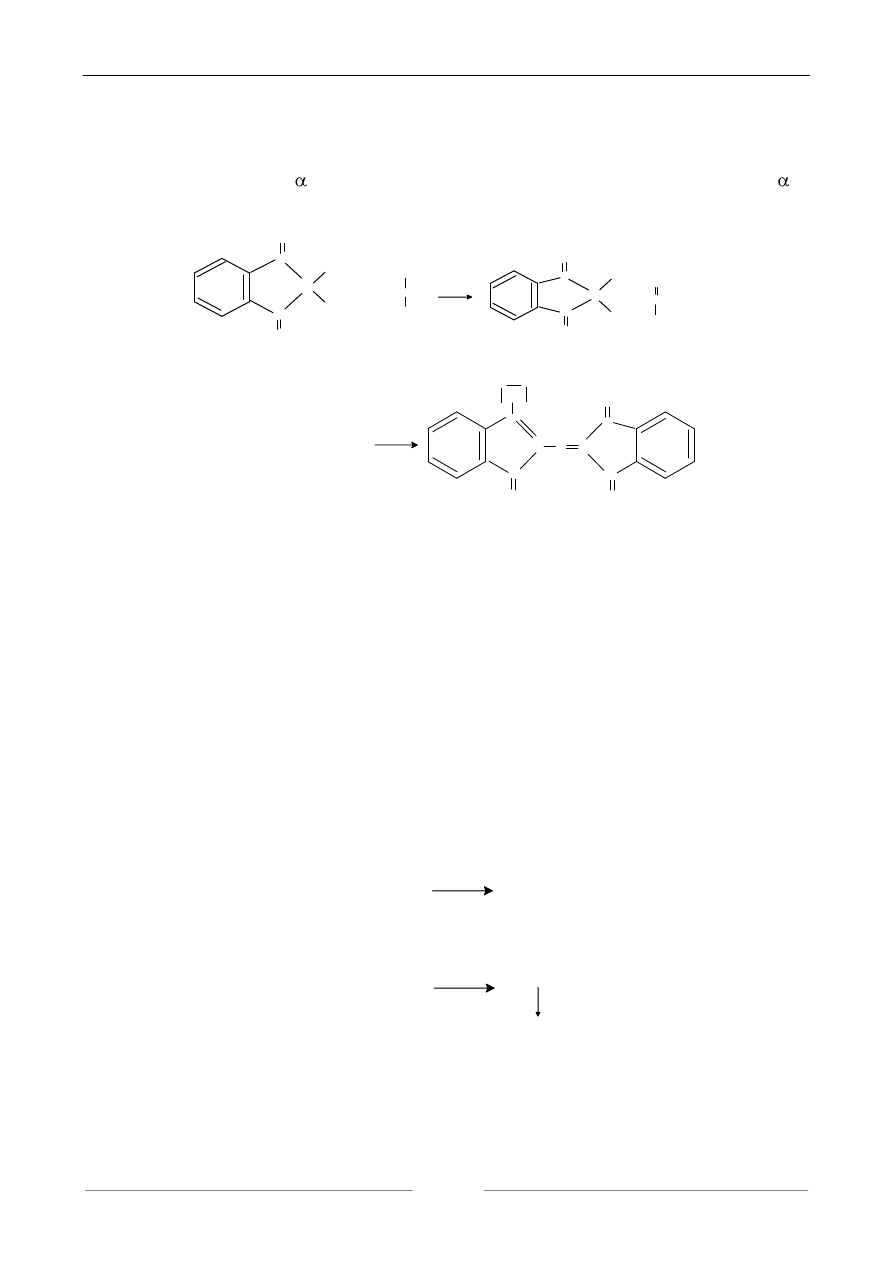
1. REAKCJA Z NINHYDRYNĄ
Charakterystyczna dla -aminokwasów ponieważ przebiega wówczas, gdy w położeniu w
stosunku do grupy karboksylowej znajduje się grupa aminowa. Przebiega ona w dwóch etapach:
+
+
3
NH
2
CO
R
O
C-H
+
H
C
C
C
O
O
OH
2
R
COOH
H N-C-H
+
OH
OH
O
C
C
C
O
ninhydryna aminokwas ninhydryna zredukowana
ninhydryna
zredukowana
+ ninhydryna + NH
3
C
C
C
O
O
N
C
_
C
C
O
O
+ 3 H O
2
fioletowo-niebieski kompleks barwny
Wydzielający się w czasie reakcji CO
2
można mierzyć manometrycznie w aparacie van Slyk-
e'a, zaś natężenie barwy kompleksu można mierzyć kolorymetrycznie. Reakcja ta daje więc pod-
stawy do ilościowego oznaczenia badanych aminokwasów, a także jest podstawową analizą jako-
ściową
.
Wykonanie:
1 ml badanego aminokwasu i 0,5 ml ninhydryny wymieszać w probówce i ogrzewać nad pal-
nikiem do wrzenia. Po chwili pojawia się fioletowe zabarwienie, a w przypadku proliny i hydroksy-
proliny zabarwienie żółte.
2. REAKCJA NA GRUPĘ TIOLOWĄ –SH
W środowisku silnie zasadowym z aminokwasów siarkowych takich jak cysteina odszczepia
się grupa -SH w postaci siarczków. Siarczki w obecności soli ołowiu tworzą czarny osad siarczku
ołowiu.
CH SH
CH NH
COOH
2
2
_
_
|
|
a/
2 NaOH
+
|
|
_
_
2
2
COOH
CH NH
CH OH
+ Na S + H O
2
2
b/
Na S + Pb(CH COO)
2
2
3
PbS + 2 CH COONa
3
czarny osad
Wykonanie:
1 ml 0,05% cystyny lub cysteiny i 10 kropli 20% NaOH ogrzewać w probówce nad palnikiem
do wrzenia. Następnie dodać 3-4 krople nasyconego roztworu octanu ołowiu i w dalszym ciągu
podgrzewać (do odparowania połowy objętości płynu). Obserwuje się wytrącanie czarnego siarczku
ołowiu, z którego po dodaniu kilku kropli stężonego HCl wydziela się siarkowodór
.
II
I
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 1
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
3
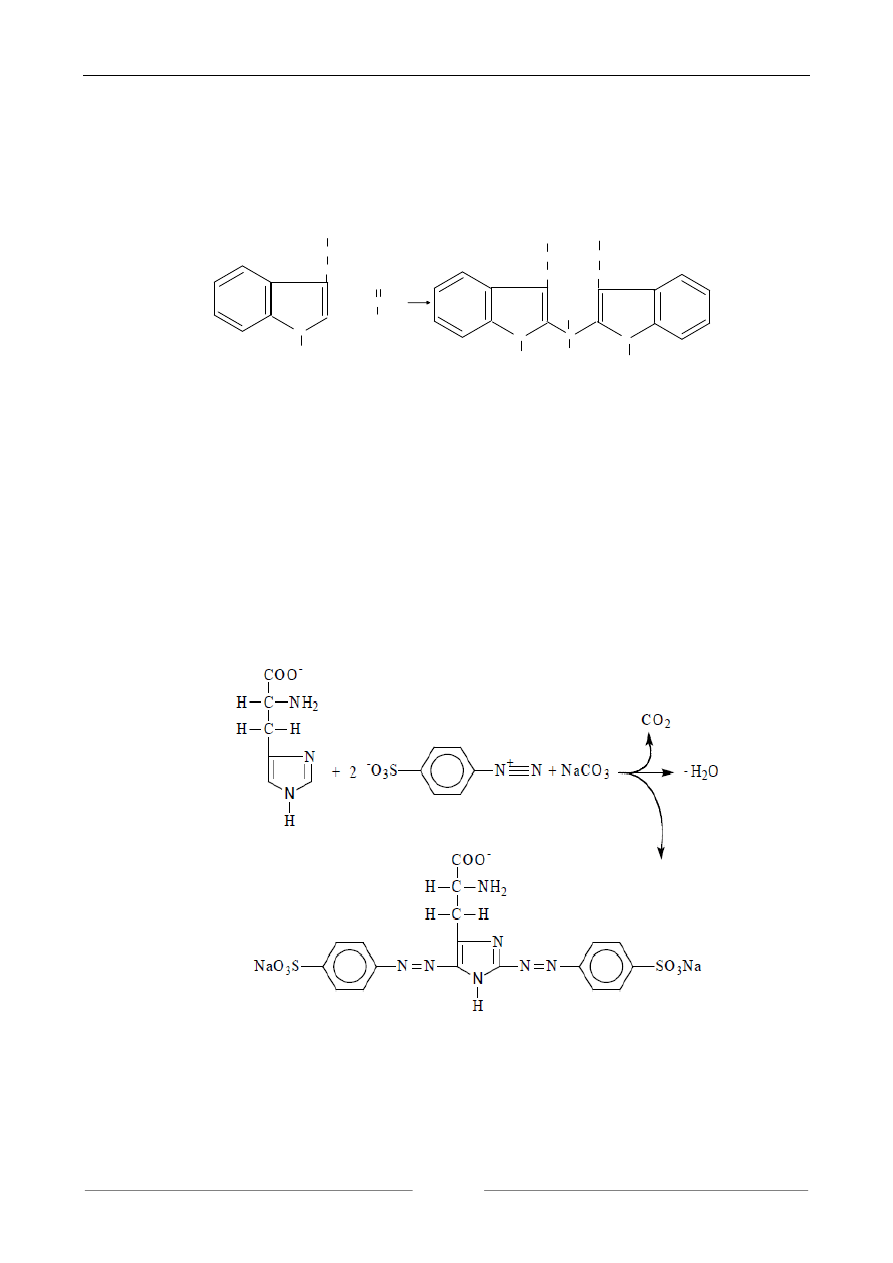
3. REAKCJA NA WYKRYCIE PIERŚCIENIA INDOLU (PRÓBA ADAMKIEWICZA).
Związki zawierające pierścień indolu między innymi tryptofan w środowisku mocno kwaso-
wym, w obecności aldehydów dają barwne produkty kondensacji. W próbie Adamkiewicza stosuje
się kwas glioksalowy CHOCOOH.
N
COOH
CHNH
CH
H
2
2
2
2
H
CH
CHNH
COOH
N
+
O
C-H
COOH
COOH
CHNH
CH
2
2
H
C
COOH
N
H
+ H O
2
2
kompleks barwy fioletowej
Wykonanie:
Do 1 ml roztworu tryptofanu dodać 0,5 ml kwasu glioksalowego i wymieszać dokładnie w
probówce, następnie płyn podwarstwić 1 ml stężonego kwasu siarkowego (nie mieszać!), wstawić
do wrzącej łaźni wodnej na 2 minuty. Na granicy płynów pojawia się fioletowy pierścień.
4. WYKRYCIE PIERŚCIENIA IMIDAZOLOWEGO W REAKCJI Z KWASEM
PARADWUAZOBENZENO-SULFONOWYM.
Pierścień imidazolowy ulega reakcji z kwasem paradwuazobenzenosulfonowym z wytworze-
niem kompleksu o barwie pomarańczowo-żółtej. Reakcję tę daje histydyna.
Wykonanie:
Sporządzić kwas p-dwuazobenzenosulfonowy przez zmieszanie 1 ml 0,5% kwasu sulfanilo-
wego i 1 ml 0,5% NaNO
2
. Roztwór zobojętnić krystalicznym Na
2
CO
3
dodając do probówki węgla-
nu tak dużo dopóki roztwór się burzy. Następnie dodać histydyny i obserwować tworzenie się bar-
wy pomarańczowo-żółtej.
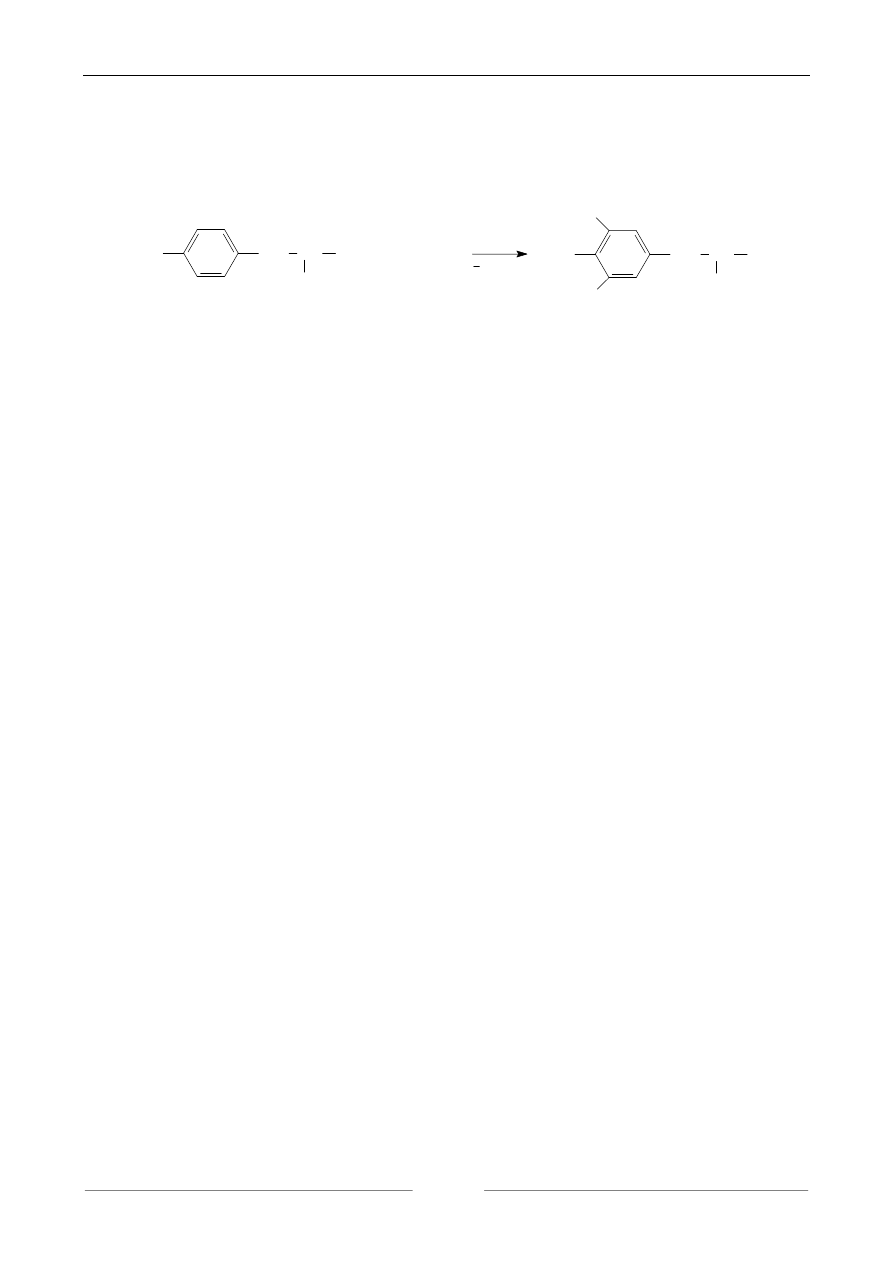
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 1
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
4
5. REAKCJA NA PIERŚCIEŃ AROMATYCZNY. PRÓBA KSANTOPROTEINOWA.
Związki aromatyczne ogrzewane z kwasem azotowym ulegają nitrowaniu z utworzeniem
barwy żółtej. Pochodne nitrowe w środowisku alkalicznym przechodzą w sole sodowe o barwie
pomarańczowej.
HO
CH
2
CH
COOH
NH
2
+ HNO
3
H
2
SO
4
H
2
O
2
HO
O
2
N
O
2
N
CH
2
CH
NH
2
COOH
2
barwa żółta
Wykonanie:
2 ml tryptofanu lub tyrozyny zalać 2 ml stężonego HNO
3
i podgrzewać kilka minut na łaźni
wodnej. Roztwór przybiera barwę żółtą. Po oziębieniu zalkalizować 20% NaOH. W miarę dodawa-
nia ługu rozwija się barwa pomarańczowa.
B) WYKAZANIE AMFOTERYCZNYCH WŁAŚCIWOŚCI AMINOKWASÓW
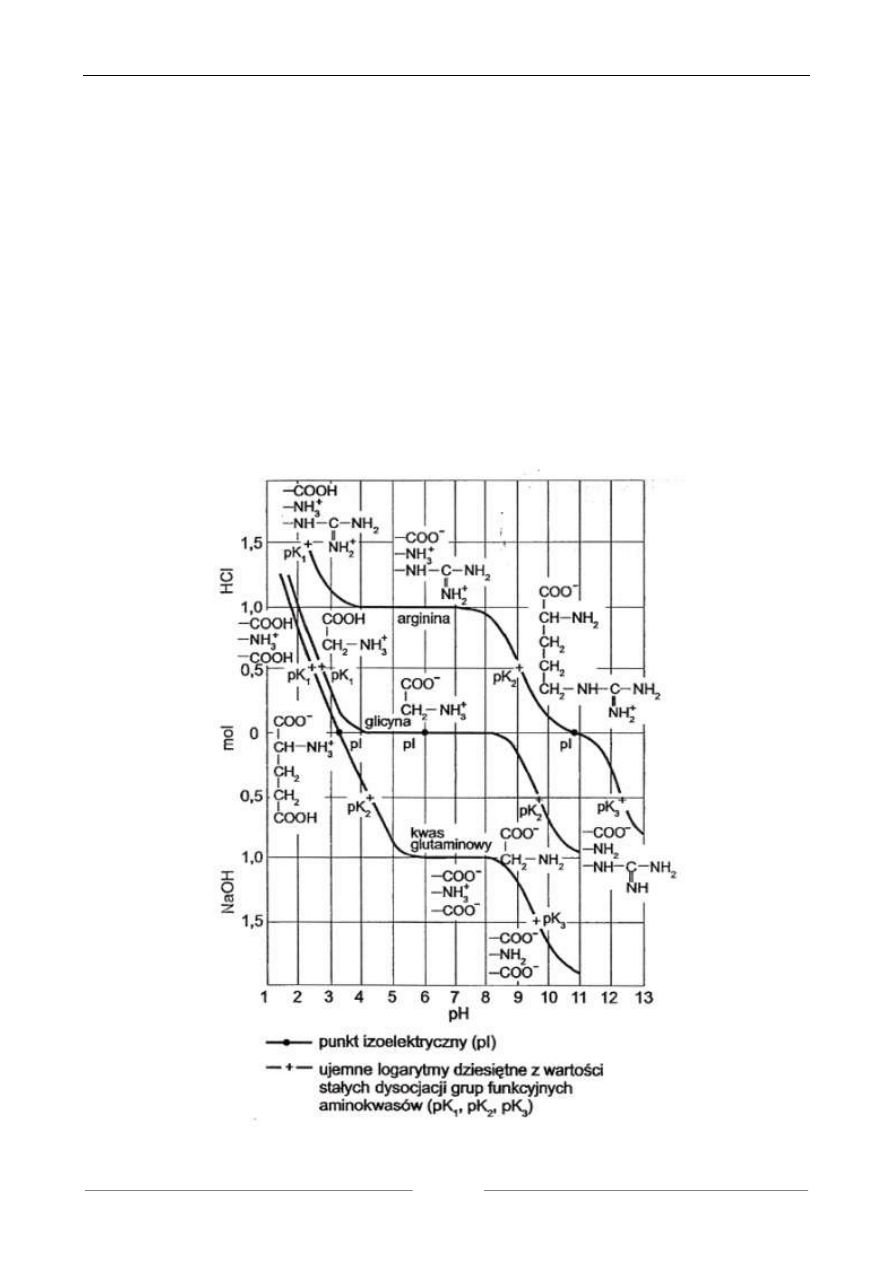
Charakter amfoteryczny aminokwasów ujmuje graficznie krzywa miareczkowania wodnych
roztworów aminokwasów mocnymi kwasami i zasadami. Przedstawia ona zależność wartości pH
miareczkowanego roztworu aminokwasu od ilości dodawanych moli kwasu lub zasady. Miarecz-
kowanie roztworu aminokwasu połączone z równoczesnym pomiarem pH roztworu pozwala na do-
świadczalne wyznaczenie krzywej dysocjacji aminokwasu i wartości pK jego grup funkcyjnych.
Wykonanie:
W dwóch zlewkach na 100 ml przygotować po 10 ml 0,1 M roztworu glicyny (dodać ok. 30
ml wody, by można było zanurzyć elektrodę). Roztwór w jednej zlewce miareczkować potencjome-
trycznie HCl, a w drugiej zlewce miareczkować NaOH.
Miareczkowanie kwasem: zmierzyć wyjściowe pH roztworu glicyny i stopniowo dodawać po
0,5 ml 0,1 M HCl, mierząc za każdym razem pH. Po dodaniu 3 ml kwasu, zwiększyć porcję doda-
wanego kwasu do 1 ml. Pomiar zakończyć po dodaniu 12 ml kwasu.
Miareczkowanie ługiem: zmierzyć wyjściowe pH roztworu glicyny i stopniowo dodawać po
0,5 ml 0,1 M NaOH, mierząc za każdym razem pH. Po dodaniu 3 ml ługu, zwiększyć porcję doda-
wanego ługu do 1 ml. Pomiar zakończyć po dodaniu 12 ml ługu.
Pomiaru pH dokonywać na pH-metrze. Wykreślić krzywą potencjometrycznego miareczko-
wania nanosząc na oś odciętych ilość ml kwasu i ługu, a na oś rzędnych wartości pH. Z wykresu
odczytać wartości pK dla kwasu i ługu oraz wartość pI.
C. ROZDZIAŁ AMINOKWASÓW METODĄ
CHROMATOGRAFII BIBUŁOWEJ ROZDZIELCZEJ
Chromatografia to technika, w której unoszone przez fazę ruchomą substancje rozdzielają się
dzięki różnicom w ich właściwościach fizyko-chemicznym (wielkość cząsteczek, hydrofobowość,
powinowactwo itp.) oddziałując z fazą stacjonarną. Ze względu na siły fizyczne, które odgrywają
rolę w procesie rozdziału oraz stan skupienia fazy stacjonarnej – wyodrębnia się: chromatografię
adsorpcyjną i podziałową. Rozdział składników w chromatografii adsorpcyjnej (chromatografia
w układzie ciecz - ciało stałe) uwarunkowany jest głównie różnicami w położeniu i charakterze po-
larnych podstawników w cząsteczkach adsorbatu (substancji zatrzymanej na powierzchni adsorben-
tu); w podziałowej (chromatografia w układzie ciecz - ciecz) – odmienną rozpuszczalnością solutu
(substancji rozpuszczonej w układzie rozwijającym) w obu fazach ciekłych.
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 1
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
5
Techniki chromatograficzne można podzielić bardziej szczegółowo i wyróżnić dodatkowo:
chromatografię żelową (sita molekularnego), jonowymienną, powinowactwa, oddziaływań hydro-
fobowych. Z kolei ze względu na technikę pracy wyróżnia się dwa rodzaje chromatografii: kolum-
nową i planarną, do tej drugiej zalicza się chromatografię bibułową oraz cienkowarstwową. W
chromatografii bibułowej nośnikiem fazy stacjonarnej (najczęściej polarnej) jest odpowiednio spre-
parowana bibuła filtracyjna. Z uwagi na kierunek migracji fazy ruchomej w bibule wyróżnia się
chromatografię jednowymiarową i dwuwymiarową, a ze względu na kształt bibuły – chromatogra-
fię arkuszową, paskową oraz krążkową.
Wykonanie:
Z bibuły Whatman 1 wyciąć pasek o szerokości 15 cm i długości 22 cm. W odległości 2 cm
od dołu zaznaczyć miękkim ołówkiem linię startową i nanieść mikropipetą mieszaninę badanych
aminokwasów oraz wzorce. Po wysuszeniu plam zawiesić pasek na pręciku szklanym i umieścić w
komorze z układem rozpuszczalników. Rozwijać minimum 2 godz. Po upływie tego czasu chroma-
togram wyjąć z komory, wysuszyć w suszarce w temp. 100
o
C. Zwilżyć pasek roztworem ninhydry-
ny w acetonie lub izatyny w acetonie i ponownie wysuszyć. Na podstawie różnic w szybkości wę-
drówki zidentyfikować badane aminokwasy
.
Załącznik:
Ostatnie zmiany: 13.02.2013
Wyszukiwarka
Podobne podstrony:
Biochemia(ŻCz)Ćw2 Właściwości fizyko chemiczne białek
Biochemia(ZCz)Cw5 Wlasciwosci f Nieznany
Właściwości fizykochemiczne białek
Otrzymywanie i?danie właściwości fizykochemicznych hydrolizatów skrobi 16
Biochemia(ZCz)Cw6 Oznaczanie za Nieznany (2)
Wykład 1 WŁAŚCIWOŚCI FIZYKOCHEMICZNE SUBSTANCJI TOKSYCZNEJ
Badania wybranych właściwości fizycznych i chemicznych wapna palonego
Sprawozdanie Właściwości fizykochemiczne skrobi
Biochemia(ZCz)Cw4 Klasyfikacja Nieznany (2)
właściwości fizykochemiczne tłuszczu
Badanie moczu właściwości fizyczne i chemiczne(1)
Chemia żywnosci Cwiczenie laboratoryjne nr 1 wyodrebnianie i badanie własciwosci fizykochemicznych b
Tablica. Niektore wlasciwosci fizykochemiczne gazĂłw, Procesy spalania
Biochemia TZ wyklad 11 biosynteza II aminokwasy low
więcej podobnych podstron