
Obliczenia w biochemii i biologii
eksperymentalnej
Godziny konsultacji: czwartek 10-11
piątek 10-11
Prowadzący:
dr inż. Agnieszka Sok-Grochowska
Zakład Fizjologii Molekularnej Zwierząt
ul. Cybulskiego 30, pok.11
e-mail: a.grochowska@biol.uni.wroc.pl

Regulamin ćwiczeń i wykładu z
obliczeń
1. Obecność na wykładzie nie jest obowiązkowa. Obecność na
ćwiczeniach jest obowiązkowa.
2. Zaliczenie wykładu będzie na podstawie kolokwium (70%) i
projektu (30%). W sumie będzie można uzyskać 100pkt. Skala
ocen w zależności od otrzymanej sumy punktów:
0-50 ndst
51-55 dst
56-65 dst+
66-75 db
76-85 db+
86-100 bdb
Obliczenia w biochemii i biologii molekularnej

Regulamin ćwiczeń i wykładu z
obliczeń
3. Zaliczenie ćwiczeń będzie na podstawie aktywności, mikro-
kolokwiów, pracy na zajęciach i prezentacji.
4. Na każdych zajęciach ćwiczeniowych można dostać/stracić
punkty za aktywność/brak przygotowania. Jedne zajęcia =
jeden punkt. Będą one doliczane/odejmowane podczas
wystawiania oceny.
5. Termin kolokwium zaliczeniowego z wykładu: 03.06.2015;
termin oddania projektu 05.06.2015
Obliczenia w biochemii i biologii molekularnej

Zagadnienia do omówienia na
wykładach i ćwiczeniach
1. Podstawowe jednostki miary ilości, masy i stężeń (układ SI). Przeliczanie
jednostek.
2. Podstawowe pojęcia w obliczeniach biochemicznych.
3. Przygotowywanie roztworów w laboratorium. Obliczanie stężeń,
rozcieńczeń, pH. Skład najczęściej wykorzystywanych roztworów w
pracowni biochemii i biologii molekularnej.
4. Reakcja PCR, trawienie enzymatyczne restryktazami i ligacja.
Planowanie starterów do PCR. Obliczania dla reakcji enzymatycznych.
5. Reakcja qPCR (ilościowy PCR). Planowanie starterów. Krzywa
standardowa. Obliczenia różnic ekspresji metodą Pfafl'a.
6. Plazmidy jako narzędzie w pracy biologa molekularnego.
7. Bazy danych sekwencji białkowych i nukleotydowych.
8. Programy ułatwiające obliczenia w biologii molekularnej
9. Spekrofotometria. Obliczanie stężeń. Pomiary aktywności enzymów.
10. Energetyka i kinetyka reakcji enzymatycznych.
Obliczenia w biochemii i biologii molekularnej
Obliczenia w biochemii i biologii molekularnej

Układ SI
Układ SI (franc. Système International d'Unités) –
Międzynarodowy Układ Jednostek Miar zatwierdzony w 1960
(później modyfikowany) przez Generalną Konferencję Miar.
Jest stworzony w oparciu o metryczny system miar. Jednostki
w układzie SI dzielą się na podstawowe i pochodne.
W Polsce układ SI obowiązuje od 1966, obecnie został
oficjalnie przyjęty przez wszystkie kraje świata z wyjątkiem
Stanów Zjednoczonych, Liberii i Birmy.
Obliczenia w biochemii i biologii molekularnej
źródło: http://pl.wikipedia.org

Układ SI
Jednostki podstawowe układu SI (legalne w Polsce jednostki
miar; Dz. U. Nr 225, poz. 1638)
Obliczenia w biochemii i biologii molekularnej
źródło:
nazwa
symbol
wielkość
fizyczna
definicja fizyczna
metr
m
długość
długość drogi przebytej w próżni przez światło w czasie 1/299 792 458 sekundy
kilogram
kg
masa
jednostka masy, która jest równa masie międzynarodowego prototypu kilograma
przechowywanego w Międzynarodowym Biurze Miar w Sevres
sekunda
s
czas
czas równy 9 192 631 770 okresom promieniowania odpowiadającego przejściu
mię́dzy dwoma nadsubtelnymi poziomami stanu podstawowego atomu cezu 133
amper
A
prąd
elektryczny
prąd elektryczny niezmieniający się, który, płynąc w dwóch równoległych
prostoliniowych, nieskończenie długich przewodach o przekroju kołowym
znikomo małym, umieszczonych w próżni w odległości 1 metra od siebie,
wywołałby między tymi przewodami siłę 2 · 10–7 niutona na każdy metr długości;
kelwin
K
temperatura
1/273,16 części temperatury termodynamicznej punktu potrójnego wody
mol
mol
liczność
materii
liczność materii układu zawierającego liczbę cząstek równą liczbie atomów w
masie 0,012 kilograma węgla 12
kandela
cd
światło
Światłość źródła emitującego w określonym kierunku promieniowanie
monochromatyczne o częstotliwości 540·10
12
herców i o natężeniu
promieniowania w tym kierunku równym 1/683 wata na steradian

Układ SI
Legalne jednostki miar, pochodne układu SI, o nazwach i
oznaczeniach specjalnych (przykłady)
nazwa
symbol
wielkość
fizyczna
wyrażenie w jednostkach podstawowych SI
radian
rad
kąt płaski
1 rad = 1m/1m = 1
herc
Hz
częstotliwość
1Hz = 1/1s; s
-1
niuton
N
siła
1N = 1kg·1(m/s
2
)
paskal
Pa
ciśnienie,
naprężenie
1Pa = 1N/1m
2
dżul
J
energia, praca
1J = 1N·1m
wat
W
moc
1W = 1J/1s
farad
F
pojemność
elektryczna
1F = 1C/1V
katal
kat
aktywność
katalityczna
1kat = 1mol/1s
Obliczenia w biochemii i biologii molekularnej
źródło:
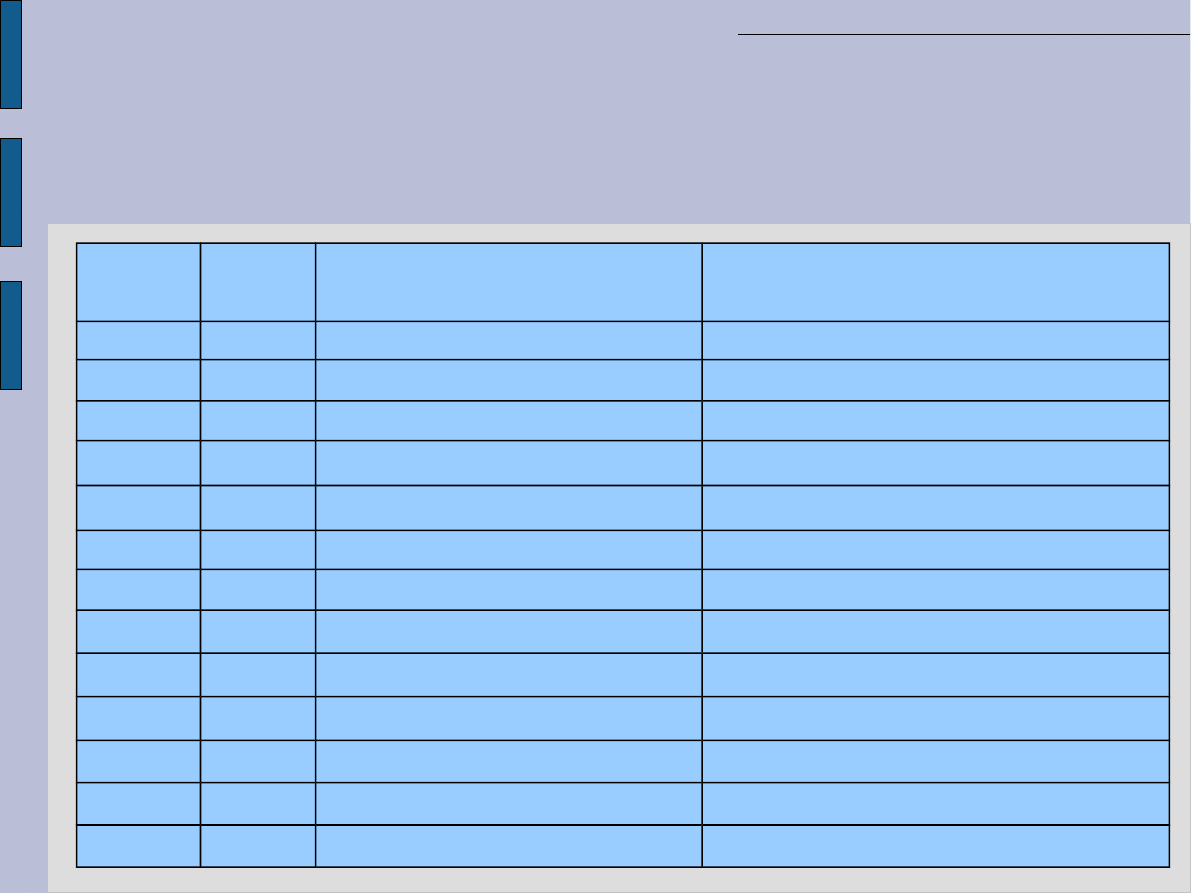
Skalowanie jednostek -
przedrostki
Obliczenia w biochemii i biologii molekularnej
Nazwa
(przedrostek)
Symbol
Mnożnik
Nazwa mnożnika
tera
T
1 000 000 000 000 = 10
12
bilion
giga
G
1 000 000 000 = 10
9
miliard
mega
M
1 000 000 = 10
6
milion
kilo
k
1 000 = 10
3
tysiąc
hekto
h
100 = 10
2
sto
deka
da
10 = 10
1
dziesięć
1 = 10
0
jeden
decy
d
0,1 = 10
-1
jedna dziesiąta
centy
c
0,01 = 10
-2
jedna setna
mili
m
0,001 = 10
-3
jedna tysięczna
mikro
µ
0,000 001 = 10
-6
jedna milionowa
nano
n
0,000 000 001 = 10
-9
jedna miliardowa
piko
p
0,000 000 000 001 = 10
-12
jedna bilionowa

Skalowanie jednostek-
przykłady
Obliczenia w biochemii i biologii molekularnej
Zamień podane wielkości na jednostki podstawowe układu SI:
100µmol =
200dag =
5000dm =
60000ns =

Zamień podane wielkości na jednostki podstawowe układu SI:
100µmol = 0,0001mol = 1
·10
-4
mol
200dag = 2kg
= 2
·10
0
kg
5000dm = 500m
= 5
·10
2
m
60000ns = 0,00006s
= 6
·10
-5
s
Skalowanie jednostek-
przykłady
Obliczenia w biochemii i biologii molekularnej

Skalowanie jednostek-
przykłady
Zamień podane wielkości na jednostki podstawowe układu SI:
100µmol = 0,0001mol = 1
·10
-4
mol
1µmol=1
·10
-6
mol
→ 1µmol·100=1·10
-6
mol
· 10
2
=1
·10
(-6+2)
mol=1
·10
-4
mol
200dag = 2kg
= 2
·10
0
kg
1dag=1
·10
-2
kg
→ 1dag·200=1·10
-2
kg
· 2·10
2
=2
·10
(-2+2)
kg=2
·10
0
kg
5000dm = 500m
= 5
·10
2
m
1dm=1
·10
-1
m
→ 1dm·5000=1·10
-1
m
· 5·10
3
=5
·10
(-1+3)
m=5
·10
2
m
60000ns = 0,00006s
= 6
·10
-5
s
1ns=1
·10
-9
s
→ 1ns·60000=1·10
-9
s
· 6·10
4
=1
·10
(-9+4)
s=1
·10
-5
s
Obliczenia w biochemii i biologii molekularnej
UWAGA!- wielokości addytywne
i nieaddytywne
Wielkości addytywne:
Skalarne
✔
ilość substancji
•
liczba atomów (ale nie w reakcjach jądrowych)
•
liczba cząsteczek lub liczność materii (liczba moli)
✔
masa (w fizyce klasycznej, ale nie w relatywistycznej)
✔
energia
✔
ładunek elektryczny
✔
moment bezwładności względem tej samej osi
✔
energia kinetyczna – tylko wówczas, gdy elementy układu nie oddziałują ze sobą
Wektorowe
✔
pęd
✔
moment pędu
Wielkości nieaddytywne
✔
masa (w fizyce relatywistycznej)
✔
objętość (w pewnych warunkach może być bliska addytywności)
✔
objętość molowa związków chemicznych nie jest sumą objętości molowych ich składników
✔
stężenie
✔
pH roztworu
Obliczenia w biochemii i biologii molekularnej
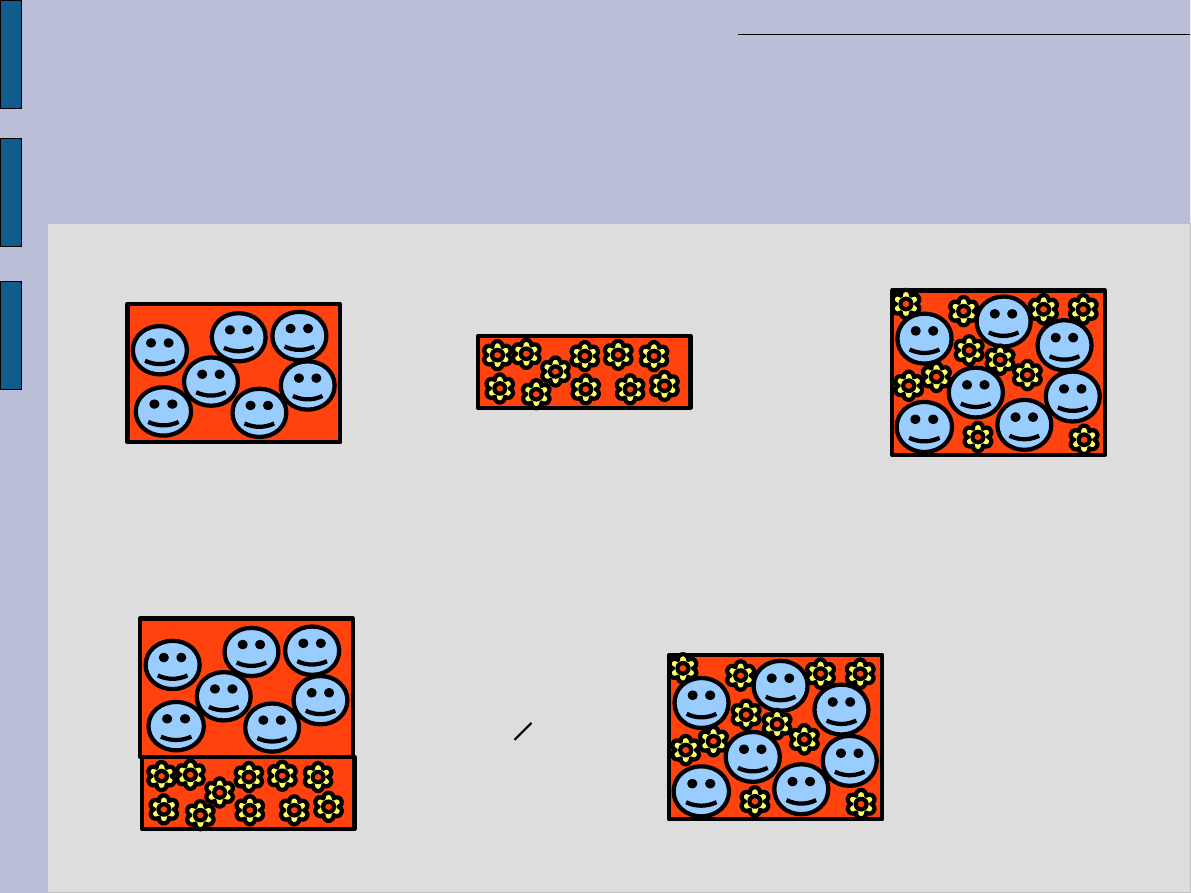
Wielokości addytywne i
nieaddytywne- przykłady
Addytywne [masa i ilość substancji (liczność)]
+
=
7 cząsteczek
11 cząsteczek
18 cząsteczek
14ng
11ng
25ng
Nieaddytywne [objętość]
2ml
+
= 3ml
np.= 2,2ml
1ml
Obliczenia w biochemii i biologii molekularnej

Roztwory
Roztwór – jednorodna mieszanina dwu lub więcej
rodzajów cząsteczek nie reagujących chemicznie
ze sobą.
Stężenie roztworu – ilość substancji
rozpuszczonej w określonej liczbie jednostek
objętości lub masy roztworu bądź rozpuszczalnika.
W przypadku roztworów jako jednostkę objętości
możemy legalnie stosować – litr (l) zamiast dm
3
.
Obliczenia w biochemii i biologii molekularnej

Stężenia roztworów
Procentowe:
✔
C% (wag/wag) – zwykle stosowane
Ilość gramów substancji rozpuszczonej w 100g
roztworu.
Można spotkać zapis C% (wag.) lub C% (w/w) -stężenie procentowe wagowe lub
%wag. -procenty wagowe
✔
C% (wag/obj)
Ilość gramów substancji rozpuszczonej w 100ml
roztworu.
Rzadko spotykany sposób wyrażania stężenia %
✔
C% (obj/obj)
Objętość substancji rozpuszczonej w 100ml roztworu.
Można spotkać zapis C%(obj.) lub C%(vol.) lub C%(v/v) -stężenie procentowe
objętościowe, lub %vol. -procenty objętościowe
Obliczenia w biochemii i biologii molekularnej
Stężenia procentowe-przykłady
✔
C% (wag/wag)
Ile gramów substancji rozpuszczonej jest w 250g 5%
(wag/wag) roztworu NaCl?
Rozwiązanie:
Obliczenia w biochemii i biologii molekularnej
C %wag /wag =
masa substancji
masa roztworu
⋅
100 %
5 % =
masa substancji
250g
⋅
100 % ⇒ masa substancji =
5 %⋅ 250g
100 %
=
12,5 g

Stężenia procentowe-przykłady
Obliczenia w biochemii i biologii molekularnej
✔
C% (wag/wag)
Jakie będzie miał stężenie procentowe
(wag/wag)roztwór, jeżeli w 500 gramach wody
rozpuścimy 25 gramów cukru?
Rozwiązanie:
C %wag / wag=
masa substancji
masa roztworu
⋅
100 %
C % =
50g
500g50g
⋅
100 % ⇒ C % =
50g
550g
⋅
100 %=9,09 %

Stężenia procentowe-przykłady
✔
C% (wag/obj)
Ile gramów substancji rozpuszczonej jest w 400ml 8%
(wag/obj) roztworu NaCl?
Rozwiązanie:
Obliczenia w biochemii i biologii molekularnej
C %wag /obj=
masa substancji
objętość roztworu
⋅
100 %
8 % =
masa substancji
400ml
⋅
100 % ⇒ masa substancji =
8 %⋅ 400ml
100 %
=
32g

Stężenia procentowe-przykłady
✔
C% (wag/obj)
Jakie jest stężenie procentowe (wag/obj) roztworu po
rozpuszczeniu 50g NaOH w 200ml wody? Gęstość
roztowru po wymieszaniu wynosi d=1,219g/cm
3
.
Rozwiązanie:
Zaczynamy od obliczenia objętości roztworu po wymieszaniu przy założeniu
gęstości wody d=1g/cm
3
.
masa roztworu po wymieszaniu: 200g+50g=250g
objętość roztworu po wymieszaniu :
na koniec właściwe stężenie:
Obliczenia w biochemii i biologii molekularnej
gęstość=
masa
objętość
, d =
m
v
[
g
cm
3
]
v=
m
d
⇒
v=
250g
1,219
g
cm
3
=
205,1 cm
3
C %wag /obj=
50g
205,1 ml
⋅
100 %=25,4%

Stężenia procentowe-przykłady
✔
C% (obj/obj)
Jaka objętość czystego alkoholu etylowego jest w 750ml
12%(vol.) wina czerwonego?
Rozwiązanie:
Jaką masę ma 90ml etanolu?
Żeby to obliczyć musimy znać gęstość czystego etanolu – d=0,791 g/cm
3
m = V
·d = 90ml · 0,791g/ml = 71,19g
Obliczenia w biochemii i biologii molekularnej
C %obj /obj=
objętość substancji
objętość roztworu
⋅
100 %
12% =
objętość substancji
750ml
⋅
100 % ⇒ objętość substancji =
12 %⋅750ml
100 %
=
90ml

Pojęcie mola
Mol – podstawowa jednostka liczności materii.
Jeden mol jest to liczba cząstek (np. atomów,
cząsteczek, jonów, elektronów i innych
indywiduów chemicznych) równa liczbie atomów
zawartych w 12g izotopu węgla
12
C.
Liczba cząstek zawartych jednym molu jest
nazywana liczbą Avogadra, wynosi ona
6,02214179
·10
23
± 3,6
·10
17
Obliczenia w biochemii i biologii molekularnej
Wyszukiwarka
Podobne podstrony:
prezentacja do wykladu obliczenia PCR i startery optymalizacja
prezentacja do wykladu obliczenia2
Prezentacja do wykładu
Prezentacja do wykładu
prezentacja do wykładu pt Antropologia jako nauka
Prezentacja do wykładu systemy ogrzewania
prezentacje do wykladu WSAP 2006zaoczne
prezentacja do wykładu pt Antropologia jako nauka
Prezentacja do wykładu miejskie systemy ciepłownicze
Prezentacja do wykładu ogrzewanie powietrzem
Prezentacja do wykladu 3 2 cel
Prezentacja do wykładu
Prezentacja do wykladu 13 2 cel
Prezentacja do wykladu 14 2 cel
więcej podobnych podstron