
CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
1
7. Elementy chemii nieorganicznej
Chemia mineralnych materiałów
budowlanych
Nazewnictwo i podział związków nieorganicznych
Chemia krzemu, krzemiany
Chemia wapnia
Spoiwa mineralne:
wapno,
gips,
cementy.
Procesy twardnienia i wiązania zapraw i spoiw
budowlanych.
Metale i stopy metali stosowane w budownictwie.

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
2
7.1. Nazewnictwo i podział związków
nieorganicznych
Tlenki
- E
n
O
m
, np. tlenek azotu (III)
Wodorki
- H
n
E, np. wodorek litu (I)
Wodorotlenki
- M(OH)
n
np. wodorotlenek glinu
(III)
Kwasy.
- (H)
n
E, (H)
n
R, H
n
E
m
O
z
Sole.
- Me
n
R
m
Sole obojętne
Wodorosole
Hydroksysole
Inne związki nieorganiczne nie należące do ww. grup;
siarczki, wodorki, związki kompleksowe.
Materiały budowlane: ceramika, spoiwa, betony,
szkło, drewno, metale, tworzywa sztuczne, inne.
Spoiwa budowlane:
Wypalone i sproszkowane materiały, które po
wymieszaniu z wodą, na skutek reakcji chemicznych
ulegają stwardnieniu, wykazując właściwości wiążące.
• Spoiwa powietrzne
•
Spoiwa hydrauliczne

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
3
7.2. Chemia krzemu
Si + O
2
= SiO
2
; ∆H
o
= - 859,8 kJ/mol
Kwarc - SiO
2
Ogółem znane są 22 odmiany krystaliczne SiO
2
;
Krzemionka reaguje z florowodorem tworząc gazowy
tetrafluorek krzemu
SiO
2
+ 4HF = SiF
4
+ 2H
2
O
KRZEMIANY
SiO
2
+ 2FeO = Fe
2
SiO
4
SiO
2
+ 2NaOH = Na
2
SiO
3
+ H
2
O
SiO
2
+ Na
2
SO
4
= Na
2
SiO
3
+ SO
3
SiO
2
+ CaCO
3
= CaSiO
3
+ CO
2
KWASY KRZEMOWE
Na
2
SiO
3
+ HCl + 2H
2
O = H
4
SiO
4
+ 2NaCl
SiCl
4
+ 4H
2
O = H
4
SiO
4
+ 4HCl
Si(OCH
4
)
4
+ 4H
2
O = H
4
SiO
4
+ 4CH
3
OH
SPOIWA KRZEMIANOWE
Na
2
SiO
3
+ 2H
2
O = H
2
SiO
3
+ 2NaOH
CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
4
Na
2
SiO
3
+ CO
2
+ 2H
2
O = Na
2
CO
3
+ H
4
SiO
4
2Na
2
SiO
3
+ Na
2
SiF
6
+ 2H
2
O = 3H
2
SiO
3
+ 6NaF
Na
2
SiO
3
+ Ca(OH)
2
+ nH
2
O = CaSiO
3
nH
2
O +
+2NaOH
KRZEMIANY WAPNIA CaO-SiO
2
• krzemian trójwapniowy –
alit
3CaO SiO
2
(Ca
3
SiO
5
)
• krzemian dwuwapniowy –
belit
2CaO SiO
2
(Ca
2
SiO
4
)
• dwukrzemian trójwapniowy –
rankinit
3CaO 2SiO
2
(Ca
3
Si
2
O
7
)
• krzemian wapniowy –
wolastonit
CaO SiO
2
(CaSiO
3
)
Krzemiany dwuwapniowy (belit) i trójwapniowu (alit)
charakteryzują się bardzo ważnymi w technologii
cementu właściwościami hydraulicznymi, co
oznacza, że mogą twardnieć i wiązać pod wodą.
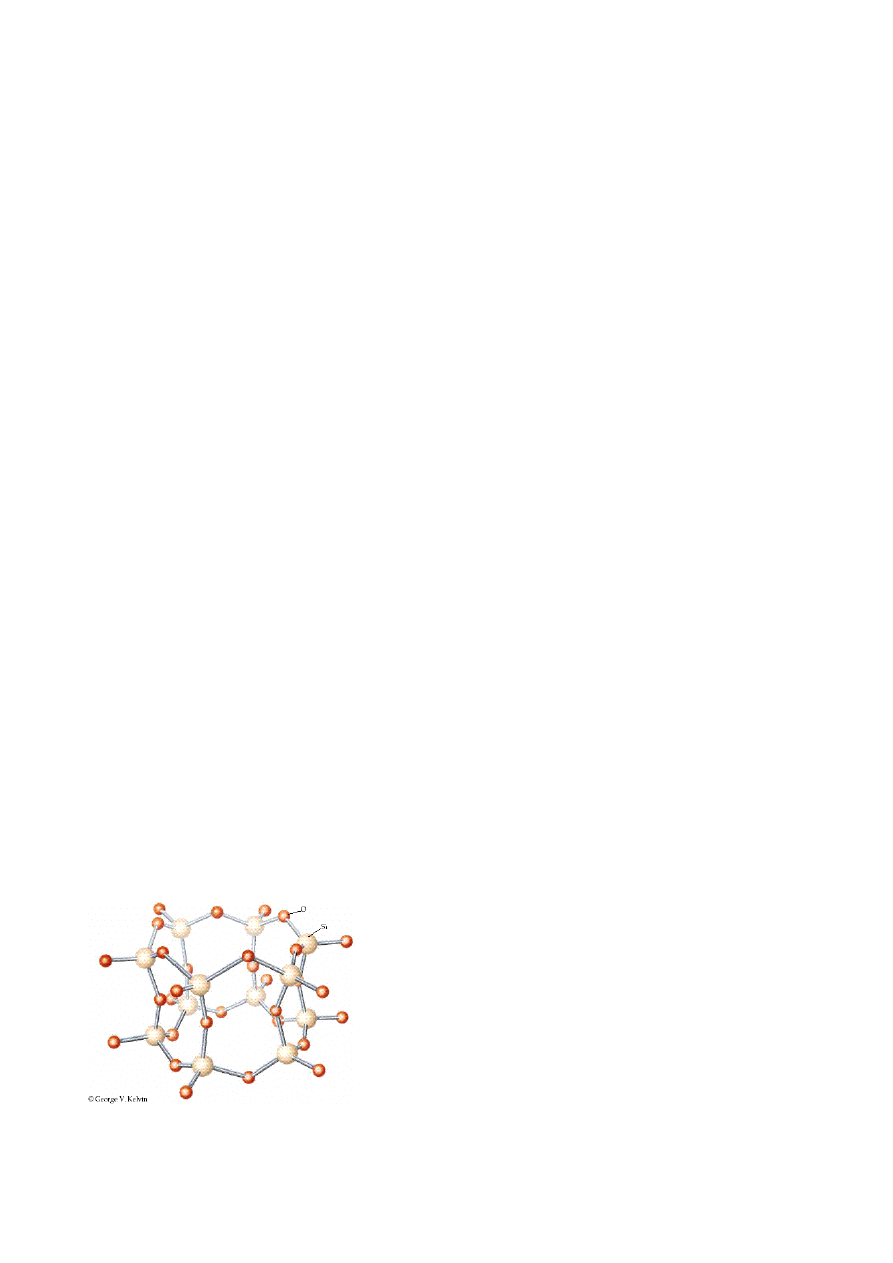
Struktura podstawowych minerałów krzemianowych.
Rys. Struktura powtarzających się jednostek SiO
2
w kwarcu
CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
5
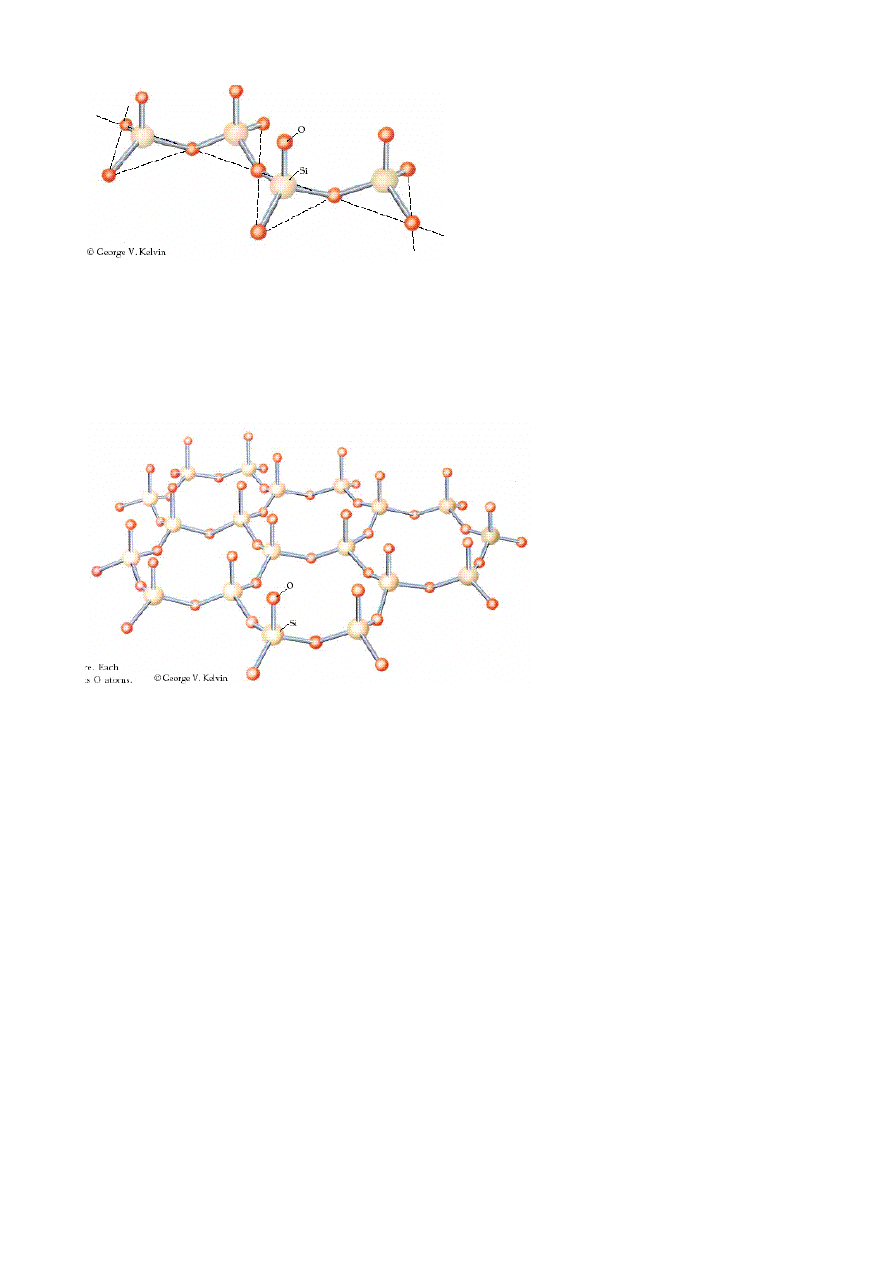
Rys. Piroksen. Jednostki podstawowe SiO
4
połączone w łańcuch poprzez
wspólny atom tlenu.
Pirokseny to nazwa grupa bardzo rozpowszechnionych minerałów skałotwórczych o
strukturze wewnętrznej odpowiadającej krzemianom łańcuchowym i ogólnym wzorze:
AB[Si
2
O
6
]
– gdzie: A – to najczęściej; wapń, sód, lit; B – to najczęściej; magnez, żelazo, glin.
Rys. Struktura miki. Każda jednostka strukturalna SiO
4
ma trzy wspólne
atomy tlenu. Mika ma budowę warstwową.
7.3. Chemia związków glinu
4Al + 3O
2
= 2Al
2
O
3
; ∆H
o
= -1671 kJ/mol
Al(OH)
3
+ 3HCl = AlCl
3
+ 3H
2
O
Al(OH)
3
+ 3NaOH = Na
3
[Al(OH)
6
]
W procesie twardnienia i wiązania materiałów budowlanych
największe znaczenie mają nw. gliniany:
CaO - Al
2
O
3
oraz SiO
2
- Al
2
O
3

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
6
7.4. Siarczany i węglany
Ditlenek siarki – SO
2
Tritlenek siarki SO
3
2SO
2
+ O
2
= 2SO
3
(z udziałem katalizatora -
tlenki azotu)
SO
2
+ H
2
O = H
2
SO
3
kwas siarkowy (IV)
SO
3
+ H
2
O = H
2
SO
4
kwas siarkowy (VI)
CaMg(CO
3
)
2
= CaCO
3
x MgCO
3
- dolomit
CaCO
3
– wapień, kamień wapienny, kreda,
marmur
MgCO
3
- magnezyt
Na
2
CO
3
- soda kaustyczna
K
2
CO
3
- potaż
CaCO
3
= CaO + CO
2
; ∆H
o
= 178,3 kJ
CaCO
3
+ CO
2
+ H
2
O = Ca(HCO
3
)
2
7.5. Litowce i berylowce
2Na + ½ O
2
= Na
2
O; ∆H
o
= - 416,2 kJ
Ca + ½ O
2
= CaO; ∆H
o
= - 635,0 kJ
Na
2
O + H
2
O = 2Na
+
+ 2OH
-
Na
2
CO
3
+ H
2
O = 2Na
+
+ HCO
3
-
+ 2OH
-

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
7
7.6. Chemia wapnia. Zaprawy ceramiczne.
Materiały wiążące. Cementy
Zaprawami ceramicznymi nazywamy się układy wielofazowe
i wieloskładnikowe tworzące z wodą plastyczne zaczyny, mające
właściwości przechodzenia ze stanu plastycznego w ciała stałe.
Dzięki takim właściwościom znajdują one zastosowanie do spajania
elementów budowlanych lub do ich wytwarzania.
W skład zapraw obok materiałów wiążących (wapno, cement)
wchodzą: kruszywa (piasek, żwir, tłuczeń) i woda.
Przemiany jakim podlegają zaprawy można podzielić na dwa
zasadnicze etapy:
1. wiązanie – etap wstępny (następuje utrata plastyczności),
2. twardnienie – etap podstawowy (następuje wzrost
wytrzymałości zaprawy).
7.7. Spoiwa mineralne
Spoiwa wapienne
Surowce do wytwarzania wapna – węglan wapnia w postaci
wapniaka, który zawiera minerał o nazwie kalcyt i domieszki..
Do minerałów wapiennych zalicza się:
marmur – czysty węglan wapnia o wykształconych kryształach;
kreda minerał zawierający węglan wapnia z młodszych epok;
dolomit CaCO
3
x MgCO
3
margle – wapienie z domieszką materiałów ilastych(glin).
CaCO
3(s)
= CaO
(s)
+ CO
2(g)
; ∆H
o
=+178,5 kJ
(temp. 950-1100
o
C)
Pomimo utraty 44% masy w procesie wypalania, objętość
otrzymanego wapna palonego CaO, w porównaniu z
surowcem wyjściowym (wapniakiem) zmniejsza się o 10%.
Wynika to z porowatej struktury wapna palonego.
Reakcja gaszenia (lasowania) wapna palonego:
CaO + H
2
O = Ca(OH)
2
; ∆H
o
= -66,7 kJ

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
8
Wodorotlenek wapnia jest trudno rozpuszczalny
w wodzie. Jego rozpuszczalność w temperaturze
20
o
C wynosi około 1,3 g/dm
3
.
W zależności od ilości wody dodanej do wapna
palonego można otrzymać:
• wapno hydratyzowane,
• ciasto wapienne,
• mleko wapienne.
Wapno pokarbidowe otrzymuje się z karbidu (węglika
wapnia) i wody:
CaC
2
+ 2H
2
O = C
2
H
2
+
Ca(OH)
2
Zaprawę wapienną
sporządza się z mieszaniny
wapna, wody i piasku. Po spojeniu cegieł zaprawa
tężeje wskutek pochłaniania wody przez porowaty
materiał ceramiczny.
Wodorotlenek wapnia jest trudno rozpuszczalny w
wodzie. Jego rozpuszczalność w temperaturze 20
o
C
wynosi około 1,3 g/dm
3
.
Twardnienie zaprawy
wapiennej polega na reakcji
wodorotlenku wapnia z dwutlenkiem węgla.
Ca(OH)
2
+ CO
2
= CaCO
3
+ H
2
O ; ∆H
o
= -83,6 kJ/mol
Działanie wody nasyconej dwutlenkiem węgla na
węglan wapnia (rozpuszczanie węglanu wapnia).

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
9
CaCO
3
+ CO
2
+ 2H
2
O = Ca(HCO
3
)
2
Spoiwa gipsowe i anhydrytowe
Spoiwami gipsowymi i anhydrytowymi nazywany
materiały zawierające półwodny (CaSO
4
x ½H
2
O) lub
bezwodny (CaSO
4
) siarczan wapnia. Siarczan wapnia
występuje w kilku odmianach różniących się kształtem
kryształów, rozpuszczalnością w wodzie i kinetyką
twardnienia.
Produkcja gipsu polega na częściowym
odwodnieniu CaSO
4
x 2H
2
O w temp. 185-190
o
C
w stalowych reaktorach ogrzewanych przeponowo.
Ogrzany gips przybiera w temp. 180
o
C postać ciekłą
i z tego powodu proces ten nazywa się „gotowaniem
gipsu”.
CaSO
4
x 2H
2
O = CaSO
4
x ½H
2
O + 3/2H
2
O
(185-190
o
C)
Gips sztukatorski ma skład chemiczny odpowiadający
mieszaninie około 94% półwodzianu β-CaSO
4
x ½
H
2
O i około 6% anhydrytu.
Gips stosowany do kładzenia suchych tynków jest
prawie całkowicie odwodniony w temp. do 700
o
C
i zawiera pewną ilość tlenku wapnia CaO powstałego
w wyniku dysocjacji CaSO
4
:
CaSO
4
= CaO + SO
2
+ ½O
2
(650-1000
o
C)

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
10
Gips budowlany rozpuszcza się w wodzie tylko
częściowo.
Wiązanie zapraw gipsowych polega na szybkiej
krystalizacji CaSO
4
x 2H
2
O w formie długich
przeplatających się kryształów.
CaSO
4
x 1/2H
2
O + 3/2H
2
O =
= CaSO
4
x 2H
2
O ; ∆H
o
= 14,2 kJ/mol
Gips bardzo szybko osiąga wytrzymałość
końcową. Wiązaniu gipsu towarzyszy ok. 1% wzrost
objętości. Ta właściwość spowodowała, że jest to
doskonały materiał do wypełniania form, ubytków itp.
Czas wiązania gipsu można regulować sposobem
odwadniania oraz przez dodatek różnych soli.
Gips stosowany jest jako dodatek do cementu (ok.
2-3%) regulujący szybkość wiązania betonu.
Spoiwa hydrauliczne – cementy
Cementami nazywamy hydrauliczne materiały wiążące
powstałe w wyniku wypalenia, do spieczenia, surowców
mineralnych.
Naturalne zaprawy hydrauliczne.
Należą do nich:
• cementy pucolanowe wytwarzane z tufów wulkanicznych
z południowych Włoch,
• cementy santorynowe wytwarzane z podobnych skał
występujących na wyspach greckich,
• cementy trasowe wydobywane w Niemczech.
CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
11
Otrzymuje się je z ogniowych skał wylewnych i w celu uaktywnienia
ich hydraulicznych właściwości wiążących miesza się je
z kilkuprocentowym dodatkiem wapna. Właściwości podobne do
zapraw naturalnych mają niektóre zasadowe żużle hutnicze oraz
pyły.
Cement portlandzki
Materiał ten został (prawdopodobnie) przypadkiem odkryty
przez angielskiego murarza Josepha Aspina w Anglii-1824.
W wyniku prażenia mieszaniny gliny i zmielonego wapienia
Aspin otrzymał spoiwo, które mogło wiązać pod wodą.
W Polsce pierwsza cementownia została uruchomiona
przez Jerzego Ciechanowskiego w Grodźcu k. Będzina
w 1854 r. W 35 lat później (1890 r.) rozpoczęto produkcję
cementu w USA.
Podstawowe surowce do produkcji cementu:
(1) wapienie, wapniak -
CaCO
3
(2) gliny (glinokrzemiany)
-
Al
2
O
3
x SiO
2
x H
2
O+ m H
2
O
(3) surowce odpadowe
-
żużle hutnicze
-
popioły paleniskowe
-
szlamy odpadowe zawierające
CaCO
3
Klinkier czyli spiek cementu portlandzkiego powstaje
w wyniku prażenia do spieczenia mieszaniny surowców,
które dobiera się w taki sposób aby po wypaleniu otrzymać
klinkier o module hydraulicznym od 1,8 do 2,2 i module
krzemianowym ok. 2,5.
Podstawowe składniki cementu portlandzkiego:
CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
12
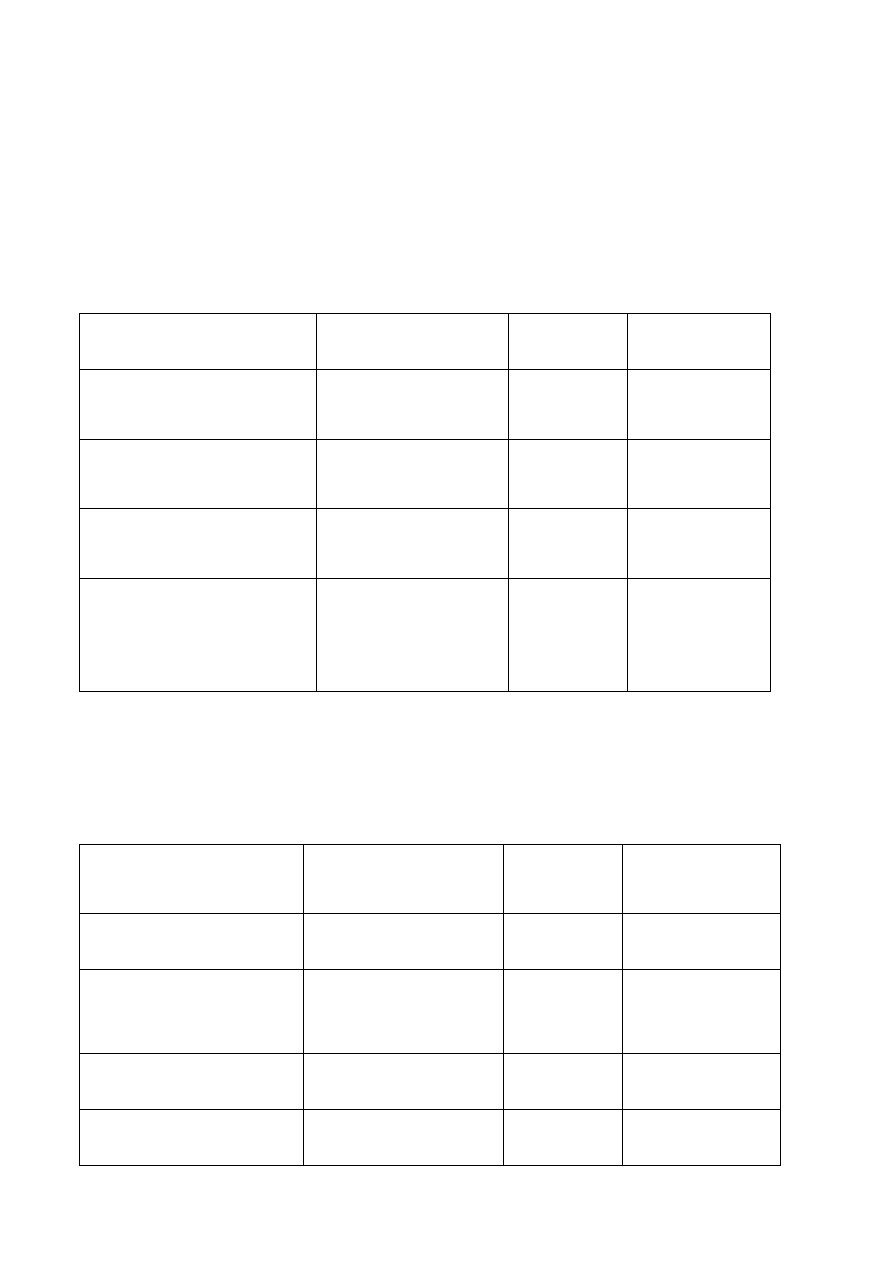
Wzór
chemiczny
Nazwa
chemiczna
Ozna-
czenie
Zawartość
%
CaO
tlenek wapnia (II)
C
58-66
SiO
2
,
ditlenek krzemu
(IV)
S
18-26
Al
2
O
3
,
tritlenek glinu (III)
A
4-12
Fe
2
O
3
tritlenek żelaza
(III)
F
2-5
MgO
tlenek magnezu
(II)
M
0,5-5
Na
2
O+K
2
O
tlenek sodu (I)
tlenek potasu (I)
N+K
0-2
SO
3
tritlenki siarki (VI)
S
0,5-2,5
Podstawowe operacje technologiczne przy
produkcji cementu:
• urabianie i rozdrabnianie surowców skalnych,
• odważanie i mielenie surowców,
• wypalanie w piecu obrotowym,
• mielenie produktu wypalania – klinkieru
cementowego z domieszką 3% gipsu.
Charakterystyka cementu:
Współczynnik
(moduł) hydrauliczny M
H
:
od 1,8 do 2,9
M
H
= %CaO/(%SiO
2
+ %Al
2
O
3
+ %Fe
2
O
3
)
Współczynnik
(moduł) krzemianowy M
K
:
od 2,1 do 3,5
M
K
= %SiO
2
/(%Al
2
O
3
+ %Fe
2
O
3
)
CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
13
Współczynnik
(moduł) glinowy M
G
:
od 1,0 do 2,8
M
G
= %Al
2
O
3
/%Fe
2
O
3
Skład mineralogiczny klinkieru
Nazwa
Wzór
chemiczny
Symbol Zawartość
%
Krzemian
trójwapniowy (
alit
)
3CaO SiO
2
,
C
3
S
50-60
Krzemian
dwuwapniowy (
belit
)
2CaO SiO
2
,
C
2
S
15-28
Glinian trójwapniowy
3CaO Al
2
O
3
C
3
A
8-11
Glininożelazian
czterowapniowy
(
Braunmilleryt
)
4CaO Al
2
O
3
Fe
2
O
3
C
4
AF
8-10
Skład mineralogiczny cementu
portlandzkiego
Nazwa
Wzór
chemiczny
Symbol Zawartość
%
Krzemian
trójwapniowy (alit)
3CaO SiO
2
,
C
3
S
30-65
Krzemian
dwuwapniowy
(belit)
2CaO SiO
2
,
C
2
S
15-45
Glinian
trójwapniowy
3CaO Al
2
O
3
C
3
A
5-15
Glininożelazian
czterowapniowy
4CaO Al
2
O
3
C
4
AF
5-15

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
14
(Braunmilleryt)
Fe
2
O
3
Siarczan wapnia
dwuwodny (gips)
CaSO
4
x2H
2
O CSH
2
2-5
7.8. Procesy twardnienia i wiązania
zapraw i spoiw budowlanych
a. zaprawy wapienne – tworzenie
CaCO
3
b. spoiwa gipsowe – tworzenie
CaSO
4
x 2H
2
O
c. cementy
Hydratacja cementu
Tworzenie soli Candlota:
3CaO x Al
2
O
3
+ 3CaSO
4
+ 31 H
2
O =
3CaO x Al
2
O
3
x 3CaSO
4
x 31 H
2
O
Hydroliza glinianu trójwapniowego:
3CaO x Al
2
O
3
+ 6H
2
O = 3CaO x Al
2
O
3
x 6H
2
O
Hydroliza żelazianu czterowapniowego (celitu):
4CaO x Al
2
O
3
x Fe
2
O
3
+ (n+6)H
2
O =
3CaO x Al
2
O
3
x 6H
2
O + CaO x Fe
2
O
3
x nH
2
O
Hydroliza krzemianu trójwapniowego (alitu):
3CaO x SiO
2
+ (n+1) H
2
O =
2CaO x SiO
2
x n H
2
O + Ca(OH)
2
Hydroliza krzemianu dwuwapniowego (belitu):

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
15
2CaO x SiO
2
+ nH
2
O = 2CaO x SiO
2
x nH
2
O
Karbonatyzacja składników stwardniałego
zaczynu cementowego:
Reakcja składników zaczynu z CO
2
:
Ca(OH)
2
+ CO
2
= CaCO
3
+ H
2
O
4CaO x Al
2
O
3
x 12H
2
O + 4CO
2
=
4CaCO
3
+
+ 2Al(OH)
3
+ 9H
2
O
3CaO x Al
2
O
3
x 3CaSO
4
x 31 H
2
O + 3CO
2
=
3CaCO
3
+ 2Al(OH)
3
+3(CaSO
4
x 2H
2
O) + 22H
2
O
3CaO x 2SiO
2
x 3 H
2
O + 3CO
2
=
3CaCO
3
+ 2SiO
2
+ 3H
2
O
Proces karbonatyzacji jest powolny; około 0,5 do
1 mm na rok. W wyniku karbonatyzacji zmieniają
się właściwości betonu: zmniejsza się zdolność
ochrony antykorozyjnej betonu wobec stali
zbrojeniowej. Zwiększa się za to wytrzymałość
mechaniczna betonu.
ODMIANY CEMENTÓW
Cementy ogólnego stosowania,

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
16
Cementy o podwyższonej odporności
siarczanowej,
Cementy szybkotwardniejące,
Cementy o małym cieple hydratacji
Cementy białe
– cementy o bardzo małej ilości
Fe, Cr i Mn. Charakteryzuje się białym kolorem
oraz parametrami odpowiadającymi cementom
portlandzkim klasy 32,5 i 42,5. Do produkcji
białego klinkieru stosowane są surowce o
niewielkiej zawartości tlenków żelaza (III) –
Fe
2
O
3
, oraz ditlenku manganu (IV) - MnO
2
.
Cement biały zawiera głównie krzemiany wapnia
i znajduje zastosowanie do wytwarzania betonu
architektonicznego, galanterii betonowej oraz
zapraw murarskich i tynkarskich.
Cementy kolorowe
są to cementy białe z
dodatkiem barwnych tlenków metali, np. Fe
2
O
3
,
CoO
2
, MnO
2
.
Cementy ekspansywne.
Mają właściwość zwiększania objętości podczas wiązania.
Efekt ekspansji uzyskuje się w wyniku wprowadzenia
dodatków zwiększających swoją objętość w wyniku reakcji z
wodą. Należą do nich: CaO, MgO i CaSO
4
½ H
2
O.
Cementy glinowe.
Cement ten charakteryzuje się
wysokim modułem glinowym. Nie zawiera natomiast gipsu.
Po zarobieniu z wodą cementy te szybko wiążą. Reakcja
jest silnie egzotermiczna co pozwala na stosowanie

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
17
cementu przy obniżonych temperaturach zewnętrznych.
Cement glinowy osiąga bardzo szybko wytrzymałość
mechaniczną (nawet po kilku godzinach). Na skutek braku
w takich zaprawach Ca(OH)
2
betony wykonane na bazie
tego cementu są odporne na korozję kwasową i
siarczanowa. Beton glinowy jest natomiast podatny na
reakcje z zasadami i alkaliami.
CaO x Al
2
O
3
+ K
2
CO
3
+ H
2
O =
CaCO
3
+ 2KOH + Al
2
O
3
Al
2
O
3
+ 2KOH = 2K(AlO
2
) + H
2
O
7. 9. KOROZJA BETONU
W przypadku betonu wyróżnia się korozję siarczanową,
chlorkową i węglanową.
K
K
o
o
r
r
o
o
z
z
j
j
a
a
s
s
i
i
a
a
r
r
c
c
z
z
a
a
n
n
o
o
w
w
a
a
Niszczenie betonu wywołane oddziaływaniem obecnych
w wodzie i ściekach siarczanów polega na tworzeniu się
trudno rozpuszczalnych siarczanów i związanym z tym,
wzroście objętości produktów reakcji. Duży wzrost objętość
produktów korozyjnych prowadzi do powstania naprężeń
mechanicznych w objętości materiału, a w konsekwencji
beton ulega zniszczeniu mechanicznemu. Typowym
przykładem korozji siarczanowej jest korozja etryngitowa -
powstawaniu etryngitu towarzyszy zwiększenie objętości aż
o 168%.
Korozja wywołana reakcjami rozpuszczonych w wodzie
siarczanów zalicza się do najgroźniejszych w skutkach

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
18
K
K
o
o
r
r
o
o
z
z
j
j
a
a
c
c
h
h
l
l
o
o
r
r
k
k
o
o
w
w
a
a
Chlorki zawarte m.in. w wodzie morskiej czy wodach
kopalnianych wywołują korozję chlorkową. Innym źródłem
agresywnego działania chlorków są tzw. środki odladzające
(NaCl, CaCl
2
) stosowane zimą w celu utrzymania właściwej
nawierzchni dróg.
Działanie chlorków jest podwójnie niebezpieczne: następuje
niszczenie betonu w wyniku reakcji jonów chlorkowych z
produktami hydratacji cementu, a dodatkowo, znacznemu
przyspieszeniu ulegają procesy
korozyjne stali zbrojeniowej
.
Ma to szczególne znaczenie w przypadku konstrukcji
żelbetowych (mosty, wiadukty). Powstanie wżerów na
powierzchni prętów stalowych powoduje znaczne
zmniejszenie wytrzymałości całej konstrukcji żelbetowej, a
w konsekwencji może doprowadzić do jej zniszczenia.

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
19
K
K
o
o
r
r
o
o
z
z
j
j
a
a
w
w
ę
ę
g
g
l
l
a
a
n
n
o
o
w
w
a
a
Dwutlenek węgla zawarty w powietrzu lub w roztworach
wodnych wywołuje korozję węglanową betonu. Mechanizm
niszczenia betonu polega na osłabieniu struktury zaczynu
cementowego co jest spowodowane wymywaniem produktu
hydratacji - wodorotlenku wapnia.
Proces korozyjny przebiega dwuetapowo:
• dwutlenek węgla reagując z wodorotlenkiem wapnia
powoduje powstanie węglanu wapnia - CaCO
3
, który jest
trudno rozpuszczalną substancją chemiczną. Prowadzi to do
stopniowego zobojętniania „otuliny” betonowej i stanowi
zagrożenie dla stali zbrojeniowej (możliwość korozji).
• w wyniku dalszego działania dwutlenku węgla i wody na
węglan wapnia tworzy się wodorowęglan wapnia -
Ca(HCO
3
)
2
, który jako substancja dobrze rozpuszczalna jest
wymywany z betonu.

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
20
W
W
y
y
s
s
o
o
k
k
ą
ą
o
o
d
d
p
p
o
o
r
r
n
n
o
o
ś
ś
ć
ć
k
k
o
o
r
r
o
o
z
z
y
y
j
j
n
n
ą
ą
b
b
e
e
t
t
o
o
n
n
u
u
u
u
z
z
y
y
s
s
k
k
u
u
j
j
e
e
s
s
i
i
ę
ę
p
p
r
r
z
z
e
e
z
z
:
:
• wykonanie odpowiednio szczelnego betonu (niska
porowatość) o niskim wskaźniku w/c,
• stosowaniu właściwego rodzaju cementu - cementy
hutnicze, cementy z dodatkami (modyfikowane, cementy
odporne na siarczany i cementy pucolanowe,
• wprowadzenie domieszek chemicznych - uszczelniających
i uplastyczniających.
7.10. Metale i stopy metali stosowane
w budownictwie
Ogólna charakterystyka metali
- metale lekkie: d<5000 kg/m
3
Li, Mg, Al, Ti

CHEMIA, Budownictwo, WAT
Kierunek studiów: budownictwo, inżynieria materiałowa
Specjalności: wszystkie
21
- metale ciężkie: d>5000 kg/m
3
Fe, Cr, Ni, Sn, Pb
- metale łatwo topliwe: T
t
<700
o
C, - Sn, Zn, Pb, Cs
- metale trudno topliwe: T
t
>700
o
C, - Fe, Cr, W, Ni, Ti
W
W
ł
ł
a
a
ś
ś
c
c
i
i
w
w
o
o
ś
ś
c
c
i
i
:
:
- gęstość, d (kg/m
3
)
- wytrzymałość na rozciąganie, f
r
(MPa)
- moduł sprężystości podłużnej, E (GPa)
- temperatura topnienia, T
t
(K)
- przewodność cieplna, λ (W/m K)
- przewodność elektryczna, ρ (Om/m)
- współczynnik liniowej rozszerzalności cieplnej
α
T
10
5
, K
-1
Wyszukiwarka
Podobne podstrony:
Mat Bud wyk 07
Mat Bud wyk 07
mat bud 006 (Kopiowanie) (Kopiowanie)
mat bud 102 (Kopiowanie) (Kopiowanie)
mat bud 067 (Kopiowanie) (Kopiowanie)
mat bud 051 (Kopiowanie) (Kopiowanie)
mat bud 091 (Kopiowanie) (Kopiowanie)
Wnioski do tabeli własciwości mechaniczne, mat bud Laborki
mat bud - kruszywo metoda iteracji, Studia, II rok, Materiały Budowlane 2
Projektowanie betonu metodą zaczynu, Semestr 3 moje, MAT BUD 2, sprawka do wszystkiego, Sprawko - Pr
egzamin korozja mat bud
mat bud 050 (Kopiowanie) (Kopiowanie)
mat bud 106 (Kopiowanie) (Kopiowanie)
mat bud 121 (Kopiowanie) (Kopiowanie)
MAT BUD 4odp
mat bud cwicz 10 11 id 282450 Nieznany
mat bud 118 (Kopiowanie) (Kopiowanie)
więcej podobnych podstron