
___________________________________________________________________________
„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Anna Szukała
Zastosowanie podstawowych procesów fizycznych
311[31].Z1.02
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
1
Recenzenci:
mgr inż. Beata Misiek-Wachowska
mgr inż. Andrzej Wachowski
Opracowanie redakcyjne:
mgr inż. Małgorzata Urbanowicz
Konsultacja:
dr inż. Bożena Zając
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[31].Z1.02
„Zastosowanie podstawowych procesów fizycznych” zawartego w modułowym programie
nauczania dla zawodu technik technologii chemicznej 311[31].
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
10
5.1. Stany skupienia materii
10
5.1.1. Ćwiczenia
10
5.2. Równowagi fazowe w układach jednoskładnikowych
12
5.2.1. Ćwiczenia
12
5.3. Równowagi fazowe w układach dwuskładnikowych
15
5.3.1. Ćwiczenia
5.4 Zjawiska powierzchniowe zachodzące na granicy faz.
Efekty energetyczne przemian fazowych
5.4.1. Ćwiczenia
15
17
17
6. Ewaluacja osiągnięć uczniów
21
7. Literatura
34

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela „Zastosowanie podstawowych
procesów fizycznych”, który będzie pomocny w prowadzeniu zajęć dydaktycznych w szkole
kształcącej w zawodzie technik technologii chemicznej 311 [31].
Aktywizacja uczniów w procesie nauczania jest szczególnie ważna w kształceniu
zawodowym, ponieważ nowoczesny przemysł potrzebuje pracowników wykazujących
postawę twórczą. W kształceniu i rozwijaniu samodzielności uczniów szczególnie sprzyja
nauczanie przez rozwiązywanie zadań problemowych. Dlatego wskazane jest, aby zajęcia
dydaktyczne były prowadzone różnymi metodami aktywizującymi ze szczególnym
uwzględnieniem:
–
testu przewodniego,
–
metody projektów,
–
ćwiczeń praktycznych,
–
zadań problemowych.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy grupowej.
W poradniku zamieszczono:
–
wymagania wstępne,
–
wykaz umiejętności, jakie uczeń opanuje w trakcie kształcenia,
–
przykładowe scenariusze lekcji,
–
propozycje ćwiczeń, które mają na celu ukształtowanie u uczniów umiejętności
praktycznych,
–
wykaz literatury uzupełniającej.
–
zestaw zadań testowych, który umożliwi przeprowadzenie sprawdzianu wiadomości
i umiejętności uczniów.
Zadania testowe zawierają plan testu, instrukcję dla nauczyciela i ucznia, punktację zadań
oraz propozycję norm wymagań.
„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
4
Schemat układu jednostek modułowych
311[31].Z1
Fizykochemiczne podstawy
wytwarzania półproduktów
i produktów przemysłu
chemicznego
311{311].Z1.01
Określanie warunków
prowadzenia procesów
chemicznych
311[31].Z1.02
Zastosowanie
podstawowych procesów
fizycznych
311[31].Z1.03
Zastosowanie
podstawowych procesów
chemicznych
311[31].Z1.04
Opracowanie koncepcji procesów
wytwarzania półproduktów
i produktów przemysłu
chemicznego

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej, uczeń powinien:
−
scharakteryzować budowę atomu i cząsteczek,
−
scharakteryzować pojęcie mola i masy molowej,
−
posługiwać się podstawowym sprzętem laboratoryjnym,
−
znać zasady bhp przy posługiwaniu się odczynnikami chemicznymi,
−
udzielać pierwszej pomocy przy oparzeniach termicznych i chemicznych,
−
znać zasady postępowania podczas pracy z substancjami lotnymi, trującymi
i łatwopalnymi,
−
znać podstawowe jednostki w układzie SI,
−
korzystać z wag analitycznych i technicznych,
−
korzystać z różnych źródeł informacji.
−
czytać tekst ze zrozumieniem.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji jednostki modułowej, uczeń powinien umieć:
−
scharakteryzować stany skupienia substancji,
−
określić charakterystyczne właściwości układów jednoskładnikowych jednofazowych i
wielofazowych,
−
scharakteryzować przemiany zachodzące na granicy faz,
−
obliczyć efekty energetyczne przemian fazowych,
−
scharakteryzować procesy równowagowe zachodzące w układach dwuskładnikowych,
−
zinterpretować wykresy fazowe dla układu ciecz-para i ciecz-faza stała,
−
scharakteryzować podstawowe procesy fizyczne: destylacji, ekstrakcji, absorpcji,
adsorpcji, desorpcji i wymiany jonowej,
−
rozdzielić mieszaniny z zastosowaniem podstawowych procesów fizycznych,
−
wykorzystać w sposób racjonalny substancje i czynniki energetyczne,
−
sporządzić dokumentację laboratoryjną,
−
wyciągać właściwe wnioski z obserwowanych zjawisk,
−
określić zastosowanie podstawowych procesów fizycznych w technologii chemicznej,
−
zastosować przepisy bhp oraz ochrony przeciwpożarowej podczas wykonywania prac
laboratoryjnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
7
4.
PRZYKŁADOWE SCENARIUSZE LEKCJI
Scenariusz zajęć 1
Osoba prowadząca: ……………………………………………
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł: Fizykochemiczne podstawy wytwarzania półproduktów i produktów przemysłu
Chemicznego 311[31].Z1
Jednostka modułowa: Zastosowanie podstawowych procesów fizycznych 311[31].Z1.02
Temat: Równanie stanu gazu doskonałego.
Cel ogólny: kształtowanie umiejętności rozwiązywania problemów indukcyjno– uogólniających,
usystematyzowanie i utrwalenie wszystkich poznanych praw, opisujących stan
gazowy materii.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
–
słownie i matematycznie podać równanie gazu doskonałego dla jednego i „n” moli gazu,
–
określić stałą gazową i jej wymiar,
–
wykazać, że zastosowanie prawa zależy od parametrów stanu gazu,
–
obliczać masę molową związków chemicznych.
Metody nauczania–uczenia się:
–
dyskusja problemowa.
Formy organizacyjne pracy uczniów:
–
grupowa i indywidualna,
Czas: 45
minut.
Środki dydaktyczne:
–
foliogram ilustrujący przemiany gazowe,
–
grafoskop,
–
Kalendarz chemiczny,
–
Tablice fizykochemiczne.
Przebieg zajęć:
1. Czynności organizacyjne – sprawdzenie obecności.
2. Wyjaśnienie celu lekcji, nawiązanie do tematu.
3. Przypomnienie praw dotyczących przemian: izochorycznej, izobarycznej i izotermicznej.
4. Organizowanie sytuacji problemowej.
5. Sformułowanie zadania problemowego przez uczniów.
6. Rozwiązanie problemu i zreferowanie wyników.
7. Weryfikacja wyników przez rozwiązanie przykładowego obliczenia.
8. Sprawdzenie wyniku obliczenia w Tablicach fizykochemicznych lub Kalendarzu
chemicznym.
9. Podsumowanie i integracja wiedzy.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
8
Zakończenie zajęć
Praca domowa
Wykonanie zadania obliczeniowego, polegającego na obliczeniu masy molowej określonej
substancji.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
– anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć, trudności
podczas realizowania zadania i zdobytych umiejętności

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca: …………………………………………
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł:
Fizykochemiczne podstawy wytwarzania półproduktów i produktów przemysłu
Chemicznego 311[31].Z1
Jednostka modułowa: Zastosowanie podstawowych procesów fizycznych 311[31].Z1.02
Temat: Badanie wpływu temperatury na rozpuszczalność ciał stałych w cieczach.
Cel ogólny: określenie wpływu temperatury na rozpuszczalność ciał stałych w cieczach.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
– określić wpływ temperatury na rozpuszczalność ciał stałych w cieczach,
– uzasadnić zaobserwowane zjawiska,
– wskazać praktyczne zastosowanie wpływu temperatury na rozpuszczalność ciał stałych.
Metody nauczania–uczenia się:
– ćwiczenie praktyczne.
Formy organizacyjne pracy uczniów:
– grupowa.
Czas: 45
minut.
Środki dydaktyczne:
– podstawowy sprzęt laboratoryjny,
– waga techniczna,
– odczynniki chemiczne: KI, CuSO
4
·5H
2
O, Na
2
CO
3
, Pb(NO
3
)
2
, sacharoza,
– Tablice fizykochemiczne.
Przebieg zajęć:
1. Czynności organizacyjne – sprawdzenie obecności.
2. Nawiązanie do tematu, omówienie celu zajęć, przypomnienie przepisów bhp.
3. Sformułowanie zadania problemowego.
4. Analiza problemu i ułożenie planu działania.
5. Wykonanie doświadczeń.
6. Zapis obserwacji z przeprowadzonego eksperymentu.
7. Wyciągnięcie wniosków z przeprowadzonego eksperymentu.
Zakończenie zajęć
Praca domowa
Zapoznaj się, korzystając z materiałów dla ucznia oraz z literatury pkt 6, z wiadomościami
dotyczącymi rozpuszczalności ciał stałych w innych rozpuszczalnikach niż woda.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
– anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć, trudności
podczas realizowania zadania i zdobytych umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
10
5. ĆWICZENIA
5.1. Stany skupienia materii
5.1.1. Ćwiczenia
Ćwiczenie 1
Oblicz objętość, jaką zajmie 100 dm
3
gazu znajdującego się w warunkach normalnych
jeżeli jego temperatura wzrośnie o 100K. Ogrzewanie prowadzono w warunkach
izobarycznych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) znać prawa gazowe,
2) znać parametry warunków normalnych,
3) dokonać obliczeń wskazanych w treści zadania.
Zalecane metody nauczania–uczenia się
–
ćwiczenia rachunkowe
Środki dydaktyczne
–
materiał nauczania pkt 4.1.1,
–
literatura pkt 6.
Ćwiczenie 2
Oblicz ciśnienia gazów: H
2 ,
N
2,
CO
2
w temperaturze 25
o
C znajdujących się w naczyniach
o objętościach 3 dm
3
każde, zawierających jednakowe masy wynoszące po 4 gramy. Jakie
ciśnienie wywierałaby mieszanina tych gazów w tych samych warunkach, znajdująca się
w naczyniu o objętości 3 dm
3
?
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) znać i umieć wykorzystać prawa gazowe,
2) znać wartość liczbową uniwersalnej stałej gazowej,
3) przeliczyć temperaturę ze skali Celsjusza na skalę Kelvina,
4) obliczyć liczbę moli poszczególnych gazów,
5) obliczyć ciśnienie gazów w każdym zbiorniku,
6) obliczyć sumaryczne ciśnienie mieszaniny gazów,
7) wyciągnąć wnioski z uzyskanych wyników.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
11
Zalecane metody nauczania–uczenia się
–
ćwiczenia rachunkowe
Środki dydaktyczne
–
materiał nauczania pkt 4.1.1.,
–
literatura pkt 6.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
12
5.2. Równowagi fazowe w układach jednoskładnikowych
5.2.1. Ćwiczenia
Ćwiczenie 1
Określ wpływ temperatury i ciśnienia na rozpuszczalność gazów.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien;
1) znać cechy charakterystyczne dotyczące stanu gazowego,
2) ogrzać lub oziębić wodę gazowaną do temperatury wskazanej przez nauczyciela,
3) dokonać obserwacji wody gazowanej w różnych temperaturach,
4) przeanalizować foliogram przedstawiający rozpuszczalność CO
2
w wodzie pod różnymi
ciśnieniami,
5) wyciągnąć i zapisać wnioski z dokonanych obserwacji.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
–
podstawowy sprzęt laboratoryjny,
–
termometr,
–
grafoskop,
–
foliogram – rozpuszczalność CO
2
= f(p)
–
woda gazowana,
–
lód.
Ćwiczenie 2
Sprawdź, czy rozpuszczalność tlenu w wodzie jest zgodna z prawem Henry´ego.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z foliogramem przedstawiającym rozpuszczalność tlenu pod różnymi
ciśnieniami,
2) wyznaczyć współczynnik proporcjonalności występujący w zapisie prawa Henry´ego,
3) sporządzić wykres izotermy dla tlenu rozpuszczonego w wodzie,
4) wyciągnąć wnioski z przeprowadzonego ćwiczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
13
Zalecane metody nauczania–uczenia się
–
metoda tekstu przewodniego.
Środki dydaktyczne:
–
grafoskop,
–
foliogram – rozpuszczalność O
2
= f(p).
Ćwiczenie 3
Wyznacz krzywą równowagi etanolu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z obsługą przyrządu służącego do pomiaru ciśnienia pary nasyconej,
2) zmierzyć ciśnienie pary nasyconej w kilku różnych temperaturach,
3) sporządzić wykres zależności: p = f (T).
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne
–
przyrząd do pomiaru pary nasyconej,
–
termostat,
–
termometr,
–
etanol.
Ćwiczenie 4
Określ wpływ temperatury na rozpuszczalność ciał stałych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) otrzymać PbI
2
, dysponując wodnymi roztworami KI i Pb(NO
3
)
2
,
2) ogrzać powstały układ i określić zmiany zachodzące po ogrzaniu,
3) ochłodzić układ,
4) zinterpretować zaobserwowane zjawiska,
5) przestrzegać przepisów bhp przy ogrzewaniu substancji w probówkach.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
14
Środki dydaktyczne
–
podstawowy sprzęt laboratoryjny,
–
palnik,
–
roztwory wodne KI i Pb(NO
3
)
2
.
Ćwiczenie 5
Określ wpływ mieszania i stopnia rozdrobnienia na rozpuszczalność ciała stałego.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) odważyć próbki tej samej substancji, o tej samej masie lecz o różnym stopniu
rozdrobnienia,
2) sporządzić roztwory o tym samym stężeniu z przygotowanych uprzednio próbek,
3) obserwować i porównać czas rozpuszczania tych próbek,
4) określić czas rozpuszczania dwóch próbek tej samej substancji, o takim samym stopniu
rozdrobnienia i w tej samej temperaturze, mieszając jedna z nich.
5) wyciągnąć wnioski z poczynionych obserwacji i uzasadnić je.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
–
podstawowy sprzęt laboratoryjny,
–
waga techniczna,
–
moździerz,
–
stały CuSO
4
5H
2
O,
–
woda destylowana.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
15
5.3. Równowagi fazowe w układach dwuskładnikowych
5.3.1. Ćwiczenia
Ćwiczenie 1
Określ czynniki wpływające na koagulację białka.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) sporządzić wodny roztwór białka kurzego,
2) roztwór białka podzielić na pięć części,
3) do każdej z tych części dodać kolejno:
–
roztwór H
2
SO
4
,
–
etanol,
–
roztwór CuSO
4,
–
roztwór NaCl,
–
ostatnią probówkę należy ogrzać,
4) dokonać obserwacji przeprowadzonego eksperymentu,
5) wyciągnąć wnioski i uzasadnić je.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
sprzęt laboratoryjny:
–
kolba stożkowa,
–
probówki w statywie,
–
pipetki, łapa do probówek,
–
palnik,
odczynniki:
–
białko,
–
roztwory H
2
SO
4
, CuSO
4,
NaCl,
–
etanol,
–
woda destylowana.
Ćwiczenie 2
Otrzymaj zol i żel wodorotlenku żelaza(III).
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) wkraplać 0,1 mol/dm
3
roztwór FeCl
3
do 50 cm
3
wrzącej wody aż do uzyskania żółtej barwy,
2) rozdzielić zawartość zlewki na cztery jednakowe części,

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
16
3) do każdej z tych części należy dodać kolejno roztwory o stężeniu 1 mol/dm
3
następujących odczynników: Na
2
SO
4,
MgSO
4,
KAl(SO
4
)
2,
4) dokonać obserwacji, porównując zawartości zlewek z czwartą częścią roztworu
wyjściowego,
5) wyciągnąć wnioski i uzasadnić je.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
sprzęt laboratoryjny :
–
5 zlewek,
–
pipetki,
–
palnik,
–
trójnóg,
–
siatka ochronna,
–
roztwory następujących odczynników o stężeniu 1 mol/dm
3
:
Na
2
SO
4,
MgSO
4,
KAl(SO
4
)
2,
FeCl
3
, H
2
O destylowana
Ćwiczenie 3
Sporządź emulsję z wody i oleju mineralnego.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) sporządzić acetonowy roztwór oleju mineralnego,
2) zmieszać roztwór acetonowy z wodą destylowaną,
3) ogrzewać otrzymaną mieszaninę pod wyciągiem, do temp. bliskiej jej wrzenia w celu
usunięcia acetonu. Należy pamiętać o przestrzeganiu przepisów bhp,
4) obserwować emulsję w świetle przechodzącym i oświetleniu bocznym,
5) wyciągnąć wnioski z poczynionych obserwacji.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne,
Środki dydaktyczne:
sprzęt laboratoryjny:
–
zlewki,
–
łaźnia wodna elektryczna,
–
mieszadło elektromagnetyczne, dipol,
odczynniki:
– olej mineralny,
– aceton,
– woda destylowana
Uwaga: można użyć również oleju parafinowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
17
5.4. Zjawiska powierzchniowe zachodzące na granicy faz. Efekty
energetyczne przemian fazowych
5.4.1.Ćwiczenia
Ćwiczenie 1
Wyznacz ilość energii niezbędnej do odparowania metanolu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) znać obsługę przyrządu do wyznaczania ciśnienia pary nasyconej,
2) zmierzyć ciśnienie pary nasyconej w kilku różnych temperaturach,
3) sporządzić wykres w układzie logp = f( 1/T),
4) obliczyć molowe ciepło parowania, wykorzystując wykres lub równanie Clausiusa-
Clapeyrona,
5) obliczyć efekt energetyczny dla określonej masy metanolu.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
–
przyrząd do pomiaru ciśnienia pary nasyconej,
–
termostat,
–
termometr,
–
metanol.
Ćwiczenie 2
Wyznacz efekt energetyczny rozpuszczania i rozcieńczania kwasu siarkowego(VI).
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zmierzyć gęstość kwasu siarkowego(VI),
2) odczytać z tablic fizykochemicznych stężenie procentowe kwasu,
3) odważyć w ampułce próbkę kwasu.
4) odmierzyć określoną objętość wody i wprowadzić do kalorymetru,
5) rozbić ampułkę w wodzie,
6) zmierzyć temperaturę wody przed rozbiciem ampułki i po rozbiciu,
7) po ustaleniu się temperatury dolać określoną porcję wody i zmierzyć temperaturę,
„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
18
8) pomiarów temperatury dokonywać po każdorazowym rozcieńczeniu roztworu kwasu
określoną ilością wody,
9) obliczyć ciepło rozpuszczania kwasu w wodzie i po każdorazowym dodaniu wody –
ciepło rozcieńczania,
10) sporządzić wykres: ilość wydzielonego ciepła podczas rozpuszczania kwasu jako funkcja
ilości dodanej wody i zinterpretować uzyskaną krzywą.
Zalecane metody nauczania–uczenia się
−
ćwiczenie praktyczne.
Środki dydaktyczne
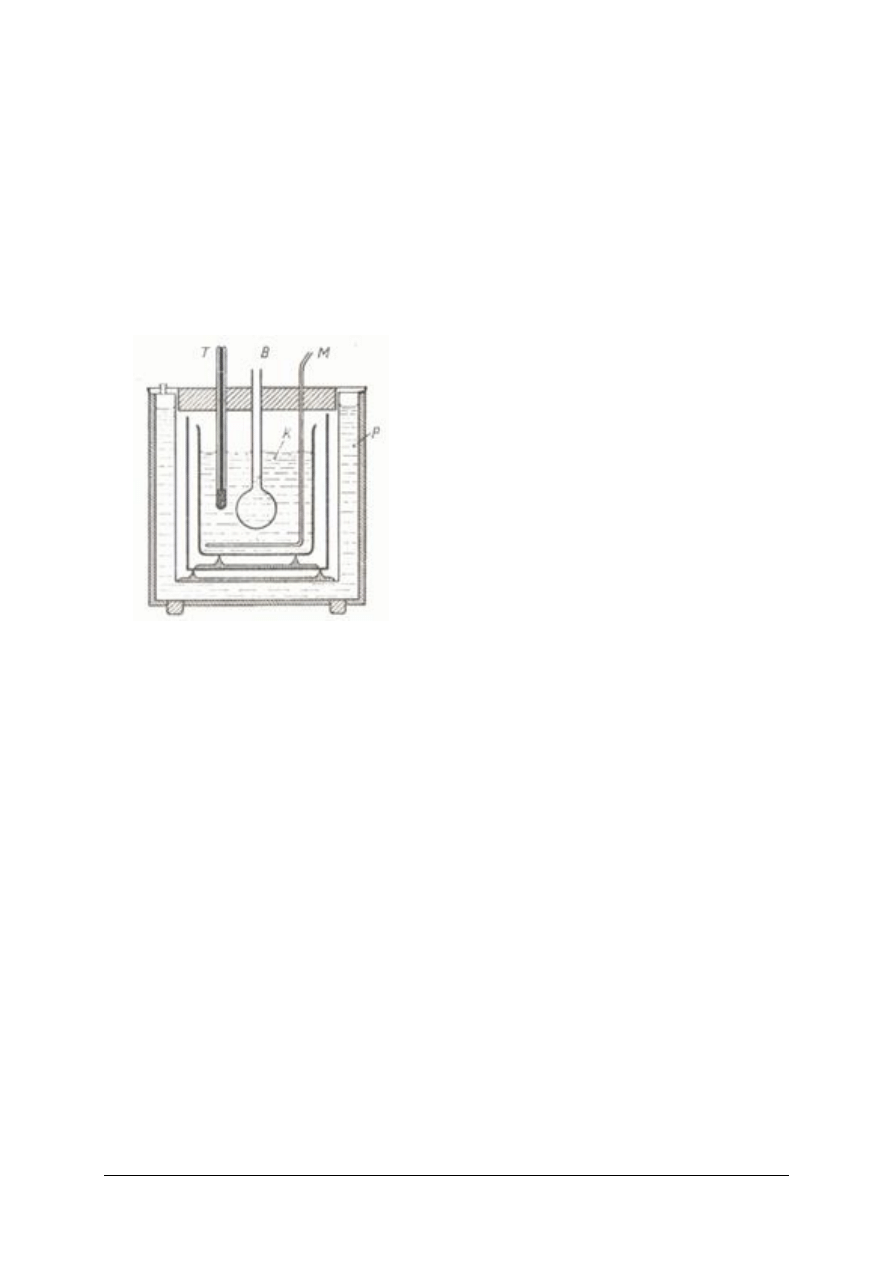
Rys. 30 Kalorymetr: T –termometrBeckmanna
M –mieszadło, K –kalorymetr, P –płaszcz wodny
B –ampułka [5]
−
kalorymetr
−
termometr Beckmanna,
−
waga analityczna,
−
areometr,
−
ampułki,
−
podstawowy sprzęt laboratoryjny,
−
Tablice fizykochemiczne,
−
kwas siarkowy(VI), woda destylowana.
Ćwiczenie 3
Rozdziel na składniki mieszaninę ciekłą.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania
Uczeń powinien:
1) zmontować zestaw do destylacji frakcyjnej,
2) po doprowadzeniu cieczy do wrzenia zbierać frakcje wrzące w odpowiednim zakresie
temperatur,
3) wyciągnąć wnioski.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
19
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
–
zestaw do destylacji frakcyjnej,
–
ropa naftowa.
Ćwiczenie 4
Rozdziel na składniki kolorowy atrament.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przygotować paski z bibuły filtracyjnej dłuższe o 1 cm od wysokości cylindra
i szerokości mniejszej niż średnica cylindra,
2) do cylindra wlać mieszaninę etanolu z wodą (1:1),
3) umieścić paski z zaznaczoną na nich czarną kreską tak, aby kreski znalazły się ponad
roztworem,
4) wykonać próbę rozdzielenia stosując różny skład cieczy użytej do rozdzielania,
5) obserwować wędrująca ciecz na paskach bibuły,
6) wyciągnąć wnioski z poczynionych obserwacji.
Zalecane metody nauczania–uczenia się
–
ćwiczenie praktyczne.
Środki dydaktyczne:
–
cylindry, zlewki, bagietki,
–
bibuła filtracyjna,
–
nożyczki,
–
etanol, ocet, woda destylowana.
Ćwiczenie 5
Usuń wyznaczony składnik z roztworu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) oznaczyć stężenie kwasu octowego,
2) odmierzyć określoną objętość kwasu i umieść w niej porcję węgla aktywnego,
3) wytrząsać kwas z węglem,
4) przesączyć i wyznaczyć stężenie kwasu w przesączu, porównać stężenie kwasu przed i po
adsorpcji,
5) wyciągnąć wnioski.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
20
Zalecane metody nauczania–uczenia się
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zestaw do miareczkowania,
−
kolby stożkowe, lejek,
−
bibuła filtracyjna,
−
roztwór kwasu octowego,
−
mianowany roztwór NaOH, fenoloftaleina,
−
węgiel aktywny.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
21
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test dwustopniowy do jednostki modułowej „Zastosowanie podstawowych
procesów fizycznych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
-
zadania 4, 6, 11, 13, 17,18 są z poziomu ponadpodstawowego
-
pozostałe zadania są z poziomu podstawowego.
Punktacja zadań 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
-
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
-
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
-
dobry – za rozwiązanie 16 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
-
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 4 z poziomu
ponadpodstawowego,
Klucz odpowiedzi:1.d, 2.a, 3.b, 4.c, 5.b, 6.c, 7.b, 8.a, 9.b, 10.d, 11.a, 12.d, 13.c,
14.a, 15.d, 16.b, 17.a, 18.c, 19.a, 20.c.
Plan testu
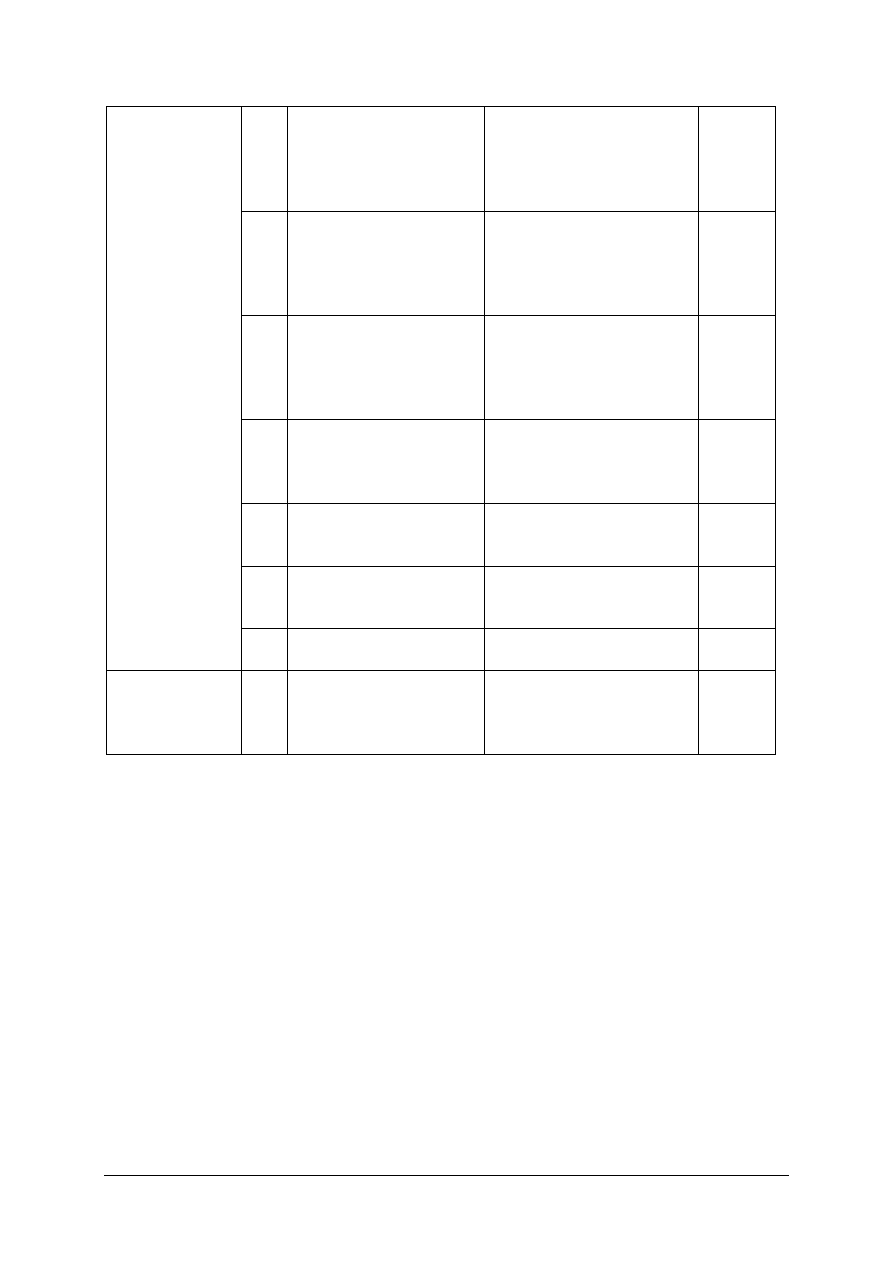
Nr
zadania.
Cel operacyjny
Mierzone osiągnięcia uczniów
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1.
Określić warunki istnienia poszczególnych
stanów materii
B
P
d
2.
Określić
warunki
zbliżające
gaz
rzeczywisty do doskonałego
B
P
a
3.
Wykazać się znajomością prawa Avogadra
A
P
b
4.
Zastosować prawo Avogadra w
rozwiązywaniu zadań
C
PP
c
5.
Określić graficzny obraz izotermy
B
P
b
6.
Zastosować prawo Gay-Lussaca przy
rozwiązywaniu zadań
C
PP
c
7.
Ustalić od jakich parametrów zależy
wartość uniwersalnej stałej gazowej
A
P
b
8.
Ustalić rodzaj przemiany w zależności od
jej kształtu graficznego
B
P
a
9.
Ustalić wpływ sił międzycząsteczkowych
B
P
b

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
22
na prawo Raoulta
10.
Określić
trwałość
stanu
układu
w
zależności od zmian parametrów stanu
B
P
d
11.
Przeliczyć stężenie procentowe na molowe
C
PP
a
12.
Określić efektywne warunki prowadzenia
procesów adsorpcji
B
P
d
13.
Przeliczyć rozpuszczalność substancji na
stężenie molowe
D
PP
c
14.
Określić warunki współistnienia ze sobą
faz
B
P
a
15.
Określić stopień nasycenia roztworu w
zależności od jego składu w punkcie
eutektycznym
B
P
d
16.
Podać cechy koloidów
A
P
b
17.
Określić ilość stopni swobody parametrów
dla
układu
trójskładnikowego
jednofazowego bez zmiany stanu układu
C
PP
a
18.
Dobrać rodzaj destylacji do rozdzielenia
mieszanin ciekłych
C
PP
c
19.
Określić rolę substancji powierzchniowo
czynnych
B
P
a
20.
Określić efekt energetyczny przemian
fizycznych
B
P
c

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
23
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych,
jakie będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego.
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Test zawiera 20 pytań wielokrotnego wyboru.
5. Dodrze zastanów się nad wyborem prawidłowej odpowiedzi.
6. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi, stawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci czas wolny.
8. Na rozwiązanie testu masz 45 min.
9. Pracuj samodzielnie.
Powodzenia
Materiały dla ucznia:
−
instrukcja,
−
zestaw zadań testowych,
−
karta odpowiedzi.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
24
ZESTAW PYTAŃ TESTOWYCH
1. Występowanie substancji w danym stanie skupienia nie zależy od:
a)
ciśnienia,
b)
temperatury,
c)
sił spójności,
d)
masy molowej.
2. Gazy rzeczywiste właściwościami zbliżają się do gazu doskonałego:
a)
w warunkach rozrzedzenia i podwyższonej temperaturze,
b)
tylko przy niskich ciśnieniach,
c)
tylko w podwyższonej temperaturze i warunkach zagęszczenia,
d)
w żadnych warunkach.
3. Różne gazy mają taką samą ilość cząsteczek, gdy:
a)
objętości są takie same,
b)
są jednakowe: objętości, ciśnienie i temperatura,
c)
ciśnienie jest takie samo,
d)
temperatura jest taka sama.
4.W warunkach normalnych 1,505 · 10
23
cząsteczek wodoru zajmuje objętość:
a)
22,4 dm
3
,
b)
5,6 m
3
,
c)
5,6 dm
3
,
d)
2,24 m
3
.
5.Izoterma funkcji p = f( v) ma kształt:
a)
linii prostej równoległej do osi rzędnej,
b)
hiperboli równobocznej,
c)
paraboli,
d)
linii prostej równoległej do osi odciętej.
6. Gaz o objętości 5 dm
3
i temperaturze 300 K ogrzany pod stałym ciśnieniem o 100 K zajmie
objętość:
a)
7,5 dm
3
,
b)
5,5 dm
3
,
c)
6,6 dm
3
,
d)
7,6 dm
3
,
7. Uniwersalna stała gazowa:
a)
zależy od temperatury i nie zależy od ciśnienia,
b)
nie zależy od żadnych parametrów stanu,
c)
zależy od ciśnienia, nie zależy od objętości,
d)
zależy od objętości, nie zależy od temperatury.
8. Linią prostą funkcji p = f(v), p = f(T), v = f(T) jest:
a)
izochora i izobara,
b)
izoterma i izochora,
c)
izobara i izotera,
d)
tylko izochora.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
25
9. Jeżeli siły międzycząsteczkowe składników roztworu są większe od sił
międzycząsteczkowych w czystych składnikach, to:
a)
spełnione jest prawo Raoulta,
b)
wystąpi ujemne odchylenie od prawa Raoulta,
c)
wystąpi dodatnie odchylenie od prawa Raoulta,
d)
roztwór jest doskonały.
10. W układzie dwuskładnikowym punkt niezmienny istnieje, gdy występują obok siebie:
a)
dwie fazy,
b)
trzy fazy,
c)
jedna faza,
d)
cztery fazy.
11. Stężenie molowe roztworu kwasu siarkowego(VI) 90% o gęstości 1,8 g/cm
3
wynosi:
a)
16,5 mol/dm
3
,
b)
33,0 mol/dm
3
,
c)
20, 6 mol/dm
3
,
d)
15,5 mol/dm
3
.
12. Gazy i ciecze są dobrze adsorbowane przez jeden i ten sam adsorbent im:
a)
wyższa temperatura adsorbenta,
b)
niższe ciśnienie adsorbatu,
c)
wyższa temperatura krytyczna adsorbatu,
d)
większa masa molowa adsorbatu.
13. Stężenie molowe wodnego roztworu NaCl o gęstości 1,2 g/cm
3
i rozpuszczalności
36 g/100g wody wynosi:
a)
3,4 mol/dm
3
,
b)
8,2 mol/dm
3
,
c)
5,4 mol/dm
3
,
d)
6,0 mol/dm
3
.
14.Współistnienie faz stałej, ciekłej, gazowej zależy od:
a)
temperatury,
b)
wymiany energii z otoczeniem,
c)
wprowadzenie innego składnika do układu,
d)
rodzaju substancji.
15. Roztwór dwuskładnikowy o składzie eutektycznym jest roztworem:
a)
nienasyconym,
b)
nasyconym tylko względem składnika A,
c)
nasyconym tylko względem składnika B,
d)
nasyconym względem składnika A i B.
16. Koloidy liofobowe charakteryzują się tym, że:
a)
tworzą galarety i piany,
b)
cząstki ich są zawsze naładowane elektrycznie,
c)
stężenie fazy rozproszonej może być duże,
d)
wykazują małą wrażliwość na działanie elektrolitów.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
26
17. Dla układu trójskładnikowego jednofazowego liczba stopni swobody wynosi:
a)
4,
b)
3,
c)
2,
d)
1.
18. Jaką destylację należy zastosować przy rozdzielaniu mieszaniny rozkładającej się
w wysokich temperaturach:
a)
zwykłą,
b)
z parą wodną,
c)
próżniową,
d)
frakcyjną .
19. Substancje powierzchniowo czynne:
a)
obniżają napięcie powierzchniowe cieczy,
b)
gromadzą się bezładnie na powierzchni cieczy,
c)
zwiększają napięcie powierzchniowe cieczy,
d)
obniżają stężenie w warstwie powierzchniowej.
20. Które przemiany fazowe wymagają dostarczenia do układu energii na sposób ciepła:
a)
krzepnięcie,
b)
skraplanie,
c)
parowanie,
d)
desublimacja .
„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
27
Karta odpowiedzi
Imię i nazwisko............................................................................................
Zastosowanie podstawowych procesów fizycznych
Zakreśl poprawną odpowiedź, wpisz brakujące części zdania lub wykonaj rysunek.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
28
TEST 2
Test próba pracy
-
Test jest przewidziany jako próba pracy.
Zadanie: Określ wpływ mieszania, stopnia rozdrobnienia i temperatury na rozpuszczalność
ciał stałych w cieczach.
Punktacja zadań 0 lub 1 punkt
Za każdą prawidłowo wykonaną czynność uczeń otrzymuje 1 punkt. Za źle wykonaną
czynność lub jej brak uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące oceny szkolne:
dopuszczający : za wykonanie prawidłowo czynności 1, 2, 4, 5, 7, 8, 10, 13 i uzyskanie
8 punktów,
dostateczny: za wykonanie prawidłowo czynności 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 14 i uzyskanie
11 punktów,
dobry: za wykonanie prawidłowo czynności 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16 i uzyskanie
13 punktów,
bardzo dobry: za wykonanie wszystkich czynności i uzyskanie 16 punktów.
„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
29
Kryteria oceny
Klucz punktowania
Obszar
wymagań
N
u
m
er
cz
ynno
śc
Sprawdzana czynność
Kryterium wykonania
czynności
Punktacja
0 – 1
Organizacja
stanowiska
pracy
1.
Uczeń organizuje
stanowisko pracy
zgodnie z wymogami
bhp
Zorganizował stanowisko
pracy i założył fartuch
ochronny
1
2.
Dobiera sprzęt
potrzebny do wykonania
zadania
Przygotował: zlewki,
wagę, cylinder miarowy,
naczyńko wagowe,
moździerz, sita,
termometr, palnik, siatkę
ochronną, łopatki, stoper,
mieszadło i substancje
wskazaną przez
nauczyciela
1
3.
Uczeń rozdrabnia
substancję wskazaną
przez nauczyciela
Rozdrobnił w moździerzu
substancję otrzymaną
1
4.
Uczeń przesiewa
rozdrobniona substancję
Przesiał substancje i
uzyskał co najmniej dwie
frakcje
1
5.
Uczeń przygotowuje
odważki substancji
Odważył na wadze
technicznej po 3 odważki
z każdej uzyskanej frakcji
(każda o masie 50 g)
1
6.
Uczeń sprawdza
w literaturze
rozpuszczalność
otrzymanej soli
Prawidłowo odczytał w
tablicach
fizykochemicznych
rozpuszczalność
otrzymanej soli
1
7.
Uczeń przeprowadza
obliczenia dotyczące
ilości rozpuszczalnika
Obliczył prawidłowo ilość
wody potrzebną do
sporządzenia roztworów
o tym samym stężeniu
1
Wykonywanie
zadania z
zachowaniem
przepisów bhp
8.
Uczeń określa czas
rozpuszczania soli
w temp. pokojowej
Przeprowadził poprawnie
przygotowanie próbek i
porównał czas ich
rozpuszczania
1
„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
30
9.
Uczeń określa czas
rozpuszczania soli,
uwzględniając mieszanie
Przeprowadził poprawnie
przygotowanie próbek,
uruchomił mieszadło
i zmierzył czas
rozpuszczania
1
10.
Uczeń określa czas
rozpuszczania soli,
uwzględniając
temperaturę
Przeprowadził poprawnie
przygotowanie próbek i
zmierzył czas ich
rozpuszczania w temp.
70
0
C
1
11.
Uczeń porównuje wpływ
parametrów na
rozpuszczalność
substancji
Dokonał porównania
wpływu temperatury,
stopnia rozdrobnienia i
mieszania na
rozpuszczalność substancji
1
12.
Uczeń utrzymuje ład
i porządek podczas
wykonywania ćwiczenia
Podczas wykonywania
ćwiczenia uczeń
utrzymywał ład i porządek
na stanowisku pracy
1
13.
Uczeń porządkuje
stanowisko pracy
Uporządkował stanowisko
pracy po wykonaniu
ćwiczenia
1
14.
Uczeń wyciąga wnioski
z przeprowadzonego
eksperymentu
Wyciągnął poprawne
wnioski
1
15.
Uczeń uzasadnia
wyciągnięte wnioski
Poprawnie i logicznie
uzasadnił wnioski
1
Prezentowanie
i ocena
wykonanego
ćwiczenia
16.
Uczeń prezentuje i
ocenia wykonane
ćwiczenie
Ocenił jakość swojej
pracy, wskazał ewentualne
nieprawidłowości
1

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
31
KARTA OBSERWACJI
Imię i nazwisko ……………………………………………………..
Zastosowanie podstawowych procesów fizycznych
Określ wpływ mieszania, stopnia rozdrobnienia i temperatury na rozpuszczalność ciał
stałych w cieczach.
O
B
S
Z
A
R
W
Y
M
AGA
Ń
CZYNNOŚCI OCENIANE I KRYTERIA
WYKONANIA
L
IC
Z
B
A
P
UNK
T
ÓW
Czynność 1: Organizowanie stanowiska pracy
Organizacja stanowiska
pracy
Kryterium wykonania: jeżeli uczeń :
Przygotował odzież ochronną – fartuch ochronny
Czynność 2: Dobieranie sprzętu potrzebnego do
wykonania zadania
Kryterium wykonania: jeżeli uczeń :
Przygotował: zlewki, wagę, cylinder miarowy,
naczyńko wagowe, moździerz, sita, termometr, palnik,
siatkę ochronną, łopatki, stoper, mieszadło i
substancję wskazaną przez nauczyciela
Czynność 3.: Rozdrabnianie substancji wskazanej
przez nauczyciela
Kryterium wykonania: jeżeli uczeń:
Rozdrobnił w moździerzu substancję otrzymaną do
wykonania zadania
Czynność 4.: Przesiewanie rozdrobnionej substancji
Kryterium wykonania: jeżeli uczeń:
Przesiał substancję i uzyskał co najmniej dwie frakcje
Czynność 5.:przygotowanie odważek substancji
Kryterium wykonania: jeżeli uczeń:
Odważył na wadze technicznej po 3 odważki
z każdej uzyskanej frakcji (każda o masie 50 g)
Czynność 6.: Sprawdzenie w literaturze
rozpuszczalności otrzymanej soli
Kryterium wykonania: jeżeli uczeń:
Prawidłowo odczytał w tablicach fizykochemicznych
rozpuszczalność otrzymanej soli
Czynność 7.: przeprowadzenie obliczeń dotyczących
ilości rozpuszczalnika
Wykonywanie zadania z
zachowaniem przepisów bhp
Kryterium wykonania: jeżeli uczeń:
Obliczył prawidłowo ilość wody potrzebnej do
rozpuszczenia soli i sporządzenia roztworów o tym
samym stężeniu

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
32
Czynność 8.: Określanie czasu rozpuszczania próbek
substancji w temp. pokojowej, bez mieszania
Kryterium wykonania: jeżeli uczeń:
Przeprowadził poprawnie przygotowanie próbki,
uruchomił mieszadło i zmierzył czas rozpuszczania
Czynność 9.: Określanie czasu rozpuszczania próbek
substancji w temp. pokojowej z mieszaniem
Kryterium wykonania: jeżeli uczeń:
Przeprowadził poprawnie przygotowanie próbki,
uruchomił mieszadło i zmierzył czas rozpuszczania
w temp. pokojowej
Czynność 10.: Określanie czasu rozpuszczania
próbek w temp. 70
0
C
Kryterium wykonania: jeżeli uczeń;
Przeprowadził poprawnie przygotowanie próbek
i zmierzył czas rozpuszczania w temp. 70
0
C
Czynność 11.: Porównanie wpływu parametrów na
rozpuszczalność substancji
Kryterium wykonania: jeżeli uczeń:
Dokonał porównania wpływu temperatury, stopnia
rozdrobnienia i mieszania na rozpuszczalność
substancji
Czynność 12.: Utrzymywanie ładu i porządku na
stanowisku pracy
Kryterium wykonania: jeżeli uczeń:
Utrzymywał ład i porządek na stanowisku pracy
Czynność 13.: Porządkowanie stanowiska pracy
Kryterium wykonania: jeżeli uczeń:
Po zakończeniu zadania uporządkował stanowisko
pracy
Czynność 14.: Wyciąganie wniosków
z przeprowadzonego eksperymentu
Kryterium wykonania: - jeżeli uczeń:
Poprawnie sformułował wnioski
Czynność 15.: Uzasadnienie wyciągniętych
wniosków
Kryterium wykonania: jeżeli uczeń:
Poprawnie i logicznie uzasadnił wnioski
Czynność 16.: Prezentacja i ocena wykonanego
zadania
Prezentowanie
i ocena wykonanego zadania
Kryterium wykonania: - jeżeli uczeń ocenił jakość
swojej pracy, wskazał ewentualne nieprawidłowości
Łączna liczba punktów
Uzyskana ilość punktów
i ocena
Uzyskana ocena szkolna

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
33
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów ze sposobem testowania: próba pracy oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę ocenienia wykonywanych czynności, jakie będą w teście.
5. Omów z uczniami sposób wykonania zadania typu próba pracy,
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom Instrukcje do wykonania zadania wraz z dokumentacją, podaj czas
przeznaczony na wykonanie zadania.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia wykonania ćwiczenia.
10. Wpisz do karty obserwacji wyniki przeprowadzonego testowania..
11. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te czynności, które
sprawiły uczniom największe trudności.
12. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
13. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Zapoznaj się z dokumentacją zadania.
3. Test próba pracy oceniany jest według punktacji określającej zarówno czynności
wykonywane podczas testowania, jak i ich prawidłowość.
4. Pracuj samodzielnie.
5. Utrzymuj ład i porządek na stanowisku pracy.
6. Po zakończonym zadaniu uporządkuj stawisko pracy.
7. Zaprezentuj efekty swojej pracy, wskaż trudności lub niedociągnięcia.
8. Na rozwiązanie testu masz 90 min.
Powodzenia
Materiały dla ucznia:
−
Instrukcja z dokumentacją zadania,
−
Zestaw odczynników chemicznych
−
Sprzęt laboratoryjny umożliwiające wykonanie zadania
−
Tablice fizykochemiczne, Kalendarz chemiczny.

„Projekt współfinansowany ze środków Europejskiego Funduszu społecznego”
34
7. LITERATURA
1. Atkins P.W.: Chemia fizyczna. PWN, Warszawa 2002
2. Buchnowski H. Ufnalski W.: Gazy, ciecze, płyny. WNT, Warszawa 1995
3. Buchnowski H. Ufnalski W.: Roztwory. WNT, Warszawa 1995
4. Karpiński W. Chemia fizyczna. WSiP, Warszawa 1978
5. Pigoń K., Ruziewicz Z.: Chemia fizyczna. PWN, Warszawa 1996
6. Ufnalski W. Równowagi chemiczne. WNT, Warszawa 1995
7. Praca zbiorowa: Chemia fizyczna. PWN, Warszawa 1980
Wyszukiwarka
Podobne podstrony:
11 Zastosowanie programu komput Nieznany (2)
gri2 lab cwiczenia z podstaw pr Nieznany
11 Zastosowanie podstawowych procesów fizycznych
11 Zastosowanie podstawowych procesów fizycznych
Podstawowe parametry i cechy pr Nieznany
Podstawowe regulacje Kodeksu pr Nieznany
Pr dom nr 11 RPiS id 382112 Nieznany
11 Stereochemia i podstawowa nomenklatura sacharydów i polisacharydów
2013 01 15 ustawa o srodkach pr Nieznany
matematyka podstawowe wzory i Nieznany
11 Mozaryn T Aspekty trwalosci Nieznany (2)
11 Wytwarzanie specjalnych wyro Nieznany (2)
11 Wycinanie elementow obuwia z Nieznany (2)
KA Admin Publ i Sąd nst Podstawy pr pracy 2011 - 2012, Studia na KA w Krakowie, 4 semestr, Prawo pra
11 elektryczne zrodla swiatlaid Nieznany
więcej podobnych podstron