
I.1.Chemia spalania:
* Typy reakcji chemicznych
-jednocząsteczkowe (I-rzędu)
A→C+D (np.C
2
H
6
→CH
3
+CH
3
-dwucząsteczkowe (II-rzędu)
A+B→C+D (np.H+O
2
→OH+O)
-trójcząsteczkowe (III-rzędu)
A+B+M→C+M (np.H+O
2
+M→HO
2
+M)
* Skład reakcji chemicznych (reagenty)
-cząstki stabilne:O
2
, H
2
, N
2
,...
-cząstki wzbudzone:O
2
*,CO
2
*,N
2
*,...
-rodniki:O, H, N, C, OH, HO
2
,CH, CH
3
, C
2
H
5
,...
* Rodniki
Rodniki-są to wolne atomy i fragmenty o cząstek o nieparzystej liczbie elektronów lub dwóch elektronach
niesparowanych.
Stężenie rodników w płomieniu jest niewielkie: 10
-5
- 10
-12
mol/m
3
ale ich rola we wszystkich reakcjach jest bardzo
ważna poniewaz są bardzo reaktywne i niosą dużą energię.
* Skąd się biorą rodniki
a. Reakcje dysocjacji:
-dysocjacja termiczna: O
2
+M→O+O+M
-dysocjacja foto : NO
2
+vh→NO+O
b. Reakcje rozgałęziania:
H+O
2
→O+OH
O+H
2
→H+OH
* Szybkość reakcji-wpływ stężęń
I-rzędu (A→B+C) ,
dC
A
dt
=−
k∗C
A
II-rzędu (A+B→C+D) ,
dC
A
dt
=−
k∗C
A
C
B
III-rzędu (A+B+M→CD+M) ,
dC
A
dt
=−
k∗C
A
C
B
C
M
k-stała szybkość reakcji, C
A
-stężenie A [mol/m
3
]
* Szybkość reakcji-wpływ ciśnienia
Stężenie składnika C
A
określa się mol/m
3
,co jest proporcjonalne do gęstości (kg/m
3
), a gęstość z równania stanu gazu
jest proporcjonalna do ciśnienia p: ρ=pRT, więc szybkość rekcji zależy od ciśnienia i rzędu reakcji:
dC
A
dt
−
p
n
n-rząd reakcji.
* Szybkość reakcji-wpływ temperatury
Prawo Arrheniusa
k =k
0
∗
e
−
E
RT
k
0
-współczynnik przedeksponencjalny
E-energia aktywacji (J/mol)
T-temperatura (K)
R-uniwersalna stała gazowa (j/mol*K))
* Reakcje elementarne
Reakcje elementarne zachodza jako pojedyńcze akty między reagentami, np.: H+O
2
→O+OH
Są to przede wszystkim reakcje rodnikowe, jak wyżej. Rząd ich reakcji odpowiada liczbie składników w reakcji.
* Reakcje złożone
Reakcje złożone to zapis reakcji między stabilnymi substratami dającymi stabilne produkty, np.:
CH
4
+2O
2
→CO
2
+2H
2
O
Takiej reakcji nie ma, jest to tylko zapis związku substraty-produkty.
dC
A
dt
=−
k∗C
A
C
B
gdzie: α i β są współczynikami doświadczalnymi.
Naprawde rekacje złozone składają sie z wielu reakcji elementarnych (rodnikowych).
* Typy reakcji rodnikowych
1.Reakcje rozgałęzienia (rodników R): R+A→R
1
+R
2
2.Reakcje propagacji: R
1
+A→R
2
+B
3.Reakcje rekombinacji: R+A+M→AB+M

* Znaczenie trzeciego ciała w reakcji rekombinacji
Reakcje trójcząsteczkowe (rekombinacji): A+B+M→C+M
M-trzecie ciało (O
2
,N
2
,H
2
,H
2
O,...)pochłaniające energię przebudowy związku.
Np. H+O
2
+M→HO
2
+M , H+OH+M→H
2
O+M
* Mechanika spalania układu:H
2
+O
2
(strefa płomienia)
Znaczenie układu H
2
+O
2
: reakcje z tego układu występują w reakcjach wszystkich paliw kopalnych
H+O
2
→O+OH (r, rozgałęzienia)
O+H
2
→H+OH (r. rozgałęzienia)
OH+H
2
→H+H
2
O (r. propagacji)
H+O
2
+M→HO
2
+M (r. rekombinacji)
* Mechanika spalania układu:H
2
+O
2
(strefa popłomienna)
Rekombinacja rodników wynosi największy wkład do energii wewnętrznej spalin w strefie popłomiennej.
H+H+M→H
2
+M
H+OH+M→H
2
O+M Reakcje rekombinacji w strefie popłomiennej
OH+HO
2
+M→H
2
O+O
2
+M
* Mechanika spalania:utlenianie CO
Znaczenie CO wynika stąd, że CO jest półproduktem spalania wszystkich paliw kopalnych i utlenia się powoli.
W płomieniu CO utlenia się prawie wyłącznie w reakcji: CO+OH→CO
2
+H.
Dlatego dla utleniania CO w płomieniu potrzebna jest w układzie woda.
Dodatkowo występuje reakcja trójmolekularna: CO+O+M→CO
2
+M , ale ona ma marginalne znaczenie dla szybkości
spalania CO.
* Mechanika spalania:utlenianie węglowodorów
Znaczenie utleniania węglowodorów wynika z faktu, ze paliwa kopalne składają się z węglowodorów.
Utlenianie węglowodorów obejmuje złożone mechanizmy.
Generalnie można wyróżnić mechanizmy utleniania węglowodorów:
-niskotemperaturowy (zimne płomienie, silniki Diesla),
-wysokotemperaturowy (spalanie wysokotemperaturowe)
* Wysokotemperaturowe wtlenianie węglowodorów
W płomieniach ważny jest mechanizm wysokotemperaturowy utleniania węglowodorów (RH, R-rodnik).
Utlenianie węglowodorów zaczyna sie atakiem rodników:
RH+H→R+H
2
RH+OH→R+H
2
O
RH+O→R+OH
W dalszym ciągu następuje rozbicie rodników R na mniejsze rodniki, które w kolejnych reakcjach przekształcają się do
półproduktów spalania CHO i CO, utlenianych w końcu doCO i H
2
O.
* Utlenianie węglowodorów-liczba reakcji
Liczba reakcji elementarnych utleniania węglowodorów zależy od ich budowy i zawiera sie w zakresie od kilkuset do
kilkutysięcy.
* Termiczny mechanizm tworzenia NO
X
Mechanizm termiczny polega na tworzeniu NO
X
przez reagowanie O
2
i N
2
w powietrze wysokiej temperaturze.
Decydujące znaczenie ma reakcja dysocjacji tlenu: O
2
+M→O+O+M
Dostarcza ona rodników do ataku atomów O na cząstki N
2
: O+N
2
→NO+N , N+O
2
→NO+O.
W płomieniu dodatkowo należy uwzglednić jeszcze: OH+N→NO+H
2.Termochemia spalania:
* I zasada termodynamiki
dQ=dH-Vdp
W przemianach izobarycznych: dp=0
dQ=dH , dH=c
p
dT →dQ=c
p
dT , Q=∫c
p
(T)dT
gdzie: Q-ciepło , H-entalpia właściwa, V-objętość, P-ciśnienie
* Efekt cieplny spalania
Efekt cieplny spalania jest wynikiem wyzwalania ciepła reakcji utleniania paliwa.
1.Ważnym składnikiem energii wewnętrznej ciała jest jego energia chemiczna wynikająca z budowy chemicznej.
2.Zmiana tej budowy chemicznej ciała wiąże się ze zmianą tej części energii wewnętrznej.
* Energia tworzenia związku
Każda substancja chemiczna ma swą indywidualną energię chemiczną, która może być określona jako ciepło jej
syntezy. Wytaża się je jako:
-entalpia tworzenia, ∆h
tw
[J/mol]
W celu ułatwienia porównania entalpii tworzenia związków określa sie je w warunkach standardowych: p=0,1 MPa,
T=298 K przyjmując oznaczenia: ∆h
tw,st
.
Wartośi entalpii tworzennia ∆h
tw,st
związków chemicznych podane są w tablicach chemicznych.
* Ciepło reakcji
Znajomość ciepła (entalpii) tworzenia związków pozwala obliczyć ciepło reakcji ∆h
r
tw,st
zapisanej ogólnie:
∑
i
v
i
A
i
=0 (v
i
-współczynniki stechiometryczne) jako sumę entalpii tworzenia reagentów ∆h
i
tw,st
:

∆h
r
tw,st
=∑
i
v
i
∆h
i
tw,st
, gdzie v
i
przyjmuje się v
i
>0 dla substratów i v
i
<0 dla produktów, a indeks st odnosi się do
warunków standardowych.
* Efekty cieplne reakcji-typy reakcji chemicznych
Typy reakcji chemicznych:
-egzotermiczne
-endotermiczne
Przykłady (utlenianie węgla)
C+O
2
=CO
2
-393,5 kJ/mol -egzoter
C+0,5 O
2
=CO-110,5 kJ/mol -egzoter
C+CO
2
=2CO+172,5 kJ/mol -endoter
* Eekt cieplny reakcji-prawo Hessa
Efekt cieplny reakcji zależy tylko od stanu początkowego i końcowego układu reagującego, a nie zależy od drogi
przemian.
* Ciepło spalania i wartość opałowa
Wartość energetyczną danego paliwa określa się dwoma parametrami:
-ciepło spalania: Q
S
[J/kg]
-wartość opałowa: Q
i
[J/kg]
Obie wartości są sciśle zdefiniowane, możliwe do obliczenia na podstawie składu chemicznego lub do wyznaczenia
doswiadczalnie.
Ciepła spalania i wartości opałowe typowych paliw są podane w tablicach cieplnych.
* Ciepło spalania
Ciepło spalania jest wynikiem zmiany energii wewnętrznej substratów biorących udział w procesie spalania.
W pewne związki znikają, a na ich miejsce powstają nowe związki. Zmienia się wiec energia chemiaczna układu.
Entalpia tworzenia, ∆h
tw,
[J/mol]
Przyjmiemy warunki standardowe: p=0,1 MPa, T=298 K
Stąd: ∆h
tw,st
* Standardowe ciepło spalania Qs,st (definicja)
Q
S,St
=∆h
tw,st
(pp)-∆h
tw,st
(sp) , gdzie pp-powietrze i paliwo, sp-spaliny
W praktyce indeks "st" opuszcza sie przyjmując, ze ciepło spalania wyznaczane jest w warunkach standardowych.
* Standardowa wartość opałowa Q
a
is,t
(definicja)
Q
a
i,st
=Q
a
s,st
-r*(W
a
+8,94 H
a
)
r-ciepło parowania wody w temp.25◦C odpowiadające 1% wody w paliwie [J/g], r=24,42 [J/g],
W
a
=zawartości wilgoci w próbce analitycznej paliwa [%], H
a
-udział wodoru w próbce analitycznej paliwa [%]
(8,94-przelicznik na wodę)
* Wartość opałowa a ciepło spalania
Różnica między ciepłem spalania Q
S
i wartością opałową Q
i
polega na tym, podczas wyznaczania Q
S
woda w
spalaniach jest w postaci ciekłej, a podczas wyznaczania Q
i
w postaci pary. Zatem różnią się one ciepłem parowania
wody w spalinach. Q
S
> Q
i
Ciepło spalania jest większe od wartości opałowej!
* Entalpie tworzenia typowych reagentów w reakcji spalania:pierwiastki
Przyjęte zostało, że entalpie tworzenia pierwiastków są równe zero, np.:
azot cząsteczkowy N
2
-∆h
tw,st
=0
tlen cząsteczkowy O
2
-∆ht
w,st
=0
wodór cząsteczkowy H
2
-∆h
tw,st
=0
* Entalpie tworzenia typowych reagentów w reakcji spalania:rodniki i inne reagenty
Rodniki, np:
Atom wodoru H:217,99 [kJ/mol]
Atom tlenu O:249,19 [kJ/mol]
Woda, np:
Woda (ciecz) H
2
O: -285,83 [kJ/mol]
Woda (para) H
2
O: -241,81 [kJ/mol]
Tlenek węgla CO: -110,52 [kJ/mol]
* Efekt cieplny spalania-spalanie reagenty
Utlenianie metanu:
I) CH
4
+3/2 O
2
→CO+2 H
2
O+Q
1
-spalanie niezupełne
II) CH
4
+2 O
2
→CO
2
+2 H
2
O+Q
2
-spalanie zupełne
Q
2
>Q
1
CO+ 1/2 O
2
→CO
2
+Q
3
: Q
1
+Q
3
=Q
2
* Wyznaczanie wartosci opałowej z wzorów przybliżonych
Q
i
=4,187 [81C+246 H + -26(O-S)-6W] kJ/kg
C, H, O, S, W - udziały masowe pierwiastków w paliwie (w procentach)
* Wymienność gazów i liczba Wobbego
Gazy są wymienne względem siebie, jeżeli spalają się prawidłowo w tych samych palnikach bez potrzeby ich
przystosowania.

Warunek wymienności gazów: dwa gazy są wymienne, jeżeli przy tym samym nadciśnieniu zasilania (∆p) moc cieplna
aparatu gazowego N będzie taka sama: N
1
=N
2
.
Warunek wymienności gazów określa liczba Wobbego.
Liczba Wobbego W
b
:
W
b
=
Q
S
d
V
0,5
Gęstość względna:
d
V
=
gazu
powietrza
3.Stechiometria spalania-spalania:
* Mole i kilomole
Masa atomowa pierwiastka-to średnia wyrażona mas wszystkich jego naturalnych izotopów w stosunku do:
1
12
=
12
6
C
1,66∗10
−
27
kg
Liczba Aogadra : 6,0222*10
23
atomów
Jeden mol jest to masa 6,0222*10
23
(l. Avogadra) atomów danego pierwiastka lub cząsteczek związku.
Objętość molowa (g. doskonały) 22,414 l/mol
Kmol: 10
3
moli
Masa molowa-jest to ilość substancji wyrażonej w gramach odpowiadającej liczbowo masie atomowej (cząsteczkowej)
tej substancji.
* Reakcje chemiczne
A+2B→C
1mol+2mole→1mol
A, B i C są to reagenty.A i B są substratami, C jest produktem.
Współczynniki wystepujące przed symbolami reagentów to: współczynniki stechiometryczne.
Ze związków miedzy współczynnikami stechiometrycznymi wynika stechiometria spalania i inne pochodne pojęcia.
* Stechiometria spalania
Paliwa kopalne to przede wszystkim związki węgla i wodoru (C
m
H
n
). Reakcje ich utleniania mozna zapisać równaniem
stechiometrycznym:
C
m
H
n
m
n
4
O
2
mCO
2
n
2
H
2
O
1 molm
n
4
moli m
n
2
moli
Jest to równanie stechiometrii spalania:
Na jeden mol paliwa przypada dokładnie
m
n
4
moli tlenu
* Skład mieszanki palnej
Mówi się, że skład mieszanki jest stechiometryczny, jeżeli udzieły paliwa i utleniacza wynikają z równania
stechiometrii.
W wyniku zupełnego spalania mieszanki o składzie stechiometrycznym w spalinach nie może być: ani paliwa, ani
tlenu.
* Rodzaje mieszankek palnych:
-bogata
-stechiometryczna
-uboga
* Przykład:spalanie metanu w powietrzu-spalanie stechiometryczne
Powietrze: 79% N
2
+ 21% O
2
CH
4
2 O
2
7,52 N
2
CO
2
2 H
2
O7,52 N
2
Uwaga: w spalinach nie ma metanu, ani tlenu.
Calkowita liczba moli spalin N równa sie:
N =1 mol CO
2
2 mole H
2
O7,52 mola N
2
=
10,52 mole
Udziały molowe składników spalin, wg analizy mokrej (woda w postaci pary) przedstawiają się następująco:
[
CO
2
]=
1 mol CO
2
10,52
=
9,5 %CO
2
obj.
[
H
2
O]=
2 mole H
2
O
10,52
=
19 H
2
O obj.
[
N
2
]=
7,52 mola N
2
10,52
=
71,5 N
2
obj.
* Przykład:spalanie metanu w powietrzu-spalanie z nadmiarem powietrza
Założenie: nadmiar powietrza :5%
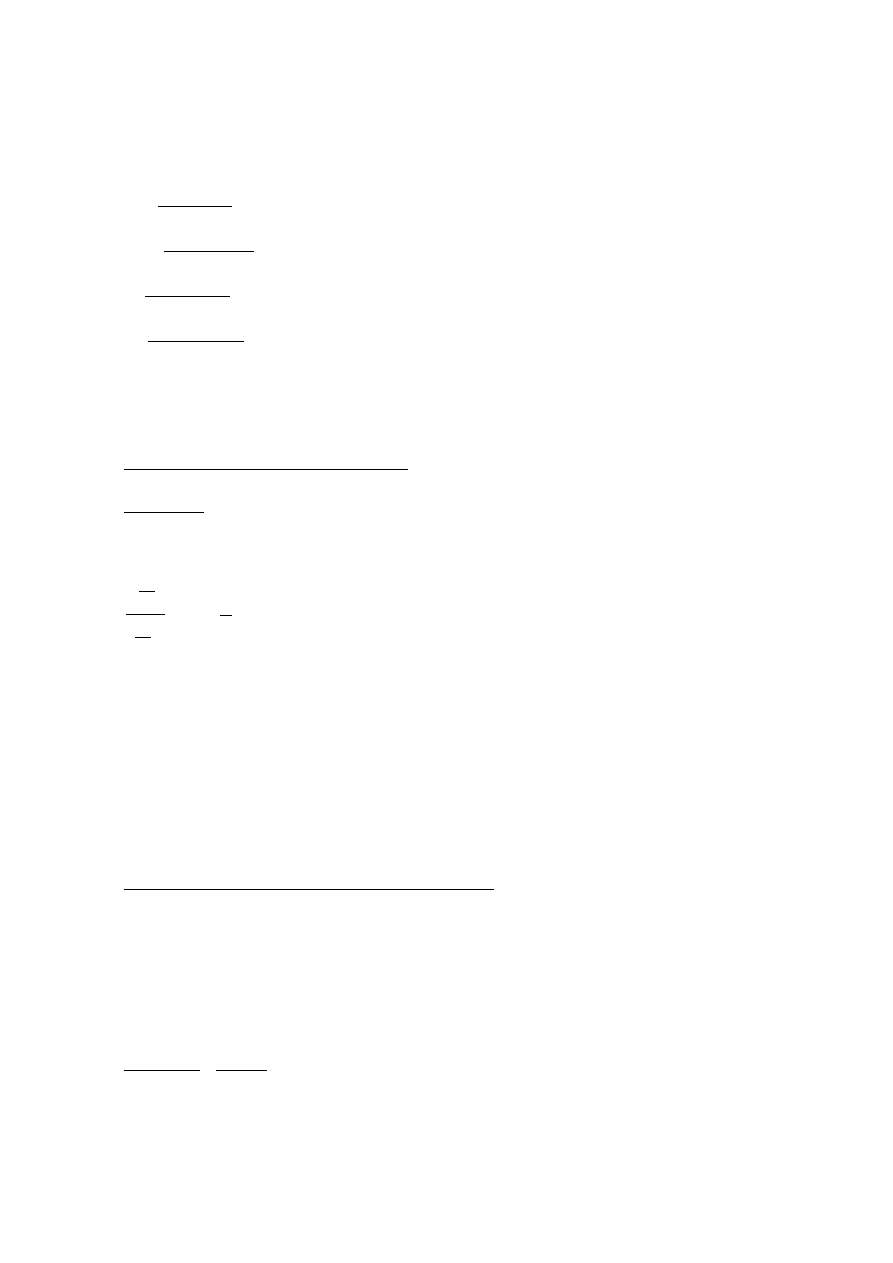
CH
4
2,1 O
2
7,9 N
2
CO
2
2 H
2
O7,9 N
2
0,1 O
2
Uwaga: w spalinach jest tlen.
Całkowita liczba moli spalin N równa się:
N =1 mol CO
2
2 mole H
2
O7,9 mola N
2
0,1 mola O
2
=
11 moli
Udziały molowe składników spalin, wg analizy mokrej (woda w postaci pary) przedstawiają się następująco:
[
CO
2
]=
1 mol CO
2
11
=
9,09 %CO
2
obj.
[
H
2
O]=
2 mole H
2
O
11
=
18,2 % H
2
O obj.
[
O
2
]=
0,1 mola O
2
11
=
0,91 %O
2
obj.
[
N
2
]=
7,52 mola N
2
10,52
=
71,82 % N
2
obj.
* Zapotrzebowanie powietrza spalania
Teoretyczne zapotrzebowanie powietrza do spalania oznacza ilośc powietrza przypadajacego na jednostkę paliwa w
stechiometrycznej mieszanki palnej. Dla paliw gazowych określa się je w m
3
/m
3
w warunkach normalnych.
Przeczywiste zapotrzebowanie powietrza do spalania zależy od założonego nadmiaru powietrza.
* Współczynnik nadmiaru powietrza (λ)
=
całkowita ilość powietrza do spalania
teoretyczna ilość powietrza do spalania
=
20,9
20,9−[O
2
]
* Współczynnik ekwiwalencji (FUEL RATIO)
W literaturze anglojęzycznej częsciej niż współczynnikiem nadmiaru powietrza λ posługuje się współczynnikiem ϕ.
=
F
A
F
A
S
=
1
F-ilość moli paliwa, A-ilość moli powietrza, s-stechiometryczny
* AIR/FUEL RATIO (AFR) i FUEL/AIR RATIO (FAR)
Ze wzgledu na łatwość wyznaczania w praktyce zastosowanie ma stosunek strumienia powietrza do paliwa określany
jako AFR (Air/Fuel Ratio) AFR= F/A
A-strumień powietrza (A-air) [kg/s], F-strumień paliwa (F-fuel) [kg/s]
Podobnie definiuje się FAR (Fuel/Air Ratio).
* Współczynnik nadmiaru powietrza a rodzaj płomienia
Rodzaj płomienia (lub skład mieszanki):
-bogaty: λ<1, ϕ>1
-stechiometryczny: λ=1, ϕ=1
-ubogi: λ>1, ϕ<1
* Nadmiar płomienia (n)
n=
całkowita−teoretyczna ilość powietrza do spalania
teoretyczna ilość powietrza do spalania
Związek współczynnika nadmiaru pow. i nadmiaru powietrza
n=(λ-1)*100%
* Przykład
Teoretyczne zapotrzebowanie powietrza do spalenia CH
4
wynosi 9,52 m
3
/m
3
.
Przyjmując:
-strumień metanu V=10 m
3
/h
-strumień powietrza V=114,62 m
3
/h
otrzymuje się:
=
114,62
10∗9,52
=
114,62
95,2
=
1,2
n=(1,2 -1,0)*100%=20%

4.Temperatura spalania:
* Definicje temperatury spalania
Temperatura kalorymetryczna spalania:
Ts,a – najwyższa temperatura jaka osiągają niezdysocjowane spaliny w wyniku
adiabatycznego i izobarycznego spalania paliwa z teoretyczna ilością powietrza.
Temperatura teoretyczna spalania
: Ts,t - najwyższa temperatura jaka osiągają zdysocjowane spaliny w wyniku
adiabatycznego i izobarycznego spalania paliwa z nadmiarem powietrza.
Temperatura rzeczywista spalania:
Ts - może być bardzo różna, zależna od strat ciepła w procesie spalania.
* Temperatura spalania-temperatura spalin
* Temperatura teoretyczna spalania
Temperaturę teoretyczną spalania
Ts
pod stałym ciśnieniem oblicza się z bilansu entalpii substratów (paliwa i
powietrza) i produktów (spalin).
m
pp
h
tw , st
pal
∫
Tst
Tpal
c
p
pal dT m
pow
∫
Tst
Tpow
c
p
pal dT =m
sp
h
tw , st
sp
∫
Tst
Ts
c
p
sp dT
gdzie: h
tw,st
– entalpia tworzenia (paliwa i spalin)
m
pp
– strumień masy paliwa, mpow – strumień masy powietrza,
m
sp
– strumień masy spalin
W szczelnym palenisku (komorze spalania): m
sp
= m
pp
+ m
pow
* Obliczanie temperatury teoretycznej spalania
Korzystając z wielomianowej postaci zależności c
p
= c
p
(T), np. c
p
= a
1
+ a
2
T + a
3
T
2
+a
4
T
-2
otrzymuje się po scałkowaniu:⅓ a
3
T
s
4
+ ½a
2
T
s
3
+ a
1
T
s
2
+ f
∗
T
s
– a
4
= 0
Równanie to rozwiązuje się ze względu na temperaturę Ts.
* Uproszczone obliczanie temperatury teoretycznej spalania
Jeśli przyjąć, że temperatura wlotowa paliwa T
pal
i powietrza T
pow
są równe temperaturze otoczenia T
st
= 25 ºC, to
równanie bilansu entalpii (1) przyjmie postać:
m
pp
h
tw ,st
pal −m
spal
h
tw , st
sp=m
spal
∫
Tst
Ts
c
p
sp dT
ale:
m
pp
h
tw ,st
pal −m
spal
h
tw , st
sp=m
pp
Q
i
czyli:
m
pp
Q
i
=
m
spal
∫
Tst
Ts
c
p
sp dT
Uwaga: przyjęto Q
i
a nie Q
s
, ponieważ woda w spalinach jest w postaci pary.
* Bardzo uproszczone obliczanie temperatury teoretycznej spalania
Przyjmując średnie ciepła właściwe: c
p
(pal) = c
p
(pow) = c
p
(sp) oraz T
pal
= T
pow
= T
ot
otrzymuje się równanie: (T
s
– T
ot
)
∗
c
p
(sp)
∗
m
sp
= Q
i
∗
m
pal
gdzie Q
i
jest wartością opałową, ponieważ w płomieniu woda jest pod postacią pary.
stąd: T
s
= T
ot
+ (Q
i
∗
m
pal
)/(m
s
∗
c
p
(sp))
lub: T
s
= T
ot
+ Q
i
/[(1+λm
pow,t
)
∗
c
p
(sp)]
Błąd popełniany przy tym oszacowaniu T
s
to: 10-20%.
* Rzeczywista temperatura spalania
Rzeczywista temperatura spalania jest niższa od kalorymetrycznej temperatury spalania na skutek: strat cieplnych od
płomienia niezupełnego spalania (dysocjacja), niecałkowitego spalania.
* Temperatura spalania w zależności od typu paliwa
Straty cieplne płomienia wynikają głównie z promieniowania. Dlatego odchylenie od temperatury kalorymetrycznej
spalania zależy od zdolności emisyjnej płomienia:
Odchylenia temperatury od T
s.t
-płomienie gazowe: 30-50°,
-płomienie olejowe: 200-300°,
-płomienie pyłowe: 500-600°.
II.1.Paliwa
*Paliwa-definicja
Paliwa-to substancje chemiczne lub ich mieszaniny, które łatwo spalają się z udziałem powietrza, a produktem ich
spalania są przede wszystkim gazy.
*Paliwa-podział :
-ze względu na stan skupienia:gazowe,ciekłe i stałe;
-ze względu na pochodzenie:naturalne i sztuczne;
-ze wzgledu na wartość opałową: nisko i wyskokokaloryczne.
*Paliwa kopalne
Paliwa kopalne wydobywa się z ziemi,ich praźródłem jest energia słoneczna.
Są to:
-węgiel;
-ropa naftowa;
-gaz ziemny.

*Inne rodzaje paliw:
-paliwa odpadowe:
~z odpadów (PAKOM);
~produkty uboczne przeróbki paliw (muły, koks rafineryjny);
-biomasa i biopaliwa.
2.Paliwa gazowe
*Paliwa gazowe-podstawy klasyfikacji
Ze względu na pochodzenie:
-naturalne (gaz ziemny, gaz kopalniany, gazy płynne),
-sztuczny (gaz miejski, koksowniczy, produkt zgazowania węgla, wodór).
Ze względu na wartość energetyczna:
-wysokokaloryczne
- niskokaloryczne.
*Klasyfikacja paliw gazowych:normy i parametry klasyfikacyjne
Normy Polskie
• PN-C-04750:2002 Paliwa gazowe
• PN-C- 04753:2002 Wymagania dla gazu ziemnego
Parametry klasyfikacyjne
• Ciepło spalania, J/m3
• Górna liczba Wobbego Ws, J/m3
• Zawartość głównych składników
*Gęstość względna i liczba Wobbego gazu palnego
Gęstość względna dV
d
V
=
gazu
powietrza
Górna (dolna) liczba Wobbego W
S
(W
i
)
(W
s
= Q
s
d
v
–0,5)
(W
i
= Q
i
d
v
–0,5)
*Gazy płynne skroplone
Gazy płynne to mieszaniny węglowodorów (C
3
-C
4
) będące ubocznym produktem procesów rafineryjnych ropy
naftowej.
LPG – Liquid Petroleum Gas
Główne składniki LPG:
- propan ( C
3
H
8
)
- butan (i izobutan) (C
4
H
10
)
2a.Gaz ziemny
*Ważniejsze składniki gazu ziemnego
Gaz ziemny występuje w części skorupy Ziemi: w litosferze.
Jego pochodzenie jest organiczne.
•Palne składniki gazu ziemnego to głównie:
metan (CH
4
) i jego homologi C
3
-C
7
.
•Niepalne składniki gazu ziemnego to:
azot,CO
2
, woda, ...
*Występowanie gazu ziemnego
Gaz ziemny występuje:
-lub towarzyszy ropie naftowej
-oddzielnie.
Gaz ziemny może występować:
- swobodnie,
- rozpuszczony w ropie naftowej,
- w wodzie,
-w skałach (w węglu – metan kopalniany).
*stosowanie akronimy dla gazu ziemnego:
-Gaz ziemny: NG (natural gas)
-Gaz ziemny sieciowy: E, L
-Gaz ziemny sprężony: CNG (Compressed Natural Gas)
-Skroplony gaz ziemny: LNG (Liquid Natural Gas)
-Niskokaloryczny gaz ziemny : LCNG (Low caloric natural gas)
*Metan pokładów węgla MPW
W niektórych złożach węgla kamiennego w węglu jest zaabsorbowany pod dużym ciśnieniem metan (kopalniany).
Udział metanu w węglu, zależny od gazowości złoża, jest w zakresie 0-200 m3/Mg węgla. MPW zawiera średnio 96%
metanu, 3% azotu i 1% innych składników. Uzyskiwany w procesie odmentanowania złoża węglowego gaz kopalniany
nazywa się też metanem kopalnianym. Podczas wydobywania węgla ciśnienie w złożu ulega zmniejszeniu, co sprzyja
uwalnianiu gazu. Odprowadzany z odwiertu stalowymi sączkami metan MPW może mieć znaczny udział powietrza
.

*Hydraty (wodziany)
Hydraty (wodziany) to krystaliczne złożone kompleksy molekuł powstałe w wyniku fizycznej kombinacji wody i
gazów. Najbardziej rozpowszechnione są w przyrodzie hydraty metanowe. Moją one postać lodu, dopiero po ogrzaniu
wydziela się gaz. Udział metanu w hydracie jest wysoki: 164 m
3
CH
4
/m
3
hydratu. Złoża hydratów znajdują się na
stokach oceanicznych i w lądowych regionach wiecznej zmarzliny. Oszacuje się, że ich zasoby w świecie są ogromne,
niektórzy oceniają je na 10
16
m
3
metanu (dla porównania zasoby gazu ziemnego w świecie ocenia się na ponad 3*
10
14
m
3
). Ze względu na warunki klimatyczne raz geologiczne pozyskiwanie metanu z hydratów jest nieopłacalne
obecnie.
*Hydraty-przykłady: CH
4
·6H
2
O, C
2
H
6
·7H
2
O
2b.Gazy sztuczne
*Gaz miejski
Gaz miejski (wytlewny lub świetlny) otrzymuje się w warunkach nisko- i średniotemperaturowego wytlewania węgla.
Przykładowy skład gazu miejskiego: 55% H2, 25% CH4, 8% CO, 7% N2 i O2
Wartość opałowa gazu miejskiego: ~17,5 MJ/m3
*Gaz koksowniczy
Gaz koksowniczy otrzymuje się metodą wysokotemperaturowego odgazowania węgla.
Skład i właściwości:
zbliżone do składu i właściwości gazu miejskiego
Gaz z procesów wielkopiecowych ma również podobne właściwości.
*Wodór
Wodór - paliwo przyszłości:
-„proekologiczny” charakter,
- duża wartość opałowa,
- nadaje się do ogniw paliwowych.
Wodór otrzymuje się na skalę przemysłową z metanu (ściślej z gazu ziemnego) w procesie reformingu. który polega na
oddziaływaniu na gaz ziemny parą wodną w obecności katalizatora niklowego.
*Ważniejsze elementy gazu palnego
a. Skład gazu
b. Ciepło spalania Qs i wartość opałowa Qi, MJ/m
3
c. Gęstość ρ, kg/m
3
i gęstość względna d
V
d. Liczba Wobbego W (Ws – górna, Wi - dolna)
e. Temperatura punktu rosy i wilgoć
f. Granice stężeniowe wybuchu, %
g. Zapotrzebowanie powietrza do spalania
h. Liczba oktanowa LO.
*Liczba oktanowa LO
Liczba oktanowa LO- jest miarą odporności paliwa na spalanie stukowe.
LO określa się przez porównanie spalania danego paliwa w badawczym silniku tłokowym o zapłonie iskrowym ze
spalaniem paliwa wzorcowego.
Paliwo wzorcowe: mieszanina izooktanu i n-heptanu. Izooktan ma LO = 100, a n-heptan ma LO = 0. LO mieszaniny
jest równe udziałowi objętościowemu izooktanu.
*Zalety gazu jako paliwa:
– wysoka sprawność energetyczna wykorzystania gazu,
– nie wymagają magazynowania u użytkownika,
– zapewnienie stałości ciepła i temperatury spalania,
– płomień gazowy można łatwo regulować,
– łatwość automatyki palenisk i kotłów gazowych,
– konstrukcja pieców gazowych jest stosunkowo prosta,
– spalają się bezdymnie i nie tworzą popiołu, nie wydzielają SO
2
, pozwalają łatwo kontrolować emisję NO
X
,
– mała emisja CO
2
w porównaniu do węgla.
*Zastosowanie gazu ziemnego:
W hutnictwie:
– w piecach grzewczych i w piecach walcowniczych,
– w piecach kuziennych i do obróbki cieplnej.
W przemyśle materiałów budowlanych do produkcji:
– szkła, cementu i ceramiki budowlanej.
W energetyce:
– w tłokowych silnikach spalinowych i w turbinach gazowych,
– w ogniwach paliwowych i w generatorach MHD.
W technologii chemicznej: do wytwarzania gazu syntezowego, który służy do produkcji (w skali świata):
– amoniaku (90 mld Mg/rok),
– metanolu (20 mld Mg/rok),
– wodoru (200 mld m
3
/rok),

*Zasoby światowe, rezerwy i zużycie gazu ziemnego:
Rezerwy gazu ziemnego: 146 000 mld m
3
.
Zasoby gazu ziemnego: 338 000 mld m
3
.
Geografia rozkładu rezerw GZ w świecie (w mld m
3
):
Rosja, Europa Wsch. – 56 738,
Azja Środk.-Wsch. – 44 809,
Afryka – 9 785,
Azja i Oceania – 13 328,
Płn. Ameryka – 7 306,
Płd. Ameryka – 7 763,
Europa Zach. – 8 295.
Światowe roczne zużycie: 2606 mld m
3
Wskaźnik wystarczalności (w stosunku do rezerw): 63 lata
*Zasoby, rezerwy i zużycie gazu ziemnego w Polsce:
Rezerwy i zasoby
Rezerwy gazu ziemnego: 153 mld m
3
.
Zasoby perspektywiczne: 606 mld m
3
.
(Zasoby geologiczne gazu ziemnego pod dnem Bałtyku: 7 mld m
3
z uwzględnieniem gazu rozpuszczonego w r.n. - 10
mld m
3
)
Roczne zużycie gazu ziemnego w Polsce (2005):
• gazu ziemnego wysokometanowego: ok. 12,8 mld m
3
• gazu ziemnego zaazotownego: ok. 3,5 mld m
3
Struktura zużycia
• sektor komunalny: 57%
• sektor przemysłowy: 43%.
*Źródła zaopatrzenia gazu ziemnego:
•Roczne zużycie gazu w Polsce wynosi 13,5 mld m
3
(2007 r.)
•1/3 - zapotrzebowania z krajowego wydobycia
•2/3 - zapotrzebowania z importu
•Większość surowca otrzymujemy z Ukrainy, przez przejście w Drozdowiczach.
•Ok. 2,8 mld m
3
wpływa przez gazociąg jamalski.
•Gaz dociera do Polski również z terenu Białorusi
•oraz przez przejście w Zgorzelcu na zachodzie kraju.
•W podziemnych magazynach jest prawie 2 mld m
3
.
*Wydobycie i import gazu ziemnego w Polsce:
Roczne wydobycie gazu ziemnego w Polsce (2005):
• gazu ziemnego wysokometanowego: ok. 2,2 mld m
3
• gazu ziemnego zaazotowanego: ok. 3,5 mld m
3
• metanu pokładów węgla: ok. 0,35 mld m
3
Import gazu ziemnego: ok. 9,9 mld m
3
*Kopalnie gazu ziemnego i koncesje w Polsce
PGNiG ekspolatuje 56 złóż gazu ziemnego, udostępnionych 392 odwiertami. Dotychczas PGNiG wydobyto ponad 83
mld metrów sześciennych gazu, a do wydobycia pozostało około 60 mld m
3
gazu ze złóż zagospodarowanych.
*Ceny gazu w Europie
Ceny gazu Polska-dla Odbiorców indywidualnych gazu ziemnego wysokometanowego (grupy E)
- grupy taryfoweo symbolu E 1,14 zł m sz.
3.Paliwa ciekłe
*podział paliw ciekłych:
-naturalne-(ropa naftowa i jej pochodne, oleje łupkowe, smoła łupkowa);
-sztuczne-(alkohole, paliwa z upłynniania węgla, oleje roślinne).
*Inne surowce do wytwarzania paliw ciekłych
Surowcem do wytwarzania paliw ciekłych są także:
-łupki olejowe
-łupki smołowe
-piaski olejowe
*Ropa naftowa
Ropa naftowa-jest jedynym naturalnym paliwem ciekłym.
Ponad połowa złóż ropy naftowej pochodzi z trzeciorzędu (sprzed 1-60 mln lat).
Ropa naftowa to mieszanina 3000 węglowodorów.
Początki eksploatacji ropy naftowej łączą się z nazwiskiem Łukasiewicz (1853).
*Skład ropy naftowej:
-frakcyjny (udział różnych frakcji różniących się temperaturą wrzenia);
-chemiczny (udział poszczególnych grup węglowodorów);

-elementarny (udział poszczególnych pierwiastków).
*Destylacja ropy naftowej
Frakcje ropy naftowej:
-lekka benzyna: 313-433K;
-ciężka benzyna (ligroina): 430-473K;
-nafta: 473-590K;
-olej napędowy: 590-633K;
-lekki destylat próżniowy: 633-813K;
-ciężki destylat próżniowy: powyżej 813K.
*Skład chemiczny ropy naftowej
– węglowodory parafinowe są to węglowodoryry nasycone (C
n
H
2n+2
) występujące we wszystkich frakcjach ropy
naftowej,
– węglowodory naftenowe są to nasycone węglowodory cykliczne (C
n
H
2n
) o pierścieniowym układzie atomów węgla i
wodoru, występują w dużych ilościach w olejach ciżkich,
– węglowodory aromatyczne – z tej grupy węglowodorów w ropie występują głównie benzen, naftalen, fenantren i
antracen oraz ich homologi,
– węglowodory olefinowe występują w niewielkich ilościach w ropie naftowej, spotykane są raczej w produktach
przeróbki ropy, są to pentan, oktan itd.,
– związki heteroorganiczne - siarki (merkaptany, siarczki dwusiarczki i inne), azotu (głównie pirydyna i jej pochodne
oraz aminy), tlenu (kwasy karboksylowe i ich estry, fenole, alkohole, ketony), a ponadto aminokwasy, tiazole i inne.
*Skład elementarny ropy naftowej:
Jest pięć podstawowych pierwiastków w ropie naftowej:
-węgiel 83-87%;
-wodór 12-14%;
-siarka 0,01-8%;
-azot 0,01-1,2%
-tlen 0,05-4%
Inne pierwiastki w ropie jak wanad, nikiel, żelazo, mangan, kobalt, fosfor oraz mikroelementy występują w stężeniu
rzędu wartości 10
-3
-10
-5
%.
*Klasyfikacja ropy naftowej:
Nie ma jednolitej klasyfikacji gatunków ropy naftowej.
Najprostsze systemy klasyfikacyjne opieraj się na łatwo mierzalnych właściwościach ropy:
-gęstość,
-zawartość siarki,
-zawartość substancji żywiczno-asfaltenowych,
-zawartość parafiny oraz frakcji „lekkich”.
*Przykłady systemów klasyfikacji ropy naftowej:
a) ze względu na zawartość siarki ropę dzielimy na:
niskosiarkową (S < 0,5%), siarkową (S = 0,5–2%) i wysokosiarkową (S > 2%),
b) ze względu na gęstość wyróżnia się ropę :
-lekką (ρ < 0,87 kg/m
3
),
-średną (ρ = 0,87–0,91 kg/m
3
),
-ciężką (ρ > 0,91 kg/m
3
),
c) ze względu na zawartość parafiny ropę dzieli się na:
- niskoparafinową zaw. parafiny < 5%),
-parafinową (zaw. parafiny 5–10 %)
-wysokoparafinową (zaw. parafiny >10%).
3a. Klasyfikacja ropy naftowej:
*Klasa ropy:
-parafinowa-zawartość węglowodorów parafinowych 75%;
-naftenowa-zawartość węglowodorów ponad 70%;
-aromatyczna-zawartość węglowodorów aromatycznych ponad 50%,
-asfaltowa-zawartość żywic i asfaltów ponad 60%;
-parafinowo-naftenowa-zawartość węglowodorów parafinowych 60-70% i węglowodorów naftenowych ponad 20%;
-parafinowo-naftenowo-aromatyczna-zawartość węglowodorów parafinowych, naftenowych i aromatycznych w
przybliżeniu jednakowe;
-naftenowo-aromatyczna-zawartość węglowodorów naftenowych lub aromatycznych ponad 35%;
-naftenowo-aromatyczno-asfaltowa-zawartość węglowodorów naftenowych, aromatycznych lub związków żywiczno-
asfaltowych ponad 25%;
-aromatyczna-asfaltowa-zawartość węglowodorów aromatycznych lub związków żywiczo-asfaltowych ponad 35%.
*Produkty naftowe:
-gaz płynny;
-paliwa silnikowe (benzyny, oleje napędowe, paliwa odrzutowe, nafta);

-oleje opałowe;
-stałe węglowodory naftowe (parafiny, cerezyny, wazeliny);
-asfalty drogowe i przemysłowe;
-surowce węglowodorowe do syntez organicznych.
*Procesy przeróbki ropy naftowej:
-destylacja;
-kraking katalityczny;
-reforming katalityczny;
-hydrokraking;
-piroliza;
-hydrorafinacja.
*Paliwa ciekłe z ropy naftowej:
Zastosowanie:
a)benzyna:
-lotnicza-(42900-46500 kJ/kg)-do tłokowych silników spalinowych z zapłonem iskrowym w lotnictwie;
-samochodowa-(42900-46500 kJ/kg)-do tłokowych silników spalinowych z zapłonem iskrowym w motoryzacji oraz w
innych maszynah i urządzeniach;
-traktorowa-(43500-45250 kJ/kg)-do tłokowych silników spalinowych z zapłonem isktowym w traktorach i innych
maszynach rolniczych;
b)nafta:
-lotnicza-(42400-45700 kJ/kg)-do turbinowych silników spalinowych w lotnictwie;
c)oleje:
-napedowe-(41800-42750 kJ/kg)-do tłokowych silników z zapłonem samoczynnym w motoryzacji oraz energetycznych
turbinach gazowych;
-opałowe-(39400-39800 kJ/kg)-do palników olejowych w urządzeniach grzewczych, energetycznych i przemyslowych.
*Oleje opałowe
Oleje opałowe-to pozostałość po destylacji ropy naftowej lub mieszaniny ropy z frakcjami olejowymi lub frakcje
olejowe otrzymywane przez destylacje ropy naftowej.
Według PN-C-96024:2001 dzieli się je na dwie grupy, oleje opałowe:
-lekkie;
-ciężkie.
*Ciężkie oleje opałowe C-3:
-mazut-pozostałość po atmosfertcznej destylacji r.n.;
-gudron-pozostałość po próżniowej destylacji r.n.
Ciężkie oleje opalowe (3) mają dużą lepkość, co powoduje, że do transportu i rozpylania wymagają podgrzania do
temperatury co najmniej w zakresie 65-90 ͦC.
*Jednostki lepkości:
-podstawowa: m
2
/s
-pochodna: cSt mm
2
/s , 1cSt=10
-6
m
2
/s.
*Przykład parametrów mazutu przy zamówieniu w elektrowni (kocioł OP-650):
-dolna wartość opałowa: 39380 kJ/kg;
-minimalna temp.zapłonu: 438 K (165ͦ C);
-maksymalna temp.krzepnięcia: 303 K (30ͦ C);
-lepkość w temp.353 K (30 ͦ C):110 cSt;
-maksymalna temp.podgrzania oleju: 363-398 K (90-125ͦ C);
-maksymalna zawartość siarki: 3%;
-maksymalna pozostałość po spalaniu:0,3%;
-maksymalna zawartość wody: 1,5%;
-maksymalna zawartość ciał stałych: 5,5%.
3b. Sztuczne paliwa ciekłe
*Olej opałowy ze smoły
Oleje opałowe otrzymuje się z :
-surowej smoły koksowniczej;
-gazowniczej, generatorowej;
-wytlewnej z węgla kamięnnego.
Smoła koksownicza powstaje w procesie koksowania węgla w bateriach koksowniczych w temp. do 1000ͦ C, uzyskuje
sie ją przez oczyszczanie gazu koksowniczego.
Olej opałowy uzyskuje się jako jedną z frakcji destylacji smoły, tworzą go głównie węglowodory aromatyczne.
3c. Alkohole
*Wytwarzanie alkoholi
Alkohole:metylowy i etylowy mogą być silnikowymi paliwami zastępczymi w stosunku do węglowodorów (benzyn).
Wytwarzanie alkoholi:
-metanol-mozna produkować na skalę przemysłową z takiech surowców jak; gaz ziemny, węgiel, drewno i odpady;

-etanol-jest wytwarzany z biomasy przez fermentację i destylację.
3d. Oleje roślinne
*Rodzaje olejów roślinnych:
-rzepakowy;
-słonecznikowy;
-palmowy;
-sojowy.
*Estryfikacja olejów roślinnych
Estryfikacja jest procesem oddziaływania na olej roslinny alkoholu metylowego/etylowego w obecnośi katalizatora.
W wyniku otrzymuje się estry metylowe kwasów tłuszczowych (EMKT, lub FAME z ang. Fatty Acid Methyl Ester) o
właściwościach zbliżonych do olejów napędowych.
Wymagania właściwości EMKT, jako biopaliwa silnikowego, określa norma PN-EN 14214:2004.
*Liczba cetanowa
Liczba cetanowa LC-jest miarą zdolności palwa do tłokowych silników z zapłonem samoczynnym do samozapłonu.
Określa się ja przez porównanie LC danego paliwa z LC wzorcowanego paliwa, którym jest mieszanina cetanu i
metylonaftalenu. Cetan ma LC=100, a α-metylonaftalen ma LC=0. Udział objętościowy cetanu w mieszaninie jest
równy jej LC.
*Zużycie oraz zasoby ropy naftowej
Świat:
Światowe rezerwy ropy naftowej ocenia sie na 137 mld Mg.
Światowe zasoby naftowej ocenia się na: 370 mld Mg.
Przy obecnym poziomie światowego wydobycia naftowej wystarczy jej na : 44 lata.
*Zuzycie oraz zasoby ropy naftowej
Polska
Zasoby ropy naftowej ocenia się na: 12 mld Mg.
Roczne wydobycie ropy naftowej: 728 tys Mg.
Import ropy naftowej: 18 mln Mg.
Import benzyn silnikowych: 0,627 mln Mg.
Import oleju napędowego: 968 tys. Mg.
4.Węgiel
*Występowanie pierwiastka węgla:
a) w małych ilościach w stanie wolnym: grafit, diament
b) głównie w stanie związanym:
- węglany (CaCO
3
, MgCO
3
, i innych),
- dwutlenek węgla w powietrzu, w wodzie
- związkach organicznych, zalicza się do nich paliwa kopalne: gaz ziemny, ropa naftowa, węgiel i biomasa.
*Pochodzenie węgla:
• Pochodzenie węgla jest organiczne: należy do biolitów (kaustobiolit) – skał osadowych pochodzenia organicznego.
*Powstawanie węgla:
•Materia węglowa powstała z materiału roślinnego, który w procesie przemian ulegał wzbogacaniu w pierwiastek C.
Przemiany te określa się mianem uwęglenia.
•Proces uwęglenia substancji organicznej dzieli się na dwie fazy: biochemiczną i geochemiczną:
materiał roślinny – torf – węgiel brunatny (faza biochemiczna)
węgiel brunatny – węgiel kamienny – antracyt (faza geochemiczna)
*Okresy powstawania węgla:
-węgiel kamienny-przed 300-200 mln lat;
-węgiel brunatny(twardy)-przed 100 mln lat;
-lignity(miekki)-przed 70-2 mln lat;
-torf-od 2 mln lat do teraz.
4a. Struktura wegla
*Petrografia węgla 1:
• Litotypy: witryn, klaryn, duryn i fuzyn (węgiel błyszczący, półbłyszczący, matowy i włóknisty)
• Mikrolitotypy (obserwowalne pod mikroskopem)
• Macerały:
– grupa witrynitu,
– grupa egzynitu,
– grupa inertynitu.
*Litotypy:
• węgiel błyszczący (witryn) – charakteryzujący się intensywnym połyskiem i smolistoczarną barwą. Zawartość popiołu
w węglu błyszczącym zmienna w zakresie 2 – 6 % .
• węgiel półbłyszczący (klaryn) – charakteryzujący się obecnością naprzemianlegle ułożonych drobnych pasemek
węgla matowego i błyszczącego.
• węgiel matowy (duryn) – który, może posiadać barwę szarą lub barwę brunatnoczarną.

• węgiel włóknisty (fuzyn) – który, przypomina w dużym stopniu węgiel drzewny. Charakteryzuje się dużą kruchością i
ścieralnością.
*Ważniejsze składniki węgla
Węgiel składa się z:
- substancji organicznej (palnej),
- substancji mineralnej,
- wilgoci.
*Substancja organiczna węgla
Substancja organiczna to materia powstała w czasie wzrostu organizmów żywych, a następnie obumarła uległa
przemianom (uwęgleniu). Substancja organiczna składa się z następujących pierwiastków: C, H, O, S, N, P
i innych pierwiastków w śladowych udziałach.
4b. Klasyfikacja węgla
*Klasyfikacja (przemysłowo-handlowa) węgli
Potrzeba klasyfikacji węgli:
- zróżnicowanie palenisk kotłowych,
- wymagania różnych technologii chemiczna,
- rozpowszechnienie handlu węglem.
*Podstawy klasyfikacji węgli
a. Pochodzenie węgla
b. Właściwości węgla.
Właściwości węgla określone wskaźnikami wg. PN.
– ciepło spalania (wg PN-81/G-04513 lub PN-ISO 1928:2002),
– wskaźnik wolnego wydymania (wg PN-81/G-04515),
– zawartość części lotnych w węglu (wg PN-G-04516:1998),
– wskaźniki dylatometryczne (PN-81/G-04517),
– zdolność spiekania (PN-81/G-04518).
*Analiza węgla
Analiza elementarna:
- udział pierwiastków: C, H, O, S, N, P, ...
Analiza techniczna – udziały w węglu:
- wilgoci,
- popiołu,
- części lotnych.
oraz: ciepło spalania i wartość opałowa.
*Pochodzenie węgli a stopień uwęglania
• Stopienia uwęglenia (udział pierwiastka C):
-Torf: 52-60
-Węgiel brunatny: 58-77
-Węgiel kamienny: 76-93
-Antracyt: 91-93.
*Znaczenie stanu węgla dla klasyfikacji
Stany w jakich paliwo poddawane jest analizie:
-Stan analityczny lub powietrzno-suchy (a), gdy wilgoć w węglu jest w równowadze z wilgocią otoczenia,
-Stan suchy ( d lub wf), po suszeniu przez dwie ponad godziny w temperaturze 105-110 oC,
-Stan suchy, bezpopiołowy (daf lub waf).
-Stan roboczy w którym paliwa jest użytkowane (r).
*Podział węgli
• W polskiej klasyfikacji węgle dzieli się na:
– grupy (klasy),
– typy,
– sortymenty.
*Podzial węgli na grupy (klasy)
•Grupę paliwa określa dwucyfrową liczbę xy:
- pierwsza określa klasę ze względu na stopień uwęglenia,
- druga miejsce paliwa w obrębie grupy:
- x – klasa, y - miejsce w klasie.
*Grupy (klasy) węgli
• Drewno: 01-09
• Torf: 11-19
• Węgle brunatne: 21-29
• Węgle kamienne: 31-39
• Antracyty: 41 i wyżej
• Grafit: 50

*Podatność przemiałowa węgla
•Podatność przemiałowa jest to parametr możliwości rozdrabniania węgli. Zależna od składu petrograficznego
węgla, składu substancji mineralnej oraz stopnia metamorfizmu węgla.
•W energetyce zawodowej najbardziej rozpowszechnioną metodą określania przemiałowości jest test Hardgrove’a.
Polega on na mieleniu frakcji 0,6–1,18 mm w młynie Hardgrove’a.
•Miarą podatności przemiałowej metody jest ilość uzyskanej frakcji ziarnowej < 0,75 mm z 50 g próbki węgla
poddanej mieleniu ze stałym nakładem energetycznym.
4c. Charakterystyka ważniejszych składników węgla
*Substancja organiczna
Substancja organiczna składa się głównie z:
- C i H,
ponadto z:
- O, S, N, i P oraz pierwiastków śladowych.
*Rozkład termiczny substancji organicznej
Po podgrzaniu powyżej 600 ºC substancja organiczna
węgla rozkłada się na:
- części lotne,
- pozostałość koksową (karbonizat)
*Substancja mineralna
Dzieli się na:
- wewnętrzną (pochodzącą z substancji węglotwórczej)
- zewnętrzną (skała płonna, i naniesione: piasek i glina)
Udział substancji mineralnej w węglu: 2-60%.
*Składniki substancji mineralnej węgla
Składniki:
- krzemionka (kwarc SiO
2
),
- minerały ilaste (kaolinit, ilit),
- tlenki (np. hematyt FeO
2
)
- węglany (kalcyt CaCO
3
, dolomit)
- siarczki FeS
2
– piryt i siarczany CaSO
4
– anhydryt.
*Składniki węgla:wilgotność (5-60%)
Składa się z:
- wilgoci przemijającej(nie jest związana z substancją organiczną, może być usunięta przez suszenie w temperaturze
pokojowej – stan powietrzno-suchy lub analityczny (a))
- wilgoć higroskopijnej (jest związana z substancją organiczną, można ją usunąć z węgla podgrzewając go do
105-110 ºC, stan suchy (d))
*Udział ważniejszych pierwiastków w węglu
-Węgiel C: 50-93%
-Wodór H: 2-5%
-Siarka S: 1-5 (11)% (w siarczkach (FeS
2
), w siarczanach (CaSO
4
, FeSO
4
))
*Energetyczne węgle kamienne (cd)
Podstawowe parametry polskich węgli energetycznych
Wu = 18-25 MJ/kg
A = 7-25%
S = 1,2%
N = 0,6-2,8%
*Energetyczne węgle brunatne
Podstawowe parametry polskich węgli brunatnych
Wu = 5,6-11,7 (średnio 8,5) MJ/kg
A = 4-25 (średnio 12,0)%
S = 0,2-1,7 (średnio 0,7)%
N = 0,6-2,0%
*Wystepowanie węgla w Polsce 1-węgiel kamienny
Zagłębia węgla kamiennego:
- górnośląskie,
- dolnośląskie
- lubelskie
*Wystepowanie węgla w Polsce 3-węgiel brunatny
Zagłębia:
- adamowsko-konińskie
- bełchatowskie (Szczerców)
- turoszowskie
- sieniawskie.

Zasoby łączne: 40 mld Mg
Zasoby udokumentowane: 13-14 mld Mg
Zasoby operatywne; 3,5 mld Mg
5.Biomasa
*Rodzaje biomasy
Roślinna:
- drewno i odpady drzewne (leśne i inne),
- odpady z produkcji i przetwarzania roślin (agro: słoma, siano, łuski, skorupy ...),
- rośliny hodowane do celów energetycznych,
- oleje roślinne i alkohole.
Zwierzęca
- obornik i gnojowica,
- tłuszcze i mączka kostna.
Odpady:
- osady ściekowe, odpady komunalne
*Pochodzenie biomasy roslinnej
Biomasa pochodzenia roślinnego powstaje w procesie fotosyntezy:
6CO
2
+ 6H
2
O + światło →C
6
H
12
O
6
+ 6O
2
Sprawność energetyczna fotosyntezy to: < 1% co daje wydajność upraw ok. 10-50 Mg/ha.
5a. Zasoby biomasy
*Zasoby biomasy-drewno
– lasy (5900 dam
3
),
– przemysł drzewny (1110 dam
3
),
– zadrzewienie (265 dam
3
),
– sady (1000 dam
3
),
dam
3
= 1000 m
3
.
Roczną produkcję drewna, które można wykorzystać do celów energetycznych, ocenia się zatem na 8265 dam3, co
odpowiada energii 68,3 PJ (
bez upraw energetycznych
).
*Zasoby biomasy-olej rzepakowy
Roczna produkcja rzepaku w Polsce 1,6 mln Mg.
Z 1 Mg rzepaku uzyskuje się ok. 400 kg oleju.
Możliwość produkcji oleju rzepakowego do celów energetycznych ocenia się na 1 mln Mg, co odpowiada ok. 30 PJ.
*Zasoby biomasy-etano i metanol
Etanol otrzymuje się przez fermentację alkoholową zboża i ziemniaków.
Możliwość produkcji etanolu do celów energetycznych ocenia się na 1 mln Mg , co odpowiada ok. 22 PJ.
*Zasoby biomasy-paliwa gazowe(biogaz)
Rodzaje paliw gazowych (biogazu):
- produkt fermentacji metanowej: gnojowicy, obornika i odpadów roślinnych,
- „metan” z wysypisk śmieci.
- zgazowanie biomasy (drewna).
Potencjał: 16 PJ.
5b.Właściwości biomasy
*Budowa chemiczna biomasy roślinej
Związki chemiczne tworzące biomasę to przede wszystkim węglowodany C
x
H
y
O
z
Największe znaczenie energetyczne ma biomasa typu ligninoceluloza, składająca się głownie z:
• hemicelulozy
• celulozy
• ligniny
*Wilgoć w biomasie roślinnej
a. Udział wilgoci w świeżej biomasie sięga 60%, w takim stanie biomasa nie powinna być spalana.
b. Pozyskiwanie biomasy z roślin jednorocznych do celów energetycznych powinno odbywać się pod koniec okresu
wegetacyjnego (np. słoma W
r
= 15% , Q
r
i
= 14-15 MJ/kg)
c. Świeże drewno nie nadaje się do spalania (Q
r
i
= 10 MJ/kg),
d. Należy je podsuszyć do stanu powietrzno-suchego (W
a
= 12-15%, Q
a
i
= 15-16 MJ/kg).
e. Naturalny sposób osuszania drewna, to sezonowanie (2 lata).
*Wpływ wilgoci na wartość opałową
Wilgoć jest balastem w biomasie roślinnej powodujący zmniejszenie jej kaloryczności:
Q
r
i
= Q
d
i
•(100 – W
r
)/100, kJ/kg
*Słoma
Główny składnik słomy: celuloza (C
6
H
10
O
5
)
n
Zalety słomy:
- znaczna wartość opałowa i mała zawartość siarki.
Wady słomy:
- znaczny udział chloru i potasu, mała gęstość, rozproszenie i zawilgocenie.

5d.Drewno
*Pochodzenie drewna-jako paliwa
• Odpady z produkcji (tartaki, przemysł celulozowy, meblowy...),
• Z porządkowania obszarów zielonych,
• Z obszarów leśnych,
• Z upraw energetycznych.
*Postać drewna-jako paliwa
Postać:
- z rębaków: zrębki
- odpady: kora, ścinki, plastry, trociny, pył,
- z terenów zielonych i lasów: dłużyzna,
- po scaleniu: granulki i brykiety.
Magazynowanie drewna: pod zadaszeniem (wilgoć: 12-14%).
*Postać drewna-jako paliwa
-pozostałości pozrębowe;
-opał sosnowy S4;
-drobnica M1;
-odpady zrębowe M2;
-odpady zrębowe belowane;
-pasy przydrożne;
-zrębki leśne;
-kora;
-trociny.
*Chemiczne składniki drewna
Składniki drewna:
- holoceluloza (celuloza i chemiceluloza)
- lignina ponadto: wilgoć (w stanie powietrzno-suchym: 13-22% wody).
Zalety drewna jako paliwa:
- mały udział popiołu i praktyczny brak siarki.
*Charakterystyka upraw energetycznych
Ogólna charakterystyka upraw energetycznych :
• rośliny szybkorosnące
• długoterminowa wydajność plantacji
• odporność na szkodniki i choroby
• ekonomiczność uprawy.
*Przykład roślin energetycznych
Drzewa:
•wierzba wiciowa
• malwa pensylwańska
• słonecznik bulwiasty
• róża wielokwiatowa
• rdest sachaliński
Trawy wieloletnie:
• miskant olbrzymi
• miskant cukrowy
• spartina preriowa.
-wierzba energetyczna-paliwo podobne do drewna pochodzenia leśnego;wyższa zawartość chloru i alkaliów;plantacje
na gruntach rolniczych, 3-4 letni cykl zbioru, koszt produkcji 14-18PLN/GJ.
5c. Odpadowa biomasa typu rolniczego
*Przykłady odpadowej biomasy rolniczej
• łuski słonecznika
• łuski orzechów
• kaczany kukurydzy
• śruta rzepakowa
• pestki owoców (np. malin)
• pestki oliwek
• wytłoki po jabłkach.
*Ekonomika energetycznego wykorzystania biomasy
Cena biomasy w stanie roboczym (mokrej) =120-160zł/Mg.
Koszt wytworzenia 1GJ ciepła z biomasy: 15-25zł/GJ.
6.Biopaliwa
*Dlaczego biopaliwa?
a. Efekt cieplarniany

b. Wyczerpywanie się ropy naftowej
c. Uzależnienie krajów UE od importu paliw: import gazu i ropy naftowej wzrośnie do 70% do 2030 r.
d. Utrudnienia w bezpośrednim energetycznym użytkowaniu biomasy spowodowane:
- zawilgoceniem, stanem skupienia, rozmiarami i rozproszeniem biomasy.
*Główny cel polityki paliwowej UE w zakresie biomasy
Wytworzenie z biomasy biopaliw będących konkurencyjną alternatywą dla paliw kopalnych.
*Biopaliwa-stałe
a)biomasa:
-drwa;
-wióry;
-mielony torf;
-darń torfowa;
-trawa;
b)biopaliwa:
-większe wióry;
-torf (groszek);
-granulki;
-brykiet;
-pył.
6a. Brykietowane/granulowane biomasy
*Ważniejsze operacje przetwarzania biomasy na biopaliwa stałe
-suszenie (w suszarniach, lub sezonowanie);
-rozdrabnianie ( w rębakach, sieczkarniach, mielenie w młynach);
-tłoczenie;
-spajanie;
-granulowanie/brykietowanie.
*Niektóre procesy brykietowanie/granulowania surowców roślinnych
Materiały roslinne zawierają celulozę,skrobię,białka,żywice,woski i tłuszcze.
Podczas zageszczania, pod działaniem temperatury, ciśnienia i wilgoci, substancje te ulegają przemianą fizycznym i
chemicznym:
-żelatynizacja skrobi;
-kleikowania białka;
-stapiania żywicy i ligliny itd.
Obniża to opory tarcia między cząstakami materiału i o ścianki kanału komory zagęszczajacej, co obniża
energochłonność procesu i poprawia właściwości mechaniczne produktu.
* Cechy ważne dla procesu brykietowania/granulowania biomasy
- wilgoć (8-18%), zbyt duża wilgoć rozsadza brykiet podczas prasowania,
- rozdrobnienie: lepsze rozdrobnienie ułatwia spajanie,
- rodzaj materiału: jego gęstość i zdolność do spajania pod działaniem określonego ciśnienia i temperatury,
- właściwości fizykochemiczne: skład chemiczny udział i rodzaj substancji mineralnej, wartość opałowa.
* Słoma jako materiał do brykietowania/granulowania
a. Słoma składa się głownie z celulozy, hemicelulozy i ligniny.
b. Do brykietowania najbardziej przydatna jest słoma: żytnia, pszenna, rzepakowa, gryczana i kukurydzy.
c. Słomę w celu przygotowania do brykietowania rozdrabnia się do sieczki.
d. Wilgotność słomy do brykietowania powinna wynosić ok. 15%.
* Sieczka do spajania słomy
Sieczka do spajania – otrzymywana jest przez rozdrobnienie słomy w młynach bijakowych wyposażonych w sita do
regulacji rozkładu cząstek po długości. Długość najczęściej występującej frakcji jest w zakresie od kilku do kilkunastu
mm.
6b. Pelety
* Wytwarzanie peletów drzewnych
Surowcem dla granulatu drzewnego są odpady drzewne np: trociny a proces produkcji zawiera następujące fazy:
1) suszenie
2) mielenie surowca
3) zagęszczanie
4) tłoczenie na matrycach i chłodzenie
5) przechowanie w workach 16-25 kg lub big bagach 1 000 kg.
* Wybrane parametry peletów drzewnych
Parametry peletów (zgodne zDIN51731):
Wartość opałowa – 18 MJ/kg
Wilgoć całkowita : 7%
Zawartość popiołu <1 %
Zawartość węgla: 49%

Zawartość siarki i chloru: <0,08%
Gęstość : 1000-1400 kg/m
3
Cena: 550 zł/t (netto)
6c. Brykiety
* Brykiety drzewne
Brykiet ma kształt walca o średnicy do 50 mm.
Parametry brykietu opałowego:
Wartość opałowa – 16- 18 MJ/kg
Gęstość: 985 kg/m
3
Wilgoć całkowita: 6,5 %
Zawartość popiołu : 3,5 %
Zawartość węgla : 44%
Zawartość siarki i chloru : po 0,01%.
Cena: 450 zł/t (netto)
6d. Węgiel drzewny.
6e. Toryfikacja biomasy
*Toryfikacja biomasy
Toryfikacja (torrefaction)- polega na traktowaniu termicznym biomasy w średnim zakresie temperatury (250-300
oC) celem łatwiejszego jej przemiału.
Uzyskany materiał (biowęgiel – biocoal) może być traktowany jak węgiel i zgazowany w reaktorach przepływowych.
*Charakterystyka upraw energetycznych
Ogólna charakterystyka upraw energetycznych :
• rośliny szybkorosnące
• długoterminowa wydajność plantacji
• odporność na szkodniki i choroby
• ekonomiczność uprawy
*Rodzaje upraw energetycznych
a. Wierzba
b. Malwa pensylwańska – ślazowiec pensylwanski
c. Miskant olbrzymi
d. Miskant cukrowy
e. Słonecznik bulwiasty
*Biopaliwa-ciekłe
Paliwa motorowe:
-Estery: metylowy/etylowy kwasów tłuszczowych
-Alkohole (etanol i metanol).
*Biopaliwa-gazowe
Producenci biogazu w UE :
- Niemcy: 2,4 mln t
- Polska: 62 tys. t
Wytwarzanie energii elektrycznej z biogazu: - 20 tys. GWh
*Biomasa jako paliwo-podsumowanie
a. Biomasa ma wielki potencjał rozwojowy dla zastosowań energetycznych dzięki możliwości formowania biopaliw.
b. Konieczność przetwarzania biomasy w biopaliwa wynika z trudności w ich energetycznej utylizacji w stanie
nieprzetworzonym.
c. Najlepsze perspektywy wytwarzania biopaliw są prze biomasa typu ligninoceluloza.
d. UE aktywnie wspiera rozwój technologii przetwarzania biomasy w paliwa stałe mogące być substytutem paliw
kopalnych.
e. Biopaliwa stałe powinny być substytutem węgla.
III. Spalanie i palniki
1. Aerodynamika spalania
*Znaczenie aerodynamiki spalania
*Czynniki
Utleniacz:
- powietrze (pierwotne, wtórne)
Paliwo:
- gaz (mieszanie), olej (rozpylanie), pył (transport)
Spaliny:
- mieszanie (recyrkulacja), przekazywanie ciepła, erozja i korozja.
*Obiekty aerodynamiki spalania
Podstawowe:
- palniki,
- paleniska kotłowe,

- komory spalania.
Pomocnicze:
- rurociągi,
- młyny,
- separatory.
*Zadania paleniska i palnika
- dostarczenie do paleniska strumienia paliwa zapewniającego moc cieplną,
- dostarczenie do paleniska strumienia powietrza zapewniającego wymagane l,
- mieszanie powietrza z paliwem zapewniające wymaganą formę płomienia
- utrzymanie paliwa w palenisku dostatecznie długo dla zapewnienia wypalenia.
*Rola mieszania w procesie spalania
a. Do spalania trzeba, żeby paliwo było w kontakcie z tlenem (powietrzem).
b. Mieszanie jest procesem dzięki któremu paliwo uzyskuje kontakt z powietrzem.
c. W procesach spalania wyróżnia się dwa sposoby mieszania:
- mieszanie laminarne,
-mieszanie turbulentne.
*Mieszanina a charakter płomienia
a. Zależnie od charakteru przepływu wyróżnia się płomienie:
- laminarne
-turbulentne.
b. W płomieniach laminarnych mieszanie ma charakter molekularny.
c. W płomieniach turbulentnych mieszanie ma charakter turbulentny.
*Bliska aerodynamika spalania
Formowanie się pola przepływu bezpośrednio za palnikiem wpływa na:
- formowanie się płomienia,
- niedopał,
- zanieczyszczenia,
- przekazywanie ciepła.
1a.Strugi
*Struga swobodna w przestrzeni
*Struktura strugi prostej
*Profile predkości strugi prostej
*Mieszanie się strug
*Mieszanie się strug poprzecznych
*Strugi współosiowe
1b. Strugi zawirowane
*Strugi zawirowane w obszarze nieograniczonym
*Struktura strugi silnie zawirowanej
*Struga zawirowana w obszarze ograniczonym
*Liczba wiru: s
S = Gf /(0,5 Gxdo)
Gx - strumień pędu osiowego,
G
X
=
∫
0
R
u u2 rdr
∫
0
R
P2 rdr
Gf - strumień pędu obwodowego
G
=
∫
0
R
wr u2 rdr
*Strefa recyrkulacji w strugach zawirowanych
*Zawirowywacz łopatkowy
1c. Turbulencja
*Turbulencja-definicja
u = uśr + u’, T = Tśr + T’
*Generacja turbulencji
-warstwa przyścienna;
-ślad aerodynamiczny;
-struga swobodna.
*Mieszanie turbulentne
*Struktura turbulentnego płomienia
*"Powierzchniowy" mechanizm spalania turbulentnego

S
T
S
L
=
A
L
A
T
*"Wyspowy" mechanizm spalania turbulentnego
*Mechanizm turbulentnego spalania
Model spalania mikroobjętościowego.
*Przejście od płomienia laminarnego do turbulentnego
Zmiany wysokości i struktury płomienia gazowego ze wzrostem prędkości wpływu.
*Przejście od płomienia laminarnego do turbulentnego-krytyczna liczba Re
Rekr
– wodór: 2000
– gaz miejski: 3000–4000
– tlenek węgla: 5000
– wodór + powietrze pierwotne: 5500–8500
– gaz miejski + powietrze pierwotne 5500–8500
– propan, acetylen: 9000–10000
– metan: 3000
1d. Stabilizacja płomieni
S
u
=
U∗cos
*Warunek stabilności płomienia
Co najmniej w jednym punkcie składowa prędkości przepływu na normalną do czoła płomienia jest równa prędkości
płomienia.
*Sposoby stabilizacji płomieni w warstwie granicznej płomieniem pilotującym recyrkulacją spalin.
*Stabilizacja płomieni gorącymi spalinami
Stabilizacja gorącymi spalinami:
- pilotujący płomień,
- recyrkulacja spalin.
Recyrkulacja:
- zewnętrzna,
- wewnętrzna.
*Stabilizacja płomieni-recykrkulacja zewnętrzna
Recyrkulacja zewnętrzna wywołana działaniem strugi.
*Stabilizacja płomieni recyrkulacja wewnętrzna
Wywołana:
- umieszczeniem w przepływie ciał nieopływowych,
- silnym zawirowaniem przepływu.
*Stabilizacja płomieni-sposoby generacji recyrkulacji
Przykład generatorów przepływów recyrkultacyjnych.
*Działanie statecznika płomienia
Zasada stabilizacji płomienia statecznikiem.
*Stabilizacja płomienia gazowego na stożku
*Charakterystyka statecznika
Zakres stabilności spalania.
*Charakterystyka stateczności zawirowanego płomienia
Wpływ liczby wiru S na zakres stabilności płomienia pyłowego.
2. Spalanie paliw gazowych
*Mieszanka palna
Mieszanka palna to mieszanina powietrza z paliwem, w której: po zniknięciu źrodła zapłonu proces spalania rozwija się
w niej samorzutnie.
*Rodzaje mieszanek palnych:
-bogata λ<1;
-stechiometryczna λ=1;
-uboga λ>1.
2a. Granica stężenia zapłonu
*Granice stezenia zapłonu
Minimalne (dolna granica) i maksymalne (granica gorna) stężenie paliwa w mieszance, w ktorej może nastąpić zapłon.
Dolna i górna wartość stężenia paliwa w mieszance paliwa z utleniaczem, poza którymi zapłon jest niemożliwy.
*Rodzaje granic stęzeniowych zapłonu
DGW – dolna granica zapłonu (wybuchu),
GGW – gorna granica zapłonu (wybuchu).
2b. Zapłon mieszanki palnej
* Definicja zapłonu
Zapłon jest to spowodowanie stanu spalania przez lokalne wywołanie intensywnej reakcji chemicznej w mieszance
palnej.
*Sposoby zapłonu
Rodzaje zapłonów:
- wymuszony (np.. iskrą elektryczna ...),
- samozapłon.
*Minimalna energia zapłonu
Definicja:
Emin – jest to najmniejsza ilość energii, która wywołuje zapłon w mieszance palnej [J].
Typowe Emin dla różnych paliw:
- gazowe: < 1 mJ
- płynne: 10-100 mJ
- pyły: 0,1-1,0 J
*Minimalna energia zapłonu gazów
Minimalna energia zapłonu różnych gazów w mieszaninie z powietrzem w zależności od składu mieszaniny palnej.
*Samozapłon
Samozapłon- jest to wywołanie stanu spalania (wybuchu) przez przekroczenie temperatury samozapłonu w mieszance
palnej. Tot > Tkr
*Sposoby przenoszenia się procesu spalania
a.Deflagracja-jest przenoszenie się procesu spalania przez płomień
- Mechanizm przenoszenia jest cieplny: przez przewodnictwo cieplne.
b.Detonacja- fala detonacyjna jest to fala reakcji spalania poprzedzona falą uderzeniową.
c.Tlenie.
*Płomień- jest to fala chemicznej reakcji egzotermicznej rozchodząca się z charakterystyczną dla danej mieszanki
palnej prędkością, zwana prędkością propagacji płomienia
Q=
−
dT
dx
*Podział płomieni:
Ze względu na charakter przepływu:
- laminarne,
- turbulentne.
Ze względu na sposób mieszania:
- kinetyczne (wymieszane)
- dyfuzyjne (nie wymieszane).
2c. Płomienie kinetyczne
*Łaminarny płomien kinetyczny:
-"płaski" płomień;
-mieszanka gazowa;
-strefa popłomienna.
*Struktura laminarnego płomienia kinetycznego 1
Przewód wypełniony mieszanką palną.
*Struktura laminarnego płomienia kinetycznego 2
*Predkość propagacji laminarnego płomienia kinetycznego
Metan:~40cm/s.
*Laminarny płomień kinetyczny nad palnikiem
*Laminarny płomień kinetyczny nad palnikiem Bunsena
Wyznaczanie prędkości propagacji z kąta stożka.
2d. Promienie dyfuzyjne
*Struktura laminarnego płomienia dyfuzyjnego 1
Schemat płomienia dyfuzyjnego:
-paliwo;
-spaliny;
-utleniacz;
-temperatura;
-płomień.
*Struktura laminarnego płomienia dyfuzyjnego 2
*Struktura płomienia dyfuzyjnego 3
Wpływ prędkości wpływu na wysokość płomienia dyfuzji.
*Struktura płomienia dyfuzyjnego 4
*Ruch burzliwy
Rozwinięcie powierzchni w ruchu turbulentnym.
*Struktura płomienia turbulentnego
-turbulentny

-laminarny
*Wpływ burzliwości na strukturę płomienia turbulentnego
*Stabilność płomieni gazowych
Wykres stabilności płomieni w przestrzeni otwartej.
2e. Palniki gazowe
*Wymagania dla palników gazowych
Zadaniem palnika jest dostarczenie gazu i powietrza oraz takie zorganizowanie mieszania, żeby ukształtować płomień o
pożądanych cechach.
Cechy dobrego palnika:
- poprawna i stabilna praca w zakresie projektowego zakresu warunków,
- mała emisja zanieczyszczeń,
- trwałość,
- mały poziom hałasu.
*Rodzaje palników gazowych:
•Powszechnego użytku (kompaktowe)
•Niskoemisyjne
•Rozpałkowe
•Pilotujące
•Specjalne
Zakres mocy palników gazowych: waty-megawaty.
*Typy palników gazowych:
a)inżektorowe:
-wysokiego ciśnienia;
-niskiego ciśnienia;
b)nadmuchowe:
-szczelinowe;
-wirowe;
*Palniki gazowe inżektorowe niskiego ciśnienia-zasada działania
*Palniki gazowe inżektorowe niskiego ciśnienia-przykłady
*Palniki gazowe inżektorowe wysokiego ciśnienia-przykłady
*Palniki gazowe nadmuchowe-szczelinowe
*Palniki gazowe nadmuchowe-wirowe
3. Rozpylanie paliw ciekłych
*Rozpylanie oleju-mechanizmy
Mechanizmy rozpylania strugi cieczy
Istota rozpylania cieczy w strudze polega na pokonaniu napięcia powierzchniowego cieczy przez siły zewnętrzne lub
wewnętrzne:
-naprężenia styczne na powierzchni strugi, wywołane różnicą prędkości między cieczą a powietrzem, które
destabilizuje struge, wywołując jej rozkład;
-siły odśrodkowe ruchu wirowego strugi, siły wywołane wzrostem ciśnienia w kropli na skutek parowania w jej
wnętrzu;
-zewnętrzne siły mechaniczne, elektrostatyczne i ultradzwięków.
*Rozpylanie oleju-zasady działania
a)energia cieczy:
-rozpylacze strumieniowe (o działaniu ciągłym i o działaniu przerywanym);
-rozpylacze wirowe;
-rozpylacze strumieniowo-wirowe;
b)energia gazu:
-rozpylanie pneumatyczne;
c)energia mechaniczna:
-rozpylacze rotacyjne.
*Rozpylanie w strudze:
-pierwotny rozpad strugi;
-wtórny rozpad kropel.
*Zakresy rozpylania cieczy
Re=(UL)/v
We=(U
2
L)/v
*Typy rozpylaczy oleju:
a)ciśnieniowe:
-wirowe;
-strumieniowe;
b)pneumatyczne:
-typu Y;

-z krzyżowym przepływem;
c)obrotowe.
3a. Rozpylacze ciśnieniowe oleju
*Ciśnieniowy rozpylacz oleju:strumieniowy
Strumieniowy rozpylacz przelotowy
Do > 0,5 mm
Dp = 0,3-1(5) MPa
a = 5-15ͦ
Prosta konstrukcja, niska jakość rozpylania.
*Ciśnieniowy wirowy rozpylacz oleju:zasada działania
do = 2-6 mm
Dp = 0,12-0,25 MPa
a = 45-90ͦ
Prosta budowa, pewnośc działania, dobra jakość rozpylania, małe zużycie mocy.
3b. Pneumatyczne rozpylacze oleju
*Działanie pneumatycznego rozpylacza oleju
Zużycie czynnika roboczego δ =0,06-0,1 kg/kg.
Struktura rozpylonej strugi paliwa ciekłego:
-ciekłe paliwo;
-medium rozpylające(sprężone powietrze lub para);
-recyrkulujące małe krople;
-strumień powietrza;
-pierścieniowa warstwa paliwa dookoła medium rozpylającego;
-krople paliwa w strumieniu medium rozpylajacego;
-toki deformacji paliwa;
-małe krople formowane poza strumieniem;
-rozproszone strugi;
-małe krople formowane ze strugi;
-duże krople formowane z rozpadu strugi;
-ok.5 średnic dyszy rozpylającej;
-ok. 40 średnic dyszy rozpylajacej.
*Typy pneumatycznych rozpylaczy oleju:
a)rozpylacz pneumatyczny typu Y:
-ciecz;
-gaz;
-głowica rozpylacza;
-otwory wylotowe.
b)rozpylacz pneumatyczny typu krzyżowego:
-ciecz;
-gaz;
-otwory cieczowe;
-otwory gazowe;
-komora mieszania,otwory wylotowe.
*Regulacja wydatku oleju
Regulacja wydatku z rozpylaczy strumieniowych odbywa się przez zmianę ciśnienia oleju, z ujemnymi dla jakości
rozpylania.
Wirowe rozpylacze regulowane dzielą się na:
-dwustopniowe;
-upustowe;
-z regulacją powierzchni otworów wylotowych.
Regulacja wydatku z rozpylaczy pneumatycznych odbywa się przez zmianę ciśnienia oleju, bez ujemnych skutków dla
jakości rozpylania.
*Dwustopniowa regulacja wydatku oleju
Schemat jednokomorowego rozpylacza dwuzakresowego:
-zawór;
-odprowadzenie.
*Upustowa regulacja wydatku oleju
Rozpylacz upustowy, rozpylacz upustowy z zaworem:
-zawór;
-komora wirowa;
-otwory upustowe.
3c. Jakość rozpylania oleju
*Ocena jakości rozpylania oleju
Parametry rozpylania:
-wydajność;
-kąt rozpylania;
-rozłożenie kropel;
-jakość rozpylania.
*Wybrane parametry rozpylaczy:
-charakterystyka rozpylaczy;
-kąt nachylenia;
-rozkład cieczy w strudze kropel;
-widmo rozpylenia.
*Wydajność rozpylaczy
Wydajność ciśnieniowych rozpylaczy m definiuje się jako:
m= A∗2
c
p
0,5
gdzie: A jest polem powierzchni wyplywu,a μ jest współczynnikiem wypływu.
*Rozkład kropel po rozmiarze
Średnia średnica kropli:
-średni rozmiar kropel:
SRK=[
nD
3
nD
]
0,5
-średnica Sautera:
SMD=
nD
3
nD
2
4.Spalanie paliw ciekłych
*Fazy spalania paliw ciekłych:
-faza parowania paliwa;
-faza spalania par paliwa.
*Dominujęce czynniki w spalaniu paliw ciekłych:
-parowanie cieczy;
-mieszanie par z utleniaczem;
-kinetyka chemiczna spalania.
*Spalanie pojedyńczej kropli paliwa
Model dyfuzyjnego spalania kropli paliwa:
-geometria płomienia;
-rozkłady temperatury oraz stężenia paliwa C
f
i tlenu C
o2
.
*Czas spalania pojedyńczej kropli paliwa:
τ
S
=kd
0
2
, gdzie d
0
-średnica początkowa kropli, k-współczynnik
*Wpływ konwekcji na spalanie kropli paliwa
-wpływ konwekcji swobodnej;
-wpływ konwekcji wymuszonej (przepływ, kropla, strefa recyrkulacji).
*Wpływ ruchu wirowego wewnątrz kropli na jej spalanie
*Wpływ parowania wewnętrznego na spalanie kropli paliwa
Fazy spalania kropli paliwa ciekłego.
*Spalanie kropli oleju ciężkiego
Cztery etapy spalania:
a)czas indukcji zapłonu-zakończony zapłonem lekkich frakcji oleju;
b)spalanie-parowanie, kraking ciężkich frakcji oleju, formowanie się powłoki koksowej;
c)mikroeksplozja-rozerwanie koksowej powłoki;
d)dopalanie cząstek koksu olejowego.
*Spalanie kropli ciężkiego oleju, cząstka koksu olejowego
*Spalanie się grupy kropel oleju w płomieniu
4a. Struktura płomienia olejowego
*Struktura płomienia olejowego-model jednowymiarowy
*Struktura płomienia olejowego-za dyszą rozpylającą
-struga;
-krople;
-spalanie kropel;
-dopalanie.
*Struktura zawirowanego płomienia olejowego
4b. Palniki olejowe
*Palniki olejowe-blokowe
Palnik blokowy jes zbudowany z trzech zespołów:
-rozpylania;
-aerodynamiki;
-sterowania.

*Rozpałkowy, lancowy palnik mazutowy do kotłów pyłowych
-dyfuzor;
-lanca olejowa;
-elektroda zapalarki elektrycznej;
-skrzynia powietrzna (P-para wodna, M-mazut, P1, P2-powietrze pierwotne i wtórne).
5.Spalanie węgla
*Paleniska do spalania węgla
Paleniska podstawowe:
-rusztowe (z rusztem:stałym, ruchomym);
-fluidalne (ze złożem:pęcherzykowe,cyrkulujące);
-pyłowe.
Inne:
-cyklonowe;
-retortowe;
-piece obrotowe.
*Typy palenisk do spalania węgla
Ważniejsze sposoby spalania węgla:
-w złożu stałym;
-na ruszcie ruchomym;
-w złożu fluidalnym;
-w płomieniu pyłowym.
*Rozdromnienie węgla
Rusztowe z rusztem:
• stałym:muł miał, drobny, groszek, orzech, gruby,
• ruchomym: groszek, orzech (10-30 mm),
Fluidalne ze złożem:
• pecherzykowe:<25mm;
• cyrkulujące:6mm;
Pyłowe dla węgla:
• kamiennego: R90= 25-30%, R200<8%,
• brunatnego: R90= 48-55%, R200 = 25-32%, R1000<2-3%.
*Proces spalania węgla:
-wydzielanie i spalanie części lotnych;
-spalanie pozostałości koksowej.
5a. Spalanie pojedyńczej cząstki węgla
*Spalanie pojedyńczej cząstki węgla
*Etapy spalania pojedyńczej cząstki węgla
Czas indukcji zapłonu:
-nagrzewanie się cząstki;
-oddawanie wody.
Proces spalania:
-wydzielenie i spalanie części lotnych;
-spalanie pozostałości koksowej.
Stosunek tych czasów: 1:10.
*Mechanizm wydzielania części lotnych z węgla
*Rozkład termiczny węgli koksujących
*Dynamika wydzielania części lotnych z węgla
*Struktura karabonizatu (pozostałości koksowej,koksu)
*Substancja mineralna węgla
Substancja mineralna węgla:
-związana (z substancji węglowotwórczej);
-wolna (glina, piasek i skała płonna).
Najważniejsze cztery grupy minerałów w węglu to:
-glinokrzemiany-głównie kaolinit;
-tlenki-krzemionka SiO
2
i hematyt Fe
2
O
3
;
-węglany-kalcyt CaCO
3
, syderyt FeCO
3
i dolomit CaCO
3
MgCO
3
;
-związki siarki-piryt FeS
2
i gips CaSO
4
2H
2
O.
*Przemiany substancji mineralnej węgla 1
Spalanie:substancja mineralna→popiół.
Przemiany substancji mineralnej podczas spalania:
-fizyczne (topnienie, parowanie, sublimacja i kondensacja);
-chemiczne (dehydracja, rozkład węglanów i utlenianie siarczków).
*Przemiany substancji mineralnej węgla 2
*Odpady paleniskowe z kotłów pyłowych
-popioły lotne;
-żużle i szlaka.
5b. Spalanie pozostałości koksowej
*Mechanizm chemiczny spalania węglana
Mechanizm chemiczny spalania karbonizatu:
C+O
2
=CO
2
-393,5 kJ/mol
C+0,5O
2
=CO-110,5 kJ/mol
C+CO
2
=2CO+172,5 kJ/mol
2CO+O
2
=2CO
2
-283,0 kJ/mol
*Spalanie pojedynczej cząstki węgla
Rozkład stężen produktów pierwotnych i wtórnych produktów utleniania koksu.
*Szybkość spalania pozostałości koksowej
W
C
=
Y
0
1
k
1
D
Ω=0,375 współczynnik stechiometryczny dla spalania do CO
2
;
k=k
0
exp[-E/(RT)]-szybkośc reakcji;
α
D
=(D/d)Sh-współczynnik przekazywania masy (Sh=CRe
n
Pr
k
).
Obszar kinetyczny:
1
k
≫
1
D
W
C
=
Y
O
k
0
exp [
−
E
RT
]
Obszar dyfuzyjny:
1
k
≪
1
D
W
C
=
Y
O
D
*Reżimy spalania cząstki pozostałości koksowej:
-kinetyczny;
-przejściowy;
-dyfuzyjny.
*Reżimy spalania pojedynczej porowatej cząstki koksu
Obszary reagowania porowatej cząstki pozostałości koksowej z tlenem.
*Rola reakcji wtórnych w spalaniu pojedyńczej cząstki koksu
Wpływ konwekcji i temperatury na rolę piwrwotnych i wtórnych reakcji w spalaniu cząstki pozostałości koksowej.
5c. Struktura płomienia pyłowego
* Wpływ substancji mineralnej na udział części palnych w popiele lotnym
Czynniki wpływające na niedopał:
-jakość przemiału węgla;
-reaktywność koksu;
-warunki spalania.
Odmiany petrograficzne powodujące niedopał:inertynit, ksylity.
5d. Palinki i paleniska pyłowe
*Dobór palenisk pyłowych:
-stopowe-palniki szczelinowe;
-czołowe-palniki wirowe;
-tangencjalne-palniki szczelinowe.
*Palniki wirowe
Liczba wiru S=0,4-0,7
Prędkość wypływu mieszanki:20-22 m/s.
Prędkość wypływu powietrza: 26-30 m/s.
*Palniki strumieniowe: na pył węgla brunatnego:
-dysza powietrza chłodzącego ceramikę;
-dysza powietrza górnego;
-dysza pyłowa z powietrzem rdzeniowym;
-dysza powietrza pośredniego;
-dysza pyłowa z powietrzem rdzeniowym;
-dysza powietrza dolnego;
-dysza powietrza chłodzacego ceramikę.
*Palniki strumieniowe: prędkości czynników
Czynnik nośne pyłu węglowego:
-węgiel kamienny-powietrze;

-węgiel brunatny-spaliny.
Prędkość wypływu z dysz(wegiel brunatny):
-mieszanki pyłowej 11-13 m/s;
-powietrza górnego i dolnego 45-55 m/s;
-powietrza pośredniego 45-55 m/s;
-powietrza rdzeniowego i chłodzącego 20-25 m/s.
*Palniki strumieniowe-węgiel brunatny
Współczynnik wentylacji: 1,6 (strumień spalin/strumień pyłu).
Liczba dysz pyłowych w palniku strumieniowym zależnie od wentylacji.
5e. Spalanie fluidalne
*Skład i temperatura złoża fluidalnego
Złoże fluidalne składa się z :
-materiału inertnego (piasek i popiół);
-sorbentu wapniowego (i produktów odsiarczania);
-2-6% węgla.
Temperatura złoża fluidalnego: -800-900ͦ C.
Optymalna temperatura ze względu na odsiarczanie: 850 ͦ C.
*Rodrobnienie cząstek w paleniskach fluidalnych
-nastepuje na skutek:
-wzrostu porowatości;
-zderzenia cząsttek w złożu;
-ścierania się cząstek w złożu.
5f. Paleniska specjalne
*Spalanie węgla w palenisku retortowym.
*Spalanie w palenisku cyklonowym.
6. Spalanie biomasy
*Dawne znaczenie energetyczne biomasy
W epoce pre-industrialnej (<1850 r.) drewno było dominującym źródłem energii wykorzystywane przede wszystkim w
celach :
- grzewczych,
- w prymitywnych silnikach parowych,
- w metalurgii.
*Ważniejsze sposoby enegetycznego wykorzystywania biomasy
a. Spalania (spalanie bezpośrednie, współspalanie)
b. Piroliza biomasy
c. Zgazowanie biomasy
d. Fermentacja beztlenowa
e. Fermentacja alkoholowa (np. bio-etanol)
f. Konwersja fizykochemiczna (np. bio-oleje).
*Negatywne cechy biomasy jako nośnika enegii
- rożnorodność gatunkow biomasy,
- zrożnicowanie rozmiarow i kształtow biomasy,
- zawilgocenie biomasy,
- mały ciężar nasypowy biomasy,
- rozproszenie biomasy i inne.
*Paleniska do spalania biomasy
Specyficzne cechy biomasy spowodowały, że należało opracować wiele typów specjalizowanych palenisk do jej
spalania. Najbardziej typowe to:
-do spalania słomy,
-do spalania drewna w postaci: biedron, zrębków, pelletów, granulatów i trocin,
-do spalania odpadów produkcji roślinnej (łusek, kaczanów i bagassy).
6a. Spalanie drewna
*Wpływ dostępu tlenu na mechanizm spalania drewna
Rozkład termiczny drewna ależnie od charakteru spalania.
*Strefy spalania drewna
Mechanizm płomieniowy spalania drewna .
6b. Spalanie cząstek drewna
*Spalanie drewna a spalanie węgla
Proces spalania cząstek drewna jest podobny do spalania młodych węgli, a zwłaszcza węgli brunatnych.
Fazy spalania cząstki drewna (biopaliwa stałego)
a. Nagrzewanie i suszenie.
b. Rozkład termiczny.
c. Spalanie produktów rozkładu termicznego.

d. Spalanie pozostałości koksowej.
*Etapy spalania cząstek drewna
-nagrzewanie;
-suszenie;
-spalanie cz.1;
-spalanie koksu;
-popiół.
* Chemia spalania części lotnych
a. Rozkład termiczny na mniejsze molekuły, np.:
CH
3
COOH →CH
4
+ CO
2
CH
3
CHO → CH
4
+ CO
b. Strefa spalania (generacji rodników):
C
2
H
6
+ M →2CH
3
+ M
C
2
H
6
+ H →C
2
H
5
+ H
2
CH
3
+ O
2
+ M → CH
3
O
2
+ M
CH
3
O
2
→ CH
2
O + OH
c. Strefa dopalania (rekombinacji i utleniania CO)
HCO + OH →CO + H
2
O
CO + OH → CO
2
+ H
2
H + OH →H
2
O + M
6c. Spalanie węgla drzewnego
*Pozostałość koksowa-koks-węgiel drzewny
Pozostałość koksowa - koks - węgiel drzewny):
- węgiel drzewny ma:
~ok. 80% C
~1-3% substancji mineralnej oraz
~12-15% części lotnych.
- porowaty: 200-400 m2/g (po aktywacji 2000 m2/g
- reaktywny.
*Mechanizm spalania pozostałości koksowej (koksu, węgla drzewnego)
2C + O
2
→ 2C(O)
C(O) → CO
C(O) + C(O) → CO
2
+ C
E = 125 kJ/mol
Temperatura zapłonu koksu: 200-250 oC
Temperatura spalania w warstwie: 800-1000 oC
Temperatura spalania w płomieniu: 1200 – 1700 oC.
6d. Piroliza drewna
*Temperatura rozkładu termicznego drewna
Główne składniki drewna rozkładają się w temperaturze:
– hemicelulozy 500–600 K,
– celuloza 600–650 K,
– lignina 500–773 K
*Produkty rozkładu termicznego drewna
- Gazowe (CO, CO2, CH4, C2H4, C2H6 i H2)
- Ciekłe/kondensujące (woda, metanol, kwas octowy, aldehyd octowy i smoła),
- Stałe – pozostałość koksowa (koks, węgiel drzewny).
*Wpływ temperatury na produkty pirolizy drewna
Ilość i skład gazów, smoły i karbonizatu zależy od szybkości nagrzewania, temperatury końcowej i czasu trwania.
*Paleniska do spalania drewna
Wybór paleniska zależy od:
- postaci drewna (drwa, zrębki,trociny, pył)
- mocy cieplnej kotła.
*Typy palenisk stosowanych do spalania drewna
Najczęściej stosowane typy palenisk:
- rusztowe z rusztem:
~stałym
~przesuwnym (pochyłe, schodkowe, posuwisto-zwrotne)
- fluidalne (pęcherzykowe, cyrkulujące),
- retortowe
- cyklonowe (pyłowe).
*Paleniska rusztowe "na drewno"

Możliwość spalania:
-różne rozmiary;
-zawartość do wody 60%;
-nieduża emisja popiołu.
Znaczna emisja: NO
X
i CO.
Ze względu na duży udział części lotniczych i zawilgocenie zwykle wymagane jest przedpalenisko.
*Paleniska fluidalne "na drewno"
Możliwości spalania:
-ograniczone rozmiary;
-zawartość wody do 60%;
-zmienne obsiążenie;
-mała emisja NO
X
.
Problemy: niebezpieczeństwo defluidyzacji.
*Przykład paleniska fluidalnego
Konstrukcja kotła fluidalnego na biomasę firmy Babock.
Dane techniczne:
-moc:10-150 MW
t
;
-wartość opałowa:3-20 MJ/kg.
6e. Spalanie słomy
*Przygotowanie słomy do spalania
Słoma może być spalania w następujących postaciach:
– w belach lub balotach,
– pocięta (sieczka, dłuższe włókna)
– jako brykiety lub granulat (pelety).
*Typy palenisk do spalania słomy
Ze względu na sposób podawania paliwa można wyróżnić trzy typy kotłów do spalania słomy:
– kotły wsadowe – do okresowego spalania bel/balotów słomy (ok. 20 – 500 kW),
– kotły do spalania rozdrobnionej słomy (sieczka, dłuższe włókna) (do 50 MW)
– kotły do cygarowego spalania balotów (do 30 MW).
6f. Kotły wsadowe na słomę
*Charakterystyka kotłów wsadowych
Kotły przepływowe
– sprawność: 35-40%
– duża emisja CO i pyłów
Kotły przeciwprądowe
– sprawność: 70-75%
– emisja CO: 1000-4000 mg/m3
– nadmiar powietrza: 25-50%.
*Cygarowy system spalania balotów
Palenisko cygarowe do ciągłego spalania balotów (Dania), stosowane do kotłów o mocy do 30 MW.
6g. Kotły na słomę rozdrobioną-kotły zmechanizowane
*Charakterystyka kotłów na słomę rozdrobnioną
Podstawowe wyposażenie:
a. Linia podawania słomy (stół podawczy)
b. Rozdrabniacz słomy
c. Linia transportu słomy rozdrobnionej (mechaniczny, pneumatyczny)
d. Zabezpieczenie przeciwpożarowe (śluza mechaniczna oddzielająca układ transportu słomy od podajnika)
e. Podajnik słomy do kotła (slimakowy)
f. Kocioł z paleniskiem (ruszt schodkowy).
*Rozdrabniacze słomy
Rozdrabniacze wolnoobrotowe tnące słomę na sieczkę o długości 6-10 mm.
Moc kotłów : do 50 MW.
*Emisje innych zanieczyszczeń przy współspalaniu węgla i biomasy
Przy współspalaniu biomasy z węglem w małych kotłach (rusztowe) problemem jest emisja:
- tlenku węgla (ponad 10 tys. ppm co odpowiada 1% obj. CO)
- WWA (wielopierścieniowych węglowodorów aromatycznych
Duża emisja tlenku węgla wynika z dużej zawartości części lotnych w biomasie typu: drewno i słoma. Znaczenie ma
też zawilgocenie węgla.Spalanie drewna charakteryzuje się dużą emisją WWA.
6h. Negatywne skutki spalania biomasy
*Problemy związane ze spalaniem biomasy w kotłach
- korozja chlorkowa (słoma),
- spiekanie i aglomeracja popiołów (defluidyzacja złoża fluidalnego)
- tworzenie się osadów na powierzchniach konwekcyjnych

- zagrożenia pożarowo-wybuchowe.
*Składniki biomasy powodujące problemy spalania i współspalania biomasy w kotłach
Składniki biomasy stwarzające problemy eksploatacyjne:
- znaczny udział chloru (słoma, trawa)
- znaczny udział metali alkalicznych (drewno, słoma, trawa).
*Korozja chlorowa podczas spalania biomasy
Mechanizm chemiczny korozji chlorowej powierzchni stalowych.
Zachodząca w osadzie reakcja siarkowania chlorku potasu z udziałem SO
2
ze spalin powoduje wyzwolenie gazowego
chloru, który atakuje żelazo i chrom w stali
2KCl(s) + SO
2
(g) + ½O
3
+ H
2
O → K
2
SO
4
(s) + 2HCl(g).
*Defluidyzacja złoża fluidalnego
Aglomeracja materiału złoża z udziałem popiołu ze spalania biomasy.
Piasek kwarcowy (SiO
2
): temperatura topnienia 1450 °C temperatura złoża 800-900 °C, ale obecne w popiele ze
spalania biomasy tlenki i sole metali alkalicznych reagują z SiO
2
2SiO
2
+ Na
2
CO
3
→Na
2
O
2
SiO
2
+ CO
2
4SiO
2
+ K
2
CO
3
→ K
2
O
4
SiO
2
+ CO
2
6i. Zagazowanie biomasy
*Produkty zagazowania biomasy
Produkty zgazowania biomasy:
• gazowe (główne),
• ciekłe (kondensujące, para wodna, alkohole, kwasy),
• smoła (ciężkie węglowodory kondensujące do stałej postaci),
• stałe (popiół).
*Technologie zagazowania biomasy 1:
Gazogenerator przeciwprądowy ze złożem stałym.
*Technologie zagazowania biomasy 2:
Gazogenerator fluidalny.
*Parametry procesu zagazowania drewna w złożu fluidalnym:
-strumień drewna-1,6 kg/s;
-strumień powietrza-1,8 m
3
/s;
-λ-0,3;
-temperatura powietrza-415 ͦC;
-temperatura gazu-800-900 ͦC;
-wartość opałowa drewna-16,6 MJ/kg (daf);
-wartośc opałowa gazu- 4,8 MJ/m
3
;
-wydajność gazu-2 m
3
/kg
drewna
.
6j.Przykłady energetycznego wykorzystania biomasy.
IV. Spalanie w urządzeniach technicznych:
1
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron