Nazwisko, imię (DRUKOWANYMI LITERAMI)
.
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. ..
.
.
.
.
....
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. ..
.
.
.
.
....
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. ..
.
.
.
.
....
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
.
http://www.sggw.waw.pl/~stepniak
Ćwiczenia z chemii organicznej Nr 1
e-mail:
I.
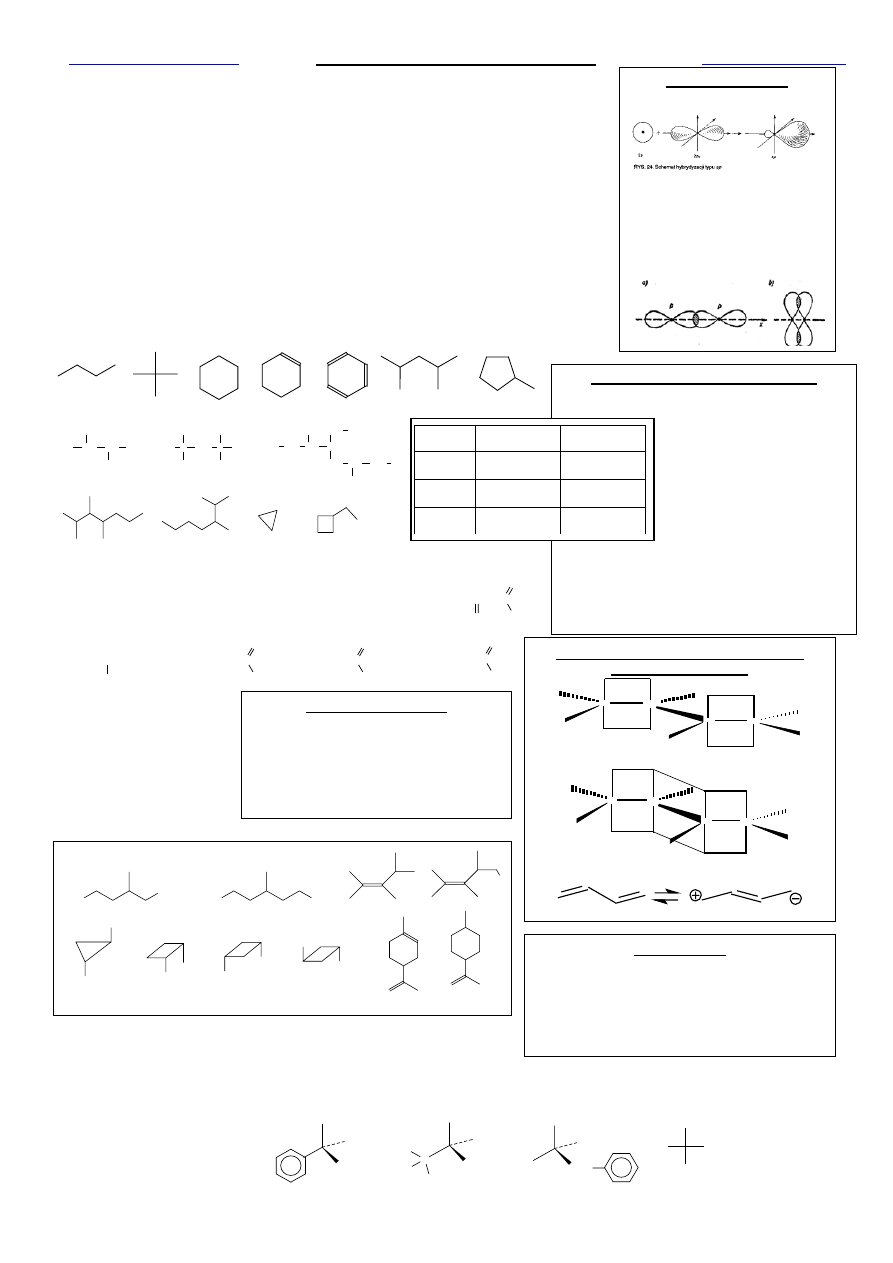
Hybrydyzacja orbitali atomowych C a struktura cząsteczek
1. Na wybranych przykładach wyjaśnić teorię hybrydyzacji orbitali atomowych: sp, sp
2
i sp
3
.
2. Z jakich orbitali atomowych mogą być utworzone orbitale molekularne: σ i π?
3. Jaka jest hybrydyzacja orbitali atomowych, kąty między wiązaniami i struktura cząsteczki propadienu?
4. Jaka jest hybrydyzacja orbitali atomowych, kąty między wiązaniami i struktura cząsteczki but-1,3-dienu?
5. Jaka jest hybrydyzacja orbitali atomowych, kąty między wiązaniami i struktura cząsteczki butatrienu?
6. Jaka jest hybrydyzacja orbitali atomowych, kąty między wiązaniami i struktura cząsteczki cykloheksa-1,3-dienu?
7. Jaka jest hybrydyzacja orbitali atomowych, kąty między wiązaniami i struktura cząsteczki benzenu?
8. Z jakich orbitali atomowych zostały utworzone orbitale molekularne w cząsteczce acetylenu?
9. Z jakich orbitali atomowych zostały utworzone orbitale molekularne w cząsteczce etenu?
10. Z jakich orbitali atomowych zostały utworzone orbitale molekularne w cząsteczce 2-metylo-but-2-enu?
11. Z jakich orbitali atomowych zostały utworzone orbitale molekularne w cząsteczce 2-cykloheksylo-but-2-enu?
12. Kiedy może wystąpić zjawisko delokalizacji elektronów w cząsteczce? Podaj przykłady.
13. Podaj struktury graniczne cząsteczki but-1,3-dienu.
14. Podaj struktury graniczne cząsteczki cykloheksa-1,3-dienu.
15. Podaj struktury graniczne cząsteczki benzenu.
II.
Nomenklatura związków organicznych
1. Napisz
pełne wzory strukturalne i podaj nazwy systematyczne następujących węglowodorów:
a)
b)
c)
d)
e)
f)
g)
2. Podaj nazwy systematyczne następujących węglowodorów:
a)
g)
f)
e)
d)
CH
3
C CH
2
C CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
2
CH CH
CH
3
CH
2
CH
2
CH CH
2
CH
3
CH
3
CH
3
b)
c)
CH CH CH
3
C
2
H
5
C
2
H
5
CH
3
3. Podaj nazwy grup funkcyjnych występujących w poniższych związkach:
CH
3
CH
2
NH
2
CH
3
NO
2
C
2
H
5
OC
2
H
5
CH
3
OH
C
6
H
5
C
OCH
3
O
CH
3
CH
2
C
O
NH
2
NH
2
CH
2
C
OH
O
CH
3
CHCOOH
OH
CH
3
CCH
2
C
H
O
O
a)
b)
c)
d)
e)
f)
g)
h)
i)
H
III.
Izomeria
1. Które z poniższych cząsteczek są chiralne:
Izomeria konstytucyjna:
1. Izomeria
łańcuchowa
2. Izomeria
położeniowa:
a) Wiązania wielokrotnego
b) Grupy funkcyjnej lub podstawnika
Wiązania kowalencyjne
σ(s-s), σ(s-p
x
),
σ(p
x
-p
x
),
σ(sp
i
-s),
σ(sp
i
-p
x
),
σ(sp
i
-sp
i
),
σ(sp
i
-sp
j
),
π(p
y
-p
y
),
π(p
z
-p
z
)
Delokalizacja elektronów
π w cząsteczkach
związków organicznych
C
C
H
C
C
H
H
H
H
C
C
H
C
C
H
H
H
H
H
[
]
Rodzaje hybrydyzacji orbitali atomowych C
6
C: 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
6
C: 1s
2
2(sp)
1
2(sp)
1
2p
z
1
2p
y
1
6
C: 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
6
C: 1s
2
2(sp
2
)
1
2(sp
2
)
1
2(sp
2
)
1
2p
z
1
6
C: 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
6
C: 1s
2
2(sp
3
)
1
2(sp
3
)
1
2(sp
3
)
1
2(sp
3
)
1
Liczba
wiązań
π
Typ hybrydy-
zacji
Struktura
wiązań
0
sp
3
Tetraedryczna
109
o
28`
1
sp
2
Trygonalna
120
o
2
sp
Diagonalna
180
o
i)
h)
g)
f)
e)
d)
c)
b)
a)
HO
OH
OH
HO
Cl
Cl
Cl
Cl
Cl
CH
3
CH
3
Cl
j)
Stereoizomeria:
3. Izomeria
geometryczna:
a) Alkenów
b) Dwupodstawionych
cykloalkanów
4. Izomeria
optyczna
2. Narysować wzory przestrzenne następujących związków:
a) (S)-2,3-dimetylopent-1-en, b) (R)-2-metylobutan-1-ol, c) (R)-3-metylobutan-2-ol, d) (R)-2-hydroksypropanal.
3. Określić konfigurację centrów asymetrii w następujących cząsteczkach:
Br
C
NH
2
CH
3
H
3
C
CH
3
H
COOH
Br
CH
2
H
CN
OH
H
CH
3
NH
2
COOH
H
Wyszukiwarka
Podobne podstrony:
Izomeria 4 id 221207 Nieznany
Izomeria 2 id 221205 Nieznany
Izomeria optyczna id 221213 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron