
2010-01-22
1
Chemia XVII
Korozja
KOROZJA
Korozja
– osłabienie podstawowych własności materiału w
wyniku reakcji z otoczeniem.
2010-01-22
2
Rodzaje
• korozja ogólna,
• korozja lokalna: wżerowa, szczelinowa,
międzykrystaliczna,
• korozja naprężeniowa,
• procesy korozyjno–erozyjne,
• kawitacja,
• korozja atmosferyczna,
• korozja w betonie,
• korozja w glebie,
• korozja biologiczna,
• korozja wysokotemperaturowa
Środowiska korozyjne
• kwaśne,
• alkaliczne,
• woda morska,
• solanka,
• środowiska organiczne,
• stopione sole.
2010-01-22
3
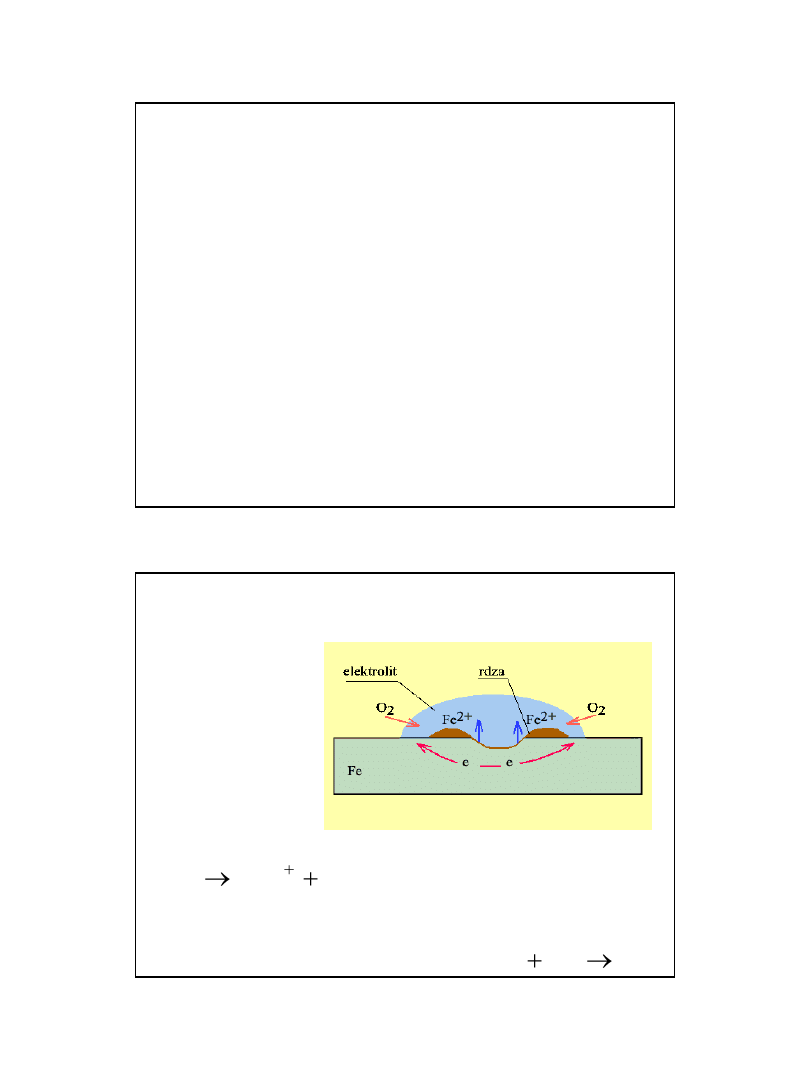
Korozja elektrochemiczna
• (glawaniczna) – najczęściej występujący typ
korozji.
• Zachodzi podczas zetknięcia dwóch metali o
różnych potencjałach elektrochemicznych.
• Tworzą one ogniwo galwaniczne - metal o
niższym potencjale stanowi anodę, metal o
wyższym - katodę
Mechanizm reakcji
Zniszczenie metalu
następuje w wyniku reakcji anodowej:
ne
Me
Me
n
d
Re
ne
Ox
sprzężonej z procesem katodowym:
2010-01-22
4
Przykłady reakcji katodowych
2
2
1
H
e
H
OH
4
e
4
O
H
2
O
2
2
2
3
Fe
e
Fe
Cu
e
Cu
2
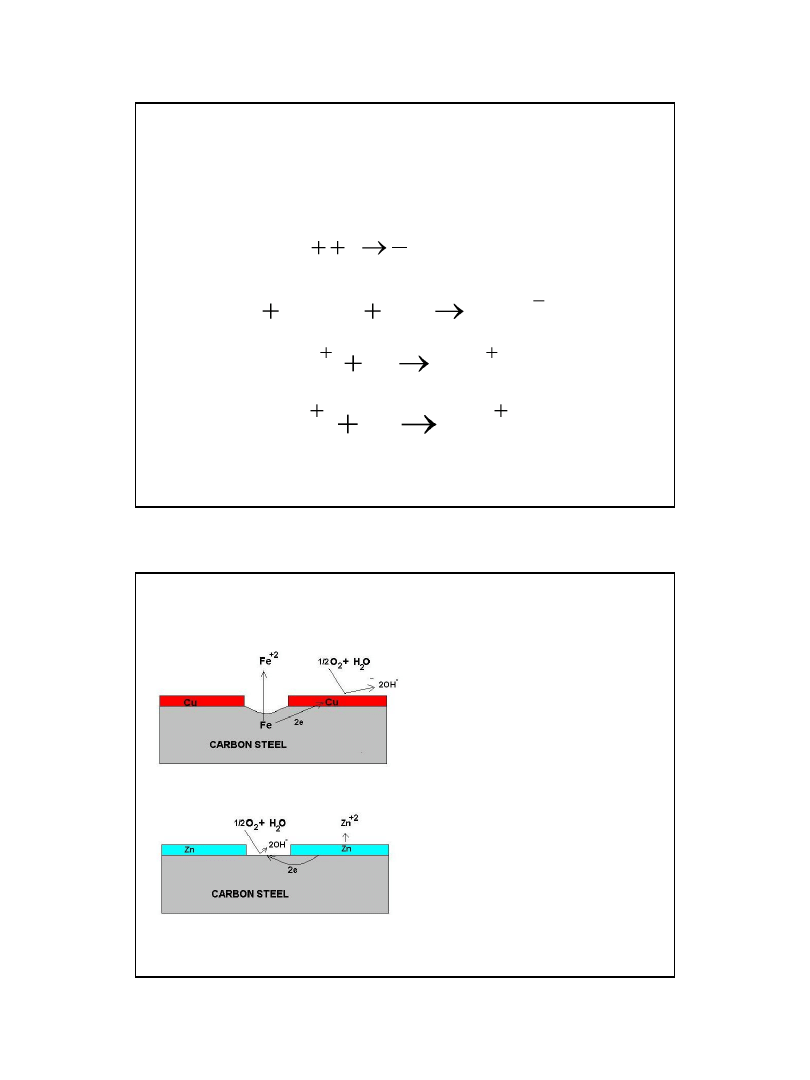
Schemat ogniwa korozyjnego
• a) stal węglowa
pokryta miedzią,
• b) stal węglowa
pokryta cynkiem
2010-01-22
5
Pasywacja
– stan odporności korozyjnej aktywnego
metalu w wyniku utworzenia odpornej
warstwy
powierzchniowej
inhibitującej
proces korozji w
określonym środowisku i
określonych warunkach pH.
Możliwe ścieżki reakcji metalu w
wodzie.
e
H
MeOH
)
O
H
(
Me
O
H
Me
ad
ad
2
2
e
MeOH
O
H
Me
2
2
H
e
H
)
OH
(
Me
2
O
H
MeO
2
O
H
2
rozpuszczanie
pasywacja

2010-01-22
6
Źródłem tlenu, niezbędnego dla
powstania warstwy pasywnej,
• - w środowisku wodnym:
• cząsteczki wody,
• rozpuszczony tlen.
• - w środowiskach bezwodnych:
• cząsteczki kwasów tlenowych (H
2
SO
4
, H
3
PO
4
,
HNO
3
, HCOOH),
• aniony zawierające tlen (CrO
4
-2
, Cr
2
O
7
-2
, MnO
4
-
),
• cząsteczki rozpuszczalnika (CH
3
OH).
Pasywacja stopów
Odporność korozyjna stopów zależy od rodzaju i ilości składników
stopowych
posiadających wysoki powinowactwo do tlenu
i
zdolności tworzenia warstwy pasywnej.
Najważniejszym pierwiastkiem stopowym odpowiedzialnym za
pasywację jest chrom.
hydroksytlenek chromu

2010-01-22
7
Typy korozji
Korozja wżerowa – rodzaj korozji lokalnej w
wyniku której powstają „dziury” w materiale.
Jest bardziej niebezpieczna od korozji ogólnej,
ponieważ trudniej ją przewidzieć i jej
przeciwdziałać.
Korozja
międzykrystaliczna
–
korozja
zachodzą
wzdłuż
granic
ziaren
metalu,
osłabiająca znacząco właściwości mechaniczne
stopu.
Ochrona przed korozją
• Stopy odporne na korozję
• Kompozyty
• Powłoki ochronne
• Ochrona katodpwa
• Ochrona anodowa
• inhibitory
2010-01-22
8
Ochrona katodowa
Chroniony metal jest
katodą – pokrywa się
go
metalem
o
niższym
potencjale
(protektor),
bądź
podnosi
się
jego
potencjał
poprzez
zewnętrzne
źródło
zasilania.
Metaliczne powłoki ochronne
• Zn
2+
+ 2e
Zn0
• Cu
2+
+ 2e
Cu0
• Ni
2+
+ 2e
Ni0
• Cr
3+
+ 3e
Cr0
• Ag
+
+ e
Ag0
• Au
3+
+ 3e
Au0
2010-01-22
9
Inhibitory
• inhibitory anodowe, np. fosforany,
krzemiany);
• inhibitory katodowe, np. Ca(HCO
3
)
2
,
polifosforany,;
• inhibitory anodowo–katodowe, np. aminy.
Układy
homogeniczne
heterogeniczne
Wielkość
cząstek
substancji
rozpuszczonej
< 1nm
1
– 200nm
>200nm
Stopień
rozdrobnienia
Rozdrobnienie
molekularne
Rozdrobnienie
koloidalne
Rozdrobnienie
makroskopowe
Charakterystyk
a układu
Jednorodne
fizycznie
Niejednorodne
fizycznie
Niejednorodne
fizycznie
Nazwa
układu
Roztwory
właściwe
Układy
koloidalne
zawiesiny
Nano 10
-9
nm - 10
-9
m
atomy, cząstki – 10
-10
m, jądro -10
-15
m
2010-01-22
10
Roztwory
Gdy mieszamy ze sobą 2 niereagujące subst. chem.
• •roztwór właściwy
•układ koloidalny
•mieszanina „gruboziarnista” rozproszenie
makroskopowe
roztwory
–jednorodne i jednolite mieszaniny
co najmniej 2 s.ch.
-
gazowe, ciekłe, stałe
•rozpuszczalnik układ dyspersyjny
•substancja rozpuszczona
•rozpuszczalność R
liczba g s.r./100g rozpuszczalnika
• •Rsoli= 15g/100 g H2O
• Cp = ms/mr•100% = 15g/115g•100% = 13,04%
• (mr= ms+ mrozpuszczalnika)
• •Cp= 40% g
R = ?
• 40g s.r. -
60g H2O
• R -
100g H2O
• R = 66,67g s.r./100g H2O
2010-01-22
11
rozpuszczalność ~ T
• dla gazów im
T tym
R
• dla ciał stałych im
T tym
R
roztwór
• nienasycony C < R
• nasycony C = R
• przesycony C > R
Układy koloidalne w zależności od
stanu skupienia
Ośrodek
rozpraszający
Cząstki
koloidalne
Gaz
Ciecz
Ciało stałe
Gaz
piana
Piana stała
Ciecz
mgła
emulsja
Emulsja
stała
Ciało stałe dym
Zol
(suspensja)
Stały zol
2010-01-22
12
Przykłady układów koloidalnych
• Naturalne:
- Mleko
– krople tłuszczu i
białka w wodzie
- Krew
– krwinki, płytki i
białecialka w osoczu
-
Błoto – zawiesina w
wodzie
• Sztuczne:
- Farby
– barwniki, sub.
Pokrywające w wodzie
-
Ciekłe kryształy –
uporządkowane struktury
drobnych cząstek
- Kosmetyki
– substancje
zawieszone w wodzie lub
tłuszczu
- Lekarstwa
– czynnik
aktywny w obojętnej
matrycy
Przykłady
• NaCl w H
2
Oroztwór rzeczywisty
• NaCl w C
6
H
6
układ koloidalny
• S w H
2
Oukład koloidalny / zawiesina
• S w CS
2
roztwór rzeczywisty
koloidy
•cząsteczkowe (typu białka) - cząstka koloidalna –
jedna bardzo duża cząsteczka np. peptyd,
białko, skrobia
•fazowe (typu złota)
(Au)
x
kilkaset
[ Fe(OH)
3
]
x
2010-01-22
13
Żele
• Niektóre roztwory koloidalne np. roztwory wodne żelatyny,
krochmalu, mydła, kauczuku w bezanie, itp. samorzutnie mogą
przejść ze stanu ciekłego w stan zbliżony do ciała stałego.
Osiąga się go często przez obniżenie temperatury.
Ten stan układu koloidalnego od typowego przykładu -
żelatyny - nosi nazwę żelu. Żele mogą być organiczne, są
bardziej elastyczne i nieorganiczne, mniej elastyczne np.
wodorotlenek żelaza, silikażel.
Elastyczny żel na skutek własności adsorpcyjnych może
pochłaniać ośrodek dyspersyjny w wyniku czego zwiększa się
objętość. Proces ten nosi nazwę pęcznienia żelu.
Metody otrzymywania układów koloidowych:
• Dyspersyjne – Rozdrabnianie jednej fazy w celu
otrzymania z niej cząstek o wymiarach koloidowych
• Kondensacyjne –polimeryzacyjne łączenie mniejszych
cząstek fazy w większe o rozmiarach koloidowych
2010-01-22
14
• Mechaniczne (wmoździerzach,
młynach koloidalnych)
•za pomocą strumienia gazu (w celu
uzyskania aerozolu)
•za pomocą fal ultradźwiękowych
(metodą tą otrzymuje się
np.roztwory koloidowe
barwników, krochmalu czy gipsu)
•termiczne– stosowane np. do
otrzymywania metali w stanie
koloidowym,
•w łuku elektrycznym – do
otrzymywania zoli srebra, platyny
i innych metali, tlenków
niektórych metali, koloidowego
grafitu.
Stosowanie metod dyspersyjnych
wymaga dodawania
stabilizatorów w celu otrzymania
trwałego układu koloidowego
(zapobiegają koagulacji koloidów
•polimeryzacjaaddycyjna,np.butadienud
o kauczuku, chlorku winylu do
polichlorku winylu,
•reakcje kondensacji i polikondensacji,
•zmniejszenie rozpuszczalności
związków trudno rozpuszczalnych
takich jak np.BaSO4,AgCl,AgI
poprzez dodatek drugiego
rozpuszczalnika
•przeniesienie danej substancji do
rozpuszczalnika, w którym trudniej
się rozpuszcza (np. otrzymywanie
koloidowego roztworu siarki czy
kalafonii przez wlanie do wody ich
nasyconych roztworów
alkoholowych),
•redukcja,np.jonów metali szlachetnych,
•utlenianie(np.koloidowa siarka
powstaje podczas utleniania H
2
S na
powietrzu),
•hydroliza wodorotlenków metali takich
jak np.Zr(OH)4,
•reakcja wymiany np. AgNO3+ KI
AgI↓+ KNO3.
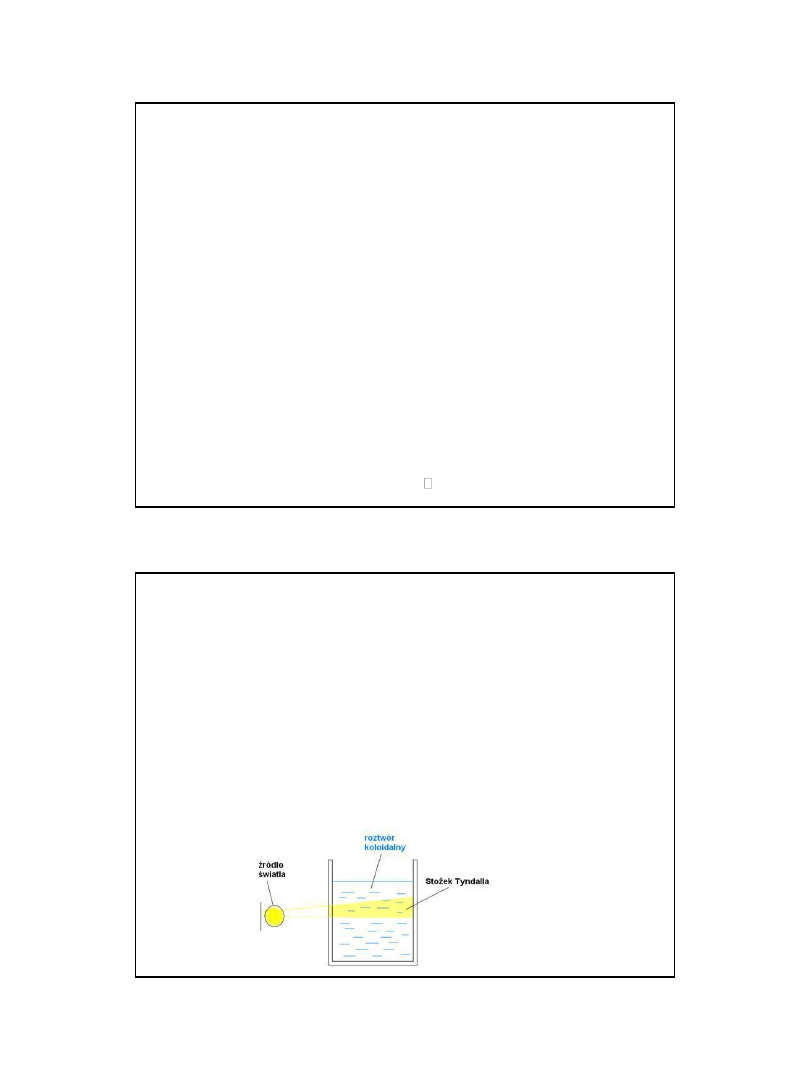
właściwości optyczne
• efekt Tyndalla
• • turbidymetria
• • nefelometria
• ugięcie, rozproszenie światła
przechodzącego przez układ koloidalny
2010-01-22
15
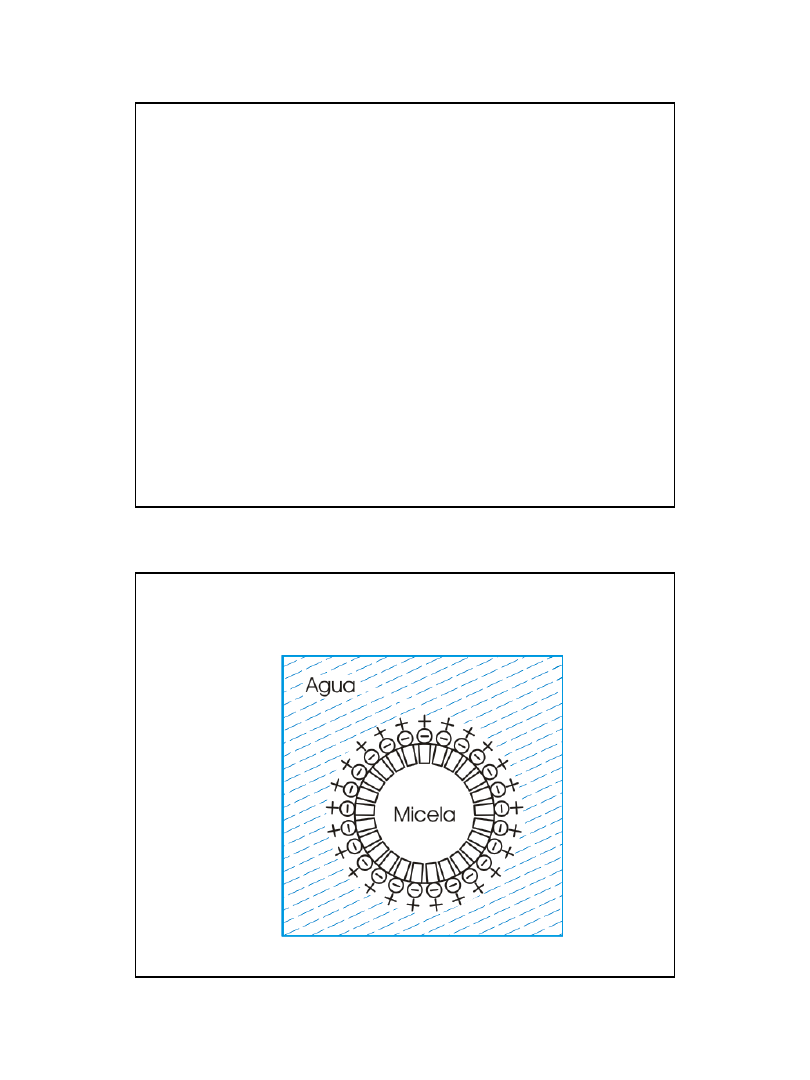
właściwości elektryczne na
• cząsteczkach koloidalnych
ładunkikoloidalna krzemionka [
SiO2]mSiO2+ H2O DH2SiO3H2SiO3+
2H2O D
2H3O++ SiO32−powłoka
(warstwa adsorpcyjna
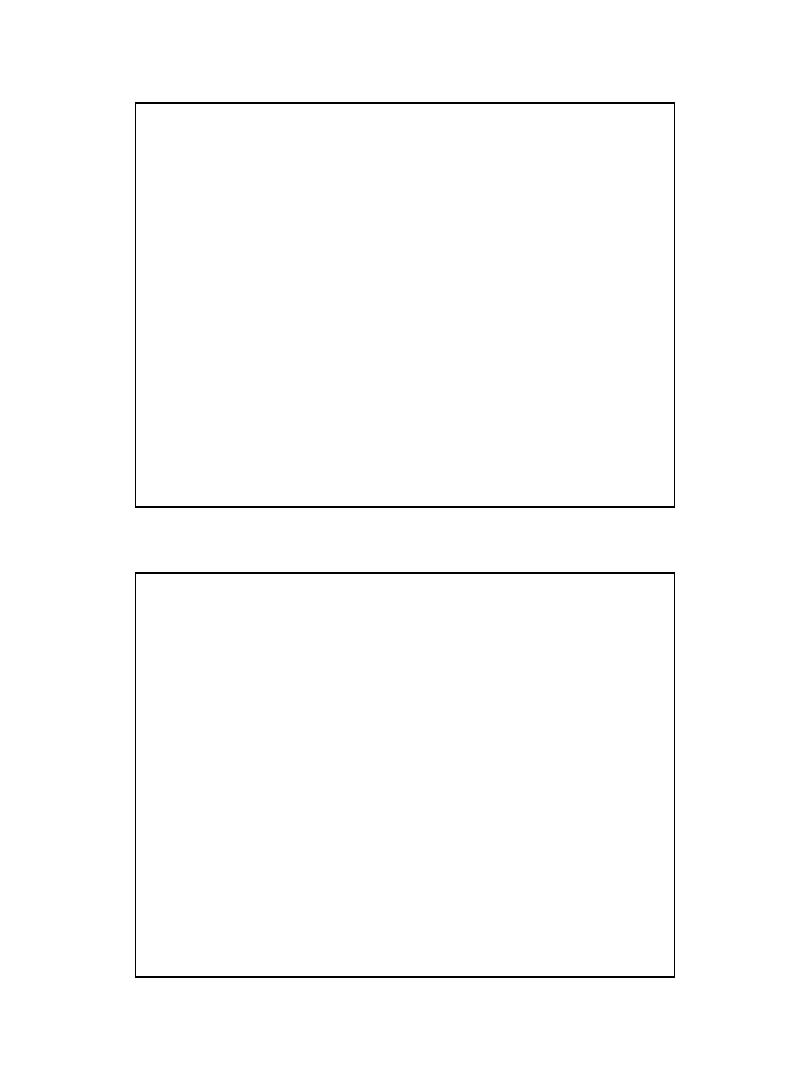
Budowa miceli
2010-01-22
16
Budowa miceli
• Roztwory koloidalne można otrzymywać przez dyspersje większych
cząstek (zawiesin), lub częściej, przez kondensację, agregacje
mniejszych cząsteczek. Odpowiednie rozdrobnienie otrzymuje się
przez mielenie w tzw. młynach koloidalnych lub przez działanie
ultradźwięków. Agregacyjny sposób otrzymywania roztworów
koloidalnych polega na przeprowadzeniu odpowiedniej reakcji
chemicznej w roztworze, powodującej powstanie nierozpuszczalnych
cząsteczek, w danych warunkach łatwo tworzących cząstki
koloidalne. Na przykład wytrącając z roztworu soli żelaza (III)
wodorotlenek Fe(OH)
3
przez zalkalizowanie środowiska często
otrzymujemy roztwór koloidalny wodorotlenku żelaza.
• Ze względu na swe właściwości chemiczne i fizyczne (adsorpcja i
chemisorpcja) na powierzchni cząstek koloidalnych gromadzą się inne
składniki fazy ciągłej - często są to jony - tworząc ochronną
warstewkę zapobiegającą dalszej agregacji i stabilizującą układ
koloidalny. Zaadsorbowane na powierzchni jony wytwarzają pole
elektryczne stanowiące dodatkowe zabezpieczenie przed koagulacją
(zlepianiem się cząstek koloidalnych).
Podział koloidów
• Koloidy możemy również podzielić na koloidy:
- liofilowe (hydrofilowe jeśli mowa o roztworach
wodnych)
- liofobowe (hydrofobowe).
Stabilność miceli koloidu liofobowego praktycznie
warunkuje wyłącznie ładunek elektryczny warstwy
adsorpcyjnej.
Micele koloidów liofilowych chronione są przed
koagulacją przez warstwę cząsteczek rozpuszczalnika
otaczającą cząstkę koloidalną.
2010-01-22
17
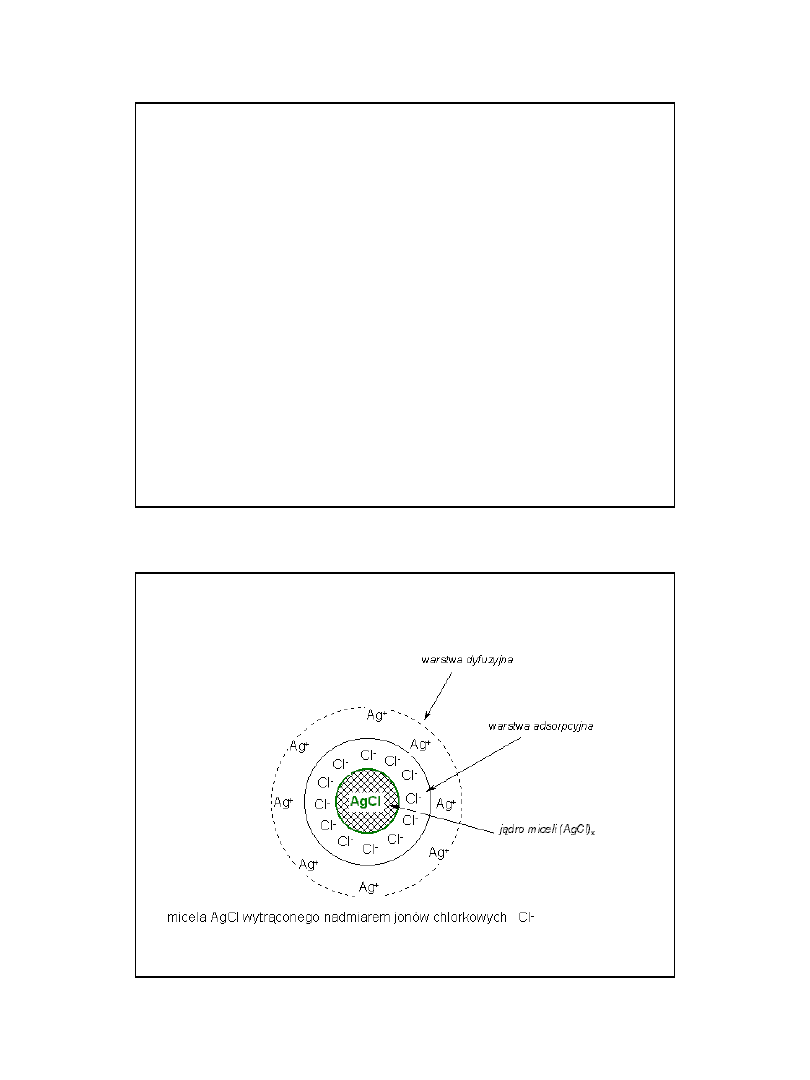
Koagulacja
Aby doprowadzić do koagulacji koloidu hydrofobowego
należy zniszczyć jonową warstwę adsorpcyjną.
Można to uczynić dodając do roztworu koloidalnego roztworu
zawierającego jony, które będą skutecznie konkurować z
cząstką koloidalną w procesie "wiązania" jonów warstwy
adsorpcyjnej.
Pozbawiona osłony cząstka (jądro miceli) łatwo połączy się w
większe agregaty. Koloidy hydrofilowe są znacznie trwalszym
układem. Do ich koagulacji doprowadzić może dopiero duży dodatek
elektrolitu, którego jony ulegając hydratacji będą niszczyć
solwatacyjną otoczkę chroniącą cząstkę koloidalną.
Koloidami hydrofilnymi są najczęściej koloidy wielkocząsteczkowych
związków - białek, skrobi itp.
Przykład
2010-01-22
18
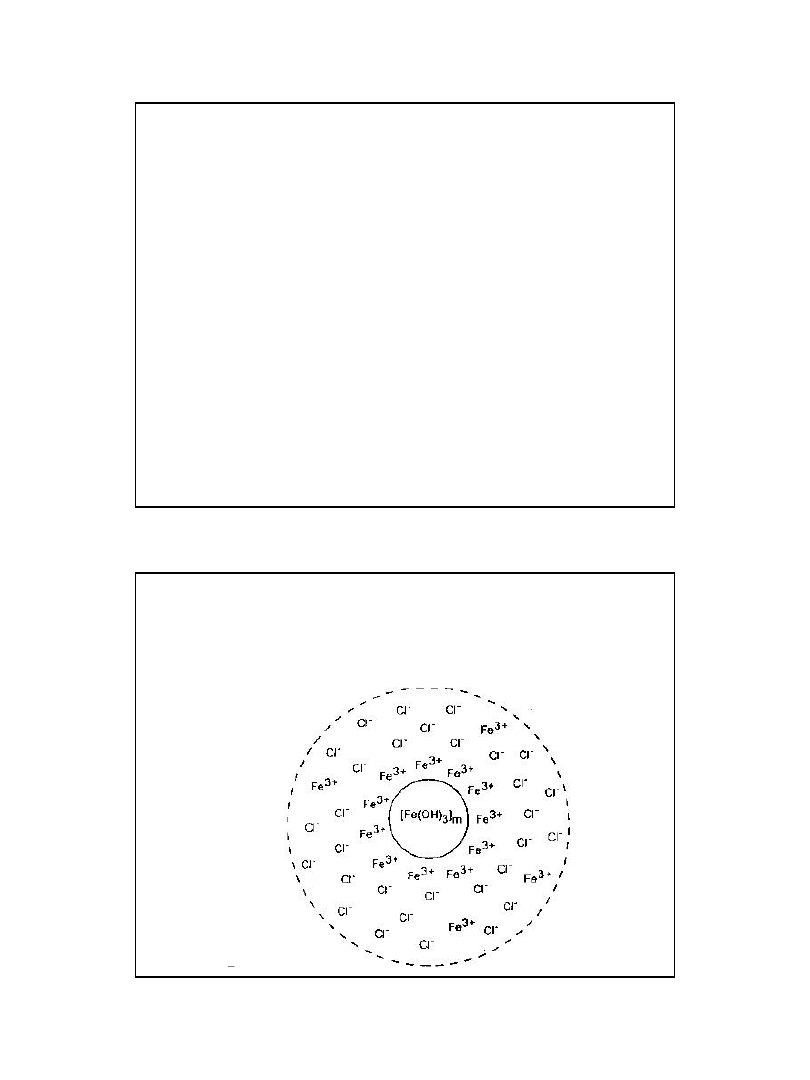
Koagulacja siarczanem
żelazawym
Zdolność koagulacyjna jonów dwuwartościowych jest
znacznie mniejsza niż jonów trójwartościowych, a
rozpuszczalność powstającego w wyniku hydrolizy
wodorotlenku żelazawego jest większa niż wodorotlenku
żelazowego. Wynika stąd konieczność utleniania żelaza
dwuwratościowego do trójwartościowego.
Reakcja utleniania jonów Fe
2+
do Fe
3+
przebiega z dobrym
skutkiem tylko przy wartościach pH powyżej 8,5.
Powstający w wyniku hydrolizy siarczanu żelazawego
wodorotlenek żelazawy utlenia się do wodorotlenku
żelazowego pod wpływem tlenu zawartego w wodzie.
• FeSO
4
+ 2H
2
O → Fe(OH)
2
+ 2H
2
SO
4
• 4Fe(OH)
2
+ O
2
+ 2H
2
O → 4Fe(OH)
3
↓

2010-01-22
19
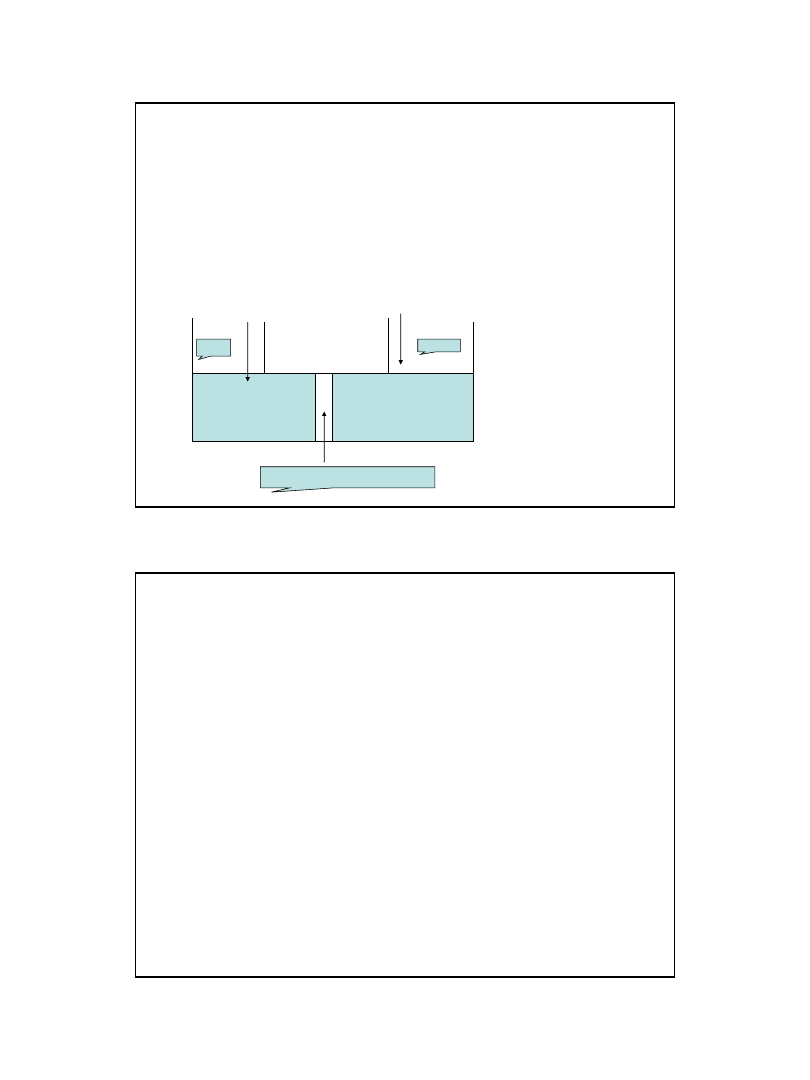
Osmoza
•zjawisko związane z istnieniem błon
półprzepuszczalnych (przepuszczalnych dla
jednego składnika roztworu,
nieprzepuszczalnych dla innych)
•proces wyrównywania ilości rozpuszczalnika
(cząsteczki rozpuszczalnika wędrują z roztworu
o większej jego zawartości do roztworu o
mniejszej)
2010-01-22
20
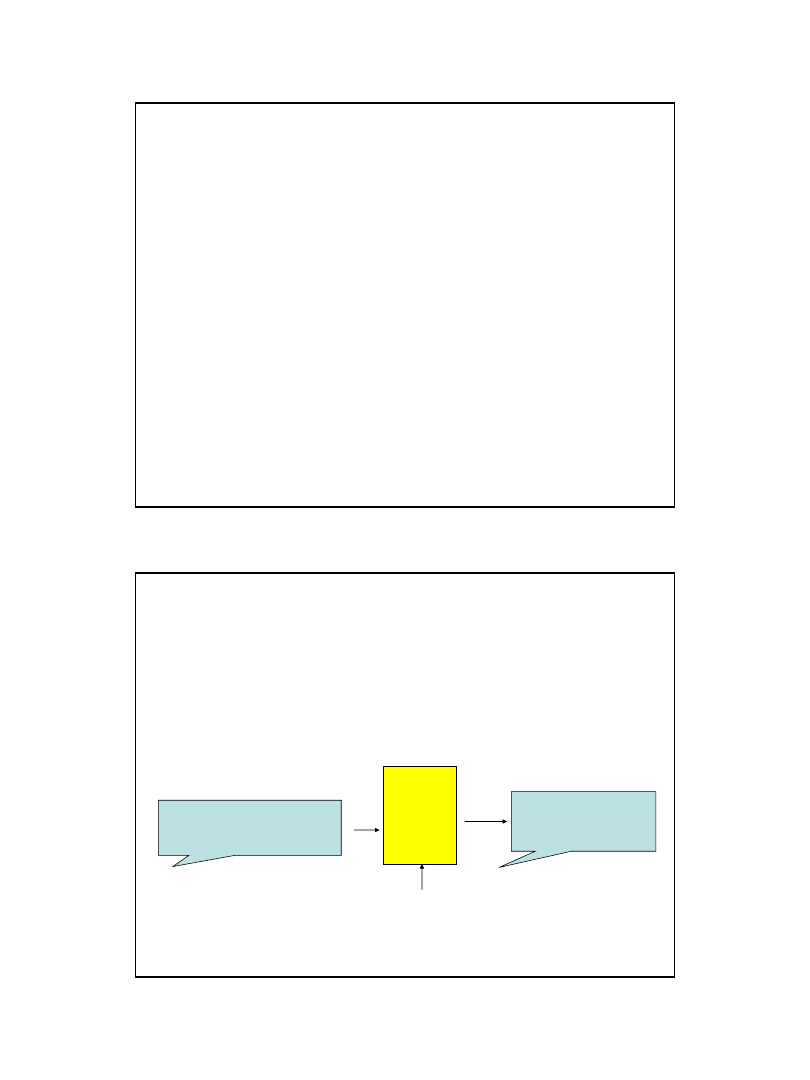
• 1.gdy p1= p2rozpuszczalnik przechodzi do roztworu
powodując przesunięcie tłoka
• 2.aby zapobiec podnoszeniu się tłoka w lewej części, na tłok
trzeba wywrzeć ciśnienie p1> p2
Ciśnienie osmotyczne –dodatkowe ciśnienie, jakie trzeba
wywrzeć na roztwór w celu osiągnięcia równowagi
roztwór
rozpuszczalnik
P
1
p
2
Błona półprzepuszczalna
Reguła van’t Hoffa:
• Reguła van’t Hoffa: Reguła van’t Hoffa: Ciśnienie
osmotyczne spowodowane obecnością substancji
rozpuszczonej w danej objętości roztworu, w określonej
temperaturze, jest równe ciśnieniu jakie posiadałby gaz,
gdyby zajmował taką samą objętość w tej samej
temperaturze.
• πV = nRT
• π = cRT
• Π – ciśnienie osmotyczne
• — spełniany w przypadku roztworów
rozcieńczonych nieelektrolitów (c < 0,1 mol/dm3)
2010-01-22
21
Ciśnienie osmotyczne
• zależy:
od stężenia molowego roztworu
od właściwości rozpuszczalnika
• nie zależy:
od rodzaju błony półprzepuszczalnej
od mechanizmu przepuszczania
rozpuszczalnika czy zatrzymywania
cząsteczek substancji rozpuszczonej
Rola ciśnienia osmotycznego w
procesach biologicznych i w życiu
człowieka:
• Tkanki i błony organizmów żywych są błonami półprzepuszczalnymi
• Komórka roślinna lub zwierzęca zachowuje się jak osmometr
• Gdy ciśn. osmotyczne zewnętrzne większe (roztwór hipertoniczny
względem roztworu w komórce) niż w komórce – woda z komórki przechodzi
do otoczenia i następuje jej kurczenie (plazmoliza) i wysuszenie
• Gdy ciśnienie osmotyczne zewnętrzne niższe (roztwór hipotoniczny
względem roztworu w komórce) – woda z zewnątrz przenika do komórki,
powoduje jej pęcznienie (deplazmoliza) i może nastąpić jej rozerwanie
• Gdy ciśn. zewnętrzne = ciśnieniu wewnątrz komórki – roztwór zewnętrzny
izotoniczny
z płynem komórkowym
• Roztwory wprowadzane do krwiobiegu muszą być izotoniczne (o tym
samym ciśnieniu osmotycznym co ciecze w organizmie, z którymi się
mieszają np. z krwią); np. leki podawane dożylnie lub domięśniowo;
podawanie soli fizjologicznej (wodny roztwór NaCl o stęż. 0,9%– izotoniczny
z płynami komórkowymi) przy znacznym ubytku krwi w organizmie
2010-01-22
22
Zastosowanie osmozy w procesach
suszenia i utrwalania (konserwacji)
żywności
• Wykorzystanie roztworów hipertonicznych
• Suszenie owoców metodą osmotycznego
odwadniania za pomocą stężonego roztworu glukozy
(woda z owoców przechodzi do roztworu; bakterie
tracą wodę i giną)
• Konserwacja mięsa – stężone roztwory soli (i=2),
woda z mięsa przechodzi do roztworu (jednocześnie
zamieranie bakterii)
• Roztwór wodny soli ma 2 razy większe ciśnienie
osmotyczne niż roztwór cukru (stąd stosowane
roztwory cukru muszą być bardziej stężone niż
roztwory soli)
Metoda odwróconej osmozy
• do oczyszczania ścieków (można je
oczyszczać przez usuwanie odpadów lub
odciąganie wody)
przegroda półprzepuszczalna z polistyrenu,
celofanu lub PCW
Ścieki pod
ciśnieniem
Przechodzi
woda
Wyszukiwarka
Podobne podstrony:
Korozja metali I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, Korozja metali I
Chemia labolatorium, Korozja, Korozja - szkodliwe działanie chemiczne lub elektrochemiczne na powier
Chemia instrukcje korozja, BUDOWNICTWO, Semestr 1, Chemia, Instrukcja do sprawozdania
Sprawozdanie - Chemia ogólna - Korozja zanurzeniowa, Polibuda
Korozja metali II oksydowanie, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, Laborator
Korozja metali, Energetyka, Chemia
Korozja betonu, budownictwo pk, sem 1, chemia
KOROZJA1, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
korozja bet, PK, CHM -Chemia budowlana, chemiaa
,chemia L,korozja metali
korozja, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana, Chemia - P
Korozja, Studia, Chemia, chemia od Ines(1)
labolatoria lab chemia korozja spoiw
labolatoria lab chemia korozja
więcej podobnych podstron